凝胶定量软件Quantity_One使用简介
如何使用quantityone计算条带灰度值

裂解细胞请尽量冰上操作,减缓酶解作用。
俺前boss nature文章上的裂解液配方是:20mM Tris/HCl, pH7.6, 100mM NaCl, 20mM KCl,1.5mM MgCl2, 0.5% NP-40 and protease inhibitors (20μg/ml leupeptin,10μg/ml pepstatin A and 10μg/mlaprotinin)(此裂解液可用于抽提核蛋白),其中蛋白酶抑制剂很复杂也很贵,其实用0.5mMPMSF替代这三种就好了;如果还要做磷酸化蛋白,加1mM Na3VO4(现加现用),10 mM NaF, 1 mM Na3VO4, 50 mMbeta-GP。
在其他网站上看到的,很实用转来分享
样品制备:
变性条件——SDS LB直接裂解:
用常温或者高温预热过(预热更有利于阻止蛋白水解或者磷酸酶去磷酸化,但容易遗忘,LB久煮某些性质会改变)的1*SDSLB(或者略高1.5*)直接加到细胞或者组织上并煮样。通常6孔板细胞80%以上密度,需200ul,其他按平板面积比类推。通常条件下,SDSLB都是过量的(因此不一定要严格参考SDS LB稀释比);如果SDSLB不够,样品核酸、蛋白浓度过高时,煮样后会发现tip吸不上来,非常粘、一砣一砣的,很容易堵住tip。这时候常规做法有两种,1.再煮5min。常规煮样时间3-5min,样品过浓时就煮10min;2.如果10min煮样后,仍然吸不起来,才适当增加SDSLB,继续煮;也可以对样品进行超声。煮样时间若过长,蛋白会凝固,此时以失去继续WB的意义,请丢弃(判断标准:出现明显的蛋白沉淀和水分层)
如何使用quantityone计算条带灰度值

如何使用quantityone计算条带灰度值在其他网站上看到的,很实用转来分享样品制备:变性条件——SDS LB直接裂解:用常温或者高温预热过(预热更有利于阻止蛋白水解或者磷酸酶去磷酸化,但容易遗忘,LB久煮某些性质会改变)的1*SDSLB(或者略高1.5*)直接加到细胞或者组织上并煮样。
通常6孔板细胞80%以上密度,需200ul,其他按平板面积比类推。
通常条件下,SDSLB都是过量的(因此不一定要严格参考SDS LB稀释比);如果SDSLB不够,样品核酸、蛋白浓度过高时,煮样后会发现tip吸不上来,非常粘、一砣一砣的,很容易堵住tip。
这时候常规做法有两种,1.再煮5min。
常规煮样时间3-5min,样品过浓时就煮10min;2.如果10min煮样后,仍然吸不起来,才适当增加SDSLB,继续煮;也可以对样品进行超声。
煮样时间若过长,蛋白会凝固,此时以失去继续WB的意义,请丢弃(判断标准:出现明显的蛋白沉淀和水分层) 此方法的缺点,SDS LB煮过的样品如果用来做IP,需要特殊方法,因此,这种制备方法制备的样品有使用局限。
非变性裂解法(不讨论诸如核抽提、亚细胞器分离等等了,其实类似)裂解细胞请尽量冰上操作,减缓酶解作用。
俺前boss nature文章上的裂解液配方是:20mM Tris/HCl, pH7.6, 100mM NaCl, 20mM KCl,1.5mM MgCl2, 0.5% NP-40 and protease inhibitors (20μg/ml leupeptin,10μg/ml pepstatin A and 10 μg/mlaprotinin)(此裂解液可用于抽提核蛋白),其中蛋白酶抑制剂很复杂也很贵,其实用0.5mMPMSF替代这三种就好了;如果还要做磷酸化蛋白,加1mM Na3VO4(现加现用),10 mM NaF, 1 mM Na3VO4, 50 mMbeta-GP。
qualityone教程使用简介

凝胶定量软件Quantity One使用简介1、内容简介凝胶电泳是每个做分子生物学的同学天天都要打交道的基本技术。
电泳之后的信息处理与电泳本身同样重要。
目前有大量软件可以用于分析电泳结果,比较有名的比如BandScan、BandLeader、Sigma Gel等等。
今天要向大家介绍的是来自Bio-Rad的1D凝胶定量软件Quantity One(Bio-Rad还有一个做2D凝胶分析的软件PDQuest)。
这个软件的最新版本可以在Bio-Rad的主页免费下载。
目前的最新版本是4.52版2、Quantity One的定量方法Quantity One的分析功能顾名思义主要用来进行凝胶或者培养皿的荧光定量分析。
它的分析功能或者说分析方式主要有4种:泳道/条带轨迹定量法;等高线直接定量法;菌落计数;分子量测定这三种方法中使用最为方便也是最为广泛的应该是等高线定量法(Volumn Contour)。
它通过半自动描绘电泳条带的等高线边缘来得到等高线区域内部面积,再将该面积乘以区域内平均光密度值得到条带内部总的信号量。
当然这种分析方法的弊病显而易见:无法同等得排除不同泳道的背景亮度;等高线的绘制处于“半自动”状态,即需要人为判断作为等高线标准的电泳条带的边缘;最致命的是在几个电泳条带距离十分接近的时候几乎无法绘制单一条带的轮廓(常出现连续的几个条带等高线相连而无法分离出单独条带的轮廓)。
三种方法中个人感觉最为科学和严谨的应该是泳道/条带轨迹定量法(Trace Tracking)。
这种方法使用起来步骤较为繁琐,必须通过泳道识别---电泳条带识别两个连续的步骤才能进行定量。
然而这种方式的最大优点在于它可以完全抛弃人为主观因素进行全自动定量。
他的定量方式为:首先根据不同电泳条带的光密度值绘制光密度曲线,然后计算光密度曲线下面积作为电泳条带的定量根据。
大家可能会问他能不能排除泳道背景?答案是肯定的,它能够最大程度的排除不同泳道之间的背景差异,让各个泳道上的不同电泳条带在一条几乎相同的起跑线上进行对比。
quantity one的使用说明

GEL EQ凝胶成像使用指南1. 打开主机电源与计算机电源.2. 点击凝胶成像软件,进入QUANTITY ONE操作界面.3. 在FILE菜单中,选择GEL EQ菜单,进入图像采集界面4. 点击LIVE/FOCUS菜单,采集图像.(根据被扫胶的要求, 在凝胶成像主机面板上选择UV/WHITE紫外光/白光.(如需使用透射白光,则把白光台电源打开,把白光台放在底板上,把胶放在白光台上.5. 调节光圈大小,点击IRIS下OPEN/CLOSE;调节聚焦,点击FOCUSE下NEAR/FAR按钮;调节远近即大小,点击ZOOM下相应按钮,直到满意为止.6. 爆光时间一般选择自动AUTO EXPOSE即可.7. 若图像上有高亮红点,说明爆光过度,则须缩小光圈.8. 图像调好后,点击SAVE键保存.若需保存为其他格式,则在FILE菜单下选择导出,保存为JPEG/TIFF格式文件.9. 关于分析处理见Quantity One应用讲义Quantity One应用讲义本讲义介绍Quantity One的两个重要分析功能:定量分析和分子量确定。
Quick Quantity One软件Help Guide快捷指南提示如何实现一个功能,如定量分析(Volumes Quick Guide,电泳条带分析(Band Analysis,差显分析(Differential Display Analysis,克隆计数(Colony Counting Analysis等。
快捷指南下有1,2,3…步骤,根据提示完成。
一.定量分析功能快捷指南Volumes Quick Guide,此功能能对任意所选区域进行定量分析,此分析可以报告2个结果:相对浓度和绝对浓度(如有浓度标准样品1.选择成像系统或打开已保存的文件(软件可以控制Bio-Rad所有的成像系统如GelDoc,ChemiDoc,VersaDoc,GS-800,FX,如不是Bio-Rad成像系统所摄取的图象,将图象保存为Tiff文件格式,软件也可进行分析处理2. Zoom Box,缩放,对图象进行放大观察3. Transform转化,调节图象的对比度黑白4. Volume Rect Tool 矩形区域选择,如U15. Volume Free hand Tool自由画笔选择区域,可以勾勒出无规则形状,如U26. Volumn Contour Tool等高线勾勒区域,自动连接浓度浓度相同的点,如U3上面3种方法选择需要定量的区域。
Bio-Rad凝胶成像使用指南-生物学中心

Bio-Rad凝胶成像操作规范及注意事项
(一)操作规范
1.打开主机电源与计算机电源.
2.点击凝胶成像软件,进入QUANTITY ONE操作界面.
3.在FILE菜单中,选择GEL EQ菜单,进入图像采集界面
4.点击LIVE/FOCUS菜单,采集图像.(根据被扫胶的要求, 在凝胶成像主机面板上选择UV/WHITE紫外光/白光).(如需使用透射白光,则把白光台电源打开,把白光台放在底板上,把胶放在白光台上.)
5.调节光圈大小,点击IRIS下OPEN/CLOSE;调节聚焦,点击FOCUSE 下NEAR/FAR按钮;调节远近即大小,点击ZOOM下相应按钮,直到满意为止.
6.爆光时间一般选择自动AUTO EXPOSE即可.
7.若图像上有高亮红点,说明爆光过度,则须缩小光圈.
8.图像调好后,点击SAVE键保存.若需保存为其他格式,则在FILE菜单下选择导出,保存为JPEG/TIFF格式文件.
(二)注意事项
1.不要污染仪器外部表面。
2.在使用紫外光源照相的过程中,不可打开凝胶成像系统的暗门。
3.照相后把废胶取出,并用软纸擦拭干净。
4.调焦时要轻缓,调焦需要等待过程。
5.保持暗香内干燥。
6.使用仪器时,要关闭门和观测台,否则无法使用紫外灯。
7.使用完毕及时关闭电源并在记录本上进行登记。
8.勿用U盘拷贝数据。
生物学实验中心
天津市动植物抗性重点实验室
2013年9月。
QuantityOne 说明

这三种方法中使用最为方便也是最为广泛的应该是等高线定量法(Volumn Contour)。
它通过半自动描绘电泳条带的等高线边缘来得到等高线区域内部面积,再将该面积乘以区域内平均光密度值得到条带内部总的信号量。
当然这种分析方法的弊病显而易见:无法同等得排除不同泳道的背景亮度;等高线的绘制处于“半自动”状态,即需要人为判断作为等高线标准的电泳条带的边缘;最致命的是在几个电泳条带距离十分接近的时候几乎无法绘制单一条带的轮廓(常出现连续的几个条带等高线相连而无法分离出单独条带的轮廓)。
三种方法中个人感觉最为科学和严谨的应该是泳道/条带轨迹定量法(Trace Tracking)。
这种方法使用起来步骤较为繁琐,必须通过泳道识别---电泳条带识别两个连续的步骤才能进行定量。
然而这种方式的最大优点在于它可以完全抛弃人为主观因素进行全自动定量。
他的定量方式为:首先根据不同电泳条带的光密度值绘制光密度曲线,然后计算光密度曲线下面积作为电泳条带的定量根据。
大家可能会问他能不能排除泳道背景?答案是肯定的,它能够最大程度的排除不同泳道之间的背景差异,让各个泳道上的不同电泳条带在一条几乎相同的起跑线上进行对比。
这个背景排除功能是等高线法无法做到的(等高线法也有基本的背景排除办法,但是和泳道/条带轨迹定量法的背景排除不是一个等级的。
等高线法只能排除同一泳道上的背景,而不能均等的排除不同泳道的背景)。
另外泳道/条带轨迹定量法还可以结合Gauss Model Bands对紧密相连的电泳条带进行分析,而这种条带也是等高线法无法分析的。
我们此次重点学习这个方法。
第三个分析功能是菌落计数(Colony Counting)。
这个功能其实很实用,可以分析蓝白筛选的结果。
但是很奇怪我的电脑居然无法运行这个功能,因此无法向大家介绍了。
另外Quantity One还可以通过回归曲线测定分子量下面让我们了解一下Quantity One常用的基本菜单操作。
Quantity One说明

功能强大的操作、分析软件“Quantity One”简介“Quantity One”是Bio-Rad公司图像系列产品的操作和分析软件。
主要用来定量和分析荧光、化学发光、放射性同位素、化学染色物标记的各种单向电泳、杂交点和条带、TCL 板、酶标板、培养皿的克隆斑等。
“Quantity One”能在Windows 98、Windows 95、Windows NT 4.0、Macintosh 9500(或更高)环境下运行。
窗口设计有下拉式菜单、图像工具栏、菜单操作提示栏等,界面设计十分友好、非常简单易学。
“Quantity One”的图像文件以Tiff文本格式输出,可以方便的进入其它的图像处理软件进行更深一步的图像处理和编辑。
同时,分析数据可以直接转入到Micro Excel,以报告形式排版、打印。
每套“Quantity One”软件都有相对应的进入密码(Unique Password)和软件狗(Hardware Protection keys),并附有详尽的软件操作说明书。
1.“Quantity One”的运行程序打开操作界面输入操作指令,进行图像采集图像初步优化图像处理各种功能分析文字注解和打印格式2.“Quantity One”的主要功能和优势2.1“Quantity One”的图像采集功能步骤一:自动选择仪器的配置根据您的标记信号类型,“Quantity One”能自动选择激光波长和滤波片,使整个光路调整到适当的工作状态。
步骤二:选择扫描范围GelDoc2000提供的最大扫描面积为25cm×26cm,您可以根据样品放置的位置和大小,任意选择所需的扫描范围。
步骤三:扫描、采集图像GelDoc2000的扫描、采集图像和计算机成像同步进行,您可以随时从屏幕上观察到扫描的结果。
2.2“Quantity One”的分析功能及优势1.“Quantity One”的图像优化处理工具栏“Quantity One”的图像处理功能主要移植于Photoshop “Quantity One”可以进行背景噪音过滤,梯度背景扣除,背景灰度调节,图像的放大和缩小,图像旋转,图像修饰等图像优化和处理工作。
Quantity one 软件分析使用方法简介

Quantity one 软件分析使用方法简介一、条带分子量分析方法打开软件,在volumes quick guide一栏中选择open,打开你所需要分析的图片。
图片格式为tiff。
Transform转化,调节图象的对比度黑白到合适程度。
确定泳道(lane),并对泳道进行各种调整(实际实验中泳道往往不是垂直的而出现各种变形)。
按下图所示在软件的工具栏中有一Lane Tool图标,包含有更多泳道编辑工具(Frame Lane中输入泳道个数即可做到自动添加泳道,手动调整大小即可)。
确定泳道和条带的操作也可以手动进行,即点击Lane 菜单,选择Sigle Lane中的Creat Lane,将鼠标移至打开的图片中,这时鼠标后面会有一个绿色的加号,选择一个marker泳道和需要计算分子量的泳道,每个泳道重上至下的创建。
这种方法是单个泳道一个一个的创建,创建时注意在每个泳道条带的正中间开始创建,减少跑电泳时条带的不整齐对结果计算的影响,并且创建的泳道线(红线)一定要垂直。
完成泳道添加步骤后,确定分析条带。
该步骤可以自动也可以手动。
手动添加步骤为:点击Band菜单,选则Create Band,这时是要创建每个泳道中条带的位置。
再将鼠标移动至图片位置,同样鼠标后面呈现绿色加号形式,用鼠标依次点击marker的条带位置。
最后点击你所测定的目的条带。
泳道中创建Band时也要在条带的中间位置创建,以免跑电泳时加量过多使跑出来的条带过宽,进而影响测定结果。
自动添加步骤为:选择Detect Band,检测泳道内的条带,打开出现如下窗口。
通过调节sensitivity灵敏度可调节检测出的条带数,调节Lane Width使代表表带的红色横线与条带宽度差不多宽。
中间一行人工编辑按钮可以用来增加/减少条带、调节条带的上、下边界等。
打开工具栏中Band Tool条带编辑工具包可看到更多编辑工具。
条带确定后点击Match菜单,选择Standards,选择New Standard,编辑好所创建的marker的名称,并依次输入你所跑的marker的分子量(KDa栏)和所对应的名字(Name 栏),点Achive保存。
quantity_one_软件使用说明
quantity one 软件使用说明
quantity one软件,对于熟悉分子生物学实验技术凝胶成像操作的各位大侠一定都不陌生,可是这个软件功能非常全面,对于每一个功能不知大家是不是一样的熟悉,我目前正在使用它的一项功能,稍稍了解了一点,希望能讲给大家,不到之处,还请各位指点!
我想向大家介绍band analysis功能:
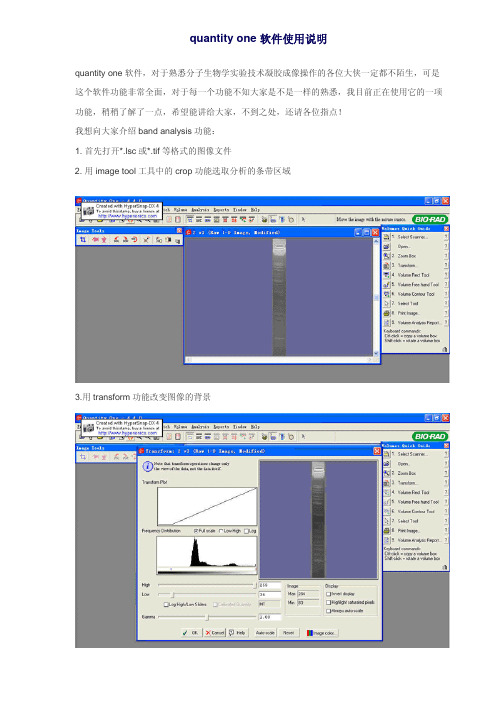
1. 首先打开*.lsc或*.tif等格式的图像文件
2. 用image tool工具中的crop功能选取分析的条带区域
3.用transform功能改变图像的背景
4. 选frame lanes功能,确定分析区域,一条带对应于选择的数字为1
5. 用stretch lanes及add/adjust anchors进行区域的调整,点击每个框架四周的4个小圆圈待光标有变化时,即可拖动调节区域的范围
6. 用lane background substraction功能进行本底剪影
7. 用detect band 功能进行条带的标记,可以通过调节敏感度来使标记的条带认为受到控制,利于对一些结果准确和客观的判读,band 工具栏中有编辑,去除及调整band的工具进行band 的修改
8. 用standards功能,选择合适的standards
9. band attributes 功能了解band 信息描述
10. all lanes report给出关于每一条band的分析结果,可以保存为*. txt文件,常选的指标有峰值,域值,相对量等,条带分析即可完成。
凝胶定量软件QuantityOne使用

凝胶定量软件Quantity One使用简介1 内容简介凝胶电泳是每个做分子生物学的同学天天都要打交道的基本技术。
电泳之后的信息处理与电泳本身同样重要。
目前有大量软件可以用于分析电泳结果,比较有名的比如BandScan、BandLeader、Sigma Gel等等。
今天要向大家介绍的是来自Bio-Rad的1D凝胶定量软件Quantity One(Bio-Rad还有一个做2D凝胶分析的软件PDQuest)。
这个软件的最新版本可以在Bio-Rad的主页免费下载。
目前的最新版本是4.52版2 Quantity One的定量方法Quantity One的分析功能顾名思义主要用来进行凝胶或者培养皿的荧光定量分析。
它的分析功能或者说分析方式主要有4种:泳道/条带轨迹定量法;等高线直接定量法;菌落计数;分子量测定这三种方法中使用最为方便也是最为广泛的应该是等高线定量法(V olumn Contour)。
它通过半自动描绘电泳条带的等高线边缘来得到等高线区域内部面积,再将该面积乘以区域内平均光密度值得到条带内部总的信号量。
当然这种分析方法的弊病显而易见:无法同等得排除不同泳道的背景亮度;等高线的绘制处于“半自动”状态,即需要人为判断作为等高线标准的电泳条带的边缘;最致命的是在几个电泳条带距离十分接近的时候几乎无法绘制单一条带的轮廓(常出现连续的几个条带等高线相连而无法分离出单独条带的轮廓)。
三种方法中个人感觉最为科学和严谨的应该是泳道/条带轨迹定量法(Trace Tracking)。
这种方法使用起来步骤较为繁琐,必须通过泳道识别---电泳条带识别两个连续的步骤才能进行定量。
然而这种方式的最大优点在于它可以完全抛弃人为主观因素进行全自动定量。
他的定量方式为:首先根据不同电泳条带的光密度值绘制光密度曲线,然后计算光密度曲线下面积作为电泳条带的定量根据。
大家可能会问他能不能排除泳道背景?答案是肯定的,它能够最大程度的排除不同泳道之间的背景差异,让各个泳道上的不同电泳条带在一条几乎相同的起跑线上进行对比。
用Quantity One进行定量分析的方法

用Quantity One进行定量分析的方法生物技术2009-09-06, 21:17 叶林Quantity One是Bio-Rad公司的凝胶电泳图像获取、处理以及定量分析软件。
功能很强大,到底多么强大在这就不说了。
用处很多,到底多么多在这也不说了,具体功能请参考Quantity One使用说明及相关教程。
下面只是Quantity One用于DGGE结果定量分析的一般操作方法:有下面这么一张DGGE图像,需要分析一下左边第5条泳道的8个条带对应的DNA在样品中占的百分比各分别是多少。
第一步:建立泳道点击菜单栏“Lane-Auto Frame Lanes”,一般情况下Quantity One会自动识别并建立泳道。
但也有很多时候不能自动建立泳道,这就需要选择菜单栏“Lane- Frame Lanes…”然后输入要建立泳道的数目,手动建立泳道。
泳道建立后需要调整,在菜单栏“Lane-Edit Frame”中有拉伸、旋转、移动、添加/删除锚点等选项,通过这些选项可以对泳道进行调整,调整后大致如下:第二步:消除泳道背景点击菜单栏“Lane-Lane Background…”跳出一个对话框,“All Lanes”中选择第二个,然后点一下第5条泳道,“Selected Lane”的下面会显示Selected Lan:#5(#5),然后选择”Lane On“ Rolling Disk Size中填一个10~20之间的数(可以多尝试几个,看看效果),最后点“Done”完成操作。
第三步:建立条带点击菜单栏“Band->Detect Bands…”打开一个对话框,调整Sensitivity和Lane Width的数值,使每个条带都被检测到,如果条带上面显示的是一条红线,可以在“Band-Band Attributes”的Style栏中选择Brackets,使之显示为括号形式。
条带建立后图像显示如下:第四步:生成报告点击菜单栏“Report-Lane Report”然后点一下第五条泳道,在弹出的对话框的Measurements 一栏中选择Trace Qty (个人感觉选择这个比较合适,也可以选择其他的看看效果),然后点Report,就看到了每个条带的Trace Qty值,这个值与DNA的浓度呈正比,根据这个值计算百分比即可。
凝胶成像系统软件操作指南2

Quantity One 应用讲义本讲义介绍Quantity One 的两个重要分析功能:定量分析和分子量确定。
Quantity One 软件Help Quick Guide 快捷指南提示如何实现一个功能,如定量分析(V olumes Quick Guide),电泳条带分析(Band Analysis),差显分析(Differential Display Analysis),克隆计数(Colony Counting Analysis)等。
快捷指南下有1,2,3…步骤,根据提示完成。
二.条带分析功能Band Analysis介绍用此功能对泳道内的所有条带进行分子量确定,相对浓度分析1,2,3同上4,5,6确定泳道lane,并可对泳道进行各种调整(实际实验中泳道往往不是垂直的而出现各种变形。
在软件的工具栏中有一Lane Tool 图标,包含有更多泳道编辑工具。
7.Lane Background 去除泳道背景,建议不做Lane Tool泳道编辑工具包 Band Tool条带编辑工具包8.Detect Band ,检测泳道内的条带,打开出现如下窗口,一般可通过调节sensitivity 灵敏度来调节检测出的条带,或通过人工编辑来增加/减少条带。
打开工具栏中Band Tool 条带编辑工具包可看到更多编辑工具(如上图)10. Standard 输入分子量标准,软件自带有许多Bio-Rad 的分子量标准,如你用的是自己的标准,进入New Standard 建立新的分子量标准,软件可以选择标准单位是MW (蛋白质)还是BP (核酸)等(左下图)。
在Protein-Standard 对话框中输入分子量数值,完成后单击赋值图标(右下图),回到图象文件上单击标准样品的泳道,软件自动将所输的分子量数值和泳道内的条带一一对应。
10. Band Attribute 条带属性,在完成第9步以后,软件已自动计算出了其他未知条带的分子量,打开band attribute 选择要报告的参数,这里我们选择Molecular Weight ,图象上可以看到所有条带的分子量(红颜色标记),标准分子量为蓝色标记。
Quantity One用于DGGE结果定量分析(该法不适用于PCR-DGGE)

有下面这么一张DGGE图像,需要分析一下左边第5条泳道的8个条带对应的DNA 在样品中占的百分比各分别是多少。
第一步:建立泳道点击菜单栏“Lane-Auto Frame Lanes”,一般情况下Quantity One会自动识别并建立泳道。
但也有很多时候不能自动建立泳道,这就需要选择菜单栏“Lane- Frame Lanes…”然后输入要建立泳道的数目,手动建立泳道。
泳道建立后需要调整,在菜单栏“Lane-Edit Frame”中有拉伸、旋转、移动、添加/删除锚点等选项,通过这些选项可以对泳道进行调整,调整后大致如下:第二步:消除泳道背景点击菜单栏“Lane-Lane Background…”跳出一个对话框,“All Lanes”中选择第二个,然后点一下第5条泳道,“Selected Lane”的下面会显示Selected Lan:#5(#5),然后选择”Lane On“ Rolling Disk Size中填一个10~20之间的数(可以多尝试几个,看看效果),最后点“Done”完成操作。
第三步:建立条带点击菜单栏“Band->Detect Bands…”打开一个对话框,调整Sensitivity和Lane Width的数值,使每个条带都被检测到,如果条带上面显示的是一条红线,可以在“Band-Band Attributes”的Style栏中选择Brackets,使之显示为括号形式。
条带建立后图像显示如下:第四步:生成报告点击菜单栏“Report-Lane Report”然后点一下第五条泳道,在弹出的对话框的Measurements 一栏中选择Trace Qty (个人感觉选择这个比较合适,也可以选择其他的看看效果),然后点Report,就看到了每个条带的Trace Qty值,这个值与DNA的浓度呈正比,根据这个值计算百分比即可。
以上仅仅是Quantity One进行定量的简单流程,非常不具体,一些具体的参数设置及软件的其它功能请参考相关的使用说明或教程。
Quantity One 中文教学光盘说明

Quantity One 中文教学光盘说明1、教程开始了,Quantity One一级主菜单栏、主工具栏。
主工具栏包括:标准文件操作命令、主浏览工具、以及打开自己工具栏和快捷指南的图标。
如果将鼠标指向任意图标会出现一个附助式命令相应的在主工具栏中会显示该命令的简短介绍。
Quantity One次级菜单栏包括数组相关的命令,例如图象工具栏包括:修剪工具、图象旋转工具、过滤指南、数据反转命令等。
击工具栏中右下角按扭可改变它的水平和和垂直的分布方式,对新用户而言可采用扩展窗口形式查看命令。
扩展窗口在每一图标边显示该命令的名称,并有一个问号图标可打开相应的在线帮助,工具栏可在窗口中任意移动,在同一时刻可打开多个窗口。
要关闭某一窗口再击一下此按扭即可。
下面开始讲解如何使用Quantity One 。
2、图象显示在主工具栏中选择Open按扭打开一个对话框,选择目录,双击目录下的文件名,打开此图象文件,在窗口内可将的此图象的位置及尺寸进行调整。
主工具栏中的缩放按扭能将所选择的区域放大,选择此按扭在图象上拖动鼠标选择所要放大的区域,释放鼠标所选择区域将充满整个图象窗口。
Quantity One 中有许多类似缩放操作的命令,它们必须要用鼠标来完成,先选择该命令,然后在图象内单击或拖动鼠标来完成。
在实际操作中,这些操作可能会改变鼠标的形状。
在主菜单的状态栏中会显示当前所进行的命令。
当击此命令显示可将鼠标恢复原状。
抓取工具可调整图象在窗口中的位置。
击一下此按扭,然后将图象抓取到新的位置,你也可用键盘的上下左右方向键对图象位置进行调整。
全屏显示按扭,可将图象恢复到全窗口显示状态,下面我们来看看如何优化图象显示。
3、优化图象显示,选择主工具栏中的转换按扭,打开转换窗口,在此窗口中可进行一系列的图象优化操作,转换窗口中有一缩小的图象预览及多种调节亮度和对比度的按扭,须注意的是这些转换只是改变图象的外观,并不能改变图象的质量和数据。
BIO-RAD凝胶成像仪简明操作程序

BIO-RAD凝胶成像仪简明操作程序
一、打开电源(仪器左侧靠后)。
二、将胶放在台面上,点亮Tran UV键。
三、双击电脑桌面上Quantity One图标,启动成像软件,按Fil e→
Gel Doc的流程进入成像界面
四、成像和保存。
调节以下功能键使图像清晰:
Iris:调节光圈(亮度)
Zoom:放大和缩小图像
Focus:聚焦使图像清晰
Auto expose/Manual expose:自动/手动曝光
分析软件还可以进行分子量计算,相对定量等工作,具体操作详见说明书
成像完毕后,Save 保存文件在“常规用户”各自的文件夹下,如需要拷贝文件,则选择Fil e→Export将文件转换后再拷贝,否则文件拷贝后将无法打开
五、关闭电源、清洁台面
注意:
●每次使用要登记,使用完毕后应关闭电源并清洁台面。
●严禁将图像存在桌面上,一经发现,立即删除
●严禁在本仪器计算机上做与成像和分析无关的事情
●未经允许,不得带本实验室以外的人员使用本仪器。
Quantityone的使用方法

Quantityone的使用方法执行步骤:由于Quantiy One只能识别黑白的TIF文件,而实际上发表论文时,很多杂志也要求提供TIF等格式的图片而非JEPG格式的;因此,考虑到这两层因素,我建议大家从一开始扫描就统一存贮为TIF格式的图片。
1.创建泳道:a.打开我们要分析的电泳图片(以蛋白质电泳为例)。
b.选择“Lane-Auto Frame lanes”。
这时如果您的电泳图片比较标准的话,Quantity One就会自动识别出每条电泳泳道的位置,而且将各个泳道的路径用一条红线标画出来;如果您对软件自动标记的泳道不甚满意,您可以通过“Lane-Edit Frame”下级各个子菜单提供的功能对泳道框架位置、大小等进行调节;调节方法就是通过鼠标的拖放来实现。
如果您只需要分析其中几个泳道的数据而不想其他泳道的标记干扰您的视线,您可以通过“Lane-Single Lane-Remove Lane”删除您不需要的泳道的标记。
注意:不是所有的电泳图片的泳道都能够被Quantity One自动识别。
在不能自动识别的情况下,Quantity One就会弹出对话框告诉您它不能识别泳道。
这时大家就需要手工绘制电泳泳道。
方法和上面一样,同过“Lane-Single Lane-Creat Lane”来实现。
只要用鼠标在您的电泳图片上顺着待标记的泳道的中轴线拖放就可以绘制出该泳道的标记红线。
2.不同泳道的背景排除:我们要将我们的电泳图片进行前面谈到的泳道识别,不管是自动方式还是手工识别。
然后选择“Lane-Lane Backgroud...”命令。
选择该命令后,鼠标即变成一个绿色的“+”,将鼠标移到您打算进行背景排除的泳道,点击左键一下,立刻就会弹出如下图所示的对话框。
其中“Optical Density”显示得是该泳道光密度值的分布情况。
大家会注意到这个分布曲线并不是紧贴着纵轴,而是位于纵轴上方分布。
造成这个“悬空现象”的原因就是该泳道自身存在着一定的光密度“背景”。
Bio-rad凝胶成像软件

GEL EQ凝胶成像使用指南1.打开主机电源与计算机电源.2.点击凝胶成像软件,进入QUANTITY ONE操作界面.3.在FILE菜单中,选择GEL EQ菜单,进入图像采集界面4.点击LIVE/FOCUS菜单,采集图像。
(根据被扫胶的要求,在凝胶成像主机面板上选择UV/WHITE紫外光/白光).(如需使用透射白光,则把白光台电源打开,把白光台放在底板上,把胶放在白光台上.)5.调节光圈大小,点击IRIS下OPEN/CLOSE;调节聚焦,点击FOCUSE下NEAR/FAR按钮;调节远近即大小,点击ZOOM下相应按钮,直到满意为止。
6.爆光时间一般选择自动AUTO EXPOSE即可。
7.若图像上有高亮红点,说明爆光过度,则须缩小光圈.8.图像调好后,点击SAVE键保存。
若需保存为其他格式,则在FILE菜单下选择导出,保存为JPEG/TIFF格式文件.9.关于分析处理见Quantity One应用讲义Quantity One应用讲义本讲义介绍Quantity One的两个重要分析功能:定量分析和分子量确定。
Quantity One软件Help Quick Guide快捷指南提示如何实现一个功能,如定量分析(Volumes Quick Guide),电泳条带分析(Band Analysis),差显分析(Differential Display Analysis),克隆计数(Colony Counting Analysis)等。
快捷指南下有1,2,3…步骤,根据提示完成。
一.定量分析功能快捷指南Volumes Quick Guide,此功能能对任意所选区域进行定量分析,此分析可以报告2个结果:相对浓度和绝对浓度(如有浓度标准样品)1.选择成像系统或打开已保存的文件(软件可以控制Bio-Rad所有的成像系统如GelDoc,ChemiDoc,VersaDoc,GS-800,FX,如不是Bio-Rad成像系统所摄取的图象,将图象保存为Tiff文件格式,软件也可进行分析处理)2.Zoom Box,缩放,对图象进行放大观察3.Transform转化,调节图象的对比度黑白4.Volume Rect Tool 矩形区域选择,如U15.Volume Free hand Tool自由画笔选择区域,可以勾勒出无规则形状,如U26.Volumn Contour Tool等高线勾勒区域,自动连接浓度浓度相同的点,如U3上面3种方法选择需要定量的区域。
Bio-Rad凝胶成像操作规范及注意事项

Bio-Rad凝胶成像操作规范及注意事项
(一)操作规范
1.打开主机电源与计算机电源.
2.点击凝胶成像软件,进入QUANTITY ONE操作界面.
3.在FILE菜单中,选择GEL EQ菜单,进入图像采集界面
4.点击LIVE/FOCUS菜单,采集图像.(根据被扫胶的要求, 在凝胶成
像主机面板上选择UV/WHITE紫外光/白光).(如需使用透射白光,则把白光台电源打开,把白光台放在底板上,把胶放在白光台上.)
5.调节光圈大小,点击IRIS下OPEN/CLOSE;调节聚焦,点击FOCUSE下
NEAR/FAR按钮;调节远近即大小,点击ZOOM下相应按钮,直到满意为止.
6.爆光时间一般选择自动AUTO EXPOSE即可.
7.若图像上有高亮红点,说明爆光过度,则须缩小光圈.
8.图像调好后,点击SAVE键保存.若需保存为其他格式,则在FILE菜
单下选择导出,保存为JPEG/TIFF格式文件.
(二)注意事项
1.不要污染仪器外部表面。
2.在使用紫外光源照相的过程中,不可打开凝胶成像系统的暗门。
3.照相后把废胶取出,并用软纸擦拭干净。
4.调焦时要轻缓,调焦需要等待过程。
5.保持暗香内干燥。
6.使用仪器时,要关闭门和观测台,否则无法使用紫外灯。
7.使用完毕及时关闭电源并在记录本上进行登记。
8.勿用U盘拷贝数据。
生物学实验中心
天津市动植物抗性重点实验室
2013年9月。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
凝胶定量软件Quantity One使用简介1、内容简介凝胶电泳是每个做分子生物学的同学天天都要打交道的基本技术。
电泳之后的信息处理与电泳本身同样重要。
目前有大量软件可以用于分析电泳结果,比较有名的比如BandScan、BandLeader、Sigma Gel等等。
今天要向大家介绍的是来自Bio-Rad的1D凝胶定量软件Quantity One(Bio-Rad还有一个做2D凝胶分析的软件PDQuest)。
这个软件的最新版本可以在Bio-Rad的主页免费下载。
目前的最新版本是4.52版2、Quantity One的定量方法Quantity One的分析功能顾名思义主要用来进行凝胶或者培养皿的荧光定量分析。
它的分析功能或者说分析方式主要有4种:泳道/条带轨迹定量法;等高线直接定量法;菌落计数;分子量测定这三种方法中使用最为方便也是最为广泛的应该是等高线定量法(Volumn Contour)。
它通过半自动描绘电泳条带的等高线边缘来得到等高线区域内部面积,再将该面积乘以区域内平均光密度值得到条带内部总的信号量。
当然这种分析方法的弊病显而易见:无法同等得排除不同泳道的背景亮度;等高线的绘制处于“半自动”状态,即需要人为判断作为等高线标准的电泳条带的边缘;最致命的是在几个电泳条带距离十分接近的时候几乎无法绘制单一条带的轮廓(常出现连续的几个条带等高线相连而无法分离出单独条带的轮廓)。
三种方法中个人感觉最为科学和严谨的应该是泳道/条带轨迹定量法(Trace Tracking)。
这种方法使用起来步骤较为繁琐,必须通过泳道识别---电泳条带识别两个连续的步骤才能进行定量。
然而这种方式的最大优点在于它可以完全抛弃人为主观因素进行全自动定量。
他的定量方式为:首先根据不同电泳条带的光密度值绘制光密度曲线,然后计算光密度曲线下面积作为电泳条带的定量根据。
大家可能会问他能不能排除泳道背景?答案是肯定的,它能够最大程度的排除不同泳道之间的背景差异,让各个泳道上的不同电泳条带在一条几乎相同的起跑线上进行对比。
这个背景排除功能是等高线法无法做到的(等高线法也有基本的背景排除办法,但是和泳道/条带轨迹定量法的背景排除不是一个等级的。
等高线法只能排除同一泳道上的背景,而不能均等的排除不同泳道的背景)。
另外泳道/条带轨迹定量法还可以结合Gauss Model Bands对紧密相连的电泳条带进行分析,而这种条带也是等高线法无法分析的。
我们此次重点学习这个方法。
第三个分析功能是菌落计数(Colony Counting)。
这个功能其实很实用,可以分析蓝白筛选的结果。
另外Quantity One还可以通过回归曲线测定分子量。
3、Quantity One的基本常用菜单操作下面让我们了解一下Quantity One常用的基本菜单操作。
打开文件:由于Quantity One是Bio-Rad的硬件配套软件,因此Quantity One可以自动输入来自Bio-Rad公司的凝胶分析仪的数据。
具体支持哪些硬件大家可以在“Edit-Preference-Imagers”里面设置。
如果您的实验室没有采用Bio-Rad的硬件设施也没关系。
您只要将电泳图片用ACDSee等程序转换为TIF 图片格式就可以被Quantity One识别了。
注意Quantity One只支持8位和16位灰度的TIF文件。
PHP代码:Quantity One似乎有一个小bug,就是在按“Open”之后并没有立刻弹出资源管理器让你选择目标文件的位置。
其实你只要将鼠标在屏幕右下方点击一下,资源管理器就会乖乖弹出来了。
PHP代码:Quantity One只能分析白色背景+黑色条带的电泳图。
而我们正常情况下得到的一般都是黑色背景+白色条带的电泳图。
我们可以在“Image-Invert data 中将图片色彩进行反转,然后便可以用Quantity One进行分析了。
文字注释:Quantity One提供基本的文字注释功能。
您可以在您的电泳图片上记录您的分析结果比如电泳条带的分子量、光密度值、物质的量等等。
这个功能可以通过“Edit-Text Overlay Tools”来实现。
在弹出的浮动工具栏中选择“ABC”或者“”就可以进行文字输入和画标记线的操作。
光密度工具:在“View-Plot Density”的下级菜单中大家会见到几个和电泳条带光密度值相关的显示选项。
大家可以分别选择不同的选项感受一下它们之间的差别。
选择方法是点击相应的下级菜单比如“Plot Cross Section”,然后将变成带一个蓝色感叹号的鼠标移到您想知道光密度的位置,点击一下就会显示该处的光密度相关信息。
在下面这幅图片中我们可以看见两条黄线交叉处的电泳条带的相关信息。
上方的一串曲线是不同泳道之间在同一水平线上的光密度比值曲线;左边是黄线交叉处所在泳道的几个电泳条带的光密度分布情况。
3D Viewer:在“View-3D Viewer”菜单中大家会看到一个有趣的功能叫做3D Viewer。
这个玩意按照Bio-Rad的说法可以辅助辨别几条紧密相连在一起的电泳条带的分布情况。
大家只要选择了这个命令后鼠标就会一个“+”型,然后将+型移动到您感兴趣的位置,拖动鼠标画出一个正方形区域,然后用鼠标双击,Quantity One就会将这块区域按照gauss分布规律渲染成一个三维模型,颇有意思。
但个人感觉这个功能噱头多于实用。
4、Quantity One的基本背景排除功能最开始的时候我们就说过Quantity One的等高线定量模式也有一种比较基本的背景排除方法。
这个方法同样也适用于泳道/条带定量模式。
现在我们就来学习这个方法。
基本背景排除的功能位于“Image-Substract backgroud...”和“Image-Filter Wizard...”这两个菜单。
Image-Filter Wizard:这个功能是对原始图片做一些初步的加工,主要是除去一些图片上的“斑点”。
这些斑点主要有两种类型:一种是深色的“胡椒面”型和浅色的“食盐”型,两种斑点都可以毫不犹豫地去除。
从“Image-Filter Wizard...”菜单调出向导菜单后选择“pepper”和“salt”,下面两个选项可以按照程序默认的选项,然后“OK”就可以完成这第一步的降噪过程。
Image-Substract backgroud:这个功能是真正对图片背景进行清理的工具(区别于“Image-Filter Wizard...”的降噪模式)。
只是这种清理是一种“全局”型的清理,即它以相同的参数对每条泳道进行背景清理。
然而在清理方式上它还是可以分成两种不同的方式:Backgroud Box:一种是以一个局部小面积为标准背景,将整张电泳图片上所有比该区域光密度值低的区域全部漂白。
这种发式称为“Backgroud Box”。
操作时用鼠标选中对话框下部左侧的“Backgroud Box”按钮,然后用鼠标在电泳图片上选择一块色彩接近于背景色,色泽比较均匀的区域,用鼠标拖动画出一个正方形。
释放鼠标后程序就会立即对电泳图片进行降低背景的处理;Backgroud Stripe:相对于“Backgroud Box”来说是一种更加智能化的处理方式。
它特别适用于梯度凝胶,即凝胶浓度由上至下依次变化。
由于梯度胶的光密度值在一定距离内不断变化,因此如果采用“Backgroud Box”的方法除背景就会发生偏差。
Quantity One此时提供一种随着凝胶浓度变化而变化的除背景方式就是“Backgroud Stripe”。
和“Backgroud Box”类似,选择右下角的“Backgroud Stripe”按钮,然后用鼠标沿着电泳泳道拖放形成一个狭长的剪影带(Stripe),这个剪影带内部的光密度值顺着泳道逐渐升高或降低。
Quantity One根据这个Stripe可以动态的对整张图片的背景进行剪影。
比如泳道起始处光密度低,那么Quantity One在此处的剪影值也降低;随着Stripe向前延伸,光密度值逐渐升高,Quantity One也同样不断加大剪影的强度。
这样一来就可以排除由于梯度胶带来的背景不一致的影响因素5、Quantity One的电泳泳道分析功能---创建泳道前面说过Quantity One之所以强大是因为它具有的泳道/条带轨迹定量法。
现在我们就来学习一下如何在电泳图片上创建泳道(Lane)以及如何进行针对不同泳道的背景排除。
创建泳道:首先打开我们要分析的电泳图片(以蛋白质电泳为例)。
然后选择“Lane-Auto Frame lanes”。
这时如果您的电泳图片比较标准的话,QuantityOne就会自动识别出每条电泳泳道的位置,而且将各个泳道的路径用一条红线标画出来;如果您对软件自动标记的泳道不甚满意,您可以通过“Lane-Edit Frame”下级各个子菜单提供的功能对泳道框架位置、大小等进行调节。
调节方法就是通过鼠标的拖放来实现,大家可以自己体验一下;如果您只需要分析其中几个泳道的数据而不想其他泳道的标记干扰您的视线,您可以通过“Lane-Single Lane-Remove Lane”删除您不需要的泳道的标记。
PHP代码:不是所有的电泳图片的泳道都能够被Quantity One自动识别。
在不能自动识别的情况下,Quantity One就会弹出对话框告诉您它不能识别泳道。
这时大家就需要手工绘制电泳泳道。
方法和上面一样,同过“Lane-Single Lane-Creat Lane”来实现。
只要用鼠标在您的电泳图片上顺着待标记的泳道的中轴线拖放就可以绘制出该泳道的标记红线.6、Quantity One的电泳泳道分析功能---排除背景前面说过Quantity One之所以强大是因为它具有的泳道/条带轨迹定量法。
现在我们就来学习一下如何在电泳图片上创建泳道(Lane)以及如何进行针对不同泳道的背景排除。
排除背景:首先请大家注意,这个排除背景和前面我们在“Image”菜单中使用的“Substruct Backgroud”有所不同。
后者排除背景的对象是整个电泳图片而非将各个电泳泳道的背景分别进行排除。
现在我们要学习的这个命令可以帮助我们分别排除各个泳道(也可以将全部泳道用相同标准进行排除)的不同的光密度背景。
这个功能对我们以后的分析影响甚大,大家一定好好学习。
首先我们要将我们的电泳图片进行前面谈到的泳道识别,不管是自动方式还是手工识别。
然后选择“Lane-Lane Backgroud...”命令。
选择该命令后,鼠标即变成一个绿色的“+”,将鼠标移到您打算进行背景排除的泳道(比如下图中的第4泳道),点击左键一下,立刻就会弹出如下图所示的对话框。
