无机化学习题
无机化学_习题集(含答案)

48.下列物质中,氢键最强的是( )。
A)H2O B)H2S C)HCl D)HF
49.NH3分子中,氮原子以sp3杂化轨道成键,NH3分子空间几何构型是( )。
A)正方形B)四面体形C)三角锥形D)T字形
50.一个电子排布为1s22s22p63s23p1的元素可能的氧化数是( )。
A)S和Fe(OH)2+B)NO2C)(NH4)2S2D)S和NH3·H2O
36.将足量的SiF4气体通入到NaOH溶液中,反应产物是( )。
A)Na2SiO3与HF B)Na2SiO3与Na2SiF6
C)H2SiO3与HF D)Na2SiO3与NaF
37.为了防止水解,实验室在配制一些盐的溶液时常要在水中加入相应的酸,配制下列溶液不能加酸的是( )。
《无机化学》课程习题集
一、单选题
1.下列反应中,反应的标准摩尔焓变等于生成物的标准摩尔生成焓的是()。
A)CO2(g)+CaO(s)CaCO3(s)B)1/2H2(g) +1/2I2(g)HI(g)
C)H2(g)+Cl2(g)2HCl(g)D)H2(g)+ 1/2O2(g)H2O(g)
2.增大反应物浓度,使反应速率增大的原因是()。
A)先有AgCl沉淀B)先有Ag2CrO4沉淀
C)两种沉淀同时析出D)不产生沉淀
68.下列元素中,电负性最大的是( )。
A)KB)SC)OD)Cl
69.27℃,101.0kPa的O2(g)恰好和4.0L,127℃,50.5kPa的NO(g)反应生成NO2(g),则O2(g)的体积为()。
A)1.5LB)3.0LC)0.75LD)0.20L
《无机化学》习题册及答案

《无机化学》课程习题册及答案第一章溶液和胶体一、是非题:(以“+”表示正确,“-”表示错误填入括号)1.渗透压力比较高的溶液,其物质的量浓度也一定比较大。
()2.相同温度下,物质的量浓度均为200mmol·L-1的NaCl溶液和葡萄糖溶液,其渗透压相等()3.相同温度下,渗透浓度均为200mmol·L-1的NaCl溶液和CaCl2溶液,其渗透压相等()4.临床上的两种等渗溶液只有以相同的体积混合时,才能得到等渗溶液。
()5. 两种等渗溶液以任意比例混合所得溶液在临床上必定是等渗溶液()6.临床上,渗透浓度高于320 mmol⋅L-1的溶液称高渗液()7.在相同温度下,0.3 mol⋅L-1的葡萄糖溶液与0.3 mol⋅L-1的蔗糖溶液的渗透压力是相等的()8. 物质的量浓度均为0.2mol·L-1的NaCl液和葡萄糖液渗透浓度相等()9. 对于强电解质溶液,其依数性要用校正因子i来校正。
()二、选择题1.使红细胞发生溶血的溶液是()A.0.2mol·L-1 NaCl B.0.1mol·L-1葡萄糖C.0.3mol·L-1葡萄糖 D.0.4mol·L-1 NaCl2.物质的量浓度均为0.1 mol·L-1的下列溶液,其渗透压最大的是()A.葡萄糖 B.NaCl C.CaCl2 D.无法比较3.使红细胞发生皱缩的溶液是()A.0.1mol·L-1 NaCl B.0.1mol·L-1葡萄糖C.0.3mol·L-1葡萄糖 D.0.2mol·L-1 NaCl4.在相同温度下,物质的量浓度均为0.1 mol·L-1的下列溶液,其渗透压最小的是()A.葡萄糖 B.NaCl C.CaCl2 D.无法比较5.物质的量浓度均为0.1 mol·L-1的下列溶液,在临床上属于等渗溶液的是()A.葡萄糖 B.NaCl C.CaCl2 D.蔗糖6. 试排出在相同温度下下列溶液渗透压由大到小的顺序 ( )a. c(C6H12O6)= 0.2 mol·L-1b. c[(1/2)Na2CO3]= 0.2 mol·L-1c. c[(1/3)Na3PO4]= 0.2 mol·L-1d. c(NaCl)= 0.2 mol·L-1A. d>b>c>aB. a>b>c>dC. d>c>b>aD. b>c>d>a7. 医学上的等渗溶液,其渗透浓度为()A. 大于280 mmol·L-1B. 小于280 mmol·L-1C. 大于320 mmol·L-1D. 280-320 mmol·L-18.欲使同温度的A、B两种稀溶液间不发生渗透,应使两溶液(A、B中的基本单元均以溶质的“分子”式表示) ( )A 质量摩尔浓度相同B 物质的量浓度相同C 质量浓度相同D 渗透浓度相同9. 质量浓度为11.1g·L-1CaCl2 (M=111.0 g·mol-1)溶液的渗透浓度是 ( )A.100mmol ·L-1B.200mmol ·L-1C.300mmol ·L-1D.400mmol ·L-1三、填充题:1.10.0 g·L-1NaHCO3(Mr=84)溶液的渗透浓度为__________mol·L-1。
无机化学练习题

普通化学练习题一、 判断题1、一个溶液所有组分的摩尔分数总和为1( )2、状态函数都具容量性质( )3、化学反应中发生碰撞的分子,不一定是活化分子( )4、当溶液变稀时,活度系数会增大( )5、ΘΘ<B A ϕϕ可以合理判定B SP A SP K K ΘΘ<( )6、平衡状态是正逆反应都停止的状态( )7、当n=2时描述电子运动状态的四个量子数最多有四组( )8、与杂化轨道形成的健不可能是σ键( )9、配合物的Θf K 越大,表明配合物的内界与外界结合越牢固( )10、某胶体溶液在电渗时液体向负极移动,说明胶粒带正电( )11、自发进行的反应,其焓值总是下降的( )12、化学反应的级数越高,反应速率就越大( )13、强电解质也有α,称为表观电离度( )14、电极反应V Cl e Cl 36.1222==+Θ-ϕ的,那么V Cl e Cl 68.02/12==+Θ-ϕ的( )15、含有d 电子的原子都属副族元素( )16、任何中心离子的配位数为4的配离子,均为四面体构型( )17、胶粒只包含胶核和电势离子,不包括反离子( )二、单选题1、下列配离子在强酸介质中肯定能稳定存在的是()A 、-2342)(O C FeB 、+263)(NH MnC 、-36AlFD 、-2AgCl2、土壤胶粒带负电,下列对它凝结能力最强的是()A 、42SO NaB 、3AlClC 、4MgSOD 、-])([63CN Fe K3、下列有机分子中的碳原子在同一条直线上的是()A 、正丁烷B 、乙烯C 、 2-丁炔D 、甲烷4、按照量子数组取值的合理性,下列电子可能存在的是()A 、3,3,-1,+1/2B 、3,0,0,0C 、2,1,0,+1/2D 、2,0,1,-1/25、下列水溶液浓度均按0.1mol/L,其中氨根离子浓度最大的()A 、氯化铵B 、硫酸氢铵C 、碳酸氢铵D 、醋酸铵6下列过程系统熵值基本不变的是()A 、石灰石的分解B 、碳与氧生成二氧化碳C 、固体硝酸钾溶解D 、液体乙醇蒸发为气体7混合气体中含气体A 1mol,气体B 2 mol,气体C 3 mol ,混全气体总压为200Kpa, 则其中B 的分压接近下列哪个值()A 、67Kpa8难挥发性物质的水溶液,在不断沸腾时,它的沸点是()A 、继续升高9淡水鱼和海水鱼不能交换生活环境,因为()A 、渗透压不同10KBr 和AgNO3反应在一定条件下可生成AgBr ,如胶团结构[(AgBr)m ·nBr -·(n-x)K +]x-·xK +,则()A 、KBr 过量11、由石墨到金刚石的转变过程,标准焓变为1.9千焦/摩,标准生成吉布斯自由能为2.9千焦/摩,二者相比无序度更高的是()A 、石墨B 、金刚石C 、二者都一样D 、无法判断12H 2O(s)=H 2O(g),的△H 和△SA 、都为正值13相同条件下,由相同反应物变为相同的产物,两步与一步反应相比A 、熵焓内能一样14下列标准状态下的反应:2NO 2(g )=N 2O 4(g) 18.5-Θ•-=∆mol KJ G mr N 2(g)+3H 2=2NH 3(g) 18.5-Θ•-=∆mol KJ G m r A 、反应2的平衡常数比反应1的大15下列元素中,电负性最大的是()A 、KB 、SC 、OD 、Cl16反应的速率常数的单位mol ·L -1·S -1, 则反应级数为A 、零级反应17等量的酸碱中和,得到Ph 值()A 、视酸碱的相对强弱而定19由电极MnO 4-/Mn 2+和Fe 3+/Fe 2+组成的原电池,若加大溶液的酸度,原电池的电动势将:()A 、增大20、反应C (s )+CO 2(g) = 2CO(g)的K p 的表达式写作( )A 、)()(/)(22CO p C p CO pB 、)(/)(2CO p CO pC 、)()(/)(2CO p C p CO pD 、)(/)(22CO p CO p21、在醋酸溶液中加入少许固体NaCl 后,发现醋酸的离解度( )A 、没有变化B 、略有上升C 、剧烈上升D 、急剧下降22、升高温度反应速率增大的原因是( )A 、分子的活化能提高了B 、反应的活化能降低了C 、活化分子数增多了D 、该反应是吸热反应23、对于电极+-3272/Cr O Cr 来说,溶液的pH 值上升,则( )A 、电极电势上升B 、电极电势下降C 、电极电势不变D 、标准电极电势下降24、下列是极性分子的是( )A 、BeF 2B 、BF 3C 、NF 3D 、CF 425、某元素原子基态的电子构型为[Ar ]3d 54s 2,其在周期表的位置是( )A 、s 区第二主族B 、s 区第五主族C 、d 区第二副族D 、d 区第七副族26、某元素的电子构型为[Ar ]3d 64s 0的离子是( )A 、Mn 2+B 、Fe 3+C 、Co 3+D 、Ni 2+27、通常情况下,下列何种离子在各自的配合物中可能生成内轨型化合物( )A 、Fe 2+B 、Cu +C 、Ag +D 、Au 3+28、下列电对中标准电极电势最高的是( )A 、Ag Ag /+B 、Ag NH Ag /)(3+C 、Ag CN Ag /)(2-D 、Ag AgCl /29、加入氨水即可进行分离的一组离子是:( )A 、++23Z n Al 和B 、++2C u Ag 和C 、++22N i Cd 和D 、++2C a Na 和30、溶胶粒子进行电泳时( )A 、胶粒向正极运动,电势离子和吸附离子向负极移动B 、胶粒向正极运动,扩散层向负极运动C 、胶团向一个极移动D 、胶粒向一极移动,扩散层向另一极移动31、某基态原子,在n=5的轨道中仅有2个电子,则该原子n=4的轨道中含有的电子数为( )个A 、8B 、18C 、8~18D 、8~3232、根据质子酸碱理论,下列物质既是酸又是碱的是( )A 、NH 4+B 、OH -C 、H 2OD 、PO 43-33、下列给定热力学条件下,高温自发的过程是()A 、0,0<∆<∆S HB 、0,0>∆>∆S HC 、0,0<∆>∆S HD 、0,0>∆<∆S H34、热力学第一定律数学表达式适用于()体系A 、敞开B 、封闭C 、孤立D 、任何35、下列哪种情况使平衡到达所需时间最短( )A 、ΘK 很小B 、ΘK 很大C 、ΘK 接近1 D 、无法判断36、某反应的温度系数为3,当反应体系温度升高100℃时,反应时是0℃时的()A 、30倍B 、100倍C 、310倍D 、90倍37、向醋酸溶液中加入少量的固体物质,能使其离解度减小的是()A 、NaAcB 、NaClC 、FeCl 3D 、NaCN38、由电极+++-2324//Fe Fe Mn MnO 和组成的原电池,若增大溶液的酸度,原电池的电动势将( )A 、增大B 、减小C 、不变D 、无法判断39、第四周期元素原子中未成对电子数最多可达( )个A 、3B 、5C 、6D 、740、下列分子中,中心原子的杂化轨道中P 成分占2/3的是( )A 、NH 3B 、HgCl 2C 、H 2OD 、BF 341、实验证明在[Co(NH 3)6]3+配离子中没有单电子,由此可推论Co 3+采取的成键杂化轨道()A 、sp 3B 、d 2sp 3C 、dsp 2D 、sp 3d 242、基本单元的下列叙述错误的是()A 、它可以是分子、原子、离子、电子及其它粒子B 、它可以是上述粒子手组合与分割C 、它可以是一个反应式,如:O H O H 22222=+D 、它必须是客观存在的粒子43在[Pt(en)2]2+中同,Pt 的氧化数和配位数是()A 、+2,和444下列用来表标核外电子运动状态的合理组合是()A 、2,1,-1,1/2B 、2,1,0,0C 、3,1,2,1/2D 、1,2,0,-1/245、施肥过多引起烧苗是由于土壤溶液的()比植物细胞溶液高A 、渗透压B 、蒸气压C 、冰点D 、沸点46、下列物质的浓度均为0.11-•L mol ,对负溶胶聚沉能力最大的是()A 、342)(SO AlB 、43PO NaC 、2CaClD 、NaCl47、体系不做非体积功的等压过程,吸收的热与体系焓变的关系()A 、H Qp ∆=B 、H Qp ∆>C 、H Qp ∆<48、某反应0,0>∆>∆S H ,则该反应()A 、高温自发,低温不自发B 、高温不自发,低温自发C 、任何温度均自发D 、任何温度均不自发49、D C B A +=+为基元反应,如果一种反应物的浓度减半,则反应速度将减半,根据是()A 、质量作用定律B 、勒夏特列原理C 、阿仑尼乌斯定律D 、微观可逆性原理50、将A (蔗糖)及B (葡萄糖)各称出10克,分别溶于100克水中,成为A 、B 两种溶液,用半透膜将两液分开,发现()A 、A 中水渗入B B 、B 中水渗入AC 、没有渗透D 、无法确定第一种解释:把体积与质量浓度相同的葡萄糖与蔗糖溶液用半透膜(允许溶剂和葡萄糖通过,不允许蔗糖通过)隔开,开始和一段时间后页面的情况是A 甲高于乙B 乙高于甲C 甲先高于乙,乙后高于甲D 乙先高于甲,甲后高于乙过程详细的解释首先,水和葡萄糖分子可以通过半透膜,蔗糖分子不能。
无机化学习题与答案

绪论一.是非题:1.化学变化有新物质产生,而物理变化无新物质产生.2.化学变化是由于构成分子的原子外层电子运动状态的改变而引起的、原子核不变的一类变化3.元素的变化为物理变化而非化学变化.4.化学变化的特点是原子核不变分子组成或原子间结合方式发生变化.5.化学反应常伴有发光现象,但并非所有的发光现象都属于化学反应.二.选择题:1.化学研究的对象是具有宏观实体的物质,它不包括A.希有气体B:混合物C.电子流或γ──射线D.地球外的物质2.纯的无机物不包括A.碳元素B.碳化合物C.二者都对D.二者都错3.下列哪一过程不存在化学变化A.氨溶于水B.蔗糖溶在水中C.电解质溶液导电D.照相底片感光第一章原子结构和元素周期系一.是非题1.电子在原子核外运动的能量越高,它与原子核的距离就越远.任何时候,1s电子总比2s电子更靠近原子核, 因为E2s > E1s.2.原子中某电子的各种波函数,代表了该电子可能存在的各种运动状态,每一种状态可视为一个轨道.3.氢原子中,2s与2p轨道是简并轨道,其简并度为4;在钪原子中,2s与2p 轨道不是简并轨道, 2p x,2p y,2p z为简并轨道,简并度为3.4.从原子轨道能级图上可知,任何原子在相同主量子数的轨道上,能量高低的顺序总是f > d > p > s;在不同主量子数的轨道上,总是(n-1)p > (n-2)f > (n-1)d > ns.5.在元素周期表中, 每一周期的元素个数正好等于该周期元素最外电子层轨道可以容纳的电子个数.6.所有非金属元素(H,He除外)都在p区,但p区所有元素并非都是非金属元素.7.就热效应而言,电离能一定是吸热的,电子亲和能一定是放热的.8.铬原子的电子排布为Cr[Ar]4s13d5,由此得出: 洪特规则在与能量最低原理出现矛盾时,首先应服从洪特规则.9.s区元素原子丢失最外层的s电子得到相应的离子,d区元素的原子丢失处于最高能级的d电子而得到相应的离子.10.在原子核里因质子数和中子数不同,就组成了不同的核素;同样在原子核里因质子数和中子数不等,就构成了同位素.可见,核素也就是同位素.二.选择题1.玻尔在他的原子理论中A.证明了电子在核外圆形轨道上运动;B.推导出原子半径与量子数平方成反比;C.应用了量子力学的概念和方法;D.解决了氢原子光谱和电子能量之间的关系问题.2.波函数和原子轨道二者之间的关系是A.波函数是函数式,原子轨道是电子轨迹;B.波函数和原子轨道是同义词;C.只有轨道波函数与原子轨道才是同义的;D.以上三种说法都不对.3.多电子原子的原子轨道能级顺序随着原子序数的增加A.轨道能量逐渐降低,但能级顺序不变;B.轨道能量基本不变,但能级顺序改变;C.轨道能量逐渐增加,能级顺序不变;D.轨道能量逐渐降低,能级顺序也会改变.4.周期表中各周期元素数目是由什么决定的A.2n2(n为主量子数);B.相应能级组中所含轨道总数;C.相应能级组中所含电子总数D. n + 0.7规则5.下列电子构型中,电离能最低的是A.ns2np3B.ns2np4C.ns2np5D.ns2np66.下列元素中,第一电离能最大的是A.BB.CC.AlD.Si7.原子光谱中存在着不连续的线谱,证明了A.在原子中仅有某些电子能够被激发B. 一个原子中的电子只可能有某些特定的能量状态C.原子发射的光,在性质上不同于普通的白光D.白光是由许许多多单色光组成.8.原子轨道中"填充"电子时必须遵循能量最低原理,这里的能量主要是指A.亲合能B.电能C.势能D.动能9.下列哪一原子的原子轨道能量与角量子数无关?A.NaB.NeC.FD.H10.下列哪一种元素性质的周期规律最不明显A.电子亲合能B.电负性C.电离能D.原子体积11.用来表示核外某电子运动状态的下列各组量子数(n l m ms)中哪一组是合理的?A.(2,1,-1,-1/2)B.(0,0,0,+1/2)C.(3,1,2,+1/2)D.(2,1,0,0)12.元素和单质相比较时,正确的说法是A.元素由单质构成;B.元素可分解为单质;C.元素的质量比单质的质量重;D.单质是元素存在的一种形式.13.核素和同位素的相同点是A.它们中的质子数均大于中子数;B.它们中的质子数均小于中子数;C.它们中的质子数和中子数相等;D.它们各自含有相同的质子数.14.关于核素的正确说法是A.具有一定数目的核电荷的一种原子;B.具有一定数目的质子的一种原子;C.具有一定数目的中子的一种原子;D.具有一定数目的中子和一定数目的质子的一种原子.15.测定原子量最直接的方法是A.质谱法B.化合量法C.气体密度法D.α─粒子散射法三.填空题:1.宏观物体的运动可用方程F=ma 描述,但微观物体的运动要用量子力学中的( )描述. 它是一个偏微分方程式.2主量子数为4 的一个电子,它的角量子数的可能取值有( )种,它的磁量子数的可能取值有( )种.3.在氢原子中,4s和3d轨道的能量高低为( ),而在19 号元素K 和26 号元素Fe中, 4s和34轨道的能量高低顺序分别为( )和( ).4.填上合理的量子数:n=2,l=( ),m=( ),ms=+1/2.5.+3价离子的电子层结构与S2-离子相同的元素是( ).6.微观粒子运动与宏观物质相比具有两大特征,它们是( )和( ),说明微观粒子运动特点的两个重要实验是( ).7.ψn,l,m是( ),当n,l,m,一定时,处于ψn,l,m状态的一个电子的( ), ( ),( )可以确定.n,l,m可以确定一个( ).8.氢原子的电子能级由( )决定,而钠原子的电子能级由( )决定.9.Mn原子的价电子构型为( ),用四个量子数分别表示每个价电子的一定状态,是( ).10.在电子构型 a.1s22s2, b.1s22s22p54s1, c.1s22s12p13d13s1, d.1s22s22p63s13d1, e.1s22p2, f.1s22s32p1,g.1s12s22p13d1中,属于原子基态的是( ),属于原子激发态的是( ),纯属错误的是( ).11.用元素符号填空:(均以天然存在为准)原子半径最大的元素是( ), 第一电离能最大的元素是( ),原子中3d半充满的元素是( ),原子中4p半充满的元素是( ),电负性差最大的两个元素是( ), 化学性质最不活泼的元素是( ).四.简答题1.第114号元素属于第几周期? 第几族?2.为什么碳(6C)的外围电子构型是2s22p2, 而不是2s12p3,而铜(29Cu)的外围电子构型是3d104s1,而不是3d94s2?3、气体常数R是否只在气体中使用?五.综合题1.某元素位于周期表中36号元素之前,该元素失去2个电子以后,在角量子数l=2的轨道上正好半充满,试回答:(1).该元素的原子序数,符号,所处周期和族;(2).写出表示全部价电子运动状态的四个量子数;(3).该元素最高价氧化物水合物的分子式及酸碱性.2.某元素原子序数为33,试问:(1).此元素原子的电子总数是多少?有多少个未成对电子?(2).它有多少个电子层?多少个能级?最高能级组中的电子数是多少?(3).它的价电子数是多少?它属于第几周期?第几族?是金属还是非金属?最高化合价是几?3.写出原子序数为24的元素的名称,符号及其基态原子的电子排布式,并用四个量子数分别表示每个价电子的运动状态.第二章分子结构一.是非题:1、两原子间可以形成多重键,但两个以上的原子间不可能形成多重键。
无机化学练习题及答案解析

无机化学练习题一、选择题1.Na2S2O7中S的氧化数是()(A) +2 (B) +4 (C) +6 (D) +82.相同浓度的下列几种酸中,酸性最弱的是()(A) HCl (B) HBr (C) HI (D) H2Se3.CaF2 的K sp = 3.95×10-11 ,在氟离子浓度为3.0 mol·dm-3 的溶液中Ca2+离子可能的最高浓度是( ) (A)4.39×10-11 mol·dm-3 (B) 1.09×10-12 mol·dm-3(C) 1.09×10-13 mol·dm-3 (D) 4.39×10-12 mol·dm-34.由下列反应设计的电池,不需要惰性电极的是( )(A) H2(g) + Cl2 (g) = 2HCl(aq) (B) Ce4++ Fe2+= Ce3++ Fe3+(C) Zn + Ni2+= Zn2++ Ni (D) Cu + Br2 = Cu2++ 2Br-5.向原电池Zn│Zn2+(1 mol.dm-3 )‖Cu2+(1 mol.dm-3 )│Cu的负极中通入H2S气体,生成白色沉淀,则电池的电动势将( ) (A) 增大(B) 减小(C) 不变(D) 无法判断6.由铬在酸性溶液中的元素电势图,可确定能自发进行的反应是( )Cr3+ - 0.41VCr2+- 0.91VCr(A) 3Cr2+→ 2Cr3++ Cr (B) Cr + Cr2+→ 2Cr3+(C) 2Cr → Cr2++ Cr3+(D) 2Cr3++ Cr → 3Cr2+7.已知:Fe3++ e-= Fe2+θE= 0.77 VCu2++ 2e-= Cu θE= 0.34 VAg++ e-= Ag θE= 0.80 VAl3++ 3e-= Al θE= -1.66 V则最强的氧化剂是( ) (A) Al3+(B) Fe3+(C) Cu2+(D) Ag+8.下列新制备出的氢氧化物沉淀在空气中放置,颜色不发生变化的是( )(A) Fe(OH)2(B) Mn(OH)2(C) Co(OH)2(D) Ni(OH)29.Fe3+具有d5电子构型,在八面体场中要使配合物为高自旋态,则分裂能△和电子成对能P 所要满足的条件是( ) (A) △和P越大越好(B) △> P (C) △< P (D) △= P10.不具有空间异构体的是( )(A) [PtCl2(NH3)4]2+(B) [PtCl3(NH3)3]+(C) [PtCl(NO2)(NH3)4]2+(D) [PtCl(NH3)5]3+11.下列反应中配离子作为氧化剂的反应是( )(A) [Ag(NH3)2]Cl + KI = AgI↓+ KCl + 2NH3(B) 2[Ag(NH3)2]OH + CH3CHO = CH3COOH + 2Ag↓+ 4NH3 + H2O(C) [Cu(NH3)4]2+ + S2-= CuS↓+ 4NH3(D) 3[Fe(CN)6]4-+ 4Fe3+ = Fe4[Fe(CN)6]312. [Ni(CN)4]2-是平面四方形构型,中心离子的杂化轨道类型和d电子数分别是( )(A) sp2,d7(B) sp3,d8 (C) d2sp3,d6(D) dsp2,d813.下列原子中半径最大的是( )(A) Ba (B) Ca (C) As (D) At14.IA族的金属(除锂外)与过量水反应的产物,最好的表示是( )(A) MOH和H2(B) M+(aq),OH-(aq)和H2(C) MOH和H2O (D) M2O和H215.下列各组化合物热稳定性关系正确的是( )(A) Na2CO3 > Na2SO4(B) K2CO3 > Ag2CO3(C) NaHCO3 > Na2CO3(D) (NH4)2CO3 > ZnCO316.常温下和N2能直接起反应的金属是( )(A) Na (B) K (C) Be (D) Li17.ICl2-离子的几何形状为直线型,其中心原子I 的杂化态为( )(A) sp (B) sp2(C) sp3(D) sp3d18.向含I-的溶液中通入Cl2,其产物可能是( )(A) I2和Cl-(B) IO3-和Cl-(C) ICl2-(D) 以上产物均可能19.干燥H2S气体,通常选用的干燥剂是( )(A) 浓H2SO4(B) NaOH (C) P2O5(D) NaNO320.下列化合物中同时具有离子键和共价键的是( )(A) ClF (B) NaCl (C) NaCN (D) H2SO421.ⅣA族元素从Ge到Pb,下列性质随原子序数的增大而增加的是( )(A) +2氧化态的稳定性(B) 二氧化物的酸性(C) 单质的熔点(D) 氢化物的稳定性22.能共存于酸性溶液中的一组离子是( )(A) K+,I-,SO42-,MnO4-(B) Na+,Zn2+,SO42-,NO3-(C) Ag+,AsO43-,S2-,SO32-(D) K+,S2-,SO42-,Cr2O72-23. 当0.075 mol·dm-3的FeCl2溶液通H2S气体至饱和(浓度为0.10 mol·dm-3),若控制FeS 不沉淀析出,溶液的pH值应是()(K sp(FeS) = 1.1 ⨯ 10-19,H2S:K a1 = 9.1 ⨯ 10-8,K a2 = 1.1 ⨯ 10-12)(A) pH≤0.10 (B) pH≥0.10 (C) pH≤8.7 ⨯ 10-2(D) pH≤1.06二、填空题1.在含有AgCl固体的饱和溶液中加入盐酸,则AgCl的溶解度;如加入氨水,则其溶解度;若加入KNO3,则其溶解度。
无机化学练习题(含答案)

无机化学练习题(含答案)第1章原子结构与元素周期系1-1试讨论,为什么有的元素的相对原子质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-2Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
1-3氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?1-4周期系中哪一个元素的电负性最大?哪一个元素的电负性最小?周期系从左到右和从上到下元素的电负性变化呈现什么规律?为什么?1-5什么叫惰性电子对效应?它对元素的性质有何影响?1-6当氢原子的一个电子从第二能级层跃迁至第一能级层时发射出光子的波长是121.6nm;当电子从第三能级层跃迁至第二能级层时,发射出光子的波长是656.3nm。
问哪一个光子的能量大?1-7有A,B,C,D四种元素。
其中A为第四周期元素,与D可形成1:1和1:2原子比的化合物。
B为第四周期d区元素,最高氧化数为7。
C和B是同周期元素,具有相同的最高氧化数。
D为所有元素中电负性第二大元素。
给出四种元素的元素符号,并按电负性由大到小排列之。
1-8有A,B,C,D,E,F元素,试按下列条件推断各元素在周期表中的位置、元素符号,给出各元系的价电子构型。
(1)A,B,C为同一周期活泼金属元素,原子半径满足A>B>C,已知C有3个电子层。
(2)D,E为非金属元素,与氢结合生成HD和HE。
室温下D的单质为液体,E的单质为固体。
(3)F为金属元素,它有4个电子层并且有6个单电子。
第2章分子结构2-1键可由-、-p和p-p原子轨道“头碰头”重叠构建而成,试讨论LiH(气态分子)、HCl、Cl2分子里的键分别属于哪一种?2-2NF3和NH3的偶极矩相差很大,试从它们的组成和结构的差异分析原因。
2-3一氧化碳分子与酮的羰基(>C=O)相比,键能较小,键长较小,偶极矩则小得多,且方向相反,试从结构角度作出解释。
《无机化学》习题及解答(思考题)

《无机化学》习题及解答第一章物质极其变化思考题1.下列说法是否正确:⑴某物质经分析后,只含一种元素,此物质一定是单质。
⑵某物质经分析,含五种元素,此物质有可能是纯净物。
⑶某物质的组成分子经分析,含有相同种类元素,且百分组成也相同,可确定该物质为纯净物。
⑷某物质只含一种元素,但原子量不同,该物质是混合物。
1.⑴不一定。
有些同素异形体的混合物,如白磷与红磷或黑磷的混合物,氧气和臭氧的混合物,元素确实只有一种,但物质(分子)不只一种,是混合物,不是单质。
⑵正确,一种分子可以含多种元素,如(NH4)2Fe(SO4)2,虽含多种元素,但分子只有一种,是纯净物。
⑶不正确。
对于单质的同素异形体,就不是单质。
对于同分异构体,虽分子式相同,但结构不同,性质也不同,不是纯净物。
2.某气态单质的分子量为M,含气体的分子个数为x,某元素的原子量为A,在其单质中所含原子总数为y,N A为阿佛加德罗常数,则M/N A用克为单位表示的是这种气体的质量数值;用x/N A表示这种气态单质的摩尔数;y/N A是表示这种单质中A原子的摩尔数;A/N A 用克为单位表示这种元素的A原子的质量数值。
3.下列说法是否正确:⑴分子是保持物质性质的最小微粒。
⑵36.5克氯化氢含阿佛加德罗常数个分子,气体的体积约为22.4L。
⑶1体积98%浓硫酸与1体积水混合,所得溶液的浓度为49%。
⑷2克硫与2克氧气反应后,生成4克二氧化硫。
3.⑴正确。
⑵不正确。
36.5克氯化氢确实含阿佛加德罗常数个分子,但气体的体积与温度和压力有关,只有在标准态,即0℃,1个大气压时的体积约为22.4L。
⑶不正确。
98%浓硫酸与水的密度不同,由于浓硫酸密度大,混合后,所得溶液的浓度为远大于49%。
⑷不正确。
化学反应严格按化学反应方程式上的量进行反应,不是简单的按投入量反应。
4.下列有关气体的说法是否正确:⑴同温同压下不同气体物质的量之比等于它们的体积比。
⑵同温同压下,相同质量的不同气体体积相同。
无机化学练习题

无机化学练习题一、选择题A. FeB. CuC. AlD. Cr2. 下列哪个化合物是酸性氧化物?A. COB. SO2C. Na2OD. CaOA. 碳酸钙分解B. 氢气燃烧C. 氮气与氧气一氧化氮D. 氯化钠溶解4. 下列哪个元素的最高价氧化物对应的水化物具有碱性?A. NB. PC. SD. Cl二、填空题1. 无机化学研究的对象主要包括______、______、______等。
2. 在周期表中,金属元素主要集中在______区,非金属元素主要集中在______区。
3. 化合物KMnO4中,Mn的氧化态为______。
4. 氢氧化钠溶液与硫酸反应______和______。
三、判断题1. 所有金属元素都具有还原性。
()2. 同一主族元素,自上而下原子半径逐渐增大。
()3. 酸性氧化物与水反应一定酸。
()4. 氯化铵是一种强酸弱碱盐。
()四、简答题1. 请简要说明原子核外电子排布的规律。
2. 什么是同位素?请举例说明。
3. 简述氧化还原反应的基本概念。
4. 如何区分硫酸盐和碳酸盐?五、计算题1. 计算下列化合物中各元素的氧化态:(1)H2SO4(2)K2Cr2O7(3)Na2CO32. 有一溶液中含有Fe2+和Fe3+,它们的浓度分别为0.1mol/L和0.2mol/L。
加入适量KMnO4溶液后,恰好将Fe2+氧化为Fe3+,求反应消耗的KMnO4的物质的量。
3. 现有20g NaOH固体,溶解在水中配成1L溶液,求该溶液的物质的量浓度。
4. 有一反应:2A + B → 3C,已知A的初始浓度为2mol/L,B的初始浓度为3mol/L。
反应进行到平衡时,A的浓度降为1mol/L。
求平衡时B和C的浓度。
六、命名题(1)NaCl(2)CuSO4·5H2O(3)Fe2(SO4)3(4)K3[Fe(CN)6](1)硫化氢(2)五水硫酸铜(3)一氧化氮(4)氢氧化铝七、配平题(1)KClO3 → KCl + O2(2)MnO2 + HCl → MnCl2 + Cl2 + H2O(3)Cr2O7^2 + H^+ + I^ → Cr^3+ + I2 + H2O(1)MnO4^ + H^+ + Fe^2+ → Mn^2+ + Fe^3+ + H2O(2)Cr2O7^2 + H^+ + I^ → Cr^3+ + I2 + H2O八、实验题1. 设计一个实验方案,用化学方法检验溶液中是否含有Fe^2+。
无机化学练习题(附答案)
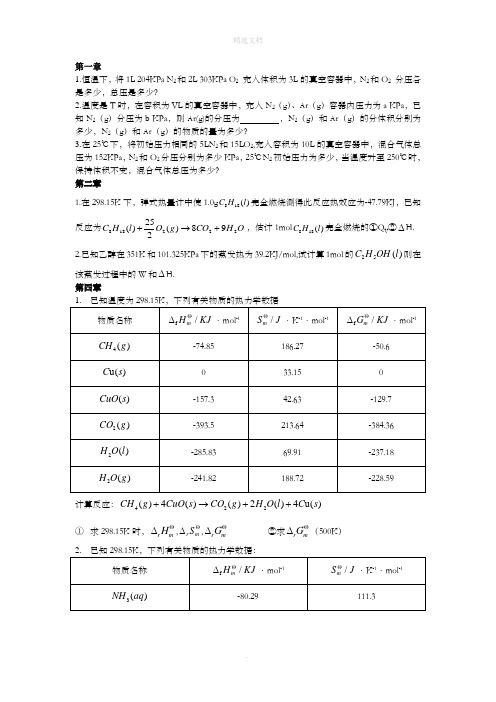
第一章1.恒温下,将1L 204KPa N 2和2L 303KPa O 2 充入体积为3L 的真空容器中,N 2和O 2 分压各是多少,总压是多少?2.温度是T 时,在容积为VL 的真空容器中,充入N 2(g )、Ar (g )容器内压力为a KPa ,已知N 2(g )分压为b KPa ,则Ar(g)的分压为 ,N 2(g )和Ar (g )的分体积分别为多少,N 2(g )和Ar (g )的物质的量为多少?3.在25℃下,将初始压力相同的5LN 2和15LO 2,充入容积为10L 的真空容器中,混合气体总压为152KPa ,N 2和O 2分压分别为多少KPa ,25℃N 2初始压力为多少,当温度升至250℃时,保持体积不变,混合气体总压为多少? 第二章1.在298.15K 下,弹式热量计中使1.0g )(188l H C 完全燃烧测得此反应热效应为-47.79KJ ,已知反应为O H CO g O l H C 22218898)(225)(+→+,估计1mol )(188l H C 完全燃烧的①Q V ②∆H. 2.已知乙醇在351K 和101.325KPa 下的蒸发热为39.2KJ/mol,试计算1mol 的)(52l OH H C 则在该蒸发过程中的W 和∆H. 第四章计算反应:422()4()()2()4u()CH g CuO s CO g H O l C s +→++① 求298.15K 时,r m H Θ∆,r m S Θ∆,r m G Θ∆ ②求r m G Θ∆(500K )2. 已知298.15K ,下列有关物质的热力学数据:用热力学原理计算反应324()H ()NH ()OH ()NH aq O l aq aq +-+→+在298.15K 和373.15K时的K Θ。
3.欲使32()()()CaCO s CaO s CO g →+在101.3KPa 下正向进行,①反应的最低温度应是多少?②计算在298.15K ,101.3Kpa 在密闭容器中CaCO 3分解所产生的平衡分压,已知298.15K时,11160r m S J K mol Θ--∆=⋅⋅12()394.4f m G CO KJ molΘ-∆=-⋅,13()1128.8f m G CaCO KJ mol Θ-∆=-⋅,1()604f m G CaO KJ mol Θ-∆=-⋅4.估算反应222()()()()CO g H g CO g H O g +→+在873K 时的标准摩尔Gibbs 函数变和标准平衡常数,若系统中各组分气体的分压分别为2()p CO =2()p H =127KPa ,()p CO =2()p H O =76KPa ,计算此条件下反应的Gibbs 函数变并判断反应进行的方向,已知298.15K ,5. 已知921()()2() 1.310 C s CO g CO g K θ+→=⨯2222()()() 6.010CO g Cl g COCl g K θ+→=⨯计算2222()()()+2()COCl g C s CO g Cl g →+的3K θ第五章1.PH=8和PH=10的溶液等体积混合,计算混合后的溶液PH 。
无机化学试题

无机化学试题无机化学试题如下:1. 请解释以下无机化合物的成键类型:(a) NaCl, (b) CO2, (c)H2O, (d) NH3。
参考答案:(a) NaCl是离子化合物,由Na+离子和Cl-离子通过电子转移而形成。
(b) CO2是共价分子化合物,由一对碳氧双键和两对碳氧单键连接而成。
(c) H2O是共价分子化合物,由一对氧氢共价键和两对氧氢单键连接而成。
(d) NH3是共价分子化合物,由一对氮氢三键和三对氮氢单键连接而成。
2. 解释以下化合物的颜色或发光原因:(a) CuSO4·5H2O, (b) KMnO4, (c) CdSe, (d) SrCl2.参考答案:(a) CuSO4·5H2O是一种蓝色的化合物。
这是因为其中Cu2+离子吸收了400-500 nm波长的光,使得其他波长的光被反射,从而显示为蓝色。
(b) KMnO4呈现紫色。
这是因为其中Mn(VII)离子吸收了在500-600 nm波长范围内的可见光,进而显示为紫色。
(c) CdSe是一种半导体材料,可通过控制Cd和Se的摩尔比例来调节其发光颜色。
CdSe发射的颜色属于半导体材料的发射,其颜色会因材料大小和组成而变化。
(d) SrCl2在无水条件下呈现红色,含水条件下呈现无色。
这是因为无水的SrCl2中的Sr2+离子吸收了589 nm黄色光,从而显示为红色。
3. 请解释以下化合物的溶解性:(a) AgCl, (b) PbSO4, (c)Na2CO3, (d) Ca(OH)2.参考答案:(a) AgCl的溶解度很低。
这是因为AgCl是一种很稳定的沉淀物,几乎不溶于水。
这是由于Ag+和Cl-离子之间的强离子键造成的。
(b) PbSO4的溶解度也很低。
这是因为PbSO4是一种不溶于水的盐,其溶解度受到了溶剂中晶格能和溶质-溶剂相互作用力之间的影响。
(c) Na2CO3的溶解度较高。
这是因为Na2CO3是一种可溶于水的盐,其分子中的Na+离子可与水分子形成水合离子,从而促进其溶解度。
无机化学练习题

无机化学练习题一、选择题(每题2分,共20分)1. 以下哪个元素的原子序数是11?A. 钠B. 镁C. 铝D. 硅2. 根据周期表,哪个元素属于第VIII族?A. 铁B. 钴C. 镍D. 铜3. 原子半径最大的元素是:A. 氢B. 氦C. 氖D. 氩4. 以下哪个化合物是共价化合物?A. NaClB. MgOC. HClD. CaF25. 根据离子键理论,以下哪个离子的离子半径最大?A. Li⁺C. K⁺D. Rb⁺6. 以下哪个反应是酸碱中和反应?A. 2H₂ + O₂ → 2H₂OB. HCl + NaOH → NaCl + H₂OC. 2H₂S + 3O₂ → 2H₂O + 2SO₂D. 2Al + 6HCl → 2AlCl₃ + 3H₂7. 以下哪个是氧化还原反应?A. NaCl + AgNO₃ → AgCl↓ + NaNO₃B. 2H₂O₂ → 2H₂O + O₂↑C. CaCO₃ → CaO + CO₂↑D. 2NaOH + H₂SO₄ → Na₂SO₄ + 2H₂O8. 以下哪个元素的电子排布是1s²2s²2p⁶3s²3p⁶4s²?A. 碳B. 氧C. 镁D. 钙9. 以下哪个是金属元素?A. 碳B. 氧C. 镁D. 硫10. 以下哪个是金属晶体?A. 石墨B. 金刚石D. 冰二、填空题(每空2分,共20分)11. 元素周期表中,周期数等于元素原子的______电子层数。
12. 元素周期表中,族数等于元素原子的最外层______电子数。
13. 根据鲍林规则,氢原子的半径大约是______埃。
14. 氧化还原反应中,失去电子的物质被称为______,获得电子的物质被称为______。
15. 根据路易斯理论,共价键是由______电子对形成的。
16. 金属晶体中的原子排列方式通常为______晶格。
17. 离子晶体中,离子键的形成是由于______力的作用。
无机化学习题集

第一章绪论一、A型选择题1.“原子学说”的创立人是A.道尔顿B.拉瓦锡C.波意尔D.门捷列夫E.牛顿2.元素周期律的提出是化学发展史上的一个里和碑,提出元素周期律的科学家是A.卢瑟福B.波意尔C.门捷列夫D.道尔顿E.波尔3.20世纪30年代初,建立在量子力学基础上的现代原子结构模型及化学键理论,揭示了()的本质A.原子核结构B.原子结构C.分子结构D.晶体结构E.物质结构4.下列不属于无机化合物的是A.CO2 B.CH4C.CS2D.CaC2E.H2CO35.下列不是人体必须元素的是A.铜B.锰C.银D.氟E.砷6.下列元素中不属于人体必须的常量元素的是A.碳B.硫C.氯D.铁E.镁7.含有金属钴元素的维生素是A.维生素CB.维生素EC.维生素B1D.维生素B6E.维生素B128.地方性“克汀病”是因为缺乏()元素所致A.碘B.锌C.硒D.铁E.氟9.长期锌缺乏会导致A.侏儒症B.克山病C.克汀病D.水俣病E.黑皮病10.现代研究表明,某些无机药物对人体的某些疾病显示了强大的活力,其中具有抗癌作用的是A.铁配合物B.铂配合物C.金配合物D.铜配合物E.钴配合物二、填空题1.依据化学发展的特征,可分为、和三个阶段。
2.人们把维持生命所必须的元素称为生命必须元素,大多数科学家认为,生命必须元素有种。
占生物体总质量以上的称为元素;占生物体总质量以下的称为元素。
3.无机化学是研究无机物质的、、和的学科。
4.无机化学课程内容主要包括、、、和等几个方面。
三、思考题1.简述无机化学和中药发展的关系。
2.根据自已的实际情况谈谈你打算怎样学好无机化学?(冯务群)第二章 溶 液一、选择题 A 型题 1.牛奶属于A. 悬浊液B. 乳浊液C. 胶体D. 真溶液E. 高分子溶液 2.下面用半透膜隔开的几组溶液,在相同温度下渗透方向从右向左进行的是 A. 50g·L -1蔗糖溶液‖50g·L -1葡萄糖溶液 B. 9g·L -1NaCl 溶液‖0.278mmol·L -1葡萄糖溶液 C. 50g·L -1葡萄糖‖9g·L -1NaCl 溶液D. 0.05mol·kg -1MgCl 2溶液‖0.05mol·kg -1MgSO 4溶液 E. 5g·L -1葡萄糖‖10g·L -1NaCl 溶液3.影响难挥发性非电解质稀溶液的蒸气压、沸点、凝固点和渗透压的因素是 A. 溶液的体积 B. 溶液的温度 C. 溶质的质量 D. 溶质的性质 E. 单位体积溶液中溶质质点数4.在25g 水中溶解1.4g 某非电解质,测得此溶液的凝固点降低值为0.579K ,水的K f = 1.86K·kg·mol -1,该电解质的相对分子质量为A. 180 g·mol -1B. 60 g·mol -1C. 180D. 60gE. 80mol 5.要使相同温度下的两种稀溶液不产生渗透,必须使两种溶液 A. 物质的量浓度相等 B. 质量浓度相等 C. 摩尔分数相等 D. 质量摩尔浓度相等 E. 渗透浓度相等6.50ml NaCl 溶液中含有23mgNa +,该溶液中Na +的物质的量浓度为 A. 0.46g·L -1 B. 20mmol·L -1 C. 23g·L -1 D. 0.92g·L -1 E. 46g·L -17.配制0.1mol·L -1硫酸铜溶液200ml ,需要硫酸铜晶体 A. 2.5g B. 3.2g C. 5g D. 1.6g E. 10g 8.可使红细胞发生皱缩现象的溶液是A. 50g·L -1 C 6H 12O 6溶液B. 308 mmol·L -1 NaCl 溶液C.61mol·L -1NaC 3H 5O 3溶液 D. 12.5g·L -1NaHCO 3溶液E. 9g·L -1 NaCl 溶液9.不能使红细胞保持原来状态的溶液是A. 100ml 生理盐水加100ml50.0g·L -1葡萄糖溶液B. 12.5g·L -1NaHCO 3溶液C. 500ml 含有4.5gNaCl 的溶液D. 10g·L -1乳酸钠(NaC 3H 5O 3)溶液E. 0.154 mol·L -1 NaCl 溶液10.配制萘的稀苯溶液,利用凝固点降低法测定萘的摩尔质量,在凝固点时析出的物质是A. 苯B. 萘C. 水D. 苯和萘E. 苯和水 11.表示质量浓度的符号是A. mB. m BC. ρD. B ρE. s m 12.下列不属于SI 单位制的单位符号是A. mB. LC. kgD. KE. s13.某防冻液,含乙二醇2250g ,含水2000g ,乙二醇和水的摩尔分数分别为 A. 1.125、1 B. 0.529、0.471 C. 36.3、111 D. 2.125、2 E. 0.246、0.75414.0.0364g 未知物样品溶解在 4.270g 苯(C 6H 6)中,质量摩尔浓度是0.0698mol·kg -1。
无机化学练习题(答案整理版)

1、气体的标准状况与物质的标准态是同一含义。
【1】答:(错)2、在一定温度下,随着可逆反应2SO2(g)+O2(g)2SO3(g)的进行,p(O2)、p(SO2)不断减少,p(SO3)不断增大,所以标准平衡常数K不断增大。
【2】答:(错)3、在0.10mol·L-1Na2CO3溶液中,c(Na+)≈2c(CO32-)。
【3】答:(对)4、当溶液的pH值为4时,Fe3+能被沉淀完全。
【4】答:(对)5、配合物形成体的配位数是指直接和中心原子或(离子)相连的配体总数。
【5】答:(错)6、NaH2PO4、Na2HPO4、Na3PO4三种溶液均呈碱性。
【6】答:(错)7、由于Sb3+易水解,稀释SbCl3溶液时,产生Sb(OH)3沉淀。
【7】答:(错)8、因为H2PO4-发生水解,所以NaH2PO4水溶液显碱性。
【8】答:(错)9、0.10mol·L-1的某一有机弱酸的钠盐溶液,其pH=10.0,该弱酸盐的水解度为0.10%。
【9】答:(对)10、将0.10mol·L-1CaCl2溶液与等体积0.20mol·L-1HF溶液混合,生成CaF2沉淀,此时溶液中c(Ca2+)为c1。
如将0.10mol·L-1CaCl2溶液与等体积0.80mol·L-1HF溶液混合,生成CaF2沉淀后溶液的c(Ca2+)为c2,则c1>c2。
【10】答:(对)11、MnS(s)+2HAc Mn2++2Ac-+H2S反应的标准平衡常数K=K(MnS)·[K(HAc)]2/[K(H2S)·K(H2S)]。
【11】答:(对)12、ds区元素的原子价层电子构型均为(n-1)d10ns1-2,都是金属元素。
【12】答:(对)13、在多电子原子中,核外电子的能级只与主量子数n有关,n越大,能级越高。
【13】答:(错)14、任何两个原子的s原子轨道,都可组成两个分子轨道σs和σs*。
无机化学考试题

无机化学考试题1. 请简要介绍无机化学的定义和相关内容。
无机化学是研究无机物质结构、性质和反应的化学分支领域。
它主要包括元素、金属及非金属化合物的化学性质、反应机理以及其在实际应用中的重要性等内容。
2. 解释以下两个概念:原子序数和周期表元素。
原子序数是指元素的周期表中的序数,代表了元素原子核中质子的数量。
周期表元素则是指根据原子序数排列的一系列元素,其中元素的性质具有一定规律性。
3. 论述氢气和氧气的物理性质以及在化学反应中的作用。
氢气是一种无色、无味且易燃的气体,常用于氢气灯中。
氧气是无色、无味且无臭的气体,可维持生物生存。
在化学反应中,氢气和氧气可反应生成水,是人类生活中不可或缺的重要物质。
4. 解释盐酸和硫酸的化学特性及在实验室中的应用。
盐酸是一种强酸,具有腐蚀性,可与碱反应生成盐和水。
硫酸也是一种强酸,熔点较高,可用于制备其他化合物。
在实验室中,盐酸和硫酸常用于酸碱中和实验以及调节反应条件。
5. 介绍铁元素及其氧化物在化学反应中的重要性。
铁是一种常见的金属元素,具有较高的生产和应用价值。
其氧化物在化学反应中起着重要的催化作用,如铁氧化物可用于吸附有机物质及氧化反应中。
6. 论述主族元素和过渡金属元素的区别及各自在自然界中的存在形式。
主族元素是周期表中主要在A族的元素,具有相对较低的原子序数,如碳、氧、氮等。
过渡金属元素是指在周期表中B族元素,具有不规则的外电子排布,如铁、铜、钴等。
主族元素在自然界中以化合物形式存在,而过渡金属元素主要以单质形式存在。
7. 结合实例分析浓硝酸和浓硫酸的性质及其在化学实验中的应用。
浓硝酸是一种无色液体,具有强腐蚀性和氧化性,常用于制备氧化物及硝酸盐。
浓硫酸是一种重要的工业品,也具有强酸性,可用于制备硫酸盐和其他有机物。
8. 解释主价态和其他价态元素的概念,以及它们在配位化合物中的作用。
主价态元素是指元素化合物中元素的通用的化合价,如铁的主价态为+2和+3。
无机化学练习题

无机化学练习题练习一:1. 在无机化学中,离子是指带有电荷的原子或原子团。
离子可根据其电荷分为阳离子和阴离子。
请列举出以下离子的名称和化学式:a) 氧离子b) 铵离子c) 氯离子d) 氢离子e) 碳离子2. 给定以下化学式,请判断其为无机离子还是有机化合物:a) NH4Clb) C6H12O6c) NaCld) CH4e) H2SO43. 下列化合物中,哪些是离子化合物?哪些是共价化合物?a) NaClb) CO2c) MgOd) N2O4e) H2O练习二:1. 请根据以下化学方程式进行配平:a) Fe2O3 + CO → Fe + CO2b) Li + H2O → LiOH + H2c) Al + Br2 → AlBr32. 写出下列化学方程式中未标注的反应物或产物:a) BaCl2 + Na2SO4 → ?b) Fe + H2SO4 → FeSO4 + ?c) AgNO3 + NaCl → AgCl + ?练习三:1. 对于以下离子,写出其电子构型:a) Fe2+b) Cl-c) Al3+d) O2-e) Cu+2. 下列化合物中,哪些是氧化剂?哪些是还原剂?a) H2O2b) KMnO4c) NaCld) HCle) K2Cr2O73. 给定以下化学方程式,请写出氧化还原反应的氧化剂和还原剂:Zn + 2HCl → ZnCl2 + H2练习四:1. 下列哪些元素在自然界中以单质的形式存在?a) Nab) Fc) Cld) Ne) S2. 请写出以下化合物的化学式:a) 二氧化硫b) 氯化铁(III)c) 硝酸铵d) 氯化铵e) 硫酸镁3. 对于以下化合物,请判断其是酸、碱,还是中性物质:a) HClb) NaOHc) H2Od) NH3e) CaCO3练习五:1. 给定以下化学方程式,请写出反应类型:a) 2Al + 3CuSO4 → Al2(SO4)3 + 3Cub) NaCl + AgNO3 → AgCl + NaNO3c) CaCO3 → CaO + CO2d) C6H12O6 + 6O2 → 6CO2 + 6H2Oe) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl2. 对于以下氧化还原反应,请写出氧化剂和还原剂:Cu + 2AgNO3 → Cu(NO3)2 + 2Ag3. 下列哪种化学反应是放热反应?哪种是吸热反应?a) HCl + NaOH → NaCl + H2Ob) NH4NO3 → N2O + 2H2Oc) 2Na + Cl2 → 2NaCl以上为无机化学的练习题,希望能够帮助您巩固和加深对无机化学的理解。
无机化学习题

无机化学作业第一章溶液一、选择题1-1、将难挥发的非电解质溶于溶剂后,将会引起( D )A 沸点下降B 凝固点升高C 渗透压下降D 蒸气压下降1-2、比溶剂更容易挥发的溶质溶于溶剂之后可能会引起( C )A 沸点上升B 凝固点降低C 蒸气压上升D 渗透压下降二、填空题1-3、难挥发非电解质稀溶液的通性又称为稀溶液的依数性,它包括蒸汽压下降;沸点升高;凝固点下降;渗透压。
1-4、拉乌尔(F·M·Raoult)于1887年得出如下结论:在一定温度下,难挥发非电解质烯溶液的蒸气压下降与溶质的物质的量分数成正比。
1-5、在纯水、以及浓度均为0.1mol/kg的KCl、K2SO4、蔗糖(C12H22O11)、NaAc 溶液中,沸点最高的是K2SO4 ,沸点最低的是纯水。
1-6、比较下列溶液渗透压的大小:1.0% 的C12H22O11 < 1.0% 的C3H6O30.1mol/kg C2H5OH = 0.1 mol/kg C12H22O11 < 0.1 mol/kg HCl1-7、难挥发非电解质稀溶液的依数性表现为蒸气压下降,沸点上升,凝固点下降和渗透压。
其中蒸气下降的数学表达式为△P = △PBθXA ,沸点上升的数学表达式为△Tb =Kbb 。
0.1mol/kg 乙醇水溶液(Kf=1.86)的凝固点下降为--0.186 。
300K,0.1mol/L 葡萄糖水溶液的渗透压约为249.42 kPa。
1-8、一定温度下、100kPa的大气中,水的饱和蒸气压为3.0kPa。
实际测出某处水蒸气的分压为2.0kPa,则该处的相对湿度是0.67 ,水蒸气的压力分数为0.02 ,H2O的物质的量分数为2% 。
三、计算题1-9、计算98%浓硫酸(M=98.07)(d=1.84)的c。
解:c= n/V = 14 x 184g/cm3 x 98%/(14 x 98.07g/mol x 10-3)= 18.4 mol/L1-10、计算38.0%盐酸(M=36.46)溶液的b。
2023无机化学课堂练习及答案

2023无机化学课堂练习及答案1. 实验室常用的无机化学试剂有哪些?请列举并简要介绍它们的用途。
- 盐酸(HCl):用于调节酸碱度、催化剂和溶剂。
- 硫酸(H2SO4):用于酸化反应、脱水剂和溶剂。
- 硝酸(HNO3):用于氧化反应、脱水剂和溶剂。
- 碳酸钠(Na2CO3):用于酸性物质的中和、沉淀物的沉淀剂。
- 硝酸银(AgNO3):用于检测氯离子的存在、沉淀反应。
- 硫化氢(H2S):用于检测金属离子的存在、沉淀反应。
- 碘酸钠(NaIO3):用于氧化还原反应、指示剂。
- 氢氧化钠(NaOH):用于中和反应、溶剂和沉淀剂。
- 氯化铵(NH4Cl):用于生成氯离子、缓冲剂和溶剂。
- 硝酸铵(NH4NO3):用于生成氨气、氧化反应和溶剂。
2. 简要描述以下无机化合物的结构特点及应用:- 二氧化碳(CO2)CO2是由一个碳原子和两个氧原子组成的无机化合物,分子式为CO2。
它是一种无色、无臭的气体,在常温下处于气态。
CO2的结构特点是线性分子结构,碳原子与两个氧原子之间有双键。
CO2的应用广泛,它是植物进行光合作用的原料之一,也是工业中常用的溶剂和制冷剂。
- 氯化钠(NaCl)NaCl是由一个钠离子和一个氯离子组成的无机化合物,是我们常说的食盐。
它是一种无色、无味的结晶体,在常温下为固态。
氯化钠的结构特点是离子晶体结构,钠离子和氯离子通过电静力相互吸引形成晶体。
氯化钠是一种重要的食品调味剂,并且在医药和化工领域有着广泛的应用。
- 二氧化硫(SO2)SO2是由一个硫原子和两个氧原子组成的无机化合物,分子式为SO2。
它是一种无色、有刺激性气味的气体,在常温下处于气态。
二氧化硫的结构特点是斜线性分子结构,硫原子与两个氧原子之间有双键。
二氧化硫是一种重要的工业原料,在制造硫酸和其他化学物质方面有着广泛的应用。
- 硝酸铜(Cu(NO3)2)Cu(NO3)2是由一个铜离子和两个硝酸根离子组成的无机化合物,是一种蓝色结晶体。
无机化学习题

第一章原子结构一、填空题1、根据现代原子结构理论,核外电子的运动状态可用波函数来描述,它在习惯上被称为原子轨道;︱ψ︱2形象化表示是电子云。
2、某一多电子原子,在其第三电子层的亚层数是 3 表示符号分别是3s 3p 3d ,该电子层一共有9 个轨道。
3、4p亚层中轨道的主量子数为 4 ,角量子数为 1 ,该亚层的轨道最多可以有 3 种空间取向,最多可容纳 6 个电子。
4、5d亚层中轨道的主量子数为 5 ,角量子数为 2 ,该亚层的轨道最多可以有 5 种空间取向,最多可容纳10 个电子。
5、原子轨道的能量是由主量子数和角量子数决定的。
6、基态原子中核外电子的三个基本原理是:能量最低原理泡利不相容原理、和洪特规则。
7、原子轨道近似能级图是按照能量由低到高的顺序排列,并将能量相近的能级划归一组,称为能级组。
相邻能级组之间能量相差比较大。
每个能级组(除第一能级组)都是从S 能级开始,于P 能级终止。
能级组数= 核外电子层数,即周期表的周期数。
能级组的划分与周期表周期的划分一致。
8、氧原子的原子序数是8,它的最外层电子的排布式是。
它位于元素周期表的第周期,第族。
9、己知某元素的原子序数在氪前,当此元素的原子失去两个电子后,l=2的轨道内电子恰好为半充满。
则该元素原子序数为,在元素周期中的周期为,族为。
10、42号元素Mo的电子构型为;其最外层电子的四个量子数为5,0,0,+1/2或者—1/2 ;价层d轨道的符号为 4 d 。
二、单选题1、在多电子原子中,具有下列各组量子数的电子中能量最高的是( A )。
(A)3,2,+1,+1/2 (B)2,1,+1,-1/2(C)3,1,0,-1/2 (D)3,1,+1,-1/22、关于原子轨道的下述观点,正确的是 B(A)原子轨道是电子运动的轨道;(B)某一原子轨道是电子的一种空间运动状态,即波函数(C)原子轨道表示电子在空间各点出现的概率;(D)原子轨道表示电子在空间各点出现的概率密度。
无机化学习题

⽆机化学习题第⼆章酸碱反应1、根据酸碱的质⼦理论,确定下列物质哪些是酸,那些是碱,哪些是两性物质?并写出酸的共轭碱或碱的共轭酸。
23343(1);(2);(3);(4)--SO H AsO HCO HCN2、已知10.10mol L HAc - 溶液的311.3310H mol L +--??=,求该溶液的pH 。
3、计算下列溶液中的[],[],H OH pOH +-。
(1)柠檬汁的 3.40pH =;41111[] 3.9810;[] 2.510;10.60+-----=?=?= H mol L OH mol L pOH(2)某海域海⽔中的8.70pH =。
9161[]210;[]510; 5.3+-----=?=?= H mol L OH mol L pOH4、计算下列溶液的pH 值。
(1)140.20mol L HClO - 溶液;(2)712.010mol L NaOH --? 溶液;(3)10.010mol L NaAc - 溶液,已知HAc 的51.810Ka -=?;(4)6145.010mol L NH Cl --? 溶液,已知3NH 的51.810b K -=?;(5)120.010mol L H S - 溶液,已知715121.310,7.110a a K K --=?=?;(6)140.10mol L NH CN - 溶液,已知3NH 的51.810b K -=?,HCN 的106.210a K -=?;5、根据下列酸、碱的解离常数,选取合适的酸及其共轭碱或合适的碱及其共轭酸来配制 4.59.5==pH pH 和的缓冲溶液.22 3.74H CO pKa =的,HAc 的 4.74pKa =,HF 的 3.18pKa =,3NH 的 4.74b pK =,2NH OH 的8.04b pK =,23210.25a H CO pK =的6、配制1000ml 5.0pH =的缓冲溶液,如果溶液中HAc 的浓度为10.2mol L - ,需要11mol L - 的HAc 溶液和11mol L - 的NaAc 溶液各多少升?(已知HAc 的4.74pKa = ) (()200;()360==V HAc ml V NaAc ml )参考答案1、解:根据酸碱质⼦理论,凡是能给出质⼦的就是酸,接受质⼦的物质就是碱,既能给出质⼦⼜能接受质⼦的物质是两性物质,可知:酸:343(2);(3);(4)-H AsO HCO HCN碱:233(1);(3);--SO HCO两性物质:3(3);-HCO2324323(1);(2);(3)/;(4)----HSO H AsO CO H CO CN2、解:log[]pH H +=-故,3log3.310 2.88pH -=-?=3、解:(1) 3.4141[]10 3.9810H mol L mol L +----==?14111410[] 2.510[] 3.98101410.60w K OH mol L H pOH pH ----+-===??=-=(2)8.7191[]10210H mol L mol L +----==?1461910[] 5.010[]21014 5.3w K OH mol L H pOH pH ----+-===??=-=4、解:(1)直接采⽤定义式进⾏计算lg0.200.7pH =-=;(2)⾸先判断类型,为强酸判断条件7612.01010c mol L ---=?<,故[]OH -=代⼊正确7[] 2.410OH --==?71414lg2.4107.38pH pOH -=-=+?=(3)Ac HAc -是的共轭碱,在⽔中有下列平衡2A c H O H A c OH --++ 故Ac -可以看作是⼀元弱碱的离解平衡处理,(判断类型)Ac -的1410510 5.6101.810b K ---==??,由于125.61020,500b w b c cK K K -=?>>,故可采取最简公式进⾏计算(判断条件)61[] 2.410OH mol L ---===?5.6214.0 5.628.38pOH pH ====-=(代⼊正确)(4)4NH +是3NH 的共轭酸,可按⼀元弱酸的离解平衡处理(判断类型),已知3NH 的51.810b K -=?,则4NH +的105.610a K -=?,因为152.81020,500a w bc cK K K -=?<>,可采⽤下式进⾏计算(判断条件)71[] 1.1106.95H mol L pH +--===?= (代⼊正确)(5)2H S 为⼆元弱酸(判断类型),9121, 1.31020a a a w K K cK K -=?>,1022 3.9100.05a K -=?<71/0.01/1.310500a c K -=?>,故可采⽤最简式进⾏计算(判断条件)5[] 3.61104.44H pH +-===?=(代⼊正确)(6)(判断类型)4NH CN 为弱酸弱碱盐,两性物质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章原子结构和元素周期系一、填空题4.1 在氢原子的激发态中,4s和3d状态的能量高低次序为E4s______________E3d;对于钾原子,能量高低次序为E4s______________E3d;对于钛原子,能量高低次序为E4s______________E3d。
4.2 氢原子的电子能级由量子数______________决定,而锂原子的电子能级由量子数______________决定。
4.3 有两种元素的原子在n=4的电子层上都只有两个电子,在次外层l=2的轨道中电子数分别为0和10。
前一种原子是______________,位于周期表中第______________周期,第______________族,其核外电子排布式为______________;原子序数大的原子是______________,位于周期表中第______________周期,第______________族,其核外电子排布式为______________,该原子的能级最高的原子轨道的量子数为______________。
4.4 镧系元素的价层电子构型为______________,锆与和铪、铌与钽性质相似是由于______________而造成的。
4.5 当n=4时,电子层的最大容量为______________,如果没有能级交错,该层各轨道能级由低到高的顺序应为______________,4f电子实际在第______________周期的______________系元素的______________元素中开始出现。
4.6 第六周期的稀有气体的电子层结构为______________,其原子序数为______________。
4.7 具有ns2np3价电子层结构的元素有______________ ,具有(n-1)d10ns2np6价电子层结构的元素有______________ ,前一类元素又叫______________族元素,后一类元素属于______________。
4.8 每一个原子轨道要用______________个量子数描述,其符号分别是______________,表征电子自旋方式的量子数有______________个,具体值分别是______________。
4.9 如果没有能级交错,第三周期应有______________个元素,实际该周期有______________个元素;同样情况,第六周期应有______________个元素,实际有______________个元素。
4.10 氢原子光谱的能量关系式为ΔE=R H(1/n12-1/n22),R H等于______________,当n1=1,n2=______________时,ΔE=R H,R H也等于氢原子的______________能。
4.11 某过渡元素在氪之前,此元素的原子失去一个电子后的离子在角量子数为2的轨道中电子恰为全充满,该元素为______________,元素符号为______________。
该元素原子的基态核外电子排布式为______________,原子最外层轨道中电子的屏蔽系数σ等于______________,有效核电荷z*______________等于。
二、选择题4.12 所谓原子轨道是指()A. 一定的电子云B. 核外电子的概率C. 一定的波函数D. 某个径向分布函数4.13 下列电子构型中,属于原子激发态的是()A. 1s22s12p1B. 1s22s22p6C. 1s22s22p63s2D. 1s22s22p63s23p64s14.14 周期表中第五、六周期的ⅣB、ⅤB、ⅥB族元素的性质非常相似,这是由于以下哪项导致的()A. s区元素的影响B. p区元素的影响C.d区元素的影响D. 镧系元素的影响4.15 描述Ψ3dZ2的一组量子数是()A. n=2, l=1, m=0B. n=3, l=2, m=0C. n=3, l=1, m=0D. n=3, l=2, m=14.16 下列各组量子数中错误的是()A. n=3, l=2, m=0, m s=+1/2B. n=2, l=2, m=-1, m s=-1/2C. n=4, l=1, m=0, m s=-1/2D. n=3, l=1, m=-1, m s=+1/24.17 下列原子半径大小顺序中正确的是()A. Be<Na<MgB. Be<Mg<NaC. Be<Na<MgD. Na<Be<Mg4.18 下列叙述中错误的是()A. |Ψ|2表示电子的概率密度B. |Ψ|2在空间分布的形象化图像称为电子云C. |Ψ|2值小于相应的|Ψ|值D. |Ψ|2表示电子出现的概率4.19 下列有关电子排布的叙述中正确的是A. 价电子层有ns电子的元素是碱金属元素B. ⅦB族元素的价电子层排布为(n-1)d6ns2C. ⅥB族的所有元素的价电子层排布为(n-1)d4ns2D. 63号元素铕(Eu)和95号元素镅(Am)的价电子层排布为(n-2)f7ns2三、简答题4.20 氮的第一电离能高于同周期左右相邻两个元素的第一电离能,试说明之。
指出在该周期内第一电离能最大的元素和第一电离能最小的元素。
4.21 从原子结构解释,氯与锰虽然属于第Ⅶ族元素,但它们的金属性和非金属性不相似,而最高氧化值却相同。
4.22 原子序数分别为29和35的两元素在周期表中处于何位置(周期和族)?一、填空题5.1 CO32-、NF3、POCl3、BF3的中心原子轨道杂化方式依次为______________,______________,______________,______________。
5.2 SiF4中硅原子的轨道杂化方式为______________,该分子中的键角为______________;SiF62-中硅原子的轨道杂化方式为______________,该离子中的键角为______________。
5.3 分子轨道是由______________线性组合而成的,这种组合必须遵守的三个原则是______________,______________和______________。
5.4 BF3,NH3,H2O,PCl4+的键角由大到小的顺序是______________,中心原子杂化轨道中不含有孤对电子的有______________。
5.5 在C2H4分子中,C与H间形成______________键,C与C之间形成______________键和______________键,碳原子的轨道杂化方式为______________。
5.6 根据分子轨道理论,H2+、He2、B2、C2、He2+、Be2中,能够存在的有______________,不能存在的有______________。
5.7 O2+的分子轨道电子排布式为______________,键级为______________;N2+的分子轨道电子排布式为______________,呈______________磁性。
二、选择题5.8 在PCl3分子中,与氯原子成键的磷原子采用的是()A. p x,p y,p z轨道B. 3个sp2杂化轨道C. 2个sp杂化轨道和1个p轨道D. 3个sp3杂化轨道5.9 根据分子轨道理论,O2的最高占有轨道是()A. π2pB. π2p *C. σ2pD. σ2p*5.10 下列分子中,含有极性键的非极性分子是()A. P4B. BF3C. IClD. PCl35.11 H2S分子的空间构型和中心离子的杂化方式分别为()A. 直线形,sp杂化B. V形,sp2杂化C. 直线形,sp3d杂化D. V形,sp3杂化5.12 下列化合物中,既存在离子键和共价键,又存在配位键的是()A. NH4FB. NaOHC. H2SD. BaCl25.13 下列叙述中错误的是()A. 相同原子间双键的键能等于单键键能的2倍B. 双原子分子的键能等于键解离能C. 多原子分子的原子化能等于各键键能总和D. 键能或键解离能愈大,共价键愈牢固5.14 下列化学键中极性最强的是()A. H-OB. N-HC. H-FD. S-H5.15 下列分子中,键级等于零的是()A. O2B. F2C. N2D. Ne25.16 下列分子或离子中,最稳定的是()A. O2+B. O2C. O2-D. O22-5.17 下列分子或离子中,具有顺磁性的是()A. N2B. F2C. H2D. O2-5.18 下列分子或离子中,没有孤对电子的是()A. H2OB. H2SC. NH4+D. PCl3三、简答题5.19 为什么N2+不如N2稳定,而O2+却比O2稳定?试用分子轨道理论说明之。
5.20 BF3和NF3中,中心原子的氧化值都为+3,为什么两者的空间构型不同?试用杂化轨道理论说明之。
5.21 H2O与H2S分子的空间构型相似,但键角却不同,试解释这种差别。
一、填空题6.1 CO2,SiO2,MgO,Ca的晶体类型分别为______________,______________,______________,______________。
6.2 NaCl的熔点______________于RuCl,CuCl的熔点______________于NaCl,MgO的熔点______________于BaO,MgCl2的熔点______________于NaCl。
6.3 NaCl,MgO,CaO,KCl熔点高低的顺序为______________;MgCl2,CaCl2,SrCl2,BaCl2熔点高低的次序为______________。
6.4 石墨为层状晶体,每一层中每个碳原子采用______________杂化方式以共价键相连,未杂化的______________轨道之间形成______________键,层与层之间靠______________而相互连接在一起。
6.5 PH3、AsH3、SbH3的沸点高低顺序为______________;NH3分子间除了存在分子间力外,还有______________。
6.6 稀有气体分子均为______________原子分子,在它们的分子之间存在______________作用,不存在______________,它们的沸点高低次序为______________。
6.7 HI分子之间的作用力有______________,其中主要的作用力是______________。
6.8 F2,Cl2,Br2,I2沸点高低顺序为______________,它们都是______________性分子,偶极矩为______________,分子之间的作用力为______________。
