自由基作业
环境化学作业-参考答案(简).doc

作业一一、填空题1.污染物在环境中所发生的空间位移称为(1 )过程。
2.污染物在环境中通过物理、化学或生物作用改变存在形态的过程称为(2 )的过程。
3.醛类光解是大气中(3 )自由基的重要来源。
4.自由基在其电子壳层的外层有一个不成对电子,所以具有很高的(4 )和(5 )作用,其中以(6 )和(7 )自山基最为重要。
5.大气污染化学中所说的氮氧化物主要是指(8 )和(9 )。
6.大气中主要温室气体有(10 )、(11 )等。
7.污染物在大气中扩散取决于(12 )、(13 )和(14 )等因素。
8.大气按垂直结构分为(15 )层、(16 )层、(17 )层、(18 )层及(19 )层。
9.HNO2的光解是污染大气中(20 )自由基的重要来源之一。
10.清洁大气中HO的重要来源是(21 )。
11.烷基和空气中。
2结合形成(22 )。
12.大气中CH3自由基的主要来源是(23 )和(24 )的光解。
参考答案:1迁移2转化3HO24活性5强氧化6 HO7HO28 NO9NO210 CO2 11甲烷12风和湍流13天气形势14下垫面15对流层16平流层17中间层18热层19逸散层20 HO 21。
3的光解离22 RO223乙醛24丙酮、环境污染物有哪些类别?主要的化学污染物有哪些?作业二一、大气中有哪些重要自由基?HO来源如何?答:大气中主要自由基有:HO、HO2、R、RO2HO的来源:①。
3的光解:Os+ h V---------------- a-0 +。
20+ H2o ------------- a 2HO②HNO2的光解: HNO2 + h v ------- > HO+N0③玦。
2的光解:H2O2 + h v ------- _> 2H0二、影响酸雨形成的因素主要有哪些?作业三一、判断题(对的7,错的X)1.H0自由基的光化学生成产率白天低于夜间。
()2.大气中存在量最多的烷基是甲基。
《高等高分子化学与物理》课程作业1-活性自由基聚合1

《高等高分子化学与物理》作业(一)“活性自由基聚合”专业:材料科学与工程学号:129317姓名:张礼华活性自由基聚合专业:材料科学与工程学号:129317 姓名:张礼华摘要:对聚合物分子的组成和结构进行精密控制是当前聚合物研究的重要领域,活性自由基聚合可以对自由基聚合进行控制,其综合了通用自由基聚合和离子聚合的优点。
本文简要介绍了自由基聚合的定义、特点,以及活性自由基聚合的背景、研究现状、发展趋势、基本思想等,详细介绍了活性自由基聚合的方法。
并对未来的研究方向进行的展望。
关键词:活性自由基聚合;可逆加成-裂解链转移;原子转移;离子聚合1 自由基聚合所谓的自由基聚合(free radical polymerization)是用自由基引发,使链增长(链生长)自由基不断增长的聚合反应。
又称游离基聚合。
加成聚合反应,绝大多数是由含不饱和双键的烯类单体作为原料,通过打开单体分子中的双键,在分子间进行重复多次的加成反应,把许多单体连接起来,形成大分子。
最常用的产生自由基的方法是引发剂的受热分解或二组分引发剂的氧化还原分解反应,也可以用加热、紫外线辐照、高能辐照、电解和等离子体引发等方法产生自由基。
其特点可归纳为以下几个方面:(1)整个聚合过程分为链引发、链增长、链终止,各步反应速率和活化能相差很大;(2)高分子瞬间形成,其产品的相对分子质量不随时间变化;(3)体系内始终由单体和高聚物组成,产物不能分离;(4)反应连锁进行,转化率随时间的延长而增加;(5)反应是不可逆的。
自由基聚合反应在高分子合成工业中是应用最广泛的化学反应,大多烯类单体的聚合或共聚都采用自由基聚合,所得聚合物都是线型高分子化合物。
按反应体系的物理状态自由基聚合的实施方法有本体聚合、溶液聚合、悬浮聚合、乳液聚合和超临界二氧化碳聚合五种聚合种方法。
它们的特点不同,所得产品的形态与用途也不相同。
自由基聚合是在上世纪80年代发展起来的,已成为工业生产高分子产品的重要技术。
自由基的作用机理

机体氧化反应中产生的有害化合物,具有强氧化性,可损害机体的组织和细胞,进而引起慢性疾病及衰老效应。
自由基,化学上也称为“游离基”,是含有一个不成对电子的原子团。
由于原子形成分子时,化学键中电子必须成对出现,因此自由基就到处夺取其他物质的一个电子,使自己形成稳定的物质。
在化学中,这种现象称为“氧化”。
我们生物体系主要遇到的是氧自由基,体内活性氧自由基具有一定的功能,如免疫和信号传导过程。
但过多的活性氧自由基就会有破坏行为,导致人体正常细胞和组织的损坏,从而引起多种疾病。
如心脏病、老年痴呆症、帕金森病和肿瘤。
此外,外界环境中的阳光辐射、空气污染、吸烟、农药等都会使人体产生更多活性氧自由基,使核酸突变,这是人类衰老和患病的根源。
一般情况下,生命是离不开自由基活动的。
我们的身体每时每刻都从里到外的运动,每一瞬间都在燃烧着能量,而负责传递能量的搬运工就是自由基。
当这些帮助能量转换的自由基被封闭在细胞里不能乱跑乱窜时,它们对生命是无害的。
但如果自由基的活动失去控制,超过一定的量,生命的正常秩序就会被破坏,疾病可能就会随之而来。
所以说自由基是一把双刃剑。
认识自由基,了解自由基对人体的作用,对健康十分必要。
人体里也有自由基,他们既可以帮助传递维持生命活力的能量,也可以被用来杀灭细菌和寄生虫,还能参与排除毒素。
受控的自由基对人体是有益的。
但当人体中的自由基超过一定的量,并失去控制时,这种自由基就会给我们的生命带来伤害。
生命体内的自由基是与生俱来的,既然生命能力历经35亿年沧桑而延续至今,就说明生命本身具有平衡自由基或者说清除多余自由基的能力。
然而,随着人类文明的飞速发展,特别是最近一百年来,在科学技术给人类创造了巨大生产力的同时也带来了大量的副产品,其中就有与日俱增的自由基。
化学制剂的大量使用、汽车尾气和工业生产废气的增加、还有核爆炸……,人类文明活动还在不断破坏着生态环境,制造着更多的自由基。
骤然增加的自由基,早已超过了人以及生命所能正常保持平衡的标准,早已让人类应接不暇,人类健康面临着前所未有的严峻挑战。
自由基反应

C O O C
过氧苯甲酸
表 5-1 一些过氧化物的键能 化合物 HO-OH (CH3)3CO-OC(CH3)3 C6H5COO-OCOC6H5 CH3CH2O-OCH3 键能(kJ/mol) 213 157 139 184
石油的重整(即将长链的烷烃变为短链的烷烃过程)也是自由基反应,产生自由基的方 法就是热裂。
o o o
H H C H H C C H H
H C H H
9 个σ-π超共轭 自由基与碳正离子相比,后者的能量高些。烷烃断裂 C-H 键形成自由基(即原子)所需 能量称离解能,从自由基形成碳正离子所需能量称电离能。从稳定的分子到碳正离子,必须 吸收离解能和电离能两部分能量。例如:叔丁烷分解为叔丁基碳正离子总共吸收 -1 1104.6kJ·mol 的能量。
1
过渡金属离子是常用的氧化还原剂, 它们可以在相对较低的温度下分解过氧化物产生自 由基。例如 Fenton 试剂,即亚铁离子和过氧化氢混合物,可以产生羟基自由基。
பைடு நூலகம்
Fe
2+
+ HOOH
Fe
3+
+ OH + .OH
此外有些反应过程中可产生自由基,如炔键用 Na-液氨还原生成烯烃,中间可产生负离 子自由基等。 5.2 自由基的结构及稳定性 5.2.1 自由基的结构 。甲基自由基的碳为 sp2 杂化,三个 sp2 杂化轨道 最简单的自由基是甲基自由基(·CH3) 分别与三个氢原子形成三个σ键, 一个单电子占据未杂化的 p 轨道。 由于自由基中心碳的周 围只有 7 个电子,未达到八隅体,属于缺电子的活泼中间体。甲基自由基的空间结构如下:
CH3Cl + Cl2
一、 自由基(radical,free radical) 二、 自由基的种类 ⒈ 原子自由基

2CH3
CH3 C + N2 CN
(异丁腈基自由基 为一个基团自由基。 异丁腈基自由基)为一个基团自由基 异丁腈基自由基 为一个基团自由基。
自由基是一个离子。如过硫酸钾分解: ⒊ 离子自由基 自由基是一个离子。如过硫酸钾分解:
K2S2O8 O O K O S O O S O K O O
水溶液中
K2S2O8
图2.2 甲烷分子 正四面体结构
2.2 自由基的基本概念
但当甲烷分子中一个H原子被分离出来后, 但当甲烷分子中一个 原子被分离出来后,形成的甲 原子被分离出来后 · 则为一个不稳定的结构。 基自由基CH3 则为一个不稳定的结构。 基自由基
H H C H H
CH3
+
H
*
H ** H* C * H
图2.3 甲基自由基 电子结构示意图 图2.3 甲基自由基 结构示意图
当自由基与吸电子取代基相连时, 自由基的稳定性增强。 当自由基与吸电子取代基相连时 自由基的稳定性增强。 · ·
2.2 自由基的基本概念
NO2 N N NO2
(1) (2) (3) (4)
NO2 >
C
>
CH2 > HO
O
> CH2
CH CH2
>R
CH C O OR
(6)
>
R CH CN
(7)
>
R CH C O R
2.2 自由基的基本概念
三、自由基的性质 自由基具有电子不饱和性和 电子不饱和性和较高的能量 自由基具有电子不饱和性和较高的能量 ⒈ 电子不饱和性 甲烷(CH4)是一个稳定的化合物。 是一个稳定的化合物。 甲烷 是一个稳定的化合物
有机化学各章作业

有机化学各章作业(总5页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--2第二章 烷烃一、命名(CH 3)2CHCH 2CH 2CH(C 2H 5)2二、单项选择题1. 在烷烃的自由基取代反应中,不同类型的氢被取代活性最大的是 ( )A.一级B. 二级C. 三级D.都不是 2. 在自由基反应中化学键发生 ( )A. 异裂B. 均裂C. 不断裂D. 既不是异裂也不是均裂 3. 下列烷烃沸点最低的是 ( )A. 正己烷B. 2,3-二甲基戊烷C. 3-甲基戊烷D. 2,3-二甲基丁烷CH 3CHCH 2CHCHCH 3CH 3CH 3CH 3CH 3(CH 2)3CH(CH 2)3CH 3C(CH 3)2 CH 2CH(CH 3)2CH 3CH 2CHCH 2CH CHCH 3CH 3CH 3 CH 2CH 2CH 3(CH 3)2CHCH 2CH 2CH(C 2H 5)2CH 3CH 2C(CH 2CH 3)2 CH 2CH 334. 引起烷烃构象异构的原因是 ( )A. 分子中的双键旋转受阻B. 分子中的单双键共轭C. 分子中有双键D. 分子中的两个碳原子围绕C-C 单键作相对旋转5. ClCH 2CH 2Br 中最稳定的构象是 ( )A. 顺交叉式B. 部分重叠式C. 全重叠式D. 反交叉式 6. 下列游离基中相对最不稳定的是 ( )A. (CH 3)3C .B. CH 2=CHCH 2.C. CH 3.D. CH 3CH 2.7. 构象异构是属于 ( )A. 结构异构B. 碳链异构C. 互变异构D. 立体异构 8. 下列化合物沸点最高的是( )。
A .辛烷 B .2,2,3,3-四甲基丁烷 C .3-甲基庚烷 D .2,3-二甲基戊烷 9. 光照下甲烷的氯代反应属于( )A .亲电取代反应B .亲核取代反应C .游离基反应D .亲电加成反应第三章 烯烃1. 在烯烃与HX 的亲电加成反应中,主要生成卤素连在含氢较( )的碳上 ( )A.多B. 少C. 不能确定2. 烯烃双键碳上的烃基越多,其稳定性越 ( )A. 好B. 差C. 不能确定3. 下列反应中间体的相对稳定性顺序由大到小为( )CH 2CH 3CH 3CHCH 3CH 3C CH 3CH 3+++A. B. C.A. A >B >CB. A >C >BC. C >B >AD. B >C >A44. 在烯烃与HX 的加成反应中,反应经两步而完成,生成( )的一步是速度较慢的步骤( )A. 碳正离子B. 碳负离子C. 自由基 5. 具有顺反异构体的物质是 ( )CH 3CH C CO 2HCH 3CH 3CH C CH 3CH 3CH 3C CH 3CHCH 2CH 3H 2C CH 2A. B.C. D.6. 实验室中常用Br2的CCl4溶液鉴定烯烃,其反应历程是( ) A .自由基加成 B . 亲电加成反应 C .亲核加成 D . 亲电取代反应7.下列化合物中具有顺反异构的是( )A. 2-甲基-1-丁烯B. 2-甲基-2-丁烯C. 3-甲基-2-戊烯D. 3-乙基-1-己烯8.按次序规则比较下列原子或基团最优的是( )。
自由基反应简介

自由基反应简介
目录
•1拼音
•2注解
1拼音
zì yóu jī fǎn yìng
2注解
自由基参与的反应叫自由基反应。
自由基是在光照、辐射、过氧化物或高温作用下,由分子中原子间的共价键的均裂产生的,有不成对价电子的原子或原子团,叫做自由基(曾用名:游离基),例如H·(氢自由基)、Cl·(氯自由基)、·CH3(甲基自由基)。
自由基反应具有链反应的特点,反应历程经链引发(产生活性中间体——自由基)、链增长(自由基向反应物进攻,生成新的自由基)和链的终止(自由基老化丧失活性)三个阶段。
自由基反应是通过共价键的均裂进行的,酸、堿的存在或溶剂极性的改变对自由基反应的影响很小,但非极性溶剂有利于自由基反应。
自由基反应主要有两大类。
一类是自由基取代反应,如烷烃的氯代反应。
另一类是自由基加成反应,如氯跟四氯乙烯的加成反应。
免责声明:本文内容来源于网络,不保证100%正确,涉及到药方及用法用量的问题,不保证正确,仅供参考。
由此造成的问题,本站概不负责。
自由基作业(部分)

2. 下列烯类单体适于何种机理聚合?自由基聚合、阳离子聚合还是阴离子聚合?并说明原因。
CH 2=CHCl CH 2=CCl 2 CH 2=CHCN CH 2=C(CN)2 CH 2=CHCH 3 CH 2=C(CH 3)2 CH 2=CHC 6H 5 CF 2=CF 2 CH 2=C(CN)COOR CH 2=C(CH 3)-CH=CH 2答:CH 2=CHCl :适合自由基聚合,Cl 原子是吸电子基团,也有共轭效应,但均较弱。
CH 2=CCl 2:自由基及阴离子聚合,两个吸电子基团。
CH 2=CHCN :自由基及阴离子聚合,CN 为吸电子基团。
CH 2=C(CN)2:阴离子聚合,两个吸电子基团(CN )。
CH 2=CHCH 3:配位聚合,甲基(CH 3)供电性弱。
CH 2=CHC 6H 5:三种机理均可,共轭体系。
CF 2=CF 2:自由基聚合,对称结构,但氟原子半径小。
CH 2=C(CN)COOR :阴离子聚合,自由基聚合,取代基为两个吸电子基(CN 及COOR ) CH 2=C(CH 3)-CH=CH 2:三种机理均可,共轭体系。
3. 下列单体能否进行自由基聚合,并说明原因。
CH 2=C(C 6H 5)2 ClCH=CHCl CH 2=C(CH 3)C 2H 5 CH 3CH=CHCH 3CH 2=CHOCOCH 3 CH 2=C(CH 3)COOCH 3 CH 3CH=CHCOOCH 3 CF 2=CFCl 答:CH 2=C(C 6H 5)2:不能,两个苯基共轭稳定使自由基活性低,取代基位阻大。
ClCH=CHCl :不能,1,2-双取代,位阻大,对称结构。
CH 2=C(CH 3)C 2H 5:不能,二个推电子基,只能进行阳离子聚合。
CH 3CH=CHCH 3:不能,1,2-双取代,位阻大,对称结构,供电子取代基。
CH 2=CHOCOCH 3:醋酸乙烯酯,能,吸电子基团及共轭作用相反。
自由基优秀课件

溴化剂: NBS
O
❖ N-bromosuccinimide (NBS) selectively
brominates allylic positions(烯丙基)
❖ Requires light for activation
NBr
❖ A source of dilute bromine atoms
O
发生重排反应
Cl + Cl 链终止 CH3 + CH3
Cl2 CH3CH3
Cl + CH3
CH3Cl
链终止旳特点是只消耗自由基而不再产生自由基。
只有在大量甲烷存在时才干得到一氯甲烷为主旳产
物。当CH3Cl到达一定浓度时,·Cl可与之反应,生成 CH2Cl2,进而有CHCl3、CCl4生成。
烯烃与HX旳加成 马氏规则
自由基反应
以甲烷氯代反应为例:
试验事实 ①加热或光照下进行,一经开始便可自动进行; ②产物中有少许乙烷; ③少许氧旳存在会推迟反应旳进行。 以上试验事实,阐明该反应是一自由基反应!
自由基反应大多可被光照、高温、过氧化物所催化, 一般在气相或非极性溶剂中进行。
烷烃旳氧化和裂化都是自由基反应。
甲烷氯代反应历程如下:
过氧化物效应 一般情况下:
CH3-CH=CH2 + HBr
但有过氧化物存在时:
CH3-CH=CH2 + HBr hor 过氧化物
CH3-CH-CH3 Br (主)
(遵马)
CH3CH2CH2Br (反马)
Why?
只能是HBr (HCl、HI都不反马)
① 光照、加热、过氧化物存在等条件下易产生自由基, 发生自由基反应。 H - I 键键能小,轻易断开生成碘自由基,但碘自由基旳活性太差。 H-Cl键键能大,不易断开生成氯自由基;
化学中的自由基反应过程及控制

化学中的自由基反应过程及控制在化学反应中,自由基反应是非常广泛的一类反应,也是一种十分重要的化学反应方式。
自由基反应指的是分子中某些原子失去电子而变成了极性分子的离子,同时带有不成对的电子,又称单电子化合物。
这些不成对电子呈现出非常强烈的化学活性,能够引发强烈的反应。
本文将从自由基反应的基本概念入手,对其反应过程及控制进行探讨。
一、自由基反应的基本概念自由基反应是指参与反应的原子和(或)分子在反应体系中形成不成对电子,这些不成对电子是这些化学物质之间反应的基础。
自由基反应中,自由基被认为是中间体,其反应速度决定了反应的快慢和化学平衡的实现。
自由基反应可以分为链反应和非链反应两类。
1. 非链反应非链反应是指反应的开始和结束都需要外在的能量,且反应过程中不会形成反应级数。
这种反应通常具有不可逆性、不放热、反应速率快等特点。
常见的非链反应包括氧化还原反应、酸碱反应、还原反应等。
2. 链反应链反应是指反应中自由基通过与反应物反应送出的自由基再次参与反应的过程,形成一个反应级数的过程。
在链反应中,一旦有某个步骤反应较快,就可能导致整个反应过程的速度迅速加快,从而产生爆炸性反应。
链反应可以分为三个步骤:起始步骤、传递步骤和终止步骤。
二、自由基反应的反应过程自由基反应的反应过程包括:起始步骤、传递步骤和终止步骤。
下面,我们将详细探讨这三个步骤的反应过程。
1. 起始步骤起始步骤也叫引发步骤,是整个反应链的开始。
在引发反应过程中,通常需要一个合适的能量,如光、温度等,对反应物进行激发,使其分解成为两个自由基。
2. 传递步骤传递步骤是自由基反应中最具有代表性的一个步骤。
在这个步骤中,反应物分子中的自由基向其他分子中的化学键迁移,从而形成新的自由基。
这一步骤是自由基反应中最重要的步骤之一,很多反应的速率都取决于这一步骤的速率常数。
3. 终止步骤终止步骤是自由基链的结束,也是反应体系中自由基数量的极限条件。
在这一步骤中,自由基与其他自由基进行反应,形成比自由基更稳定的中间体,或者双自由基结合成为一个不带任何不成对电子的反应产物。
合成化学中的自由基反应及其应用

合成化学中的自由基反应及其应用自由基反应是合成化学中极为重要的一类反应。
自由基是指电子数不足、具有极高化学反应活性的单电子物种。
自由基反应的机理具有不确定性和灵活性,因此有很多种不同的自由基反应方式。
自由基反应在有机合成、材料化学和生物化学等许多领域都有广泛的应用。
1. 常见的自由基反应烷基自由基取代反应是一种常见的自由基反应。
此反应通常涉及到一种卤代烷和一种自由基供体,如过氧化氢或光。
当光照射或通过其他方法将自由基供体加入到卤代烷中时,产生的自由基会表现出烷基的化学性质,即它们会取代卤原子。
另一种常见的自由基反应是Friedel-Crafts反应。
在这种反应中,光子、热量或者其他方式产生的自由基将亲电合成物中的原子取代为芳香族碳基。
这种方法在合成苯环化合物时,体现出了特别的效果。
单分子聚合反应是一种有趣的自由基反应。
在这种反应中,双重结合的一分子会通过裂解产生自由基并且跟另一分子结合。
这一过程被称为单分子聚合。
2. 自由基反应在有机合成中的应用自由基反应在药物合成、植物保护剂、高分子物质和医药材料等领域中都有广泛的应用。
例如,在药物合成中,自由基反应对表达数种重要生物活性的单一或多子源化合物被合成的化学工艺产生了巨大的进展。
近年来,自由基反应中的氧化还原反应、烷基化反应、重排反应、加成反应和取代反应等得到了更多的应用,并形成了很多基于自由基反应的合成路线。
3. 自由基反应在材料化学和生物化学中的应用自由基反应不仅在有机合成中有应用,还在材料化学和生物化学等领域有重要作用。
根据这一机理,人们设计了一些自由基反应类的半导体材料,如光电器件,新型光伏材料和光致色材料等。
光敏性材料、生物标记物等与自由基反应相交的科研领域是非常广泛的。
因此,自由基反应已经成为材料化学和生物化学等领域研究中不可或缺的一部分。
4. 结论自由基反应具有灵活性和不确定性,其机理也多样,这为有机合成、材料化学和生物化学的应用创造了许多机会。
大气中的自由基的作用

大气中的自由基的作用
大气中的自由基参与了许多气象和环境反应,具体包括以下几个方面:
1.光化学反应:太阳能激发氧气分子形成O(1D)自由基,当它遇到
其他分子时,会发生光化学反应,例如臭氧的形成和消耗。
2.燃烧反应:在燃烧过程中,自由基参与氧化反应,例如甲烷的氧化
生成CO和CO2。
3.大气清洁与污染:自由基可以参与大气中的清洁过程,例如生成臭
氧和清除空气中污染物,但它们也可以是造成污染的原因。
4.大气氧化:自由基可以参与大气中的氧化反应,例如NO和HO2自
由基的反应生成NO2和H2O。
总的来说,大气中的自由基是极其重要的化学物种,对大气中的许多
化学反应都发挥着至关重要的作用。
高压氧仓自由基

高压氧仓中的自由基是指机体内可与活性分子(如氧、氢、氮等)相结合的化学物质,其特点是化学反应活性很高,可以参与多种化学反应。
在高压氧仓中,自由基可以与活性分子(如氧)结合,形成新的化合物,从而在高压氧环境下保持稳定。
在高压氧治疗中,自由基的作用受到一定程度的调节。
一方面,高压氧环境可以激活人体的抗氧化系统,增强抗氧化能力,从而清除过多的自由基,改善身体机能,并有效延长端粒长度,减少衰老细胞。
另一方面,高压氧治疗可以激活细胞的活性和功能,有利于增强心肺功能,加快体内毒素的排出,改善血液循环,增强免疫能力,从而达到预防新冠和促进新冠康复的作用。
然而,过多的自由基也可能对人体造成损害,因此高压氧治疗需要在科学指导下进行,并严格控制压力和时间。
在高压氧治疗过程中,还需要注意防护措施,如戴上面罩、穿上抗压服等,确保治疗的安全性和有效性。
精选-自由基(freeradical)物理课外知识-文档

自由基(freeradical)物理课外知识
当今社会是一个高速发展的信息社会。
生活在信息社会,就要不断地接触或获取信息。
如何获取信息呢?阅读便是其
中一个重要的途径。
据有人不完全统计,当今社会需要的各种信息约有80%以上直接或间接地来自于图书文献。
这就说
明阅读在当今社会的重要性。
还在等什么,快来看看这篇自由基(freeradical)物理课外知识吧~
自由基(freeradical)
自由基(freeradical)
是指独立存在的有一个或几个不配对电子的原子(离子)或
基团,如氢自由基H活性氧自由基;超氧阴离子O2-、羟自由基OH、脂自由基L、脂类过氧化物自由基LO和LOO等。
自
由基(或非自由基活性氧)是体内正常的代谢和外界物理物
理因素(如药物、射线等)作用与机体的应激反应的产物。
自由基参与很多正常代谢过程,对机体是有益的,如杀灭入侵细菌,前列腺素的合成等。
但过量自由基(或活性氧)也能对机体形成各种损害,很多疾病,如心脑血管疾病、肝病、物理中毒、肿瘤及衰老等,其病理和生理进程都与自由基有密切的关系。
研究自由基作用机理及其应用的自由基生物学和医学是近年来发展迅速的新兴分支学科。
这篇自由基(freeradical)物理课外知识,你推荐给朋友了么?
第 1 页。
第五章 自由基反应

第六页,共三十二页。
烯丙基和苄基(biàn jī)自由基
烯丙基和苄基自由基由于p-π共轭效应,降低(jiàngdī)了自由基
碳的缺电子性,增强了稳定性。
第七页,共三十二页。
自由基稳定性的影响(yǐngxiǎng)因素
影响自由基稳定性的因素是很多的,如: 电子离域,空间 (kōngjiān)阻碍和邻位原子的性质等;
C H 3+ C l2 C H 3 C l+C l
H = -112.9 kJmol-1 Ea= 8.3 kJmol-1
Cl + Cl
CH3 + CH3
Cl + CH3
C l2
H3CCH3
H 3C C l
第十八页,共三十二页。
势能 /(kJ mol-1)
Cl
H
CH3
H3C
Cl
Cl
+16.7
Ea1
Ea2
BrCCl3, CCl4, ICF3,等在过氧化物存在(cúnzài)下,也与烯烃 发生自由基加成。
h v , 2 5 o C
4 5 %
5 5 %
选择性:2o H : 1o H = 3.7 : 1
C H 3 C H 3C H C H 3
C l2 hv , 25oC
C H 3
C H 3
C H 3C H C H 2 C l + C H 3C C H 3
C l
64%
36%
选择性:3o H : 1o H = 5 : 1
(1)热均裂产生
(chǎnshēng)
过氧苯甲酰
过氧化苯甲酰具有强氧化性能,可漂白小麦粉,且有杀菌性能。用作丙烯酸酯、 醋酸乙烯溶剂聚合,氯丁橡胶、天然橡胶、SBS与甲基丙烯酸甲酯接枝聚合
有机合成中常见的自由基反应
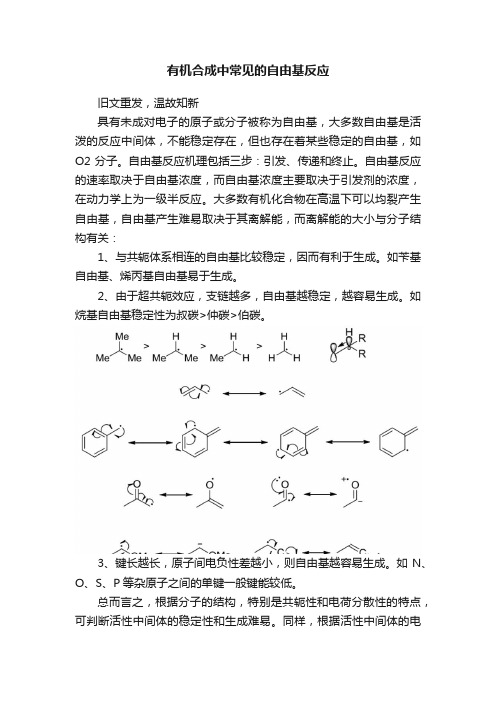
有机合成中常见的自由基反应
旧文重发,温故知新
具有未成对电子的原子或分子被称为自由基,大多数自由基是活泼的反应中间体,不能稳定存在,但也存在着某些稳定的自由基,如O2分子。
自由基反应机理包括三步:引发、传递和终止。
自由基反应的速率取决于自由基浓度,而自由基浓度主要取决于引发剂的浓度,在动力学上为一级半反应。
大多数有机化合物在高温下可以均裂产生自由基,自由基产生难易取决于其离解能,而离解能的大小与分子结构有关:
1、与共轭体系相连的自由基比较稳定,因而有利于生成。
如苄基自由基、烯丙基自由基易于生成。
2、由于超共轭效应,支链越多,自由基越稳定,越容易生成。
如烷基自由基稳定性为叔碳>仲碳>伯碳。
3、键长越长,原子间电负性差越小,则自由基越容易生成。
如N、O、S、P等杂原子之间的单键一般键能较低。
总而言之,根据分子的结构,特别是共轭性和电荷分散性的特点,可判断活性中间体的稳定性和生成难易。
同样,根据活性中间体的电
荷分布状态可判断其不同机理的化学反应活性。
自由基反应——精选推荐

有机化学中自由基反应自由基取代反应2009级应用化学班张琦为***********指导教师:曹洪玉一、自由基的定义自由基(free radical)是指能独立存在,还有未成对电子的原子、原子团、分子或离子。
如含有不成对电子的氧则称为氧自由基(oxygen free radical, OFR);自由基具有不成对电子的原子或分子。
含有基数电子或不配对电子的原子、原子团和分子。
具有很强的反应性。
自由基,化学上也称为“游离基”,是含有一个不成对电子的原子团。
由于原子形成分子时,化学键中电子必须成对出现,因此自由基就到处夺取其他物质的一个电子,使自己形成稳定的物质。
自由基的定义包含了:㈠短寿命自由基(如·CH3烷基自由基,RO·烷氧自由基等),它们是化学反应中的活泼中间体,存在时间极短,一般只有几分之一秒,最简单的甲基自由基存在时间只有0.001s;㈡较稳定的如三苯甲基自由基,它们可以较长时间地存在与溶液中;㈢稳定的无机分子如(NO2,NO)和许多原子等。
二、自由基的稳定性:自由基的稳定性是指自由基或多或少解离成较小碎片,或通过键断裂进行重排的倾向。
自由基的结构和自由基的稳定性有密切的关系。
通常,烷基自由基的中心碳原子是SP2杂化,周围只有7个电子,未达到八隅体,属于缺电子的中间体。
我们可以从R-H键的解离能(D值)来推断自由基R.,相对稳定性。
如:稳定性:D值:可见自由基的相对稳定性取决于具有未成对电子碳原子上的烷基数目,即烷基自由基的相对稳定性:叔>仲>伯。
自由基的相对稳定性还可以从电子效应上得到解释:超共轭效应和p-π共轭使得自由基的稳定性得到增加。
p-π共轭效应进一步表现在共轭效应上,有共轭可能的自由基稳定性增强。
苯基或乙烯基数目的增加,稳定性越大(这种稳定性的增加还表现在空间位阻因素)。
如:稳定性:三苯甲基自由基>二苯甲基自由基>苄基自由基>甲基自由基三苯甲基自由基相当稳定,在室温下可存在于溶液中,以二聚体形式存在。
s自由基作为氢原子转移试剂

s自由基作为氢原子转移试剂
自由基作为氢原子转移试剂是一种常见的有机化学反应中使用的试剂,主要用于将氢原子从一个分子转移到另一个分子上。
自由基是具有未
成对电子的原子或分子,可以在化学反应中作为一个独立的实体存在。
在氢原子转移反应中,自由基通常作为氢原子源,将氢原子提供给另
一个分子。
这个过程通常涉及到一个不饱和的碳-碳双键或三键的化合物,以及一个适当的自由基引发剂。
当自由基与不饱和化合物发生反
应时,氢原子会从自由基转移到不饱和化合物上,形成一个新的化合物。
这种反应通常被称为氢化反应或加氢反应,是一种在有机化学中广泛
应用的反应类型。
通过这种反应,可以合成许多有用的化合物,例如
油脂、脂肪酸、醇类和烃类等。
需要注意的是,自由基作为氢原子转移试剂的反应条件和反应机理可
能因不同的反应物和试剂而有所不同。
因此,在进行这种反应时,需
要仔细选择合适的反应条件和试剂,以确保实验的成功和安全性。
自由基生物学实训.ppt

阿1h,
(4)歧化反应
有时一个自由基可从另一个自由基的β碳上夺取 一个质子,变成安定的化合物,另一个自由基则变 成不饱和化合物,其结果与复合作用一样,使自由 基消灭,以终止自由基反应,例如:
2CH3-CH2· 岐 化 酶
CH2= CH2 + CH3-CH3
阿1h,
(5)加成反应
X-C= C-X'+ R·
阿1h,
电子转移:
OH.可与无机物或有机物发生电子转移。如:
Cl- + OH·
Cl· + OH-
以上各种反应可见,OH·如果在机体内产生,那 么它可以立刻与周围的任何生物分子发生反应,生 成活性各异的次级自由基,从而导致机体不同程度 的损伤。
阿1h,
2.超氧阴离子的毒性
O2·- 是氧分子被还原成水时所产生的第一个活 性氧自由基,其化学反应性质较OH·弱,具有双 重性质,既可作为电子供体(还原剂),又可 作为电子受体(氧化剂)。
O2 + 血红蛋白(Fe2+)
阿1h,
当它作为电子受体起作用时,可以成为弱氧化剂, 能氧化抗坏血酸:
维生素C + O2·- H+ H2O2 + 维生素C·(剧毒) 也能使与NADH结合的酶(如乳酸脱氢酶)形成 NAD自由基: 酶-NADH + O2·- H+ H2O2 + 酶-NAD·
阿1h,
由此可见,因光化学和酶反应所产生的 O2·- 能使酶失活、使红细胞溶血、杀菌、使 DNA降解和破坏动物细胞等。此外,O2·-还 可与细胞内的过度性金属离子发生反应,生 成更活泼的OH·。
阿1h,
夺氢反应:
OH·可从醇类上夺走一个氢原子,并与之结合生成 水,使醇碳原子带有一个不成对电子。以乙醇为例:
4.1 自由基的作用

4.1 自由基的作用一、自由基的概念自由基是指外层轨道上含有单个不配对电子的各种原子、原子团或分子的总称。
特点:化学性质活泼、氧化性强、半衰期短。
自由基按不配对电子所在的原子分类,分为非脂性自由基、脂性自由基和其他自由基。
1. 非脂性自由基主要指氧自由基(oxygen free radical),即以氧为中心的自由基,其不配对电子位于氧原子上。
如:超氧阴离子、羟自由基(•OH)。
2. 脂性自由基指氧自由基与多价不饱和脂肪酸作用后生成的中间代谢产物,如烷自由基(L•)、烷氧自由(LO•)、烷过氧自由基(LOO•)等。
3. 其他自由基如氯自由基(Cl-•)、甲基自由基(CH3•)、一氧化氮(NO•)等。
特别是NO•,NO是一个气体分子,本身是一种弱氧化剂,与超氧阴离子反应生成ONOO-,虽不是自由基,但具有强氧化性,产生损伤效应。
4. 活性氧指单线态氧和过氧化氢。
单线态氧(1O2)是一种激发态氧,其氧分子两个外层轨道中的一个电子发生反向自旋改变,使外层轨道两电子自旋方向相反,氧分子的反应能力大大增加。
这种氧分子在紫外光谱中呈现一条单线,故称为单线态氧。
(正常的氧属于三线态氧,外层轨道上有两个自旋方向相同的未配对电子;受到激发时,这两个电子的自旋方向变成相反,形成单线态氧。
)H2O2虽然不是氧自由基,但在Cu2+或Fe2+的作用下可生成·OH,或通过均裂生成·OH。
·OH的生成是H2O2导致氧化应激的主要机制。
二、自由基的代谢氧自由基主要是在线粒体中产生。
在生理情况下,氧通常是通过细胞色素氧化酶系统接受4 个电子还原成水,同时释放能量,但也有1% -2% 的氧接受一个电子生成,再接受一个电子生成H202,或再接受一个电子生成·OH。
另外,在血红蛋白、肌红蛋白、儿茶酚胺及黄嘌呤氧化酶等氧化过程中也可生成超氧阴离子。
超氧阴离子通过超氧化物歧化酶催化生成H2O2,并可以与H2O2反应生成·OH。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
40%蛋氨酸饮食限量能降低大白鼠心脏DNA甲基化,复合物I ROS的生产以及对线粒体DNA和线粒体蛋白的损伤摘要:蛋氨酸饮食限量(MetR),如同饮食限量(DR),能增加啮齿动物的最大长寿。
然而,利用MetR延长寿命的机制仍然不清楚。
正如DR降低氧化损伤和线粒体自由基的生成,有一个貌似真实的假设:利用MetR减小氧化胁迫是延长寿命的机制。
在目前的研究中,以雄性大白鼠为研究对象,用等热量的40%的蛋氨酸饮食限量饲养七周,发现40% MetR能降低心脏线粒体中复合物I在电子传递过程中活性氧的生成量,降低活性氧对线粒体DNA和蛋白质的氧化损伤,减小基因组DNA甲基化的程度。
线粒体对氧气的消耗量,呼吸链上四种复合体的数量以及细胞凋亡诱导因子AIF的数量都没有明显的改变。
这些结果表明:蛋氨酸是节食因子,负责降低线粒体ROS的生成和氧化胁迫,并且可能是DR中延长寿命的一部分。
他们也强调强调包括产生这些有益元素的生成的机制。
关键词:蛋氨酸,自由基,饮食限量,氧化损伤,DNA甲基化引言饮食限量(DR)是延长包括哺乳动物在内动物寿命的一种更好的实验操作。
尽管传统的观念提出,这种效果是由于减少摄入的热量本身,特别是膳食成分的作用越来越明显。
在昆虫的研究中显示了氨基酸(Mair et al. 2005; Min and Tatar 2006;Grandison et al. 2009)的作用,对啮齿动物的调查显示了必须氨基酸的重要性。
以前的研究结果表明,以大鼠和小鼠为研究对象,在1618长期的生存研究中,蛋白质限制使他们的寿命增加。
然而,现有的研究表明,限制碳水化合物或脂肪不能改变啮齿类动物长寿(Iwasaki et al. 1988; Khorakova et al.1990; Shimokawa et al. 1996)。
与饮食限量延长啮齿类动物寿命相比,蛋白质限制延长动物寿命的效果幅度高达50%。
就特定的氨基酸而言,没有热量限制的蛋氨酸限量增加大鼠和小鼠的最大寿命(Richie et al.1994; Miller et al. 2005; Sun et al. 2009)。
MetR在啮齿类动物有利影响还包括减少内脏的脂肪,甘油三脂,胆固醇,葡萄糖,胰岛素和IGFI(Malloy et al. 2006),减缓白内障的恶化,保护随年龄而变化的免疫系统(Milleret al. 2005), 改善克隆相关的功能障碍(Ramaligan et al. 2010), 增加新陈代谢的灵活性(Hasek et al. 2010), 降低癌症的发生率(Komninou et al. 2006).这也显示了,蛋氨酸亚砜还原酶的过表达延长动物寿命(Chung et al. 2010)。
另一方面,过量摄入蛋氨酸具有毒性作用,包括增加氧化胁迫(Park et al. 2008; Yalcinkaya et al. 2009; Song et al. 2009; Gomez et al. 2009)。
就相关的机制而言,以前的研究表明,在啮齿类动物中,DR常常降低线粒体活性氧(mitROS)的生成,减小对线粒体DNA(mtDNA)和蛋白质的氧化损伤(reviewed in Gredilla and Barja 2005)。
有趣的是,与短寿命的哺乳动物相比,长寿哺乳动物的线粒体活性氧和不饱和脂肪酸更少(see Pamplona and Barja 2007 for review).以前的研究表明,是蛋白质而不是碳水化合物或脂质限量能减少线粒体活性氧和氧化胁迫(Lopez-Torres and Barja 2008),并且通过单一的氨基酸,蛋氨酸限量后,在心脏中出现了同样的实验结果(Sanz et al. 2006)。
此外,除了蛋氨酸,当其他的氨基酸都被限制摄入时,不再呈现消除氧化损伤(Caroet al. 2009a)。
所有这些都表明,在饮食限量中,蛋氨酸是负责减少线粒体活性氧生成和氧化损伤的饮食因子。
然而,以前的实验以小鼠心脏为研究对象,是在80% MetR实验条件进行,而经典的实验是在40%DR条件下进行。
为了确定必须蛋氨酸在氧化胁迫中有效反应的DR标准,MetR的实施水平是40%而不是80%。
此外,运用40%的蛋氨酸限量通常还能抑制生长速率,成熟,且减小在80%MetR 和40%DR中出现的最终个体体积,这些降低的指标都使对所得结果的解释复杂化。
目前的研究,以雄性大白鼠的心脏为研究对象,研究40%MetR在七周内对线粒体活性氧和氧化损伤的效应。
以往在DR,蛋白质限制,80%MetR的研究,实验时间选择在mitROS生产和氧化应损伤明显减少的时期。
选择心脏是因为它是一个有生机的组织并且主要是由有丝分裂期的细胞组成,这使得有关寿命的研究更理想。
测定的指标包括线粒体中氧化损伤的部位,以前关于蛋氨酸饮食限量的许多研究主要以除了线粒体以外的所有器官为研究对象(Sanz et al. 2006; Naudi etal. 2007; Caro et al. 2008),测定的指标包括在磷酸化阶段和休眠阶段氧的消耗量,线粒体活性氧的生成率,以及自由基的定位,对线粒体DNA氧化损伤的部位和氧化的五个标记,利用气相色谱/质谱分析技术测定糖氧化,脂氧化对蛋白质的损伤程度。
不饱和脂肪酸对动物长寿有负面作用(Pamplona and Barja 2007),质膜对脂质过氧化的敏感性对蛋白质氧化程度影响不大,这很大程度上决定于在心脏脂质中测定的不饱和脂肪酸的程度以及所有脂肪酸的构成。
测定呼吸复合物I-IV的数量是因为它们能改变呼吸链上总的电子流和活性氧生成部位的数量,因此,他们有可能影响线粒体活性氧生成的速率。
测定清除超氧阴离子的线粒体酶MnSOD的数量以确定改变线粒体超氧阴离子自由基的释放的程度,是由于超氧阴离子自由基的生成或消除速度的修改。
研究凋亡诱导因子,因为它是一柄双刃剑(Porter and Urbano 2006),它可以刺激细胞凋亡,但它需要合成复合物I,在长寿动物,利用MetR和DR,生产线粒体活性氧的呼吸复合物都是降低的(Barja 2004; López-Torres and Barja 2008)。
通常测定线粒体去乙酰化酶SIRT5的数量,去乙酰化酶是一种与长寿有关的重要蛋白(Imai and Guarente 2010)。
最后,饮食蛋氨酸是S-腺苷甲硫氨酸合成所必需的,S-腺苷甲硫氨酸是DNA甲基化过程中甲基的供体,这是基因表达修饰的一个重要机制,通常测定心脏基因组DNA的所有甲基化。
材料与方法动物和食物雄性大白鼠:体重250–300 g,单独关在笼子里,并且在十二小时光周期,22 °C±2 °C 温度和50%±10%湿度条件下饲养。
使用由MP生化试剂所制备和从西班牙进口半纯化的食物,组成食物的详细成分如表1所示。
40%MetR的成分与对照组食物的成分相似,对照组中,除了L -蛋氨酸目前是0.516%,这与比对照组(0.86%)低的40%蛋氨酸的数量相符合。
在40%蛋氨酸中缺少的0.34%L-蛋氨酸由食物中存在的其他所有比例相符且增加的成分所补充,在两种实验食物中,当L—蛋氨酸减少的量较少时,用于实验的所有其他食物成分相同, 在七周的食物处理后把动物处死,从其心脏中分离出用以测定线粒体的呼吸作用及H2O2的生成量的线粒体,把线粒体和心脏样品在-80°C下保存以分析其他的生化指标。
分离心脏线粒体心脏线粒体是利用Mela和Seitz(1979)所采用的方法从新鲜组织中获得。
把心脏切成小块,用玻璃棒在含有5毫克的枯草杆菌酶A和25毫克无脂肪酸链的清蛋白的10毫升隔离缓冲区(220毫米70毫米蔗糖,甘露醇,1 mM EDTA的,10毫米的Tris - HCl,pH 7.4)中匀浆。
样品静置1min,然后加入含有25毫克的枯草杆菌酶的隔离缓冲液25ml,再用玻璃棒搅匀。
胞核和细胞碎片在700 ×g离心10分钟分离弃除。
把上清液在8000× g离心10分钟后去除上层清夜,把沉淀物在25ml隔离缓冲液中悬浮,然后在8000× g离心10分钟。
线粒体粗提物在1ml隔离缓冲液中再次悬浮。
上述所有的操作步骤都在4°C下进行。
用双缩脲法鉴定线粒体蛋白,最后的线粒体悬浮液保存在高浓度的线粒体蛋白中方在冰上,并立即在接下来的两个小时测量耗氧量和H2O2生成量。
线粒体H2O2的生成线粒体ROS的生成量通过增加的荧光的量来分析,荧光作为一种时间反应器(在312 nm下被激发, 在 420 nm下发出荧光)。
其本质是在辣根过氧化物酶存在的条件下,高香草酸被H2O2氧化(Barja 2002; Sanz and Barja 2006).在2 μM鱼藤酮或2 μM抗霉素A存在或缺少的缓冲溶液(145 mM KCl, 30 mM Hepes, 5 mM KH2PO4, 3 mM MgCl2, 0.1 mM EGTA, 0.1% albumin, pH 7.4)中,反应的底物有线粒体蛋白 025mg/ml ,辣根过氧化酶 6 U/ml,0.1mM高香草酸,50 U/mlSOD,2.5mM丙酮酸酯/2.5mM苹果酸酯,5mM琥珀酸盐,温度37 °C,反应总体积1.5ml。
样品在37 °C下温育15min,把样品转移到冰域并且加入反应停止溶液(2.0 M glycine, 2.2 M NaOH, 50 mM EDTA, pH 12)使反应停止,利用LS50B Perkin-Elmer 荧光计读出荧光。
以葡萄糖作为底物,利用葡糖氧化酶催化所产生的已知数量的H2O2作为基准。
在由线粒体释放的H2O2转变成过量的O2-中添加超氧化物歧化酶,测量值代表总的线粒体ROS的生成率。
线粒体耗氧量37°C 条件下,在0.5ml温育缓冲液(145 mM KCl, 30 mM Hepes, 5 mM KH2PO4,3 mM MgCl2, 0.1 mM EGTA, 0.1% albumin, pH 7.4)中,通过与计算机相连的Clark-type O2 电极测定心脏线粒体氧气消耗的速率。
反应的底物有相关的复合物I(2.5 mM pyruvate/2.5 mM malate) 或相关的复合物II(5 mM succinate +rotenone)。
在缺少(State 4-resting)和存在(State 3-phosphorylating) 500μM ADP的条件下进行试验分析。
DNA分析通过常用在哺乳动物的方法(Latorre et al(1986)),测定对mtDNA的氧化损伤。
