N_芳烷基取代苯乙醇胺类化合物的合成及药理活性
第二章 烃化反应

(H3C)3 CX
欲制备:
B-
(H3C)3 C+
CH3
H3C C
O
H3C A B
CH3 C CH2 CH3
C2H5
A: (CH3)3CX+C2H5OH
B: (CH3)3COH + C2H5X
一 、醇的O-烃化
1 卤代烷为烃化剂 2 磺酸酯作烃化剂 3 环氧乙烷类作烃化剂 4 烯烃作为烃化剂 5 醇作为烃化剂 6 其它烃化剂
1.卤代烃为烃化剂 (1)反应通式
ArOH RX OH Ar O R X H2O
(3)应用
① 芳香脂肪醚的制备 镇痛药邻乙氧基苯甲酰胺的合成
CONH2 OH
EtBr/NaOH 80~100
CONH2 (75%)
OEt
镇痛药苄达明的合成
O Na
N N
Cl(CH2)3N(CH3)2/Xyl 125~128 ,7h
温-80。
(m、n、p均约为20)
一 、醇的O-烃化
1 卤代烷为烃化剂 2 磺酸酯作烃化剂 3 环氧乙烷类作烃化剂 4 烯烃作为烃化剂 5 醇作为烃化剂 6 其它烃化剂
4. 烯烃为烃化剂
醇可与烯烃双键进行加成反应生成醚, 但对烯烃双键旁边没有吸电子基团存在时,反应
不易进行。 只有当双键的位有羰基、氰基、酯基、羧基等存
② 酚的O-烃化反应
由于酚的酸性比醇强,所以反应更容易 进行,需要的碱相对醇的反应也较弱。
反应通常是通过SN2机理完成
2.碳负离子的亲核取代反应
碳负离子带有负电荷,具有很强的碱性 和亲核能力,可以和卤代烃等烃化试剂 发生取代反应,延长碳链。
其中碳负离子可以是炔基负离子,格氏 试剂中的烷基负离子及活泼亚甲基在碱 作用形成次甲基负离子。
有机化学基础知识点芳香化合物的合成方法

有机化学基础知识点芳香化合物的合成方法芳香化合物是有机化学中重要的一类化合物,具有芳香香气,广泛应用于医药、化妆品、食品和香精等领域。
本文将介绍芳香化合物的合成方法,包括碳氢化合物芳基化反应、烯烃的芳基化反应以及苯环的官能团转化等几个方面。
一、碳氢化合物芳基化反应碳氢化合物芳基化是一种重要的芳香化合物合成方法。
常见的碳氢化合物芳基化反应有酰基化反应、烃基化反应和氨基化反应等。
1. 酰基化反应酰基化反应是利用酰基试剂与芳香化合物反应,将酰基引入芳环上的一种方法。
一般情况下,酰基试剂可为酸酐或酸氯等,通过与芳环中的氢原子发生取代反应,形成酰基化合物。
例如,苯与酰氯反应可得到酰苯化合物。
2. 烃基化反应烃基化反应是利用烷基试剂与芳香化合物反应,将烷基引入芳环上的一种方法。
常用的烷基试剂有碱金属芳基化试剂(比如合成苯、合成萘)、卤代烷(比如溴化亚砜、溴化磷)等。
例如,苯与氯代甲烷反应可得到甲苯化合物。
3. 氨基化反应氨基化反应是利用胺试剂与芳香化合物反应,将氨基引入芳环上的一种方法。
常用的胺试剂有苯胺、N,N-二甲基甲酰胺等。
例如,苯与苯胺反应可得到二苯胺化合物。
二、烯烃的芳基化反应除了碳氢化合物芳基化反应,烯烃的芳基化反应也是一种重要的芳香化合物合成方法。
常见的烯烃的芳基化反应有氢氟酸催化的芳基化反应和偶联反应等。
1. 氢氟酸催化的芳基化反应氢氟酸催化的烯烃芳基化反应是将芳基引入烯烃单键上的一种方法。
一般情况下,烯烃与氢氟酸反应,通过氢氟酸对烯烃的亲核加成,形成碳正离子中间体,再进行芳位的亲电芳香亲核取代反应,最终得到芳基化合物。
2. 偶联反应偶联反应是利用有机金属试剂与烯烃反应,将芳环引入烯烃上的一种方法。
常见的有机金属试剂有有机铜试剂、有机锌试剂等。
例如,烯烃与有机锌试剂反应可得到芳基化合物。
三、苯环的官能团转化苯环的官能团转化是利用不同官能团对苯环进行的化学反应,通过改变苯环上的官能团来合成不同的芳香化合物。
精细有机合成技术:N-烷基化反应方法

(3)用酯作烷化剂的N-烷基化法 硫酸酯、磷酸酯和芳磺酸酯都是活性很强的烷基化剂,
其沸点较高,反应可在常压下进行。因酯类价格比醇和卤 烷都高,所以其实际应用受到限制。硫酸酯与胺类烷基化 反应通式如下:
硫酸中性酯易给出其所含的第一个烷基,而给出第二烷 基则较困难。常用的是硫酸二甲酯,但其毒性极大,可通过 呼吸道及皮肤进入人体,使用时应格外小心。用硫酸酯烷化 时,常需要加碱中和生成的酸,以便提高其给出烷基正离子 的能力。如对甲苯胺与硫酸二甲酯于50~60℃时,在碳酸钠、 硫酸钠和少量水存在下,可生成N,N-二甲基对甲苯胺,收率 可达95%。
精细有机合成技术 邹静
目
录
Contents
N-烷基化反应方法
1 2 3
用醇和醚作烷化剂的N-烷基化法 用卤烷作烷化剂的N-烷基化法 用酯作烷化剂的N-烷基化法
N-烷基化方法
(1)用醇和醚作烷化剂的N-烷基化法 用醇和醚作烷 化剂时,其烷化能力较弱,反应需在较强烈的条件下才能 进行。
用醇烷基化常用强酸(浓硫酸)作催化剂,其催化作 用是将醇子化,进而脱水得到活泼的烷基正离子R+。R+ 与胺氮原子上的孤对电子形成中间络合物,其脱去质子得 到产物。
苯胺进行甲基化时,若目的产物是一烷基化的仲胺, 则醇的用量仅稍大于理论量;若目的产物是二烷基化的 叔胺,则醇用量约为理论量140%~160%。即使如此,在 制备仲胺时,得到的仍是伯、仲、叔胺的混合物。用醇 烷化时,每摩尔胺用强酸催化剂0.05~0.3mol,反应温 度约为200℃左右,不宜过高,否则有利于芳环上的C-烷 化反应。苯胺甲基化反应完毕后,物料用氢氧化钠中和, 分出N,N-二甲基苯胺油层。再从剩余水层中蒸出过量的 甲醇,然后再在170~180℃,压力0.8~1.0MPa下使季胺 盐水解转化为叔胺。
烷基化反应的简介

C12H25OH + n CH2 CH2 O
C12H25O(CH2CH2O)n H
n=20~22
将辛基酚与其质量分数为1%的氢氧化钠水溶液混合,真空脱水,氮气 置换,于160~180℃通入环氧乙烷,经中和漂白,得到聚醚产品,其商品 名为OP型乳化剂。
用环氧乙烷o烷基化小结第二节烷基化反应的基本原理三n烷基化反应简介三n烷基化反应1n烷化剂2n烷化反应类型2n烷化反应类型3n烷基化方法3n烷基化方法小结第三节相转移烷基化反应一相转移催化c烷基化二相转移催化o烷基化三相转移催化n烷基化第四节应用实例alcl3法生产异丙苯异丙苯的生产小结吲哚和溴苄在季铵盐的催化下可高收率得到n苄基化产物
第七章 烷基化
第一节 概述
一、烷基化反应的简介 二、烷基化反应的类型
一、烷基化反应的简介
1.研究作用: 可以合成塑料、医药、溶剂、合成洗涤剂、药物、染料、香料、催化剂、 表面活性剂等功能性产品。如通过C—烷基化反应可制得阴离子表面活性剂; 通过O-烷基化可制得聚乙二醇型非离子表面活性剂;通过N-烷基化合成 的季铵盐是重要的阳离子表面活性剂、相转移催化剂、杀菌剂等。
NH2 + 2 CH3OH N(CH3)2
H2 SO4 210℃/3MPa
+ 2 H2O
作用下向芳环碳上引入 烷基生成烷基苯 C 烷基化反应:在催化剂 中的氮原子上引入烷基 生成伯、仲、叔、季铵 盐 N 烷基化反应:向氨或胺 O 烷基化反应:向醇、酚 中的氧原子上引入烷基 生成醚类化合物
CH 3
CH 3
烷基化反应的简介

R' NH2 + R
' R NHR + R
z
z
z
RNH2 + HZ
RNHR' + HZ
R2NR' + HZ
R2NR' + R
z
R3NR' +
+
z-
N-烷基化产物是制造医药、表面活性剂及纺织印染助剂时的重要中间体。 氨基是合成染料分子中重要的助色基团,烷基的引入可加深染料颜色,故N-
烷基化反应在染料工业有着极为重要的意义。
它们均是反应能力相对较弱的烷化剂,仅适用于活泼芳烃的C-烷基化, 如苯、萘、酚和芳胺等。
OH OH
+
Cat HCHO
CH 2OH
二、O-烷基化反应
醇羟基或酚羟基中的氢被烷基所取代生成醚类化合物的反应,称为O -烷基化反应。 常用的O-烷基化剂: 卤烷、酯及环氧乙烷等 被烷基化物:醇、酚 反应机理: 属亲电取代反应
CH 3
A
NO2
B
AlCl3 - H-Cl
CH 3 NO2
C
CH 3
+
CH 3Cl
D
结论:C > B > A >D
★ 2.烷基化试剂
主要有卤烷、烯烃和醇类,以及醛、酮类。 (1)卤烷: 卤烷(R-X)是常用的活性较强的烷化剂。
+
AlCl3 CH 3Cl
CH 3
+
H-Cl
不能用卤代芳烃(氯苯或溴苯)来代替卤烷作烷基化试剂实验。 原因: 连在芳环上的卤素受到共轭效应的稳定作用,其反应活性较低, 不能进行烷基化反应。 (2)烯烃 : 烯烃是另一类常用的活性较强的烷基化剂。
酰胺的α-氧化反应研究

either lack of effective procedure
to prepare starting materials,or incompatible
with
sensitive
functionalities due to the harsh conditions during these transformations,or
could
potentially be
carried
out in
In the
second
a—keto
part,we
developed
all
efficient procedure the
to
synthesize above N,
N-substituted
amides.Different
witll
as
preparation
yields under the atmosphere of air.The whole thesis In the first part,we
consists
of three parts:
described a
novel cesium carbonate/tetra-n-butylammoniurn
V
Abstract
a.Keto amides
are
valuable intermediates in organic synthesis.have intriguing
are
biological properties,and
present in many natural products硒main skeleton.The
经典的合成反应04
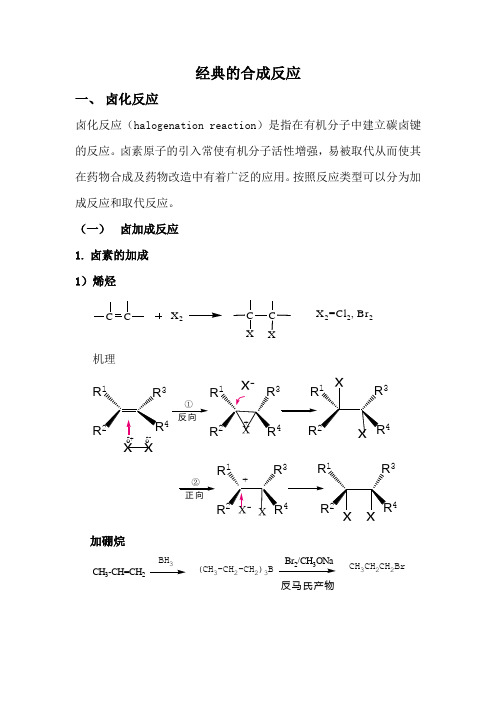
经典的合成反应一、 卤化反应卤化反应(halogenation reaction )是指在有机分子中建立碳卤键的反应。
卤素原子的引入常使有机分子活性增强,易被取代从而使其在药物合成及药物改造中有着广泛的应用。
按照反应类型可以分为加成反应和取代反应。
(一) 卤加成反应 1. 卤素的加成 1)烯烃CX 2C C XXX 2=Cl 2, Br 2机理x xR R 34RR 4334R R ①-R 1R4R 334R ②+加硼烷CH 3-CH=CH 2BH 3(CH 3-CH 2-CH 2)3B23CH 3CH 2CH 2Br反马氏产物C 6H 13C CHOBH O 70℃,2hC CC 6H 13HHO B 25℃,2hC CC 6H 13HHB(OH)2C CC 6H 13HHI90%I 2/NaOH/H 2O 2H 2O2)炔烃 得反式二卤烯烃C-CH 3CPh C-CH 3CPh C C PhC-CH 2OHCBr BrClClCH32LiBr Cl C C I H2OH I I 23)不饱和羧酸的卤内酯化反应CH 2COOHOOI2. 卤化氢的加成 1)卤化氢的亲电加成机理C R1R3+反向同向2)溴化氢的自由基加成反应CH 3CH=CH 2CH 3CHBrCH 3CH 3CH 2CH 2BrMarkovnikov 加成反Markovnikov 加成Ph-CH=CH 2HBrHBr H 2O 2或光照Ph--C-CH 3Ph-CH 2CH 2Br 反马氏规则3. 次卤酸(酯)、N-卤代酰胺加成1)次卤酸CCX 2CCX+H 2OHXX 2=Cl 2, Br 2+机理:C CR 1R 324C CR R 34 C CR 1R 34X OHXX-OHHBrOCl--OH2)N-卤代酰胺Ph-CH=CH 2Ph-CH - CH 2OHNBA(二) 卤代反应1.烃类 1)脂肪烃CH 2=CH-CH 3CH2=CH-CH 2Br NBSCH 2CH 2CH 32CH 3NBSBr2)芳烃 芳烃卤代反应 机理+E+Eπ-络合物HEE +H +σ-络合物HX X-H ++-σ-络合物举例:Cl CH 3+CH 3CH 3CH 3CH 3CH 3ClBr ++2.羰基化合物羰基化合物的卤代反应 机理OR R'δδC COHB COBHC C OCCOCC等于C O O HCOOHC O CHCOCH1)醛、酮α-H 卤代反应R- C - CH 3OR- C - CH 2Br O2亲电取代反应酸催化 CCHC CC CC CH OH碱催化C C H OH慢C C C C举例:O 2NC-CH 3O O 2NC-CH 2BrOHBrBr 2+氯霉素的制备溴对酮的加成C CH 2CH 2CH 3H 2C OHC CHCH 2CH 33COHCH 2CH 23BrH 2C OCH 2CH 2CH 3H Br HBr-Br 2C CH 2CH 2CH 32C OCHCH 2CH 3H 3C OBr+(1.5%)(58%)酮自由基反应(饱和烃、苄位和烯丙位的卤取代反应、某些不饱和烃的卤加成反应以及羧基、重碳基的卤置换反应) a-羰基自由基取代OCC O R'H R''R'''+Br 2+CC OR'Br R''R'''光Br 22Br光O +HBrOHBr2)羧酸衍生物的a 卤代反应CH 2COOHR CH COOHR3.醇、酚、醚的卤代反应 1)醇ROHRX HX(HI ﹥HBr ﹥HCl ﹥HF 叔﹥仲﹥伯)2)酚OHClBrClPh 3PBr 23)醚O 34ICH2CH2CH2CH2I4.羧酸1)羧羟基COOHNO2PCl5或 SOCl2COCl22)羧酸脱羧RCOOAg+X R-X CO2AgX Hundriecker反应++要求绝对无水RCOOH+HgO+x2R-X为特殊卤代烷提供制备方法O2N24O2N Br5.其他官能团的卤代反应1)卤化物ClCl2FCl22)磺酸酯R-OH H3C S ClOOHR O S CH3ONaI R-I3)芳香重氮盐化合物ArN2X 22Ar-X+N2 (X=Cl,Br)二、烃化反应(一)碳原子的烃化反应1.芳烃的烃化Friedel-Crafts 烷基化反应芳烃与卤代烃、醇类或烯类化合物在Lewis催化剂(如AlCl3,FeCl3, H2SO4, H3PO4, BF3, HF等)存在下,发生芳环的烷基化反应。
精细有机合成技术:N-烷基化反应

精细有机合成技术 邹静
目
录
Contents
N-烷基化反应
1 2
N-烷化剂 N-烷化反应类型
(2)卤烷类 如氯甲烷、氯乙烷、溴乙烷、苄氯、氯乙酸、 氯乙醇等。
(3)酯类 如硫酸二甲酯、硫酸二乙酯、对甲苯磺酸酯等。
(4)环氧类 如环氧乙烷,环氧氯丙烷等。 (5)烯烃衍生物类 如丙烯腈、丙烯酸、丙烯酸甲酯等。 (6)醛和酮类 如各种脂肪族和芳香族的醛、酮。
前三类反应活性最强的是硫酸的中性酯, 如硫酸二甲 酯;其次是卤烷;醇、醚类烷化剂的活性较弱,须用强酸 催化或在高温下才可发生反应。后三类的反应活性次序大 致为:环氧类>烯烃衍生物>醛和酮类。
N-烷基化反应
氨、脂肪胺或芳胺中氨基上的氢原子被烷基取代,或 通过直接加成而在上述化合物分子中的N原子上引入烷基 的反应均称为N-烷基化反应。
1.N-烷化剂
N-烷化剂是完成N-烷基化反应必需的物质,其种类和结 构决定着N-烷基化产物的结构。
(1)醇和醚类 如甲醇、乙醇、甲醚、乙醚、异丙醇、丁 醇等。
其反应可看作是胺对烷化剂的亲核加成、再消除、最后还原。 无论哪种反应类型,都是利用胺(氨)结构中氮原子上
孤对电子的活性来完成的。
感谢观看
2.N-烷化反应类型
N-烷基化反应依据所使用的烷化剂种类不同,可分为 如下三种类型:
(1)取代型 所用N-烷化剂为醇、醚、卤烷、酯类。
其反应可看作是烷化剂对胺的亲电取代反。
(2)加成型 所用N-烷化剂为环氧化合物和烯烃衍生物。 其反应可看作是烷化剂对胺的亲电加成反应。
《药物合成反应(闻韧主编第三版)》人名反应整理(新)

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
☆☆☆☆☆2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
☆☆3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
☆☆4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或直接将芳胺用亚硝酸钠和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
☆二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠、氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
☆☆☆☆6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,再经过肼解或酸水解即可得纯伯胺。
☆☆☆☆☆7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解即可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可对醛酮进行还原烃化,得各类胺。
☆9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
☆☆☆☆☆11、Hoesch反应(赫施反应):腈类化合物与氯化氢在Lewis酸催化剂ZnCl2等的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则得到羟基或烷氧基取代的芳香酮。
药物合成名词解释

名词解释1、苄位卤取代: 苄位氢原子被卤素原子取代2、烯丙位卤取代:烯丙位氢原子被卤素原子取代3、缺电子体系:含有空轨道的体系4、富电子体系:电子云密度高或含有未共用电子对的体系5、脱羧卤置换反响:羧酸脱去二氧化碳,生成比原产物少一个碳原子的卤代烃的反响6、卤交换反响:有机卤化物和无机卤化物之间进行卤素交换的反响7、 S N 1 反响:单分子亲核取代反响8、 S N 2 反响:双分子亲核取代反响9、 NBA : N- 溴代乙酰胺10、 t-BuOH :叔丁醇11、 t-BuOCl :次氯酸叔丁酯12、 n-BuLi :正丁基锂13、 Ni 2B(p-2) :在乙醇溶液中制备的硼化镍14、 TsCl :对甲苯磺酰氯15、 s-BuLi :仲丁基锂16、 i-PrOH :异丙醇17、释电子基:能增加相邻基团电子云密度的基团18、复原胺化反响:羰基与胺加成脱水成亚胺,再复原为胺类化合物19、吸电子基:能减少相邻基团电子云密度的基团20、反响机理:反响发生的机制和道理21、邻苯二甲酰亚胺制胺法:邻苯二甲酰亚胺和卤代烃在碱性条件下反响,然后肼解得伯胺的反响22、α-羟烷基化反响:含有活性α-氢原子的醛酮,在碱或酸的催化下发生缩合,生成β-羟基醛或酮类化合物的反响23、 Blanc 反响:芳烃在甲醛、氯化氢和路易斯酸或质子酸的存在下,在芳环上引入卤烷基的反响24、β-羟烷基化反响:活性化合物与环氧乙烷发生反响,生成β-羟烷基化产物25、羰基烃化反响:醛、酮的羰基复原为亚甲基的反响26、β-羰烷基化反响:α,β不饱和羰基化合物在碱性催化剂存在下与亲核试剂发生缩合生成β-羰烷基化类化合物27、双烯合成: 1, 3-丁烯衍生物和乙烯衍生物在加热情况下生成环己烯骨架的反响28、活性亚甲基:邻位具有羰基或其他强吸电子基的亚甲基结构29、单线态:两个价电子自旋方向相反时,此种分子状态为单线态30、三线态:两个价电子自旋方向相同时,此种分子状态为三线态31、 Wittig 试剂:卤代物与三苯膦在碱作用下形成磷内盐32、化学氧化:利用化学试剂进行氧化33、 Ac 2O:乙酸酐34、 (phCO) 2O:苯甲酸酐35、 AcCl :乙酰氯36、 Bn 2O2:过氧苄基醚37、 ArOH :芳香酚38、 SOCl 2:二氯亚砜39、 PE:石油醚40、 Et3N :三乙胺41、 Collins 氧化法:以三氧化铬吡啶复合物的二氯甲烷溶液作为氧化剂的方法42、 Jones 氧化法:以三氧化铬硫酸的丙酮溶液作为氧化剂的方法43、 DDQ 氧化法:以二氯二氰苯醌作为氧化剂的方法44、 Ag 2CO 3氧化法:以碳酸银作为氧化剂的方法45、 Al(O-i-Pr) 3:三异丙氧基铝46、 DMSO 氧化法:以二甲亚砜作为氧化剂的方法47、 LAH 复原法:以四氢铝锂作为复原剂的方法48、极性倒置:通过杂原子的交换、引入或添加,将某一合成子的正常极性转化成其相反的性质的过程49、 Clemmensen 复原法:锌汞齐盐酸反响将羰基复原成亚甲基的反响50、 Wolff复原法:肼在碱性条件下复原羰基成亚甲基的反响51、多相催化氢化:使用过渡金属等催化剂,使得不饱和烃加氢形成饱和烃的过程52、催化转移氢化:在催化剂的作用下,氢由氢的给体转移到有机化合物反响底物的反响53、 Rosenmund 反响:酰卤用催化氢化或金属氢化物选择性地复原为醛的反响54、 Dieckmann 反响:指二元羧酸的酯类在金属钠或醇钠作用下发生分子内的克莱森缩合反响,形成环状的β-酮酯55、质子酸:水溶液中能电离出质子的酸56、脱氢芳构化:使用氧化脱氢的方法使得脂肪族化合物转变成芳香族化合物的反响57、 Birch 复原:芳香族化合物在液氨中用钠复原,生成非共轭二烯的反响58、亲电重排:正性取代基向富电子原子上迁移的反响59、亲核重排:负性取代基向缺电子原子上迁移的反响60、单酐:相同酸脱水得到的酸酐61、混酐:不同种酸脱水形成的酸酐62、单醚:单一醇脱水生成的醚63、混醚:不同的烃基形成的醚64、酯交换反响:不同种酸脱水形成的酸酐65、 Oppenauer 氧化66、 Darzens 缩合67、 Knoevenagel 反响68、羰基烯化反响〔Wittig 反响〕69、 DMSO :二甲基亚砜70、 THF :四氢呋喃73、靶分子:但凡需要合成的有机分子。
有机化学基础知识芳香胺的合成和反应

有机化学基础知识芳香胺的合成和反应有机化学中,芳香胺是一类具有芳香环结构的胺物质。
它具有广泛的应用领域,包括医药、染料、合成材料等。
本文将介绍芳香胺的合成方法和一些常见的反应。
一、芳香胺的合成方法1. 氨基化反应氨基化反应是最常见的制备芳香胺的方法之一。
该方法通过芳香化合物与氨气在催化剂的作用下进行反应,生成相应的芳香胺。
催化剂常用的有铜催化剂、铂催化剂等。
2. 还原反应还原反应是另一种制备芳香胺的常用方法。
通常使用还原剂如亚磺酸盐或铁-氯化亚砜作为催化剂,使芳基的硝基化合物还原成相应的芳香胺。
3. 叠氮化反应叠氮化反应是一种将芳香胺转化为芳基叠氮盐的方法。
该反应可以通过在芳香胺溶液中加入硝酸钠等叠氮化合物来完成。
芳基叠氮盐是一类重要的中间体,可进一步用于合成其他有机化合物。
4. Ar-NH2衍生物的还原有时候我们可以通过芳基硝基化合物的还原来制备芳香胺。
硫酸亚铁等还原剂能将芳香硝基衍生物还原成相应的芳香胺。
二、芳香胺的反应1. 古典Schotten-Baumann反应Schotten-Baumann反应是一种芳香胺与酸酐反应的常用方法。
通过该反应,可以制备芳香胺的酰胺衍生物。
反应中常使用的酸酐有乙酰氯、苯酰氯等。
2. 叔胺化反应叔胺化反应是一种将芳香胺转化为N,N-二芳基胺的方法。
通过将芳香胺与叔胺类化合物反应,可以得到其相应的叔胺化物。
3. 氨基阴离子取代反应芳香胺具有亲核性,可以与烯烃或卤代烃等亲电性物质发生取代反应。
通过该反应,可以引入不同的官能团到芳香胺分子上,从而得到其相应的取代产物。
4. 氧化反应芳香胺也可以发生氧化反应。
常见的氧化剂有过氧化氢、高碘酸钠等。
该反应可以将芳香胺氧化为相应的亚硝基化合物或苯醌等。
综上所述,芳香胺是有机化学中重要的化合物之一,具有广泛的应用前景。
了解芳香胺的合成方法和反应规律对于有机化学领域的研究和应用具有重要意义。
这些方法的研究和应用不仅有助于我们更好地理解有机化学的基础知识,还可以为相关领域的研究和应用提供有力支持。
芳胺及芳烃胺类药物的分析

③ 具有酯的结构,容易水解。
④ 紫外吸收 具有苯环结构,有紫外吸收。
三、鉴别反应
1、重氮化-偶合反应 具有芳伯氨基药物,如盐酸普鲁卡因等,
在酸性溶液中与NaNO2TS发生重氮化反 应,再与碱性-萘酚偶合产生红色偶氮 化合物。
具有潜在芳伯氨基,如对乙酰氨基酚, 水解后可得芳伯氨基,能发生类似反应。
芳胺类药物指氨基直接与苯环相连。
芳烃胺类药物指氨基在烃基侧链上。
芳胺类* : 酰胺类、对氨基苯甲酸酯类 苯乙胺类 氨基醚衍生物
第一节 芳胺类药物的分析
一、酰胺类
1.结构特点:
R3
R1
NH C R2
O
R4
苯胺酰基衍生物,酰胺基邻位 或对位有取代基。
代表药物有:
NHCOCH3 OH
NHCOCH2N(C2H5)2
1.亚硝酸钠滴定法 ① 原理 具有芳伯氨基药物,在酸性条件下与
具有酰胺结构,被H2O2氧化成羟肟酸,羟肟 酸与FeCl3反应生成紫红色羟肟酸铁,随即 变为暗棕色至棕黑色。如盐酸普鲁卡因胺。
NH2
NH2
NH2
H2O2
FeCl3
Fe
CONHCH2CH2N(C2H5)2
CON(OH)CH2CH2N(C2H5)2
CONOCH2CH2N(C2H5)2 3
具有酰胺结构的药物
NH2
COOCH2CH2N(C2H5)2
NaOH
+ HOCH2CH2N(C2H5)2
可使湿润的红色石蕊试纸变蓝
COONa
HCl N H2
HCl
NH2 .HCl
COOH 白色
CO OH
三 杂质检查
1、对乙酰氨基酚杂质检查
有机化学之胺类化合物

sp3 N H3C
112.9 H
o
三甲铵(俗名胆碱)
105.9
o
R1 R2 N R3 N
R1 R2
H
脂肪胺:
R3
1.氮原子为SP3杂化,分子呈棱椎状,键角略小于109.5°
2.一对弧对电子占据一个SP3杂化轨道,在棱椎的顶点,压缩了
其它三个键, 孤电子对使胺具有亲核性、碱性.
3.如果氮原子连有三个不同基团,理论上似应有手性,存在对映
R NH3Cl
+ NaOH
RNH2 + Cl + H2O
胺的碱性强弱 A、碱性强度:脂肪胺 > 氨 > 芳香胺
CH3NH2
PKb
(CH3)2NH 3.27
(CH3)3N 4.21 CH3 8.92
NH3 4.76 NH2
NH2 9.37
3.38 O2N
NH2 13.0
B、脂肪胺 •在气态时碱性: (CH3)3N > (CH3)2NH > CH3NH2 > NH3 •在水溶液中碱性: (CH3)2NH > CH3NH2 > (CH3)3N > NH3 原因: •气态时,仅有烷基的供电子效应,烷基越多,供电子效应越大。 •在水溶液中,碱性的强弱决定于电子效应、溶剂化效应等。 溶剂化效应——铵正离子与水的溶剂化作用(胺的氮原子上的氢与水形成氢 键的作用)。胺的氮原子上的氢越多,溶剂化作用越大,铵正离子越稳定, 胺的碱性越强。
• 物理性质
1 存在状态:常温下,甲胺、二甲胺、三甲胺为气体,其余低 级脂肪胺为液体。十二胺以上为固体。
2 胺有不愉快难闻的气味,低级胺有臭鱼腥味 3 除叔胺外, 10 胺、20胺能形成分子间氢键。(N-H· · · N)弱于 (O-H· · · O)。其沸点高于分子量相近的非极性化合物,低于醇。
苯胺自由基偶联反应及其取代基效应的研究

Study on the Free Radical Self-coupling Reaction of Anilines and Its SubstituentEffectA Thesis Submitted to Chongqing Universityin Partial Fulfillment of the Requirement forMaster’s Degree of EngineeringByLing XuegeSupervised by Prof. Xiong YanSpecialty: ME(Chemical Engineering Field)School of Chemistry and Chemical Engineering of ChongqingUniversity, Chongqing, ChinaMay, 2014中文摘要摘要联苯胺衍生物是非常重要的有机化学品,广泛用于染料、检测着色剂、有机分子机器以及有机功能材料等领域。
高效便捷地合成多种类联苯胺衍生物是当前的研究热点之一。
过渡金属铁相对于其他贵金属,具有廉价、相对稳定、毒性低、环境友好等特点,积极地探索铁参与的有机合成新策略也成为了当前有机合成的迫切需要。
本文系统地研究了铁促进苯胺自由基偶联反应及其取代基效应,旨在发展一种便捷,有效的合成方法,将一系列结构多样性的苯胺转变成对应联苯胺。
本文主要研究了六水三氯化铁(FeCl3·6H2O)促进仲芳胺和叔芳胺发生氧化自偶联反应,得到一系列联苯胺产品。
同时在研究过程中,通过调节反应条件,高选择性地实现了N-甲基迁移反应,获得了一系列二苯甲烷类化合物。
实验过程中,我们对反应温度,溶剂,氧化剂种类及用量等反应条件进行了优化,研究了底物的电子效应、取代基效应、空间效应等对反应活性的影响,考察了反应底物的广普性。
在反应过程中,通过延长反应时间到24小时,高选择性的得到了间乙氧基取代N,N-二苄基芳胺三聚反应产物,产率达52%。
(7)烷基化反应

OH
(CH ) SO /NaOH
COOCH3 S O N O CH3
水 -乙醇介质 , 20 C,10h
(医 药 中 间 体 )
Cl
N a 2 CO 3
Cl
+
N H2
(C H 3 O ) 2 S O 2
5 0 -6 0 C N (C H 3 ) 2
o
y=95%
27
Cl
C H 2C l +
Z nC l 2 Cl 85-90 C
o
CH2
7.2.6 醇对芳烃的C-烷化 它是弱的烷化剂,主要用于活泼芳香族衍生物的烷基化 (苯、萘、酚、芳胺等)。 在酸性催化剂作用下,温度不太高(200-250℃),醇先与芳 胺发生N-烷基化反应,温度再升高(240-300℃)烷基转移, 生成烷基芳胺。
10
7.2.7 醛、酮对芳烃的C-烷化 1)甲醛与芳环反应可制得一系列的对称二芳甲烷衍生物,而 苯甲醛则可得到一系列三芳甲烷衍生物。
11
12
13
C C l3
酸催化剂
C C l3 H 3C H 3C C H
(农药和医药中间体)
C H
O + 2
CH3 + H 2O CH3
O 浓 H 2S O 4
18
2)反应特点 胺类用醇进行的烷基化反应为亲电取代反应,胺的碱性越强,反 应越容易进行。 芳香族胺类,环上的给电子基团使芳胺易烷基化,环上的吸电子 基团使烷基化变困难。 胺类用醇的烷基化反应是连串反应和可逆反应 。
是可逆的连串反应,苯胺用甲醇N-甲基化时,K1和K2都大于200, 而且K2/ K1≈1000,所以只要用适当过量的甲醇,就可以使苯胺完 全转化为N,N-二甲基苯胺。
苄基苯乙胺类生物碱的药理研究进展

苄基苯乙胺类生物碱的药理研究进展
郑颖;丁立生
【期刊名称】《天然产物研究与开发》
【年(卷),期】2009(021)B10
【摘要】苄基苯乙胺类生物碱主要分布于石蒜科植物中,是具有较强生物活性的一类重要生物碱。
本文概述了近年来对该类生物碱的药理活性的研究进展。
【总页数】4页(P532-535)
【作者】郑颖;丁立生
【作者单位】中国科学院成都文献情报中心,成都610041;中国科学院成都生物研究所,成都610041
【正文语种】中文
【中图分类】R962
【相关文献】
1.苄基四氢异喹啉类生物碱的药理作用及其研究进展 [J], 赵娜;高峰;刘彬;朴贤美
2.N-芳烷基取代苯乙醇胺类化合物的合成及药理活性 [J], 黄惠琴;赵冬梅;赵丽琴
3.苄基异喹啉类生物碱的药理活性研究进展 [J], 李丹;蒋建勤
4.双苄基异喹啉类生物碱的药理活性研究进展 [J], 孟雪莲;李超;王姝;陈长兰
5.苄基苯乙胺类生物碱的植物化学研究进展 [J], 郑颖;刘鑫;丁立生
因版权原因,仅展示原文概要,查看原文内容请购买。
常见人名反应及机理
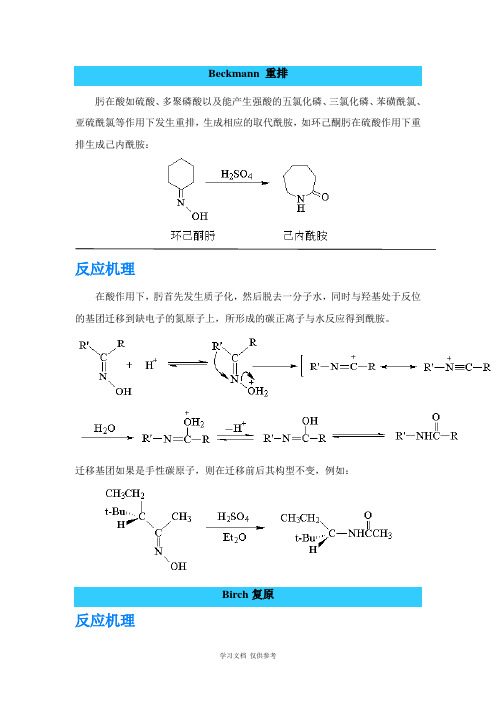
Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:Birch复原反应机理Cannizzaro 反应反应机理Claisen 酯缩合含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
二元羧酸酯的分子内酯缩合见Dieckmann 缩合反应。
反应机理乙酸乙酯的α-氢酸性很弱〔pKa-24.5),而乙醇钠又是一个相对较弱的碱〔乙醇的pKa~15.9〕,因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。
所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。
Claisen_Schmidt反应一个无α-氢原子的醛与一个带有α-氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到α,β-不饱和醛或酮:反应机理Clemmensen复原醛类或酮类分子中的羰基被锌汞齐和浓盐酸复原为亚甲基:此法只适用于对酸稳定的化合物。
对酸不稳定而对碱稳定的化合物可用Wolff-Kishner-黄鸣龙反应复原。
Cope重排1,5-二烯类化合物受热时发生类似于O-烯丙基重排为C-烯丙基的重排反应(Claisen重排)反应称为Cope重排。
这个反应30多年来引起人们的广泛注意。
1,5-二烯在150—200℃单独加热短时间就容易发生重排,并且产率非常好。
Cope重排属于周环反应,它和其它周环反应的特点一样,具有高度的立体选择性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
收稿日期:1999204226 1通讯联系人 现址:中国医学科学院药物研究所,北京1000502中国医科大学药理教研室,沈阳110003N 2芳烷基取代苯乙醇胺类化合物的合成及药理活性黄惠琴1 赵冬梅 赵丽琴 张雅芳 沈建民 王玉萍2(沈阳药科大学合成二室,沈阳110015)摘 要 以β22肾上腺素受体激动剂福莫特罗为原型化合物,合成了9个N 2芳烷基取代苯乙醇胺类化合物,除化合物HQ 03外,其余8个化合物均未见文献报道.初步药理实验结果表明:部分化合物具有较强的生物活性.关键词 哮喘;β22肾上腺素受体激动剂;N 2芳烷基取代苯乙醇胺;福莫特罗支气管哮喘(简称哮喘)是当今世界上最常见的慢性气道炎症性疾病.具不完全统计,全世界约有1亿以上的哮喘患者,我国至少也有1~2千万人患有此病,因此,哮喘病的防治就成为各国学者共同关心的重大课题.近年来对新型长效β22肾上腺素受体激动剂福莫特罗(formoterol )进行的基础和临床研究发现福莫特罗具有支气管扩张作用强、维持时间长、副作用少等特点,并可能具有降低气道非特异性超敏反应的作用〔1~3〕,是治疗哮喘急性发作的首选药物,尤其适用于治疗夜间发作性哮喘.有文献报道〔3~4〕,福莫特罗侧链N 2芳烷基结构不同于大多数短效β22受体激动剂的N 2烷基结构,具有较强的亲脂性,大大增进了其与β22受体的相互作用,对其药理活性的研究具有十分重要的意义.为了寻找新药,在研制开发福莫特罗的基础上,以β22肾上腺素受体激动剂福莫特罗为原型化合物,保留其分子结构中的侧链N 2芳烷基结构,改变母环部分,设计合成了9个福莫特罗类似物并进行了药理活性筛选.其合成路线见图1.所合成的9个目标化合物除化合物HQ 03外,其余8个均未见文献报道.Fig 11 The route of synthesis第9卷第3期1999年9月 总33期中国药物化学杂志Chinese Journal of Medicinal Chemistry Vol 19No 13p.196Sep 11999Sum 1331 合成实验波谱数据分别用IFS 255傅立叶红外光谱仪,ARX 2300核磁共振仪,DX J 2300质谱仪测定;熔点用毛细管法测定,温度未经校正.111 12(42氨基23,52二溴苯基)222〔N 2〔12甲基222(42甲氧基苯基)乙基〕氨基〕乙酮氢溴酸盐(5)的制备将310g (810mmol )42氨基23,5,α2三溴苯乙酮溶于40mL 氯仿中,回流下滴加113g(810mmol )12对甲氧基苯基222丙胺,滴毕,继续反应4h.冷却,析出固体,抽滤,氯仿洗涤,干燥,得中间体(5)110g 白色粉末状固体,收率:3011%,mp 228~230℃.其它中间体化合物(1)~(4)按同法制备,它们的mp 和收率分别为:170~180℃(1812%);202~204℃(2112%);220℃分解(1718%);218~220℃(3011%).112 12(42氨基23,52二溴苯基)222〔N 2〔12甲基222(42甲氧基苯基)乙基〕氨基〕乙醇单盐酸盐(HQ 05)的合成将110g (211mmol )化合物(5)悬浮于30mL 乙醇(95%)中,搅拌下分小批量加入011g 硼氢化钾,室温反应2h.回收乙醇,剩余物用2mol/L 盐酸酸化至p H 2~3,乙酸乙酯提取,无水硫酸钠干燥.回收乙酸乙酯得浅黄色油状物,该油状物用30mL 无水乙醚溶解,通干燥氯化氢气体,析出固体.异丙醇重结晶得110g 白色粉末状固体(HQ 05).收率:9110%,mp 112~115℃.化合物(HQ 01~HQ 04)按同法合成.113 12对硝基苯基222溴乙醇(6)的制备310g (12mmol )42硝基2α2溴苯乙酮悬浮于20mL 甲醇中,维持内温不超过30℃,分小批量加入113g 硼氢化钾固体,加毕继续反应2h.用2mol/L 盐酸酸化至p H 2,抽滤,滤饼水洗至中性,95%乙醇重结晶得黄色固体211g.收率:6710%,mp 84~86℃.同法制备化合物(7)和(8),化合物(7)为淡黄色油状物,收率为7317%;化合物(8)也为淡黄色油状物,收率为6610%.114 12(42硝基苯基)222〔N 2〔12甲基222(42甲氧基苯基)乙基〕氨基〕乙醇盐酸盐(H Q07)的合成210g (8.1mmol )12对硝基苯基222溴乙醇,218g (16mmol )12对甲氧基苯基222丙胺,40mL 乙醇混合,回流反应8h.回收乙醇得油状物,加入10mL 无水乙醚,过滤除去不溶物.向滤液中滴加氯化氢的异丙醇溶液,析出固体.抽滤,异丙醇重结晶得213g 黄色粉末状固体(HQ 07).收率:6410%,mp 198~200℃.同法合成化合物(HQ 08),(HQ 09).熔点及收率见表1.115 12(42氨基苯基)222〔N 2〔12甲基222(42甲氧基苯基)乙基〕氨基〕乙醇单盐酸盐(HQ 06)的合成于装有机械搅拌的250mL 三颈瓶中,依次加入310g (816mmol )化合物(HQ 07),30mL 甲醇,310g (53mmol )还原铁粉,加热回流下滴加2mol/L 盐酸10mL ,滴毕,继续反应3h.抽滤,滤液用氨水调p H 8~9,过滤,除去不溶物,滤液旋转蒸发除去甲醇,残液用乙酸乙酯提取,无水硫酸钠干燥.回收乙酸乙酯得淡黄色油状物,加入20mL 无水乙醚溶解,滴加氯化氢的异丙醇溶液,析出固体,用异丙醇重结晶得018g 黄色粉末状固体(HQ 06).收率:2910%,mp 180~185℃.所合成的目标化合物的理化常数及波谱数据见表1.7913期黄惠琴等:N 2芳烷基取代苯乙醇胺类化合物的合成及药理活性2 药理实验使用台式平衡记录仪、拉力换能器等仪器.条件:克2亨氏营养液、95%氧气和5%二氧化891中国药物化学杂志9卷碳混合气体、生理盐水;纸速:4mm/min ;负荷为2g ;温度恒定在37℃.豚鼠(350~500g ),雌雄兼用.10-5mol/L 氯化乙酰胆碱生理盐水溶液.目标化合物:HQ 01~HQ 09,实验前用生理盐水溶液配成10-3mol/L 溶液(生理盐水不溶的样品,先用DMSO 溶解,然后以生理盐水稀释),生理盐水为对照.采用离体豚鼠气管螺旋条法,观察被试样品对氯化乙酰胆碱所致离体气管收缩的拮抗作用,结果见表2.计算出目标化合物对氯化乙酰胆碱所致离体气管收缩的解痉百分率:解痉百分率(%)=给药前曲线高度-给药后曲线高度给药前曲线高度×100%T ab.2 The effects of the target compounds on airw ay smooth muscles of isolated guinea pigsCompd.(HQ -)010203040506070809Conc.(×10-5)11514125101075504035Spasmolysis (%)1861616173200125110251140 初步药理活性筛选试验结果表明:9个目标化合物中有8个对离体豚鼠气管平滑肌痉挛具有松驰作用;目标化合物的活性受母体苯环上取代基的影响,当母体苯环上取代基体积较小时,活性较强,如HQ 01>HQ 03;当母体苯环上取代基吸电性较强(HQ 07,HQ 02)或体积较大(HQ 09)时,活性较弱或几乎没有活性;同时,HQ 04作用最强,肯定了药物化学上拼合原理(克仑特罗的母环,福莫特罗的氨基侧链);HQ 05活性较好,亦说明电子等排原理在药物化学上的作用;同时还发现母环上无任何取代基的HQ 01活性较强.所合成的目标化合物还有待于进一步复筛,以肯定其平喘活性,并为探讨其构效关系、作用机制提供依据.目前,这些化合物的进一步生物活性实验正在进行当中.参 考 文 献1 Decker N ,Quennedey MC ,Rouot B ,et al.Effects of N 2aralkyl substitution of the bete 2agonist on alphe 2and bete 2adrenoceptor subtypes :pharmacological and binding assays.J Pharm Pharmacol ,1982,34(2):107~1122 Tasaka T.Formoterol (Atock ):A new active and selective bete 2receptor stimulant.Drugs Today ,1986,22(3):505~5093 Anderson GP.Formoterol :Pharmacology molecular basis of agonism and mechanism of long duration of a highly potent and se 2lective β22adrenoceptor agonist bronchodilator.Life Sciences ,1993,52(26):2145~21604 Anderson GP ,Linden A ,Rabe KF.Why are long 2actig bete 2adrenoceptor agonist long 2acting ?Eur Respir J ,1994,7(3):504~509The Synthesis of N 2aralkyl Substituted Phenoethanol Aminesand Studies on Their Pharmacological ActivitiesHuang Huiqin ,Zhao Dongmei ,Zhao Liqin ,Zhang Yafang ,Shen Jianmin(S henyang Pharm aceutical U niversity ,S henyang 110015)Abstract Nine N 2aralkyl substituted phenoethanol amines were designed and synthesized in this paper.All of them have not been reported in literature except for HQ 03.Pharmacological tests showed that eight target compounds had action on the contracting smooth muscles of guinea 2pigs ,and HQ 01,03,04were the most potent compounds.K ey w ords asthma ;β22adrenoreceptor agonist ;N 2aralkyl substituted phenoethanol amine ;for 2moterol 9913期黄惠琴等:N 2芳烷基取代苯乙醇胺类化合物的合成及药理活性。
