磁珠法分离纯化DNA原理及其步骤
磁珠纯化dna步骤

磁珠纯化dna步骤
磁珠纯化DNA是一种常见的DNA提取和纯化方法。
以下是通用的磁珠纯化DNA的步骤:
1. 样品准备:将DNA样品稀释到合适的浓度,通常用Tris-EDTA缓冲液(TE缓冲液)稀释。
2. 磁珠制备:将磁珠固定在磁板上,并加入磁珠结合缓冲液,使磁珠悬浮在缓冲液中。
3. 靶标捕获:将DNA样品加入磁珠结合缓冲液中,使DNA 与磁珠结合。
4. 磁珠分离:将磁板放在磁力板上,吸附磁珠到磁板上,使用磁力将磁珠分离至磁力板内壁,将上清液丢弃。
5. 洗涤:将洗涤缓冲液加入到分离后的磁珠上,重复磁珠分离步骤,以去除杂质。
6. DNA洗脱:将洗脱缓冲液加入到磁珠上,使磁珠中的DNA 与洗脱缓冲液中的物质交换,并离开磁板。
7. 验证DNA纯化:使用DNA定量方法(如紫外吸收光谱或荧光定量)检查纯化后的DNA浓度和质量。
注意:具体步骤可能会因不同厂商提供的试剂盒和设备而有所不同。
请根据所使用的具体试剂盒和设备的说明进行操作。
磁珠法提取dna原理

磁珠法提取dna原理
磁珠法提取DNA原理是利用磁性珠子及其表面修饰的特定分子与DNA之间的亲和性来实现DNA的富集和分离。
具体原理如下:
1. 磁性珠子的选择:选择具有一定磁性的微米级珠子作为DNA富集的固相载体。
这些磁性珠子通常由磁性材料(如Fe3O4)制成,可以通过磁力来进行分离和收集。
2. 磁性珠子表面修饰:在磁性珠子表面修饰特定的分子,通常是寡核苷酸(如单链DNA、RNA或寡聚核苷酸)或核酸结合蛋白,使其具有与目标DNA相互作用的能力。
修饰的分子上还可以加入亲和标记物(如亲和素或抗体),以便进一步增强富集效果。
3. DNA结合:将修饰后的磁性珠子与DNA样品混合,通过与DNA靶标相互作用,使目标DNA与磁性珠子表面的修饰分子结合,并形成稳定的DNA-珠子复合物。
4. 分离和富集:在结合后,应用外加的磁场或磁力来分离磁性珠子及其结合的DNA-珠子复合物。
由于磁性珠子的磁性,可以迅速将其吸附到反应容器的侧壁上,然后将上清液排除,实现DNA的富集和纯化。
5. 磁珠洗脱:在磁性珠子上吸附的DNA可以通过改变离心管内磁场或洗涤条件来洗脱,得到纯化的DNA产物,然后可以进一步进行下游分析,如PCR扩增、测序等。
总之,磁珠法通过磁性珠子的特性以及表面修饰分子与DNA之间的亲和性,实现了对DNA的高效富集和纯化,成为DNA提取和纯化领域中常用的方法。
磁珠法分离纯化DNA原理及其步骤

磁珠法分散杂化DNA本理及其步调之阳早格格创做日期:2012-05-22 根源:互联网标签:核酸杂化核酸分散磁珠法杂化DNA纲要 : 磁珠法杂化DNA主假如利用本钱接换吸附资料吸附核酸,进而将核酸战蛋黑量等其细胞中其余物量分散.本文主要概括了磁珠法杂化DNA本理、核酸分散与杂化的准则、核酸分散与杂化的步调.欢度大举神杯之夏,介进BRAND竞猜活动,获赠BRAND 产品!GeneCopoeia:qPCR mix免费试用感受活动启初!磁珠法杂化DNA主假如利用本钱接换吸附资料吸附核酸,进而将核酸战蛋黑量等其细胞中其余物量分散.本文主要概括了磁珠法杂化DNA本理、核酸分散与杂化的准则、核酸分散与杂化的步调.磁珠法杂化DNA本理磁珠法核酸杂化技能采与了纳米级磁珠微珠,那种磁珠微珠的表面标记表记标帜了一种官能团,能共核酸爆收吸附反应.硅磁(Magnetic Silica Particle)便是指磁珠微珠表面包裹一层硅资料,去吸附核酸,其杂化本理典型于玻璃奶的杂化办法.离心磁珠是指磁珠微珠表面包裹了一层可爆收离心接换的资料(如DEAE,COOH)等,进而达到吸附核酸脚段.分歧本量的磁珠微珠所对于应的杂化本理是纷歧致.使用磁珠法去杂化核酸的最大便宜便是自动化.磁珠正在磁场条件下不妨爆收汇集或者分别,进而可真足解摆脱心等所需的脚工支配过程.Omega拥有周到的磁珠法核酸分散试剂盒,鉴于那种技能的试剂盒,称呼前皆有’Mag-Bind’.核酸分散与杂化的准则核酸正在细胞中经常与百般蛋黑量分散正在所有的.核酸的分散主假如指将核酸与蛋黑量、多糖、脂肪等死物大分子物量分启.正在分散核酸时应按照以下准则:包管核酸分子一级结构的完备性:排除其余分子传染.核酸分散与杂化的步调大普遍核酸分散与杂化的要领普遍皆包罗了细胞裂解、酶处理、核酸与其余死物大分子物量分散、核酸杂化等几个主要步调.每一步调又可由多种分歧的要领单独或者共同真止.1. 细胞裂解:核酸必须从细胞或者其余死物物量中释搁出去.细胞裂解可通过板滞效用、化教效用、酶效用等要领真止.(1) 板滞效用:包罗矮渗裂解、超声裂解、微波裂解、冻融裂解战颗粒破碎等物理裂解要领.那些要领用板滞力使细胞破碎,但是板滞力也可引起核酸链的断裂,果而没有适用于下分子量少链核酸的分散.有报导超声裂解法提与的核酸片段少度从< 500bp ~ > 20kb 之间,而颗粒匀浆法提与的核酸普遍< 10kb.(2) 化教效用:正在一定的p H 环境战变性条件下,细胞破裂,蛋黑量变性重淀,核酸被释搁到火相.上述变性条件可通过加热、加进表面活性剂(SDS、Triton X-100 、Tween 20 、NP-40 、CTAB、sar-cosyl 、Chelex-100 等) 或者强离子剂(同硫氰酸胍、盐酸胍、肌酸胍) 而赢得.而p H 环境则由加进的强碱(NaOH) 或者慢冲液 ( TE、STE 等) 提供.正在一定的p H 环境下,表面活性剂或者强离子剂可使细胞裂解、蛋黑量战多糖重淀,慢冲液中的一些金属离子螯合剂( EDTA 等) 可螯合对于核酸酶活性所必须的金属离子Mg2+ 、Ca2+ ,进而压造核酸酶的活性,呵护核酸没有被落解.(3) 酶效用:主假如通过加进溶菌酶或者蛋黑酶(蛋黑酶K、动物蛋黑酶或者链酶蛋黑酶) 以使细胞破裂,核酸释搁.蛋黑酶还能落解与核酸分散的蛋黑量,促进核酸的分散.其中溶菌酶能催化细菌细胞壁的蛋黑多糖N-乙酰葡糖胺战N-乙酰胞壁酸残基间的β-(1 ,4) 键火解.蛋黑酶K能催化火解多种多肽键,其正在65 ℃及有EDTA、尿素(1~4mol/ L) 战去污剂(0. 5 %SDS 或者 1 %Triton X-100) 存留时仍死存酶活性,那有好处普及对于下分子量核酸的提与效用.正在本量处事中,酶效用、板滞效用、化教效用时常共同使用.简曲采用哪种或者哪几种要领可根据细胞典型、待分散的核酸典型及后绝真验脚段去决定.2. 酶处理:正在核酸提与历程中,可通过加进适合的酶使没有需要的物量落解,以好处核酸的分散与杂化.如正在裂解液中加进蛋黑酶(蛋黑酶K 或者链酶蛋黑酶) 不妨落解蛋黑量,灭活核酸酶(DNase 战RNase) ,DNase 战RNase 也用于去除没有需要的核酸.3. 核酸的分散与杂化:核酸的下电荷磷酸骨架使其比蛋黑量、多糖、脂肪等其余死物大分子物量更具亲火性,根据它们理化本量的好别,用采用性重淀、层析、稀度梯度离心等要领可将核酸分散、杂化.(1) 酚提与/ 重淀法:核酸分散的一个典范要领是酚∶氯仿抽提法.细胞裂解后离心分散含核酸的火相,加进等体积的酚∶氯仿∶同戊醇(25 ∶24 ∶1 体积) 混同液.依据应用脚段,二相经漩涡振荡混匀(适用于分散小分子量核酸) 或者简朴颠倒混匀(适用于分散下分子量核酸) 后离心分散.疏火性的蛋黑量被调配至有机相,核酸则被留于表层火相.酚是一种有机溶剂,预先要用STE 慢冲液鼓战,果已鼓战的酚会吸支火相而戴走一部分核酸.酚也易氧化收黄,而氧化的酚可引起核酸链中磷酸二酯键断裂或者使核酸链接联:故正在造备酚鼓战液时要加进82羟基喹咛,以预防酚氧化.氯仿可去除脂肪,使更多蛋黑量变性,进而普及提与效用.同戊醇则可缩小支配历程中爆收的气泡.核酸盐可被一些有机溶剂重淀,通过重淀可浓缩核酸,改变核酸溶解慢冲液的种类以及去除某些杂量分子.典型的例子是正在酚、氯仿抽提后用乙醇重淀,正在含核酸的火相中加进p H5. 0~5. 5 ,末浓度为0. 3M 的NaOAc 或者KOAc 后,钠离子会中战核酸磷酸骨架上的背电荷,正在酸性环境中促进核酸的疏火复性.而后加进2~2. 5 倍体积的乙醇,经一定时间的孵育,可使核酸灵验天重淀.其余的一些有机溶剂[ 同丙醇、散乙二醇( PEG) 等]战盐类(10. 0mol/ L 醋酸铵、8. 0mol/ L 的氯化锂、氯化镁战矮浓度的氯化锌等) 也用于核酸的重淀.分歧的离子对于一些酶有压造效用或者可效用核酸的重淀战溶解, 正在本量使用时应给予采用.经离心支集,核酸重淀用70 %的乙醇漂洗以与消多余的盐分,即可赢得杂化的核酸.(2) 层析法:层析法是利用分歧物量某些理化本量的好别而建坐的分散分解要领.包罗吸附层析、亲战层析、离子接换层析等要领正在内的层析法.果分散战杂化共步举止,而且有商品试剂盒供应,而被广大应用于核酸的杂化.正在一定的离子环境下,核酸可被采用性天吸附到硅土、硅胶或者玻璃表面而与其余死物分子分散.其余一些采用性吸附要领以经建饰或者包被的磁珠动做固相载体,磁珠可通过磁场分散而无需离心,分散至固相载体的核酸可用矮盐慢冲液或者火洗脱.该法分散杂化核酸,具备品量佳、产量下、成本矮、赶快、烦琐、节省人力以及易于真止自动化等便宜.玻璃粉或者玻璃珠被证据为一种灵验的核酸吸附剂.正在下盐溶液中,核酸可被吸附至玻璃基量上,离液盐碘化钠或者下氯酸钠可促进DNA 与玻璃基量的分散.Dederich 等用酸洗玻璃珠分散杂化核酸,赢得下产量的量粒DNA.正在该要领中,细胞正在碱性环境下裂解,裂解液用醋酸钾慢冲液中战后,间接加至含同丙醇的玻璃珠滤板,被同丙醇重淀的量粒DNA 分散至玻璃珠,用80 %乙醇真空抽洗与消细胞残片战蛋黑量重淀.末尾用含RNase A 的TE 慢冲液洗脱与玻璃珠分散的DNA ,赢得的DNA 可间接用于测序.Elkin 等使用羧化磁珠分散杂化量粒DNA.该法正在细胞裂解后,离心分散含量粒的火相,再加进羧化的磁粒,而后用PEG/ NaCl 重淀,使脚段DNA 吸附至磁珠,末尾磁场分散被吸附的DNA ,经乙醇洗涤,用火洗脱,可赢得下产量的适用于毛细管测序的模板DNA.也有用铁粒为固相支援物,经磁场分散而杂化量粒DNA 的报导.细菌用溶菌酶2煮沸法裂解,量粒被释搁至悬浮液中, 加铁珠捕获,用磁场使铁珠分散,经漂洗后用火洗脱量粒,可赢得下产量、测序级的量粒DNA.亲战层析是利用待分散物量与它们的特同性配体间所具备的特同性亲战力去分散物量的一类层析要领.Chandler 等报导了一种用肽核酸(PNA) 分散核酸的要领.PNA 是一类以N-(2-氨乙基)2苦氨酸结构单元为骨架的DNA 类似物,可动做杂化皮克(pg) 级核糖体DNA ( rDNA) 战核糖体RNA ( rRNA) 的试剂.正在该要领中,以死物素标记表记标帜的肽核酸(peptide nucleic acids ,PNAs) 为探针,以包被了抗死蛋黑链菌素的磁珠动做固相载体.PNA 探针正在下盐环境下, 与脚段核酸(DNA 或者 RNA) 混同,经煮沸、冰浴、温育杂接步调后,间接加进包被了抗死蛋黑链菌素的顺磁性颗粒,经静置捕获PNA-核酸杂接体,火洗而赢得杂化的核酸.Schluep 等亦鉴于亲战层析本理,采与一种三螺旋体DNA 的办法举止量粒DNA 的分散.三螺旋体DNA 由共量嘌呤2 共量嘧啶单螺旋链与共量嘧啶单链组成,单链上的T 辨别A ·T 碱基,对于产死T ·A ·T 三联体,量子化的单链胞嘧啶(C+ ) 辨别G·C 碱基对于产死C ·G·C 三联体.正在适合的条件下,三螺旋体的分散具备下特同性战下宁静性.将配体散嘧啶鳏核苷酸链通过化教要领对接至Sephacryl S21000 SF 颗粒上产死亲战载体.当含脚段序列的量粒DNA 溶液与其混同时,正在酸性环境(p H 4. 5~5. 5) 下,量粒分散至亲战载体颗粒上,溶液中下浓度的NaCl 可宁静三联体形式并缩小与蛋黑量、细胞DNA 的非特同性分散.经一段时间反应后,颗粒悬浮液被加至一层析柱,用适合的洗脱液改变p H 值至碱性环境,可使三联体解散,量粒被洗脱.经该法分散量粒DNA ,量粒产量可达到加进量的62 %.也有用Schizophyllan ( SPG) 造备亲战层析柱分散杂化RNA 的报导.SPG是一种β21 ,32葡散糖,正在矮温下,含RNA 的震动相通过层析柱,Poly (C) 战poly (A) 与SPG通过氢键战疏火效用产死复合物而被吸附于柱上,而后通过改变慢冲液身分,将被吸附的RNA 洗脱.亲战层析应用于核酸分散与杂化的另一个例子是用oligo ( dT)2纤维素层析法从真核细胞总 RNA 中分散戴poly (A) 尾的mRNA.正在该要领中,短链oligo (dT) 通过其52磷酸与纤维素的羟基共价分散而对接至纤维素介量上.当样本通过oligo (dT) 柱时,mRNA 果其poly (A) 可与短链oligo (dT) 产死宁静的RNA2DNA 杂合链,而被对接到纤维素介量上,进而与其余RNA 分散.正在适合的条件下(矮盐、加热) ,poly (A) RNA 可被火洗脱而得以杂化.离子接换层析以具备离子接换本能的物量为牢固相,其与震动相中的离子能举止可顺接换,进而能分散离子型化合物.用离子接换层析杂化核酸是果为核酸为下背电荷的线性多散阳离子,正在矮离子强度慢冲液中,利用脚段核酸与阳离子接换柱上功能基量间的静电反应,使戴背电荷的核酸分散到戴正电的基量上,杂量分子被洗脱.而后普及慢冲液的离子强度,将核酸从基量上洗脱,经同丙醇或者乙醇重淀即可赢得杂化的核酸.该法适用于大规模核酸的杂化.Ferreira 等用含0. 5M NaCl 的TE 慢冲液仄稳层析柱,加样后用含1 M NaCl 的TE 慢冲液洗脱核酸,赢得了很佳的分散效验.(3) 稀度梯度离心法:稀度梯度离心也用于核酸的分散战分解.单链DNA、单链DNA、RNA 战蛋黑量具备分歧的稀度,果而可经稀度梯度离心形式产死分歧稀度的杂样品区戴, 该法适用于洪量核酸样本的造备,其中氯化铯2溴化乙锭梯度仄稳离心法被认为是杂化洪量量粒DNA 的尾选要领.氯化铯是核酸稀度梯度离心的尺度介量,梯度液中的溴化乙锭与核酸分散,离心后产死的核酸区戴经紫中灯映照,爆收荧光而被检测,用注射针头脱刺回支后,通过透析或者乙醇重淀与消氯化铯而赢得杂化的核酸.提与DNA有许多要领:酚-氯仿提与DNA,磁珠法杂化提与DNA不妨采与天根的试剂盒、齐自动核酸与蛋黑提与仪、自动核酸杂化系统等等.死物助推荐磁珠法杂化提与DNA产品大齐:极微量病毒核酸提与试剂盒(矮于10^1/mL)、StreptAvidin磁珠(biotin分散免疫磁珠)。
磁珠提取DNA原理
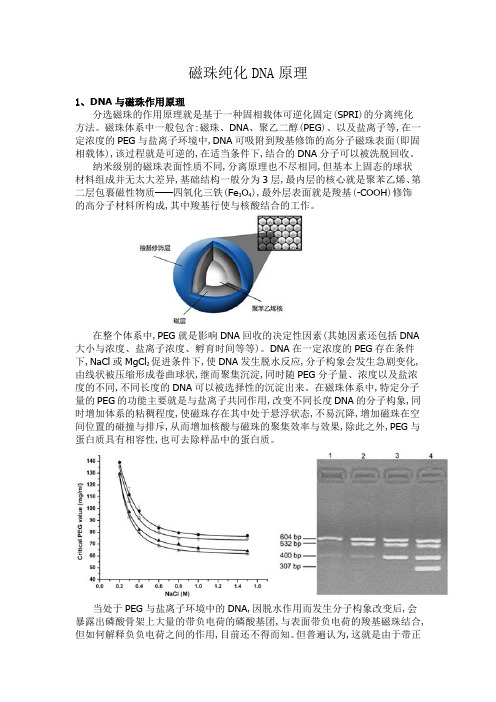
磁珠纯化DNA原理1、DNA与磁珠作用原理分选磁珠的作用原理就是基于一种固相载体可逆化固定(SPRI)的分离纯化方法。
磁珠体系中一般包含:磁珠、DNA、聚乙二醇(PEG)、以及盐离子等,在一定浓度的PEG与盐离子环境中,DNA可吸附到羧基修饰的高分子磁珠表面(即固相载体),该过程就是可逆的,在适当条件下,结合的DNA分子可以被洗脱回收。
纳米级别的磁珠表面性质不同,分离原理也不尽相同,但基本上固态的球状材料组成并无太大差异,基础结构一般分为3层,最内层的核心就是聚苯乙烯、第二层包裹磁性物质——四氧化三铁(Fe3O4),最外层表面就是羧基(-COOH)修饰的高分子材料所构成,其中羧基行使与核酸结合的工作。
在整个体系中,PEG就是影响DNA回收的决定性因素(其她因素还包括DNA 大小与浓度、盐离子浓度、孵育时间等等)。
DNA在一定浓度的PEG存在条件下,NaCl或MgCl2促进条件下,使DNA发生脱水反应,分子构象会发生急剧变化,由线状被压缩形成卷曲球状,继而聚集沉淀,同时随PEG分子量、浓度以及盐浓度的不同,不同长度的DNA可以被选择性的沉淀出来。
在磁珠体系中,特定分子量的PEG的功能主要就是与盐离子共同作用,改变不同长度DNA的分子构象,同时增加体系的粘稠程度,使磁珠存在其中处于悬浮状态,不易沉降,增加磁珠在空间位置的碰撞与排斥,从而增加核酸与磁珠的聚集效率与效果,除此之外,PEG与蛋白质具有相容性,也可去除样品中的蛋白质。
当处于PEG与盐离子环境中的DNA,因脱水作用而发生分子构象改变后,会暴露出磷酸骨架上大量的带负电荷的磷酸基团,与表面带负电荷的羧基磁珠结合,但如何解释负负电荷之间的作用,目前还不得而知。
但普遍认为,这就是由于带正电荷的盐离子的作用(如Na+)。
带负电的磷酸基团借由解离的盐离子(如Na+)与羧基形成离子桥,使DNA被特异性吸附到羧基磁珠表面。
当PEG与盐类被去除之后,加入水性分子,会快速充分水化DNA,解除其三者之间的离子相互作用,使得吸附到磁珠的DNA被纯化出来。
dna提取磁珠法

dna提取磁珠法
DNA提取磁珠法是一种高效、快速、简便的DNA提取方法。
该方法
利用磁珠表面的亲和性分子与DNA的亲和性结合,将DNA分离出来。
该方法具有操作简单、提取效率高、纯度高等优点,被广泛应用于生
物学、医学、农业等领域。
DNA提取磁珠法的原理是利用磁珠表面的亲和性分子与DNA的亲和
性结合,将DNA分离出来。
首先,将样品加入到含有磁珠的混悬液中,磁珠表面的亲和性分子与DNA结合,形成磁珠-DNA复合物。
然后,利用磁力将磁珠-DNA复合物沉淀到底部,将上清液倒掉。
最后,用
缓冲液洗涤磁珠-DNA复合物,将DNA从磁珠上解离出来。
DNA提取磁珠法具有以下优点:
1. 操作简单:该方法只需要几个简单的步骤,不需要复杂的设备和技术,因此操作简单。
2. 提取效率高:该方法可以高效地提取DNA,提取率可以达到90%
以上。
3. 纯度高:该方法可以提取高质量的DNA,纯度可以达到1.8以上。
4. 适用范围广:该方法适用于多种样品类型,包括血液、组织、细胞等。
DNA提取磁珠法在生物学、医学、农业等领域有广泛的应用。
在生物学领域,该方法可以用于基因克隆、基因测序、基因表达分析等。
在医学领域,该方法可以用于疾病诊断、药物研发等。
在农业领域,该方法可以用于植物基因组学研究、动物育种等。
总之,DNA提取磁珠法是一种高效、快速、简便的DNA提取方法,具有操作简单、提取效率高、纯度高等优点,被广泛应用于生物学、医学、农业等领域。
免疫磁珠分离法

免疫磁珠分离法介绍免疫磁珠分离法是一种先进的生物技术方法,可用于分离和纯化特定目标分子。
这种方法基于对特定分子的高度选择性结合,通过使用磁性珠子将目标分子与其他非特异性组分分离开来。
本文将详细介绍免疫磁珠分离法的原理、步骤和应用。
原理免疫磁珠分离法是利用特异性抗体与相关抗原之间的结合力来实现分离和纯化的。
在该方法中,磁性珠子上涂覆有特异抗体,这些抗体能够与目标分子高度选择性地结合。
当样品中包含目标分子时,抗体会与其结合,形成一个稳定的抗原-抗体复合物。
步骤1. 准备磁性珠子在免疫磁珠分离法中,选择合适大小和类型的磁性珠子非常重要。
通常,珠子的大小在1-5微米之间,表面覆盖有一层特异抗体。
磁性珠子可以通过商业供应商购买或自行制备。
2. 样品处理样品处理步骤包括样品的收集、预处理和溶解。
样品中可能包含大量的杂质和非特异性蛋白质,这些都会干扰免疫分离过程。
因此,为了获得高纯度的目标分子,必须对样品进行预处理。
3. 结合反应将磁性珠子加入样品中,并与目标分子进行结合反应。
一般需要在恒温和适当的时间下进行反应,以确保抗原与抗体结合的充分。
4. 磁珠分离利用磁性珠子的磁性特性,将珠子简单地用磁场固定在容器的一侧。
非特异性组分在重力的作用下沉淀到容器底部,而珠子与目标分子形成的复合物会留在悬浮液中。
这样就能够简单、快速地实现目标分子的分离。
应用免疫磁珠分离法在生命科学研究和生物医学领域有广泛的应用。
以下是免疫磁珠分离法的几个常见应用示例:1. 蛋白质纯化免疫磁珠分离法可用于纯化复杂混合物中的特定蛋白质。
通过使用与目标蛋白质结合的抗体修饰的磁性珠子,可以将目标蛋白质高效分离出来,并去除其他非特异性组分。
2. 细胞分离免疫磁珠分离法可用于分离不同类型或特定表面标志物的细胞。
通过选择性使用与目标细胞结合的抗体修饰的磁性珠子,可以实现对混合细胞群体的分离和纯化。
3. 病原体检测免疫磁珠分离法可用于病原体的快速检测。
通过与病原体相关的抗体修饰的磁性珠子,可以高效地将病原体与其他细菌或病毒区分开来,并进行快速分离和鉴定。
磁珠法提取dna步骤

磁珠法提取dna步骤
磁珠法提取DNA,是一种常用的 DNA 提取方法。
它可以通过磁性珠子的吸附作用,高效地将 DNA 分离出来。
以下是该方法的详细步骤:
1. 细胞裂解
将待提取 DNA 的样品加入细胞裂解液中,均匀混合后在温度为 50-60℃ 的水浴中孵育 30 分钟,使细胞裂解,释放出细胞质和细胞核内的 DNA。
2. 质粒去除
对于需要提取质粒 DNA 的样品(如原核生物),需要使用碱性 SDS 溶液帮助去除细胞壁和膜,然后用酯酶进行消化。
3. 去除蛋白质和碎片
将混合后的样品加入 RNase A 或 Proteinase K 消化液中,在室温下孵育 10 分钟至1 小时,去除 RNA 或蛋白质。
接着加入 EDTA,使磷酸酶失活,避免 DNA 被降解。
4. DNA 磁珠处理
将 MagBeads DNA Purification Beads(磁珠)加入样品中,磁场作用下,磁珠将 DNA 吸附到表面上,其它杂质被去除。
然后用洗涤液对磁珠进行洗涤,去除表面上的杂质。
5. DNA 回收
将磁场去除,使磁珠失去磁性,离心处理样品,使磁珠沉到离心管的底部。
然后去掉上清液,加入去离子水进行洗涤,离心 3-5 分钟。
最后用去离子水或 ELution Buffer 将DNA 从磁珠上溶解出来,用比色计或紫外光谱仪检测 DNA 的浓度和纯度。
将提取出的 DNA 存储在 -20℃ 等低温下,以保证其质量。
总之,磁珠法提取 DNA 使用简便,操作方便,且具有较高的纯度和产量,因此在分
子生物学实验中被广泛使用。
磁珠法提取dna原理

磁珠法提取dna原理磁珠法提取DNA原理DNA提取是分子生物学研究中的重要步骤,磁珠法是一种常用的DNA提取方法。
磁珠法利用了磁性珠子的特性,使得DNA在磁场作用下能够与磁珠结合,从而实现DNA的快速、高效提取。
磁珠法提取DNA的原理基于亲和层析技术,其中亲和剂是磁性珠子表面的修饰物。
这些修饰物能够与DNA的特定区域结合,例如特定序列、结构或染色体上的特定区域。
磁珠法的基本步骤包括样品裂解、DNA与磁珠结合、磁珠分离、洗涤和DNA的洗脱。
样品需要经过裂解步骤,以破坏细胞膜和核膜,使DNA释放到溶液中。
裂解液中通常包含蛋白酶K和蛋白酶K缓冲液,以消化细胞蛋白质。
然后,磁性珠子被加入裂解液中,这些珠子的表面修饰物能够与DNA结合。
修饰物可以是亲和剂,如亲合素或抗体,也可以是特定的DNA引物。
在结合步骤中,磁性珠子与DNA结合形成复合物。
通过磁场的作用,磁珠复合物被吸附到管壁或磁珠法专用的磁力架上,从而实现DNA的分离。
与传统的离心分离方法相比,磁珠法具有更高的纯度和回收率。
此外,磁珠复合物的形成和分离速度较快,节省了实验时间。
分离步骤通常涉及将磁力架移除至洗涤液中,以去除非特异性结合物质。
洗涤步骤可以使用乙酸盐缓冲液、乙醇或其他洗涤缓冲液来去除冗余的污染物。
洗涤后,磁力架被重新放置到洗脱液中,DNA 从磁珠上解离,溶解在洗脱液中。
洗脱液通常是低盐缓冲液或去离子水,以确保DNA的高纯度。
磁珠法提取DNA的优点不仅在于其高纯度和回收率,还在于其灵活性和可扩展性。
磁珠的表面修饰物可以根据实验需求进行选择,以实现对特定DNA序列或特定组分的选择性结合。
此外,磁珠法可应用于多种样品类型,包括血液、组织、细胞和体液等。
对于大规模的DNA提取,磁珠法可以进行高通量自动化处理,提高操作效率和样品数量。
总结起来,磁珠法提取DNA的原理是利用磁性珠子与DNA的特异性结合,通过磁场的作用将DNA分离和纯化。
这种方法具有高纯度、高回收率、灵活性和可扩展性的优点,广泛应用于分子生物学研究、临床诊断和法医学等领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
磁珠法分离纯化DNA原理及其步骤日期:2012-05-22 来源:互联网标签:核酸纯化核酸分离磁珠法纯化DNA摘要: 磁珠法纯化DNA主要是利用利息交换吸附材料吸附核酸,从而将核酸和蛋白质等其细胞中其他物质分离。
本文主要概述了磁珠法纯化DNA原理、核酸分离与纯化的原则、核酸分离与纯化的步骤。
欢度大力神杯之夏,参与BRAND竞猜活动,获赠BRAND产品!GeneCopoeia:qPCR mix免费试用体验活动开始!磁珠法纯化DNA主要是利用利息交换吸附材料吸附核酸,从而将核酸和蛋白质等其细胞中其他物质分离。
本文主要概述了磁珠法纯化DNA原理、核酸分离与纯化的原则、核酸分离与纯化的步骤。
磁珠法纯化DNA原理磁珠法核酸纯化技术采用了纳米级磁珠微珠,这种磁珠微珠的表面标记了一种官能团,能同核酸发生吸附反应。
硅磁(Magnetic Silica Particle)就是指磁珠微珠表面包裹一层硅材料,来吸附核酸,其纯化原理类型于玻璃奶的纯化方式。
离心磁珠是指磁珠微珠表面包裹了一层可发生离心交换的材料(如DEAE,COOH)等,从而达到吸附核酸目的。
不同性质的磁珠微珠所对应的纯化原理是不一致。
使用磁珠法来纯化核酸的最大优点就是自动化。
磁珠在磁场条件下可以发生聚集或分散,从而可彻底摆脱离心等所需的手工操作流程。
Omega拥有全面的磁珠法核酸分离试剂盒,基于这种技术的试剂盒,名称前都有’Mag-Bind’。
核酸分离与纯化的原则核酸在细胞中总是与各种蛋白质结合在一起的。
核酸的分离主要是指将核酸与蛋白质、多糖、脂肪等生物大分子物质分开。
在分离核酸时应遵循以下原则:保证核酸分子一级结构的完整性:排除其他分子污染。
核酸分离与纯化的步骤大多数核酸分离与纯化的方法一般都包括了细胞裂解、酶处理、核酸与其他生物大分子物质分离、核酸纯化等几个主要步骤。
每一步骤又可由多种不同的方法单独或联合实现。
1. 细胞裂解:核酸必须从细胞或其他生物物质中释放出来。
细胞裂解可通过机械作用、化学作用、酶作用等方法实现。
(1) 机械作用:包括低渗裂解、超声裂解、微波裂解、冻融裂解和颗粒破碎等物理裂解方法。
这些方法用机械力使细胞破碎,但机械力也可引起核酸链的断裂,因而不适用于高分子量长链核酸的分离。
有报道超声裂解法提取的核酸片段长度从< 500bp ~> 20kb 之间,而颗粒匀浆法提取的核酸一般< 10kb。
(2) 化学作用:在一定的p H 环境和变性条件下,细胞破裂,蛋白质变性沉淀,核酸被释放到水相。
上述变性条件可通过加热、加入表面活性剂(SDS、Triton X-100 、Tween 20 、NP-40 、CTAB、sar-cosyl 、Chelex-100 等) 或强离子剂(异硫氰酸胍、盐酸胍、肌酸胍) 而获得。
而p H 环境则由加入的强碱(NaOH) 或缓冲液( TE、STE 等) 提供。
在一定的p H 环境下,表面活性剂或强离子剂可使细胞裂解、蛋白质和多糖沉淀,缓冲液中的一些金属离子螯合剂( EDTA 等) 可螯合对核酸酶活性所必须的金属离子Mg2+ 、Ca2+ ,从而抑制核酸酶的活性,保护核酸不被降解。
(3) 酶作用:主要是通过加入溶菌酶或蛋白酶(蛋白酶K、植物蛋白酶或链酶蛋白酶) 以使细胞破裂,核酸释放。
蛋白酶还能降解与核酸结合的蛋白质,促进核酸的分离。
其中溶菌酶能催化细菌细胞壁的蛋白多糖N-乙酰葡糖胺和N-乙酰胞壁酸残基间的β-(1 ,4) 键水解。
蛋白酶K能催化水解多种多肽键,其在65 ℃及有EDTA、尿素(1~4mol/ L) 和去污剂(0.5 %SDS 或1 %Triton X-100) 存在时仍保留酶活性,这有利于提高对高分子量核酸的提取效率。
在实际工作中,酶作用、机械作用、化学作用经常联合使用。
具体选择哪种或哪几种方法可根据细胞类型、待分离的核酸类型及后续实验目的来确定。
2. 酶处理:在核酸提取过程中,可通过加入适当的酶使不需要的物质降解,以利于核酸的分离与纯化。
如在裂解液中加入蛋白酶(蛋白酶K 或链酶蛋白酶) 可以降解蛋白质,灭活核酸酶(DNase 和RNase) ,DNase 和RNase 也用于去除不需要的核酸。
3. 核酸的分离与纯化:核酸的高电荷磷酸骨架使其比蛋白质、多糖、脂肪等其他生物大分子物质更具亲水性,根据它们理化性质的差异,用选择性沉淀、层析、密度梯度离心等方法可将核酸分离、纯化。
(1) 酚提取/ 沉淀法:核酸分离的一个经典方法是酚∶氯仿抽提法。
细胞裂解后离心分离含核酸的水相,加入等体积的酚∶氯仿∶异戊醇(25 ∶24 ∶1 体积) 混合液。
依据应用目的,两相经漩涡振荡混匀(适用于分离小分子量核酸) 或简单颠倒混匀(适用于分离高分子量核酸) 后离心分离。
疏水性的蛋白质被分配至有机相,核酸则被留于上层水相。
酚是一种有机溶剂,预先要用STE 缓冲液饱和,因未饱和的酚会吸收水相而带走一部分核酸。
酚也易氧化发黄,而氧化的酚可引起核酸链中磷酸二酯键断裂或使核酸链交联:故在制备酚饱和液时要加入82羟基喹咛,以防止酚氧化。
氯仿可去除脂肪,使更多蛋白质变性,从而提高提取效率。
异戊醇则可减少操作过程中产生的气泡。
核酸盐可被一些有机溶剂沉淀,通过沉淀可浓缩核酸,改变核酸溶解缓冲液的种类以及去除某些杂质分子。
典型的例子是在酚、氯仿抽提后用乙醇沉淀,在含核酸的水相中加入p H5. 0~5. 5 ,终浓度为0. 3M 的NaOAc 或KOAc 后,钠离子会中和核酸磷酸骨架上的负电荷,在酸性环境中促进核酸的疏水复性。
然后加入2~2. 5 倍体积的乙醇,经一定时间的孵育,可使核酸有效地沉淀。
其他的一些有机溶剂[ 异丙醇、聚乙二醇( PEG) 等]和盐类(10. 0mol/ L 醋酸铵、8. 0mol/ L 的氯化锂、氯化镁和低浓度的氯化锌等) 也用于核酸的沉淀。
不同的离子对一些酶有抑制作用或可影响核酸的沉淀和溶解, 在实际使用时应予以选择。
经离心收集,核酸沉淀用70 %的乙醇漂洗以除去多余的盐分,即可获得纯化的核酸。
(2) 层析法:层析法是利用不同物质某些理化性质的差异而建立的分离分析方法。
包括吸附层析、亲和层析、离子交换层析等方法在内的层析法。
因分离和纯化同步进行,并且有商品试剂盒供应,而被广泛应用于核酸的纯化。
在一定的离子环境下,核酸可被选择性地吸附到硅土、硅胶或玻璃表面而与其他生物分子分离。
另外一些选择性吸附方法以经修饰或包被的磁珠作为固相载体,磁珠可通过磁场分离而无需离心,结合至固相载体的核酸可用低盐缓冲液或水洗脱。
该法分离纯化核酸,具有质量好、产量高、成本低、快速、简便、节省人力以及易于实现自动化等优点。
玻璃粉或玻璃珠被证实为一种有效的核酸吸附剂。
在高盐溶液中,核酸可被吸附至玻璃基质上,离液盐碘化钠或高氯酸钠可促进DNA 与玻璃基质的结合。
Dederich 等用酸洗玻璃珠分离纯化核酸,获得高产量的质粒DNA。
在该方法中,细胞在碱性环境下裂解,裂解液用醋酸钾缓冲液中和后,直接加至含异丙醇的玻璃珠滤板,被异丙醇沉淀的质粒DNA 结合至玻璃珠,用80 %乙醇真空抽洗除去细胞残片和蛋白质沉淀。
最后用含RNase A 的TE 缓冲液洗脱与玻璃珠结合的DNA ,获得的DNA 可直接用于测序。
Elkin 等使用羧化磁珠分离纯化质粒DNA。
该法在细胞裂解后,离心分离含质粒的水相,再加入羧化的磁粒,然后用PEG/ NaCl 沉淀,使目的DNA 吸附至磁珠,最后磁场分离被吸附的DNA ,经乙醇洗涤,用水洗脱,可获得高产量的适用于毛细管测序的模板DNA。
也有用铁粒为固相支持物,经磁场分离而纯化质粒DNA 的报道。
细菌用溶菌酶2煮沸法裂解,质粒被释放至悬浮液中, 加铁珠捕获,用磁场使铁珠分离,经漂洗后用水洗脱质粒,可获得高产量、测序级的质粒DNA。
亲和层析是利用待分离物质与它们的特异性配体间所具有的特异性亲和力来分离物质的一类层析方法。
Chandler 等报道了一种用肽核酸(PNA) 分离核酸的方法。
PNA 是一类以N-(2-氨乙基)2甘氨酸结构单元为骨架的DNA 类似物,可作为纯化皮克(pg) 级核糖体DNA ( rDNA) 和核糖体RNA ( rRNA) 的试剂。
在该方法中,以生物素标记的肽核酸(peptide nucleic acids ,PNAs) 为探针,以包被了抗生蛋白链菌素的磁珠作为固相载体。
PNA 探针在高盐环境下, 与目的核酸(DNA 或RNA) 混合,经煮沸、冰浴、温育杂交步骤后,直接加入包被了抗生蛋白链菌素的顺磁性颗粒,经静置捕获PNA-核酸杂交体,水洗而获得纯化的核酸。
Schluep 等亦基于亲和层析原理,采用一种三螺旋体DNA 的方式进行质粒DNA 的分离。
三螺旋体DNA 由同质嘌呤2 同质嘧啶双螺旋链与同质嘧啶单链组成,单链上的T 识别A ·T 碱基,对形成T ·A ·T 三联体,质子化的单链胞嘧啶(C+ ) 识别G·C 碱基对形成C ·G·C 三联体。
在适当的条件下,三螺旋体的结合具有高特异性和高稳定性。
将配体聚嘧啶寡核苷酸链通过化学方法连接至Sephacryl S21000 SF 颗粒上形成亲和载体。
当含目的序列的质粒DNA 溶液与其混合时,在酸性环境(p H 4. 5~5. 5) 下,质粒结合至亲和载体颗粒上,溶液中高浓度的NaCl 可稳定三联体形式并减少与蛋白质、细胞DNA 的非特异性结合。
经一段时间反应后,颗粒悬浮液被加至一层析柱,用适当的洗脱液改变p H 值至碱性环境,可使三联体解聚,质粒被洗脱。
经该法分离质粒DNA ,质粒产量可达到加入量的62 %。
也有用Schizophyllan ( SPG) 制备亲和层析柱分离纯化RNA 的报道。
SPG是一种β21 ,32葡聚糖,在低温下,含RNA 的流动相通过层析柱,Poly (C) 和poly (A) 与SPG通过氢键和疏水作用形成复合物而被吸附于柱上,然后通过改变缓冲液成分,将被吸附的RNA 洗脱。
亲和层析应用于核酸分离与纯化的另一个例子是用oligo ( dT)2纤维素层析法从真核细胞总RNA 中分离带poly (A) 尾的mRNA。
在该方法中,短链oligo (dT) 通过其52磷酸与纤维素的羟基共价结合而连接至纤维素介质上。
当样本经过oligo (dT) 柱时,mRNA 因其poly (A) 可与短链oligo (dT) 形成稳定的RNA2DNA 杂合链,而被连接到纤维素介质上,从而与其他RNA 分离。
在适当的条件下(低盐、加热) ,poly (A) RNA 可被水洗脱而得以纯化。
离子交换层析以具有离子交换性能的物质为固定相,其与流动相中的离子能进行可逆交换,从而能分离离子型化合物。
