第一章生物化学绪论
生物化学知识重点
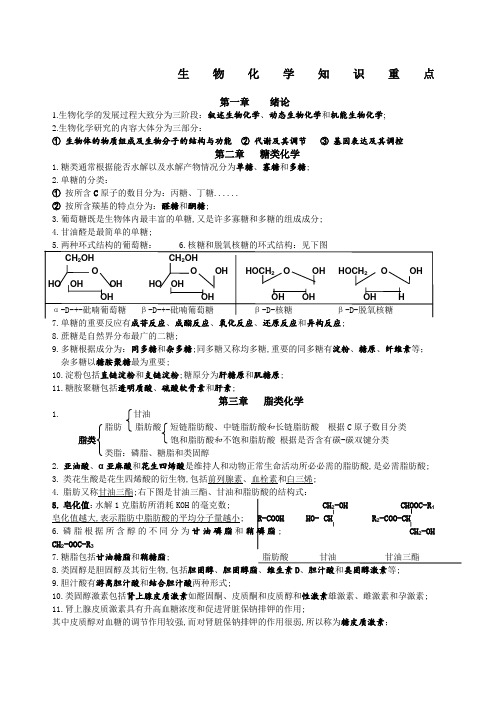
生物化学知识重点第一章绪论1.生物化学的发展过程大致分为三阶段:叙述生物化学、动态生物化学和机能生物化学;2.生物化学研究的内容大体分为三部分:①生物体的物质组成及生物分子的结构与功能②代谢及其调节③基因表达及其调控第二章糖类化学1.糖类通常根据能否水解以及水解产物情况分为单糖、寡糖和多糖;2.单糖的分类:①按所含C原子的数目分为:丙糖、丁糖......②按所含羰基的特点分为:醛糖和酮糖;3.葡萄糖既是生物体内最丰富的单糖,又是许多寡糖和多糖的组成成分;4.甘油醛是最简单的单糖;5.两种环式结构的葡萄糖:6.核糖和脱氧核糖的环式结构:见下图CH2OH CH2OHO O OH HOCH2O OH HOCH2O OHHO OH OH HO OHOH OH OH OH OH Hα-D-+-砒喃葡萄糖β-D-+-砒喃葡萄糖β-D-核糖β-D-脱氧核糖7.单糖的重要反应有成苷反应、成酯反应、氧化反应、还原反应和异构反应;8.蔗糖是自然界分布最广的二糖;9.多糖根据成分为:同多糖和杂多糖;同多糖又称均多糖,重要的同多糖有淀粉、糖原、纤维素等;杂多糖以糖胺聚糖最为重要;10.淀粉包括直链淀粉和支链淀粉;糖原分为肝糖原和肌糖原;11.糖胺聚糖包括透明质酸、硫酸软骨素和肝素;第三章脂类化学1.甘油脂肪脂肪酸短链脂肪酸、中链脂肪酸和长链脂肪酸根据C原子数目分类脂类饱和脂肪酸和不饱和脂肪酸根据是否含有碳-碳双键分类类脂:磷脂、糖脂和类固醇2.亚油酸、α亚麻酸和花生四烯酸是维持人和动物正常生命活动所必必需的脂肪酸,是必需脂肪酸;3.类花生酸是花生四烯酸的衍生物,包括前列腺素、血栓素和白三烯;4.脂肪又称甘油三酯;右下图是甘油三酯、甘油和脂肪酸的结构式:5.皂化值:水解1克脂肪所消耗KOH的毫克数; CH2-OH CHOOC-R1皂化值越大,表示脂肪中脂肪酸的平均分子量越小; R-COOH HO- CH R2-COO-CH6.磷脂根据所含醇的不同分为甘油磷脂和鞘磷脂; CH2-OH CH2-OOC-R37.糖脂包括甘油糖脂和鞘糖脂; 脂肪酸甘油甘油三酯8.类固醇是胆固醇及其衍生物,包括胆固醇、胆固醇脂、维生素D、胆汁酸和类固醇激素等;9.胆汁酸有游离胆汁酸和结合胆汁酸两种形式;10.类固醇激素包括肾上腺皮质激素如醛固酮、皮质酮和皮质醇和性激素雄激素、雌激素和孕激素;11.肾上腺皮质激素具有升高血糖浓度和促进肾脏保钠排钾的作用;其中皮质醇对血糖的调节作用较强,而对肾脏保钠排钾的作用很弱,所以称为糖皮质激素;醛固酮对水盐平衡的调节作用较强,所以称为盐皮质激素;第四章蛋白质化学1.蛋白质的作用:①生物催化—酶②运载和储存③免疫保护④机械支持⑤激素——受体系统⑥产生和传递神经冲动2.氨基酸的结构:①在20种标准氨基酸中只有脯氨酸为亚氨基酸,其他氨基酸都是α-氨基酸; COOHCOOH②除了甘氨酸之外,其他氨基酸的α-碳原子都结合了4个不同的原子或原子团;H2N-C-HH-C-NH2羧基、氨基、R基和1个氢原子; R R③氨基酸是手性分子,有L-氨基酸和D-氨基酸之分;标准氨基酸均为L-氨基酸;3.氨基酸的分类:L-氨基酸D-氨基酸①非极性疏水R基氨基酸②极性不带电荷R基氨基酸③带正电荷R基氨基酸④带负电荷R基氨基酸4.氨基酸的性质:①紫外吸收特征蛋白质的肽键结构对220nm以下的紫外线有强吸收,其所含的色氨酸和络氨酸对280nm的紫外线有强吸收;②两性解离与等电点氨基酸的等电点:在某一PH值条件下,氨基酸解离成阳离子和阴离子的趋势及程度相同,溶液中氨基酸的静电荷为零;此时溶液的PH值称为氨基酸的等电点;③茚三酮反应5.蛋白质的分类:根据组成成分分为单纯蛋白质和缀合蛋白质;根据构象分为纤维状蛋白质和球状蛋白质;6.蛋白质的分子结构:分为一级结构、二级结构、三级结构和四级结构后三种结构称为蛋白质的空间结构;7.肽分为寡肽2-10个氨基酸组成和多肽更多氨基酸构成;8.一些重要的肽:抗氧化剂:谷胱甘肽GSH是由谷氨酸、半胱氨酸和甘氨酸通过肽键连接构成的三肽;激素:抗利尿激素、血管紧张素Ⅱ、催产素、促肾上腺皮质素、内啡肽、脑啡肽;9.蛋白质的一级结构:蛋白质的一级结构:蛋白质分子内氨基酸的排列顺序;包括二硫键的位置;10.蛋白质的二级结构:蛋白质的二级结构:指多肽链主链的局部构象,不涉及侧链的空间排布;二级结构的种类:①肽单元与肽平面②α-螺旋③β折叠④β转角⑤无规卷曲⑥超二级结构超二级结构:指二级结构单元进一步聚集和组合在一起,形成规则的二级结构聚集体;作用:降低了蛋白质分子的内能,使之更加稳定;11.蛋白质的三级结构:蛋白质的三级结构:一条完整的蛋白质多肽链在二级结构基础上进一步折叠形成的特定的空间结构;维持蛋白质三级结构的化学键是疏水作用、氢键、部分离子键和少量共价键如二硫键;由一条肽链构成的蛋白质只有形成三级结构才可能具有生物活性;12.蛋白质的四级结构:蛋白质的四级结构:多亚基蛋白的亚基按特定的空间排布结合在一起形成的空间结构;13.维持蛋白质构象的化学键:蛋白质的天然构象是由多种化学键共同维持的,这些化学键包括肽键、二硫键、氢键、疏水作用、离子键和范德华力;后四种化学键属于非共价键;14.蛋白质的理化性质:实验一般性质:①蛋白质含有肽键和芳香族氨基酸,所以对紫外线有吸收;②蛋白质是两性电解质,所以有等电点; ③蛋白质还能发生呈色反应;15.沉降系数:沉降速度与离心加速度相对重力之比为一常数;该常数称为~ ;第五章核酸化学信使RNA—把遗传信息从DNA带给核糖体,指导蛋白质合成;核糖核酸RNA转移RNA—在蛋白质合成过程中转运氨基酸,同时把核酸翻译成蛋白质语言;核酸核糖体RNA—是核糖体的结构成分,而核糖体是合成蛋白质的机器;脱氧核糖核酸DNA——遗传的物质基础;核酸的结构单位是核苷酸,是核酸的水解产物;磷酸——核酸是含磷酸最多的生物大分子;核苷酸的组成戊糖——核酸的戊糖包括核糖和脱氧核糖;碱基——包括两种嘌呤碱基A、G和两种嘧啶碱基C、T ;糖苷键——碱基与戊糖以N-β-糖苷键连接;核苷酸的结构磷酸酯键——磷酸与戊糖以磷酸酯键连接;酸酐键——磷酸通过酸酐键连接第二、第三个磷酸;核苷酸的功能:①合成核酸②为生命活动提供能量③参与其他物质合成④构成酶的辅助因子⑤调节代谢ATP——为生命活动提供能量UTP——参与糖原的合成CTP——参与磷脂合成腺苷酸构成酶的辅助因子核酸的分子结构:一级结构:指核酸的碱基组成和碱基序列;分子结构二级结构:核酸中由部分核苷酸形成的有规律、稳定的空间结构;三级结构:在二级结构的基础上,DNA双螺旋进一步盘曲形成三级结构;一、核酸的一级结构——研究核酸的核苷酸序列;核苷酸以3’,5’—磷酸二酯键连接构成核酸;核酸有方向性,5’端为头,3’端为尾;核酸是核苷酸的缩聚物;根据长度将核苷酸分为:寡核苷酸长度<50 nt和多核苷酸;nt:单链核酸长度单位,1nt为1个核苷酸二、核酸的二级结构不同的生物DNA的碱基组成具有以下规律,称为C hargaff法则:①DNA的碱基组成有物种差异,没有组织差异,即不同物种DNA的碱基组成不同,同一个体不同组织DNA的碱基组成相同.②DNA的碱基组成不随个体的年龄、营养和环境改变而改变;③不同物种DNA的碱基组成均存在以下关系:A = T , G = C , A + G = C + T .C hargaff法则是研究DNA二级结构及DNA复制机制的基础;DNA二级结构的特点:①DNA是由两股反向平行互补构成的双链结构;主链位于外侧,碱基侧链位于内侧;②两条链由碱基之间的氢键相连:A + G = C + T ;③在双螺旋中,碱基平面与螺旋轴垂直;④碱基之间的氢键维系双链结构的横向稳定性;碱基平面之间的碱基堆积力维系双螺旋结构的纵向稳定性;三、核酸的三级结构——主要研究DNA和染色体的超级结构.1.真核生物的细胞核DNA与RNA、蛋白质构成染色体,其结构更复杂;2.如果把真核生物DNA形成双螺旋结构看成是DNA的一级压缩,那么DNA的二级压缩就是形成核小体;3.核小体由DNA与组蛋白构成;各两个亚基构成核小体的八聚体核;四、RNA的种类和分子结构碱基互补配对的原则是A对U、G对C.1.mRNA的特点:种类多、寿命短、含量少;2.真核生物大多数mRNA的5’端有一个帽子m7GpppNmp,3'端有一段聚腺苷酸尾或PolyA尾; 帽子结构既能抵抗RNA 5’外切酶的水解;又是蛋白质合成过程中起始因子的识别标记;在组成和结构上都有以下特点:①大小为73-93 nt②含有较多的稀有碱基③ 3'端含有CCA-OH序列;5’端大多是鸟苷酸;④二级结构呈三叶草形⑤三级结构成倒“L”形.4.rRNA是细胞内含量最多的RNA,与蛋白质构成核糖体;原核生物核糖体有三种rRNA,真核生物核糖体有四种rRNA;5.核酶:是由活细胞合成的、具有催化作用的RNA;核酸的理化性质碱基使核酸具有特殊的紫外线吸收光谱,吸收峰在260nm附近;名词解释DNA的变性:指双链DNA解旋、解链,形成无规线团,从而发生性质改变如黏度下降、沉降速度加快等;导致DNA变性的理化因素:高温和化学试剂酸、碱、乙醇、尿素等;DNA的复性:缓慢降低温度,恢复生理条件,变性DNA单链会自发互补结合,重新形成原来的双螺旋结构;又称退火;DNA片段越大复性越慢,DNA浓度越高复性越快;增色反应:DNA变性导致其紫外线吸收增加;减色反应:DNA复性导致变性DNA恢复其天然构象时,其紫外吸收减少;解链温度:使DNA变性解链达到50%时的温度;又称变性温度、熔解温度、熔点;核酸分子杂交:不同来源的核酸链因存在互补序列而形成互补双链的结构的过程;是分子生物学的核心技术;第六章酶1.新陈代谢:生物体内的全部化学反应的总称;包括物质代谢和能量代谢;2.生物催化剂:酶——是由活细胞合成的、具有催化作用的蛋白质;核酶——是由活细胞合成的、具有催化作用的核酸;单纯酶——仅由氨基酸构成,如尿素酶、蛋白酶、淀粉酶、脂酶和核糖核酸酶等3.酶结合酶蛋白质部分非蛋白质部分全酶4.只有全酶才具有催化活性,脱辅基酶蛋白单独存在时没有催化活性;5.辅助因子金属离子:K+、Na+、Zn2+等;B族维生素的活性形式;辅助因子根据与脱辅基酶蛋白的结合程度等分为:辅酶和辅基;辅助因子的作用——承担着传递电子、原子或基团的作用;①通常一种脱辅酶蛋白必须与特定的辅助因子结合,才能成为有活性的全酶白②一种辅助因子可与不同的脱辅基酶蛋白结合,组成具有不同特异性的全酶; 此决定酶的特异性6.酶的活性中心又称活性部位:是酶蛋白构象的一个特定区域,由必需基团构成,能与底物特异地结合,并催化底物生成产物;酶促反应:由酶催化进行的化学反应; 底物S ,生成产物P7.酶的必需基团——那些与酶活性密切相关的基团;结合基团:与底物结合,使底物与一定构象的酶形成复合物,又称中间产物;-催化基团:改变底物中某些化学键的稳定性,使底物发生反应生成产物;对于单纯酶来说,活性中心内的必需基团完全来自酶蛋白的氨基酸侧链,如组氨酸的咪唑基、丝氨酸的羟基半胱氨酸的的巯基和天冬氨酸的羧基等;对结合酶来说,活性中心内的必需基团还有一个来源,即辅助因子;实际上,辅助因子是指参与构成活性中心的非氨基酸成分;8.酶按分子结构分为:单体酶、寡聚酶、多酶体系和多功能酶又称串联酶;9.酶促反应的特点:酶和一般催化剂的共有特点:①只催化热力学上允许的化学反应; ②可以提高化学反应的速度,但不改变化学平衡; ③它们的催化机制都是降低化学反应的活化能; ④很少量就可以有效催化反应;①酶的催化效率极高绝对特异性——一种酶对一种底物酶的②酶具有很高的特异性相对特异性——一种酶对一类酶或一种化学键特点③酶蛋白容易失活立体异构特异性——一种酶对两种立体异构体中的一种④酶活性可以调节酶和一般催化剂之所以能提高化学反应速度,是因为它们能降低化学反应的活化能——中间产物学说;10.酶原与酶原的激活:酶原:有些酶在细胞内刚合成或初分泌时只是酶的无活性前体,必须水解掉一个或几个特定肽段,使酶蛋白构象发生改变,从而表现出酶的活性;酶的这种无活性前体称为酶原;酶原的激活:酶原向酶转化的过程;酶原的激活实际上是形成暴露酶的活性中心的过程;酶原的生理意义:①酶原适于酶的安全转运; ②酶原适于酶的安全储存;11.同工酶:是指能催化相同的化学反应,但酶蛋白的分子组成、分子结构和理化性质乃至免疫学性质和电泳行为都不相同的一组酶,是生命在长期进化过程中基因分化的产物;12.酶促反应动力学影响酶促反应的因素:酶浓度E、底物浓度S、温度、PH值、抑制剂、激活剂;根据抑制剂与酶作用方式的不同,抑制剂对酶的抑制作用分为可逆性抑制作用和不可逆性抑制作用;根据抑制剂与底物的竞争关系,可以将可逆性抑制作用分为:竞争性抑制作用、非竞争性抑制作用和反竞争性抑制作用;13.酶的分类:课本P7814.1个酶活性国际单位:在25℃、最适PH值、最适底物浓度时,每分钟催化1μmol底物反应所需的酶量;15.酶的比活性:1mg酶蛋白所具有的酶活性单位;第七章维生素维生素是维持生命正常代谢所必需的一类小分子有机化合物,是人体重要的营养物质之一;1.维生素的特点:①维生素既不是构成机体组织结构的原料,也不是供能物质,但在代谢过程中发挥着重要作用,它们大多数参与构成酶的辅助因子;②种类多,化学结构各异,本质上都属于小分子有机化合物;③维生素的需要量很少,但多数不能在体内合成或合成量不足,必须从食物中摄取;④维生素摄取不足会造成代谢障碍,但若应用不当或长期过量摄取,也会出现中毒症状;2.维生素的分类:根据溶解性分水溶性维生素:维生素C和B族维生素核黄素、泛酸、生物素等维生素脂溶性维生素:维生素A、维生素D、维生素E和维生素K ;3.水溶性维生素的共同特点:①易溶于水,不溶或微溶于有机溶剂; ②机体储存量很少,必须随时从食物中摄取;③摄入过多部分可以随尿液排出体外,不会导致积累而引起中毒;B族维生素通常都以构成酶的辅助因子的方式参与代谢;5.脂溶性维生素的共同特点:①不溶于水,易溶于脂肪及有机溶剂; ②在食物中常与脂类共存;③随脂肪的吸收不足而相应其吸收减少; ④可以在肝脏内储存,摄入过多会出现中毒症状;第一节概述生命活动需要能量供应,所需的能量来自生物氧化;生物氧化是指糖类、脂类和蛋白质等营养物质在体内氧化分解、最终生成CO2和H2O并释放能量满足生命活动需要的过程;又称组织呼吸或细胞呼吸; 生物氧化的特点:在温和条件进行连续的酶促反应,通过脱羧基反应产生CO2,能量逐步释放并得到有效利用;生物氧化的过程:第一阶段:营养物质氧化生成乙酰CoA.第二阶段:乙酰基进入三羧酸循环氧化生成CO2;第三阶段:前两阶段释放出的电子经呼吸链传递给O2生成H2O,传递电子的过程驱动合成ATP; CO2生成方式:根据是否伴有氧化反应分为:单纯脱羧和氧化脱羧;根据脱掉的羧基在底物分子结构中的位置分为:α-脱羧和β-脱羧;第二节呼吸链呼吸链是起递氢或递电子作用的酶或辅酶按一定顺序排列在线粒体内膜上,组成的递氢或递电子体系;又称电子传递链;其功能是将营养物质氧化释放的电子传递给O2生成H2O;呼吸链的组成成分包括Q 、Cyt c和四种具有传递电子功能的复合体,这些成分含有递氢体和递电子体;递氢体包括NAD、FMN、FAD和Q,递电子体包括铁硫蛋白、Cyt a 、Cyt b 和Cyt c ;呼吸链成分的排列顺序1. NADH氧化呼吸链NADH 复合体I Q 复合体III Cyt c 复合体IV O22. 琥珀酸氧化呼吸链琥珀酸复合体IIQ复合体IIICyt c 复合体IVO2细胞液NADH的氧化细胞液NADH通过3-磷酸甘油穿梭和苹果酸-天冬氨酸穿梭将电子送入呼吸链:3-磷酸甘油穿梭主要在肌肉及神经组织中进行,每传递一对电子推动合成两个ATP;苹果酸-天冬氨酸穿梭主要在心肌和肝脏内进行,每传递一对电子推动合成三个ATP;第三节生物氧化与能量代谢ATP的合成底物水平磷酸化——在生物氧化过程中,底物因脱氢、脱水等反应而使能量在分子内重新分布,形成高能磷酸基团,然后将高能磷酸基团转移给ADP,生成A TP的过程;氧化磷酸化——在生物氧化过程中,营养物质释放的电子经呼吸链传递给O2生成H2O,所释放的自由能推动ADP磷酸化生成ATP的过程;是合成ATP的主要方式;氧化磷酸化的影响因素有呼吸链抑制剂、解偶联剂、ADP、甲状腺激素和线粒体DNA ;研究氧化磷酸化最常见的方法是测定线粒体的磷、氧消耗量的比值,即磷/ 氧比值;在能量代谢中,ATP是许多生命活动的直接供能者;ATP的合成与利用构成ATP循环;ATP循环是生物体内能量转换的基本方式;第九章糖代谢物质代谢是指生物体与周围环境不断地进行物质交换的过程;包括消化吸收、中间代谢和排泄三阶段; 第一节糖的生理功能①糖是人体主要的供能物质:主要是糖原和葡萄糖;②糖也是人体的重要组成成分之一:③糖与蛋白质形成的糖蛋白是具有重要生理功能的物质;第二节血糖通过各种途径进入血液的葡萄糖称为血糖;血糖的来源和去路氧化供能主要途径食物糖消化吸收合成肝糖原、肌糖原肝糖原分解转化成核糖、脂肪、氨基酸非糖物质糖异生过高时随尿液排出不超过~ L血糖的调节机制肝脏调节——肝脏是维持血糖浓度的最主要器官;肾脏调节——肾脏对糖具有很强的重吸收能力;神经调节——交感神经和副交感神经;激素调节——胰岛β细胞胰岛素| 胰岛α细胞胰高血糖素和肾上腺皮质肾上腺素第三节糖的分解代谢④糖醛酸途径UDP-乳酸+能量①糖酵解途径③磷酸戊糖途径NADPH +磷酸戊糖乙酰CO2 + H2O + 能量②有氧氧化途径一、糖酵解途径1.葡萄糖生成1,6 - 二磷酸果糖:一分子葡萄糖生成1,6 - 二磷酸果糖消耗两分子ATP.,6 - 二磷酸果糖分解成两分子3-磷酸甘油醛:一分子1,6 - 二磷酸果糖生成两分子3-磷酸甘油醛; 磷酸甘油醛转化成丙酮酸:两分子3-磷酸甘油醛生成丙酮酸的同时产生四分子ATP.4.丙酮酸还原成乳酸:乳酸是葡萄糖无氧代谢的最终产物;全过程:葡萄糖 + 2Pi + 2ADP 2乳酸 + 2ATP + 2H2O糖酵解的生理意义糖酵解是在相对缺氧时机体补充能量的一种有效方式;某些组织在有氧时也通过糖酵解供能; 磷酸二羟丙酮是甘油的合成原料;糖酵解的中间产物是其他物质的合成原料3-磷酸甘油酸是丝氨酸、甘氨酸和半胱氨酸的合成原料;丙酮酸是丙氨酸和草酰乙酸的合成原料;二、糖的有氧氧化途径葡萄糖氧化分解生成丙酮酸丙酮酸氧化脱羧生成乙酰CoA①乙酰CoA与草酰乙酸缩合成柠檬酸. ②柠檬酸异构成异柠檬酸.三羧酸循环③异柠檬酸氧化脱羧生成α-酮戊二酸④α-酮戊二酸氧化脱羧生成琥珀酰CoA .⑤琥珀酰CoA生成琥珀酸. ⑥草酰乙酸再生.三羧酸循环的意义:1. 三羧酸循环是糖类、脂类和蛋白质分解代谢的共同途径;2. 三羧酸循环是糖类、脂类和蛋白质代谢联系的枢纽;三、磷酸戊糖途径反应过程见课本P125图9-8生理意义:磷酸戊糖途径所生成的5-磷酸核糖和NADPH是生命物质的合成原料;5-磷酸核糖——为核酸的生物合成提供核糖;提供NADPH + H+作为供氢体,参与多种代谢反应;NADPH ①为脂肪酸和胆固醇等物质的合成提供氢;还原②作为谷胱甘肽还原酶的辅酶,参与GSSG GSH ;四、糖醛酸途径葡萄糖6-磷酸葡萄糖1-磷酸葡萄糖UDP-葡萄糖UDP-葡萄醛酸第四节糖原代谢和糖异生一、糖原合成1. 6-磷酸葡萄糖的生成2. 1-磷酸葡萄糖的生成3. UDP-葡萄糖的生成4. 糖原的合成二、糖原分解1. 1-磷酸葡萄糖的生成2. 6-磷酸葡萄糖的生成磷酸葡萄糖的水解4.极限糊精的水解糖原的合成与分解是维持血糖正常水平的重要途径;三、糖异生由非糖物质合成葡萄糖的过程,称为糖异生;主要在肝脏内进行,在肾皮质中也可以进行,但较弱;糖异生的反应过程1.丙酮酸羧化支路2.1,6-二磷酸果糖水解成6-磷酸果糖3.6-磷酸葡萄糖水解生成葡萄糖糖异生的生理意义① 在饥饿时维持血糖水平的相对稳定 ② 参与食物氨基酸的转化与储存 ③ 参与乳酸的回收利用 第五节 糖代谢紊乱低血糖:空腹时血糖浓度低于L 称为 ~ ; 高血糖:空腹时血糖浓度超过L 称为 ~ ;饮食性糖尿:进食大量糖; 不糖 糖尿 情感性糖尿:情绪激动,交感神经兴奋,肾上腺素分泌增加;属尿肾糖尿:肾脏疾患导致肾小管重吸收能力减弱; 于 病 糖尿病的症状:“三多一少”多食、多饮、多尿和体重减轻 糖尿病患者会出现下列糖代谢紊乱:① 糖酵解和有氧氧化减弱 ② 糖原合成减少③ 糖原分解增加 ④ 糖异生作用加强 ⑤ 糖转化为脂肪减少葡萄糖耐量:人体处理所给予葡萄糖的能力;又称耐糖现象;是临床上检查糖代谢的常用方法; 正常人体耐糖曲线的特点:空腹血糖浓度正常,进食葡萄糖后血糖浓度升高;在1小时内达到高峰,但不超过肾糖阈; 而后血糖浓度迅速降低,在2-3小时内回落到正常水平; 课本P 133 图9-14第十章 脂类代谢第一节 脂类的分布和生理功能 一、 脂类的分布脂肪:分布在皮下、腹腔大网膜、肠系膜等处,这些部位称为脂库; 储存脂、可变脂 类脂:类脂是构成生物膜的组成成分; 基本脂或固定脂 二、 脂类的生理功能脂肪:① 维持体温 ② 减少器官间的摩擦 ③ 人体重要的营养物质和能源;类脂:① 构成生物膜的重要成分 ② 参与细胞识别及信号传导 ③合成多种活性物质 第二节 脂类的消化和吸收小肠是食物脂类的消化吸收场所;消化脂类的酶来自胰腺,主要有胰脂肪酶、磷脂酶A 2和胆固醇酯酶; 脂类的吸收场所主要是十二指肠下部和空肠上部; 第三节 血脂血浆中的脂类统称为血脂;血脂包括甘油三酯、磷脂、胆固醇酯、胆固醇和脂肪酸; 血脂的来源和去路:食物脂类的消化吸收氧化供能体内合成脂类进入脂库储存脂库动员释放构成生物膜转化为其他物质血浆脂蛋白; 电泳分类法: α脂蛋白 前β脂蛋白 β脂蛋白 乳糜微粒 超速离心分类法: HDL LDL VLDL CM 脂类:包括甘油三酯、磷脂、胆固醇和胆固醇酯等;血浆蛋白的组成 载体蛋白:是指血浆脂蛋白中的蛋白质成分,分为apoA 、apoB 、apoC 、apoD 、。
第一章 绪论生物化学

静态生物化学
动态生物化学
糖类化学 脂类化学 蛋白质化学 核酸化学 酶学 代谢与能量 糖类代谢
静态生物化学
动态生物化学
脂类代谢
蛋白质代谢 核酸代谢 代谢调节
蛋白质的降解 氨基酸代谢 蛋白质的生物合成
核酸的降解 核苷酸代谢 核酸的生物合成
绿色植物的光合作用
O2
CO2+H2O
光合作用:在多种酶的催化下,绿色植物吸收太阳的 光能,把CO2和H2O合成有机物,同时释放氧气的过程。
(1)遗传的化学本质
“种瓜得瓜,种豆得豆”
(2)酶作用的化学本质
(3)能量转化的化学本质
一辆汽车怎样行使开动? 一个正常人靠什么生存下去? 植物靠什么来生存?
生物化学的内容
研究生物体内各种化合物的结构、 化学性质和功能(主要有糖类、 脂类、蛋白质、核酸、酶、维生 素和激素) 研究构成生物体的基本物质在生 命活动中进行的化学变化,即新 陈代谢及代谢过程中能量的转换 和调节
Click to edit Master title style
生物化学
Click to edit Master text styles Second level Third level
Biochemistry
主讲教师:谷 娜
Fourth level Fifth level
第一章 绪论
Click to edit Master title style
成绩评定 平时成绩20%(课堂出勤+回答问题+作业) 期末考试成绩80%(闭卷)
六、使用教材及参考书
使用教材:
生物化学(第二版) 古练权,高等教育出版社出版,2011年
教材的特点 1)针对化学专业的生物化学,容易,需要 补充 2)从化学的角度出发
第一章 生物化学绪论

生物化学不仅是一门对生命科学有着指导性的基础
理论学科,也是一门对国民经济有着重要意义之一的应用
学科,主要表现在以下几个方面:
(1)生物化学在工业上的应用
生物化学是食品发酵工业理论基础。
例如:食品工业制酱、酿酒、制醋;纺织工业上棉布浆化; 制革业上的毛皮毛脱脂;
(2)生物化学在农业上应用
生物化学也是农业的基础课。农作物的代谢都离不开生物 化学,以及农作物病虫防治等等。
Biochemistry 或 Biological Chemistry
现译为“生物化学”,简称“生化”。 实用文档
2、生物化学发展与起源
生物化学在18世纪开始萌芽,19世纪
初步发展,20世纪初才成为独立的学科。
首先,起源于法国,由法国传之于德
国,由德国而传到美国和英国。在20世纪
后,再由上述国家流传于其他各国。大约
生物化学
BIOCHEMISTRY
主讲:生物与制药工程学院 申 宁 实用文档
第一章 绪 论
生命与生物化学
实用文档
一 、生命的定义
具有复制的能力 具有催化的能力 具有突变的能力
实用文档
地球充满着生物,从最简单的病毒到菌 藻树草,从鱼虫鸟兽到最复杂的人类, 千姿百态。不同的生物,其形态、生理 特征和对环境的适应能力各不相同,都 经历着生长、发育、衰老、死亡的变化, 都具有繁殖后代的能力。
真核细胞中含有被核膜包着的核
实用文档
真核细胞的结构
实用文档
植物细胞的结构
实用文档
原核生物:地球上数量最多、分 布最广。代谢系多样性能适应各种 环境。 真核生物:一般为原核细胞的上千 倍~上万倍,有核,其构造与机能 均比原核生物复杂。
生物化学1.绪论

美、英、日、德、法、中六国参与的国际 人类基因组计划(2003年完成)
人类基因组计划
1984年开始讨论 1990 启动 2000 序列框架图完成
人类基因组计划实施以来的成就
1995 完成原核生物Hemophilus luenzae的基因组测序 1996 完成啤酒酵母的基因组测序 1997 完成大肠杆菌的基因组测序 2000 人类基因组序列框架(中国完成1%) 2000 拟南芥基因组序列(第一个高等植物) 2002 水稻基因组序列框架图(中国独立完成) 2003 中国家蚕基因组序列框架图
生物化学是一门重要的医药学基础课程,也 是现在发展最快的学科之一,它从分子水平阐明 生命现象本质,是学习、认识疾病,认识药物治 病原理不可缺少的基础。同时,生物化学基础研 究及其技术的发展与现代药学科学的发展具有越 来越来密切的联系,呈现了巨大的应用潜力。
生化往往是阐明机理,选择合理工艺途径, 提高产品质量,探索新工艺,研制新产品的理论 基础。
霍普金斯(Hopkins),剑桥大 学生物化学教授,先后发现 了维生素、色氨酸和谷胱甘 肽,创建了剑桥普通生物化 学学派和中心。
1926年,美国的萨姆纳 (Sumner)得到了脲酶结晶,证 明了酶的本质是蛋白质。
1937年,英国生物化学家克雷 布斯(Krebs)发现并阐明了三 羧酸循环。
此外,脂肪酸氧化降解途径、 糖酵解途径等基本生物化学途 径也都在20世纪30年代前后陆 续阐明。
1960年,雅各布(Jacob)和莫诺 (Monod)提出了在原核生物中普遍 存在的基因调控的操纵子结构模型。
1965年,美国生物化学家尼伦伯格(Nirenberg) 破译出三联体遗传密码。
霍利(Holly)阐明了酵母丙氨酸tRNA的核苷酸 排列顺序,后来又证明了所有的tRNA都有着 相似的结构。
生物化学重点

生物化学重点第一章绪论1.生物化学的定义生物化学是研究生命体化学组成及化学变化规律的一门科学。
2.生物体的化学组成生物体的化学组成有水分、盐类、碳氢化合物等。
其中的碳氢化合物包括糖类、脂类、蛋白质、核酸及维生素,激素等。
3.生物化学发展经历了哪些阶段生物化学发展经历的三个阶段:1)叙述生物化学阶段,2)动态生物化学阶段,3)机能生物化学阶段。
4.我国现代生化学家最突出的贡献我国近代生物化学主要研究成果:人工合成蛋白质方面1965年,人工合成具有生物活性的蛋白质:结晶牛胰岛素。
1972年,用X光衍射法测定了猪胰岛素分子的空间结构。
1979年12月27日,人工合成酵母丙氨酸转运核糖核酸半分子。
1981年,人工合成酵母丙氨酸转运核糖核酸全分子。
第二章蛋白质构建分子—氨基酸*1.二十种蛋白质标准氨基酸【R 基决定了蛋白质的性质】七种氨基酸(Arg,Lys,His,Asp,Glu,CysandTyr)易形成离子化的侧链*2.蛋白质中的氨基酸都是L-型。
(Gly甘氨酸除外)氨基酸侧链含有.3.20种氨基酸按照酸碱性的分类。
中性氨基酸:包括8种非极性氨基酸和7种非解离的极性氨基酸,共15种。
酸性氨基酸:即天冬氨酸和谷氨酸。
解离后,分子带负电荷。
碱性氨基酸:即赖氨酸、精氨酸和组氨酸。
解离后,分子携带正电荷。
4. 氨基酸的等电点及其实际意义(用途)*等电点:当调节氨基酸溶液的pH值,使氨基酸的氨基与羧基的解离度完全相等时,则氨基酸所带净电荷为0,在电场中既不向阴极移动也不向阳极移动,此时氨基酸所处溶液的pH值称该氨基酸的等电点,即pI值。
意义:由于在等电点时,氨基酸的溶解度最小,易沉淀。
利用这一性质,可以分离制备某些氨基酸。
利用各种氨基酸的等电点不同,可通过电泳法、离子交换法等方法进行混合氨基酸的分离和制备。
实验证明在等电点时,氨基酸主要以两性离子形式存在,但也有少量的而且数量相等的正、负离子形式,还有极少量的中性分子。
生物化学第一章绪论

1965年, Holly 排出酵母tRNAAla 的一级结构 1966年,Nirenberg & Khorana 破译了遗传密码 1970 年, Temin和 Baltimore 几乎同时发现逆向转录酶,证 实了 Temin 1964 年提出的“前病毒假说”,阐明在劳氏肉 瘤病毒(RSV)感染以后,首先产生含RNA病毒基因组全部 遗传信息的 DNA 前病毒,而子代病毒的 RNA 则是以前病毒 的DNA为模板进行合成。 1972 年~1973年, Berg 等成功地进行了 DNA 体外重组; Cohen创建了分子克隆技术,在体外构建成具有生物学功能 的细菌质粒,开创了基因工程新纪元。在此同时,Boyer等 在 E.coli 中成功表达了人工合成的生长激素释放抑制因子基 因
后发现维生素
1926年,美国化学家J. B. Sumner首次得到脲酶结晶 1912-1933,生物氧化得到了卓有成效的研究
30 年代,陆续得到了胃蛋白酶、胰蛋白酶、胰凝乳 蛋白酶,从而进一步证明酶是蛋白质
30年代,英国生化学家A.Krebs提出尿素循环和三羧 酸循环 40年代,能量代谢的提出为生物能学的发展奠定了 基础 此外,糖酵解途径、光合碳代谢途径得到证明,发 现了维生素和激素、血红素、叶绿素等
第一代转基因食品,是以增加农作物抗性和耐贮 性的转基因植物源食品。
这一代的转基因食品研究起始于20世纪70年代末80年代 初,是以转入抗除草剂基因、抗虫基因增加农作物的抗逆性 以及延迟成熟基因等为主要特点。
转基因抗虫水稻
转黄瓜抗青枯病基因的甜椒
生物化学-第一章绪论

脂肪酸、甘油和胆碱
•它们是脂肪和类脂质的组 成成分。类脂质中磷脂是 组建生物膜双层脂质的基 本物质。
2.物质代谢及调控
生代谢物是体生的物基体与本外特界征的新物陈质交代换谢过。程,
是活细胞进行的复杂的系列酶促反应过 程。
第一阶段:消化吸收
第二阶段:中间代谢过程
合成代谢、分解代谢、
第三阶段:排泄阶物段质互变、代谢调控和
SOD
对后续课程的作用
病理学 本课程为炎症、肿瘤、肝性脑病、酸碱 平衡学习提供分子基础。
药理学
酶类、溶栓类、肿瘤化疗类、抗病毒类、部 分降压类、糖尿病治疗类、降脂类药物的学 习均需生物化学知识。
专业课
内、外、妇、儿等专业课程发病机理、诊断 、治疗的学习必需有生物化学知识。
❖ 对象:一切生物有机体。 ❖ 医学生物化学以人体为研究对象,利用微生物
及动物实验研究获得大量有关生物分子的知识, 也可通过临床医疗实践积累人体生物化学的资 料。 ❖ 应用:其理论和技术广泛应用于临床实践和研 究。又与其他医学基础课程联系广泛。
二、生物化学的研究内容
生化的研究范围涉及整个生物界, 其内容以介绍生物界普遍存在的化 学物质和共同遵循的基本代谢规律 为主,适当结合专业实际。 课程内容主要由四部分组成:
20种氨基酸
2种单糖
•氨基酸是组成所有蛋白质分 子的单体,也参与许多其他结 构物质和活性物质的组成。
D-葡萄糖是植物光合作用的主要 产物,也是多糖化合物的主要单 体分子。D-核糖是核苷酸的组成 成分。
5种芳香族碱基
2种嘌呤(腺嘌呤和鸟嘌呤)和 3种嘧啶(胞嘧啶、尿嘧啶、胸 腺嘧啶)分别参加核苷酸的组 成。核苷酸是DNA和RNA分子 的前体,也是核苷酸类辅酶和 高能磷酸化合物ATP等三磷酸核 苷酸的前体。
生物化学 绪论

• 1926年Sumner证 明酶是蛋白质, 并结晶了脲酶。 他获1946年诺贝 尔奖。
Sumner在观察显微镜下的脲酶结晶
•1932年Hans A. Krebs发现了尿素循 环,1937年他又发现 三羧酸循环,1953年 获诺贝尔奖。
分子生物学时期的主要发现: 1952年,提出了蛋白质α-螺旋结构模型。 1953年,阐明胰岛素的一级结构。 1953年,Watson和Crick推导出DNA分子的双螺旋结构模型。 1958年,F.Crick提出分子遗传的中心法则。 1966年,由H.G.Khorana和Nirenberg合作破译了遗传密码。 1972年,Berg和Boyer等创建了DNA重组技术。 1977年,Berget等发现了“断裂”基因,并于1993年获诺贝 尔医学和生理学奖。 1981年~1983年,Cech和Altman相继发现某些RNA具有酶的催 化活性。 1985年,美国R.Sinsheimer首次提出“人类基因组研究计 划”。并于2003年,宣布人类基因组图绘制成功。 1997年,I.Wilmut成功获得体细胞克隆羊-多莉。
言
生物化学即“生命的化学”
根据研究对象不同 人体生化 植物生化 动物生化 微生物生化
医学生物化学 已成为医学领域重 要的前沿学科之一
The first part
生物化学概述
Biochemical Overview
一、生物化学的概念与任务 二、生物化学与生命的关系 三、生物化学的发展史
一、生物生化的概念与任务
学习目标
知识性目标 掌握生物化学的概念、生物大分子的含义、新陈代谢的 主要途径、能量转化的核心形式,以及遗传学中心法则。 熟悉生物化学的任务及主要研究内容。 了解生物化学的发展史、生物化学与医学的关系,生物 化学在护理工作中的作用。 技能性目标 通过本章学习,使学生能对生物化学有系统、整体认识。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物Hale Waihona Puke 量质代 释放能量 谢
代 谢
分解代谢(异化作用)
(catabolism)
大分子
小分子
新陈代谢的内涵
功 能 调 控 路 径
生物化学的分类
动物生化(zoic ~)、植物生化(botanic ~)、 微生物生化(microbial ~)、普通生化(general ~) 进化生化(Evolutional~)或比较生化(Comparative ~) 医学生化(medicinal~)、农业生化(agricultural~)、 工业生化(industrial~)、细胞生物化学(Cellular~) 、 机能生化(Functional ~)、 海洋生物化学(Marine ~)、分 子生物化学(Molecular ~ )、辐射生物化学(Radiation ~)
生物化学的发展史
1、静态生物化学时期(1920年以前) 研究内容以分析生物体内物质的化学组成、性质和含量为主。
2、动态生物化学时期(1950年以前) 物质代谢途径及动态平衡、能量转化,光合作用、生物氧化、
糖的分解和合成代谢、蛋白质合成、核酸的遗传功能、酶、维生 素、激素、抗生素等的代谢。
3. 机能生物化学时期(1950年以后) 生命的本质和奥秘:运动、神经、内分泌、生长、发育、繁
1838年,马采斯·史雷登( Matthais Schleiden)和泽奥多 尔·史旺(Theodor Schwann)证明,细胞是植物的结构单位。
史旺的学生Rudolf提出细胞学说,细胞是进行化学反应的场所。
(四)血红蛋白赋予血液红色
化学家恩斯特·霍普-席勒(Ernst Hoppe-Seyler)首次从血 液中分离出血红蛋白,证明“血液的红色是由血红蛋白的颜色引 起的”,并在1864年将血红蛋白制成了结晶(Crystal)。
“死亡之吻”
泛素(ubiquitin)介导的蛋白质降解
发现和改造了绿色荧光蛋白
发现端粒和端粒酶如何保护染色体
G蛋白偶联受体家族的发现和结构机理研究
蛋白质组:澳大利亚的 Wilkins和Williams 在 1994年提出,指一个细胞 或组织表达的所有蛋白质。 即一个基因组所编码转录 产生的一整套蛋白质。
基因信息传递受特殊机制调节
遗传信息的传递或表达受一定机制调控的。
1961年,Francis Jacob和Jacques Monod(诺贝尔奖, 1965)揭示了原核基因表达的开启和关闭是如何控制的。
1963年,Jacob,Monod和Jean-Pierre首先用酶活性 的“别构调节”(allosteric regulation)理论解释基因和机体 代谢功能是如何被调节的,从此引入了生物调节的概念。
(三)物质代谢与能量代谢偶联
1929年, Cyrus H. Fiske、 Yellapragada Subbarow和Karl Lohman分别发现了腺苷三磷酸(ATP)。
1941年,师从麦耶霍夫的Fritz Lipmann(诺贝尔奖,1953) 提出生物能过程中的ATP循环学说。
1948年, Eugene Kennedy和Albert Lehninger证明,催化三 羧酸循环反应的酶都分布在线粒体(mitochondrion),线粒体内膜 分布有电子传递体,可进行氧化磷酸化(oxidative phosphorylation)反应。
肯德鲁(Kendrew J.C.)和佩鲁茨 (Perutz M.F.)将X-射线应用于蛋 白质分子的高级结构研究,分别测 定了肌红蛋白和血红蛋白的结构; 二人于1962年分享诺贝尔化学奖;
目前X-射线衍射分析已成为蛋 白质与核酸高级结构研究常规方法。
Holley R.W., Khorana H.G., Nirenberg M.W.阐 明遗传密码及其在蛋白 质生物合成中的功能, 1968年诺贝尔生理或医 学奖; 目前,对蛋白质的生物 合成过程已基本清楚
发现免疫球蛋白的化学结构和单克隆抗体产生的原理
对核糖核酸酶的研究,特别是对其氨基酸 序列与生物活性构象之间的联系的研究做
出贡献
对核糖核酸酶分子的活性 中心的催化活性与其化学 结构之间的关系的研究
可逆的蛋白质磷酸化作用是一种生物调节机制
发现G蛋白(GTP结合 蛋白)及其在细胞中
的信号转导作用
发现蛋白质内的信号肽
三、20世纪50年代生物化学进入分子生物学时期
这个时期生物化学发展的几个特点:
物理学家,化学家和遗传学家加入到生物化学 领域中来,研究人员流动性增大。
研究方法有突破性改进,仪器公司和试剂公 司兴起。
各类科学期刊增多,以及计算机的存储,网 络的普遍使用,使信息的传递变得更为方便快捷。
(一)蛋白质研究的突破
Avery的发现揭示了遗传学与生物化学的特殊关 系,生物化学遗传学 (Biochemical Genetics)在那时 就提出来了。
DNA双螺旋是揭示遗传信息传递的“敲门砖”
在威尔金斯和弗兰克林工作的基础上,沃森 和克里克在1953年提出了DNA双螺旋结构模型 (double helix model)(诺贝尔奖,1962)。他们的 原创著作发表在Nature上,具有划时代的意义: DNA双螺旋结构是揭示遗传信息传递规律的“敲 门砖”和联系生物化学与遗传学的“桥梁 ”。从 此,生物化学发展进入了以生物大分子结构与功 能研究为主体的分子生物学时期。
(氰氢铵)
加热
(尿素)
NCONH4
H2NCONH2
(二)“燃烧”学说使“活力论”再次遭遇重创
尤斯图斯·冯·李比希(Justus Von Liebig) 在19世 纪20年代提出了著名的“燃烧”学说—动物通过呼吸获取 空气中的O2,氧化分解摄取的食物,产生水和CO2,并且释 放能量,保持体温,维持活力。
李比希将食物分为糖、脂和蛋白质三大类主要成分, 并提出物质在生物体内可进行合成和分解两种化学过程。 物质代谢(metabolism) 的概念就这样产生了。
(三)细胞是生命体的基本结构单位
既然生命活动是以化学反应为基础的,化学反应又是在何处进 行的?
1665年,马尔塞罗·马瑟季(Marcello Malpighi)发现红血球 (细胞)。同年, 罗伯特·胡克(Robert Hooke)发现植物树皮细 胞。
遗传信息按中心法则传递
1955年,Arthur Kornberg(诺贝尔奖,1959)在E. coli发 现了DNA聚合酶,揭开了DNA复制的秘密。
1959年又有人发现RNA聚合酶。 在克里克提出RNA中介假 说基础上,Marshall Nirenberg, Heinrich Matthaei, Philip Leder和H. Gobind Khorana等历经近10年研究,在1966年揭示 了遗传密码。1968年提出了遗传信息传递的中心法则。
(二)三羧酸循环是物质氧化分解的最终途径
1932年,汉斯·克雷勃斯 (Hans A. Krebs)和库尔 特·汉瑟雷特(Kurt Henseleit)发现了尿素循环 (urea cycle)反应途径。
1937年,克雷勃斯又解释 了三羧酸循环(tricarboxylic acid cycle)机制(诺贝尔奖, 1953)。
约翰·诺尔瑟普(John H. Northrop)在1930年制备了胃蛋白酶、胰 蛋白酶结晶。结合X(射)线晶体衍射 (X-ray crystallography)分析及 多肽成分分析,彻底揭开了“酶的化学本质是蛋白质”的事实。
二、20世纪上半叶是动态生物化学阶段
(一)糖酵解又称恩伯登-麦耶霍夫途径
生物化学
第一章 绪 论
该文档是极速PDF编辑器生成,
如果想去掉该提示,请访问并下载: /
授课提纲
生物化学的含义任务和分类 生物化学的发展简史 课程学习要求及参考书目
生物化学 (Biochemistry)的含义 —“Chemistry of the living cell”
细胞是如何通过分解反应获得能量的? 20世纪30年代末,科学家们详细描述了无氧时葡萄糖的 分解途径—(糖)酵解(glycolysis)的酶促反应顺序。古斯塔 夫·恩伯登(Gustav Embden)和奥托·麦耶霍夫(Otto Meyerhof) (诺贝尔奖,1922)对葡萄糖酵解的分子演绎过程贡献最大,因 此糖酵解途径又称恩伯登—麦耶霍夫途径(Embden-Meyerhof pathway)。
1897年,埃德尔德·布希奈 (Eduard Buchner) (诺贝尔奖, 1907)和汉斯·布希奈 (Hans Buchner) 两兄弟实验证明,无细胞的 酵母提取液仍可催化生醇发酵反应,使巴斯德关于“只有活的酵 母细胞才能进行发酵”的认识前进了一步。
20世纪初, 生物化学之父埃米尔·菲舍尔 (Emil Fischer)(诺贝尔奖,1902) 首次证明蛋白质是由不同数量、种类的氨基酸残基组成的多肽,并验证了他早 在1894年提出的酶催化作用的“锁-匙”学说。菲舍尔测定底物化学结构的方 法对 20世纪生物化学研究一直产生极大影响。
1953年,Frederick Sanger采用化学方法 完成了胰岛素 (insulin)序列分析 (诺贝尔奖,1958)。
1949年,Pauling(美国)指出镰 刀形红细胞性贫血是一种分子病, 发现某些蛋白质具有类似于螺旋 的结构 (ɑ螺旋),1954年获诺 贝尔奖。
Linus Pauling
1877年,霍普-席勒创立了德文《生理化学杂志》 (Zeitschrift für Physiologische Chemie)。
生物化学从生理学分出作为一门新的独立的学科诞生。
(五)酶是化学反应的主宰
1878年,威尔海姆·库奈 (Wilhelm Kühne)首先引入 “酶”(enzyme)的概念,用以描述能催化生物化学反应的“可溶 性催化剂”。
生物化学 (Biochemistry) —“Chemistry of the living cell”
