高二人教化学课件 乙烯
合集下载
高中化学必修2 第11讲 乙烯与有机高分子材料新课件)

经典例题
【例4】某同学设计实验探究工业制备乙烯的原理和乙烯
的主要化学性质,实验装置如图所示。
(1)用化学反应方程式解释B装置中的实验现象: __C_H_2_=_=_C__H_2_+__B_r_2―__→__C__H_2_B_r_—__C_H_2_B_r___。 (2)C装置中的现象是__酸__性__高__锰__酸__钾__溶__液__褪__色__,其发生反应的类型是__氧__化__还__原__反__应____。
___C_H_3_C_H_3____________ _____C_H_3_C_H_2_O_H________
③与 Cl2 加成: CH2 == CH2 + Cl2
CH2Cl-CH2Cl
④与 HCl 加成: CH2 == CH2 + HCl
CH3CH2Cl
知识精讲
四、乙烯的化学性质 3.乙烯的加聚反应 (1)加聚反应:由相对分子质量小的化合物通过加成反应相互结合成相对分子质量很大的 高分子化合物的反应。 (2)在适当的温度、压强和催化剂存在的条件下,乙烯分子中碳碳双键中的一个键断裂, 分子间通过碳原子相互结合形成很长的碳链,生成相对分子质量很大的聚合物——聚乙烯 ______________________________________________________________________________ (3)高分子有机物中的几个概念: 单体:聚合成高分子化合物的小分子化合物,如CH2=CH2; 链节:高分子化合物中的最小重复单元,如 — CH2 — CH2 —; 聚合度:高分子化合物中的链节数,如聚乙烯中的n。
知识精讲
三、炔烃 1.分子里含有碳碳三键的不饱和烃称为炔烃。 2.乙炔的结构
分子式
高中化学 3_2.1乙烯课件新人教版必修

个原子或原子团,所以加成后每个碳原子上至少有两个H原子,B选项
不符合。
解析答案
1
2
3
4
5
6
7
8
9
题组2 乙烯和烷烃的性质比较 3.下列关于乙烯和乙烷比较的说法中,不正确的是( ) A.乙烯的结构简式为CH2CH2,乙烷的结构简式为CH3CH3 B.乙烯分子中所有原子处于同一平面上,乙烷分子则为立体结构,原子不 都在同一平面上 C.乙烯分子中含有碳碳双键,乙烷分子中含有碳碳单键,双键不如单键稳 定,导致乙烯的性质比乙烷活泼 D.乙烯分子中因含有不饱和键,导致乙烯能使酸性KMnO4 溶液和溴的四 氯化碳溶液褪色
加成反应
有机物分子里的某些原子 有机物分子中不饱和碳原子 或原子团被其他原子或原 与其他原子或原子团直接结 子团所替代的反应 一般相等 取而代之有进有出 合生成新的化合物的反应 减少 加之而成有进无出
取代反应和加成反应是两类重要的有机反应,饱和烃的特征反应是取代 反应,不饱和烃的特征反应是加成反应。
第三章 第二节 来自石油和煤的两种基本化工原料
第1课时
乙
烯
目标 导航
1.了解烯烃的概念。 2.了解乙烯的物理性质,掌握其化学性质。
3.掌握乙烯的分子结构,初步体会其结构特点对性质的影响。
4.认识加成反应的特点,会书写乙烯发生加成反应的化学方程式。 5.了解乙烯的用途。
栏目 索引
基础知识导学 重点难点探究 随堂达标检测 分层训练
液除去(引入新的杂质),应用溴水洗气除去。
答案
返回
重点难点探究
一、乙烯的结构和性质 例1 右图是两种有机物的球棍模型: 代表H原子, 代表C原子,请回答 下列问题: C2H6 、________ C2H4 。 (1)Ⅰ、Ⅱ的分子式________ Ⅰ中含有碳碳单键,Ⅱ中含有碳碳 (2)说出Ⅰ、Ⅱ结构上的两点差异:①______________________________
新教材高中化学-乙烯课件

第七章 有机化合物
第二节 乙烯与有机高分子材料
第1课时 乙烯
学习目标
核心素养
宏观辨识与微观探析:
1.认识乙烯的结构及 其主要性质与应用。
1.能从原子、分子水平分析乙烯反应的微观特征。
2.知
道氧化
、加成
、2.能从乙烯的微观结构解释其化学性质。 科学探究与创新意识:
聚合反应等有机反应
类型。
1.能有较强的问题意识,根据已有乙烯的性质,
3.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,可依次将其通
过下列哪组试剂的洗气瓶
( B)
A.澄清石灰水,浓硫酸
B.溴水,浓硫酸
C.酸性高锰酸钾溶液,浓硫酸
D.浓硫酸,酸性高锰酸钾溶液
解析:乙烯与石灰水不反应,无法除乙烯,A项错;乙烯与溴水反
应产物是液体,再经浓硫酸除去水蒸气,B项正确;乙烯与酸性高锰酸
比较项目
化学 性质
相同点 (都能燃烧)
不同点 (特征反应)
乙烷
乙烯
点燃 2C2H6+7O2――→
4CO2+6H2O
点燃 C2H4+3O2――→2CO2
+2H2O
光 C2H6+Cl2――→
C2H5Cl+HCl
CH2 ===CH2+Br2 ―→CH2BrCH2Br 能使酸性高锰酸钾溶
液褪色
典例剖析
典例1 下列叙述正确的是
应用体验 1.下列说法正确的是
A.乙烯的电子式为
B.乙烯的球棍模型为 C.乙烯分子是空间平面结构 D.乙烯的结构简式为 CH2CH2
( C)
解析:乙烯含有碳碳双键,电子式为
,A 项错误;
碳原子半径大于氢原子半径,黑球应比白球大,B 项错误;乙烯分子中
第二节 乙烯与有机高分子材料
第1课时 乙烯
学习目标
核心素养
宏观辨识与微观探析:
1.认识乙烯的结构及 其主要性质与应用。
1.能从原子、分子水平分析乙烯反应的微观特征。
2.知
道氧化
、加成
、2.能从乙烯的微观结构解释其化学性质。 科学探究与创新意识:
聚合反应等有机反应
类型。
1.能有较强的问题意识,根据已有乙烯的性质,
3.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,可依次将其通
过下列哪组试剂的洗气瓶
( B)
A.澄清石灰水,浓硫酸
B.溴水,浓硫酸
C.酸性高锰酸钾溶液,浓硫酸
D.浓硫酸,酸性高锰酸钾溶液
解析:乙烯与石灰水不反应,无法除乙烯,A项错;乙烯与溴水反
应产物是液体,再经浓硫酸除去水蒸气,B项正确;乙烯与酸性高锰酸
比较项目
化学 性质
相同点 (都能燃烧)
不同点 (特征反应)
乙烷
乙烯
点燃 2C2H6+7O2――→
4CO2+6H2O
点燃 C2H4+3O2――→2CO2
+2H2O
光 C2H6+Cl2――→
C2H5Cl+HCl
CH2 ===CH2+Br2 ―→CH2BrCH2Br 能使酸性高锰酸钾溶
液褪色
典例剖析
典例1 下列叙述正确的是
应用体验 1.下列说法正确的是
A.乙烯的电子式为
B.乙烯的球棍模型为 C.乙烯分子是空间平面结构 D.乙烯的结构简式为 CH2CH2
( C)
解析:乙烯含有碳碳双键,电子式为
,A 项错误;
碳原子半径大于氢原子半径,黑球应比白球大,B 项错误;乙烯分子中
高中化学(新人教版)必修第二册:乙烯【精品课件】

【课堂练习】
2. 下列说法错误的是(C)
A.无论是乙烯与Br2的加成反应,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有 的碳碳双键有关 B.溴的四氯化碳溶液和酸性KMnO4溶液都可以鉴别乙烯和甲烷 C.相同质量的乙烯和甲烷完全燃烧后生成水的质量相同 D.乙烯的化学性质比乙烷的化学性质活泼
【课堂练习】
乙烯
学习目标 1、会写乙烯的分子式、结构式、结构简式、电子式。 2、知道乙烯能够发生氧化反应、加成反应、聚合反应。 3、理解加成反应的概念。
核心素养 1、微观探析:认识乙烯的组成、结构、性质和变化,形成“结构决定性质”的观念 2、证据推理:通过分析、推理认识乙烯发生加成反应时的断键和成键情况。
目录
二、乙烯的化学性质
1.氧化反应
(1)燃烧
点燃
CH2=CH2 + 3O2
2CO2 + 2H2O
现象:火分数较高,燃烧时碳并没有 完全被氧化,而本身被烧成炽热状态,故火焰明亮;又 由于一部分碳呈现游离态,所以有黑烟冒出。可以据此 检验乙烯和甲烷。
二、乙烯的化学性质
3.长途运输水果时,常常将浸泡有高锰酸钾溶液的硅土放置在盛放水果的容
器中,其目的是(C )
A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变 B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂 C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟 D.利用高锰酸钾溶液的氧化性,催熟水果
【课堂练习】
碳碳单键 C、H不全在一个平面内
2C2H6+7O2 ―点――燃→ 4CO2+6H2O C2H6+Cl2 ―光 ―→ C2H5Cl+HCl
不反应
碳碳双键 6个原子都在同一平面内
C2H4+3O2 ―点――燃→2CO2+2H2O CH2==CH2+Br2―→CH2BrCH2Br 因发生氧化反应而使其褪色
人教版高中化学必修二课件:3.2 乙烯(共28张PPT)

5、除去乙烷中混有的少量乙烯的方法,正确的 是( B ) A.通入氯气后进行光照 B.通入溴水 C.通入澄清的石灰水 D.点燃
6、1mol C2H4与Cl2完全加成,再与Cl2彻底取代, 两过程共用Cl2( ) C A.2 mol C.5mol B.4mol D.6mol
6.哪个有机物中碳原子都在同一平面内? A.CH3-CH=C-CH3 CH3
阅读课本 P 66 思考与交流有关内容
石油分馏中得到的石蜡油进一步加热会得 到什么?
科学探究
阅读课本P67
石蜡油分解实验
石蜡油的分解实验
① 石蜡油:17个C以 上的烷烃混合物 酸性:增强氧
化性。 ②碎瓷片:催化剂
③加热位置:碎瓷片 ④将生成气体通人酸性 高锰酸钾溶液中。
褪色,为什么? ⑤生成的气体通入溴的四氯化碳溶液褪色,为什么?
思考:该烯烃的双键在哪两个碳原子之间 只能是③④之间
1.工业上的乙烯主要来源于 石油化工 ,它是一 难 溶于水。 种 无 色、 稍有气味 味的气体,____ 实验室制取乙烯时用 排水 法收集。 2 .下列物质不可能是乙烯加成产物的是 (B ) A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
H2O 聚合
CH3—CH2Cl
CH3—CH2OH
[ CH2—CH2]n
?你能想出几种方法鉴别C H 和CH
2 4
4
1.分别点燃两种气体,燃烧时有黑烟的是乙烯 2.分别通入酸性高锰酸钾溶液中,能使溶液 褪色的是乙烯 3.分别通入溴水中,能使溴水褪色的是乙烯
知识小结(重点掌握)
一、乙烯的结构(平面型分子)
[ CH2—CH2 ]n
聚合反应:
nCH2=CH2
新教材人教版高中化学必修第二册课件-乙烯

1934 年甘恩(Gane)才首先证明植物组织确实能产生乙烯。随着气相色 谱技术的应用,使乙烯的生物化学和生理学研究方面取得了许多成 果,并证明在高等植物的各个部位都能产生乙烯,1966 年乙烯被正式 确定为植物激素。
[素材二] 乙烯在工业方面的应用 (1)乙烯涉及很多方面,是重要的有机化工基本原料,主要用于生 产聚乙烯、氯乙烯及聚氯乙烯,乙苯、苯乙烯及聚苯乙烯以及乙丙橡 胶等。
2.下列关于乙烯分子的叙述中错误的是( ) A.乙烯分子中所有原子都在同一平面上 B.CH3CH===CH2 分子中所有原子都在同一平面上 C.乙烯分子中碳氢键之间的夹角为 120° D.碳碳双键是乙烯的官能团
B [CH3CH===CH2 的空间结构为 多为 7 个。]
,共面原子最
3.下列关于乙烯的说法正确的是( ) A.乙烯使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色的原理相 同 B.工业上利用乙烯水化法制乙醇,是发生了取代反应 C.水果运输中为延长果实成熟期,常在车厢里放置浸泡过酸性 KMnO4 溶液的硅藻土 D.乙烯在空气中燃烧,火焰明亮并带有浓烟
(2)在有机合成方面,广泛用于合成乙醇、环氧乙烷及乙二醇、乙 醛、乙酸、丙醛、丙酸及其衍生物等多种基本有机合成原料;经卤化, 可制氯代乙烯、氯代乙烷、溴代乙烷;经齐聚可制 α-烯烃,进而生产 高级醇、烷基苯等。
(3)同时乙烯也是空气污染物之一,工业区乙烯含量可达到 1 ppm(百万分之一),能够生成甲醛和一氧化碳,危害人类健康。
A.甲烷(CH4)
B.一溴甲烷(CH3Br)
C.乙烯(CH2===CH2)
D.CH3—CH===CH—CH3
D [甲烷是正四面体结构,在一个平面上最多含有 3 个原子;一 溴甲烷分子是甲烷分子中的 1 个氢原子被溴原子取代产生的,在一个 平面上最多有 3 个原子;乙烯分子是平面分子,分子中 6 个原子在同 一个平面上;2 个甲基取代乙烯分子中的 2 个氢原子,甲基中的碳原 子以及该碳原子上的 1 个氢原子与乙烯面共平面,最多有 8 个原子在 同一个平面内,D 正确。]
人教版高中化学必修2-乙烯(共33张PPT)

Br Br CH2CH2 1,2-二溴乙烷
——可用于鉴别或除杂。 Br Br (CH2BrCH2Br) 无色油状液体, 密度比水大,
不溶于水,易溶于CCl4 。
迁移应用
试写出乙烯与H2 、HCl 、H2O发生加成反应 的化学方程式。
催化剂
CH2=CH2 + H-H △
CH3-CH3 乙烷
催化剂
CH2=CH2 + H-Cl
石油裂解气: 主要成分是乙烯, 还含有丙烯、异丁 烯、甲烷、乙烷、 异丁烷、硫化氢和 碳的氧化物等。
一、乙烯的分子结构
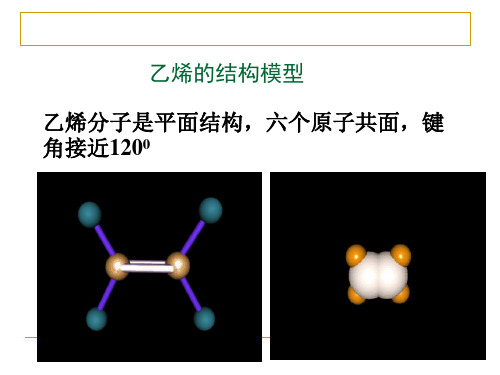
分子式
C2H4
球棍模型
电子式
结构式 结构简式 CH2= CH2
CH2CH2
比例模型
空间构型: 平面型分子 6个原子共平面
( 键角约120° )
六个原子共面
约120°
约120°
约120°
研究表明,石蜡油分解的产物 主要是烯烃和烷烃的混合物
资料卡片 石油的裂化、裂解
催化剂
CC168HH3146
△
催化剂
C8CH81H8 16
△
C4H10 C4H10
催化剂
△
催化剂
△
CC8H4H1810++CC8H4H168 辛烷 辛烯
C4H10 + C4H8 丁烷 丁烯
C2H4 + C2H6 乙烯 乙烷 CH4 + C3H6 甲烷 丙烯
• 8、普通的教师告诉学生做什么,称职的教师向学生解释怎么做,出色的教师示范给学生,最优秀的教师激励学生。上午10时55分 53秒上午10时55分10:55:5324.3.4
实验 通入酸性高锰酸钾溶液中
人教版-必修二-化学乙烯课件ppt
1. 乙烯通入酸性高锰酸钾溶液—紫色退去 2. 通入溴的四氯化碳溶液—红棕色退去 3. 通入溴水—黄色退去 4. 能燃烧,发出明亮的火焰。
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
注意问题:
(1)浓硫酸:浓硫酸与乙醇的体积比为3:1 (2)对反应温度的要求:170℃以下及170 ℃以上不能 有效脱水,故必须迅速将温度升致170℃并保持恒温。 140 ℃时分子间脱水生成乙醚和水 170℃以上浓硫酸使乙醇脱水炭化
现象、 用途
CH2=CH2 +H-Cl →CH3CH2Cl
CH2=CH2
+
H-OH
催化剂 加热、加压
CH3CH2OH
加成反应:
有机物分子中双键或叁键两端的碳原子与其他原 子或原子团直接结合生成新的化合物的反应。
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
△
C2H5OH+2H2SO4(浓)==2C+2SO2↑+5H2O
△
C2H5OH+4H2SO4(浓)==2CO↑+4SO2↑+7H2O
△
C2H5OH+6H2SO4(浓)==2CO2↑+6SO2↑+9H2O
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
4、烯烃的命名
(1)在分子中含有多个双键时,选择满 足有尽可能多的双键的最长的碳链的为主 链,并命名为某烯; (2)从最靠近双键的这一端开始编号; (3)其它命名同烷烃。
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
注意问题:
(1)浓硫酸:浓硫酸与乙醇的体积比为3:1 (2)对反应温度的要求:170℃以下及170 ℃以上不能 有效脱水,故必须迅速将温度升致170℃并保持恒温。 140 ℃时分子间脱水生成乙醚和水 170℃以上浓硫酸使乙醇脱水炭化
现象、 用途
CH2=CH2 +H-Cl →CH3CH2Cl
CH2=CH2
+
H-OH
催化剂 加热、加压
CH3CH2OH
加成反应:
有机物分子中双键或叁键两端的碳原子与其他原 子或原子团直接结合生成新的化合物的反应。
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
△
C2H5OH+2H2SO4(浓)==2C+2SO2↑+5H2O
△
C2H5OH+4H2SO4(浓)==2CO↑+4SO2↑+7H2O
△
C2H5OH+6H2SO4(浓)==2CO2↑+6SO2↑+9H2O
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
4、烯烃的命名
(1)在分子中含有多个双键时,选择满 足有尽可能多的双键的最长的碳链的为主 链,并命名为某烯; (2)从最靠近双键的这一端开始编号; (3)其它命名同烷烃。
化学乙烯课ppt课件

乙烯共聚物
乙烯还可与其他单体(如丙烯、苯 乙烯等)共聚,生成各种共聚物, 广泛应用于包装、建筑、汽车等领 域。
05
乙烯在工业上的应用
聚乙烯的生产与应用
聚乙烯的生产
通过乙烯的聚合反应得到聚乙烯 ,反应条件包括高温高压、催化
剂等。
聚乙烯的种类
根据聚合方法和分子结构的不同 ,聚乙烯可分为低密度聚乙烯( LDPE)、高密度聚乙烯(HDPE
废水排放
乙烯生产还会产生大量的废水,其中含有许多有机物和重金属离子等污染物。这 些废水如果未经处理直接排放到水体中,会对水生生物和人类造成危害。
降低乙烯生产对环境的影响
采用清洁生产技术
通过改进生产工艺和设备,减少废气、废水的产生和排放。例如,采用高效催化剂、优化 反应条件等。
加强废气、废水处理
对产生的废气、废水进行严格的处理,确保达到国家排放标准后再进行排放。例如,采用 活性炭吸附、生物处理等废气处理技术;采用化学沉淀、膜分离等废水处理技术。
安全防护措施
在生产和使用乙烯的过程中,必须采取严格的安全防护措施 。例如,穿戴防护服、戴防毒面具、保持通风等。此外,还 应定期进行安全检查和培训,提高员工的安全意识。
乙烯生产过程中的环保问题
废气排放
乙烯生产过程中会产生大量的废气,其中含有许多有害物质,如二氧化碳、硫化 氢等。这些废气如果未经处理直接排放到大气中,会对环境造成严重的污染。
技术成熟度与产量
石油裂解法技术成熟,产量高;天然 气转化法技术也在不断发展完善,产 量逐渐提高。
环境保护与可持续性
石油裂解法在生产过程中会产生一定 的环境污染;天然气转化法相对较为 环保,且原料来源广泛,具有更好的 可持续性。
适用场景与选择建议
乙烯还可与其他单体(如丙烯、苯 乙烯等)共聚,生成各种共聚物, 广泛应用于包装、建筑、汽车等领 域。
05
乙烯在工业上的应用
聚乙烯的生产与应用
聚乙烯的生产
通过乙烯的聚合反应得到聚乙烯 ,反应条件包括高温高压、催化
剂等。
聚乙烯的种类
根据聚合方法和分子结构的不同 ,聚乙烯可分为低密度聚乙烯( LDPE)、高密度聚乙烯(HDPE
废水排放
乙烯生产还会产生大量的废水,其中含有许多有机物和重金属离子等污染物。这 些废水如果未经处理直接排放到水体中,会对水生生物和人类造成危害。
降低乙烯生产对环境的影响
采用清洁生产技术
通过改进生产工艺和设备,减少废气、废水的产生和排放。例如,采用高效催化剂、优化 反应条件等。
加强废气、废水处理
对产生的废气、废水进行严格的处理,确保达到国家排放标准后再进行排放。例如,采用 活性炭吸附、生物处理等废气处理技术;采用化学沉淀、膜分离等废水处理技术。
安全防护措施
在生产和使用乙烯的过程中,必须采取严格的安全防护措施 。例如,穿戴防护服、戴防毒面具、保持通风等。此外,还 应定期进行安全检查和培训,提高员工的安全意识。
乙烯生产过程中的环保问题
废气排放
乙烯生产过程中会产生大量的废气,其中含有许多有害物质,如二氧化碳、硫化 氢等。这些废气如果未经处理直接排放到大气中,会对环境造成严重的污染。
技术成熟度与产量
石油裂解法技术成熟,产量高;天然 气转化法技术也在不断发展完善,产 量逐渐提高。
环境保护与可持续性
石油裂解法在生产过程中会产生一定 的环境污染;天然气转化法相对较为 环保,且原料来源广泛,具有更好的 可持续性。
适用场景与选择建议
烯烃课件下学期高二化学人教版选择性必修3

①共价键的形成:分子中的碳原子均采取sp2杂化,碳原子与氢原
子形成σ键,两碳原子之间形成双键(1个σ键和1个π键)。
②空间结构:乙烯分子中的所有原子都位于同一平面,相邻两个键
之间的夹角约为120°。
2、乙烯的性质
物理性质 纯净的乙烯为无色、稍有气味的气 体,难溶于水,密度比空气略小。
氧 ①可燃性 C2H4+3O2 点燃 2CO2+2H2O 化
(3)密度: 随C数目的增加而增大;但相对密度都小于1
(4)溶解性:几乎不溶于水;但可溶于有机溶剂
四、烯烃的化学性质 【思考与讨论】
(1)写出乙烯、丙烯与下列物质反应的化学方程式,并说明反应中官能团和化 学键的变化。(提示:丙烯与氯化氢、丙烯与水的反应都可能有两种产物。)
试剂
乙烯
溴
CH2=CH2+Br2→CH2BrCH2Br
产生顺反异构现象。 2.顺反异构体 相同的原子或原子团位于双键同一侧的称为顺式结构,相同的原子或原
子团位于双键两侧的称为反式结构,例如顺-2-丁烯和反-2-丁烯的结构简
式分别是
和
3.顺反异构的条件 碳碳双键的每个碳原子必须连接两个不同的原子或原子团。
有顺反异构的类型
无顺反异构的类型
4.性质顺反异构体的化学性质基本相同,物理性质有一定的差异。
CH3CH2CH2OH CH3CH(OH)CH3
(2)含有碳碳双键官能团的有机化合物在一定条件下能发生类似乙烯
的加聚反应。例如,氯乙烯可以通过加聚反应生成聚氯乙烯:
催化剂
nCH2 == CH C1
[ CH2—CH ]n C1
请根据乙烯、氯乙烯发生的加聚反应,分别写出丙烯、异丁烯
发生加聚反应的化学方程式。
【高中化学】乙烯PPT课件12(4份)
火焰明亮并伴有黑 烟,生成CO2和H2O
褪色,发生氧化反应
褪色,发生加成反应
通入Br2水或 Br2的CCl4溶 液
能用于鉴别甲烷和乙烯的试剂是 ( AB ) 练1:
A. 溴水 C. NaOH溶液
B.酸性高锰酸钾溶液 D.四氯化碳溶液
B.CH3CHCl2 D.CH3CH2Br
(B ) 练2下列物质不可能是乙烯加成产物的是 : A.CH3CH3 C.CH3CH2OH
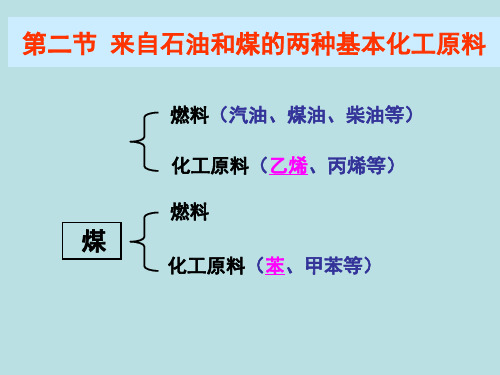
第二节 来自石油和煤的两种基本化工原料
燃料(汽油、煤油、柴油等)
化工原料(乙烯、丙烯等) 燃料
煤
化工原料(苯、甲苯等)
乙烯的用途:Leabharlann 塑料袋,薄膜等 高分子材料
乳化剂,洗涤剂,防冻剂
燃料,塑料,增塑剂
植物生长调节剂,催熟剂
杀虫剂
高分子材料
无纺布
醋酸纤维
管材
小 资 料
产量可以用来衡量一个国家的石油化工 发展水平。
1. 制塑料、合成纤维、有机溶剂。
2. 植物生长调节剂,果实催熟剂等。
小结
分子式 通式
CH4 (烷烃)
CnH2n+2
(n≥1整数) 烷烃只含碳碳单键 淡蓝色火焰 生成CO2和 H 2O 不反应,无现象 不反应,无现象
C2H4 (烯烃)
CnH2n
(n≥2整数)
结构 燃烧
通入酸性 KMnO4溶液
含有C=C
收集方法: 排水法
三、乙烯的化学性质
1、氧化反应
(1)燃烧 CH2=CH2+3O2
点燃
C
C 的性质!
2CO2+2H2O
(2)被酸性高锰酸钾氧化
现象: 酸性高锰酸钾溶液褪色。
褪色,发生氧化反应
褪色,发生加成反应
通入Br2水或 Br2的CCl4溶 液
能用于鉴别甲烷和乙烯的试剂是 ( AB ) 练1:
A. 溴水 C. NaOH溶液
B.酸性高锰酸钾溶液 D.四氯化碳溶液
B.CH3CHCl2 D.CH3CH2Br
(B ) 练2下列物质不可能是乙烯加成产物的是 : A.CH3CH3 C.CH3CH2OH
第二节 来自石油和煤的两种基本化工原料
燃料(汽油、煤油、柴油等)
化工原料(乙烯、丙烯等) 燃料
煤
化工原料(苯、甲苯等)
乙烯的用途:Leabharlann 塑料袋,薄膜等 高分子材料
乳化剂,洗涤剂,防冻剂
燃料,塑料,增塑剂
植物生长调节剂,催熟剂
杀虫剂
高分子材料
无纺布
醋酸纤维
管材
小 资 料
产量可以用来衡量一个国家的石油化工 发展水平。
1. 制塑料、合成纤维、有机溶剂。
2. 植物生长调节剂,果实催熟剂等。
小结
分子式 通式
CH4 (烷烃)
CnH2n+2
(n≥1整数) 烷烃只含碳碳单键 淡蓝色火焰 生成CO2和 H 2O 不反应,无现象 不反应,无现象
C2H4 (烯烃)
CnH2n
(n≥2整数)
结构 燃烧
通入酸性 KMnO4溶液
含有C=C
收集方法: 排水法
三、乙烯的化学性质
1、氧化反应
(1)燃烧 CH2=CH2+3O2
点燃
C
C 的性质!
2CO2+2H2O
(2)被酸性高锰酸钾氧化
现象: 酸性高锰酸钾溶液褪色。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A. CO C. C2H4
B. CO2 D. C2H6
5. 乙烯发生的下列反应中,不属于加成反 应的是 (
ቤተ መጻሕፍቲ ባይዱ
D)
A. 与氢气反应生成乙烷
B. 与水反应生成乙醇 C. 与溴水反应使之褪色 D. 与氧气反应生成二氧化碳和水
6. 四氯乙烯对环境有一定的危害,干洗衣服 的干洗剂主要成分是四氯乙烯;家用不粘锅内 侧涂覆物质的主要成分是聚四氟乙烯。下列关 于四氯乙烯和聚四氟乙烯的叙述中正确的是 C A、它们都属于纯净物
【实验】 将乙烯通入盛有溴的四氯化碳溶液的 试管中,观察试管内的颜色变化。 现象:乙烯使溴的四氯化碳溶液褪色
我是 溴分子
五.乙烯的化学性质
2 加成反应
现象:乙烯使溴的四氯化碳溶液褪色
板书
H
H C
H C H + Br Br
H
H H C C H Br Br
1,2 - 二溴乙烷
CH2=CH2+Br2
六、乙烯的用途
(1)有机化工原料
(2)植物生长调节剂,水果
催熟剂
乙烯易加成,不取代,可使
酸性高锰酸钾褪色。
练习:
1. 下列有关乙烯的说法中不正确的是( C) A.乙烯分子的双键中有一个键较易断裂 B.乙烯分子中所有的原子均在同一个平 面上 C.乙烯分子中C=C的键长是乙烷分子中 C-C的键长的2倍 D.乙烯易发生加成反应,乙烷易发生取代 反应
研究表明,石蜡油分解的产物
主要是烯烃和烷烃的混合物
二、烯烃
1、定义: 链烃分子里含有碳碳双键(C=C) 的不饱和烃叫做烯烃 2、(单烯烃,一个双键)通式 CnH2n (C≥2)
板书
最简单的烯烃是:
乙烯
三、乙烯的结构
任何键之间的键均角为:1200
空间结构: 平面结构,分子中的所 有原子均在一个平面上
四.乙烯的物理性质
乙烯是无色气体,稍有气味,密度比空气
略轻(分子量28),难溶于水。
乙烯的收集方法:
排水法
板书
五.乙烯的化学性质
1、氧化反应 a 燃烧反应 C2H4+3O2
点燃
2CO2+2H2O
火焰明亮并伴有有黑烟 b 与酸性高锰酸钾 乙烯可被KMnO4(H+)氧化成CO2, 高锰酸钾褪色
五.乙烯的化学性质
H H-C
—
H C-H
—
H H
—
—
+a
b
H-C-C-H
—
a b
加成反应:有机物分子里不饱和的碳原子跟其
它原子或原子团直接结合生成别的 物质的反应叫做加成反应。
—
板书
3、 加聚反应
(纯净物) 聚合物、高分子化合物
(混合物)
由不饱和的相对分子质量小的化合物分子结合
成相对分子质量大的化合物分子的反应,叫做 加聚反应 。
2、不能用于鉴别甲烷和乙烯的试剂是 ( C
)
A.溴的四氯化碳溶液 B.酸性高锰酸钾溶液
C.苛性钠溶 液
D.溴水
3、制取一氯乙烷最好采用的方法是 ( C )
A.乙烷和氯气反应 C.乙烯和氯化氢反应 B.乙烯和氯气反应 D.甲烷和氯气反应
4. 既可以使溴水褪色,又可以使酸性高锰酸钾溶
液褪色的气体有 ( C )
B、它们都能使酸性高锰酸钾溶液褪色
C、它们的分子中都不含氢原子
D、它们都可由乙烯只发生加成反应得到
如果把青桔子和熟苹果放在同一个 塑料袋里,系紧袋口,这样一段时间后青 桔子就可以变黄、成熟
?
这是谁的功劳?
乙 烯
来自石油和煤的两种基本化工原料
乙烯
板书
一、乙烯的来源 乙烯是从石油中获得的,乙烯的产量 可以用来衡量一个国家的石油化工发 展水平。
科学探究
:石蜡油(17个C以上)分解实验
(1)将产生的气体分别通入酸性高锰酸钾溶液, 褪色 观察现象;_________ (2)将产生的气体分别通入溴的四氯化碳溶液, 褪色 观察现象;__________ (3)用排水集气法收集 一试管气体,点燃观察现象。 明亮的火焰 _____________
三、乙烯的结构
分子式: 电子式:
C 2H 4
板书
结构式:
结构简式:
CH2=CH2
CH2CH2
空间结构: 平面结构,分子中的所 有原子均在一个平面上
乙烯分子内碳碳双键的键能 (615KJ/mol)小于碳碳单键键能 (348KJ/mol)的二倍,说明其中 有一条碳碳键键能小,容易断裂, 不稳定。
板书
CH2CH2 Br Br 1,2-二溴乙烷
乙烯还可以与氯气、水、氯化氢、氢气等物 质发生加成反应,写出方程式. CH2=CH2+Cl2→CH2Cl-CH2Cl CH2=CH2+H2O
→CH -CH -OH
3 2
催化剂
CH2=CH2+HCl
→CH -CH -Cl
3 2
催化剂
催化剂
CH2=CH2+H2 → CH3-CH3
