2006年重庆高考理综 化学部分 非常好的版本 强烈推荐
重庆一中高2006级3月月考

重庆一中高2006级3月月考 理科综合能力测试试题卷理科综合能力测试试题分选择题和非选择题两部分。
第一部分(选择题),第二部分(非选择题)。
满分300分,考试时间150分钟。
以下数据可供解题时参考:相对原子质量(原子量):H 1 C 6 O 8 Na 23第一部分(选择题 共126分)选择题一(本题包括13小题,每小题6分,共78分。
每小题只有一个....选项符合题意) 1.右图是某一DNA 片段,下列关于该图的叙述,正确的是: A .若图中ACT 决定一个氨基酸, 则ACT 可称为一个密码子B .限制性内切酶和DNA 连接酶都可作用于②处C .若该片段能与RNA 聚合酶结合, 则该片段为基因的编码区D .DNA 复制过程需解旋酶作用于 ①处,而转录不需要2.下列关于抗体的叙述,错误的是A .人首次接触过敏原时,不产生抗体,只产生组织胺等物质B .抗体与病毒结合后,一般可使病毒失去侵染宿主细胞的能力C .抗体蛋白的加工、运输和分泌过程充分体现了各种生物膜的密切联系D .单克隆抗体是单个效应B 细胞通过某种手段克隆形成细胞群所产生的 3.下列叙述中正确的是A .在生态系统中能量往往伴随着物质而循环利用B .在光合作用中光能以它原来的形式储存于糖类中C .ATP分子聚集能量和释放能量的过程中都与磷酸分子有关D .叶绿体既进行光合作用又进行呼吸作用4.某一哺乳动物的体细胞有16对染色体,假设一个初级卵母细胞在产生卵细胞的过程中,一个次级卵母细胞在分裂时有一条染色体的两个姐妹染色单体移向了同一极,则这个初级卵母细胞产生正常卵细胞的机率是A .21 B. 0 C. 31 D. 415.如图所示某种单基因病在一家庭中的发病情况。
有关叙述不正确的是A .该致病基因一般不可能在细胞质中B .该致病基因是隐性基因C .控制这种遗传病的基因不一定 存在于X 染色体上D.若Ⅱ1是一患该病的女儿,则致病基因一定在X染色体上6.据报道,德国Integral公司研究出一种新的冷却技术,并荣获德国环境大奖。
2006年普通高等学校招生全国统一考试(重庆卷.理)含详解
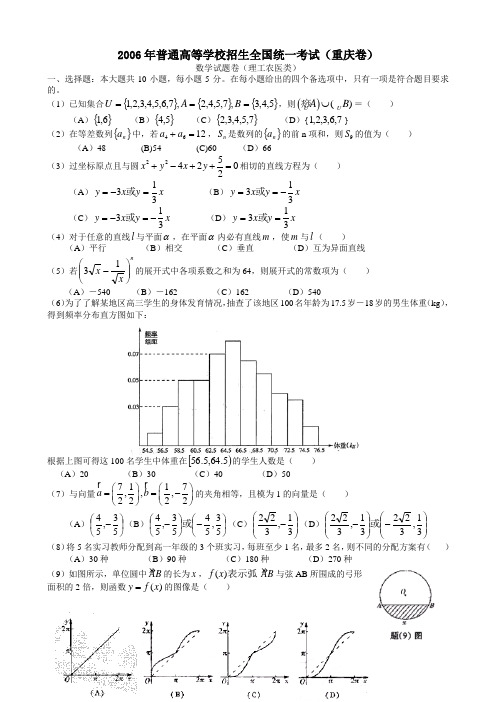
2006年普通高等学校招生全国统一考试(重庆卷)数学试题卷(理工农医类)一、选择题:本大题共10小题,每小题5分。
在每小题给出的四个备选项中,只有一项是符合题目要求的。
(1)已知集合{}{}{}5,4,3,7,5,4,2,7,6,5,4,3,2,1===B A U ,则()()U U A B ⋃痧=( )(A ){}6,1 (B ){}5,4 (C ){}7,5,4,3,2 (D ){7,6,3,2,1}(2)在等差数列{}n a 中,若4612a a +=,n S 是数列的{}n a 的前n 项和,则9S 的值为( ) (A )48 (B)54 (C)60 (D )66(3)过坐标原点且与圆2254202x y x y +-++=相切的直线方程为( ) (A )x y x y 313=-=或 (B )x y x y 313-==或(C )x y x y 313-=-=或 (D )x y x y 313==或(4)对于任意的直线l 与平面α,在平面α内必有直线m ,使m 与l ( )(A )平行 (B )相交 (C )垂直 (D )互为异面直线(5)若nx x ⎪⎪⎭⎫ ⎝⎛-13的展开式中各项系数之和为64,则展开式的常数项为( )(A )-540 (B )-162 (C )162 (D )540(6)为了了解某地区高三学生的身体发育情况,抽查了该地区100名年龄为17.5岁-18岁的男生体重(kg ),得到频率分布直方图如下:根据上图可得这100名学生中体重在[)5.64,5.56的学生人数是( ) (A )20 (B )30 (C )40 (D )50(7)与向量7117,,,2222a b ⎛⎫⎛⎫==- ⎪ ⎪⎝⎭⎝⎭的夹角相等,且模为1的向量是( )(A )⎪⎭⎫ ⎝⎛-53,54(B )⎪⎭⎫ ⎝⎛-⎪⎭⎫ ⎝⎛-53,5453,54或(C )⎪⎪⎭⎫ ⎝⎛-31,322(D )⎪⎪⎭⎫ ⎝⎛-⎪⎪⎭⎫ ⎝⎛-31,32231,322或 (8)将5名实习教师分配到高一年级的3个班实习,每班至少1名,最多2名,则不同的分配方案有( )(A )30种 (B )90种 (C )180种 (D )270种(9)如图所示,单位圆中AB 的长为x ,()f x 表示弧 AB 与弦AB 所围成的弓形面积的2倍,则函数()y f x =的图像是( )(10)若,,0a b c >且()4a a b c bc +++=-则2a b c ++的最小值为( )(A 1 (B 1 (C )2 (D )2 二、填空题:本大题共6小题,每小题4分,共24分。
2006年重庆市初中毕业生学业暨高中招生考试化学试题

Ed ward.根据短文内容,回答问题。
96.What was wrong with the wife?97.Did the wi fe go shopping wi th her husband?98.Where did the husband put the baby while he wasshopping?99.What did the woman in the supermarket thi nk ofthe husband at firs t?100.Who is the father,George or Edward?五、书面表达(共10分)!.请以∀My Hobby 为题写一篇短文。
说说你的爱好是什么?你为什么喜欢它?它对你的生活或学习产生了什么样的影响?要求:1.语句通顺,合乎逻辑。
2.词数60#80。
3.文中请勿使用真实的姓名与学校名称。
注:参考答案见本期第47页。
(考 评 提供)2006年重庆市初中毕业生学业暨高中招生考试化学试题可能用到的相对原子质量:H#1 O#16 S#32一、选择题(每小题2分,共30分;每小题只有一个选项符合题意)1.厨房里发生的下列变化中不包含化学变化的是( ).(A)沼气燃烧(B)铁锅生锈(C)水沸腾(D)蔬菜腐烂2.小巧在家里测定了一些液体的p H,她的测定或记录一定有误的是( ).(A)雨水pH=5(B)柠檬汁p H=2(C)肥皂水p H=4(D)洗涤剂p H=123.林强家里种的花出现叶子发黄的现象,老师告诉他需要施氮肥,他应该施用以下肥料中的( ).(A)NH4HCO3(B)Ca3(PO4)2(C)KCl(D)K2SO44.水是宝贵的自然资源,以下关于水的叙述中正确的是( ).(A)冰的密度小于水的密度(B)水由氢气和氧气组成(C)生活废水不会污染江河(D)淡水资源取之不尽5.建设节约型社会人人有责.下列节约行为中合理可行的是( ).(A)直接用工厂排出的废水灌溉农田(B)吃经高温蒸煮后的霉变大米(C)把用剩的药品放回原试剂瓶(D)用洗菜、洗衣服的水冲厕所6.合理利用燃料,防止污染环境是可持续发展的重要方面.关于燃料的说法错误的是( ).(A)酒精是比汽油更环保的燃料(B)天然气是比煤更清洁的燃料(C)氢气是比天然气更理想的燃料(D)石油是工厂经常使用的燃料7.每年的6月26日是国际禁毒日.一种新型毒品K粉的主要成分是盐酸氯胺酮,盐酸氯胺酮的化学式为C13H16ONCl,它会对大脑造成永久损害.下列叙述中错误的是( ).(A)青少年应该远离毒品(B)K粉是纯净物(C)盐酸氯胺酮由五种元素组成(D)盐酸氯胺酮中氢元素和氧元素的质量分数相同8.二氧化碳的下述用途没有利用其化学性质的是( ).(A)CO2用作气体肥料432007年第3期(B)C O 2用于灭火(C)干冰用于人工降雨(D)CO 2用来制Na 2C O 39.下列陈述不正确的是( ).(A)分子可以分解成原子(B)原子由原子核和电子构成(C)阳离子得到电子变成原子(D)原子失去电子变成阴离子10.(课改实验区考生做)材料与人类生活紧密相关.下列物品与所用材料的对应关系不正确的是( ).(A)羊绒衫###天然纤维(B)汽车轮胎###塑料(C)食品袋###塑料(D)不锈钢餐具###铁合金(非课改实验区考生做)对下列物质性质的描述中错误的是( ).(A)AgCl 是白色固体(B)无水CuSO 4是蓝色固体(C)Fe 3O 4是黑色固体(D)Fe(OH)3是红褐色固体11.以下判断正确的是( ).(A)只有在点燃或加热时,可燃物才能燃烧(B)只要温度达到着火点,可燃物就能燃烧(C)只有含碳元素的物质才能燃烧(D)只要使可燃物温度降到着火点以下,就能够灭火12.能够说明∀分子间存在间隔 的事实是( ).(A)空气被压缩后体积缩小(B)1L 芝麻和1L 绿豆混匀后体积小于2L (C)走近花园,闻到花香(D)2L H 2和O 2的混合气体点燃后体积小于2L 13.实验室制取氧气时,必须满足的条件是( ).(A)必须使用催化剂(B)(C)(D)14.KAl (SO 4)m 可( ).(A)1(B)215.按酸、碱、盐、氧化物的顺序排列的一组物质是( ).(A)H 2SO 4、Na 2CO 3、NaCl 、CuO(B)H 2O 、Ca(OH)2、HCl 、Na 2SO 4(C)H 2SO 4、NaOH 、Na 2CO 3、Fe 2O 3(D)NaOH 、H 2CO 3、NaCl 、C O 2二、填空题(共44分)16.(4分)(课改实验区考生做)某校食堂中餐食谱如下:主食:大米饭配菜:红烧排骨 煎鸡蛋 炸鸡腿 豆腐汤炒猪肝主食和配菜中主要含维生素、、、、无机盐和水等营养素,考虑到各种营养成分的均衡搭配,应该增加的配菜是.(非课改实验区考生做)氢气和一氧化碳都具有的化学性质是性和性,点燃它们之前都需要,实验室制取它们时都可用法收集.17.(6分)小强在厨房里发现一瓶没有标签的无色液体.(1)他闻了闻,初步判断为白醋,小强是利用白醋的(填∀物理 、∀化学 )性质作出的判断;(2)他取少量此液体放入玻璃杯中,加入纯碱,产生气体,说明该液体含有(填∀酸性 、∀碱性 或∀中性 )物质,进一步判断为白醋;(3)他另取少量此液体滴入石蕊试液,溶液变为色,要使其变为蓝色,可向其中加入(填编号).a.食盐b.熟石灰c.白酒d.水18.(9分)写出下列反应的化学方程式,并指出其基本反应类型:(1)磷在氧气中燃烧:( )(2)加热高锰酸钾制氧气:( )(3)将铁片放入硫酸铜溶液中:( )19.(3分)为了探究影响金属与酸反应剧烈程度的因素,进行了如表1所记录的实验.表 144中学教与学由此得出影响金属与酸反应剧烈程度的因素包括:因素一:;因素二:;因素三:.20.(12分)从HCl 、NaCl 、NaOH 、Na 2CO 3、Ca(OH)2几种溶液中取出其中的两种混合,可能的组合共有种.(1)若混合后溶液的质量减小,可能的组合是、;(2)若混合后溶液的质量不变,但发生了化学反应,有关的化学方程式为: ;图1(3)将稀硫酸逐滴滴入剩下的几种组合中,若产生的气体与加入的稀硫酸有如图1所示的关系,则这样的组合可能是 .21.(10分)20∃时,取相同质量的a 、b 、c 三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40∃,固体的溶解情况如图2所示.图3为a 、b 、c 三种物质的溶解度曲线.请仔细阅读图2和图3,回答下列问题:图2图3(1)三种物质的溶解度关系为b>a>c 时的温度为t ,则t 的取值范围是;(2)烧杯甲里是物质的溶液,烧杯乙里是物质的溶液;(3)40∃时,烧杯里的溶液中溶剂最少;(4)各种状态下,各烧杯(甲、乙、丙)里的溶液溶质的质量分数的比较一定正确的是.(A)甲(状态2)>甲(状态1)(B)乙(状态1)>甲(状态3)(C)甲(状态1)=乙(状态2)(D)乙(状态3)>丙(状态3)三、实验题(共16分)22.(6分)(1)选择仪器的序号填空:%量筒 &烧杯 ∋玻璃棒 (试管 )蒸发皿常用作少量药品反应的容器是,用于量取一定体积的液体的仪器是;(2)为完成过滤操作,除选用(1)中的部分仪器外,还缺少的玻璃仪器是.23.(10分)化学兴趣小组用以下装置探究炼铁的原理.(1)加热Fe 2O 3之前要先通一会儿C O ,目的是 ;(2)如图4所示的实验装置中的方框里连接的是C 和D,导管接口的连接顺序为a ∗( )∗( )∗( ),如果导管连接错误,后果是;图4(3)玻璃管A 中发生反应的化学方程式为,用这种方法∀炼 得的铁与工业上炼出的生铁在组成上的最大区别是 .四、计算题(共10分)24.(3分)煤炭中往往含有硫,直接燃烧产生的二氧化硫会污染环境.计算含硫400g 的煤炭燃烧时产生二氧化硫的质量.25.(7分)过氧化氢的水溶液俗称双氧水,其在放置过程中会缓慢分解,化学方程式为:2H 2O 22H 2O+O 2+现有一瓶未曾使用过的、久置的双氧水,瓶上商品标签提供了如下信息:%H 2O 2的质量分数为30%;&内装溶液的质量为1000g.经实验测定,其中H 2O 2的质量分数仅为10%.(1)若用这瓶双氧水配制H 2O 2的质量分数为3%的医用双氧水1500g,需用这种双氧水的质量是452007年第3期多少?(2)计算这瓶双氧水中已分解的过氧化氢的质量.(计算结果保留整数)注:参考答案见本期封三.(考 评 提供)九年级结课英语质量检测题参考答案一、1#5 CACAB 6#10 AABCB 11#15 BB CAA 16#20 CBABC 21#25 CBABB 26#30 ACCCB二、31#35 BCBC A 36#40 ADABC 41#45 CCACC三、46#50 ABCDC 51#55 ABDCD四、56#60 DDCCA 61#65 CACDD 66#70 CDBAB五、71#72 i s worth 73#74 rich in 75#76 used to 77#78 trying out 79#80 knocked down六、81.No,I haven t 82.How did it happen 83. What did the driver do with hi m 84.How is the child now85.I hope everything goes well七、86#90 FFTFT八、91.says 92.and 93.play 94.spend95.way e 97.read 98.make 99.with 100.public九、略听力录音稿A)1.May I borrow your bicycle,please?2.Who i s that girl?3.How was your holiday?4.How does he work in the factory?5.What s wrong wi th you,young man?6.Why was Mr.Wang worried?7.Where have you been this morning?8.Why didn t you stay a little longer?B)9.T om is a schoolboy.He is15.10.My friends had a good ti me in the park yesterday.11.I received a letter from Ji m yesterday.12.T he dictionary is very expensive.13.This cake is the biggest of the three.14.Shall we leave at a quarter past ten?15.People from Hunan prefer hot food to sweet food.16.∀Don t make any noise,Bill. the teacher said.C)17.M:What bad weather!I don t like the rain!W:The rain won t last long.The radio says it will be fine later on.18.M:What would you li ke to do this Sunday?W:How about goi ng fishing?M:That s not a bad idea.19.W:You look worried.What s the matter,Paul?M:I left my homework at home.20.M:Are we going to have an English exam nextweek?W:No,we aren t.But don t you know we are going to help some farmers wi th their orangeharvest next week?M:Wonderful!Working on the farm is much bet ter than having any classes!21.W:Are you going to spend the Spring Festivalhere in China?M:No,I m goin g abroad to spend the holidays.W:Where are you going?M:Australia.There are lots of beautiful places to visit,and the weather there is nice.22.M:E x cuse me.Where s the nearest post office?W:Walk along this street.Take the second turn ing on the left.T hen go ahead.You ll find agreen house between a bookshop and ahospital.That s the post office.23.W:Mr.and Mrs.Lee,thank you very much forsuch nice food.I m afraid I ll have to go backnow.M:Please come over again.Take good care of yourself.W:Thanks a lot.24.W:Did you see the football match yesterdayevening,David?M:Oh,I missed it,Alice!By the time I turned on the TV,it had already finished.W:Never mind.It s just a waste of time.D)听下面一段材料,回答第25至第27题。
2006年高考理科综合化学试卷分析

2006年高考理科综合化学试卷分析金耀宗一、2006年高考化学试题概览(一)理科综合:全国四套、北京卷、天津卷单科卷:广东卷、江苏卷、上海卷注:特别关注以上八套试卷,分析考试说明,重点考查内容是什么?新增知识点是否涉及,如果未涉及特别关注。
(二)2006年理科能力测试化学试题的特点1、注重考查学科主干知识2、注重观察能力的考查在今年高考化学学科的考试中,加大了对于考生观察能力的考查。
3、继续突出实验能力的考查化学是以实验为基础的学科,化学实验的考查一直是化学试卷的重点内容。
在2006年高考的化学试题中,更加突出了对于学生实验能力的考查。
4、突出了思维能力的考查思维能力是高考中多种能力的核心,其与观察能力、实验能力、自学能力密切相关。
5、突出考查自学能力自学是人类获取知识的主要途径。
在2006年的高考试题中,从培养学生可持续发展的角度,继续突出考查了自学能力。
二、2006年高考化学命题特点分析2006年高考理综卷化学试题,可以看出,今年试题题型与去年相比具有以下特点:(一)试题难度基本保持稳定近两年高考理综卷化学试题难度较前几年明显降低,对此虽然一些教师和部分学生颇有微词,但难度降低这是事实,而且我认为以后几年的命题还将继续保持这样的趋势。
原因有二:其一,这样命题有利于新课改的开展。
如果题目难度过大,势必将学生引入题海中,使学生陷入“睁开眼是题,闭了眼还是题”的境况,他们哪里有时间进行社会调查,探究创新?作为教师只能无可奈何地进行“应试教育”。
其二,有利于缩小普通学校与名校的差距。
因为题目简单了;名校学生能完成的题目,普通学校一些学生也能完成,名校学生能得高分,普通学校的学生照样也能得高分,这就必然使各校之间的差距缩小,使“择校热”降温,从根源上解决教育乱收费的问题,而且符合目前党中央提出的“构建和谐社会”的目标。
当然,也有些教师和学生认为,试题简单不利于名牌高校选拔新生。
而我认为,虽然试题难度降低了,但并不影响它的区分度,优秀学生依然能考取高分,并不影响高校招生。
2006年高考重庆卷理综试卷及答案

2006年普通高等学校招生全国统一考试(重庆)理科综合能力测试试题卷第I卷以下数据可供解题时参考:相对原子质量(原子量):H 1 O 16 S 32 Cl 35.5 Br 80 Fe 56 Pb 207选择题一(本题包括18小题。
每小题只有一个选项符合题意)1.题I图是某生态系统的食物网示意图。
甲~庚代表不同的生物,箭头表示能量流动的方向和食物联系。
下列叙述正确的是A 此食物网中有六条食物链,丁占有四个不同的营养级B 戊接受的太阳能是流经此生态系统的总能量C 丙可利用的总能量小于乙和丁可利用的总能量之和D 向此生态系统大量引入外来物种,可增强该系统的稳定性2.下列有关生物新陈代谢的叙述,正确的是A 完成有氧呼吸所需要的酶由线粒体DNA指导合成B 植物根系吸收矿质元素的速率与土壤溶液中矿质离子的浓度成正比C 用15N标记的蛋白质饲喂小白鼠,一段时间后可在其肝糖元中发现15ND 用14CO2研究玉米的光合作用过程,最早在C4化合物中检测到14C3.下列所述环境条件下的微生物,能正常生长繁殖的是A 在缺乏生长素的无氨培养基中的圆褐固氮菌B 在人体表皮擦伤部位的破伤风杆菌C 在新配制的植物矿质营养液中的酵母菌D 在灭菌后的动物细胞培养液中的禽流感病素4.下列有关生物大分子在细胞内转移的叙述,错误的是A 分泌蛋白可由核糖体进入内质网B DNA可由细胞核进入线粒体C mRNA可由细胞核进入细胞质D tRNA可由细胞质基质进入核糖体5.在用脊蛙(去除脑保留脊髓的蛙)进行反射弧分析的实验中,破坏缩腿反射弧在左后肢的部分结构,观察双侧后肢对刺激的收缩反应,结果如下表:刺激部位反应破坏前破坏后左后肢左后肢收缩右后肢收缩左后肢不收缩右后肢不收缩右后肢左后肢收缩右后肢收缩左后肢不收缩右后肢收缩上述结果表明,反射弧的被破坏部分可能是A 感受器B 感受器和传入神经C 传入神经和效应器D 效应器6.下列做法正确的是A 将浓硝酸保存在无色玻璃瓶中B 用镊子取出白磷并置于水中切割C 把氯酸钾制氧气后的残渣倒入垃圾桶D 氢气还原氧化铜实验先加热再通氢气7.设N A代表阿伏加德罗常数,下列说法正确的是A 5.6g铁与足量盐酸反应转移的电子数为0.3N AB 100mL 2.0mol/L的盐酸与醋酸溶液中氢离子数均为0.2N AC 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2N AD 20g 重水(D 2O )中含有的电子数为10N A8.能正确表示下列反应的化学方程式是A 黄铁矿煅烧:2FeS 2+5O 22FeO +4SO 2B 石英与石灰石共熔:SiO 2+CaO CaSiO 3C 氨的催化氧化:4NH 3+5O 24NO +6H 2OD 氯气与石灰乳反应:2Cl 2+2Ca(OH)2=CaCl 2+CaClO 2+2H 2O9.温度相同、浓度均为0.2mol/L 的①(NH 4)2SO 4、②NaNO 3、③NH 4HSO 4、④NH 4NO 3、⑤-ONa 、⑥CH 3COONa 溶液,它们的pH 值由小到大的排列顺序是A ③①④②⑥⑤B ①③⑥④②⑤C ③②①⑥④⑤D ⑤⑥②④①③10.25℃、101kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol 、285.8kJ/mol 、890.3kJ/mol 、2800kJ/mol ,则下列热化学方程式正确的是A C(s)+1/2O 2(g)=CO(g);△H =-393.5kJ/molB 2H 2(g)+O 2(g)=2H 2O(g);△H =+571.6kJ/molC CH 4(g)+2O 2(g)=CO 2(g)+2H 2O(g);△H =-890.3kJ/molD 1/2C 6H 12O 6(g)+3O 2(g)=3CO 2(g)+3H 2O(l);△H =-1400kJ/mol11.已知反应mX(g)+nY(g)qZ(g)的△H <0,m +n >q ,在恒容密闭容器中反应达到平衡时,下列说法正确的是A 通入稀有气体使压强增大,平衡将正向移动B X 的正反应速率是Y 的逆反应速率的m/n 倍C 降低温度,混合气体的平均相对分子质量变小D 增加X 的物质的量,Y 的转化率降低12.利尿酸在奥运会上被禁用,其结构简式如题12图所示。
2006全国各地高考化学试题汇集及答案详解

2006年普通高等学校招生全国统一考试理科综合能力测试(I)1、在常温常压下呈气态的化合物,降温使其固化得到的晶体属于A、分子晶体B、原子晶体C、离子晶体D、何种晶体无法判断2、下列叙述正确的是A 同一主族的元素,原子半径越大,其单质的熔点一定越高B 同一周期元素的原子,半径越小越容易失去电子C 同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高D 稀有气体元素的原子序数越大,其单质的沸点一定越高3、用N A代表阿伏加德罗常数,下列说法正确的是A 0.5mol Al与足量盐酸反应转移电子数为1N AB 标准状况下,11.2L SO3所含的分子数为0.5N AC 0.1mol CH4所含的电子数为1N AD 46g NO2和N2O4的混合物含有的分子数为1N A4、把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为A、1︰2︰3B、3︰2︰1C、6︰3︰1D、6︰3︰25、浓度均为0.1mol·L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是A BaCl2 NaOH NaHCO3B Na2CO3 MgCl2 H2SO4C AlCl3 NH3·H2O NaOHD Ba(OH)2 CaCl2 Na2SO46、在0.1mol·L-1CH 3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是A 加入水时,平衡向逆反应方向移动B 加入少量NaOH固体,平衡向正反应方向移动C 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小D 加入小量CH6COONa.固体,平衡向正反应方向移动7、茉莉醛具有浓郁的茉莉花香,其结构简式如下所示:关于茉莉醛的下列叙述错误的是A 在加热和催化剂作用下,能被氢气还原B 能被高锰酸钾酸性溶液氧化C 在一定条件下能与溴发生取代反应D 不能与氢溴酸发生加成反应8、由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为A、0.15mol·L-1B、0.2mol·L-1C、0.3mol·L-1D、0.4mol·L-19、X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
2006年高考全国理综试卷(Ⅱ)化学部分有答案(word版)

2006年高考全国理综试卷(Ⅱ)化学部分6.反应 2A(g) + B(g) 2C(g);△H > 0 。
下列反应有利于生成C的是:A. 低温、低压B. 低温、高压C. 高温、高压D. 高温、低压7.将纯水加热至较高温度,下列叙述正确的是:A. 水的离子积变大、pH变小、呈酸性B. 水的离子积不变、pH不变、呈中性C. 水的离子积变小、pH变大、呈碱性D. 水的离子积变大、pH变小、呈中性8.下列反应的离子方程式书写正确的是:A. 氯化铝溶液中加入过量氨水:Al3+ + 4NH3•H2O AlO2- + 4NH4+ + 2H2OB. 澄清石灰水与少量苏打溶液混合:Ca2+ + OH- + HCO3- CaCO3↓ + H2OC. 碳酸钙溶于醋酸CaCO3 + 2H+ Ca2+ + CO2↑ + H2OD. 氯化亚铁溶液中通入氯气:2Fe2+ + Cl2 2Fe3+ + 2Cl-9.某氯化镁溶液的密度为1.18g•cm-1,其中镁离子的质量分数为5.1%。
300mL该溶液中Cl-离子的物质的量约等于:A. 0.37molB. 0.63molC. 0.74molD. 1.5mol10.已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2 → H2O IO3- → I2 MnO4-→ Mn2+ HNO3→ NO如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是:A. H2O2B. IO3-C. MnO4-D. HNO311.下列叙述正确的是:A. NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心B. CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心C. H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央D. CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央12.下列叙述正确的是:A. 直径介于1nm ~10nm 之间的微粒称为胶体B. 电泳现象可证明胶体属于电解质溶液C. 利用丁达尔效应可以区别溶液与胶体D. 胶体粒子很小,可以透过半透膜13. 主链含5个碳原子,有甲基、乙基2个支链的烷烃有:A. 2种B. 3种C. 4种D. 5种26、(15分)可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:(1) 试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序入操作是(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是(3)实验中加热试管的目的是:①②(4) 试管b中加有饱和Na2CO3溶液,其作用是(5)反应结束后,振荡试管b静置,观察到的现象是27、(15分)已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以气态化合物,则(1)X是、Y是、Z是(2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是和(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式(分子式)是28.(15分)以下一些氧化物和单质之间可以发生如下图所示的反应:加氧气其中,氧化物(I )是红棕色固体,氧化物(II )、(III )、(IV )在反应条件下都是气体。
重庆市渝西中学2006-2007学年11月高三理科综合(化学部分)月考试题

重庆市渝西中学2006-2007学年高三理科综合化学部分月考试题(2006 年11 月)6. 2004年,美国科学家通过”勇气"号太空车探测出火星大气中含有一种称为硫化羰(化学式为COS)的物质。
已知硫化羰分子中所有原子最外层均满足8电子结构。
下列说法正确的是A •硫化羰是酸性氧化物B .硫化羰结构式为S=C=OC .硫化羰属于非极性分子D .硫化羰为分子晶体,沸点比CO2低7 .设N A表示阿伏加德罗常数的值,下列说法中不正确的是A .如果5.6L N2含有n个氮分子,则阿伏加德罗常数一定约为4nB . 15.6g Na2O2与过量CO2反应时,转移的电子数为0.2 N AC.在一定条件下,6.4g SO2与足量。
2反应生成SO3的分子数为0.1N AD . T C时,1 L pH=6纯水中,含10 N A个OH8. 化学用语是学习化学的重要工具,下面用来表示物质变化的化学用语中,正确的是A .氢气燃烧的热化学方程式:2H2(g)+ O2(g)=2H2O(l) ; △ H= +570kJ • molB .甲烷碱性燃料电池的负极反应:CH4+10OH 一—8e_= CO32一+7H2OC.饱和FeCb溶液滴入沸水中的反应:FeCb+3H2O = Fe(OH) 3+3HCl fD .铝片溶于氢氧化钠溶液:Al+2OH 一=AlO2_+H2f9. 某溶液中大量存在以下五种离子:NO3一、SO42-、Fe3+、H+、M ,其物质的量之比为一2一3+ +n(NO3 ): n(SO4 ):n(Fe ): n(H ):n(M)=2 :3:1:3:1,则M 可能是2+ 2+ —2+A . FeB . Mg C. Cl D. Ba10. 已知:①向KmnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeC"溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色•下列判断正确的是—3+A .上述实验证明氧化性:MnO4 > Cb> Fe > I2B .上述实验中,共有两个氧化还原反应C .实验①生成的气体不能使湿润的淀粉KI试纸变蓝D .实验②证明Fe2+既有氧化性又有还原性11. 向含1mol HCl和1mol MgSO 4的混合溶液中加入1mol • L「1的Ba(OH) 2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是C DA B12. 下列叙述不正确的是A .用酒精清洗沾到皮肤上的苯酚*r请填写下列空白:(1)写出下列物质的化学式: _ B ; C ; D(2 )写出下列反应的离子方程式:① H+E (溶液)〜M ___________________________________________________________ ② 用石墨电极电解 F 和G 的混合物 _______________________________________________________B .用冷凝的方法从氨气、氮气和氢气混合气中分离出氨C •用盐析的方法分离油脂皂化反应的产物D .用氨水清洗试管壁附着的银镜13.下列有关物质性质的描述不正确的是A . SO 2气体通入溴水中使溴水褪色,属于氧化还原反应B •胶体能发生电泳现象是由于胶体粒子带电C . BrCI 与 Br 2、CI 2 的化学性质相似,则 BrCI+H 20=HBr+HCI0D •在Al (OH ) 3胶体中逐渐加入稀的 Ba ( OH ) 2溶液至过量,先有沉淀后沉淀溶解 26. (14分)甲、乙、丙、戊都具有如图所示的结构或结构单元,图中正四面体以外可能有的部 分未画出,虚线不表示化学键或分子间作用力, X 、Y 可以相同也可以不同。
2006年高考理科综合试题及答案全国卷1解析

2006年普通高等学校招生考试全国理科综合卷(I化学部分以下数据可供解题时参考:相对原子质量(原子量:H 1 C 12 N 14 O 166.在常温常压下呈气态的化合物,降温使其固化得到的晶体属于A.分子晶体B.原子晶体C.离子晶体D.何种晶体无法判断答案:A备注:晶体类型的判断7.下列叙述正确的是A.同一主族的元素,原子半径越大,其单质的熔点一定越高B.同一周期元素的原子,半径越小越容易失去电子C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高D.稀有气体元素的原子序数越大,其单质的沸点一定越高答案:D备注:元素周期律的应用备注:元素周期律及元素周期表的应用8.用N A代表阿伏伽德罗常数,下列说法正确的是A.0.5molAl与足量盐酸反应转移电子数为1N AB.标准状况下,11.2LSO3所含的分子数为0.5N AC.0.1molCH4所含的电子数为1N AD.46gNO2和N2O4的混合物含有的分子数为1N A答案:C备注:阿伏伽德罗常数及其定律和推论的应用9.把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为A.1:2:3B.3:2:1C.6:3:1D.6:3:2答案:D备注:电荷转移守恒;电解法制备金属单质10.浓度均为0.1mol·L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是A.BaCl2NaOH NaHCO3B.Na2CO3MgCl2H2SO4C.AlCl3NH3·H2O NaOHD.Ba(OH2CaCl2Na2SO4答案:B备注:常见酸碱盐的反应11.在0.1mol·L-1CH3COOH溶液中存在如下电离平衡: CH3COOH H++CH3COO-对于该平衡,下列叙述正确的是A.加入水时,平衡向逆反应方向移动B.加入少量NaOH固体,平衡向正反应方向移动C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+减小D.加入少量CH3COONa固体,平衡向正反应方向移动答案:B备注:电离平衡;浓度对电离平衡的影响12.茉莉醛具有浓郁的茉莉花香,其结构简式如下所示: CC CHOHCH2(CH23CH3关于茉莉醛的下列叙述错误的是A.在加热和催化剂作用下,能被氢气还原B.能被高锰酸钾酸性溶液氧化C.在一定条件下能与溴发生取代反应D.不能与氢溴酸发生加成反应答案:D备注:碳-碳双键、醛基的化学性质13.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+=0.4mol·L-1, SO =0.8mol·L-1,则c(K+为c(24A.0.15mol·L-1B.0.2mol·L-1C.0.3mol·L-1D.0.4mol·L-1答案:C备注:离子的物质的量浓度计算26.(9分X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
2006年普通高等学校招生全国统一考试重庆卷综
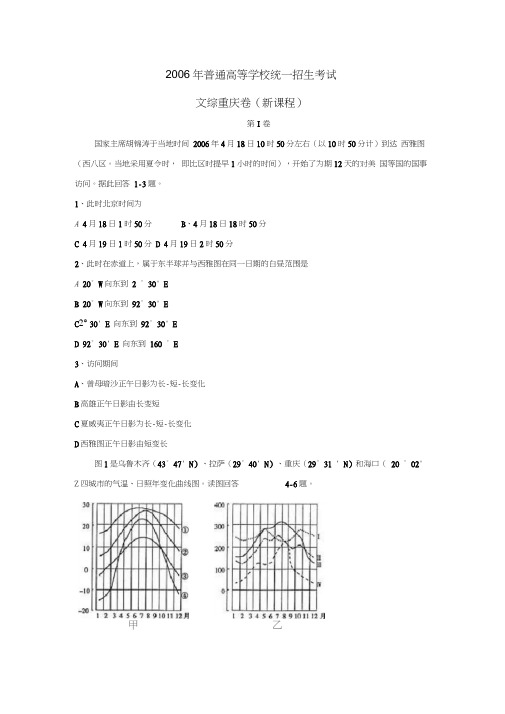
2006年普通高等学校统一招生考试文综重庆卷(新课程)第I卷国家主席胡锦涛于当地时间2006年4月18日10时50分左右(以10时50分计)到达西雅图(西八区。
当地采用夏令时,即比区时提早1小时的时间),开始了为期12天的对美国等国的国事访问。
据此回答1-3题。
1、此时北京时间为A 4月18日1时50分B、4月18日18时50分C 4月19日1时50分D 4月19日2时50分2、此时在赤道上,属于东半球并与西雅图在同一日期的白昼范围是A 20° W向东到 2 ° 30' EB 20° W向东到92° 30' EC2°30' E 向东到92° 30' ED 92° 30'E 向东到160 ° E3、访问期间A、曾母暗沙正午日影为长-短-长变化B高雄正午日影由长变短C夏威夷正午日影为长-短-长变化D西雅图正午日影由短变长图1是乌鲁木齐(43° 47' N)、拉萨(29° 40' N)、重庆(29° 31 ' N)和海口(20 ° 02' Z四城市的气温、日照年变化曲线图。
读图回答4-6题。
甲乙4、甲图中能反映气温受地势影响较大的曲线是A、①B、②C③ D、④5、乙图中代表重庆、拉萨日照年变化的曲线是A、H、IB、□、山C W、ID W、山6、四城市中气温曲线与日照曲线组合正确的是A、①—川B、②—nC③—W D④—川图2中数码①—⑦代表陆地自然带,“干”、“湿”表示水分状况。
读图回答7 —9 :题。
北 --------- 1 ----- 1——I ----------- 1------- M④③ ② ① ② ③④+ ----- 说西------- ------- 东®⑥⑦图27、甲大陆北端地处两大板块交界地带,这两大板块是A、亚欧板块、非洲板块B、亚欧板块、印度洋板块C美洲板块、非洲板块D美洲板块、印度洋板块8、两大陆陆地自然带类型相同的是A、①与⑤B、①与⑥C③与⑤ D③与⑥9、与①所处纬度相当的表层海域相对于⑦东侧表层海域A、温度高、盐度低B、温度高、盐度高图3为三个区域的人口统计图。
2006年普通高等学校招生全国统一考试理科综合能力测试(重庆卷)

空气水图 162006年普通高等学校招生全国统一考试理科综合能力测试(重庆卷)选择题一(每小题6分,每小题只有一个....选项符合题意) 14.如图14所示,在同一竖直平面内,小球a 、b 从高度不同的两点分别以初速度v a 和v b沿水平方向抛出,经过时间t a 和t b 后落到与两抛出点水平距离相等的P 点。
若不计空气阻力,下列说法正确的是[ A ]A .t a >t b ,v a <v bB .t a >t b ,v a >v bC .t a <t b ,v a <v bD .t a <t b ,v a >v b解析:此题平抛运动,小球在空中运动的时间由竖直方向的分运动决定,根据212h gt =,可得t a >t b ,水平方向做匀速直线运动,根据s =v 0t 可得v a <v b ,故选A 。
15.宇航员在月球上做自由落体这实验,将某物体由距月球表面高h 处释放,经时间t 后落月球表面(设月球半径为R ),据上述信息推断。
飞船在月球表面附近绕月球做匀速圆周运动所必须具有的速率为 [ B ] ABCD解析:根据自由落体知识可得:212h gt =,根据万有引力定律和圆周运动公式可得:22GMm v m R R =, 2GMmmg R=,v =v =故选B 。
16.如题16图,某同学将空的薄金属筒开口向下压入水中。
设水温均匀且恒定,筒内空气无泄漏,不计气体分子间相互作用,则被淹没的金属筒在缓慢下降过程中,筒内空气体积减小。
[ C ]A .从外界吸热B .内能增大C .向外界放热D .内能减小解析:薄金属筒可以传导热量,水温均匀且恒定,因此在缓慢下降过程中,筒内温度保持不变,由于不考虑气体分子间的相互作用,因而内能不变;体积减小,外界对空气做功,根据ΔE =Q +W 可推知,气体必须对外界放热。
故选C 。
图 1417.14C 是一种半衰期为5730年的放射性同位素。
若考古工作者探测某古木中14C 的含量为原来的14,则该古树死亡时间口中距今大约为 [ B ] A .22920年 B .11460年 C .5730年 D .2865年解析:根据半衰期公式可得:11()42t=,t=5730×2年=11460年,故应选B 。
2006年全国高考化学试题分析2007年化学命题趋势

(2)将ZY3溶液滴入沸水可得到红褐色液体, 反应的离子方程式是:
Fe3++3H2O 高温 Fe(OH)3(胶体)+3H+ ________________________________________, 此液体具有的性质是_________(填写序号字母)。 a b d a.光束通过该液体时形成光亮的“通路” b.插入电极通直流电后,有一极附近液体颜 色加深 c.向该液体中加入硝酸银溶液,无沉淀产生 d.将该液体加热、蒸干、灼烧后,有氧化物 生成
例2(2006—全国Ⅱ—13)主链含5个碳原 子,有甲基、乙基2个支链的烷烃有: A A 2种 B 3种 C 4种 D 5种
例3(2006-北京-9)将aL NH3通过灼热的装 有铁触媒的硬质玻璃管后,气体体积变为bL(气体 体积均在同温同压下测定),该bL气体中NH3的体 积分数是: C
2a b A. a
(1)六套理科综合能力测试的化学试题 均依据2006年理科综合考试大纲命题,展示了 命题的连续性和稳定性。2006年全国卷Ⅱ与 2005年全国卷Ⅲ相近。 北京卷、天津卷的化学试题则与2005年两 市的高考化学试题相联系;上海、江苏两省市 的化学单科试题与2005年的化学单科试题表现 出命题的连续性和力考查力度。
例1(2006-全国Ⅰ-10)浓度均为0.1mol· -1的三 L 种溶液等体积混合,充分反应后没有沉淀的一组溶液 是: B
A. B. C. D.
BaCl2 NaOH NaHCO3 Na2CO3 MgCl2 H2SO4 AlCl3 NH3· 2O NaOH H Ba(OH)2 CaCl2 Na2SO4
(3)X单质在空气中燃烧生成一种无色有刺激性 气味的气体。 ①已知一定条件下,每1 mol该气体被O2氧化 放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下 发生反应,达到平衡时放出的热量是176.4 kJ,则 90% 该气体的转化率为________。 ②原无色有刺激性气味的气体与含1.5 mol Y的 一种含氧酸(该酸的某盐常用于实验室制取氧气)的 溶液在一定条件下反应,可生成一种强酸和一种氧 化物,若有1.5×6.02×1023个电子转移时,该反应 的化学方程式是:
重庆市2006年普通高中毕业考试

重庆市2006年普通高中毕业考试物理试卷注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,考试时间90分钟,分值共100分。
2.答题前,考生务必将自己的姓名、准考证号、考试科目等填写在答题卡及答题卷规定的位置上。
3.第Ⅰ卷(选择题)答在答题卡上,第Ⅱ卷(非选择题)答在答题卷上,考试结束,将答题卡和答题卷一并交回。
第Ⅰ卷选择题(共51分)一、选择题(本题共17小题,每小题3分,共51分。
在每小题给出的四个选项中只有一项是正确的)1.下列物理量中,属于矢量的是A.位移B.时间C.质量D.路程2.下面所列的各种力,根据力的效果命名的是A.重力B.阻力C.弹力D.摩擦力3.一个物体受两个共点力的作用,它们的大小分别是3N和10N,则它们的合力大小不可能...的是A.13N B.10NC.8N D.3N4.关于物体做匀变速直线运动,下列说法中正确的是A.物体的速度较小,其加速度一定较小B .物体的速度减小,其位移一定减小C .物体的加速度较小,其速度变化量一定较小D .物体的加速度较小,其速度变化一定较慢 5.下列关于惯性的说法中正确的是A .只有静止或做匀速直线运动的物体才具有惯性B .物体运动的速度越大,惯性越大C .两个质量相等的物体,惯性大小相同D .在太空中的宇航员没有惯性6.在显微镜下观察稀释了的墨汁,将会看到 A .碳颗粒的无规则运动 B .碳分子的无规则运动 C .水分子的无规则运动D .水分子和碳颗粒的无规则运动7.关于单摆振动的周期,下列说法正确的是A .摆球质量越大,周期越小B .振幅越大,周期越小C .摆长越长,周期越小D .摆长越长,周期越大8.在匀强电场中放入带电量为q 的正点电荷时,电场对它的作用力为F ,方向竖直向上,则下列判断正确的是A .匀强电场的场强q F E =,方向竖直向上B .匀强电场的场强qF E =,方向竖直向下C .匀强电场的场强qF E =,方向竖直向上D .匀强电场的场强qFE =,方向竖直向下9.“物体是由大量分子组成的”这句话中的“大量”是指 A .几十万个 B .几百万个C .几千万个D .以上说法均不正确 10.下列关于电动势的说法中不正确...的是 A .电源电动势表示电源把其他形式的能转化为电能的本领大小 B .电源电动势等于电源没有接入电路时两极间的电压 C .电源电动势的单位与电能的单位相同 D .电源电动势等于内、外电路电压之和P LAE rab 11.关于磁通量和磁感强度,下列说法正确的是 A .磁感强度越大,磁通量越大 B .磁感强度很大,磁通量可能为零 C .磁通量越大,磁感强度也一定越大 D .磁通量为零,磁感强度也为零12.电磁波从空气进入水中,不发生变化的物理量是A .频率和周期B .频率和波速C .波长和波速D .周期和波长 13.改变汽车的质量和速度,都能改变汽车的动能。
2006年高考理综化学试题(重庆卷)

2006年高考理综化学试题(重庆卷)6.下列做法正确的是A.将浓硝酸保存在无色玻璃瓶中B.用镊子取出白磷并置于水中切割C.把氯酸钾制氧气后的残渣倒入垃圾桶D.氢气还原氧化铜实验先加热再通氢气7.设N A 代表阿伏加德罗常数,下列说法正确的是A.5.6 g 铁与足量盐酸反应转移的电子数为0.3N AB.100 mL 2.0 mol/L 的盐酸与醋酸溶液中氢离子均为0.2N AC.标准状况下,22.4 L 氦气与22.4 L 氟气所含原子数均为2 N AD.20 g 重水(D 2O)中含有的电子数为10N A8.能正确表示下列反应的化学方程式是A.黄铁矿煅炼:2FeS 2+5O 2FeO+4SO 2 B.石英与石灰石共熔:SiO 2+CaOCaSiO 3 C.氨的催化氧化:4NH 3+5O 24NO+6H 2OD.氯气与石灰乳反应:2Cl 2+2Ca(OH) 2=CaCl 2+CaClO 2+2H 2O9.温度相同、浓度均为0.2 mol 的①(NH 4)2SO 4、②NaNO 3、③NH 4HSO 4、④NH 4NO 3、 ⑤⑥CH 3COONa 溶液,它们的pH 值由小到大的排列顺序是A. ③①④②⑥⑤B. ①③⑥④②⑤C. ③②①⑥④⑤D. ⑤⑥②④①③10.25℃、101 kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol 、285.8 kJ/mol 、890.3 kJ/mol 、2 800 kJ/mol,则下列热化学方程式正确的是 A.C(s)+21O 2(g)=CO(g);△H =-393.5 kJ/mol B.2H 2(g)+O 2(g)=2H 2O(g);△H =+571.6 kJ/molC.CH 4g)+2O 2(g)=CO 2(g)+2H 2O(g);△H =-890.3 kJ/molD.21C 6H 12O 6(s )+3O 2(g)=3CO 2(g)+3H 2O(l);△H =-1 400 kJ/mol 11.已知反应mX(g)+nY(g)qZ(g)的△H <0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是A.通入稀有气体使压强增大,平衡将正向移动B.X 的正反应速率是Y 的逆反应速率的m/n 倍C.降低温度,混合气体的平均相对分子质量变小D.增加X 的物质的量,Y 的转化率降低12.利尿酸在奥运会上被禁用,其结构简式如题12图所示.下列叙述正确的是A.利尿酸衍生物利尿酸甲脂的分子式是C 14H 14Cl 2O 4B.利尿酸分子内处于同一平面的原子不超过10个C.1 mol 利尿酸能与7 mol H 2发生加成反应D.利尿酸能与FeCl 3溶液发生显色反应13.下列各组溶液中,用括号内的试剂及物质间相互反应不能..鉴别的一组是 A.Ba(OH) 3 KSCN NaCl Mg(NO 3) (FeCl 3溶液)B.NaNO 3 NaHCO 3 (NH 4) 2SO 3 Na 2SiO 3 (H 2SO 4溶液)C.NH 4Br K 2CO 3 NaI CaCl 2 (AgNO 溶液)D.(NH 4) 3PO 4 NaBr CuSO 4 AlCl 3 (KOH 溶液)26.(15分)(请在答题卡上作答)为除去粗盐中的Ca 2+、Mg 2+、Fe 3+、SO 42+以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):(1)判断BaCl2已过量的方法是_________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2006年普通高等学校招生全国统一考试(重庆卷)
理科综合能力测试
注意事项:
1.答题前,务必将自己的姓名、准考证号填写在答题卡规定的位置上。
2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦
擦干净后,再选涂其它答案标号。
3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定的位置上。
4.所有题目必须在答题卡上作答,在试题卷上答题无效。
5.考试结束后,将试题卷和答题卡一并交回。
以下数据可供解题时参考:
相对分子质量:H 1 O 16 S 32 Cl 35.5 Br 80 Fe 56 Pb 207
第一部分(选择题共126分)
选择题一(本题包括18小题。
每小题6分,共108分。
每小题只有一个
....选项符合题意)
6、下列做法正确的是
A.将浓硝酸保存在无色玻璃瓶中
B.用镊子取出白磷并置于水中切割
C.把氯酸钾制氧气后的残渣倒入垃圾桶
D.氢气还原氧化铜实验先加热再通氢气
7、设N A代表阿伏加德罗常数,下列说法正确的是
A.5.6 g铁与足量盐酸反应转移的电子数为0.3N A
B.100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2N A
C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 N A
D.20 g重水(D2O)中含有的电子数为10N A
8、能正确表示下列反应的化学方程式是
A.黄铁矿煅炼:2FeS2+5O2FeO+4SO2
B.石英与石灰石共熔:SiO2+CaO CaSiO3
C.氨的催化氧化:4NH3+5O24NO+6H2O
D.氯气与石灰乳反应:2Cl2+2Ca(OH) 2=CaCl2+CaClO2+2H2O
9、温度相同、浓度均为0.2 mol的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、
⑤⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是
A. ③①④②⑥⑤
B. ①③⑥④②⑤
C. ③②①⑥④⑤
D. ⑤⑥②④①③
10、25℃、101 kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol 、285.8 kJ/mol 、890.3 kJ/mol 、2 800 kJ/mol,则下列热化学方程式正确的是 A.C(s)+2
1O 2(g)=CO(g);△H=-393.5 kJ/mol B.2H 2(g)+O 2(g)=2H 2O(g);△H=+571.6 kJ/mol
C.CH 4g)+2O 2(g)=CO 2(g)+2H 2O(g);△H=-890.3 kJ/mol
D.2
1C 6H 12O 6(s )+3O 2(g)=3CO 2(g)+3H 2O(l);△H=-1 400 kJ/mol 11、已知反应mX(g)+nY(g)
qZ(g)的△H <0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A.通入稀有气体使压强增大,平衡将正向移动
B.X 的正反应速率是Y 的逆反应速率的m/n 倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X 的物质的量,Y 的转化率降低
12、利尿酸在奥运会上被禁用,其结构简式如题12图所
示。
下列叙述正确的是
A.利尿酸衍生物利尿酸甲脂的分子式是C 14H 14Cl 2O 4
B.利尿酸分子内处于同一平面的原子不超过10个
C.1 mol 利尿酸能与7 mol H 2发生加成反应
D.利尿酸能与FeCl 3溶液发生显色反应
13、下列各组溶液中,用括号内的试剂及物质间相互反应不能..
鉴别的一组是 A.Ba(OH) 3 KSCN NaCl Mg(NO 3) (FeCl 3溶液)
B.NaNO 3 NaHCO 3 (NH 4) 2SO 3 Na 2SiO 3 (H 2SO 4溶液)
C.NH 4Br K 2CO 3 NaI CaCl 2 (AgNO 溶液)
D.(NH 4) 3PO 4 NaBr CuSO 4 AlCl 3 (KOH 溶液)
第二部分(非选择题共174分)
26、(15分)(请在答题卡上作答)
为除去粗盐中的Ca 2+、Mg 2+、Fe 3+、SO 42+以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)判断BaCl2已过量的方法是_________________________________。
(2)第④步中,相关的离子方程式是_____________________________。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
_____________________________。
(4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,题26图是该同学转移溶液的示意图,图中的错误
..是_____________________。
27、(14分)(请在答题卡上作答)
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电
池总反应式为:
Pb+PbO2+4H++2SO2-42PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是______________;电解液中
H2SO4的浓度将变________;当外电路通过1 mol电子时,
理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按题27图连接,电解一段时间后,则在A电极上生成__________、B电极上生成________,此时铅蓄电池的正负极的极性将________________________。
28、(17分)(请在答题卡上作答)
α-松油醇可经以下路线合成,小方框中的每一字母各代表一种有机物:
请回答下列问题:
(1)试剂1是________,试剂2是________。
(2)A至H中,能发生银镜反应的是__________。
(3)G和H的结构简式分别是:G______________;H_______________。
(4)E转化为F的反应方程式是_______________________________________。
29、(14分)(请在答题卡上作答)
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。
单质Y 和W都可与浓的NaOH溶液反应。
请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是________________________。
(2)ZW2的电子式是______________,它在常温下呈液态,形成晶体时,属于_________晶体。
(3)工业生产单质Y的原理是_____________________________(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是___________________。
(5)0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是_________________。
参考答案
选择题一(包括18小题,每小题6分,共108分)
1.C
2.D
3.A
4.B
5.C
6.B
7.D 8.C 9.A 10.D 11.B 12.A
13.C 14.A 15.B 16.C 17.B 18.C
26.(15分)
(1)取第②步后的上层溶液1—2滴于点滴板上,再滴入1—2滴BaCl2溶液,若溶液未变混浊。
则表明BaCl2已过量
(2)Ca2++CO32-=CaCO3↓
Ba2++ CO32-=BaCO3↓
(3)在此酸度条件下会有部分沉淀溶解,从而影响制得精盐的纯度
(4)未用玻璃棒引流;未采用150ml容量瓶
27.(14分)
(1)PbO2 +2e-+4H+ +SO42- =PbSO4+2H2O;小;48
(2)Pb;PbO2;对换
28.(17分)
(1)O 2; Br 2
(2)CH 3CHO (3)
(4)
29.(14分) (1)Cl <S <Al
(2)
分子
(3)2Al 2O 34Al+3O 2↑
(4)Be+2NaOH=Na 2BeO 2+H 2↑。
