最新有机化学竞赛笔记教学文案
化学竞赛无机部分笔记摘要

化学竞赛无机部分笔记摘要。
一、路易斯结构式一、FC(形式电荷)计算公式1、公式及其表达意义V=价电子总数 L=孤对电子数(不是电子对数,电子数为电子对数的2倍) S=共用电子数FC=2、中性原子FC之和应等于零;负离子FC之和应为负值,绝对值等于所带电量;正离子FC 之和应为正值,绝对值等于所带电量。
3、注意Lewis结构式中孤电子(对)要标出,结构稳定的一般满足8电子结构。
另外形式电荷的大小与整体结构的稳定性无关,结构首先要符合八隅律,然后再考虑形式电荷大小。
绝对值越低越稳定。
在满足八隅律的前提下·以总量最低的为准。
4、形式电荷不同于氧化数。
二、路易斯结构式画法1、首先确定分子骨架,通过电离能,较低在中间。
2、依照路易斯结构规则讨论价电子总数3、讨论按八隅体规则共需多少电子4、确定成键电子=所需总数-价电子总数5、合理排列,画出简图6、添加孤对电子7、成键连线,标孤对电子8、检验FC,选择FC最低的结构三、共振杂化1、共振论认为,如果一个物质存在两种以上满足共振要求的路易斯结构,这类物质只能用共振式来书写,而且它们实际上综合具有这些结构的特点。
每一个共振中的结构称为共振结构或极限结构,而这样的物质看作由共振结构“杂化”而成,称为杂化体。
2、共振能杂化体的能量总是低于各极限结构,常用共振能的概念来表示该降低值。
它被定义为杂化体能量低于最稳定极限结构能量的数值,常与另一个概念离域能混用。
电子的离域降低了轨道能,增加了分子的稳定性,常会造成分子的芳香性,如苯。
共振能随着极限结构数的增多而增大,尤其是存在等价极限结构时(能量相等)。
可由量子化学计算、热化学方法或分子的氢化热来估计共振能。
四、八隅体规则不适用的情况1、奇数价电子情况1)、自由基时未成对电子添加在中心原子上,单电子导致自由基化学性质活泼。
在体内人即需要自由基有有酶修复自由基造成的损害。
2)、一氧化氮(NO)属于自由基(这种缺少了一个电子,而又非常活跃的原子或分子的自由基,自由基,化学上也称为“游离基”,是指化合物的分子在光热等外界条件下,共价键发生均裂而形成的具有不成对电子的原子或基团。
高中化学奥林匹克竞赛-有机化学的几个基本反应教学文案
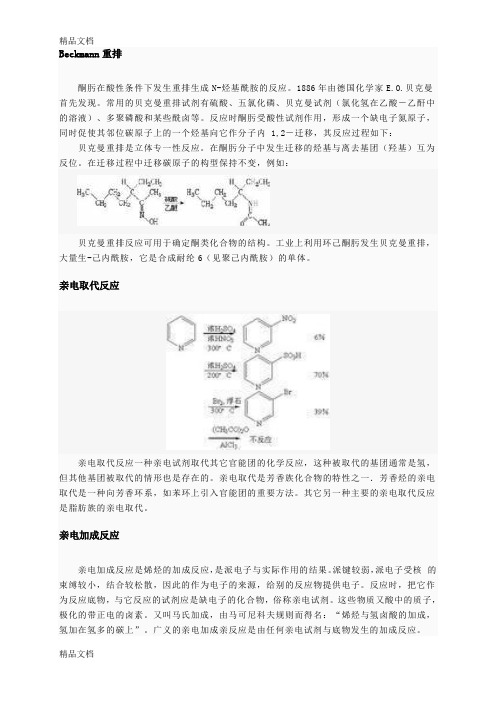
Beckmann重排酮肟在酸性条件下发生重排生成N-烃基酰胺的反应。
1886年由德国化学家E.O.贝克曼首先发现。
常用的贝克曼重排试剂有硫酸、五氯化磷、贝克曼试剂(氯化氢在乙酸-乙酐中的溶液)、多聚磷酸和某些酰卤等。
反应时酮肟受酸性试剂作用,形成一个缺电子氮原子,同时促使其邻位碳原子上的一个烃基向它作分子内 1,2-迁移,其反应过程如下:贝克曼重排是立体专一性反应。
在酮肟分子中发生迁移的烃基与离去基团(羟基)互为反位。
在迁移过程中迁移碳原子的构型保持不变,例如:贝克曼重排反应可用于确定酮类化合物的结构。
工业上利用环己酮肟发生贝克曼重排,大量生-己内酰胺,它是合成耐纶6(见聚己内酰胺)的单体。
亲电取代反应亲电取代反应一种亲电试剂取代其它官能团的化学反应,这种被取代的基团通常是氢,但其他基团被取代的情形也是存在的。
亲电取代是芳香族化合物的特性之一.芳香烃的亲电取代是一种向芳香环系,如苯环上引入官能团的重要方法。
其它另一种主要的亲电取代反应是脂肪族的亲电取代。
亲电加成反应亲电加成反应是烯烃的加成反应,是派电子与实际作用的结果。
派键较弱,派电子受核的束缚较小,结合较松散,因此的作为电子的来源,给别的反应物提供电子。
反应时,把它作为反应底物,与它反应的试剂应是缺电子的化合物,俗称亲电试剂。
这些物质又酸中的质子,极化的带正电的卤素。
又叫马氏加成,由马可尼科夫规则而得名:“烯烃与氢卤酸的加成,氢加在氢多的碳上”。
广义的亲电加成亲反应是由任何亲电试剂与底物发生的加成反应。
在烯烃的亲电加成反应过程中,氢正离子首先进攻双键(这一步是定速步骤),生成一个碳正离子,然后卤素负离子再进攻碳正离子生成产物。
立体化学研究发现,后续的卤素负离子的进攻是从与氢离子相反的方向发生的,也就是反式加成。
如丙烯与HBr的加成:CH-CH=CH+ HBr → CH-CHBr-CH2第一步,HBr电离生成H和Br离子,氢离子作为亲电试剂首先进攻C=C双键,形成这样的结构:第二步,由于氢已经占据了一侧的位置,溴只能从另外一边进攻。
【笔记】化学竞赛无机部分笔记摘要

【关键字】笔记化学竞赛无机部分笔记摘要。
一、路易斯结构式一、FC(形式电荷)计算公式1、公式及其表达意义V=价电子总数L=孤对电子数(不是电子对数,电子数为电子对数的2倍)S=共用电子数FC=V-L-0.5S2、中性原子FC之和应等于零;负离子FC之和应为负值,绝对值等于所带电量;正离子FC之和应为正值,绝对值等于所带电量。
3、注意Lewis结构式中孤电子(对)要标出,结构稳定的一般满足8电子结构。
另外形式电荷的大小与整体结构的稳定性无关,结构首先要符合八隅律,然后再考虑形式电荷大小。
绝对值越低越稳定。
在满足八隅律的前提下·以总量最低的为准。
4、形式电荷不同于氧化数。
2、路易斯结构式画法1、首先确定分子骨架,通过电离能,较低在中间。
2、依照路易斯结构规则讨论价电子总数3、讨论按八隅体规则共需多少电子4、确定成键电子=所需总数-价电子总数5、合理排列,画出简图6、添加孤对电子7、成键连线,标孤对电子8、检验FC,选择FC最低的结构三、共振杂化1、共振论认为,如果一个物质存在两种以上满足共振要求的路易斯结构,这类物质只能用共振式来书写,而且它们实际上综合具有这些结构的特点。
每一个共振中的结构称为共振结构或极限结构,而这样的物质看作由共振结构“杂化”而成,称为杂化体。
2、共振能杂化体的能量总是低于各极限结构,常用共振能的概念来表示该降低值。
它被定义为杂化体能量低于最稳定极限结构能量的数值,常与另一个概念离域能混用。
电子的离域降低了轨道能,增加了分子的稳定性,常会造成分子的芳香性,如苯。
共振能随着极限结构数的增多而增大,尤其是存在等价极限结构时(能量相等)。
可由量子化学计算、热化学方法或分子的氢化热来估计共振能。
四、八隅体规则不适用的情况1、奇数价电子情况1)、自由基时未成对电子添加在中心原子上,单电子导致自由基化学性质活泼。
在体内人即需要自由基有有酶修复自由基造成的损害。
2)、一氧化氮(NO)属于自由基(这种缺少了一个电子,而又非常活跃的原子或分子的自由基,自由基,化学上也称为“游离基”,是指化合物的分子在光热等外界条件下,共价键发生均裂而形成的具有不成对电子的原子或基团。
化学竞赛知识点总结有机

化学竞赛知识点总结有机有机化学竞赛是一种针对有机化学知识的考试,旨在检验学生对有机化学理论知识、实验操作、解题能力和创新思维的掌握程度。
在竞赛中,学生需要熟练掌握有机化学理论知识,灵活运用化学实验技能,理解和分析有机化合物的结构与性质,解决有机化学问题,提高解题思维和创新能力。
以下是有机化学竞赛知识点的总结:一、有机化学基础知识1. 有机化合物的命名规则:包括正式命名法、通用命名法和简化命名法等,学生需要掌握各种命名规则,并能够根据给定的有机化合物结构进行正确的命名;2. 有机化合物的结构特点:包括碳链、碳环、官能团等结构特点,学生需要理解有机化合物的结构特点与性质关系;3. 有机反应的基本类型:包括加成反应、消除反应、取代反应、重排反应等,学生需要了解各种有机反应的基本类型及其特点;4. 有机化学的重要概念:包括构象、立体化学、手性等重要概念,学生需要理解这些概念在有机化学中的应用;5. 有机化学实验技术:包括有机合成实验、制备有机化合物实验、有机化合物性质表征实验等,学生需要具备操作化学仪器的基本技能,并能够按照实验要求进行操作。
二、有机化学竞赛解题技巧1. 理解题目:学生需要仔细阅读题目,理解题目要求、考察内容及解题思路;2. 总结规律:学生需要总结解题规律和方法,整理解题思路和逻辑;3. 多练习:学生需要进行大量的有机化学竞赛题目练习,熟悉解题技巧和方法;4. 主动思考:学生需要主动思考解题思路和方法,锻炼解题的创新能力;5. 多交流:学生可以参加有机化学竞赛培训班、讲座等活动,与其他竞赛学生交流、沟通,共同进步。
三、有机化学竞赛知识点练习题1. 有机化合物命名题:给出有机化合物的结构,要求学生进行正确地命名;2. 有机反应类型题:给定有机反应方程式,要求学生预测反应类型、产物结构等;3. 有机化合物结构性质题:给出有机化合物的结构,要求学生分析其性质、构象、立体化学等;4. 有机合成题:给出有机化合物的结构,要求学生设计合成方案;5. 实验操作题:给出实验操作流程,要求学生进行正确的实验操作。
高中化学竞赛专题讲座教案

高中化学竞赛专题讲座教案
主题:化学竞赛的基本知识和应试技巧
目标:通过本次讲座,学生将掌握化学竞赛的基本知识,了解常见的应试技巧,提高应试能力。
一、引言(5分钟)
介绍化学竞赛的重要性,激发学生对化学竞赛的兴趣。
二、化学竞赛的基本知识(15分钟)
1. 化学竞赛的类型及要求
2. 常见的竞赛题型和题材
3. 竞赛题目的难易度和分值分布
4. 常见的竞赛规则和注意事项
三、化学竞赛的应试技巧(20分钟)
1. 如何阅读和理解竞赛题目
2. 如何解答选择题和计算题
3. 如何运用化学知识和思维方法解答主观题
4. 如何高效备考和应对考试压力
四、实例分析与练习(20分钟)
结合真实的竞赛题目,分析解题思路和方法,引导学生进行练习和应用。
五、答疑与交流(10分钟)
学生对化学竞赛相关问题进行提问,老师进行答疑解惑,促进学生之间的交流与分享。
六、总结与展望(5分钟)
总结本次讲座的内容和收获,展望未来在化学竞赛中取得更好的成绩。
教学方法:讲授结合互动,理论联系实际,案例分析与实践操作相结合。
课后作业:学生自主复习,完成相关练习题目。
评价方法:学生的课堂参与度、讲座笔记、课后作业完成情况。
教学反思:通过本次讲座,希望学生能够了解化学竞赛的基本知识和应试技巧,提高应试能力,为参加化学竞赛做好充分准备。
高中化学竞赛有机部分的学习方法和技巧

高中化学 有机部分
在有机部分的学习中,实验也是非常重要的一部分。通过实验,学生可以更 加深入地了解有机化合物的性质和合成方法,同时也可以提高自己的实验技能和 实验能力。
高中化学 有机部分
总之,高中化学中的有机部分是化学的重要组成部分,对于学生来说是非常 重要的知识点。在学习过程中,学生需要注重基础知识的学习,同时也要注重实 验和实践,提高自己的综合素质和能力。
在有机部分的学习中,学生需要掌握各类有机化合物的结构、性质和合成方 法。例如,烷烃、烯烃、炔烃、芳香烃等烃类化合物,以及醇、醛、酮、羧酸、 酯等含氧有机物,这些都是有机部分的重要知识点。学生需要了解这些化合物的 分子结构、物理性质和化学性质,以及它们之间的相互转化。
高中化学 有机部分
此外,有机部分还涉及到一些重要的反应机制,如亲核反应、亲电反应、自 由基反应等。这些反应机制对于理解有机化学中的反应机理和反应过程具有重要 意义。
参考内容二
内容摘要
随着科学技术的快速发展,化学作为一门基础学科,越来越受到社会的重视。 其中,高中化学竞赛作为一项重要的学术活动,旨在培养高中生的化学素养和科 学思维能力。本次演示将介绍一些全国高中化学竞赛的学习资料,帮助同学们更 好地备战竞赛。
一、教材与参考书籍
一、教材与参考书籍
1、高中化学教材:作为基础学习资料,高中化学教材是必不可少的。建议同 学们在复习时,以学校指定的教材为主,同时参考其他版本的教材。
一、学习方法
3、错题管理与笔记错题是学习过程中的重要资源。同学们应该将做错的题目 进行归类和整理,分析错误原因并找出解决办法。同时,要善于利用笔记,将学 习过程中的重要知识点、公式、反应机理等记录下来,方便随时查阅和复习。
二、答题技巧
汪小兰版有机化学答案全教学文案

答案:
有机化学答案 生命科学学院 丁家宝 王彬
a.2,4,4 -三甲基-5-正丁基壬烷
5- butyl - 2,4,4 -trimethylnonane
b. 正己烷 hexane
c.3,3 -二乙基戊烷 3,3 -diethylpentane
d.3 -甲基-5-异丙基辛烷5- isopropyl - 3-methyloctane
e. 2-甲基丙烷(异丁烷)2- methylpropane(iso-butane)
f.2,2 - 二 甲 基 丙 烷 ( 新 戊 烷 ) 2,2 -
dimethylpropane(neopentane)
g.3 -甲基戊烷3- methylpentane
h. 2-甲基-5-乙基庚烷 5-ethyl -2-methylheptane
答案:
b. Cl
Cl
c. H C
H H
Br d. Cl
H
e.
C Cl
O
Cl
H3 C
f.
O
H
H 3C
CH 3
1.6 根据 S 与 O的电负性差别, H2O与 H2S 相比,哪个有较强的偶极 偶极作用力或氢键?
第 2 页共 108 页
答案:
有机化学答案 生命科学学院 丁家宝 王彬
电负性 O>S,H2O与 H2S 相比, H2O有较强的偶极作用及氢键。
第 5 页共 108 页
有机化学答案 生命科学学院 丁家宝 王彬
1、 含有两个三级碳原子的烷烃 2,3-dimethylbutane
2、 含有一个异丙基的烷烃 2-methylpentane 3、 含 有 一 个 四 级 碳 原 子 和 一 个 二 级 碳 原 子 的 烷 烃
高中化学竞赛有机化学要义精讲

奥林匹克竞赛有机化学要义精讲一.有机物系统命名法根据IUPAC命名法及1980年中国化学学会命名原则,按各类化合物分述如下。
1.带支链烷烃主链选碳链最长、带支链最多者。
编号按最低系列规则。
从靠侧链最近端编号,如两端号码相同时,则依次比较下一取代基位次,最先遇到最小位次定为最低系统(不管取代基性质如何)。
例如,命名为2,3,5-三甲基己烷,不叫2,4,5-三甲基己烷,因2,3,5与2,4,5对比是最低系列。
取代基次序IUPAC规定依英文名第一字母次序排列。
我国规定采用立体化学中“次序规则”:优先基团放在后面,如第一原子相同则比较下一原子。
例如,称2-甲基-3-乙基戊烷,因—CH2CH3>—CH3,故将—CH3放在前面。
2.单官能团化合物主链选含官能团的最长碳链、带侧链最多者,称为某烯(或炔、醇、醛、酮、酸、酯、……)。
卤代烃、硝基化合物、醚则以烃为母体,以卤素、硝基、烃氧基为取代基,并标明取代基位置。
编号从靠近官能团(或上述取代基)端开始,按次序规则优先基团列在后面。
例如,3.多官能团化合物(1)脂肪族选含官能团最多(尽量包括重键)的最长碳链为主链。
官能团词尾取法习惯上按下列次序,—OH>—NH2(=NH)>C≡C>C=C如烯、炔处在相同位次时则给双键以最低编号。
例如,(2)脂环族、芳香族如侧链简单,选环作母体;如取代基复杂,取碳链作主链。
例如:(3)杂环从杂原子开始编号,有多种杂原子时,按O、S、N、P顺序编号。
例如:4.顺反异构体(1)顺反命名法环状化合物用顺、反表示。
相同或相似的原子或基因处于同侧称为顺式,处于异侧称为反式。
例如,(2)Z,E命名法化合物中含有双键时用Z、E表示。
按“次序规则”比较双键原子所连基团大小,较大基团处于同侧称为Z,处于异侧称为E。
次序规则是:(Ⅰ)原子序数大的优先,如I>Br>Cl>S>P>F>O>N>C>H,未共享电子对:为最小;(Ⅱ)同位素质量高的优先,如D>H;(Ⅲ)二个基团中第一个原子相同时,依次比较第二、第三个原子;(Ⅳ)重键分别可看作(Ⅴ)Z优先于 E,R优先于S。
初中化学竞赛技巧知识点归纳

初中化学竞赛技巧知识点归纳化学竞赛作为一项具有挑战性的学术竞赛,旨在提升学生对化学科学的理解和应用能力。
为了在竞赛中取得好成绩,掌握一些技巧是必不可少的。
本文将为大家总结一些初中化学竞赛的技巧知识点,帮助大家在竞赛中取得优异的成绩。
1. 理论知识的掌握在参加化学竞赛前,学生们需要掌握基本的化学理论知识,包括元素周期表、化学方程式、化学反应等基础概念。
同时要熟悉常见的离子、元素的性质和化合物的命名规则等。
充分掌握这些理论知识是解答问题的基础。
2. 做题时注重细节在竞赛中,细节往往决定了答题的准确性。
因此,在解答问题时要注意题目中给出的关键信息,例如反应条件、反应物比例等。
同时,注意单位的换算和使用,不要忽略一些看似微小的细节。
3. 快速计算和估算化学竞赛的时间通常是有限的,因此解答问题时要能够迅速进行计算和估算。
例如,在计算物质的摩尔质量时可以使用近似值,而不是精确计算。
此外,还要熟练掌握一些常见的化学计算方法,例如摩尔浓度的计算、氧化还原反应的计算等。
4. 实验与观察化学竞赛中常常涉及到实验与观察题目。
对于这类题目,学生需要熟悉常见的化学实验和观察现象,并能够准确地描述实验步骤和观察结果。
为了更好地准备这类题目,参加实验课和实践操作是非常必要的,通过亲自进行实验和观察,加深对化学现象的理解与记忆。
5. 多做习题和模拟试题做题是提高化学知识和应用能力的关键。
在备战化学竞赛时,同学们应该多做习题和模拟试题,提高解题技巧和速度。
通过多做题目可以找到自己的薄弱环节,并针对性加强练习。
同时,在对比答案时,要注意查漏补缺,总结错误的原因。
6. 及时复习与总结及时复习和总结是提高学习效果的关键。
在竞赛前,同学们可以根据自己的学习进度和时间安排,合理安排复习的内容和时间。
定期进行知识点的复习和总结,可以提高对知识点的记忆和理解。
同时,还可以使用错题本和笔记,及时记录和查漏补缺。
7. 竞赛策略的运用在实际竞赛时,运用一定的策略是提高竞赛成绩的利器。
有机化学实验-----蒸馏及沸点的测定技术教学文案

有机化学实验-----蒸馏及沸点的测定技术实验报告姓名:班级:同组人:项目:蒸馏及沸点的测定技术课程:学号:一、实验目的1.了解蒸馏和沸点测定的基本原理和意义。
2.掌握蒸馏和沸点测定的操作技术。
二、实验原理液体分子由于运动有从液面逸出的倾向,这种倾向随着温度的升高而增大,进而在液面上部形成蒸气。
当分子由液体逸出的速率与分子由蒸气中回到液体中的速率相等,液面上的蒸气达到饱和,称为饱和蒸气。
它对液面所施加的压力称为饱和蒸气压。
实验证明,液体的蒸气压只与温度有关,即液体在一定温度下具有一定的蒸气压。
将液体加热,它的蒸气压就随着温度的升高而增大。
当液体的蒸气压增大到与外界施于液面的总压力(通常是大气压力)相等时,液体就开始沸腾。
这时的温度称为液体的沸点。
纯的有机化合物在一定压力下均有恒定的沸点,且沸程很小,一般不超过1~2 ℃。
所以测定沸点是鉴别有机化合物和判断物质纯度的依据之一。
测定沸点常用的方法有常量法(蒸馏法)和微量法两种。
将液体物质加热到沸腾,使其变成蒸气,然后将蒸气冷凝为液体的过程称为蒸馏。
蒸馏是分离和提纯液体化合物最常用的一种方法,通过蒸馏可以仅供学习与交流,如有侵权请联系网站删除谢谢2把易挥发的物质和不挥发的物质分离,也可将沸点不同的液体混合物分离开来。
但液体混合物中各组分的沸点要相差30 ℃以上,才能取得较好的分离效果。
而要彻底分离,混合物中各组分的沸点要相差110 ℃以上。
蒸馏也是测定液体有机化合物沸点的一种方法。
三、仪器和药品仪器:圆底烧瓶(100 mL、50 mL)、蒸馏头、温度计(100 ℃)、温度计套管、冷凝管、接液管、50 mL量筒、长颈漏斗、铁架台、铁圈、铁夹、橡皮管、石棉网、酒精灯、提勒管、玻璃管(内径为4~5 mm)、毛细管。
沸石、橡皮圈。
药品:95%医用酒精、苯(分析纯)、液体石蜡。
四、内容及步骤(一)蒸馏和常量法测定沸点常量法测定沸点即蒸馏法测定沸点,所用的仪器装置与蒸馏完全一样。
化学有机化学有机化合物的结构与性质

化学有机化学有机化合物的结构与性质好嘞,以下是为您创作的关于“化学有机化学有机化合物的结构与性质”的文案:嘿,同学们!今天咱们一起来探索一下有机化学中那些神奇的有机化合物的结构与性质。
还记得我有一次去菜市场买菜,看到一堆五颜六色的蔬菜水果,突然就想到了咱们的有机化学。
就说那红彤彤的苹果吧,它为啥能散发着诱人的香气?这就得从有机化合物的结构和性质说起啦。
咱们先聊聊有机化合物的结构。
有机化合物就像是一个个精心搭建的小城堡,碳原子是那坚固的基石,氢、氧、氮等原子就像是各种精美的装饰。
比如甲烷,它就是一个简单而又稳定的结构,一个碳原子周围连着四个氢原子,就像一个正四面体。
再看看乙烯,两个碳原子通过双键相连,那形状就像是张开的双臂,准备拥抱其他的分子。
而有机化合物的性质呢,就像是这些小城堡的功能。
有的化合物易燃,像汽油,一点就着,这是因为它们的分子结构决定了它们容易与氧气发生剧烈的反应。
有的化合物能溶于水,有的却不行,这也和它们的结构有着密切的关系。
比如说乙醇,也就是咱们常说的酒精。
它的分子结构中有一个羟基,这就让它既能和水亲密无间地混合在一起,又能在我们体内发生各种奇妙的变化。
大家想想,为啥喝酒会让人醉呢?这就是乙醇在咱们身体里的作用呀!还有那香喷喷的乙酸,也就是醋的主要成分。
它的分子结构决定了它具有酸性,能和碱发生中和反应。
咱们在家里做凉拌菜的时候,加点醋,味道就变得更加鲜美,这可都是有机化学的功劳!再说说油脂吧,咱们每天吃的食用油就是一种油脂。
它的结构里有酯键,这使得它在一定条件下能够水解,为我们提供能量。
想象一下,我们吃进去的食物在身体里经过一系列的化学反应,变成了我们活动所需的能量,是不是很神奇?有机化合物的结构和性质的关系,就像是一把钥匙开一把锁。
只有了解了它们的结构,才能真正明白它们的性质和用途。
就像我在菜市场看到的那些蔬菜水果,它们之所以有着各自独特的味道、颜色和营养价值,都是因为它们内部的有机化合物有着不同的结构和性质。
有机化学实验背景的实验题()汇总教学文案

有机化学实验背景的实验题1.溴苯是一种常用的化工原料。
实验室制备溴苯的实验步骤如下:步骤1:在a中加入15 mL苯和少量铁屑,再将b中4.0 mL液溴慢慢加入到a中,充分反应。
,有___________(填现象)产生;将b中的液溴慢慢加入到a中,而不能快速加入的原因是,继续滴加液溴滴完。
装置d 的作用是___________________;步骤2:向a中加入10 mL水,然后________(填操作名称)除去未反应的铁屑。
步骤3:滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤,分液得粗溴苯。
NaOH溶液洗涤的作用是____________;步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。
加入氯化钙的目的是______________;已知苯、溴苯的有关物理性质如上表:(1)实验装置中,仪器c的名称为___________,作用是冷凝回流,回流的主要物质有(填化学式)(2)步骤4得到的粗产品中还含有杂质苯,,则要进一步提纯粗产品,还必须进行的实验操作名称是。
2.(12分)苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。
反应原理如下:C6H5-CH3+2KMnO4C6H5-COOK+KOH+2MnO2↓+H2OC6H5-COOK+HCl → C6H5-COOH+KCl已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866 g·cm-3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3 g和6.9g。
【制备产品】30.0 mL甲苯和25.0 mL 1 mol·L-1高锰酸钾溶液在80℃下反应30 min,装置如图所示:(1)图中支管的作用是_______________________。
(2)在本实验中,三颈烧瓶最合适的容积是________(填字母)A.50 mL B.100 mL C.200 mL D.250 mL【分离产品】他们设计如下流程分离粗产品苯甲酸和回收甲苯:(3)操作Ⅰ的名称是____;含杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是_______。
精华笔记发布

封面绘画:张庚辰
配合物结构
衡水二中2016-2018级化学竞赛盐
衡水二中2016-2018级化学竞赛盐
衡水二中2016-2018级化学竞赛 盐
后记 讲真有三所学校提出过出钱买这个东西了,刺激地我将它公开。
我选择化学竞赛只是因为喜欢化学,不因为别的,我希望化学竞赛可以让更多喜欢化学的人参与进来(毕竟本人有同学确实喜欢化学而在高一升级的时候因为家长担心升学问题被逼退,真心难受)而并不是学习的目的在于升学,我不想让化学竞赛变成另一种形式的高考,我也不想让化学竞赛成为资源竞争战,成为同学之间争夺全班第一的一个途径,我们还是只是因为爱化学而学竞赛,行吗?(恐怕不行) 本册的大封皮的作者正在准备考取清华大学美术学院,祝她成功,加油&必胜!
谢谢我的师傅即焓哥即H C h O 独立命题人即王沐焓学长,您告诉我了什么是真正的化学竞赛,学习化学竞赛的日子里我很开心,谢谢。
衡水二中2016-2018级化学竞赛
徐天翼
2018-9-8于廊坊。
有机化学竞赛知识点总结

有机化学竞赛知识点归纳第一章 绪论一. 有机化合物和有机化学有机化合物是指碳氢化合物及其衍生物。
有机化学是研究有机合物的结构特征.合成方法和理化性质等的化学。
二. 有机化合物的特点碳原子的价电子层 1S22S22P2因此,有机物分子是共价键结合。
1.可燃性:绝大多数有机物都是可燃的。
2.耐热性、熔点、沸点低:3.水溶性:小,原理依据,相似相溶原理、与水形成氢键的能力。
4.导电性能:差。
5.反应速度:慢。
6.反应产物:常有副产物,副反应。
7.普遍在同分异构体同分异构体是指分子式相同结构式不同,理化性质不同的化分物。
三. 有机化合物的结构理论1858年凯库勒和古柏尔提出有机化合物分子中碳原子是四价及碳原子之间相互连接成碳链的概念,成为有机化合物分子结构的,最原始和最基础的理论。
1861年布特列洛夫对有机化合物的结构提出了较完整的的概念,提出原子之间存在着相互的影响。
1874年范荷夫和勒贝尔建立分子的立体概念,说明了对映异构和顺反异构现象。
*碳原子总是四价的,碳原子自相结合成键,构造和构造式分子中原子的连接顺序和方式称为分子的构造.表示分子中各原子的连接顺序和方式的化学式叫构造式(结构式).用两小点表示一对共用电子对的构造式叫电子式,用短横线(-)表示共价键的构造式叫价键式.有时可用只表达官能团结构特点的化学式,既结构简式.四. 共价键的性质1. 键长:形成共价键的两个原子核间距离。
2. 键角:两个共价键之间的夹角。
3. 键能:指断单个特定共价键所吸收的能量,也称为该键的离解能。
共价键的键能是断裂分子中全部同类共价键所需离解能的平均值。
4. 键的极性:键的极性与键合原子的电负性有关,一些元素电负性数值大的原子具有强的吸电子能力。
常见元素电负性为:H C N O F Si P S Cl Br I2.1 2.53.0 3.54.0 1.8 2.1 2.5 3.0 2.5 2.0对于两个相同原子形成的共价键来说,可以认为成键电子云是均匀的分布在两2核之间,这样的共价键没有极性,为非极性共价键。
化学竞赛能力测试初中分册

目录分析
该书的目录还提供了丰富的例题和练习题。这些题目既能够帮助学生巩固所 学知识,又能够提高学生的解题能力和竞赛水平。这些题目还具有很强的代表性, 能够帮助学生更好地理解和掌握化学竞赛中的常见题型和解题技巧。
目录分析
《化学竞赛能力测试初中分册》这本书的目录结构清晰、内容丰富、层次分 明、连贯性好,并且提供了丰富的例题和练习题。这些特点使得该书成为一本优 秀的初中化学竞赛教材,能够帮助学生在竞赛中取得更好的成绩。
化学竞赛能力测试初中分册
读书笔记
01 思维导图
03 精彩摘录 05 目录分析
目录
02 内容摘要 04 阅读感受 06 作者简介
思维导图
本书关键字分析思维导图
竞赛
技能
测试
能力
实践
学生
思维
能力
化学
化学 测试
创新
竞赛
知识
掌握
练习
相关
这些
提高
内容摘要
内容摘要
《化学竞赛能力测试初中分册》是一本专门为初中生设计的化学竞赛辅导教材。本书旨在通过一 系列的测试和练习,提高学生的化学竞赛能力,帮助他们更好地理解和掌握化学知识。 本书的内容非常丰富,包括了许多与化学竞赛相关的知识点和技能。本书介绍了化学竞赛的基本 知识和技能,包括化学实验操作、化学计算、化学分析等。这些内容都是学生在参加化学竞赛时 必须掌握的基本技能。 本书还提供了一系列与化学竞赛相关的练习和测试。这些练习和测试涵盖了各种题型,包括选择 题、填空题、计算题等。学生可以通过这些练习和测试,加深对化学知识的理解和掌握,提高解 题能力和应试能力。 本书还注重培养学生的创新思维和实践能力。
精彩摘录
这句话提醒我们,化学不仅仅是一门学科,更是一种探索世界的方法。通过 化学,我们可以更好地理解物质的变化和性质,进一步推动科学技术的发展。
有机化学竞赛笔记

7.1 有机化合物的分类(1)按照碳骨架分类按照碳链结合方式的不同,有机化合物可分为三类a. 开链化合物(脂肪族化合物)只含碳和氢的链烃类化合物。
此类化合物的分子中碳原子之间互相连接而成碳链,而不是成环状。
这类化合物也称脂肪族化合物。
例如:正丁烷正丁醇十八酸b. 碳环族化合物分子中具有碳原子连接而成的闭合环。
这类化合物由于成环方式不同又可分为两类:(a) 脂环族: 性质与脂肪族化合物相似的碳环化合物,这类化合物可以看作由开链化合物连接闭合成环;例如:环己烷(b) 芳香族:含有苯环和稠苯环,性质与脂肪族化合物不同的化合物例如:苯c. 杂环化合物在这类化合物的分子中,组成环的原子除碳原子外还有氧、氮、硫等杂原子。
例如:例如:呋喃噻吩(2)按照官能团分类:决定一类化合物典型性质的原子或原子团叫官能团。
这些原子或者原子团能体现整个化合物的特征结构,也决定着化合物的一些主要性质。
一般来说,含有相同官能团的有机化合物能起相似的化学反应,因此把它们看作为同一类化合物。
按官能团分类为研究数目庞大的有机化合物提供了更系统更方便的研究方法,并且有机化合物的反应主要在官能团处发生。
表7-1 一些重要官能团的结构和名称化合物类别官能团结构官能团名称实例烯烃双键乙烯炔烃三键乙炔卤代烃卤素氯苯醇和酚羟基乙醇醚醚键乙醚醛和酮羰基乙醛羧酸羧基乙酸硝基化合物硝基硝基苯胺氨基苯胺偶氮化合物重氮基偶氮苯硫醇和硫酚巯基乙硫醇磺酸磺酸基苯磺酸具有相同官能团和相似结构的化合物具有相似的性质,化合物按照官能团进行分类,反映了有机化合物之间的内在联系。
7.2 饱和烃和不饱和脂肪烃由碳和氢两种元素组成的有机物叫做烃(hydrocarbon),也叫做碳氢化合物。
根据分子中的碳架结构,可以把烃分成饱和烃与不饱和烃两大类。
饱和烃一般指烷烃和环烷烃,不饱和烃一般包括烯烃、炔烃和芳香烃。
7.2.1 烷烃烷烃是指分子中的碳原子以单键相连,其余的价键都与氢原子结合而成的化合物。
全国初中化学“天原杯”竞赛教程

该书的目录还包含了大量的例题和练习题。这些题目不仅可以帮助读者巩固所 学知识,还可以提高他们的解题能力和竞赛水平。同时,这些题目也具有一定 的难度和挑战性,能够激发读者的学习兴趣和动力。
作者简介
作者简介
这是《全国初中化学“天原杯”竞赛教程》的读书笔记,暂无该书作者的介绍。
谢谢观看
内容摘要
《全国初中化学“天原杯”竞赛教程》是一本非常实用的教程,可以帮助初中学生更好地理解和 掌握化学知识,提高化学竞赛成绩。这本书也可以作为初中化学教学的辅助教材,帮助教师更好 地开展教学工作。
精彩摘录
《全国初中化学“天原杯”竞赛教程》是一本优秀的化学竞赛教程,涵盖了初 中化学的重要知识点和竞赛技巧。下面我将分享一些这本书中的精彩摘录,以 帮助读者更好地理解和掌握化学知识。
我想说的是,《全国初中化学“天原杯”竞赛教程》是一本非常优秀的书籍。 它不仅为我们提供了丰富的竞赛知识,还让我们对化学学科有了更深入的认识 和体验。我相信,只要我们认真阅读这本书,并在实践中不断应用所学知识, 就一定能够在化学竞赛中取得优异的成绩。
目录分析
《全国初中化学“天原杯”竞赛教程》是一本为全国初中化学竞赛所编写的教 程,旨在帮助学生更好地理解和掌握化学知识,提高他们的竞赛水平。该书的 目录经过精心设计,涵盖了竞赛所需的各个方面,为读者提供了一个全面而系 统的学习框架。
本书还提供了大量的案例分析,包括历届化学竞赛的试题解析和答案解析。这 些案例分析可以帮助学生更好地了解竞赛的题型和难度,提高解题能力。
《全国初中化学“天原杯”竞赛教程》是一本非常优秀的化学竞赛教程,包含 了丰富的知识点、实验技能、竞赛技巧和案例分析。通过阅读这本书,学生可 以更好地理解和掌握化学知识,提高化学素养和兴趣,为参加化学竞赛打下坚 实的基础。
化学竞赛知识点总结

化学竞赛知识点总结化学竞赛是一项世界范围内的科学竞赛,通过测试参赛选手的化学知识、实验技能和解决问题的能力。
参加化学竞赛需要对化学知识有扎实的掌握,并且需要具备丰富的实验经验和解决化学问题的能力。
下面是化学竞赛中常见的知识点总结,希望对参加化学竞赛的同学有所帮助。
1. 基本概念化学竞赛中的基本概念包括原子结构、化学键、化学式、化学方程式、物质的性质和变化等。
参赛选手需要熟练掌握这些基本概念,能够灵活运用在解决问题和实验操作中。
2. 元素周期表元素周期表是化学竞赛中必不可少的知识点,参赛选手需要熟练掌握周期表上各元素的原子序数、原子量、化学性质等信息,并且需要了解元素的分布规律,例如,同一周期元素的化学性质的特点、同一族元素的性质及其周期性变化的原因。
3. 化学键和分子结构化学键的种类、形成及性质对化学竞赛来说是重要的知识点,需要了解共价键、离子键和金属键的性质和结构,另外也需要了解有机分子中的键和结构。
4. 化学反应化学反应是化学竞赛中的一个重要知识点,包括原子、离子和分子之间的化学反应,以及化学反应的速率、平衡等相关知识。
参赛选手需要了解不同类型的化学反应,以及反应速率和平衡的影响因素。
5. 化学平衡和化学计量化学平衡和化学计量是化学竞赛中的必备知识,参赛选手需要了解化学平衡的特点、化学平衡常数和平衡常数的影响因素,另外还需要灵活运用化学计量的知识解决问题。
6. 酸碱平衡和化学物质的性质酸碱平衡和化学物质的性质对化学竞赛来说是重要的知识点,参赛选手需要了解酸碱中和反应、酸碱指示剂、酸碱滴定等基本概念,并且需要了解不同化学物质的性质及其影响因素。
7. 化学反应速率化学反应速率是化学竞赛中的一个重要知识点,包括反应速率的定义、测定和影响因素等。
参赛选手需要了解不同类型的反应速率,以及速率常数和速率方程的相关知识。
8. 化学热力学化学热力学是化学竞赛中不可或缺的知识点,包括热力学系统、焓、内能、熵、热容等基本概念,以及热力学定律和热力学过程等相关知识。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7.1 有机化合物的分类(1)按照碳骨架分类按照碳链结合方式的不同,有机化合物可分为三类a. 开链化合物(脂肪族化合物)只含碳和氢的链烃类化合物。
此类化合物的分子中碳原子之间互相连接而成碳链,而不是成环状。
这类化合物也称脂肪族化合物。
例如:正丁烷正丁醇十八酸b. 碳环族化合物分子中具有碳原子连接而成的闭合环。
这类化合物由于成环方式不同又可分为两类:(a) 脂环族: 性质与脂肪族化合物相似的碳环化合物,这类化合物可以看作由开链化合物连接闭合成环;例如:环己烷(b) 芳香族:含有苯环和稠苯环,性质与脂肪族化合物不同的化合物例如:苯c. 杂环化合物在这类化合物的分子中,组成环的原子除碳原子外还有氧、氮、硫等杂原子。
例如:例如:呋喃噻吩(2)按照官能团分类:决定一类化合物典型性质的原子或原子团叫官能团。
这些原子或者原子团能体现整个化合物的特征结构,也决定着化合物的一些主要性质。
一般来说,含有相同官能团的有机化合物能起相似的化学反应,因此把它们看作为同一类化合物。
按官能团分类为研究数目庞大的有机化合物提供了更系统更方便的研究方法,并且有机化合物的反应主要在官能团处发生。
表7-1 一些重要官能团的结构和名称化合物类别官能团结构官能团名称实例烯烃双键乙烯炔烃三键乙炔卤代烃卤素氯苯醇和酚羟基乙醇醚醚键乙醚醛和酮羰基乙醛羧酸羧基乙酸硝基化合物硝基硝基苯胺氨基苯胺偶氮化合物重氮基偶氮苯硫醇和硫酚巯基乙硫醇具有相同官能团和相似结构的化合物具有相似的性质,化合物按照官能团进行分类,反映了有机化合物之间的内在联系。
7.2 饱和烃和不饱和脂肪烃由碳和氢两种元素组成的有机物叫做烃(hydrocarbon),也叫做碳氢化合物。
根据分子中的碳架结构,可以把烃分成饱和烃与不饱和烃两大类。
饱和烃一般指烷烃和环烷烃,不饱和烃一般包括烯烃、炔烃和芳香烃。
7.2.1 烷烃烷烃是指分子中的碳原子以单键相连,其余的价键都与氢原子结合而成的化合物。
烷烃属于饱和烃,饱和意味着分子中的每一个碳原子都达到了与其他原子结合的最大限度。
烷烃中最简单的是甲烷,分子式是CH4,乙烷、丙烷、丁烷和戊烷的分子式分别为:C2H6,C3H8,C4H10和C5H12。
上述烷烃的性质也很相似。
这样的一系列化合物叫做同系列。
同系列中的各个化合物彼此互称为同系物。
CH2则叫做同系列的系差。
同系物具有相类似的化学性质,其物理性质一般随分子中碳原子的递增而有规律的变化。
总体来说,分子量越大的烷烃,其熔沸点越高,密度越大。
通式: C n H2n+2简式:CH3(CH2)3CH3, CH3CH2CH(CH3)2, C(CH3)41. 烷烃的结构甲烷是最低级的烷烃,在讨论烷烃分子结构之前,首先介绍甲烷的分子结构。
甲烷的分子式为CH4,一般把其结构式写成:()。
但这只能说明分子中碳原子与四个氢原子直接相连,而没有表示出氢原子与碳原子在空间的相对位置,即分子的立体形象。
实验证明甲烷分子里的碳原子和四个氢原子不在一个平面上,而是形成正四面体的立体结构,可用模型来表示(见下图)。
甲烷中的碳原子采取sp³杂化H—C—H间键的夹角是109°28’。
图:甲烷分子模型sp³杂化又称正四面体杂化,四个sp³杂化轨道对称地分布在碳原子的周围,它的对称轴之间的夹角是109.5°,这样的排布可以使四个轨道彼此在空间的距离最远,电子之间的相互斥力最小,体系最稳定。
由碳原子的四个sp³杂化轨道与四个氢原子的s轨道进行重叠,形成四个相等的C—H共价键而构成甲烷分子。
在构成甲烷分子时,碳氢键是轨道沿着对称轴方向相互重叠所形成的共价键,其特点是电子云分布呈圆柱形轴对称,两核连线之间电子云密度最大,这种键叫做σ键。
σ键比较牢固,能自由旋转,而不影响电子云重叠程度。
一个碳原子的sp³杂化轨道与另一个碳原子的sp³杂化轨道也能形成C—C之间的σ键。
任何两个原子轨道,只要是沿着轨道对称轴方向相互重叠所形成的键都叫σ键。
2. 烷烃的化学性质烷烃中的碳都是饱和的,所以化学性质稳定。
常温下与强酸、强碱、强氧化剂及还原剂都不易反应,所以通常除作为燃料外,常用作溶剂,润滑油来使用,在较特殊的条件下,烷烃也显示一定的反应性能,而这些化学性质在基本有机原料工业及石油化工中都非常重要。
结构决定性质,同系列中各化合物的结构是相似的,因此它们的化学性质也基本相似,但是同系列中碳原子数差别较大的同系物间,反应速率会有较大差别,有时甚至不反应。
(1)取代反应烷烃分子中的氢原子被其它原子或基团所取代的反应称为取代反应。
如被卤素取代的反应称卤代反应。
卤代反应烷烃与卤素在室温和黑暗中并不起反应,但在高温下或光照下,可以发生反应生成卤代烷和卤化氢。
工业上常用甲烷的氯代反应来生产氯甲烷,所生成的氯甲烷可以继续反应生成二氯甲烷、三氯甲烷(氯仿)及四氯化碳.不同卤素的反应活性为:F2>Cl2>Br2>I2不同氢原子的反应活性: 3º氢>2º氢>1º氢(参见课本p174)卤代反应的机理——自由基历程反应机理是指化学反应所经历的途径和过程(也叫反应历程、反应机制)。
反应机理是基于大量的实验事实而做出的理论推导。
了解反应机理对掌握反应规律,控制反应条件等生产实践有指导意义。
烷烃的卤代反应属于自由基反应,反应机理大致经历以下三个步骤:(i) 链的引发在光照或高温下,氯分子吸收能量而分解为两活泼的氯原子:(ii) 链的增长氯原子可以夺取烷烃分子中的氢原子而生成甲基自由基CH3×,CH3×再与氯分子作用生成一氯甲烷和一个新的氯原子,反应可重复进行。
链的增长阶段根据反应物的量,也可以逐步生成二氯甲烷、三氯甲烷和四氯甲烷:(iii) 链的终止自由基之间的彼此结合,反应就会逐渐停止。
如:自由基反应一般是由高温、光照、辐射或引发剂(如过氧化物)所引起。
通常在气相或非极性溶剂进行。
(2)氧化反应:引入氧或出去氢为氧化;引入氢或去掉氧为还原。
烷烃在空气中燃烧、完全氧化而生成碳和水,同时放出大量热能。
烷烃燃烧时放出大量的热。
这就是沼气、天然气、石油能作为能源的基础。
3. 烷烃的物理性质沸点(bp):烷烃的沸点随分子量的增加而升高(因为分子间作用力随分子量增加而增大)一般:C4以下为气体,C5~C17为液体,>C17为固体。
支链烷烃的沸点<直链烷烃的沸点(因为支链增加,空间阻碍增大,分子间作用力减小)室温和一个大气压下,C1—C4的直链烷烃是气体,C5—C16的直链烷烃是液体,C17以上的直链烷烃是固体。
直链烷烃的沸点随分子量的增加而有规律地升高。
碳链的分支及分子的对称性对沸点有显著影响。
在含同数碳原子的烷烃同分异构体中,直链异构体的沸点最高,支链愈多,沸点愈低。
熔点(mp):烷烃的熔点基本上也是随分子量增加而升高。
而且偶数碳链烷烃的熔点>奇数碳链烷烃的熔点,(因偶数碳链具有较高的对称性,分子间作用力增大)。
相对密度:烷烃的相对密度随其分子量的增加而逐渐增大,因为烷烃分子间的作用力随其分子量的增大而增大,其分子排列更加紧密。
溶解度:烷烃是非极性分子,根据“相似相溶”经验规律,烷烃不溶于水,而易溶于有机溶剂(如四氯化碳、乙醚等)。
7.2.2 烯烃分子结构中碳原子间含有碳碳双键(>C=C<=)的烃,叫做烯烃,它的通式为C n H2n。
1.烯烃的结构乙烯是烯烃中的第一个成员,它的构造式为:近代物理方法测定,乙烯分子中的六个原子处于同一平面,H—C—H和H—C==C的键角分别为117.3°和121.4°,碳碳双键的键长为0.134nm,碳氢键的键长为0.108nm,乙烯分子中碳碳双键的键长比乙烷分子中碳碳单键的键长短。
图:乙烯分子的模型根据杂化轨道理论,碳原子在形成双键时进行了sp²杂化,三条杂化轨道分布在同一平面上,以碳原子为中心向平面的三个方向延伸,其中两条轨道与两个氢原子的1s轨道重叠形成两个sp²-s的σ键,C还剩余一个杂化轨道与另一个碳原子的杂化轨道重叠形成sp²-sp²的另一个σ键。
这两个碳原子上还各有一条未参与杂化的p轨道垂直于sp²杂化轨道的平面,彼此“头碰头、脚碰脚”地重叠形成π键。
Π键电子云分布在分子平面的上方和下方。
图:乙烯分子中的σ键和π键尽管在乙烯的构造式中用两个相同的短横来表示碳碳双键,但碳碳双键中的两个键是不同的,其中一个是σ键,另一个是π键,为了保证组成π键的两条p轨道处于平行状态,此处的σ键不能象单独存在时那样自由旋转。
2.烯烃的化学性质烯烃中碳碳双键的π键的键能比σ键的小,因而容易在双键的碳原子上加两个原子或原子团而转变成更强的σ键。
π键容易受到带正电或带部分正电荷的亲电性质的分子或离子的攻击而发生反应,具有亲电性能的试剂叫做亲电试剂。
由亲电试剂的作用而引起的加成反应叫做亲电加成反应。
(1)亲电加成反应a. 加卤化氢烯烃能与卤化氢气体或浓的氢卤酸起加成反应,生成卤代烷。
亲电加成反应的难易程度:碘化氢最易发生加成,溴化氢次之,氯化氢最难(HI>HBr>BCl)。
工业上制备氯乙烷的方法之一:乙烯在三氯化铝催化下,通过加成反应实现丙烯与卤化氢(极性试剂)加成时,可能生成两种加成产物。
实验证明丙烯与卤化氢加成的主要产物是2—卤丙烷。
根据大量的实验结果归纳出一条经验规律,凡不对称烯烃与卤化氢等极性试剂进行加成时,试剂中带正电荷的部分总是加到含氢较多的双键碳原子上,试剂中带负电荷的部分则加到含氢较少或不含氢的双键碳原子上------马尔柯夫尼柯夫(Markovnikov)规则,简称马氏规则或不对称烯烃加成规则。
利用这个规则可以预测不对称烯烃的加成产物。
例如:烯烃与卤化氢加成反应的历程:第一步反应是极性分子卤化氢中的质子首先与双键上的p 电子结合,经p 络合物生成碳正离子;第二步反应是碳正离子再与卤负离子结合,生成卤代烃:其中第一步是决定整个反应速度的步骤,在这一步中生成的碳正离子愈稳定,反应愈容易进行。
马氏规则可用碳正离子的稳定性来解释:根据物理学上的规律,一个带电体系的稳定性决定于电荷的分布情况,电荷愈分散体系愈稳定。
碳正离子的稳定性也同样取决于其本身电荷的分布情况。
碳正离子的稳定性:在丙烯与HBr进行的加成反应的第一步中,产生的碳正离子可能有两种:由于反应速度决定步骤是生成碳正离子的第一步,因而两种卤代烷在最后产物中的比例取决于生成这两种碳正离子的相对速度,后者则取决于生成它们的过渡状态能量的高低,过度状态的能量低,活化能小,反应速度快。
由于仲碳正离子比伯碳正离子稳定,相应的过渡状态的能量前者比后者低,因而2—溴丙烷生成的速度较快是主要产物。
