【化学】2011年北京市各区一模试题分类汇编:化工生产
北京怀柔区2011化学一摸带答案

2011年高级中等学校招生怀柔区第一次模拟考试一、单项选择题(下列各小题均有四个选项,其中只有一个选项符合题意。
共24分,每小题2分)1.下列物理量中,以科学家的名字“安培”作为单位的物理量是A.电压B.电流C.电阻D.电功率2.图1所示四种现象中,属于光的反射现象的是3.下列用品中,通常情况下属于导体的是A.绘画橡皮B.物理课本C.不锈钢直尺D.塑料刻度尺4.图2所示的四个实例中,目的是为了减小摩擦的是5.图3所示的各种自然现象中,属于熔化的是6.图4所示的家用电器中,不属于...电热器的是瓶盖起子A镊子 D钳子 C核桃夹子 B7.图5所示的工具中,正常使用时属于费力杠杆的是8.放在室内的一杯酒精,加快杯中酒精蒸发的措施是A .将杯子放在冰块里B .增加酒精的质量C .把装酒精的杯子装入塑料袋密封D .用扇子在杯口扇动,加快装有酒精的杯子上方空气的流动 9.图6所示的情景中,关于力对物体做功的叙述,正确的是10.下列数据中最接近实际的是A .初中物理课本的宽度约20mB .一支未用过的2B 铅笔的长度约为15mmC .一块橡皮的质量约为10kgD .一名初中生体重约为600N11.如图7所示电路中,电源电压保持不变。
闭合开关S ,当滑动变阻器的滑片P 向下滑动时,四个电表的示数都发生了变化,电表的示数分别用I 、U 1、U 2和U 3表示,电表示数变化量的大小分别用ΔI 、ΔU 1、ΔU 2和ΔU 3表示,电阻R 1、R 2、R 3消耗的电功率分别用P 1、P 2、 P 3表示,下列选项正确的是图5A.U1/I不变,ΔU1/ΔI变小B.U2/I变大,ΔU2/ΔI不变C.U3/I不变,ΔU3/ΔI不变D.滑动变阻器的滑片P向下滑动时,P1变大,P2变小,P3变大12.如图8甲是一个底面为正方形、底面边长l=20cm的容器。
把盛有h=10cm深的某种液体的容器放在水平桌面上,然后将边长a=b=10cm、c=12cm的均匀长方体木块放入这种液体中(液体未溢出),木块漂浮在液面上,此时木块底面受到液体向上的压力为7.2 N,容器底受到的液体压强为980Pa(g取10N/kg),由以上条件可以得出A.液体的密度为0.98×103kg/m3B.木块漂浮在液面上时,容器中液体的深度为12.2cmC.以图乙所示方式将木块放入液体中静止时,木块浸入液体中的深度为7.5cmD.以图丙所示方式将木块放入液体中静止时,木块下表面离容器底的距离是4.75cm二、多项选择题(下列各小题均有四个选项,其中符合题意的选项均多于一个。
北京市2011年中考化学一模试题精选汇编:化学用语

主题3 化学用语(2011年昌平区一模)14. 金属钒被誉为“合金的维生素”。
五氧化二钒(V2O5)中钒元素的化合价为A.-3 B.+ 1 C.+ 3 D.+5答案:D(2011年朝阳区一模8)8.日本东京电力公司4月6日宣布,在注入硅酸钠等阻水材料后,第一核电站高辐射污水不再流入大海。
硅酸钠的化学式是Na2SiO3,其中硅元素的化合价为A.+1 B.+ 2 C.+ 3 D.+4答案:D(2011年朝阳区一模18)18.物质X是一种重要的阻燃剂。
工业上用三氧化二锑(Sb2O3)生产X的化学方程式为Sb2O3 + 2H2O2 == X + 2H2O。
根据质量守恒定律,推断X的化学式为A.SbO2B.Sb2O5C.HSbO3D.H3SbO4答案:B(2011年朝阳区一模21)21.某种玉石的主要成份是NaAlSi2O6,关于NaAlSi2O6的下列说法正确的是A.该物质中含有三种金属元素B.该物质的一个分子中含有10个原子C.该物质由四种原子直接构成D.该物质中钠元素与氧元素质量比为1:6答案:B(2011年大兴区一模)14.下列化学方程式书写正确的是A.C + O2 == CO2B.2H2O === O2↑+ 2H2↑点燃C.H2SO4+NaOH==NaSO4+H2O D.4P + 5O2 ==== 2P2O5答案:D(2011年大兴区一模)19.“绿色化学”能实现零排放(即反应物中的原子利用率达到100%)。
CO与H2在一定条件下按照不同的比例可以合成不同的有机化工原料。
根据零排放的要求,以CO和H2合成的有机物不可能...是A.甲醇(CH4O)B.乙醇(C2H6O) C.甲醛(CH2O) D.乙酸(C2H4O2)答案:B(2011年大兴区一模)20.过氧乙酸常用来配制消毒液,过氧乙酸的化学式为C2H4O3。
下列叙述中正确的是A.过氧乙酸是由9个原子构成的B.过氧乙酸的相对分子质量为76 gC.过氧乙酸中碳、氢、氧元素的质量比为6∶1∶12D.一个过氧乙酸分子中,碳、氢、氧原子的个数比为1∶2∶3答案:C(2011年东城区一模)8.亚硒酸钠(Na2SeO3)具有清除人体内活性氧的作用,其中硒元素(Se)的化合价是A.-2 B.+2 C.+4 D.+6答案:C(2011年东城区一模)15.下列化学方程式中,书写正确的是A.2HgO === Hg + O2B.Fe2O3 + 4HCl === 2FeCl2 + 2H2OC.Zn + HCl === ZnCl2 + H2↑D.Na2CO3+Ca(OH)2 === 2NaOH + CaCO3↓答案:D(2011年东城区一模)25.根据右图所提供的信息,下列对该袋食盐的判断不正确...的是A.该食盐中氯元素的质量分数最大B.每袋食盐中碘元素的质量为10 mgC.每袋食盐中含碘酸钾的质量约为16.9 mgD.若仅靠该盐补充碘,成人每天需摄入该食盐5 g答案:D(2011年房山区一模)5.下列符号表示二个氢分子的是A.H B.2H2C.H2 D.2H答案:A(2011年房山区一模)15.2010年,冰岛火山多次喷发,曾迫使欧洲的民航飞机停飞,火山灰里含有大量的硅酸钙(CaSiO3),硅酸钙中Si元素的化合价为A.+4 B.-4 C.+5 D.+3答案:A(2011年房山区一模)18.大蒜具有一定的抗病功能和食疗价值,大蒜新素(C6H10S3)是其有效成分之一。
2011北京中考化学一模试题分类汇编物质的制备除杂与分离
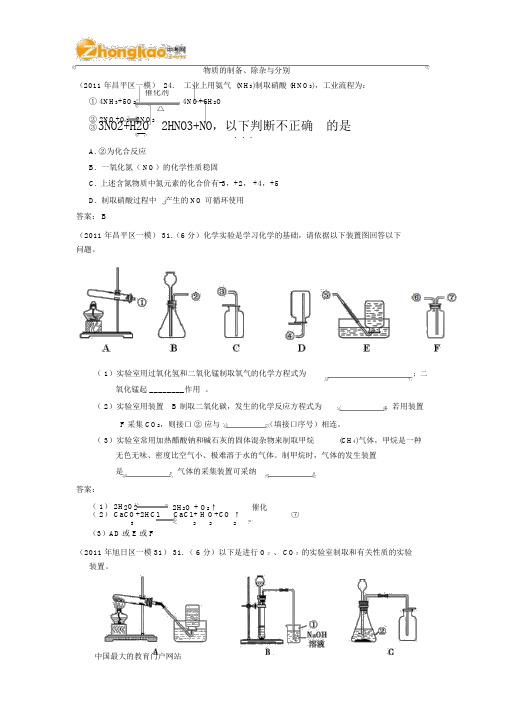
物质的制备、除杂与分别(2011 年昌平区一模)24.工业上用氨气 (NH3)制取硝酸 (HNO3),工业流程为:催化剂4NO+6H2O① 4NH3+5O2△② 2NO+O2 2NO2③3NO2+H2O 2HNO3+NO,以下判断不正确的是...A.②为化合反应B.一氧化氮( NO)的化学性质稳固C.上述含氮物质中氮元素的化合价有-3,+2, +4,+5D.制取硝酸过程中产生的 NO 可循环使用答案: B(2011 年昌平区一模)31.(6分)化学实验是学习化学的基础,请依据以下装置图回答以下问题。
( 1)实验室用过氧化氢和二氧化锰制取氧气的化学方程式为;二氧化锰起 ________作用。
( 2)实验室用装置 B 制取二氧化碳,发生的化学反应方程式为;若用装置F 采集 CO2,则接口②应与(填接口序号)相连。
( 3)实验室常用加热醋酸钠和碱石灰的固体混杂物来制取甲烷(CH4)气体,甲烷是一种无色无味、密度比空气小、极难溶于水的气体。
制甲烷时,气体的发生装置是,气体的采集装置可采纳。
答案:( 1) 2H2O22H2O + O2↑催化( 2) CaCO+2HCl CaCl + H O+CO ↑⑦3222(3)AD或 E或 F(2011 年旭日区一模 31)31.(6分)以下是进行O2、CO2的实验室制取和有关性质的实验装置。
(1)写出带有序号仪器的名称:①_______________,② ______________ 。
(2)用K MnO 4固系统取 O2,应采纳上图中的 _________装置(填字母),当O2采集满并拿出集气瓶后,停止该实验的正确操作步骤是。
( 3)用稀盐酸和大理石在B装置中反应制取CO2并检验其有关性质,观察到烧杯中导管口有气泡冒出,但无其他显然现象。
若证明CO2与NaOH溶液发生了化学反应,以下方案合理的是 ___________(填序号)。
① 取少许烧杯中液体滴加无色酚酞② 取少许烧杯中液体滴加足量稀盐酸③ 取少许烧杯中液体滴加足量石灰水( 4)用 C 装置制取了一瓶无色、无味的气体(纯净物),试用最简易的方法确立气体的成分。
2011年北京市各区一模化学试题汇编试题及答案(选择题)

12011年各区汇编理综化学部分6.下列关于水处理的方法不正确...的是 A .向水中通入O 3,用以杀菌消毒 B .向酸性废水中加入生石灰,将其中和 C .向废水中加入Na 2CO 3,可将细小悬浮物凝聚 D .向废水中加入Na 2S ,可将其中的 Cu 2+、Hg 2+沉淀7.X 、Y 、Z 、W 均为短周期元素,在周期表中位置如图所示。
Y 原子的最外层电子数是电子层数的3倍。
下列说法中不.正确..的是 A .Y 、Z 的气态氢化物,前者更稳定B .Z 、W 的最高价氧化物对应水化物的酸性,前者强C .X 、W 的气态氢化物相互反应,生成物中既含离子键又含共价键D .Y 、W 的单质,均可通过电解的方法获得8.右图是探究铁发生腐蚀的装置图。
发现开始时U 型管左端红墨水水柱下降,一段时间后U 型管左端红墨水水柱又上升。
下列说法不正确...的是 A .开始时发生的是析氢腐蚀 B .一段时间后发生的是吸氧腐蚀C .两种腐蚀负极的电极反应均为:Fe - 2e - == Fe 2+D .析氢腐蚀的总反应为:2Fe + O 2 + 2H 2O == 2Fe(OH)2 9.双酚A 是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大。
下列有关双酚A 的叙述不正确...的是A .双酚A 的分子式是C 15H 16O 2B .双酚A 的核磁共振氢谱显示氢原子数之比是1:2:2:3C .反应①中,1 mol 双酚A 最多消耗2 mol Br 2D .反应②的产物中只有一种官能团 10.下列解释过程或事实的方程式不.正确..的是 A .熔融烧碱时,不能使用普通石英坩埚:SiO 2 + 2NaOH△Na 2SiO 3 + H 2OB .在海带灰的浸出液(含有I —)中滴加H 2O 2得到I 2:2I —+ H 2O 2 + 2H + == I 2 + O 2↑+ 2H 2OC .红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe + 4H 2O△Fe 3O 4 + 4H 2D .“84消毒液” (有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气: ClO -+Cl -+2H +== Cl 2↑+H 2OHO — C — —OHCH 3 CH 3 饱和Br 2水 ②①足量H 2/Ni Δ双酚AX Y ZW红墨水pH=3的雨水浸 泡过的 铁钉11.常温下,有下列四种溶液:①②③④0.1mol/L NaOH溶液pH = 11NaOH溶液0.1mol/LCH3COOH溶液pH = 3CH3COOH溶液下列说法正确的是A.由水电离出的c(H+):①>③B.③稀释到原来的100倍后,pH与④相同C.①与③混合,若溶液pH = 7,则V(NaOH)>V(CH3COOH)D.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)12.已知:2CH3OH(g) CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol某温度下的平衡常数为400。
北京市各区2011年一模试题分类汇编 有机化学
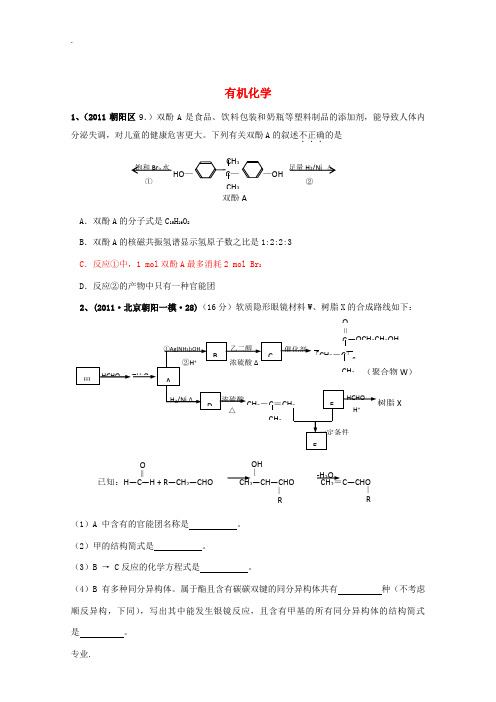
有机化学1、(2011朝阳区9.)双酚A 是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大。
下列有关双酚A 的叙述不正确...的是A .双酚A 的分子式是C 15H 16O 2B .双酚A 的核磁共振氢谱显示氢原子数之比是1:2:2:3C .反应①中,1 mol 双酚A 最多消耗2 mol Br 2D .反应②的产物中只有一种官能团2、(2011·北京朝阳一模·28)(16分)软质隐形眼镜材料W 、树脂X 的合成路线如下:(1)A 中含有的官能团名称是 。
(2)甲的结构简式是 。
(3)B → C 反应的化学方程式是 。
(4)B 有多种同分异构体。
属于酯且含有碳碳双键的同分异构体共有 种(不考虑顺反异构,下同),写出其中能发生银镜反应,且含有甲基的所有同分异构体的结构简式是 。
HO —C —OHCH 3CH 3 饱和Br 2水②①足量H 2/Ni Δ双酚A‖O 2OH XW )∣ ∣ R已知:H―C―H + R―CH 2―CHO CH 2―CH―CHO CH 2=C―CHO‖ OOH ∣R -H 2O(5)已知F 的相对分子质量为110,分子中碳原子、氢原子数都是氧原子数的3倍,苯环上的氢原子化学环境都相同。
则F 还能发生的反应是(填序号) 。
a .加成反应b .氧化反应c .加聚反应d .水解反应 (6)写出树脂X 可能的结构简式(写出一种即可) 。
(7)E 的分子式为C 10H 14O 2,含三个甲基,苯环上的一溴代物有两种。
生成E 的化学方程式是 。
答案28.(16分) (1)碳碳双键 醛基 (2)CH 3CH 2CHO(3)(4)5 (5)ab(6)(7)3、(211海淀一模26.)(16分)苏合香醇可以用作食用香精,其结构简式如图17所示。
(1)苏合香醇的分子式为 ,它不能..发生的有机反应类型 有(填数字序号) 。
①取代反应 ②加成反应 ③消去反应④加聚反应 ⑤氧化反应 ⑥水解反应CH 3∣ CH 2 = C —COOCH 2CH 2OH + H 2OCH 3 ∣ CH 2 = C —COOH + HOCH 2CH 2OH浓硫酸Δ‖ O H —C —O —CH = CH —CH 3∣ CH 3‖O H —C —O —C = CH 2nOHCH 2 H OH OH∣ CH 3 —C —CH 3 CH 3 ∣ OHOH +O OHCH 3CH 3―C =CH 2一定条件图17有机物丙是一种香料,其合成路线如图18。
北京海淀区2011年中考化学一模试题和答案

海淀区九年级第二学期期中练习化学2011.5考生须知1.本试卷共8页,共四道大题,35个小题,满分80分。
考试时间100分钟。
2.在答题纸上准确填写学校名称、班级名称、姓名。
3.试题答案填涂或书写在答题纸上,在试卷上作答无效。
考试结束,将答题纸交回。
4.请使用蓝色或黑色钢笔或圆珠笔答题。
可能用到的相对原子质量H 1 C 12 O 16 Na 23 Mg 24 Cl 35.5 K 39 Ca 40 Fe 56 Cu 64 I 127一、选择题(每小题只有1个选项符合题意,共25个小题,每小题1分,共25分。
)1.空气中含量较多且化学性质不活泼...的气体是A.氧气B.氮气C.水蒸气D.二氧化碳2.下列图示中的水,可以看作纯净物的是A.河湖水B.温泉水C.蒸馏水D.自来水3.地壳中含量最多的金属元素是A.氧B.硅C.铝D.铁4.从燃烧产物对环境影响的角度考虑,下列燃料中最理想的是A.氢气B.汽油C.酒精D.天然气5.关于生活中常见的盐,下列说法不正确...的是A.碳酸钙可用作补钙剂B.高锰酸钾紫色溶液用来作酸碱指示剂C.食盐可用于调味和腌渍蔬菜、鱼、肉等D.小苏打是焙制糕点所用的发酵粉的主要成分之一6.氮肥能使作物枝叶茂盛,叶色浓绿。
下列物质中能用作氮肥的是A.Na2SO4B.KCl C.Ca(H2PO4)2D.NH4HCO3 7.将少量下列物质混合,充分振荡后形成溶液的是A.植物油和水B.蔗糖和水C.洗涤剂和油污D.泥沙和水8.要配制50 g 5%的NaCl溶液,需要用到的一组仪器是A.托盘天平、量筒、烧杯、试管、玻璃棒B.托盘天平、量筒、烧杯、酒精灯、玻璃棒C.托盘天平、量筒、烧杯、胶头滴管、漏斗D.托盘天平、量筒、烧杯、胶头滴管、玻璃棒9.下图所示操作中,正确的是A.取用液体B.点燃酒精灯C.称量氯化钠固体D.加热固体10.下列有关化学知识的叙述中,正确的是A.化学反应过程中都有发光、放热现象B.CO2会导致全球变暖,所以大气中CO2越少越好C.所有化学反应在生成新物质的同时,都伴随着热量放出D.人类应更多地开发和利用太阳能、风能、地热能等新能源11.下列叙述中,不正确...的是A.氧气易溶于水B.一氧化碳会导致煤气中毒C.二氧化碳无毒,但是不能供给呼吸D.二氧化硫是无色、有刺激性气味的气体12.出土的古文物中,金器保存完好,铜器表面有锈迹,而铁器锈蚀严重。
北京市各区2011年中考化学一模试题分类汇编 第五单元主题1 化学与能源及资源的利用

主题1 化学与能源及资源的利用(2011年昌平区一模)28. (6分)我国属于海洋大国,浩瀚的海域蕴藏着丰富的化学资源。
(1)海底蕴藏着大量的煤、、天然气等常规化石燃料。
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃料。
燃烧反应前后分子种类变化的微观示意图如下所示。
①1个B分子中含有个原子。
②四种物质中属于化合物的是(填图中字母)。
③若8gA参加反应,则生成C的质量为g。
(3)海水晒盐能够得到粗盐和卤水。
卤水中含有MgCl2、KCl和MgSO4等物质,右图是它们的溶解度曲线。
t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是。
将t1℃的MgCl2、KCl和MgSO4三种物质的饱和溶液加热到t2℃以上时,可能会析出晶体。
答案:(1)石油(2)① 2② A C D③22(3)MgCl2MgSO4(写名称给分)(2011年大兴区一模)10.森林失火时,灭火队员通常要砍伐一些树木,开辟”防火隔离带”,其主要目的是A.隔离空气B.隔离可燃物C.降低可燃物温度D.开辟运输水的道路答案:B(2011年东城区一模)32.(6分)某化学小组同学利用以下三组装置探究燃烧条件。
图1 图2 图3(1)如图1所示,能燃烧的物质是(填字母序号),燃烧反应的化学方程式为。
A.水中的白磷B.铜片上的白磷C.铜片上的红磷(2)如图2所示,将液体a滴入瓶中并与固体b接触,能观察到白磷燃烧,则瓶内发生反应的化学方程式为。
(3)如图3所示,在空气中放置时,两团棉花均不燃烧;若将足量二氧化碳倒入烧杯时,可以观察到的现象有:①;②粘有过氧化钠的棉花燃烧;③未粘有过氧化钠的棉花不燃烧。
通过上述实验的对比分析,写出产生现象②的原因。
完成三组实验之后,同学成功探究出了燃烧所需要的条件。
答案:(1)B 4P+5O2 2P2O5 (2)2H2O22H2O + O2↑(3)蜡烛的火焰熄灭过氧化钠与二氧化碳反应时生成氧气,并放出热量(2分,错答、漏答均为0分)(2011年房山区一模)27.(6分)随着经济的发展,能源与环境成为人们日益关注的问题。
2011年北京各区一模推断题汇编

1.【西城 25】 Q 、W 、X 、Y 、Z 是5种短周期元素,原子序数逐渐增大,Q 与W 组成的化合物是一种温室气体,W 与Y 、X 与Y 组成的化合物是机动车排出的大气污染物,Y 和Z 能形成原子个数比为1∶1和1∶2的两种离子化合物。
(1)W 在元素周期表中的位置是 ,Z 2Y 的电子式是 。
(2)工业合成XQ 3是放热反应。
下列措施中,既能加快反应速率,又能提高原料转化率的是 。
a .升高温度b .加入催化剂c .将XQ 3及时分离出去d .增大反应体系的压强(3)2.24 L (标准状况)XQ 3被200 mL 1 mol/L QXY 3度从大到小的顺序是 。
(4)WQ 4Y 与Y 2如右图所示,a 极的电极反应式是 。
(5)已知:W(s)+ Y 2 (g)= WY 2(g) ΔH =-WY(g)+ Y 2 (g)= WY 2(g) ΔH =-283.0 kJ/mol24 g W 与一定量的Y 2反应,放出热量362.5 kJ ,所得产物的物质的量之比是 。
(6)X 和Z 组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
2.【东城 26】一定量的铁粉在氯气中充分燃烧后,将所得固体完全溶于稀盐酸,制得溶液A 。
(1)铁在氯气中燃烧的化学方程式是 。
(2)推测A 中可能含有的金属阳离子:①Fe 3+;②只有Fe 2+;③ 。
甲同学为探究溶液的组成,实验如下:(3)乙同学继续探究溶液A 的组成。
查阅资料:16HCl+2KMnO 4=2KCl+2MnCl 2+5Cl 2↑+8H 2O12实验过程:另取少量溶液A于试管中,逐滴加入酸性KMnO4溶液,充分振荡,KMnO4紫色褪去。
实验结论:(填写字母序号)。
a.可能有Fe2+b.可能无Fe2+c.一定有Fe2+根据你选择的实验结论,简述理由:。
3.【海淀25】甲是一种盐,由A、B、C、D、E五种元素组成,其中四种是短周期元素。
2011北京中考化学一模试题分类汇编(空气、氧气、水、碳及碳的氧化物与金属)

2011北京中考化学一模试题分类汇编(空气、氧气、水、碳及碳的氧化物与金属)D(2011年昌平区一模)27. (6分)铁、铜是我们生活中重要的金属材料。
(1)将油漆涂在铁艺家具上防止生锈,其目的是将铁与空气中的隔绝。
(2)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,发生的化学方程式为。
(3)矿物的储量有限,而且不可再生,我们必须保护金属资源并进行金属的回收利用。
欲从含有硫酸、硫酸亚铁和硫酸铜的废液中,回收全部铜。
处理过程如下:步骤①加入过量铁粉,发生的反应方程式为:,。
充分反应后步骤②进行的操作是,得到的滤渣中含有,继续处理可以得到纯净的金属铜和硫酸亚铁固体。
答案:(1)氧气和水高(2)3CO+Fe 2O 3 2Fe+3CO 2 (3)Fe+CuSO 4 Cu+FeSO 4 Fe+H 2SO 4FeSO 4+H 2↑(2011年朝阳区一模3)3.空气中含量最多的气体是A .二氧化碳B .水蒸气C .氮气D .氧气答案:C (2011年朝阳区一模4)4.下列物质可用于人工降雨的是A .冰B .干冰C .二氧化硫 D .五氧化二磷答案:B (2011年朝阳区一模27)27.(6分)水是重要的自然资源(1)下列“水”中,属于纯净物的是 。
A.矿泉水B.蒸馏水C.雨水D.自来水 (2)右图是电解水的实验装置,甲试管中收集到的气体是 , 该化学反应的基本类型是 。
(3)我国生活饮用水的主要标准为:感官指标 化学指标 细菌指标 水质无色无味澄清 pH 6.5~8.5 细菌总数<100个/mL 等 测定水样的酸碱度可选用 (填字母)。
A .酚酞溶液 B .石蕊溶液C.pH试纸(4)只用水能区分下列各组物质(物质均为白色固体)的是(填字母)。
A.纯碱、烧碱 B.生石灰、熟石灰 C.淀粉、白糖 D.氯化钠、硝酸铵(5)水常用作溶剂。
公共场所可用过氧乙酸溶液对环境进行消毒。
现有溶质质量分数为15%的过氧乙酸溶液10g,要配制成溶质质量分数为1%的过氧乙酸溶液,需加水 g。
2011北京各区高三化学一模实验汇编(含答案)

2011各区高三化学一模实验试题汇编1、(2011东城一模)10.下列说法正确的是A. 可以用乙醇萃取溴水中的溴单质B. 利用盐析或变性均可分离和提纯蛋白质C. 加入稀HNO3和BaCl2溶液产生白色沉淀的溶液中一定含SO42-D. 玻璃棒在配制0.1mol/LNaCl溶液与粗盐提纯的实验中所起的作用相同2、(2011丰台一模)9.为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确...的是A.关闭活塞1,加入稀硝酸至液面a处B.在装置左侧稍加热可以加快稀硝酸与铜的反应速率C.通过关闭或开启活塞1可以控制反应的进行D.反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO3、(20114、(2011门头沟一模)9.关于下列各装置图的叙述中,正确的是A.若采用装置①精炼铜,则a极为纯铜,b极为粗铜,电解质溶液为CuSO4溶液B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应C.装置③中X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸D.装置④可用于实验室配置一定物质的量浓度的稀硫酸5、(2011石景山一模)10.某无色溶液中含有:①Na +、②Ba 2+、③C1—、④Br —、⑤SO 32-、⑥SO 42-、2+根据上述实验现象,判断以下结论中正确的是A .肯定含有的离子是①④⑤B .肯定没有的离子是②⑤⑦C .可能含有的离子是①②⑥D .不能确定的离子是①③⑥6、(2011西城一模)9.向如下图所示的装置中缓慢地通入气体X ,若关闭活塞K ,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞K ,则品红溶液褪色。
X 和Y 可能是7、(2011东城一模)27. (16分)S 2Cl 2是工业上常用的硫化剂,实验室制备S 2Cl 2的反应原理有两种:①CS 2+3Cl 2CCl 4+S 2Cl 2;②2S+ Cl 2S 2Cl 2。
已知:S 2Cl 2易与水反应;下表是几种物质的熔沸点:95~100℃ 111~140℃ 浓盐酸MnO 2水冷水(1)利用图-21装置(部分夹持仪器已略去)来制备S 2Cl 2,反应原理是 (填写数字序号)。
北京市各区2011年中考化学一模试题分类汇编 第三单元主题2 关于化学方程式的计算
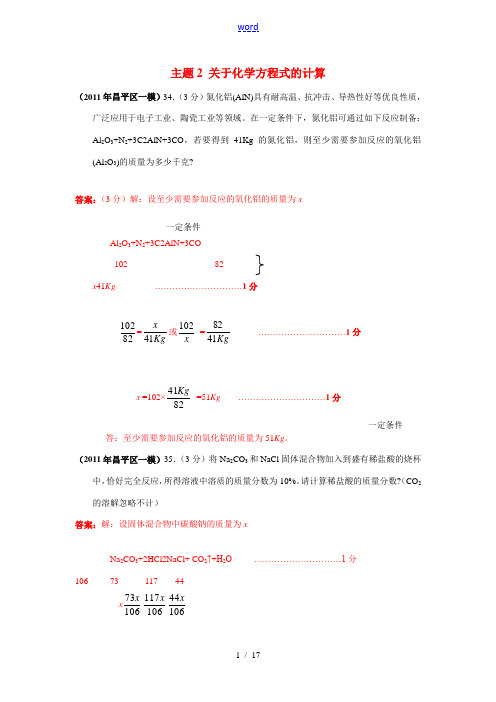
一定条件一定条件主题2 关于化学方程式的计算(2011年昌平区一模)34.(3分)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,广泛应用于电子工业、陶瓷工业等领域。
在一定条件下,氮化铝可通过如下反应制备:Al 2O 3+N 2+3C2AlN+3CO ,若要得到41Kg 的氮化铝,则至少需要参加反应的氧化铝(Al 2O 3)的质量为多少千克?答案:(3分)解:设至少需要参加反应的氧化铝的质量为xAl 2O 3+N 2+3C2AlN+3CO 102 82 x 41Kg …………………………1分82102=Kg x 41或x102=Kg 4182 …………………………1分x =102×8241Kg=51Kg …………………………1分答:至少需要参加反应的氧化铝的质量为51Kg 。
(2011年昌平区一模)35.(3分)将Na 2CO 3和NaCl 固体混合物加入到盛有稀盐酸的烧杯中,恰好完全反应,所得溶液中溶质的质量分数为10%。
请计算稀盐酸的质量分数?(CO 2的溶解忽略不计)答案:解:设固体混合物中碳酸钠的质量为xNa 2CO 3+2HCl2NaCl+ CO 2↑+H 2O …………………………1分106 73 117 44x 10673x 106117x 10644xx ) g +106117x22.3 g + g - 10644xx = 10.6 g ---------------------------------------------------------------------1分HCl 的质量=10673x =1066.1073g=稀盐酸的质量分数=gg1.21673×100%=3.4%--------------------------------1分答:稀盐酸的质量分数为3.4%。
(2011年某某区一模34)34.(3分)发射通讯卫星的火箭用联氨(N 2H 4)做燃料,用四氧化二氮(N 2O 4)助燃,生成物不会对大气造成污染,其反应的化学方程式为:2N 2H 4 + N 2O 43N 2 + 4H 2O ,请计算12.8 g N 2H 4完全燃烧需要N 2O 4的质量。
北京市各区2011年中考化学一模试题分类汇编 第四单元主题4 实验设计与评价

主题4 实验设计与评价(2011年昌平区一模)32. (5分)实验是学习化学的重要手段之一。
某班同学分成两个小组,利用右下图所示装置进行如下实验,请你参与他们的实验过程。
(1)第一小组同学的实验:位置 A B C 分液漏斗药品澄清石灰水碳酸钠溶液澄清石灰水稀盐酸操作关闭K1,打开K2和分液漏斗的活塞,缓慢滴加稀盐酸现象,并写出C中反应的化学方程式操作关闭K2,打开K1现象B中液体沿导管流入A中,A中有白色沉淀产生上述现象产生的原因(2)第二小组同学的实验:位置 A B C 分液漏斗药品X溶液稀盐酸水(滴有石蕊溶碳酸钠溶液答案:(2011年昌平区一模)33.(8分)做完“铁在氧气里燃烧”的实验后,小名同学有两个疑惑不解的问题,于是他进行了以下探究活动。
【问题1】铁燃烧时溅落下来的黑色物质中还有没有铁呢?【查阅资料1】(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);(2)铁的氧化物均能溶于酸的溶液。
【实验探究】将冷却后的黑色物质碾碎,装入试管,加入_____溶液,观察到的现象是_____,说明铁燃烧时溅落下来的黑色物质中还含有铁。
【问题2】铁燃烧的产物为什么不是Fe2O3呢?【查阅资料2】Fe3O4Fe2O3铁(1)Fe3O4和Fe2O3的分解温度、铁的熔点见表:分解温度/℃1538 1400 —(2)Fe2O3高温时分解成Fe3O4。
熔点/℃——1535 【理论探讨】结合表中数据,可推知铁在氧气里燃烧时产生的高温应在_____之间,在此温度X围内_____已分解,所以铁在氧气里燃烧的产物是_____。
【拓展延伸】(1)实验中为了防止集气瓶炸裂,必须_____;(2)有些食品包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色_____,就说明包装盒破损进气,这样售货员就能及时发现并处理。
(3)下列铁的氧化物中,铁元素的质量分数由大到小的顺序是_____(填字母)。
北京市各区高三化学一模试卷汇编

2011-2012学年度北京各区高三综合模拟练习一2012年海淀区高三一模理综化学试题6.下列做法对改善大气质量无益..的是 A .推广使用无铅汽油B .在农田中焚烧秸秆为土地施肥C .开发利用太阳能、氢能等新能源D .在汽车尾气系统中安装催化转化器7. 下列说法正确的是A .硫酸钠溶液和醋酸铅溶液均能使蛋白质变性B .油脂是高级脂肪酸的甘油酯,均不能发生氢化反应C .H 2N —CH 2—COOH 既能与盐酸反应、又能与氢氧化钠溶液反应D.合成橡胶 的单体之一是8. X 、Y 、Z 、W 是分别位于第2、3周期的元素,原子序数依次递增。
X 与Z 位于同一主族,Y 元素的单质既能与盐酸反应也能与NaOH 溶液反应,Z 原子的最外层电子数是次外层电子数的一半,Y 、Z 、W 原子的最外层电子数之和为14。
下列说法正确的是 A .原子半径由小到大的顺序:X< Y < Z< W B .Z 的最高价氧化物能与水反应生成相应的酸 C .Y 单质在一定条件下可以与氧化铁发生置换反应D .室温下,0.1 mol/L W 的气态氢化物的水溶液的pH > 19.下列实验方案不能达到实验目的的是10.海洋约占地球表面积的71%,对其进行开发利用的部分流程如下图所示。
下列说法CH 2-CH=CH —CH 2—CH 2—CHnCH 3-C ≡C —CH 3不正确...的是 A .可用BaCl 2溶液除去粗盐中的SO 42-B .从苦卤中提取Br 2的反应的离子方程式为:2Br - + Cl 2 == 2Cl - + Br 2 C .试剂1可以选用石灰乳D .工业上,电解熔融Mg(OH)2冶炼金属镁11.下列说法不正确的是12.有①氨水 ②NH 4Cl 溶液 ③Na 2CO 3溶液 ④NaHCO 3溶液各25 mL ,物质的量浓度均为0.1 mol/L ,下列说法正确的是 A .4种溶液pH 的大小顺序:①>④>③>②B .溶液①、②等体积混合后pH > 7,则c (NH 4+) < c (NH 3·H 2O)C .向溶液①、②中分别加入25 mL 0.1mol/L 盐酸后,溶液中c (NH 4+):①>② D .向溶液③、④中分别加入12.5 mL 0.1mol/L NaOH 溶液后,两溶液中的离子种类相同25. (14分)工业上利用CO 和水蒸气在一定条件下发生反应制取氢气:CO(g)+H 2O(g)CO 2(g)+H 2(g) △H =-41 kJ/mol某小组研究在相同温度下该反应过程中的能量变化。
北京市西城区高三一模理综化学试题

北京市西城区2011年高三一模试卷理科综合能力测试2011.4以下数据可供解题时参考:可能用到的相对原子质量:H 1 C 12 N 14O16 Na 236•下列有关无机非金属材料的说法中,不正确..的是A .高纯硅可用于制造半导体材料B . SiO2制成的玻璃纤维,由于导电能力强而被用于制造光缆C .玻璃、水泥和陶瓷,其成分均含有硅酸盐D . Si3N4是一种新型无机非金属材料,可应用于制造发动机7.下列说法正确的是16 18A . 0.1 mol O2和0.1 mol O2均含有0.8 mol 质子B . K+、S2「的最外层电子数相同,化学性质相同C. N2O5是酸性氧化物,能与NaOH溶液反应D .新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色&下列说法正确的是A. HCHO溶液、(NH 4)2SO4溶液均能使蛋白质变性B .煤的干馏是物理变化,煤的气化和液化是化学变化C .纤维素、蛋白质、油脂、葡萄糖在一定条件下都能发生水解反应CH 3 O OD .聚碳酸酯H —0—f*~~—C—〈—0—C —n OCH3中含有一O —C —O —结构CH39.向如下图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色。
X和Y可能是isA B C DX SO2NO2HCl Cl2Y饱和NaHCO3溶液水Na2SO3溶液Na2SO3溶液10 .某未知溶液中已检验出含有离子Ca2+、NO3「,且pH=2。
欲检验此溶液中是否大量存在以下6种离子:①ClO —②NH4+③Fe3+④「⑤AIO2「⑥C「,其中不必检验就能加以否定的离子是A.③⑤⑥ B .④⑤⑥ C .①③④ D .①④⑤11.向10.00 mL 0.01 mol/L 某一元酸HA溶液中逐滴加入图所示。
下列说法不正确的是A . HA是弱酸B . b 点表示的溶液中:2c(Na+) = c(A「)+ c(HA)C . c 点时:V= 10.00 mL 0.01 mol/L NaOH p溶液,溶液pH变化曲线如右dD . b、c、d 点表示的溶液中:c(Na+) + c(H+) = c(A「)+ c(OH「)12 •下列比较项与依据的化学反应事实不对应..的是比较项依据的化学反应事实A 比较Cl 和S 的非金属性 Na 2S + 2HCl = 2NaCl + H 2S TB 比较Fe 2+和Br_的还原性 6FeBr 2+ 3Cl 2(少量)=2FeCl 3+ 4FeBr 3C 比较碳酸和苯酚的酸性 C 6H 5ONa + CO 2+ H 2O = C 6H 5OH + NaHCO 3 D比较氯化银和碘化银的溶解度AgCl(s)+I —(aq) = AgI(s)+ Cl —(aq)25.( 14分)Q 、W 、X 、丫、Z 是5种短周期元素,原子序数逐渐增大,Q 与W 组成的化合物是一种温室 气体,W 与Y 、X 与Y 组成的化合物是机动车排出的大气污染物,Y 和Z 能形成原子个数比为 1 : 1和1 : 2的两种离子化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化工生产1、(2011朝阳区25.)(12分)KClO 3在农业上用作除草剂,超细CaCO 3 广泛用于消光纸、无炭复写纸等。
某同学在实验室模拟工业过程,利用制乙炔产生的残渣制备上述两种物质,过程如下: Ⅰ.① 电石与水反应的化学方程式是 。
② 残渣..中主要成分是Ca(OH)2 和 。
Ⅱ. 将Ⅰ中的部分灰浆..配成浊液,通入Cl 2 ,得到Ca(ClO 3)2与CaCl 2物质的量之比为1∶5 的溶液,反应的化学方程式是 。
Ⅲ. 向Ⅱ所得溶液中加入KCl ,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得KClO 3 晶体。
你认为能得到KClO 3 晶体的原因是 。
Ⅳ. 将Ⅰ中的残渣..溶于NH 4Cl 溶液,加热,收集挥发出的气体再利用。
向所得CaCl 2溶液中依次通入NH 3、CO 2,便可获得超细CaCO 3,过程如下:① 根据沉淀溶解平衡原理,解释残渣..中难溶盐的溶解原因 。
② CaCl 2溶液中通入两种气体后,生成超细CaCO 3的化学方程式是 。
③ 图示的溶液A 可循环使用,其主要成分的化学式是 。
答案:25.(12分) Ⅰ.①CaC 2 + 2H 2O Ca(OH)2 + C 2H 2↑② CaCO 3Ⅱ.6Cl 2+6Ca(OH)2 == 5CaCl 2+Ca(ClO 3)2 + 6H 2O Ⅲ.KClO 3的溶解度小 Ⅳ.① CaCO 3(s )Ca 2++CO 32-,NH 4Cl 溶液显酸性,使CO 32-浓度减小,平衡向右移动,CaCO 3溶解 ② CaCl 2 + 2NH 3 + CO 2 + H 2O == CaCO 3↓+ 2NH 4Cl ③ NH 4Cl2、(211海淀一模27.)(15分)某电镀铜厂有两种废水需要处理,一种废水中含有CN -离子,另一种废水中含有电 石水灰 浆 自然风干 残 渣 残CaCO 3Cr 2O 72-离子。
该厂拟定如图19所示的废水处理流程。
图19 回答以下问题:(1)上述处理废水的流程中主要使用的方法是 。
(2)②中使用的NaClO 溶液呈碱性,用离子方程式解释原因 。
(3)②中反应后无气体放出,该反应的离子方程式为 。
(4)③中反应时,每0.4 mol Cr 2O 72-转移2.4 mol e -,该反应的离子方程式为 。
(5)取少量待检水样于试管中,先加入NaOH 溶液,观察到有蓝色沉淀生成,继续加入NaOH 溶液,直到不再产生蓝色沉淀为止,再加入Na 2S 溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少。
请你使用化学用语,结合必要的文字解释其原因 。
答案:2.(15分)(1)氧化还原法 ……………………………………………………………(2分) (2)ClO - + H 2OHClO+OH - ……………………………………………(3分)(3)CN - + ClO - === CNO -+ Cl - ……………………………………………(3分) (4)3S 2O 32- + 4Cr 2O 72- +26H + === 6SO 42- + 8Cr 3+ + 13H 2O ………………(3分) (5)待检水样中还有Cu 2+ (1分) Cu 2++2OH - === Cu(OH)2↓(1分) Cu(OH)2(s)+S 2-(aq)=== CuS(s)+2OH -(aq)(1分,未标状态给分,或Cu(OH)2Cu 2++2OH -;Cu 2++S 2-===CuS ↓给分)CuS 比Cu(OH)2更难溶(1分,或溶解度更小)…………(共4分)3、(211西城一模26.)(14分)铬铁矿的主要成分可表示为FeO ·Cr 2O 3,还含有SiO 2、Al 2O 3等杂质,已知:① NaFeO 2遇水强烈水解。
② Cr 2O 72-+ H 2O 2CrO 42-+ 2H +请回答:(1)K 2Cr 2O 7中Cr 元素的化合价是 。
(2)生成滤渣1中红褐色物质的反应的化学方程式是 。
滤液1的成分除Na 2CrO 4外,还含有(填化学式) 。
(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是 。
(4)由滤液2转化为Na 2Cr 2O 7溶液应采取的措施是 。
(5)向Na 2Cr 2O 7溶液中加入KCl 固体,获得K 2Cr 2O 7晶体的操作依次是:加热浓缩、 、过滤、洗涤、干燥。
(6)煅烧铬铁矿生成Na 2CrO 4和NaFeO 2反应的化学方程式是 。
答案:3(14分)(1)(1分)+6 (2)(2分)NaFeO 2 + 2H 2O =NaOH + Fe(OH)3↓(各1分)NaAlO 2、Na 2SiO 3和NaOH(3)(2分)2Al 2O 3(熔融) 4Al + 3O 2↑ (4)(2分)加硫酸酸化 (5)(2分)冷却结晶(6)(2分)4FeO ·Cr 2O 3 + 7O 2 + 20NaOH 8Na 2CrO 4 + 4NaFeO 2+ 10H 2O3、(2011东城28.)(14分)欲降低废水中重金属元素铬的毒性,可将转化为Cr(OH)3沉淀除去。
已知:电解煅烧(1)某含铬废水处理的主要流程如图-22所示:①初沉池中加入的混凝剂是K 2SO 4﹒Al 2(SO 4)3﹒24H 2O ,用离子方程式表示其反应原理是 。
②反应池中发生主要反应的离子方程式是++5H +=2Cr 3+++4H 2O 。
根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH 溶液,此过程中发生主要反应的离子方程式是 、 。
证明Cr 3+沉淀完全的方法是 。
(2)工业可用电解法来处理含废水。
实验室利用如图-23模拟处理含的废水,阳极反应式是Fe-2e -=Fe 2+,阴极反应式是2 H + +2e -=H 2↑。
Fe 2+与酸性溶液中的反应的离子方程式是 ,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是 。
用电解法处理该溶液中0.01mol 时,至少得到沉淀的质量是 g 。
答案:28.(14分,每空2分)(1)①Al3+ +3H 2O= Al(OH)3(胶体)+3H+ 或Al3+ +3H 2OAl(OH)3+3H+②Cr3++ 3OH- =Cr(OH)3↓、H++ OH- = H 2O 。
测定溶液的pH ,若pH≥8,则证明Cr3+沉淀完全。
(2)+6Fe2++14H+=2Cr3++6Fe3++7H 2O ,阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强。
8.484、(2011丰台26.)(14分)工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na 2S 。
① 测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因 。
② 含硫废水的处理过程中可以采用纯氧将Na 2S 转化为Na 2SO 4,则反应中还原剂与氧化剂的物质的量之比为 。
已知1000℃时,硫酸钠与氢气发生下列反应:Na 2SO 4(s) + 4H 2(g)Na 2S(s) + 4H 2O(g) ,+FeFe含Cr 2O 72—废水、稀H 2SO 4 图-23混凝剂排放含的废水NaHSO 3 NaOH Cr(OH)3 图-22已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:①中和含酸废水工业常用的试剂x是。
②写出H2S气体与足量NaOH溶液反应的化学方程式。
③铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式:。
④已知:2H2S(g)+O2(g) = 2 S(s) +2 H2O(l) △H= —632.8 kJ/molSO2 (g)= S(s) + O2(g) △H= +269.8kJ/molH2S与O2反应生成SO2和H2O的热化学方程式为。
答案:26.(14分)(1)①S2—+ H 2O HS—+ OH—(2分)②1:2 (2分)> (2分)(2)①石灰水(2分)②H2S + 2NaOH = Na2S + 2H2O (2分)③SO32—+ 8H+ + 6e—= H2S↑+ 3H2O (2分)④2H2S(g)+3O2(g) = 2SO2 (g) + 2H2O(l) △H= —1172.4kJ/mol(2分,合理给分)5、(2011石景山27.)(14分)我国制碱工业的先驱——侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O NH4Cl+NaHCO3(晶体),依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。
(1)A装置中所发生反应的离子方程式为________________________。
C装置中稀硫酸的作用为___________________________________________。
(2参照表中数据,请分析B装置中使用冰水的目的是______________________。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在_____________装置之间(填写字母)连接一个盛有___________的洗气装置,其作用是_____________________________________。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为。
答案.(共14分,每空2分)(1)CaCO3+2H+=Ca2++CO2↑+H2O;吸收从B装置中的试管内逸出的氨气,减少对环境的污染(2)温度越低,碳酸氢钠的溶解度越小,便于析出(3)A与B;饱和NaHCO3溶液(其他合理答案均可给分);除去CO2中混合的HCl气体(4)60%。
