九年级化学酸碱盐
初三化学酸碱盐归纳总结
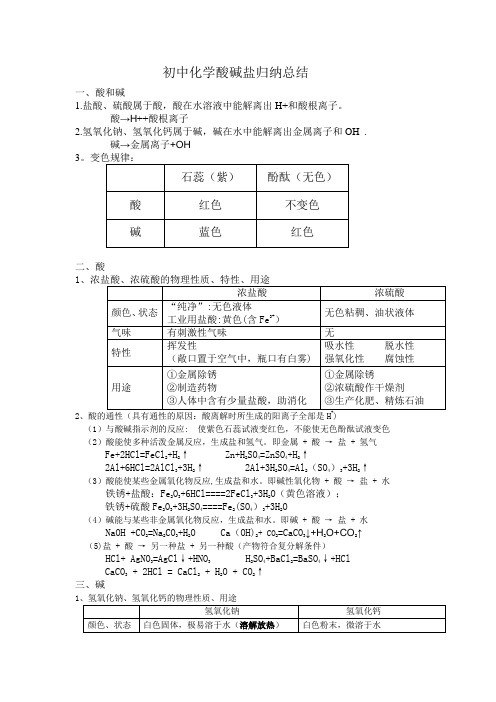
初中化学酸碱盐归纳总结一、酸和碱1.盐酸、硫酸属于酸,酸在水溶液中能解离出H+和酸根离子。
酸→H ++酸根离子2.氢氧化钠、氢氧化钙属于碱,碱在水中能解离出金属离子和OH¯. 碱→金属离子+OH ¯ 3二、酸12(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色,不能使无色酚酞试液变色 (2)酸能使多种活泼金属反应,生成盐和氢气。
即金属 + 酸 → 盐 + 氢气Fe+2HCl=FeCl 2+H 2↑ Zn+H 2SO 4=ZnSO 4+H 2↑2Al+6HCl=2AlCl 3+3H 2↑ 2Al+3H 2SO 4=Al 2(SO 4)3+3H 2↑(3)酸能使某些金属氧化物反应,生成盐和水。
即碱性氧化物 + 酸 → 盐 + 水 铁锈+盐酸:Fe 2O 3+6HCl====2FeCl 3+3H 2O (黄色溶液); 铁锈+硫酸Fe 2O 3+3H 2SO 4====Fe 2(SO 4)3+3H 2O(4)碱能与某些非金属氧化物反应,生成盐和水。
即碱 + 酸 → 盐 + 水 NaOH +CO 2=Na 2CO 3+H 2O Ca (OH)2+ CO 2=CaCO 3↓+H 2O+CO 2↑ (5)盐 + 酸 → 另一种盐 + 另一种酸(产物符合复分解条件) HCl+ AgNO 3=AgCl ↓+HNO 3 H 2SO 4+BaCl 2=BaSO 4↓+HClCaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 三、碱12、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH )(1)碱溶液与酸碱指示剂的反应: 使紫色石蕊试液变蓝色,使无色酚酞试液变红色 (2)酸性氧化物+碱 → 盐+水 2NaOH+CO 2=Na 2CO 3+H 2O (3)酸+碱 → 盐+水NaOH + HCl = NaCl + H 2O(4)盐+碱 → 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)HCl+ AgNO 3=AgCl ↓+HNO 3 H 2SO 4+BaCl 2=BaSO 4↓+HCl CaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 注:①难溶性碱受热易分解(不属于碱的通性) 如Cu(OH )2 ΔCuO +H 2O 2Fe(OH)3 ΔFe 2O 3+3H 2O②常见沉淀:AgCl ↓ BaSO 4↓ Cu(OH)2↓ F e (OH)3↓ Mg (OH)2↓ BaCO 3↓ CaCO 3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
九年级化学酸碱盐相互反应及方程式

制备Cu(OH)2
2H2O 通电 2H2↑ + O2↑
2Cu +O2 Δ 2CuO
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + 2NaOH = Cu(OH)2↓+Na2SO4
氢氧化铝和稀盐酸反应 Al(OH)3+3HCl=AlCl3+3H2O 氢氧化铝和稀硫酸反应 2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
3、碱与盐
氢氧化钠和氯化铁反应 3NaOH + FeCl3= 3NaCl + Fe(OH)3↓ 氢氧化钠和硫酸铜反应 2NaOH + CuSO4= Na2SO4 + Cu(OH)2↓ 氢氧化钙和碳酸钠反应 Ca(OH)2 + Na2CO3=2NaOH + CaCO3↓ 氢氧化钙和硫酸铜反应 CuSO4+Ca(OH)2=Cu(OH)2 ↓ +CaSO4 氢氧化钙和氯化铁反应 2FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2
锌与稀盐酸反应 Zn+2HCl=ZnCl2+H2↑
锌与稀硫酸反应 Zn+H2SO4(稀)=ZnSO4+H2↑
铁与稀盐酸反应
Fe+2HCl=FeCl2+H2↑
铁与稀硫酸反应
Fe+H2SO4(稀)=FeSO4+H2↑
2、酸与某些金属氧化物
氧化铁和稀盐酸反应 Fe2O3+6HCl=2FeCl3+3H2O 氧化铁和稀硫酸反应 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 氧化铜和稀盐酸反应 CuO+ HCl=CuCl2+H2O 氧化铜和稀硫酸反应 CuO+H2SO4=CuSO4+H2O
初中化学酸碱盐知识归纳总结

初中化学酸碱盐知识归纳总结酸碱盐是化学最后一部分内容,也是中考的重中之重,各大方程式更是考卷的常客。
这里豆姐详细地总结了这一专题的重点知识,如果你还有任何疑问的话,一定要仔细阅读。
一、酸及酸的通性酸的定义,电离时生成的阳离子全部都是H+。
酸是由氢离子和酸根离子构成。
1.浓盐酸、浓硫酸的物理性质、特性、用途2.酸的通性:盐酸HCl 硫酸H2SO4酸使紫色石蕊试液变红,使无色酚酞试液不变色。
金属+酸→盐+氢气Zn+2HCl=ZnCl2+H2↑Zn+ H2SO4 =ZnSO4+H2↑碱性氧化物+酸→盐+水Fe2O3+6HCl=2FeCl3+3H2OFe2O3+3H2SO4=Fe2(SO4)3+3H2O碱+酸→盐+水NaOH+HCl=NaCl+ H2OCu(OH)2+H2SO4= CuSO4+2H2O盐+酸→另一种盐+另一种酸AgNO3+HCl=AgCl↓+HNO3BaCl2+H2SO4=BaSO4↓ +2HCl注意:(1)在‘金属+酸→盐+氢气’中,酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸。
因为浓硫酸或硝酸都有强氧化性,与金属反应时不能生成氢气而生成了水。
(2)通过金属跟酸的反应情况导出金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性由强逐渐减弱金属活动性顺序中,金属位置越靠前,活动性越强,反应越剧烈,所需时间越短。
(3)浓硫酸具有吸水性,通常用它作为干燥剂。
硫酸还具有脱水性,它对皮肤或衣服有很强的腐蚀性。
稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,切不可把水倒进浓硫酸里,如果把水注入浓硫酸里,水的密度较小,会浮在硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液向四处飞溅,容易发生事故。
二、碱及碱的通性定义:电离时生成的阴离子全部是OH-离子。
碱是由金属离子(或铵根离子)和氢氧根离子构成。
1.氢氧化钠、氢氧化钙的物理性质、用途2.碱的通性碱使紫色石蕊试液变蓝,使无色酚酞试液变红。
初中化学酸碱盐

第4节
酸碱盐的溶解性
酸碱盐的溶解性
钾钠铵盐溶于水
硝酸盐遇水影无踪,指钾盐、钠盐、 铵盐、硝酸盐都是可溶于水的
2 碳酸盐能溶钾钠铵
其它盐多不溶水中间,指钾盐、钠 盐、铵盐都能溶于水,其它大多数
碳酸盐难溶于水
4
1
氯化物只有银不溶
硫酸盐不溶只有钡,指氯化银难溶 于水,硫酸银、硫酸钡难溶于水
3
酸碱盐的化学性质
盐的化学性质
与金属反应:生成新的金属和新的盐, 前提是金属的活泼性大于该盐中的金属 与碱反应:生成新的碱和新的盐 与某些酸反应:生成新的酸和新的盐 热分解:如$NH_{4}HCO_{3}$加热分解成 $NH_{3}$、$H_{2}O$和$CO_{2}$
第3节
酸碱盐的反应规律
酸碱盐的反应规律
等
在生活中的应用
如食盐用于调味和腌渍食 品;小苏打用于发酵粉等
-
谢谢聆听
xxxxxx
初中化学酸碱盐
XXXXX
-
1 酸碱盐的基本概念
2 酸碱盐的化学性质
3 酸碱盐的反应规律
4
酸碱盐的溶解性
5
酸碱盐的应用
第1节
酸碱盐的基本概念
酸碱盐的基本概念
酸:在水中能解离出阳离子全部是氢离子($H^{+}$)的
1
化合物
碱:在水中能解离出阴离子全部是氢氧根离子($OH^{-
2
}$)的化合物
盐:由金属阳离子(或铵根离子)和酸根阴离子组成的
钾钠钙铵碱可溶
其它多数碱不溶,指氢氧化钾、氢 氧化钠、氢氧化钙、氨水(一水合氨) 可溶于水,其他大多数难溶于水
第5节
酸碱盐的应用
酸碱盐的应用
九年级科学--化学部分复习(酸碱盐)
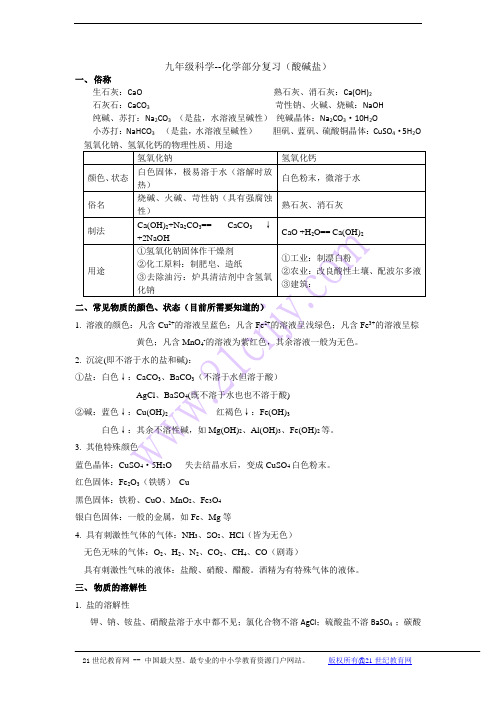
九年级科学--化学部分复习(酸碱盐)一、俗称生石灰:CaO 熟石灰、消石灰:Ca(OH)2石灰石:CaCO3 苛性钠、火碱、烧碱:NaOH纯碱、苏打:Na2CO3(是盐,水溶液呈碱性)纯碱晶体:Na2CO3·10H2O小苏打:NaHCO3(是盐,水溶液呈碱性)胆矾、蓝矾、硫酸铜晶体:CuSO4·5H2O 氢氧化钠、氢氧化钙的物理性质、用途氢氧化钠氢氧化钙颜色、状态白色固体,极易溶于水(溶解时放热)白色粉末,微溶于水俗名烧碱、火碱、苛性钠(具有强腐蚀性)熟石灰、消石灰制法Ca(OH)2+Na2CO3== CaCO3↓+2NaOHCaO +H2O== Ca(OH)2用途①氢氧化钠固体作干燥剂②化工原料:制肥皂、造纸③去除油污:炉具清洁剂中含氢氧化钠①工业:制漂白粉②农业:改良酸性土壤、配波尔多液③建筑:二、常见物质的颜色、状态(目前所需要知道的)1. 溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色;凡含MnO4-的溶液为紫红色,其余溶液一般为无色。
2. 沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(不溶于水但溶于酸)AgCl、BaSO4(既不溶于水也也不溶于酸)②碱:蓝色↓:Cu(OH)2红褐色↓:Fe(OH)3白色↓:其余不溶性碱,如Mg(OH)2、Al(OH)3、Fe(OH)2等。
3. 其他特殊颜色蓝色晶体:CuSO4·5H2O 失去结晶水后,变成CuSO4白色粉末。
红色固体:Fe2O3(铁锈)Cu黑色固体:铁粉、CuO、MnO2、Fe3O4银白色固体:一般的金属,如Fe、Mg等4. 具有刺激性气体的气体:NH3、SO2、HCl(皆为无色)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)具有刺激性气味的液体:盐酸、硝酸、醋酸。
酒精为有特殊气体的液体。
三、物质的溶解性1. 盐的溶解性钾、钠、铵盐、硝酸盐溶于水中都不见;氯化合物不溶AgCl;硫酸盐不溶BaSO4 ;碳酸盐只溶钾、钠、铵。
(完整版)初三化学酸碱盐知识点(最全整理版)
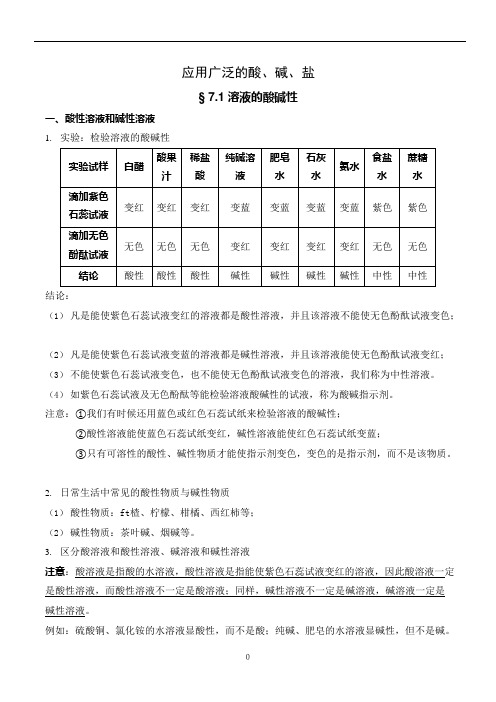
应用广泛的酸、碱、盐§ 7.1 溶液的酸碱性一、酸性溶液和碱性溶液1.实验:检验溶液的酸碱性结论:(1)凡是能使紫色石蕊试液变红的溶液都是酸性溶液,并且该溶液不能使无色酚酞试液变色;(2)凡是能使紫色石蕊试液变蓝的溶液都是碱性溶液,并且该溶液能使无色酚酞试液变红;(3)不能使紫色石蕊试液变色,也不能使无色酚酞试液变色的溶液,我们称为中性溶液。
(4)如紫色石蕊试液及无色酚酞等能检验溶液酸碱性的试液,称为酸碱指示剂。
注意:①我们有时候还用蓝色或红色石蕊试纸来检验溶液的酸碱性;②酸性溶液能使蓝色石蕊试纸变红,碱性溶液能使红色石蕊试纸变蓝;③只有可溶性的酸性、碱性物质才能使指示剂变色,变色的是指示剂,而不是该物质。
2.日常生活中常见的酸性物质与碱性物质(1)酸性物质:ft楂、柠檬、柑橘、西红柿等;(2)碱性物质:茶叶碱、烟碱等。
3.区分酸溶液和酸性溶液、碱溶液和碱性溶液注意:酸溶液是指酸的水溶液,酸性溶液是指能使紫色石蕊试液变红的溶液,因此酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。
例如:硫酸铜、氯化铵的水溶液显酸性,而不是酸;纯碱、肥皂的水溶液显碱性,但不是碱。
014 4 34. 补充知识:酸、碱、盐的概念(1) 酸:电离时生成的阳离子全部是氢离子的化合物。
如:HCl 、HNO 3、H 2SO 4、H 2CO 3 等。
HCl==H ++Cl -;H 2SO 4==2H ++SO 2-;(2) 碱:电离时生成的阴离子全部是氢氧根离子的化合物。
如:NaOH 、Ca(OH)2 等。
NaOH==Na ++OH -;Ca(OH)2==Ca 2++2OH -;(3) 盐:电离时生成金属离子(或铵根离子)和酸根离子的化合物。
如:NaCl 、NH 4NO 3 等。
NaCl==Na ++Cl -;NH 4NO 3==NH ++NO -;二、溶液的酸碱性的强弱1. 酸碱度:用来表示溶液的酸性或碱性的强弱程度。
中考化学:酸碱盐总结版

专题六知识点一:常见的酸、碱、盐1. 酸金属和酸性溶液的反应条件:在金属活动性顺序表中,金属要排在氢前。
浓硫酸、硝酸跟金属反应不能生成氢气。
铁发生置换反应时,生成+2价的铁的化合物(比如FeCl 2,而不是FeCl 3)。
浓硫酸可用来洗气干燥(长进短出)。
酸酸的组成:酸 H + + 酸根离子常 见 的 酸盐酸硫酸浓盐酸的性质:无色液体,有刺激性气味,具有挥发性,打开瓶盖后可以看见白雾(盐酸小液滴),敞口放置后溶质挥发,溶质质量分数变小;稀盐酸化学性质:可与酸碱指示剂、金属、金属氧化物、碱、盐等发生化学反应; 用途:重要的化工原料。
用于金属表面除锈、精炼石油、制造药物等。
浓硫酸的性质:粘稠油状液体,无气味,具有吸水性、脱水性(碳化现象)、强氧化性,溶于水时放出大量的热,敞口放置后溶剂增多,溶质质量分数变小; 稀硫酸的化学性质:可与酸碱指示剂、金属、金属氧化物、碱、盐等发生化学反应。
用途:重要的化工原料。
用于生产化肥、农药、火药、冶炼金属、金属除锈等碱碱的组成:碱 OH - + 金属离子(或NH )常见 的 碱氢氧化钠 苛性钠、火碱、烧碱氢氧化钙 熟石灰、消石灰 物理性质:白色固体、颗粒,极易溶于水,溶于水时放出大量的热,易潮解;化学性质:可与酸碱指示剂、非金属氧化物、酸、盐等发生化学反应,有强腐蚀性,暴露在空气中会结合CO 2发生变质;用途:重要的化工产品。
广泛用于肥皂、石油、造纸、纺织等。
物理性质:白色粉末状固体,微溶于水;化学性质:可与酸碱指示剂、非金属氧化物(CO 2、SO 2)、酸、碱、盐等发生化学反应,有腐蚀性;用途:建筑业上常用来砌砖抹墙;农业上用来降低土壤的酸性,改良土壤结构,还用它来配制农药波尔多液等。
怎么判断?补充:1、注意区分酸溶液和酸性溶液、碱溶液和碱性溶液:酸溶液是指酸的水溶液,而酸性溶液是指能使紫色石蕊试液变红的溶液,因此,酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。
初三化学酸碱盐所有化学方程式

精心整理初三化学酸碱盐所有化学方程式:(氯化物/盐酸盐)氯化钾氯化钠(食盐)氯化镁氯化钙氯化铜氯化锌氯化钡氯化铝KClNaClMgCl2CaCl 2CuCl2ZnCl2BaCl 2AlCl 3氯化亚铁氯化铁氯化银FeCl 2FeCl 3AgCl(常见的酸)硫酸盐酸硝酸磷酸硫化氢溴化氢碳酸H 2SO 4HClHNO 3H3PO 4H 2SHBrH 2CO 3(我 子-1 1 2、铁在氧气中燃烧:3Fe+2O 2=3FeO 4现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
3、铜在空气中受热:2Cu+O 2=2CuO 现象:铜丝变黑、用来检验是否含氧气。
4、铝在空气中燃烧:4Al+3O 2=2Al2O 3现象:发出耀眼的白光,放热,有白色固体生成。
5、氢气中空气中燃烧:2H2+O2=2H2O 高能燃料现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。
6、红(白)磷在空气中燃烧:4P+5O 2=2P2O5证明空气中氧气含量现象:(1)发出白光(2)放出热量(3)生成大量白烟。
7、硫粉在空气中燃烧:S+O2=SO2现象:A、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
8、碳在氧气中充分燃烧:C+O2=CO2现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊9、碳在氧气中不充分燃烧:2C+O2=2CO10、二氧化碳通过灼热碳层:C+CO2=2CO(是吸热的反应)11、一氧化碳在氧气中燃烧:2CO+O2=2CO2现象:发出蓝色的火焰,放热,产生的气体能使澄清石灰水变浑浊。
121314151617124678现象:(1)发出白光(2)放出热量(3)生成大量白烟。
9、硫粉在空气中燃烧:S+O2点燃SO2现象:A、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
初三化学-酸碱盐的综合复习

01 酸碱盐的综合复习一、基础知识复习知识点一:酸的复习1.常见的酸(1)浓盐酸①盐酸的物理性质:盐酸是_____色透明的液体,有_____气味,具有_____性。
【拓展】通常盐酸为无色液体,工业盐酸因含FeCl3而显黄色。
②挥发性:盐酸浓度越大,挥发性越_____。
浓盐酸瓶口出现_____,这是由于___________________________________________的缘故。
保存时必须__________,敞口放在空气中,溶质质量_______,溶液浓度会_______。
(2)浓硫酸①物理性质:纯净的硫酸是无色、粘稠、油状的液体,不易挥发,易溶于水并放出大量的热。
浓硫酸稀释时,需把浓H2SO4沿容器壁慢慢注入水中且边倒边搅拌,切不可将水倒入浓硫酸。
※②吸水性、脱水性、强氧化性。
③硫酸的用途:用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等,在实验室中还可作干燥剂。
2.稀酸的通性酸的组成中均含有________,因此酸具有相似的性质。
(1)酸溶液与指示剂反应。
(2)中和反应:酸+ 碱→ 盐+ 水①定义:酸和碱反应,生成盐和水并放出热量的反应称为中和反应。
如盐酸与氢氧化铁的反应,实验现象是:再如H2SO4 +2NaOH = Na2SO4 + 2H2O;无明显现象,需要使用酸碱指示剂判定反应的发生。
②中和反应的应用:a.___________:改良酸性土壤。
b.___________:治疗胃酸过多。
(4)酸+ 活泼金属(活动性顺序表中排在H前的金属)→盐+ H2↑铁钉和盐酸反应:;现象:;【注意】一般采用稀硫酸或者稀盐酸,浓盐酸挥发性太强,产生的氢气中含有大量氯化氢气体,浓硫酸或硝酸与金属反应不产生氢气。
(5)酸与某些盐反应:①与碳酸盐反应生成二氧化碳:实验现象:有气泡产生②与一些盐反应生成沉淀用氯化钡溶液检验硫酸:_________________________________;用硝酸银溶液检验盐酸:_________________________________;【酸的基础小练习】1.下列物质与盐酸反应,既不生成沉淀,又无气体放出,且溶液显无色的是()A.Na2CO3B.AgNO3C.MgO D.Cu(OH)22.经测定某溶液的pH=1,下列物质中不能在该溶液中大量存在的是()A.氯化钠B.氯化铜C.氢氧化钾D.稀硫酸3.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种。
初三化学酸碱盐知识点最全整理版

初三化学酸碱盐知识点最全整理版一、酸碱盐的基本概念酸碱盐是指化合物中含有酸性离子和碱性离子的化合物,它们在水溶液中能够产生酸、碱或盐的性质。
二、酸的概念与性质1. 酸的定义:酸是指能够产生H+(氢离子)的物质。
2. 酸的性质:a) 酸与金属反应产生盐和氢气;b) 酸与碱反应产生盐和水;c) 酸与金属碱式盐反应产生盐和水;d) 酸与金属氧化物反应产生盐和水。
三、碱的概念与性质1. 碱的定义:碱是指能够产生OH-(氢氧根离子)的物质。
2. 碱的性质:a) 碱溶液具有碱性;b) 碱能与酸反应产生盐和水;c) 碱与非金属氧化物反应生成盐和水。
四、酸碱反应1. 酸与金属氧化物的反应:a) 酸与金属氧化物反应生成盐和水;b) 酸和金属氧化物的反应方程式为:酸+ 金属氧化物→ 盐+ 水。
2. 酸与金属氢化物的反应:酸与金属氢化物反应生成盐和氢气,反应方程式为:酸 + 金属氢化物→ 盐 + 氢气。
3. 酸与碱的反应:酸与碱反应生成盐和水,反应方程式为:酸 + 碱→ 盐 + 水。
4. 酸与金属的反应:酸与金属反应生成盐和氢气,反应方程式为:酸 + 金属→ 盐 +氢气。
五、酸碱指示剂酸碱指示剂可用来检测溶液的酸碱性质,常用的酸碱指示剂有酚酞、甲基橙、溴酚蓝等。
六、pH值pH值用来表示溶液的酸碱性,其计算公式为pH = -log[H+],其中[H+]表示溶液中的氢离子浓度。
a) pH值小于7的溶液为酸性溶液;b) pH值大于7的溶液为碱性溶液;c) pH值等于7的溶液为中性溶液。
七、盐的性质与分类1. 盐的性质:a) 盐的固态结晶体呈现颗粒状;b) 盐可溶于水,生成电离的阳离子和阴离子;c) 盐的溶液能导电;d) 盐在高温下能产生颜色。
2. 盐的分类:a) 氯盐:含有氯离子的盐类,如氯化钠(NaCl);b) 硫盐:含有硫离子的盐类,如硫酸钙(CaSO4);c) 亚硝酸盐:含有亚硝酸根离子的盐类,如亚硝酸钠(NaNO2);d) 酸式盐:含有酸性离子的盐类,如硫酸钠(NaHSO4);e) 硼酸盐:含有硼酸根离子的盐类,如硼酸钠(Na2B4O7);f) 碳酸盐:含有碳酸根离子的盐类,如碳酸钠(Na2CO3)。
(完整版)初中化学酸碱盐知识归纳

初中化学酸碱盐知识归纳一、酸、碱、盐的组成1、酸是由氢元素和酸根组成的化合物,如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)2、碱是由金属元素和氢氧根组成的化合物,如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)3、盐是由金属元素元素(或铵根)和酸根组成的化合物,如:氯化钠、碳酸钠4、酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)二、酸1、浓盐酸、浓硫酸的物理性质、特性(1)浓盐酸具有挥发性,溶液放置一段时间后浓度会减小。
(2)浓硫酸❖吸水性,在实验室中常用它做干燥剂(干燥:O2、H2、N2、CO2、CO)(NH3不行)❖脱水性,能夺取含碳、氢、氧等元素组成的化合物里的“水分”(氢、氧元素),生成黑色的炭和水。
❖强烈的腐蚀性❖强氧化性注:稀释浓硫酸的方法——一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。
(酸入水)2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)金属 + 酸→ 盐 + 氢气(3)碱性氧化物 + 酸→ 盐 + 水(4)碱 + 酸→ 盐 + 水(5)盐 + 酸→ 另一种盐 + 另一种酸(产物符合复分解条件)三、碱(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)酸性氧化物+碱→ 盐+水(3)酸+碱→ 盐+水(4)盐+碱→ 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)注:①常见沉淀:AgCl↓,BaSO4↓,Cu(OH)2↓,F e(OH)3↓,Mg(OH)2↓,BaCO3↓,CaCO3↓②复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
五、中和反应与溶液酸碱度的表示法--pH1、定义:酸与碱作用生成盐和水的反应2、溶液酸碱度的表示法--pH(1)(2)pH的测定:最简单的方法是使用pH试纸用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)六、熟记常见物质的俗称和化学式:生石灰—— CaO 熟石灰——Ca(OH)2 石灰石、大理石—— CaCO3食盐——NaCl 火碱、烧碱、苛性钠—— NaOH 纯碱、苏打——Na2CO3 小苏打——NaHCO3 金刚石、石墨——C 干冰——CO2 冰——H2O 天然气(甲烷)——CH4 酒精(乙醇)—— C2H5OH 醋酸(乙酸)——CH3COOH七、熟记常见物质的颜色:(1)红色的固体——Cu、Fe2O3 、P(红磷)(2)黑色的固体——C、CuO、Fe3O4、FeO、MnO2(3)暗紫色的固体——KMnO4(4)黄色的固体—— S(5)蓝色絮状沉淀——Cu(OH)2(6)红褐色絮状沉淀——Fe(OH)3(7)蓝色的溶液—— CuSO4、CuCl2、Cu(NO3)2等含Cu2+溶液(8)浅绿色的溶液——FeSO4、FeCl2等含Fe2+溶液(9)黄色的溶液——FeCl3、Fe2(SO4)3、Fe(NO3)3等含Fe3+溶液八、物质的检验和鉴别:1、检验稀盐酸(或Cl-)——取少量待检液体于洁净的试管中,滴入几滴AgNO3溶液和稀HNO3,有白色沉淀产生。
九年级化学酸碱盐怎么区分

酸、碱、盐
酸:
1.定义:电离时生成的阳离子全部是H+的化合物
2.常见的酸:HCl,H2SO4,HNO3,H3PO4。
碱:
1.定义:电离时生成的阴离子全部是OH-的化合物
2.常见的碱:NaOH,KOH,Cu(OH)2,Fe(OH)3等
盐:
1. 定义:电离时生成金属离子(包括NH4+)和酸根离子的化合物
2. 常见的盐:NaCO3,NaCl,NaSO4等
区分酸碱盐的方法:阳离子全是H+的化合物是酸,阴离子全是OH-的化合物是碱,金属离子和酸根离子组成的化合物是盐。
怎么区分酸碱盐
酸:电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸,或者溶于水并能释放质子形成H3O+(水合氢离子)的物质也是酸。
如盐酸、硫酸、碳酸、硝酸等。
碱:在水溶液中电离出的阴离子全部都是OH-的物质是碱。
如氢氧化锂、氢氧化钠、氢氧化铷、氢氧化铯、氢氧化钫等。
盐:金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物是盐。
如氯化钠,硝酸钙,硫酸亚铁和乙酸铵硫酸钙,氯化铜,醋酸钠等。
有关酸碱盐的口诀
酸类多数都易溶,硅酸微溶是独种。
碱类钾钠钡铵溶,钙是微溶余不溶。
硫酸铅钡沉水中,微溶钙银与亚汞。
盐类溶有钾钠铵,外加易溶硝酸盐。
碳酸能溶钾钠铵,其余俱沉水中间。
盐酸沉淀银亚汞,还有微溶氯化铅。
(完整版)初中化学酸碱盐总结

1、酸(1)使酸碱指示剂变色(非氧化性酸),紫色石蕊试液或蓝色石蕊试纸遇酸溶液变红色,无色酚SU式液遇酸溶液不变色(2)酸呈酸性(PH值〈7)(3)跟金属活动性顺序表(H)前的活泼金属的单质起置换反应(非氧化性酸)酸+金属一-盐+氢气【置换反应】例:2HCl+Fe=FeC12+H2 t(4)跟碱性氧化物和某些金属氧化物反应酸+碱性(金属)氧化物一-盐+水例:3H2S04+Fe203=Fe2(S04)3+3H20(5)跟碱起中和反应酸+碱盐+水例:2HC1+Cu (OH) 2=CuC12+2H20(6)与某些盐反应生成酸和新盐。
盐+酸二新盐+新酸,要依照复分解的条件来判断是否会发生反应例:BaC12+H2S04=BaS04 I +2HC1{常见的酸:盐酸:物理性质:有刺鼻性气味和酸味的液体,易挥发,遇水蒸气形成口雾。
化学性质:有酸的通性用途:除锈,制药,胃液里的盐酸帮助消化。
硫酸:物理性质:纯硫酸是无色粘稠油状液体,不挥发。
硫酸特性:吸水性.脱水性.强氧化性。
稀硫酸有酸的通性。
2、碱非可溶性碱的性质:1、能与酸反应可溶性碱的通性:2、碱呈碱性碱能使紫色石蕊试液变蓝碱能使无色的酚駄试剂变红。
pH>73、与酸性氧化物反应注:碱+酸性氧化物=盐+水【不是复分解反应】例:φCa (OH) 2+C02=CaC03 I ÷H20②2NaOH+CO2=Xa2CO3+H2O注:酸性氧化物不等于非金属氧化物4碱+酸=盐+水5碱+盐=碱+盐【反应物均可溶】{常见的碱:NaOH俗称:烧碱。
火碱。
苛性钠。
物理性质:白色固体,易溶于水,溶解时放热明显,易潮解。
化学性质;有碱的通性。
用途:除油污。
用于肥皂造纸纺织印染。
Ca(OH)2俗称:消石灰。
熟石灰。
物理性质:白色粉末,微溶于水。
化学性质:有碱的通性。
用途:水溶液用于检验二氧化碳,制烧碱。
改良酸性土壤。
砌砖抹墙。
3、盐1.能和酸反应生成新酸和新盐2.能和酸性氧化物生成盐和水3.能和盐反应生成新碱和新盐酸与碱中和的产物(中和反应),由金属离子(包括钱根离子)与酸根离子构成。
初中化学酸碱盐知识归纳

一、概念:1、酸的组成——氢离子+酸根离子2、碱的组成——金属离子+氢氧根离子3、盐的组成——金属离子+酸根离子4、复分解反响——由两种化合物互相交换成分,生成另外两种化合物的反响,叫做复分解反响。
AB+CD=AD+CB5、稀释浓硫酸的方法——一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。
6、中和反响——酸跟碱作用生成盐和水的反响叫做中和反响。
二、熟记常见元素和原子团的化合价口诀:〔正价〕一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷。
〔负价〕负一价:氟、氯、溴、碘;负二价:氧和硫。
〔可变正价〕:一二铜汞,二三铁,二四碳,四六硫。
〔原子团的化合价负一价:氢氧根〔OH〕,硝酸根〔NO3〕,氯酸根〔ClO3〕,高锰酸根〔MnO4〕;负二价:硫酸根〔SO4〕,碳酸根〔CO3〕,亚硫酸根〔SO3〕,锰酸根〔MnO4〕;负三价:磷酸根〔PO4〕;正一价:铵根〔NH4〕。
三、熟记以下反响方程式:〔一〕酸的性质〔1〕与指示剂反响紫色石蕊试液变红色,无色酚酞试液不变色。
〔2〕酸+碱=盐+水。
〔3〕酸+*些金属氧化物=盐+水。
〔4〕酸+活泼金属=盐+氢气。
〔5〕酸+盐=新盐+新酸。
1、锌跟稀盐酸反响: Zn + 2HCl = ZnCl2 + H2 ↑有气泡产生,锌粒逐渐减少。
2、锌跟稀硫酸反响: Zn + H2SO4 = ZnSO4 + H2 ↑3、铁跟稀盐酸反响: Fe + 2HCl = FeCl2 + H2 ↑有气泡产生,铁逐渐减少,4、铁跟稀硫酸反响: Fe + H2SO4 =FeSO4 + H2 ↑溶液变成浅绿色。
5、铁锈跟稀盐酸反响:Fe2O3 +6HCl = 2FeCl3 + 3H2O 红色铁锈逐渐消失,6、铁锈跟稀硫酸反响:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 溶液变成黄色7、氧化铜跟稀盐酸反响:CuO + 2HCl =CuCl2 +H2O 黑色氧化铜逐渐消失,8、氧化铜跟稀硫酸反响:CuO + H2SO4 = CuSO4 + H2O 溶液变成蓝色。
初中化学酸碱盐性质总结

③硝酸也是一种含氧酸,对应的酸酐是N2O5,而不是NO2。
纯净的硝酸是无色的液体,具有刺激性气味,能挥发。
打开浓硝酸的瓶盖在瓶口会产生白色酸雾。
浓硝酸通常带黄色,而且硝酸越浓,颜色越深。
这是因为硝酸具有不稳定性,光照或受热时分解产生红棕色的NO2气体,NO2又溶于硝酸溶液中而呈黄色。
所以,实验室保存硝酸时要用棕色(避光)玻璃试剂瓶,贮存在黑暗低温的地方。
硝酸又有很强的腐蚀性,保存硝酸的试剂瓶不能用橡胶塞,只能用玻璃塞。
除具有酸的通性外,不管是稀硝酸还是浓硝酸都具有强氧化性。
硝酸能溶解除金和铂以外的所有金属。
金属与硝酸反应时,金属被氧化成高价硝酸盐,浓硝酸还原成NO2,稀硝酸还原成NO。
但是,不管是稀硝酸还是浓硝酸,与金属反应时都没有氢气产生。
较活泼的金属铁和铝可在冷浓硝酸中钝化,冷浓硝酸同样可用铝槽车和铁罐车运输和贮存。
硝酸不仅能氧化金属,也可氧化C、S、P等非金属。
硝酸与Cu、C发生反应的化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O3Cu+8 HNO3(稀)=3Cu(NO3)2+2NO↑+4H2OC+4HNO3(浓) CO2↑+4NO2↑+2H2O④磷酸是一种中等强度的三元酸,可以形成一种正盐和两种酸式盐。
如:磷酸氢二钠(Na2HPO4),磷酸二氢钠(NaH2 PO4),磷酸二氢铵[NH4H2PO4 ],磷酸氢二铵[(NH4)2HPO4 ],磷酸二氢钙[Ca(H2PO4)2](溶于水)。
2.常见物质的溶解性常见酸中除硅酸(H2SiO3)外均可溶;常见碱中除NaOH、KOH、Ca(OH)2 、NH3•H2O可溶,微溶外其余均为难溶碱。
其中Cu(OH)2 为蓝色沉淀,Fe(OH)3 为红褐色沉淀,其余均为白色沉淀;常见的盐的溶解性规律是:钾、钠、铵、硝溶;盐酸银不溶;硫酸钡不溶硫酸钙、硫酸银微溶;碳酸钾、钠、铵能溶;碳酸镁微溶。
3.金属活动顺序表的应用金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au ———————————————————————————————→金属活动性由强到弱金属活动顺序表的应用主要是在置换反应中的应用。
人教版 九年级 化学酸碱盐知识点总结

第十单元课题1 常见的酸和碱1.酸碱指示剂(1)定义:能跟酸或碱的溶液起作用而的物质叫做酸碱指示剂。
(2)常见的酸碱指示剂有紫色石蕊溶液和无色酚酞溶液。
①紫色石蕊溶液遇酸性溶液,遇碱性溶液,在中性溶液中。
②无色酚酞溶液遇酸性溶液,遇碱性溶液,在中性溶液中。
2.常见的酸(1)盐酸①是气体的水溶液。
②色、气味液体,有性。
③打开浓盐酸瓶塞,瓶口冒(小液滴)。
④用途:金属表面、胃液中含盐酸帮助。
(2)硫酸①色、气味、的液体。
②浓硫酸特性:强性、性。
③用途:金属表面、作剂、铅蓄等。
④事故处理:先用,再涂上3%~5%的溶液。
⑤稀释浓硫酸:一定要把沿器壁慢慢注入中,并不断用搅拌,切不可将倒入,原因是防止。
(3)敞口放置在空气中的浓盐酸和浓硫酸的比较(4)化学性质①与指示剂反应:紫色的石蕊试液遇酸变色,无色的酚酞试液遇酸色。
②酸+活泼金属= (基本反应类型属于反应)HCl+Mg== H2SO4+Fe==注意:单质铁与稀盐酸、稀硫酸发生反应时,生成的化合物中铁元素显价。
③酸+金属氧化物= (基本反应类型属于反应)HCl+Fe2O3== H2SO4+CuO==④酸+碱= (基本反应类型属于反应)HCl+NaOH== H2SO4+Ca(OH)2==⑤酸+盐= (基本反应类型属于反应)HCl +CaCO3== H2SO4 +BaCl2== 3.常见的碱(1)氢氧化钠①俗名:、、。
②溶于水,溶于水时;固体有吸水性并(称量时应放在等玻璃器皿上)。
③用途:制肥皂;造纸、印染等工业;精炼石油、炉具等。
④事故处理:先用,再涂上溶液。
(2)氢氧化钙①俗名:、。
②溶于水,且溶解度随温度升高而。
氢氧化钙溶液俗名,当含水中有较多未溶解的Ca(OH)2时,称为。
③用途:建筑业、护树、改良、配制。
(3)化学性质①与指示剂反应:紫色的石蕊试液遇碱变色,无色的酚酞试液遇碱色。
②碱+非金属氧化物= (是否属于基本反应类型?)NaOH+CO2== Ca(OH)2+CO2==注意:一般用吸收CO2,用检验CO2。
初三酸碱盐化学式

活泼金属+酸==盐+氢气Fe+2HCl==FeCl2+H2 现象:铁粉慢慢减少,同时有气体生成,溶液呈浅绿色Fe+CuSO4==FeSO4+Cu 现象:铁溶解生成红色金属金属氧化物+酸==盐+水CuO+2HCl==CuCl2+H2O 现象:黑色固体溶解,生成黄绿色的溶液Zn+2HCl==ZnCl2+H2↑现象:黑色固体溶解,生成黄绿色的溶液Mg+2HCl==MgCl2+H2↑现象:黑色固体溶解,生成黄绿色的溶液Fe+2HCl==FeCl2+H2↑现象:溶液变成浅绿色,同时放出气体2Al+6HCl==2AlCl3+3H2↑现象:有气体生成Fe2O3+3H2SO4==Fe2(SO4)3+3H2O 现象:红色固体溶解,生成黄色溶液CuO+H2SO4==CuSO4+H2O 现象:黑色固体溶解,生成蓝色溶液Fe2O3+6HCl==2FeCl3+3H2O 现象:红色固体溶解,生成黄色的溶液酸+碱==盐+水NaOH+2HCl==NaCl+H2O 现象:不明显KOH+2HCl==KCl+H2O 现象:不明显Fe(OH)3+3HCl==FeCl3+3H2O 现象:红棕色絮状沉淀溶解,形成了黄色的溶液Cu(OH)2+2HCl==CuCl2+2H2O 现象:蓝色沉淀溶解,形成黄绿色的溶液2NaOH(或KOH)+H2SO4==Na2SO4+2H2O 现象:不明显NaOH+HCl(或HNO3、H2SO4)==NaCl+H2O 现象:酸碱中和反应,现象不明显BaCl2+Na2SO4==BaSO4↓+2NaCl 现象:有白色的不溶于强酸的沉淀生成Cu (OH) 2+H2SO4==CuSO4+2H2O 现象:蓝色沉淀溶解,生成蓝色溶液Fe (OH) 3+3HCl==FeCl3+3H2O 现象:红棕色絮状沉淀溶解,溶液呈黄色Fe (OH) 2+2HCl==FeCl2+2H2O 现象:白色絮状沉淀溶解,溶液呈浅绿色酸+盐==新酸+新盐HCl+AgNO3==AgCl↓+HNO3 现象:有白色沉淀生成,这个反应用于检验氯离子CaCO3+2HCl==CaCl2+H2O+CO2↑现象:百色固体溶解,生成能使纯净石灰水变浑浊的气体Na2CO3+2HCl==2NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体NaHCO3+HCl==NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体H2SO4+BaCl2==BaSO4↓+2HCl 现象:生成不溶于强酸的白色沉淀,用于检验硫酸根离子CaCO3+H2SO4==CaSO4+H2O+CO2↑Na2CO3+H2SO4==Na2SO4+H2O+CO2↑AgNO3+HCl==AgCl↓+HNO3 现象:有白色沉淀生成,且不溶于强酸2AgNO3+Na2SO4==Ag2SO4↓+2NaNO3 现象:有白色沉淀生成非金属氧化物+碱==盐+水CO2+Ca(OH)2==CaCO3↓+H2O 碱+盐==新碱+新盐NaOH(KOH)+FeCl3(Fe(NO3)3、Fe2(SO4)3)==Fe(OH)3↓+NaCl 现象:生成红棕色絮状沉淀,括号里面的反应过程相似,产物相对应就行了2NaOH(KOH)+FeCl2(Fe(NO3)2、FeSO4)==Fe(OH)2↓+2NaCl 现象:生成白色絮状沉淀,括号里面的反映过程相似,产物相对应就行了2NaOH(KOH)+CuCl2(Cu(NO3)2、CuSO4)==Cu(OH)2↓+2NaCl 现象:生成蓝色絮状沉淀,括号里面的反应过程相似,产物相对应就行了MgCl2(Mg(NO3)2、MgSO4)+NaOH(KOH)==Mg(OH)2↓+NaCl 现象:生成白色沉淀,括号里面的反应过程相似,产物相对应就行了CuCl2+2NaOH==Cu (OH) 2↓+2NaCl 现象:生成了蓝色絮状沉淀FeCl2+2NaOH==Fe(OH)2↓+NaCl 现象:有白色絮状沉淀生成金属+盐==新盐+新金属Fe+AgNO3==Fe(NO3)2+Ag 现象:铁溶解生成银白色的金属Zn+FeCl2==ZnCl2+Fe 现象:锌粉慢慢溶解,生成铁Cu+2AgNO3==Cu(NO3)2+2Ag 现象:红色的铜逐渐溶解,同时有银白色的金属生成盐+盐=新盐+新盐BaCl2+Na2CO3==BaCO3↓+2NaCl 现象:有白色沉淀生成但可溶于盐酸和硝酸,其实也溶于硫 酸,但生成硫酸钡沉淀,不容易看出来CaCl2+Na2CO3==CaCO3↓+2NaCl 现象:生成白色沉淀AgNO3+NaCl==AgCl↓+NaNO3现象:有白色沉淀生成,且不溶于强酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例7 :
取质量分数为10%的酒精溶液和 质量分数为60%的酒精溶液相混 合,配制质量分数为30%的酒精溶 液100g ,需各取多少g ?
; / 微信红包群
vhd82wkw
远的吃货夜叉看姑姑是真的在生气,偷看了她一眼之前。以迅雷不及掩耳之势,在盘子里添了一大勺红烧肉,至于那条鱼,她因为一直忙着和 鸡做斗争,还无从下爪,心犹不甘的端着盘子向后院走去。赶走了夜叉,饭局空前安静了下来,陆婉娉从来就有食不语的习惯,反正这位公孙 大爷也有黄哈咯招呼,她也懒得多说一句。反倒是这位公孙公子自来熟,不拿自己当外人,一个劲的往陆婉娉的碗里添菜添饭。让人莫名奇怪 的是,他所添都是女鬼大人喜欢吃的青菜,既然是喜欢的她就没理由拒绝。对于一直殷勤对己的黄大哈咯,这位公孙公子自然也是不敢怠慢, 也是忙不停的替黄大哈咯布菜。陆婉娉这一餐做的菜不少,但并一定都合所有人的胃口,所以连带着面对公孙公子在自己碗里堆的如小山般的 各式菜肴,黄大哈咯的脸顿时苦了下来,一脸哀怨的望着并不看向自己的公孙公子,哪里还有愉快心情?感觉今天一整天身体就不舒服,所以 这饭吃的也更少了,陆婉娉匆匆扒拉几口,很快就以极其认真仔细的心态吃完了自己碗里的饭菜,放下碗筷冲向二人微微一笑,“二位慢用, 我吃好了!”头疼,突如其来的头疼,并且头疼的差不多要炸裂开来,陆婉娉现在已经明显不同于从前,她不想迁就自己顾及别人的感受,更 不要说在这当着明晃晃的大灯泡,看黄大哈咯和公孙公子二人眉来眼去的媚态了。留下一个足够大的空间给自己休息的余地,彼此何乐而不为 呢?嗯,估计用不了多久,这里就快成为黄大哈咯和公孙公子的二人专场了,这个如果有必要的话,她这个名誉副镇长还是可以理解的,太平 镇女人多,单身女人更多,妇女问题毕竟是她想要一力放在第一的首要工作。已经吃罢午饭的夜叉正在后院里逗小爱玩儿,看到陆婉娉走过来, 夜叉倒是没敢抬头。小爱“呜呜”地往前伸出两只前爪,女鬼大人现在是有身份的人了,她不想似从前一样将体重差不多要和自己一样重的小 爱抱在怀里,嘻笑着拍了拍小爱的头,“小爱啊,我看你的伤也好的差不多了,找个合适的时候,我回山上的时候把你送走吧!”小爱“呜呜 咽咽”地撒着娇,“不嘛,不嘛,我要和女鬼大人你在一起,我还要担负起时刻保护你的安全的重任呢!”陆婉娉呵呵一笑,“你呀,我看是 越来越懒了,别的见识没有,这肉却是越长越磁实了,再不回狼族,只怕是到时候狼王和一众朋友都不认识你了,一味的惰化,怕是连个老公 也寻不到了。”做为一个成年母狼,这话无疑是很伤人感情的,小爱似是被踢了一狠脚的狗一般,垂下了骄傲的尾巴。一脸唉怨的看着夜叉, 那意思也是显而易见的:都怪你,我都说要回去了嘛!“姑姑,你当真要把小爱送走?”夜叉嘟着个嘴,眼里噙着泪,孩子一般报怨着。再看 向夜叉的时候,陆婉娉脸色就
2.盐水是不是溶液?盐+水,盐有不溶 解沉在杯底的液体是不是溶液?
观察: 1.在两杯盐溶液中放入鸡蛋,观察
现象,并且解释为什么会出现你
所观察到的现象呢? 2.观察三个试管里面的硫酸铜溶液 观察有什么不同?为什么?
同种溶质的溶液有浓稀之分:
溶液浓稀的实质是:
相等质量的溶液中所含溶质的多少 Nhomakorabea溶液浓稀的表示方法
例5 :
化学实验室现有98%的浓硫酸,为 了做制取氢气的实验,需要20%的 稀硫酸。要把30克质量分数为98% 的浓硫酸稀释为质量分数是20%的 稀硫酸,需要水多少克?
例6 :
把50mL 质量分数为98%的浓硫酸 稀释成质量分数为20%的稀硫酸 多少mL ?需水多少mL ?(浓硫 酸的密度是1.84×103千克/米3)
第一章
第五节
酸 碱 盐
配制溶液
思考:
1.在两杯相同质量的水中分别加入10 克和20克的食盐,请问他们在味觉上 有什么不同之处,为什么?
溶液的组成: 溶质:
溶剂:
溶液:由一种或一种以上的物质分
散到另一种液体物质里,形成均一、稳 定的混合物叫做溶液。
思考:
1.请你辨别一下,以下物质是不是溶液: 牛奶、泥土+水、植物油加水、汽水、碘 酒、36度的白酒、75%的酒精;若是溶液 的话请你指出溶液中的溶剂、溶质;
-------溶液溶质的质量分数 溶液中溶质质量与溶液质量的比值 溶液的质量=溶质的质量+溶剂的质量 溶液的质量分数==(溶质质量/溶液质 量)×100% ==【溶质质量/(溶质质量+溶剂质 量)】×100%
例1:
请你判断下面两句话,是否正确? ①在100g溶剂里溶解了5g 溶质,则该溶 液中溶质的质量分数为5% 。 ②在100mL 的溶液中有5mL的溶质, 则溶液中该溶质的质量分数为5% 。
例2 :
将20g硫酸铵完全溶于180g水中,所得 溶液中硫酸铵的质量分数为多少?
例3 :
1.化学实验室现需要10%的氢氧 化钠溶液30g,问需要氢氧化钠固 体和水分别多少? 2.现有氯化钠固体15g,现要配制 成浓度为20%的溶液,需要水多 少?
例4 :
配制饱和的食盐溶液,实验员在 配制的时候往1500g蒸馏水中加入 了食盐350g,其中有50g食盐沉在 容器底部,请问这个配成的溶液 的质量分数是多少?
