第五章_金属有机化学-2.
有机化学 第五章旋光异构

旋光性
旋光仪(polarimeter)
旋光性的表示方法: • 旋光性--能旋转偏振光的振动方向的性质叫旋光性
• 旋光性物质(或叫光活性物质)--具有旋光性的物质.
• 右旋物质--能使偏振光的振动方向向右旋的物质. 通常用 “d” 或 “+” 表示右旋. • 左旋物质--能使偏振光的振动方向向左旋的物质. 通常用 “ l” 或 “-” 表示左旋. l • 旋光度-- 偏振光振动方向的旋转角度.用“”表 示.
(2)锲形式——比较直观 •将手性碳原子表示在纸面上,用实线表示在纸面 上的键,虚线表示伸向纸后方的键,用锲形实线表 示伸向纸前方的键。
2、构型的标记 (1)D—L法
(相对标记法)
甘油醛
D-(+)-甘油醛
L-(-)-甘油醛
目前,糖类、氨基酸的构型仍采用D、L标 记法,适合含一个C*的分子构型。
(2) R-S标记法
(补充). 螺环化合物
• 类似于丙二烯型化合物
a b
H HOOC
c a b ,c d 时, d 存在对映体
CH3 COOH
例2:联苯(邻位上有较大取代基时):
两个苯环不在一个平面 • 如果两个苯环上的取代基分布不对称,整个分子就具有 手性.(6,6’-二硝基-2,2’-联苯二甲酸)
HOOC
NO2
构造异构:分子式相同而分子中原子或 基团连接顺序不同 立体异构:分子中原子的结合顺序相同 而原子或基团在空间相对位置不同 对映异构:分子式和构造式相同,构型 不同并呈镜象对映关系的立体异构现象 称为对映异构,又称旋光异构或光学异 构。
一、 手性和对映体
生活中的对映体 (1)-镜象
沙漠胡杨
生活中的 对映体(2) -镜象
第五章 过渡金属有机化合物的基元反应

金属有机化学
配体的配位和解离反应
◎过渡金属和烯烃的配位
按照Chatt -Dewar -Duncanson模型,乙烯和过渡金属的 配位键包括: ● 烯烃的成键π轨道供给电子和金属的空d 轨道相重叠; ● 金属的满填d 轨道和烯烃的反键π* 轨道相重叠,即金 属的反馈。
金属有机化学
二、 氧化加成与还原消除
O OC CO Mn OC CO CO
14
CH3 +
14
OC CO OC
CO
C
CH3
Mn CO CO
金属有机化学
插入反应和反插入反应
不饱和化合物插入M—H键,如:
[R h (N H 3 ) 5 H ]
2+
+ C H 2=C H 2
[R h (N H 3 ) 5 C 2 H 5 ]
2+
如不饱和化合物插入M—R键则可表示为:
M
L
L
M
S
+
L
L
L
S
: S o lv e n t
M L3
+
L’ M L 3L ’
M L 3L ’
L
: lig a n t
K = M L3 L’
通常人们喜欢:易生成配位饱和的配合物而分离、纯化易, 而其中某个配体又极易在温和条件下解离,生成配位不饱和 的配合物而发生反应。
P d ( P P h 3) 4 P d ( P P h 3) 3 + PPh3
LnM R + C C LnM C C R
插入反应还有:
T i(N R 2 ) 4 + 4 C S 2 R 3P b R ' + S O 2 R 3S n -N R 2 + C O 2 T i(S 2 C N R 2 ) 4 R 3P b O S O R ' R 3S n O C O N R 2
第五章金属在各种环境中的腐蚀

8
2.4防止海水腐蚀的措施
• 1)研制和应用耐海水腐蚀的材料。 如:铁、镍、铜及其合金,耐海水钢。
• 2)阴极保护。 腐蚀最严重处采用护屏保护较合理,亦可采用简易可行的牺牲阳极法。
• 3)涂层。 除应用防锈油漆外,还可采用防止生物玷污的双防油漆,对于潮汐区和飞
溅区的某些固定的钢结构可以使用蒙乃尔合金包覆。
其寿命一般有几年。 *镍及其合金在碱液中的腐蚀
镍及其合金对于高温高浓度的碱耐蚀性很好,所以广泛用于制碱业。镍实际上 适合各种浓度和温度的碱液,其耐蚀性一般与合金含镍量成正比。 *两性金属在碱液中的腐蚀 铝、锌、锡等两性金属在碱溶液中不耐蚀。钛、钽、铌等在碱溶液中耐蚀性也 不好。在热碱中,钽的耐蚀性更差。
• (3)微生物引起的腐蚀。
11
3.3防止土壤腐蚀的措施
• 1)采用涂料或包覆玻璃布防水。 • 2)采用电化学保护,多采用牺牲阳极法,阴极保护与涂料联合使用效果更好。 • 3)采用金属涂层或包覆金属,镀锌层等。
12
第四节 金属在工业环境中的腐蚀
4.1金属在酸溶液中的腐蚀
• 氧化性酸与非氧化性酸对金属的腐蚀情况大不相同。 非氧化性酸的特点:腐蚀的阴极过程基本上是氢去极化过程,增加溶液酸度 相应地会增加阴极反应,并使金属腐蚀速度增加。
6
第二节 金属在海水中的腐蚀
2.1 海水腐蚀特点 • 1. 盐类及导电率 • 2. 溶解氧 • 3.海水的电化学特点
2.2影响海水腐蚀的因素
• 盐类 • 海水中溶解氧 • 海洋生物和腐烂的有机物 • 海水的温度、流速 • PH值
7
2.3海水中常用金属材料的耐蚀性
• 金属材料在海水中的耐蚀性差别很大,其中耐蚀性最好的是钛合金和Cr-Ni合金,而铸铁 和碳钢耐蚀性较差。不锈钢的均匀腐蚀速度虽然很小,但在海水中易产生点蚀。
金属有机化学 第5章 羰基配合物

过渡金属原子簇化合物的结构和性质
多核配位化合物,并不一定是原子簇化合物,因一般 的多核体系中,M 与 M 之间不一定存在 M-M 键。例如 Cr2O7= 并不是簇合物,因 Cr 与 Cr 之间由O来键合。上世 纪的60年代以前仅合成了几个簇合物,如 K3W2Cl9,Fe2(CO)9 等。但近年来发展非常迅速,已合成出了数百个结构新颖 的簇合物。
侧基配位的情况比较少, 此时, CO可认 为是一个四电子给予体, 它一方面以5孤 对电子同M1配位,同时又以1电子同M2 配位。
5σ
C :
O
1π
M1
M2
12
2) 边桥基配位 在双核或多核羰基化合物中,用符号“-CO” 表示,CO作为两电子配体,能够同时和两个金属原 子的空轨道重叠;另一方面金属原子充满电子的轨 道也能同CO的*反键轨道相互作用,形成反馈键。 结果是CO作为桥将两个金属联结到一起.
7
(2)与酸作用生成羰基氢化物
(3)配体取代反应 Fe2(CO)9+4NO
(4)氧化还原反应 Mn2(CO)10 +Br2
羰基配合物的成键: CO哪些分 子轨道上的电子能给予中心原子 形成配位键? (sp-sp反键)
(二重简并) (sp(C))
(二重简并)
(sp-sp成键) (sp(O))
8
4 轨道由于电子云大部分集中在CO核之间, 不能给予其它原子。 能给予中心金属原子电子对的只有3、1和 5电子。 3电子是 属于氧的孤对电子,由于氧的电负性比碳原子大, 除少数情况之外, 氧很难将3电子对拿出来给予中心金属原子, 因此,能与中心金 属原子形成σ 配键的分子轨道就只有1和 5了。
29
硼烷簇化合物的结构类型
structure type
有机化学第五章答案
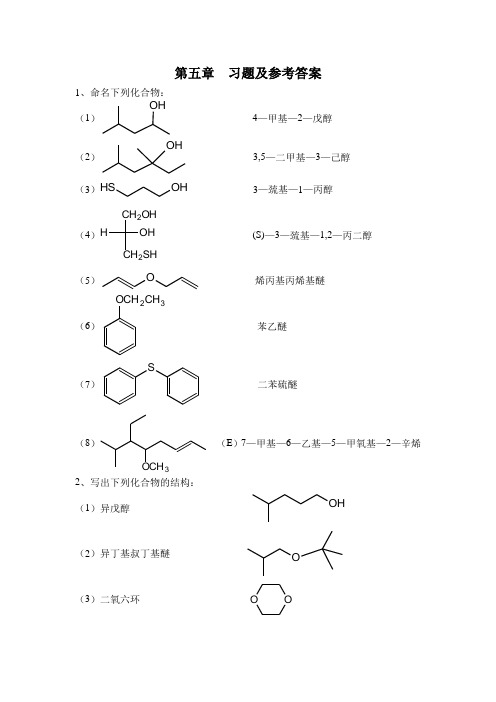
第五章 习题及参考答案1、命名下列化合物:(1)O H4—甲基—2—戊醇(2)O H3,5—二甲基—3—己醇(3)O H SH 3—巯基—1—丙醇(4)H O H CH 2OHCH 2SH(S)—3—巯基—1,2—丙二醇 (5)O烯丙基丙烯基醚(6)OCH 2CH3苯乙醚(7)S二苯硫醚(8)OCH3(E )7—甲基—6—乙基—5—甲氧基—2—辛烯2、写出下列化合物的结构:(1)异戊醇O H(2)异丁基叔丁基醚O(3)二氧六环 O O(4)DMSOC H 3SC H 3O(5)THFO(6)环氧丙烷 O3、按沸点从高到低顺序排列下列化合物:(1)正丁醇(2)正戊醇(3)异丁醇(4)叔丁醇(5)四氢呋喃 (2)﹥(1)﹥(3)﹥(4)﹥(5) 4、用化学方法区别下列各组化合物: (1)正丁醇、仲丁醇、叔丁醇取三支试管分别加入三种化合物少许,分别加入几滴Lucas 试剂,立即变浑浊的是叔丁醇,放置片刻变浑浊的是仲丁醇,室温下无变化,加热后变浑浊的是正丁醇。
(2)1,4—丁二醇、1,2—丁二醇取两支试管分别加入硫酸铜溶液少许,滴加氢氧化钠溶液至有氢氧化铜沉淀生成,一只试管中加1,4—丁二醇,另一只试管中加1,2—丁二醇,能生成将蓝色溶液的是1,2—丁二醇,则另一个是1,4—丁二醇 (3)苄醇和苄基溴高锰酸钾酸性溶液,步骤略 (4)O(CH2CH 2OH)2C H 2C H O HO HC H 3同(2)5(1)CH 2CH 3CH3O H H SOCC HC H 3C H(2)H 3CH2(3)(CH 3)3CCH 2OH+B r H H 3C C H 2C H 3B rC H(4)+OIH O H+CH 3I (Imol)(5)+IH +CH 3I OCH3O H(6)O33(7)O3+OO H(8)O HC C C H 3PhPh O HPh H 2SO4PhC C C H Ph O(9)O HO(CrO 3 /(C 5H 5N)2)或(CrO 3 /H 2SO 4/H 2O)或(MnO2/C 5H 12)6、将下列化合物按水溶解度由大到小排列成序:(1)丙三醇 (2)正丁醇 (3)甲乙醚 (4)甲硫醚 (1)﹥(2)﹥ (3)﹥ (4) 7、解释下列现象: (1)CH 2OHH 2SO4++(2)(CH 3)3C C H O HC H 334(CH 3)3C C HC H 2+(CH 3)2CH CC H 2C H 3+(CH 3)2C=C(CH 3)2(3)CH2OH24175℃(4)O HO HC H3C H3H2SO4OC H3C H3解释:(1)CH2OHH2SO4+C H2O+HH-H2OCH2+重排+++-H++(2)+(CH3)3C C HO HC H385%H3PO4(CH3)2CH C C H2C H3(CH3)2C=C(CH3)2(CH3)3C C HO+C H3H H-H2O(CH3)3C C H+C H3重排C H3C+C HC H3C H3C H3-H+(CH3)3C C H C H2-H+(3)+CH 2OHH 2SO4175℃CH 2O +H 2-H 2OCH2+-H +(4)+O H O HC H 3C H3H 2SO4OC H 3O H OH2+C H 3C H 3-H OO HC H 3C H 3重排3O +C H 3C H H-H +8、写出环氧丙烷与下列试剂反应的主要产物:(1)无水HBr (2)(CH 3CH 2)2NH (3)CH 3CH 2ONa/CH 3CH 2OH (4)CH 3CH 2MgBr (5)CH 3CH 2OH/H + (6)PhOH/OH -O(CH CH )NH3CH 2ONa/CH 3CH 2OHCH 3CH 2MgBrCH 3C H 3C B r C H 3O HC H 3COCH 2CH3C H 3O HC H 3C HC H 2O HC H 3C HC H 2OMgBrC H 2C H 3C H 3C HC H 2O HN(CH2CH 3)2C H 3C HC H 2O HOCH 2CH39、用指定原料合成:(1)由叔丁醇和乙醇合成乙基叔丁基醚C H 3C H 2O H H 3C H 2IC H 3CO HC H 3C H 3NaC H 3CO C H 3C H 3NaC H 3CO C H 3C H 3Na +C H 3C H 2IC H C H O HH 3COC H 3C H 3C 2H 5(2)由正丙醇和异丙醇合成2—甲基—2—戊醇C H 2C H 2O HC H 3C H 3C H O HC H 34C H 3C C H 3O+C H 2C H 2B C H 3Mg无水醚C H 2C H 2MgBrC H 3C H 3C C H 3O C H 2C H 2MgBrC H 3C H 3CC H 2C H 3C H 2C H 3OMgBr2C H 3C C H 2C H 3C H 2C H 3O H(3)由溴苯和异丙醇合成2—苯基—2—丙醇C H 3C H O HC H 34C H 3C C H 3O+Mg C H 3C C H 3O C H 3CC H 3OMgBr 2B rTHFMgBrMgBrC H 3CC H 3O H(4)由环己醇合成二环己醚+O HB rH B rO NaO N aB rO N aHO10、用高碘酸分别氧化四个邻二醇,得到的氧化产物如下: (1)只得到C H 3C C H 2C H 3O(2)得到CH3CHO 和CH3CH2CHO (3)得到HCHO 和C H 3C C H 3O(4)得到一个二羰基化合物C H 3C C H 2OC H 2C H 2CHO请根据氧化产物分别写出四个邻二醇的结构式。
第五章第2节高分子材料第2课时 课件 2021-2022学年高二化学人教版(2019)选择性必修3

B.CH2==CH—COOH
C.CH3—CH(OH)—COOH D.H2N—CH2—COOH
随堂巩固
3.X是一种性能优异的高分子材料,其结构简式为
,
已被广泛应用于声、热、光的传感等方面,它是由HC≡CH、(CN)2、CH3COOH三种 单体通过适宜的反应形成的。由X的结构简式分析合成过程中发生反应的类型有
很难溶解,但往往有一定程 度的胀大
性能
具有热塑性,无固定熔点
具有热固性,受热不熔化
强度大、绝缘性好、有可塑 特性 强度大、可拉丝、吹薄膜、绝缘性好
性
常见 物质
聚乙烯、聚氯乙烯、天然橡胶
酚醛树脂、硫化橡胶
小结
随堂巩固
1.手术缝合线、人造器官等人体用的功能高分子要求无毒且与人体有较好的相容性。
根据有关化合物的性质及生物学知识可知,下列高分子不宜用作手术缝合线或人造
②合成新的带有强亲水基团的高分子。
如CH2==CH—COONa —一交—定联—条—剂件→
聚丙烯酸钠(网状结构)
学习任务三:高吸水性树脂
3.性能: 不溶于水,也不溶于有机溶剂,与水接触后在很短的 时间内溶胀,可吸收其本身质量的数百倍甚至上千倍 的水,同时保水能力要强,还能耐一定的挤压作用。
《时代周刊》评出20世纪最伟 大的100项发明,其中“尿不 湿”榜上有名
器官材料的是 A.聚乳酸
B.聚氨酯
C
C.氯纶
D.聚乙烯醇
随堂巩固
2.用高分子塑料骨钉取代钛合金骨钉是医学上的一项新技术,这种塑料骨钉不仅具
有相当的强度,而且可在人体内水解,使骨科病人免遭拔钉的痛苦。合成这种塑料
骨钉的原料能与强碱溶液反应,也能在浓硫酸条件下形成环酯。则合成这种塑料骨
第5章-过渡金属有机化学基础

配体 CO 用碳原子的一个 σ 轨道同过渡金属未 填充电子的空d轨道发生重叠,电子由碳原子流向 过渡金属,形成σ配位键,又称σ给予键 过渡金属填充电子的d轨道与CO的2π*反键轨 道重叠形成 π 反馈键,电子从过渡金属流向 CO, 形成π反馈键,又称π接受键
金属有机化学
这种 σ 给予与 π 接受的作用是协同的。当碳原 子向过渡金属供给电子时,CO上的电子云相对密 度降低,并有利于通过反馈键从过渡金属获得电 子。 这样的结果导致CO中的碳氧叁键被削弱,接 近于双键性质;而过渡金属与碳之间的键加强, 也接近于双键。 从羰基的红外光谱和原子间的键长数据验证 了这些结果 。
非过渡金属有机化合物和过渡金属有机配合 物的合成方法有许多相似的地方,如用非过渡金 属有机化合物对过渡金属盐的烃基化,可引入 M—C σ键配位的配体 利用氧化加成反应引入 M-Cσ 键或 M-Cπ 键的 配体只在合成过渡金属有机配合物中才有
金属有机化学
5.3.1 钯有机配合物 1.合成钯有机配合物的初始原料 Pd(MeCN2)C12 、 Pd(PhCN)2C12 、 Pd(OAc)2 等是合成钯有机配合物的重要原料 氯化钯是合成钯配合物常用的初始原料,但 它在大多数有机溶剂中的溶解度很小,不便使用。
金属有机化学
就是将氯化钯转变成一个既能溶入有机溶剂,配 位的乙腈或苯甲腈又容易解离的过渡性钯配合物, 便于随后的反应 将氯化钯和过量氯化钙溶入甲醇中加入烯丙 基 氯 , 通 入 CO 能 得 到 烯 丙 基 钯 配 合 物 (C3H5)2Pd2Cl2
金属有机化学
2.用配体置换反应合成二价钯有机配合物 配体置换反应是合成过渡金属有机配合物的 重要方法之一 如Pd(acac)2就可以用Li2PdCl4和乙酰丙酮,在氢氧 化钠水溶液中,通过配体置换制备
第5章 过渡金属有机化学基础

R CC )R (IV
SO2 OC L Ir L Cl
R
L CO Cl Ir CO L
L Ir L Cl CO
图 5-5 Vaska配合物的氧化加成反应
• C-O键与过渡金属有机配合物的氧化加成反应
Ni(cod)2 + OAc C3H5)NiOAc C3H5)2Ni + Ni(OAc)2
• 还原消除反应 还原消除反应是氧化加成的逆反应。发生还 原消除反应时,配合物的氧化态及有效原子序 数均下降 "2",形成A-B型的消除产物。
• 还原消除经过一个非极性、非自由基的三中心过 渡态 。
图5-8 还原消除的三中心过渡态
由于还原消除反应按三中心过渡态机理 进行,发生消除反应的两个配体在过渡金 属有机配合物中必须处在顺位。
Ph2 P Me Pd P Me Ph2 DMSO, 80oC Me-Me
DMSO, 80oC NR Me Ph2P Pd P Ph2 Me
• 在反应过程中加入吸引电子的配体,如顺 丁烯二酸酐,丙烯腈等可加速还原消除反 应。
CN N Ni N Me N Me CN N Ni Me N Me CN CN N Ni CN + Me-Me
表5-3 有效原子序数的计算方法
• 5.3 过渡金属有机配合物的合成 • 5.4 过渡金属有机配合物的化学性质
(1),配体置换反应。(配位体的配位与解离) (2),氧化加成和还原消除反应。 (3),插入反应和消除(反插入)反应。 (4),过渡金属有机配合物配体上的反应。
• 5.4.1过渡金属有机配合物的配体置换反应 配位饱和的过渡金属有机配合物的配体 置换是它们的重要化学性质,也是它们实 现催化作用的首要条件。原有配体被另一 个配体---反应底物置换,使底物进入配位 圈,改变了底物的化学键状态而得到活化, 并接着在配位圈内发生反应。 这是配位催化中第一种反应底物进入配 位圈的途径。
金属有机化学:第五章 膦配体 (2)

金属中心反馈p键向P-C的 s*轨道填充电子,削弱P-C 键,使P-C键变长
注意:同时存在缩短P-C键 长的反效应,P给出孤对电 子到金属,导致P原子周围 孤对与键对电子的排斥作用 减弱,缩短P-C键
• 膦配体的电子性质可以在很大的范围内调节(从“强s电子给 体/弱p电子受体”到“弱s电子给体/强p电子受体”)
128
PBr3
131
PEt3, PPr3, PBu3
PPh2(OMe)
132
PEt2Ph, PMePh2
136
Cy2PCH2CH2PCy2
142
PPh3
145
PPh2(t-Bu)
157
PPh2(C6F5)
158
P(i-Pr)3
160
PBz3
165
PCy3
PPh(t-Bu)2
170
P(O-t-Bu)3
87
PPhH2
P(OCH2)3CR
101
PF3
104
Me2PCH2CH2PMe2
P(OMe)3
107
P(OEt)3
109
P(CH2O)3CR
114
Hale Waihona Puke Et2PCH2CH2PEt2
115
PMe3
118
Ph2PCH2PPh2
121
PMe2CF3
PCl3
124
Ph2PCH2CH2PPh2
125
PPh2H
P(OPh)3
P(C6F5)3
P(O-i-Pr)3 P(OEt)3
P(OMe)3
PPh2Cl PMe2CF3 P(O-2,4-Me-C6H3)3 P(OPh)3 P(OCH2)3CR
金属有机化学第五章

rate =
-d[MeMn(CO)5] dt
k1k2[L][MeMn(CO)5] k2[L]
k1[MeMn(CO)5]
First order reaction
ii. If k-1 is large relative to k2[L], then the equation becomes:
rate =
C MAB
1,1 insertion
C +L
MA
elimination
-L
B
L C
MA
B
C
C
A 1,2 insertion M
A +L
B elimination M B
-L
LC
A MB
General Features: • There is no change in the formal oxidation state of the metal unless AB is an alkylidene or alkylidyne. • The groups undergoing migratory insertion must be cis to one another. In complexes where the cis coordination sites are blocked by strongly coordinated ligands, insertion or elimination processes are not possible. • An open coordination site is created during migratory insertion. Therefore, for the reverse reaction--elimination--to occur, an open coordination site must be generated by ligand dissociation.
有机化学第五章习题答案

c.α,β-二溴代丁酸d. 2-甲基-2-丁烯酸
答案:
5.6下列化合物中哪个有旋光活性?如有,指出旋光方向
A没有手性碳原子,故无
B(+)表示分子有左旋光性
C两个手性碳原子,内消旋体,整个分子就不具有旋光活性了
5.7分子式是C5H10O2的酸,有旋光性,写出它的一对对映体的投影式,并用R,S标记法命名。
f.相同g.顺反异构h.相同
5.11如果将如(I)的乳酸的一个投影式离开纸面转过来,或在纸面上旋转900,按照书写投影式规定的原则,它们应代表什么样的分子模型?与(I)是什么关系?
答案:
5.12丙氨酸的结构
5.13
可待因是镇咳药物,四个手性碳,24个旋光异构体。
5.14下列结构是中哪个是内消旋体?
答案:a和d
答案:
5.8分子式为C6H12的开链烃A,有旋光性。经催化氢化生成无旋光性的B,分子式为C6H14。写出A,B的结构式。
答案:
5.9(+)-麻黄碱的构型如下:
它可以用下列哪个投影式表示?
答案:b
5.10指出下列各对化合物间的相互关系(属于哪种异构体,或是相同分子)。
答案:
a.对映体b.相同c.非对映异构体d.非对映异构体e.构造异构体
旋光异构
5.1(略)
5.2(略)
5.3(略)
5.4下列化合物中哪个有旋光异构体?如有手性碳,用星号标出。指出可能有的旋光异构体的数目。
ቤተ መጻሕፍቲ ባይዱ答案:
新版本增加两个K(无) 和L (2个)
5.5下列化合物中,哪个有旋光异构?标出手性碳,写出可能有的旋光异构体的投影式,用R,S标记法命名,并注明内消旋体或外消旋体。
有机化学课后习题答案第五章

有机化学课后习题答案第五章5章思考题5.1 不饱和卤代烃根据卤原子与不饱和键的相对位置可以分为三类:丙烯基卤代烃,如CH3CH=CHX;烯丙基卤代烃,如CH2=CH-CH2X;孤立式卤代烃,如CH2=CHCH2CH2X。
5.2 S N 2和S N 1历程的区别是:S N 2反应是一步反应,攻击剂和离去基同时发生,而S N 1反应是两步反应,先发生离去基的离去,然后攻击剂才进攻。
5.3 溶剂化效应是指在溶剂中,分子或离子都可以通过静电力与溶剂分子相互作用的现象。
5.4 温度对消除反应的影响是:增加温度可以提高消除反应的比例。
5.5 卤代芳烃在结构上的特点是:卤素连在sp2杂化的碳原子上,卤原子中具有弧电子对的p轨道与苯环的π轨道形成p-π共轭体系,使得卤代芳烃的碳卤键与卤代脂环烃比较明显缩短。
5.6 对二卤代苯比相应的邻或间二卤代苯具有较高的熔点和较低的溶解度的原因是:对二卤代苯的对称性好,分子排列紧密,分子间作用力较大,故熔点较大。
由于对二卤代苯的偶极矩为零,为非极性分子,在极性分子水中的溶解度更低。
5.7 芳卤中最能使苯环电子离域的卤原子是氟原子,因为氟原子电负性最高,能够更强烈地吸引苯环上的电子。
题5.1 化合物命名:1)3-溴-1-丙烯(2)苄基氯(3)4-甲基-5-溴-2-戊炔(4)2,2-二氟-1-丙醇(5)CF2Cl2(6)三碘甲烷(7)溴代环戊烷(8)2-氯-1-苯乙烷(9)1,1-二氯-3-溴-7-乙基-2,4-壬二烯(10)1,3-二溴苯甲烷(11)(1R,2S,3S)-1-甲基-3-氟-2-氯环己烷(12)(2S,3S)-2-氯-3-溴丁烷5.2 化合物构造式:1)CH2=CHCH2Br(2)C6H5CH2Cl(3)CH3C≡XXX(CH3)2Br(4)CH3CHBrCF2(5)CHCl2F(6)CHI3(7)C5H9Br(8)C6H5CH2CH2Cl(9)Cl2BrC10H18(10)C6H4BrCH2Br(11)CHClFCH2CHClCH3(12)CH3CHBrCH2CH2Cl5.3 反应式补全:1)XXX(水)→ XXX2)CH3CH2Br + KOH(醇)→ CH3CH2OH + KBr3)CH3CH2Br + Mg(乙醚)→ CH3CH2MgBr;CH3CH2MgBr + HC≡CH → CH3CH2CH2C≡CH4)CH3CH2Br + NaI/丙酮→ CH3CH2I + NaBr5)CH3CH2Br + NH3 → CH3CH2NH2 + HBr6)CH3CH2Br + NaCN → XXX NaBr7)CH3CH2Br + CH3C≡CNa → CH3CH2C≡CCH3 + NaBr 8)CH3CH2Br + AgNO3(醇)→ CH3CH2NO2 + AgBr9)CH3CH2Br + Na → CH3CH2Na + Br10)CH3CH2Br + HN(CH3)2 → CH3CH2NH(CH3)2 + HBr5.4 CH3CH2CH2Br与下列化合物反应的主要产物:1)KOH(水)→ CH3CH2OH2)KOH(醇)→ CH3CH2OH3)(A)Mg,乙醚;(B) (A)的产物+HC≡CH →CH3CH2CH2C≡CH4)NaI/丙酮→ CH3CH2I5)NH3 → CH3CH2NH26)NaCN → CH3CH2CN7)CH3C≡CNa → CH3CH2C≡CCH38)AgNO3(醇) → CH3CH2NO29)Na → CH3CH2Na10)HN(CH3)2 → CH3CH2NH(CH3)25.5 化学方法区别各组化合物:1)苯酚和苯甲醛:用FeCl3试剂检验,苯酚会出现紫色沉淀,而苯甲醛不会;2)苯胺和苯甲酰胺:用FeCl3试剂检验,苯胺会出现绿色沉淀,而苯甲酰胺不会;3)苯甲酸和苯甲酐:用NaHCO3试剂检验,苯甲酸会产生CO2气体,而苯甲酐不会产生;4)苯乙酮和苯乙烯:用Baeyer试剂检验,苯乙酮会产生深蓝色沉淀,而苯乙烯不会;5)苯酚和苯醇:用FeCl3试剂检验,苯酚会出现紫色沉淀,而苯醇不会。
有机化学课后习题及答案(第五章)

5章思考题5.1 在不饱和卤代烃中,根据卤原子与不饱和键的相对位置,可以分为哪几类,请举例说明。
5.2 试比较S N2和S N1历程的区别。
5.3 什么叫溶剂化效应?5.4 说明温度对消除反应有何影响?5.5 卤代芳烃在结构上有何特点?5.6 为什么对二卤代苯比相应的邻或间二卤代苯具有较高的熔点和较低的溶解度?5.7 芳卤中哪种卤原子最能使苯环电子离域,为什么?解答5.1 答:可分为三类:(1)丙烯基卤代烃,如CH3CH=CHX(2)烯丙基卤代烃,如CH2=CH-CH2X(3)孤立式卤代烃,如CH2=CHCH2CH2X5.2 答:(略)5.3 答:在溶剂中,分子或离子都可以通过静电力与溶剂分子相互作用,称为溶剂化效应。
5.4 答:增加温度可提高消除反应的比例。
5.5 答:在卤代芳烃分子中,卤素连在sp2杂化的碳原子上。
卤原子中具有弧电子对的p轨道与苯环的π轨道形成p-π共轭体系。
由于这种共轭作用,使得卤代芳烃的碳卤键与卤代脂环烃比较,明显缩短。
5.6 答:对二卤代苯的对称性好,分子排列紧密,分子间作用力较大,故熔点较大。
由于对二卤代苯的偶极矩为零,为非极性分子,在极性分子水中的溶解度更低。
5.7 答:(略)习题5.15.1命名下列化合物。
5.25.2写出下列化合物的构造式。
(1)烯丙基溴(2)苄氯(3)4-甲基-5-溴-2-戊炔(4)偏二氟乙浠(5)二氟二氯甲烷(6)碘仿(7)一溴环戊烷(环戊基溴) (8)1-苯基-2-氯乙烷(9)1,1-二氯-3-溴-7-乙基-2,4-壬二烯(10)对溴苯基溴甲烷(11)(1R,2S,3S)-1-甲基-3-氟-2-氯环己烷(12)(2S,3S)-2-氯-3-溴丁烷5.3 完成下列反应式。
5.4用方程式表示CH3CH2CH2Br与下列化合物反应的主要产物。
(1)KOH(水)(2)KOH(醇)(3)(A)Mg ,乙醚;(B) (A)的产物+HC≡CH (4)NaI/丙酮(5)NH3 (6)NaCN (7)CH3C≡CNa(8)AgNO3(醇) (9) Na (10) HN(CH3)25.5用化学方法区别下列各组化合物。
有机化学05章脂环烃

1 3 2 5 6 4
4 2 3
6
5
椅型构象
船型构象
1. 椅型构象
直立键——与对称轴平行 的键,或叫做a键。
6个(3上、3下)
平 伏 键 —— 与 对 称 轴 成 109.5o 倾 斜 角 的 键 , 或 叫 做e键。
6个(3上、3下)
1. 椅型构象
H H H 2 3 H H 4 H H 6 5 H 1 H H
力大,非键合原子张力也较大, 故船型构象不稳定。
6
5
椅型和船型环己烷构象中氢原子间的斥力比较
椅型环己烷 C1 上的 H 原子与最 近的 H 原子距离为 0.25 nm , 斥力较小 。
船型环己烷 C1 上的 H 原子与最 近的 H 原子距离为 0.23 nm , 斥力较大。
3. 构象的互变
由于 C—C 键的旋转, 环己烷构象之间可以相 互转化的,这种构象的
3.2. 环丁烷和环戊烷的结构
3.2.1. 环丁烷的结构
环丁烷的四个碳原子实际上不在一个平面上。分子通过C-C键 的扭转而以折叠的碳环形式存在。三个碳处于同一平面,另一 个处于该平面外。这样可减少C-H键的重叠,从而使环张力 相应降低。
环丁烷的构象——蝴蝶型 尽管环丁烷的折叠式构象较平面构象能量有所降低,但环张力 还很大,故也不稳定。
7 1 6 5 4 3 2
9 8 6 7 1 2 5 4 3
1,6-二甲基二环[2.2.1]-2-庚烯
1,9,9-三甲基二环[3.2.2]-6-壬烯
5-甲基二环[2.2.1]-2-庚烯 三环[2.2.1.02,6]庚烷 三环[7.4.1.05,14]-3-十四碳烯
X
三环[8.3.1.05,14]-2-十四碳烯
第五章_金属有机化学-2

5.6 过渡金属有机化合物的基元反应
过渡金属有机化合物的化学性质非常复杂,但随着 人们认识的不断深化,已将众多的过渡金属有机配合物 的化学性质归纳为若干基元反应,它们也构成了配位催 化反应机理的基本框架。按照它们反应的类别,可以分 为若干个基元反应。
30
过渡金属有机化合物的基元反应
25
b) 金属相同 1. R(Et)-M < Me-M < Ph-M < CF3-M
2. 烷 基 - 金 属 配 合 物 中 , 不 同 烷 基 其 稳 定 性 不 同 : 伯碳> 仲碳> 叔碳;
3. 对称性好的金属有机化合物稳定性大于对称性差的金属 有机化合物。 4. 金 属 - 碳 键 中 碳 的 电 负 性 越 强 , 如 杂 化 轨 道 中 S 成 分 越 多 或 碳 上 连 有 提 高 碳 的 电 负 性 的 基 团 , M-C 键 的 稳定性就增加。
烯烃或炔烃可以通过插入金属与氢或金属与碳之间 的键中或取代某个配体而生成新的配位化合物。这是制
备金属-烷基化合物的重要方法之一。
(多两个碳原子)
M-X
+ C
C
M
C
C
X
X通常是H或烷基; M可以是所有的金属,特别是硼、铝、硅和过渡金属。
12
工业上制备烷基铝的主要方法:
Al + 3/2H2 + 3C2H4 Et3Al
N2 Cl
+
-
HgCl HgCl2
Cu
+
COCl
COMn(CO)5 NaMn(CO) 5
- CO
Mn(CO)5
+
20
6. 碳环键合
绝大多数四碳键合的配位体是用四碳键配位体如丁 二烯、 1,3- 环己二烯等与金属有机化合物直接反应,取
有机化学第五章习题

有机化学第五章习题 P109习题1.命名下列化合物:(1) ;(2) ;(3) ;(4);(5);(6) ;(7) 。
解:(1) 1-甲基-3-异丙基环己烯;(2) 对甲苯乙烯;(3) 1,2-二甲基-4-乙基环戊烷;(4) 3,7,7-三甲基双环[4.1.0]庚烷;(5) 1,3,5-环庚三烯;(6) 5-甲基双环[2.2.2]-2-辛烯; (7) 螺[2.5]-4-辛烯。
2.写出下列化合物的结构式。
(1) 1,1-二甲基环庚烷; (2) 2,3-二甲基环戊烯;(3) 1-环己烯基环己烯; (4) 3-甲基-1,4-环己二烯; (5) 双环[4.4.0]癸烷;(6) 双环[3.2.1]辛烷; (7) 螺[4.5]-6-癸烯。
解:(1) ;(2) ;(3) ;(4) ;(5) ;(6) ;(7) ;3.写出C 5H 10的环烷烃的构造式和顺反异构体的结构式,并命名它们。
解:乙基环丙烷 1,1-二甲基环丙烷 反-1,2-二甲基环丙烷 顺-1,2-二甲基环丙烷 甲基环丁烷 环戊烷4.下列化合物有无顺反异构体?若有,写出它们的立体结构式。
(1) ;(2) ;(3) ;(4) ;(5) ;(6) ;CH 3CHCH 3CH 3CH CH 2CH3CH 3CH 3CH 2CH 3CH 333CH3CH 3CH 3CH 3CH 3CHCH 3CH=C(CH 3)2Cl CH=CHCH 3ClClClC=CHCH 3HC=CH CH 3HC=CHH CH 3C=CHH CH 3解:(1)、(2)和(3)无顺反异构体;(4)(5)(6)5.写出下列化合物最稳定的构象的透视式。
(1)异丙基环己烷;(2)顺-1-甲基-2-异丙基环己烷;(3)反-1-甲基-2-异丙基环己烷;(4) 反-1-乙基-3-叔丁基环己烷;(5)解:(CH3)2CHCH3(2)(CH3)2CH(1)(CH3)2CHCH3(3)C(CH3)3C2H5(4)(CH3)3CCH3CH3(5)6.完成下列反应式。
有机化学第五章旋光异构

OH C CO2 H HO2 C CH3 镜象 CH3
OH C H 实物
03:03
13
二、 分子的手性和旋光性
手性分子:物质的分子和它的镜象不能重叠,这种分子叫手性分子。 一般说来 具有手性的分子都有旋光性;
从分子的内部结构来说,手性与分子的对称性有关。
对称性
{
对称面 对称轴
对称中心
若一个分子中没有上述任何一种 对称因素,这种分子就叫不对称 分子,不对称分子就有手性
-OH经-CH3至-H的排列顺序
03:03
A 逆时针方向
B
顺时针方向
19
A、B两分子不能重叠,是实物和镜象的关系
COOH H OH CH3 镜
COOH HO CH3 H
(A)
(B)
若将A中的任意两个基团对调,就是B……,所以含有一个手性 碳原子的化合物,只能有两种构型,也就是只能有两个具旋光 活性的异构体。
COOH COOH
OH H CH3 H
OH CH3
03:03
29
2、透视式
COOH HO C H CH3 H COOH C CH3 OH
3、费歇尔投影式
横向基团位于平面的前方
COOH H CH3 H
COOH OH CH3
30
竖向基团位于平面的后方 HO
03:03
COOH OH H CH3
光照
费歇尔投影式
碳干异构 构造异构 位置异构 官能团异构 同分异构 立体异构 互变异构 构型异构 构象异构 对映异构
03:03 2
顺反异构
偏振光和旋光活性
普通光是由各种波长的在垂直于前进方向的各个平面内振动的光波 所组成
03:03 3
有机化学课后习题及答案(第五章)

5章思考题5.1 在不饱和卤代烃中,根据卤原子与不饱和键的相对位置,可以分为哪几类,请举例说明。
5.2 试比较S N2和S N1历程的区别。
5.3 什么叫溶剂化效应?5.4 说明温度对消除反应有何影响?5.5 卤代芳烃在结构上有何特点?5.6 为什么对二卤代苯比相应的邻或间二卤代苯具有较高的熔点和较低的溶解度?5.7 芳卤中哪种卤原子最能使苯环电子离域,为什么?解答5.1 答:可分为三类:(1)丙烯基卤代烃,如CH3CH=CHX(2)烯丙基卤代烃,如CH2=CH-CH2X(3)孤立式卤代烃,如CH2=CHCH2CH2X5.2 答:(略)5.3 答:在溶剂中,分子或离子都可以通过静电力与溶剂分子相互作用,称为溶剂化效应。
5.4 答:增加温度可提高消除反应的比例。
5.5 答:在卤代芳烃分子中,卤素连在sp2杂化的碳原子上。
卤原子中具有弧电子对的p轨道与苯环的π轨道形成p-π共轭体系。
由于这种共轭作用,使得卤代芳烃的碳卤键与卤代脂环烃比较,明显缩短。
5.6 答:对二卤代苯的对称性好,分子排列紧密,分子间作用力较大,故熔点较大。
由于对二卤代苯的偶极矩为零,为非极性分子,在极性分子水中的溶解度更低。
5.7 答:(略)习题5.15.1命名下列化合物。
5.25.2写出下列化合物的构造式。
(1)烯丙基溴(2)苄氯(3)4-甲基-5-溴-2-戊炔(4)偏二氟乙浠(5)二氟二氯甲烷(6)碘仿(7)一溴环戊烷(环戊基溴) (8)1-苯基-2-氯乙烷(9)1,1-二氯-3-溴-7-乙基-2,4-壬二烯(10)对溴苯基溴甲烷(11)(1R,2S,3S)-1-甲基-3-氟-2-氯环己烷(12)(2S,3S)-2-氯-3-溴丁烷5.3 完成下列反应式。
5.4用方程式表示CH3CH2CH2Br与下列化合物反应的主要产物。
(1)KOH(水)(2)KOH(醇)(3)(A)Mg ,乙醚;(B) (A)的产物+HC≡CH (4)NaI/丙酮(5)NH3 (6)NaCN (7)CH3C≡CNa(8)AgNO3(醇) (9) Na (10) HN(CH3)25.5用化学方法区别下列各组化合物。
金属有机化学教案4
Li[AuR2]也不稳定。然而,如果把Li+转化为络合离子如 Li(PMDT)+, 则稳定性大大增加。 [Li(PMDT)]+[AuMe2]− 加热到120°C才分解。 =
Me2N N Me NMe2
PMDT
中 国 科 学 技 术 大 学
[AuMe2]−具有线型几何结构。
Cp化合 物: 卡宾插入: Ylid 络合物:
σ-donor配体较易对R2Zn配位
中 国 科 学 技 术 大 学
RZnX的结构型式:
CpZnMe
气态结构
固体结构
中 国 科 学 技 术 大 学
Cp*2Zn
气态结构 Cp2Zn在固态是多聚结构。 R2Zn的化学反应性与RLi或有机镁相似,但更温和。 Reformatsky反应
中 国 科 学 技 术 大 学
reformatsky反应中国科学技术大学iznch2i在合成中的应用中国科学技术大学二有机cd化合物制备和反应有机镉化合物的结构和反应性类似于它的锌类似物
第五章 有机Zn、Cd、Hg化合物
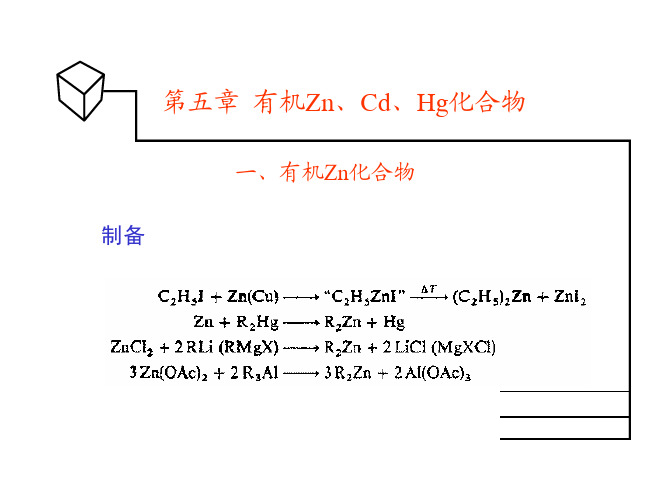
一、有机Zn化合物 制备
结构和性质 与R2Be及R2Mg不同,R2Zn (R = 烷基或芳基)是monomeric,分 子呈线型,具有低的熔点或沸点。很少形成烷基桥联的2e3c键,但 H桥联的2e3c键较为多见。
炔银
中 国 科 学 技 术 大 学
部分有机铜和有机银化合物的性质
结 构
中 国 科 学 技 术 大 学
(CuCH2SiMe3)4 (PhCu)n
中 国 科 学 技 术 大 学
(2-MeC6H4Cu)4。1H NMR研究表 明芳环有旋转位阻
有机Cu化合物在有机合成中的应用
中 国 科 学 技 术 大 学
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+ Mn(CO)6 +
Fe(CO)5
(C6H8)2Mn(CO)2+ 4 CO Fe(CO)3 + 2 CO
五元环的配体配合物常用环戊二烯钠和金属卤化 物反应制得。
2C5H6 + 2Na 2 NaC5H5 + H2
NiCl2 THF
[ (n5-C5H5)2Ni + NaCl
有时也可用环戊二烯和有机金属配合物作用,取代 掉两个其它的中性配体,然后再从环上脱去一个质子 得到环戊二烯键合的金属有机化合物。
b) 金属相同 1. R(Et)-M < Me-M < Ph-M < CF3-M 2. 烷 基 - 金 属 配 合 物 中 , 不 同 烷 基 其 稳 定 性 不 同 : 伯碳> 仲碳> 叔碳; 3. 对称性好的金属有机化合物稳定性大于对称性差的金属 有机化合物。 4. 金 属 - 碳 键 中 碳 的 电 负 性 越 强 , 如 杂 化 轨 道 中 S 成 分 越 多 或 碳 上 连 有 提 高 碳 的 电 负 性 的 基 团 , M-C 键 的 稳定性就增加。
同位素示踪表明反应可能有两种途径:a. 原来分子的羰 基插入Mn-CH3键机理;b. 甲基转移机理。研究表明:实际 的机理是甲基转移。 反应动力学指出反应的第一阶段包括甲基转移得到5-配 位的酰基络合物,然后受到进入的一氧化碳(或其他配位体) 的攻击得到最后的6-配位体产物。
(CH3)Mn(CO)5 (CH3CO)Mn(CO)4 CO (CH3CO)Mn(CO)5
HgEt2 + 2Li
△Hf (KJ/mol) +27.0 0
Hg + 2LiEt
0 -58.5
△Hf = -144 KJ/mol
这是第一个由于金属有机化合物本身的形成提供 反应推动力的例子。
R2Zn + 2Li R2Hg + 2Na 2C2H5Li + (CH3)2Hg
2RLi + Zn 2RNa + Hg (C2H5)2Hg + 2CH3Li
对于重主族元素(M = Tl, Pb, Bi, Hg),由于这些元 素的M-C键很弱,上述反应比较困难。但可以通过加 入电正性很强的金属来促进这个反应的进行。
2. 从金属有机试剂的交换反应制备
CH3Li + CuCl 2CH3Li + (PEt3)2PtBr2 CH3MgBr + (PEt3)2PtBr2 CH3Cu + LiCl (PEt3)2Pt(CH3)2 + 2LiBr (PEt3)2Pt(CH3)Br + MgBr2
反应通常是活泼金属有机试剂与一较为不活泼 的金属卤盐发生交换反应。 。
2LiEt + HgCl2
△Hf (KJ/mol) -58.5 -230.0
HgEt2 + 2LiCl
+27.0 -409.0
△Hf = -444 KJ/mol
可见,电正性较大的金属失去它的烷基而得到卤 素是反应的推动力。
羰基金属阴离子还可以与卤代烷反应生成金属有机 羰基金属阴离子 配合物。
14
CO
加热
加压
(CH3CO)Mn(CO)4(14CO)
(a) (b)
(CH314CO)Mn(CO)5
(CH3)Mn(CO)4(14CO)
+
CO
从反应式a可以看出,不用CO而用其它配位体也可使烷 基锰转化为酰基锰。
(CH3)Mn(CO)5 + L
L= NH3,PR3等
(CH3CO)Mn(CO)4L
b) 二价金属元素 二价金属元素与卤代烃反应可以制备有机金属化合 物。其中Grignard试剂的制备是最为主要的。
Mg + PhBr PhMgBr Grignard试剂 试剂 Zn + EtI EtZnI Hg + CH2 CH CH2I CH2 CH CH2HgI
这些金属没有一价金属活泼,通常需要加热, 反应才能发生。活性 RI > RBr > RCl
金属交换反应在有机合成中非常有用,可以高选择 高选择 性的制备活泼金属有机化合物。因为可以直接从金属本 性的制备活泼金属有机化合物 身制备的金属有机化合物太活泼,反应的选择性差,而 选择性高的金属有机试剂活性低,难以直接从金属制备, 所以只好用间接方法。
3. 烯(炔)烃的插入反应和取代反应
烯烃或炔烃可以通过插入金属与氢或金属与碳之间 的键中或取代某个配体而生成新的配位化合物。这是制 这是制 备金属-烷基化合物的重要方法之一 烷基化合物的重要方法之一。 备金属 烷基化合物的重要方法之一。
例:甲基五羰基锰(I)的羰基化反应
(CH3)Mn(CO)5 + CO 加压 (CH3CO)Mn(CO)5
特点: 1)把标记的CO引入反应,它不是成为酰基,而是顺式接到金 属上形成羰基(反应式a); 2)逆反应中,14C标记的酰基络合物不放出标记的一氧化碳(反 应式b)。
(CH3)Mn(CO)5 +
Na[Mn(CO)5] + CH3I (CH3)Mn(CO)5 + NaI
反应的推动力是生成不溶性的碘化钠。
Na[Mn(CO)5] + ClCH2CH
CH2
(CO)5Mn(CH2CH CH2)
Mn(CO)4
该反应先生成σ-烯丙基配合物,而后失去一分子CO并 重排成π-烯丙基配合物。
金属有机化合物还可以通过金属元素的交换反应制 备,电正性较小的金属烷基化合物和电正性较大的金属 反应时,烷基转移。
2. 反馈键
凡有反馈键形成的金属有机化合物, 凡有反馈键形成的金属有机化合物, 其稳定性相对 较高。 较高。 如果在过渡金属有机化合物中存在反馈键,则反馈 的π键增加了M-C之间键的多重性,提高了M-C之间σ键 的强度,从而提高金属有机化合物的稳定性,例如烯烃、 芳基就比烷基与过渡金属配位形成的化合物要在一定程 度上稳定。
RM + MX
M=Li, Na, K, Cs, X=Cl, Br, I
C2H5Cl (气) + 2Li
LiEt(固)+LiCl(固)
△Hf (KJ/mol)
-105
0
-58
-409
△Hf = -362 KJ/mol
可见,金属和卤代烷直接反应的成功不是取决于金 属-烷基键的生成焓,而是取决于金属-卤化物键的生成 焓:放热的金属 卤化物键的生成有利于反应的右行 放热的金属-卤化物键的生成有利于反应的右行 放热的金属 卤化物键的生成有利于反应的右行。
AlCl3
(C 6H6)Cr(AlCl4) I
除上面这些代表性的方法外,还可以用电解、裂解、重 排、还原、加成等方法得到各类金属有机化合物。
5.5 有机金属化合物稳定性和反应性的影响因素
与其他有机化合物一样,金属有机化合物的稳定性 与反应性,需视具体的反应类型、反应条件以及不同的 溶剂体系等各种因素而定。 金属有机化合物的稳定性越小, 一般规律:金属有机化合物的稳定性越小 , 其反应 金属有机化合物的稳定性越小 性就越大,稳定性越大,其反应性就越小。 性就越大,稳定性越大,其反应性就越小 金属有机化合物的反应性与金属原子的氧化态、 金属有机化合物的反应性与金属原子的氧化态 、 配 位数以及几何构型有密切的关系。 位数以及几何构型有密切的关系。
[ (PEt3)2PtHCl ]
+
C2H4
[ (PEt3)2Pt(C2H5)Cl ]
180℃,1大气压 ℃ 大气压
烯烃插入反应可逆性为烯烃的催化异构化提供基础。 烯烃插入金属-氢键的反应在工业上应用于烯烃催化加氢 反应,烯烃插入金属-碳键的反应在工业上应用于烯烃催 化聚合反应。
烯(炔)烃类金属化合物还可以由烯(炔)烃把 其它配位体取代而制得。
5. 分解反应
酰基、羰基、芳基磺酸基和重氮化合物等都可以发 生分解反应脱去一个小分子得到新的金属有机化合物。
N2 Cl
+
-
HgCl HgCl2
Cu
+
COCl
COMn(CO)5 NaMn(CO)5
-CO
Mn(CO)5
+
6. 碳环键合
绝大多数四碳键合的配位体是用四碳键配位体如丁 二烯、1,3-环己二烯等与金属有机化合物直接反应,取 代原来在金属上的配体如CO而直接生成新的配位化合 物。
H2O
Na2PtCl4
+
CH2=CH2
Na[(C2H4)PtCl3]
+
NaCl
CH2=CH2
+
(n5-C5H5)Mn(CO)3
紫外照射
(n5-C5H5)Mn(CO)2(C2H4) + CO
[Pt(PPh3)4]+Ph来自CPhCH2Cl2 25℃
[(PPh3)2Pt(PhC≡CPh)]
+
2PPh3
4. 小分子的配位反应 除了烯烃外,一些小分子化合物如CO、CO2、N2、 SO2、CS2等也可和金属进行配位。
>120℃ ℃ Al
插入反应与它的逆反应——消除反应 消除反应相互竞争,并 插入反应 消除反应 且在160℃左右时得到平均链长是C14的烷基铝化合物, 经氧化和水解反应得到需要的醇。
烯烃插入过渡金属-氢键反应的最主要特征是它的可 烯烃插入过渡金属 氢键反应的最主要特征是它的可 逆性。 逆性。
环己烷, ℃ 环己烷,95℃,40大气压 大气压
5.4 有机金属化合物的制备
许多金属有机化合物对氧和水是不稳定的。
2 CH3MgI + O2 CH3MgI + H2O 2CH3OMgI CH 4(气) + Mg(OH)I
