“第五届华人药师临床药学专题研讨会”集锦
注射用艾普拉唑钠的回顾性多中心巢式病例对照安全性研究

注射用艾普拉唑钠的回顾性多中心巢式病例对照安全性研究Δ李晋 1, 2*,方壬德 2,宋娟 3,张永州 4,张帆 5,赵群 6,蔡素华 7,张怡 8,胡海棠 3 #a ,邓剑雄 2 #b (1.广州和睦家医院药剂科,广州 510335;2.广东省药理学会,广州 510080;3.丽珠医药集团股份有限公司,广东 珠海 519000;4.河南大学淮河医院药剂科,河南 开封 475000;5.聊城市人民医院药剂科,山东 聊城 252000;6.淄博市中心医院药剂科,山东 淄博 255036;7.广州中医药大学金沙洲医院药剂科,广州 510168;8.东莞康华医院药剂科,广东 东莞 523080)中图分类号 R 975;R 969 文献标志码 A 文章编号 1001-0408(2023)11-1379-05DOI 10.6039/j.issn.1001-0408.2023.11.18摘要 目的 了解注射用艾普拉唑钠在临床实际应用中的安全性。
方法 通过中国医院药物警戒系统收集5家三级医院2019年1月1日至2020年2月29日使用注射用艾普拉唑钠的住院患者共3 926例的病历资料,采用回顾性多中心单队列研究对注射用艾普拉唑钠进行上市后安全性分析;同时采用巢式病例对照研究(试验组与对照组按1∶4比例匹配)来证实本研究队列基线的稳定性,以及不良反应与注射用艾普拉唑钠的相关性。
结果 3 926例患者中,3例患者使用注射用艾普拉唑钠后共发生了5次不良事件,不良事件发生率为0.076%,无严重不良事件,发生时间均为用药2 d 后;不良事件以肝功能指标(丙氨酸转氨酶、天冬氨酸转氨酶、总胆红素)升高为主,均为轻度且未处理,所有不良事件转归均为好转。
巢式病例对照研究结果显示,试验组与对照组属于同一背景基线,不良事件的发生与注射用艾普拉唑钠相关性更大。
结论 注射用艾普拉唑钠整体安全性较高,不良事件的发生与其相关性更大。
关键词 注射用艾普拉唑钠;回顾性研究;巢式病例对照;安全性研究;药品不良反应;药品不良事件Retrospective multicenter nested case -control safety study of Ilaprazole sodium for injectionLI Jin 1, 2,FANG Rende 2,SONG Juan 3,ZHANG Yongzhou 4,ZHANG Fan 5,ZHAO Qun 6,CAI Suhua 7,ZHANG Yi 8,HU Haitang 3,DENG Jianxiong 2(1. Dept. of Pharmacy , Guangzhou United Family Hospital , Guangzhou 510335, China ;2. Guangdong Pharmacological Society , Guangzhou 510080, China ;3. Lizhu Pharmaceutical Group Co., Ltd., Guangdong Zhuhai 519000, China ;4. Dept. of Pharmacy , Huaihe Hospital of Henan University , Henan Kaifeng 475000, China ;5. Dept. of Pharmacy , Liaocheng Municipal People ’s Hospital , Shandong Liaocheng 252000, China ;6. Dept. of Pharmacy , Zibo Central Hospital , Shandong Zibo 255036, China ;7. Dept. of Pharmacy , Jinshazhou Hospital of Guangzhou University of Chinese Medicine , Guangzhou 510168, China ; 8. Dept. of Pharmacy , Dongguan Kanghua Hospital , Guangdong Dongguan 523080, China )ABSTRACTOBJECTIVE To understand the safety of Ilaprazole sodium for injection in clinical practice. METHODS From Jan.1st 2019 to Feb. 29th 2020, the data of 3 926 valid hospitalized patients receiving Ilaprazole sodium for injection were collected prospectively from 5 third-level hospitals through CHPS , and the post-marketing safety analysis was performed by using retrospective multicenter single cohort study. At the same time , a nested case-control study (the ratio of trial group and control group was 1∶4) was used to confirm the baseline stability of this study cohort and the correlation between adverse reactions and Ilaprazole sodium for injection. RESULTS Among 3 926 patients , 3 patients experienced 5 adverse drug events after using Ilaprazole sodium for injection , with the incidence of 0.076%. There was no serious adverse event , and the occurrence time was 2 days after medication ; adverse drug events mainly include elevated liver function indicators (alanine transaminase , aspartate transaminase , total bilirubin ), which were mild and untreated , and all adverse drug events were improved. The results of the nested case-control study showed that the trial group and the control group belonged to the same background baseline , and the occurrenceof adverse drug events was more closely related to Ilaprazole sodium for injection. CONCLUSIONS The overall safety of Ilaprazole sodium for injection is relatively high , and the occurrence of adverse events is more related to it.KEYWORDSIlaprazole sodium for injection ; retrospectivestudy ; nested case-control ; safety study ; adverse drug reaction ;adverse drug eventsΔ 基金项目广东省药理学会专项研究基金(No.GDPHARS-X 20210002)*第一作者副主任药师,博士。
3_种常用碳青霉烯类抗生素血药浓度UPLC-MS

3种常用碳青霉烯类抗生素血药浓度UPLC-MS/MS检测方法的建立Δ秦怡1*,张瑞霞2,吕雅瑶2,翁莉莉1,张弋2 #(1.天津医科大学一中心临床学院,天津 300192;2.天津市第一中心医院药学部,天津 300192)中图分类号 R917;R978.1文献标志码 A 文章编号 1001-0408(2024)03-0343-05DOI 10.6039/j.issn.1001-0408.2024.03.14摘要目的建立3种临床常用碳青霉烯类抗生素——厄他培南(ETP)、亚胺培南(IPM)、美罗培南(MEM)血药浓度检测的超高效液相色谱-质谱联用(UPLC-MS/MS)法。
方法血浆样品经甲醇沉淀蛋白后,以3种抗生素的稳定性同位素(ETP-D4、IPM-D4、MEM-D6)为内标,采用ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7μm)色谱柱分离;流动相为98%乙腈+2%水+0.1%甲酸和98%水+2%乙腈+0.1%甲酸,梯度洗脱;流速为0.3 mL/min;柱温为40 ℃;采用正离子、多反应监测模式进行扫描分析。
结果该方法专属性良好,在ETP、IPM、MEM 0.2~200、0.1~100、0.1~100μg/mL范围内线性良好(r2≥0.993),批内、批间精密度和准确度良好(RE均≤5.14%,RSD均≤11.15%),基质效应、提取回收率较一致(RSD≤12.99%)。
结论本实验建立了一种可以同时定量ETP、IPM、MEM血药浓度的UPLC-MS/MS法,该方法样品前处理简单、检测时间短、所需样品量少,可满足临床需求。
关键词碳青霉烯类抗生素;超高效液相色谱-质谱联用;血药浓度;厄他培南;亚胺培南;美罗培南Establishment of UPLC-MS/MS method for the determination of plasma concentration of three common carbapenem antibioticsQIN Yi1,ZHANG Ruixia2,LYU Yayao2,WENG Lili1,ZHANG Yi2(1. First Central Clinical College of Tianjin Medical University,Tianjin 300192,China;2. Dept. of Pharmacy,Tianjin First Central Clinical Hospital,Tianjin 300192, China)ABSTRACT OBJECTIVE To establish a UPLC-MS/MS method for the determination of plasma concentration of three carbapenem antibiotics,i.e. ertapenem (ETP),imipenem (IPM)and meropenem (MEM).METHODS After protein precipitation with methanol,the plasma samples were separated by ACQUITY UPLC BEH C18column (2.1mm×50mm,1.7μm)using stable isotopes of three antibiotics (ETP-D4,IPM-D4,MEM-D6)as the internal standard. The mobile phases were 98%acetonitrile +2% water +0.1%formic acid and 98%water +2%acetonitrile +0.1%formic acid,by gradient elution. The flow rate was 0.3mL/min and the column temperature was 40 ℃. Scanning analysis was performed in the positive ion and multiple reaction monitoring mode. RESULTS The method had good specificity,good linearity (r2≥0.993)in the range of 0.2-200,0.1-100and 0.1-100μg/mL of ETP,IPM and MEM,and good intra-batch and inter-batch precision and accuracy (all RE≤5.14%,all RSD≤11.15%),the matrix effect and extraction recovery were consistent (RSD≤12.99%). CONCLUSIONS This study establishes the UPLC-MS/MS method to simultaneously quantify the plasma concentration of ETP,IPM and MEM. The method has the advantages of simple pretreatment, short detection time and small sample quantity to meet clinical requirement.KEYWORDS carbapenem antibiotics; UPLC-MS/MS; plasma concentration; ertapenem; imipenem; meropenem碳青霉烯类抗生素具有抗菌谱广、抗菌活性强、耐药率低的特点,已成为治疗重症感染的主要选择。
中国药学会2018年学术会议计划

乌鲁木齐
医院药学专业委员会
四川大学华西医院;新疆医科大学第一附属医院
徐珽
第28届中国药学会医院药学学术年会暨第78届FIP卫星会
医院药师
8月
24-26日
1800
太原
医院药学专业委员会
山西医科大学第二附属医院
张毕奎
8
第29届中国药学会儿科药学学术年会暨第10届儿科中青年药师论文报告会
医院药师
9月
12-15日
联系
电话
中国药学会毒性病理专业委员会地区阅片会
食品、药品毒性病理从业人员
3月-12月
50
北京上海成都广州
毒性病理专业委员会
中科院上海药物研究所安评中心;中国食品药品检定研究院安评中心;毒性病理专委会南部地区学组;国家成都新药安全性评价中心
乔俊文
-4080
碳青霉烯类抗生素临床应用、耐药问题与相关新药研发专题研讨会
医疗机构、药品经营企业药学技术人员
11月
1000
中国药学会
学会科技开发中心
刘晓华
2018年太湖马山生命与健康论坛
生物医药研发、监管、临床研究和企业管理人员
4月
20-22日
800
无锡
中国药学会等
江苏省药学会等
孙文虹
第十四届中国药学会青年药学论坛
青年药学科技人员
7月上旬
200
杭州
中国药学会
青年工作委员会
江苏鼎泰药物研究股份有限公司
耿兴超
2018年中国药学会药物分析专业委员会学术年会
高校、研究院所、药检及制药企业科技人员
8月18-20日
500
西安
药物分析专业委员会
中国药学会2011年学术活动计划
田颂九
第六届中日韩三国生药学联合学术研讨会
中药和天然药物等相关领域科技工作者
10月
100
沈阳
中药和天然药物专业委会
沈阳药科大学
杨峻山
第十一届全国中药和天然药物学术研讨会
中药和天然药物等相关领域科技工作者
10月
300
沈阳
中药和天然药物专业委会
沈阳药科大学
杨峻山
抗生素与生物技术药物高峰论坛
从事抗生素、生物技术药物科研、临床、新药开发、药品生产等相关工作者
11月
150
北京
抗生素专业委员会
中国医学科学院医药生物技术研究所
蔡年生
第十届“全国青年药师成材之路论坛”
医院中青年药师
11月
200
北京
医院药学专业委员会
袁锁中
2011年全国药物化学学术研讨会
药物化学相关领域从业人员
11月
300
广州
药物化学专业委员会
中山大学药学院;
暨南大学药学院
陈凯先
第四届创新药物与制药工艺研讨会
王爱国
第一届全国医药产业链低碳技术研讨会
科研院所、大专院校、企业从事新药研发、生产与经营的科技人员等
5月或
6月
100
北京
中国药学会
生化与生物技术药物专业委员会;医药行业生产力促进中心
王福清
第八届全国生化与生物技术药物学术年会
科研院所、大专院校、企业从事新药研发人员等
7月
120
台州
中国药学会
生化与生物技术药物专业委员会;医药行业生产力促进中心
200
内蒙古
阿拉善
中国药学会
北京大学中医药现代研究中心、中药与天然药物专委会
探索临床药学高质量发展之华山路

探索临床药学高质量发展之华山路作者:张晓熙来源:《上海医药》2022年第01期临床药学服务是医疗机构诊疗服务的重要组成部分,是促进临床合理用药、保证用药安全、提高医疗质量的重要环节。
近年来,随着我国新药审评审批加快、国家药品集中采购、医保支付方式改革和医药卫生体制改革等工作的深入,要求药学服务内涵有质的变化,以更好地满足政府部门、医疗机构和患者持续发展的需求,已成为临床药学服务高质量发展亟待解决的问题。
“临床药学是在药师运用临床药学知识和技术,以医生和患者为中心,解决临床实际用药问题的学科。
”复旦大学附属华山医院钟明康主任说。
在20世纪五六十年代,华山医院的汪国芬教授最早提出临床药剂学概念,经过王洪图、张静华和钟明康等三代人的艰辛努力和臨床实践,逐步形成拥有一支国际化人才队伍、实践创新和开放理念的学科团队。
2016年,上海市卫生健康委率先在国内开展临床药学重点专科建设,全面提升临床药学服务能力和专业技术水平,以推动医院药学服务转型发展,华山医院是首批通过验收的“上海市临床药学重点专科”。
以医疗改革和医疗质量为导向,以人才培养和学科建设为目标,以治疗药物监测、药物基因检测、智慧药房、处方集中点评和药品不良反应检测为技术,以人工智能、大数据和临床综合评价为科技支撑,实现治疗药物的精准给药、科学遴选和合理使用,建成智慧药房为标志的新型药品供应模式,推进临床药学学科的持续、健康发展,是建设华山医院临床药学重点专科的宗旨。
具体包括六个重点项目:一是建设规范化“智慧药房”,共享临床药学信息和服务,实现医院药品供应与服务创新;二是应用治疗药物监测技术和个体化给药方案技术,实现精准给药、安全用药的目标;三是开展临床药品综合评价,实现抗菌药物、抗肿瘤药物等药品的评价试点;四是创建临床药学实践和临床药师培养的新模式,加快医院药师转型发展;五是建设医院处方集中点评和评价标准,实现医院处方合理率95%以上的目标;六是建设新型手术室药房,实现麻醉药品应用便捷和安全可控。
26911940_山东省医疗机构中药制剂注册常见问题及分析

药事管理㊀作者简介:房娟娟ꎬ女ꎬ研究方向:药品审评检查ꎬE-mail:fangjuanjuan@shandong.cn㊀通信作者:武海军ꎬ男ꎬ研究方向:药品审评检查ꎬTel:0531-51795606ꎬE-mail:121956519@qq.com山东省医疗机构中药制剂注册常见问题及分析房娟娟ꎬ谢纪珍ꎬ卢雪明ꎬ高延甲ꎬ武海军(山东省食品药品审评查验中心ꎬ山东济南250014)摘要:目的㊀对我省医疗机构中药制剂注册常见问题进行分析汇总ꎬ探讨经典名方向中药新药的递级转化思路ꎬ为申报工作提供参考ꎮ方法㊀汇总近年来相关政策发布与制剂申报情况ꎬ探讨«山东省医疗机构制剂注册管理办法的通知»实施以来中药制剂审评常见问题及原因ꎮ结果㊀申请人应注重申报资料及相关研究的完整性㊁立题科学合理性㊁资料豁免情形的认知等方面ꎮ结论㊀建议加强自身建设ꎬ重视与主管部门的沟通ꎬ积极探索医药研发合作模式ꎮ关键词:医疗机构中药制剂ꎻ申报ꎻ转化中图分类号:R95㊀文献标识码:A㊀文章编号:2095-5375(2022)04-0277-004doi:10.13506/j.cnki.jpr.2022.04.016CommonproblemsandanalysisofregistrationoftraditionalChinesemedicinepreparationsinShandongmedicalinstitutionsFANGJuanjuanꎬXIEJizhenꎬLUXuemingꎬGAOYanjiaꎬWUHaijun(ShandongCenterforFoodandDrugEvaluation&InspectionꎬJinan250014ꎬChina)Abstract:Objective㊀ToanalyseandsummarizethecommonregistrationproblemsoftraditionalChinesehospitalmedicinepreparationinShandongprovinceꎬanddiscussthethoughtofgradualtransformationfromclassic&famouspre ̄scriptiontowardnewChinesetraditionalmedicineꎬsoastoprovidereferenceforthedeclaration.Methods㊀ThesituationofrelevantpolicyannouncementsandpreparationdeclarationsinrecentyearsweresummarizedꎬthencediscussthecommonproblemsofthereviewontraditionalChinesemedicinepreparationsandanalyzethereasonsforthemsincetheimplementa ̄tionoftheNoticeontheRegistrationManagementMeasuresoftheHospitalMedicinePreparationsinShandongProvince.ToanalyzeandsummarizethecommonregistrationproblemsoftraditionalChinesehospitalmedicinepreparationinShandongprovinceꎬanddiscussthethoughtofgradualtransformationfromclassic&famousprescriptiontowardnewChinesetraditionalmedicineꎬsoastoprovidereferenceforthedeclaration.Results㊀Applicantsshouldpayattentiontotheintegrityoftheap ̄plicationmaterialsandrelatedresearchꎬthescientificrationalityofthetopicꎬandtheawarenessoftheexemptionofmateri ̄als.Conclusion㊀Itisrecommendedtostrengthenself-constructionꎬattachimportancetocommunicationwithcompetentau ̄thoritiesꎬandactivelyexplorethecooperationmodeofpharmaceuticalresearchanddevelopment.Keywords:PreparationoftraditionalChinesemedicineinmedicalinstitutionsꎻDeclareꎻTransform㊀㊀近年来随着国家对中医药产业发展的高度重视ꎬ中医药产业展现出蓬勃生机ꎬ医疗机构中药制剂也迎来了发展之年ꎬ特别是在新冠肺炎疫情防控阻击战中ꎬ中医药作出了不可磨灭的贡献ꎬ为广大人民群众重新认识中医㊁了解中药提供了重大机遇ꎮ根据多年来山东省医疗机构制剂申报情况来看ꎬ医疗机构制剂相关事项的申请数量与政策法规具有一定的相关性ꎬ本文对我省近年来医疗机构制剂相关政策及中药制剂申报情况进行概括汇总ꎬ并对«山东省医疗机构制剂注册管理办法的通知»[1](以下称办法)自2021年4月15日实施以来的申报受理情况进行分析ꎬ为我省医疗机构中药制剂注册工作提供参考ꎬ为推进经典名方向医疗机构制剂㊁医疗机构制剂向中药新药的递级转化提供思路[2-4]ꎮ1㊀医疗机构中药制剂注册基本情况2015~2018年我省批准医疗机构中药制剂品种64个[2]ꎬ平均每年度批准16个制剂品种ꎮ2018年2月12日原国家食品药品监管总局颁布实行了«关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告(2018年第19号)»[5]ꎬ2019年2月1日ꎬ山东省药监局印发了«山东省医疗机构应用传统工艺配制中药制剂备案管理实施细则(试行)»[6]并正式施行ꎬ当年便有符合条件的已有批准文号的中药制剂品种申请转为备案管理ꎬ并开始有首次备案的品种出现ꎬ2019年度受理备案申请30余件ꎬ2020年开始出现大规模的备案品种ꎬ全年受理备案品种70余件ꎮ2021年3月15日山东省发布了«山东省医疗机构制剂注册管理办法的通知»ꎬ该法规于4月15日起正式实施ꎬ截至当年12月31日受理的中药制剂各类注册申请21件ꎬ已完成注册16件ꎬ均为自行配制ꎬ注册通过率76.19%ꎬ其中一次申报通过仅5件ꎬ多数为补充完善后通过ꎮ2 审评常见问题及原因分析根据审评情况看ꎬ医疗机构制剂注册通过率偏低尤其是一次申报通过率较低ꎬ其原因主要集中在以下几方面ꎮ2.1㊀审评常见问题2.1.1㊀申报材料存在完整性问题㊀根据相关文件要求ꎬ医疗机构制剂注册申报资料项目共计17项内容㊁备案资料项目共计16项内容ꎬ除根据申报资料豁免要求可不提交的材料外ꎬ应按申报资料说明提供完善的申报材料ꎮ但在审评过程中往往存在提交资料不完整或者关键内容缺失ꎬ如:缺少工艺研究验证㊁质量研究㊁临床研究㊁稳定性研究等资料ꎮ大多质量研究的申报资料缺少相关图谱资料ꎬ工艺研究资料缺少详细工艺筛选㊁确认过程和依据ꎬ且工艺参数设定无合理性阐述ꎬ三批工艺验证资料存在以实验研究批次数据代替3批中试研究批次数据等情形ꎮ研究资料的充分性㊁准确性㊁完整性是提高通过率很重要的一项内容ꎬ申请人需仔细研读«办法»相关规定ꎬ按要求提供尽可能翔实㊁完善的研究资料ꎬ相关图谱及统计数据也要提供尽量翔实的内容ꎮ2.1.2㊀制剂名称不符合命名原则㊀首先ꎬ按照要求医疗机构制剂名称不得与已批准的药品和医疗机构制剂重名ꎬ其中已批准药品名称ꎬ申请人可通过国家药品监督管理局官网查询ꎬ我省医疗机构制剂名称可查阅«山东省医疗机构制剂规范»ꎮ此外根据«关于发布中成药通用名称命名技术指导原则的通告»[7]的要求ꎬ中药制剂的命名要符合科学简明ꎬ避免重名㊁规范命名㊁避免夸大疗效㊁体现传统文化特色的基本原则ꎮ在审评中发现普遍存在命名缺乏中医药传统文化特色ꎬ命名方式较为单一的情形ꎬ许多申请人习惯性只选用处方中的一味名贵中药材进行命名ꎬ如 海马接骨∗∗ 黄精∗∗ ꎮ另外ꎬ申请人在命名时应注意避免使用夸大疗效或宣传性的用词ꎬ如 强力 根治 灵 等文字ꎮ«通告»对单味制剂㊁复方制剂命名方式有详尽的指导ꎬ申请人可参考相关要求进行命名ꎮ2.1.3㊀处方的组成㊁来源等情况缺乏必要说明㊀医疗机构制剂所用处方一般都是各机构在经方验方的基础上经过临床筛选后固定的ꎬ这种筛选一般是长期的㊁多次反复的ꎬ涉及大量的临床使用经验和相关病历等信息ꎬ申请人在提报申报资料时应提供详细的处方组方依据ꎬ尤其是源于为经方/验方的ꎬ尽可能提供详尽的处方来源㊁筛选过程及原始数据或文献资料ꎬ资料的提交要注明出处ꎬ同时还要注重专利和真实性的问题ꎮ对于中药制剂而言应格外注意对处方的配伍情况(君㊁臣㊁佐㊁使等)的分析及药物加减情况ꎬ用中医理论及临床使用经验来说明组合合理性㊁科学性ꎮ在审评过程中发现多存在无法提供引用文献资料的来源出处㊁缺少必要的证候分析及处方立法㊁分析判断标准使用非中医判断指标等的情形ꎬ这也是很多涉及临床试验制剂ꎬ在设计之初容易犯的关键性问题ꎮ申请人要树立中医思维ꎬ科学把握中医药理论特殊性ꎬ探索并保存以临床价值为导向ꎬ以中医药理论㊁人用经验和临床试验相结合的中药特色的证据ꎬ强化循证医学应用ꎬ充分发挥医疗机构制剂真实世界证据的作用ꎮ2.1.4㊀研究验证工作不充分㊀根据«办法»规定ꎬ配制工艺研究㊁质量研究㊁稳定性试验及3批样品的自检报告应以中试或者生产规模的数据为依据ꎬ要求提供的数据要全面ꎬ可以以列表的形式表现出相关数据ꎬ同时提供相关照片㊁图谱等原始数据资料ꎮ审评中发现往往存在样品来源不明确(比如生产单位)㊁批量不明及研究资料提交不完整的问题ꎮ比如多基原中药材未明确基原ꎬ工艺研究关键工艺参数未明确㊁缺少工艺筛选资料及选定依据㊁未提供工艺验证报告ꎬ质量研究缺少方法学研究及确认㊁质量控制项目不合理[8-9]㊁未提供相关图谱等问题ꎬ稳定性考察多存在考察时间过短㊁未提供相关数据图谱等情况ꎮ制剂的安全有效可控是应用于临床的前提ꎬ生产工艺的开发验证㊁质量控制的研究验证㊁稳定性的考察是基础ꎬ而且前期研究的越翔实越深入对于后期向新药转化提供的基础支撑材料也就越厚重ꎮ对于具体要求申请人可参考国家药审中心2020年发布的«中药复方制剂生产工艺研究技术指导原则(试行)»相关内容ꎮ2.1.5㊀对申报资料的豁免问题把握不准㊀«办法»中规定: 根据中医药理论组方配制(制剂配制过程没有使原组方中治疗疾病的物质基础发生变化的)ꎬ且该处方在本医疗机构具有5年以上使用历史的中药制剂ꎬ可免报资料13-17项..... [10]但申请人需注意ꎬ若申请豁免的中药制剂是源于机构经方的ꎬ«办法»中也规定应提供临床使用历史情况ꎬ包括:处方起源㊁处方筛选过程㊁剂型㊁用法用量的考察及处方固定时间㊁药物应用基础㊁临床应用等情况ꎮ同时还应提供处方在本医疗机构连续使用5年以上的文字证明资料及至少100例以上的临床病历及相关数据及分析ꎬ每年的病历数不少于10例ꎮ总而言之ꎬ申请人要有足够的资料㊁数据支撑豁免相关研究不影响制剂的安全性㊁有效性ꎬ若无相关支撑或力度不够即便声称临床使用时间再长㊁有效病例再多也无法得到有效认可ꎮ2.2㊀原因分析2.2.1㊀对医疗机构制剂的概念理解不到位㊀«办法»第三条规定: 医疗机构制剂ꎬ是指医疗机构根据本单位临床需要经批准而配制㊁自用的固定处方制剂ꎮ医疗机构配制的制剂ꎬ应当是市场上没有供应的品种 ꎮ根据«办法»相关规定可知ꎬ医疗机构的申请人需为获得医疗机构执业许可证及医疗机构制剂许可证的医疗机构ꎬ且医疗机构制剂的处方需为固定处方且市场上没有供应方可申请配制ꎬ其使用除经批准后调剂ꎬ否则只能在本机构内使用ꎮ申报中会存在申报已上市药品的情况ꎬ且很多无法提供申请的制剂是以固定处方的形式在本医疗机构临床应用的相关证明性材料ꎬ比如某申请人提交的临床使用的医师处方为多组方ꎬ但无法提供最终的固定处方ꎬ也就是这个组方虽在该机构使用多年ꎬ但处方一直并未固定ꎬ还是一直随症加减的形式在临床应用ꎬ也就是还处于临床筛选阶段ꎬ或申请人未形成处方筛选的概念ꎻ又如ꎬ某申请人提交的制剂处方与市场上已有供应品种处方包括规格等都相同ꎮ以上这些问题的出现主要原因就是申请人对医疗机构制剂的概念缺乏清晰完整的认知ꎬ未理解其内涵ꎬ也就无法对相关要求有清晰的认知ꎮ2.2.2㊀医疗机构队伍建设水平亟待提高㊀长期以来各医疗机构普遍存在制剂室人员流动性大ꎬ从业人员非药学相关专业或相关专业但无制剂相关工作经验的情况ꎬ且不同程度的存在对法律法规学习不够重视㊁制剂品种档案的建立和维护意识薄弱的情况ꎬ这与机构领导层对制剂相关工作的重视程度有关ꎮ此外作为新法实施第一个开局之年ꎬ申请人对«办法»及相关政策的认知需要一个成长过程ꎬ现阶段相关从业人员对政策法规了解不多甚至不知晓相关政策法规ꎬ这也就直接导致申请人在申报之初便存在偏离或不符合相关政策规定的情况ꎬ从而导致了申报通过率较低的情况ꎬ而且这种政策法规的知识欠缺及品种档案的不完善也导致了申请人在后期的补充申请或再注册时也同样存在各种问题ꎬ注重制剂队伍建设ꎬ提升医疗机构中药制剂科研人员的积极性和主观能动性ꎬ对于发展本机构的制剂工作是非常必要的ꎮ2.2.3㊀申请人自身条件无法满足制剂配制要求㊀根据«办法»第七条规定ꎬ获得医疗机构执业许可证及医疗机构制剂许可证的医疗机构可以自行配制制剂许可证配制范围内的相应剂型ꎮ注册申请在被受理后要接受对制剂研究㊁配制和临床使用的现场核查ꎮ但通过申报资料的审查和现场检查发现有些申请人其人员㊁仪器㊁设备等研发㊁生产条件医并不能保障其生产出安全有效可控的制剂ꎮ根据本办法规定ꎬ医疗机构中药制剂可以由医疗机构制剂自行配制ꎬ也可以委托取得医疗机构制剂许可证的医疗机构或者通过药品生产质量管理规范符合性检查的药品生产企业配制中药制剂ꎮ也就说ꎬ目前中药制剂是允许委托配制的ꎬ申报单位在申报前期要自行评估医院人员㊁设施设备等相关资源ꎬ若自己不具体自行研发㊁配制的条件可按相关要求委托配制ꎬ不要盲目申报ꎬ避免因配制环境㊁设施设备㊁药学相关研究不符合要求而申报不成功ꎮ此外需注意中药制剂可以委托但需注意被委托方相关资质及要有相应的剂型生产范围ꎮ3 意见与建议3.1㊀加强制剂人员培养ꎬ重视制剂品种档案管理ꎮ许多医疗机构对于制剂室及制剂从业人员重视不够ꎬ往往存在制剂室规章制度不健全ꎬ人员流动性强ꎬ忽视政策法规学习等的情况ꎬ这直接导致了申报中频发的立题不准㊁资料不完善等各种问题ꎬ同时也会导致后期变更㊁再注册的时候问题频出ꎬ而且容易发生因不了解新法规ꎬ发生违规行为而不自知的情况ꎮ制剂品种档案是制剂的全生命周期资料的一个缩影ꎬ一方面可以很好地保存制剂品种的相关信息以备检查需要ꎬ另一方面相关资料的留存也便于后期相关变更的申请ꎬ以及向新药转化时提供真实㊁详尽的历史资料ꎮ3.2㊀重视申报前可行性分析ꎬ加强与主管部门的沟通交流ꎮ近年来为了更好地服务企业ꎬ山东省药监局及省食品药品审评查验中心不断拓宽沟通渠道ꎬ从线上线下打通服务企业的最后一公里ꎬ线上可通过官网咨询㊁电话咨询ꎬ线下可通过官网公示的联系电话或者到申请现场咨询㊁沟通交流等多种渠道ꎮ近期山东省药监局 药监业务智慧帮办 平台已上线试运行ꎬ向申请人提供审评查验等业务的咨询服务ꎮ申请人要对申报品种及相关法规有清楚的认知ꎬ及时关注相关法规政策的发布㊁解读ꎬ申报前中后期政策技术性问题可向相关部门进行咨询[11]ꎬ答疑理清思路后再行研发申报ꎬ充分认识理解合规申报的意义和不合规的风险ꎬ减少后续不必要的隐患ꎬ降低各环节的成本和风险ꎬ以免盲目投入研发造成人力㊁物力的浪费ꎮ3.3㊀加强向新药转化意识ꎬ探索与药品研发㊁生产企业的合作模式ꎮ国家近年来大力倡导传统中医药的发展ꎬ政策方面也发布了很多指导性的文件ꎬ仅2021年国家药品审评中心就发布中药相关指导原则十余个ꎬ其中就有«中药新药研究各阶段药学研究技术指导原则»«按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)»等一系列指导意义很强的内容ꎮ2020年国家药监局印发了«真实世界证据支持药物研发与审评的指导原则(试行)»[12]ꎬ在真实世界证据支持药物监管决策章节中提出ꎬ对于名老中医经验方㊁中药医疗机构制剂等已有人用经验药物的临床研发ꎬ在处方固定㊁生产工艺路线基本成型的基础上ꎬ可尝试将真实世界研究与随机临床试验相结合ꎬ探索临床研发的新路径ꎮ应用真实世界证据支持已有人用经验中药的临床研发策略可以有多种ꎬ应根据产品的特点㊁基础研究的信息(如毒理试验)㊁临床应用情况㊁既往临床实践的有效数据积累等采取恰当的策略ꎮ并明确提出了高质量真实世界数据作为申请直接作为支持产品上市的依据的可能ꎬ这无疑是给医疗机构制剂向新药转化提供了强有力的政策及技术支持ꎬ因此医疗机构要着眼长远ꎬ加强前瞻性系统性谋划ꎬ在立项之初就从处方确定㊁规范临床试验㊁专利保护㊁真实世界证据收集等[13-14]各个方面做好准备ꎬ为向新药转化夯实坚实基础ꎮ为此申请人可加强与高等院校㊁药品研发及药品生产企业的合作ꎬ积极搭建医药研发共享实验室ꎬ补齐短板ꎬ促进传统中药制剂向新药的转化ꎮ3.4㊀建议加大释放政策红利ꎬ促进医疗机构制剂快速发展ꎮ一方面要服务传统ꎬ继续强化政策性支撑ꎮ医疗机构制剂长期以来受使用范围限制㊁价格倒挂等因素影响发展较为缓慢ꎬ近年来诸如将医疗机构制剂纳入医保㊁增加调剂使用范围㊁增加调剂使用制剂品种㊁审评制度改革等利好政策相继出台ꎬ给医疗机构制剂尤其是中药制剂的发展增添了极大活力ꎬ但这种政策红利的持续性㊁力度及内涵都有待扩大和强化ꎬ以期为医疗机构制剂发展提供更大空间ꎮ另一方面要服务创新ꎬ助力医疗机构制剂向新药转化ꎮ近年来国家在探索中药传承创新发展新途径ꎬ支持和推动中药传承创新发展方面做了很多努力ꎬ也取得显著成绩ꎬ2021年获批上市的45个创新药品中12个为中药ꎬ创近5年来数量新高ꎮ国家药监局发布的«关于促进中药传承创新发展的实施意见»中提出要发挥医疗机构中药制剂传承创新发展 孵化器 作用ꎬ鼓励医疗机构制剂向中药新药转化ꎮ但这个转化需要临床㊁科研㊁生产等各方合力协作才能有所作为ꎬ更需要政府搭桥ꎬ搭建产学研合作平台ꎬ将各方资源有效联合起来ꎬ提高转化质量与成功率ꎮ同时也需要相关部门提供技术支撑ꎬ探索出一套符合中医中药特色的审评审批体系㊁一套能将中医药传统理论与人用经验及临床试验有机结合的审评证据体系ꎬ蹚出一条支持中药人用经验证据的合理应用的路子ꎬ助力经典名方向医疗机构制剂㊁医疗机构制剂向中药新药递级转化ꎮ4 结语中医中药是我们中华民族的瑰宝ꎬ近年来中医药产业在经济社会发展中的地位不断提升ꎮ在新冠肺炎的救治和预防中ꎬ中医药也发挥了重要作用ꎬ展现出强大生命力ꎬ为广大人民群众重新认识中医㊁了解中药提供了重大机遇ꎮ医疗机构制剂向中药复方新药转化有其独特的真实世界数据的强大优势ꎬ加之近年来我国大力发展传统中医药ꎬ对中医药的发展提供了很多政策性的支持ꎬ这些对于中药制剂发展及向新药转化是非常利好的ꎮ山东省局为全面落实 人民药监为人民 的理念ꎬ积极探索服务企业方式ꎬ线上线下拓宽与企业沟通渠道ꎬ下沉企业对申请人进行集中培训与宣贯ꎬ提升申请人对于法规政策㊁指导原则㊁申报资料要求等的理解ꎬ多措并举助力产业发展ꎮ2021年初省局联合10部门出台了«关于促进山东省中药产业高质量发展的若干措施»对中药制剂产业转化方面提出完善的政策举措ꎮ制度的生命力在于执行ꎬ作为申请人也要加强学习ꎬ吃透政策㊁用好政策ꎬ落实好主体责任ꎮ只有政企双方双向努力双向奔赴才能实现我省医中医药产业的高质量发展ꎮ参考文献:[1]㊀山东省药品监督管理局.山东省医疗机构制剂注册管理办法[EB/OL].(2021-03-30)[2022-01-18].http://mpa.shandong.gov.cn/art/2021/3/30/art_101747_10292515.html.[2]尹宁宁ꎬ谢纪珍ꎬ周黎明ꎬ等.山东省医疗机构中药制剂技术审评常见问题及分析[J].药学研究ꎬ2019ꎬ38(11):679-682.[3]周萃ꎬ王杰ꎬ邬科ꎬ等.加强医疗机构中药制剂研发与备案管理的思考[J].中医药管理杂志ꎬ2019ꎬ27(12):90-92.[4]夏杰ꎬ尹蔚萍ꎬ张文荫.发展中医医院中药制剂的思考[J].中医药管理杂志ꎬ2014ꎬ22(9):1523-1527. [5]国家食品药品监督管理总局.关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告(2018年第19号)[EB/OL].(2018-02-12).[2022-01-18].https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20180212143401381.html. [6]山东省药品监督管理局.山东省医疗机构应用传统工艺配制中药制剂备案管理实施细则(试行)[EB/OL].(2018-04-23)[2022-01-18].http://mpa.shandong.gov.cn/art/2019/1/2/art_108868_8877078.html?xxgkhide=1.[7]国家食品药品监管总局.总局关于发布中成药通用名称命名技术指导原则的通告(2017年第188号)[EB/OL].(2017-11-28)[2022-01-18].https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20171128180501239.html. [8]陈家润ꎬ沈小莉ꎬ王晓英ꎬ等.医疗机构中药制剂配制工艺研究的探讨[J].海峡药学ꎬ2019ꎬ31(9):17-20. [9]樊艳霞ꎬ郭海波ꎬ陆珞ꎬ等.医疗机构应用传统工艺配制中药制剂实施备案管理之见解[J].中国卫生产业ꎬ2018(9):89-90.[10]徐婧.山东有条件豁免中药院内制剂临床试验研究[J].中医药管理杂志ꎬ2021ꎬ29(7):198.[11]蒋晓峰ꎬ何雨桐.关于提高云南省药品注册审评工作质量及时效的几点思考[J].全科口腔医学杂志(电子版)ꎬ2019ꎬ6(29):20.[12]国家药监局药审中心.真实世界证据支持药物研发与审评的指导原则(试行)(2020年第1号)[EB/OL].(2020-01-03)[2022-01-18].https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=db4376287cb678882a3f6c8906069582.[13]李灿ꎬ丁建华ꎬ刘春ꎬ等.关于医疗机构中药制剂向中药新药转化的思考[J].中国新药杂志ꎬ2016ꎬ25(9):973-975.[14]王嵩ꎬ郤庆ꎬ罗发珍ꎬ等.基于医疗机构中药制剂的中药新药研发刍议[J].上海医药ꎬ2021ꎬ42(1):6-9.。
发展中国临床试验注册制度——第五届亚太地区循证医学研讨会纪要(1)

9、第二军医大学学报
“创建和发展中国临床试验注册制度”是第五届亚太地 区循证医学研讨会的重要内容之一,2008年5月24日世界卫 生组织国际临床试验注册平台(wH0 ICTRP)项目官员Davi一 岫Ghe鹅i教授专程出席并做大会演讲,25日举行了医学期刊 与循证医学的专题报告与讨论会,会议由《解放军医学杂志》 常务副总编兼编辑部主任贾万年大校与中国临床研究注册中 心负责入吴泰相副.教授共同主持,中国循证医学中心主任李 幼平教授做了“中国基金资助课题注册情况”的研究报告, 中国循证医学中心研究生杨洵哲介绍了“中国临床试验注册 与发表协作网运行机制”建设情况,中国循证医学中心吴泰 相副教授代表中国临床试验注册与发表协作网(clliCTRPc) 做“ChicTRPC工作报告”及“临床试验透明化:世界医学 发展新潮流”报告,香港浸会大学中医学院卞兆祥博士代表
fbr
TcM是受c0Ns0RT工作组委
托,中国循证医学中心牵头,全球28位中医和中西医结合专 家、方法学家、统计学家参与制订的中医药随机对照试验报 告指南,推广c0NSORT矗”TcM是促进中医药现代化、临床 试验透明化的重要工作。CONSORT f打TCM的草稿巴经于 2007年在中国循证医学杂志上发表,目的在于进一步征求各 专业人士对于发展CONsORT
注:2004年国际期刊委员会要求其成员期刊将在公共临 床试验注册机构注册作为发表论文的前提条件,并宣布所有
临床试验必须在纳入观察对象前进行注册。于2005年7月1 日后实施。对在此日期前已经纳入观察对象的试验,只延长 至2005年9月13日。 2008年3月,印度医学期刊宣布:“我们全体一致决定: 编辑们有责任推动在印度实施的所有临床试验注册,促使研 究者在一定时间内注册临床试验,使临床试验资料透明化, 并使其研究结果发表在高水平期刊上。我们谨代表所有印度 的生物医学期刊,促使所有正在进行和(或)计划进行的人 体临床试验在印度临床试验注册机构或任何其他一级注册机 构注册。从20lO年1月开始,对2008年6月以后进行的临床 试验,只有预注册者才能发表;2008年6月以前进行的试验, 必须进行补注册。” 参考文献 1刘雪梅,李幼平,吴泰相,等.基金资助的中国临床试验注册情
卡瑞利珠单抗或信迪利单抗联合仑伐替尼治疗肝癌的效果及对肿瘤标志物的影响

3<#.=,$354>#667%$Q("#O$@$*F$%$"#O$47*I#F$*$O$4$I76.#*.76$0""(*'F)76#E&
原 发 性 肝 癌 常 见 于 ("%%" 岁 人 群"是 全 世 界 第 六大常见 癌 症"也 是 致 死 率 第 二 的 癌 症# 目 前"全 身
系统治疗是肝癌患者首选治疗方案 (#)#既往研究表 明"免疫治疗用于晚期肝癌患者能够促进其免疫系统
-#"*"-
>)$*7,717E#F'%'+&"<.F-!"!!"G'%-!$"9'-#"
肝癌
卡瑞利珠单抗或信迪利单抗联合仑伐替尼治疗 肝癌的效果及对肿瘤标志物的影响
杨建奇曹文淼吴银霞殷婷邢恩明
摘要目的探讨卡瑞利珠单抗或信迪利单抗联合仑伐替尼治疗肝癌的效果及对肿瘤标志物的影响#方法选取 !"#*年)月2!"!#年)月苏北人民医院收治的原发性肝癌患者+%例作为研究对象进行回顾性分析"根据治疗方法将患 者分为仑伐替尼组&&例%仑伐替尼治疗&'卡瑞利珠组&"例%卡瑞丽珠单抗联合仑伐替尼&'信迪利组&!例%信迪丽单抗联 合仑伐替尼&"比较三组治疗后临床疗效'毒副不良反应及对患者肝脏生化指标(丙氨酸氨基转移酶%/45&'天冬氨酸氨基 转移酶%/@5&及总胆红素%5:$%&)'肿瘤标志物(甲胎蛋白%/8C&'癌胚抗原%>!/&'#343岩藻糖苷酶%/8A&'糖类抗原#++ %>/#++&)的影响#结果卡瑞利珠组'信迪利组临床疗效明显高于仑伐替尼组%!"-"%&$治疗后三组 /45'/@5和 5:$% 水平明显降低"卡瑞利珠组'信迪利组明显低于仑伐替尼组%!"-"%&$治疗后三组 /8C'>!/'/8A 和>/#++水平明显降 低"卡瑞利珠组'信迪利组明显低于仑伐替尼组%!"-"%&$三组患者毒副不良反应差异无统计学意义%!"-"%&#结论 卡瑞利珠单抗或信迪利单抗联合仑伐替尼治疗肝癌能有效提高疗效"改善肝功能"降低肿瘤标志物水平"且安全性好#
赖氨酸磷酸氢钙颗粒评价性抽验结果及质量评价

赖氨酸磷酸氢钙颗粒评价性抽验结果及质量评价咸瑞卿1ꎬ2ꎬ王聪聪2ꎬ巩丽萍2ꎬ石峰2(1.山东大学药学院ꎬ山东济南250012ꎻ2.山东省食品药品检验研究院ꎬ山东济南250101)摘要:目的㊀评价国产赖氨酸磷酸氢钙颗粒质量现状及存在问题ꎬ为提高质量标准及临床用药安全提供参考ꎮ方法㊀对全国范围内抽取的167批样品采用法定标准检验与探索性研究结合的方法进项检验ꎬ并对检验结果进行统计分析ꎬ用于风险评估ꎮ结果㊀按法定标准检验ꎬ167批样品结果均符合规定ꎻ探索性研究中ꎬ合格率为83.8%ꎬ不合格项目为干燥失重及未按批准处方投料ꎮ结论㊀本次抽检的赖氨酸磷酸氢钙颗粒整体质量状况差ꎬ现行质量标准存在缺陷ꎬ需进一步完善ꎮ关键词:赖氨酸磷酸氢钙颗粒ꎻ评价性抽验ꎻ质量评价中图分类号:R927.11㊀文献标识码:A㊀文章编号:2095-5375(2020)04-0205-009doi:10.13506/j.cnki.jpr.2020.04.005SamplingresultsandassessmentqualityofLysineHydrochlorideandCalciumHydrogenPhosphateGranulesXIANRuiqing1ꎬ2ꎬWANGCongcong2ꎬGONGLiping2ꎬSHIFeng2(1.SchoolofPharmaceuticalSciencesꎬShandongUniversityꎬJinan250012ꎬChinaꎻ2.ShandongInstituteforFoodandDrugControlꎬJinan250101ꎬChina)Abstract:Objective㊀ToevaluatethequalitystatusandexistingproblemsofLysineHydrochlorideandCalciumHy ̄drogenPhosphateGranulesandprovidereferencesfortheimprovementofqualitystandardandclinicalmedicationsafety.Methods㊀Totally167batchesofsamplesfromalloverthecountrywereexaminedbystatutorytestingmethodscombinedwiththeexploratoryresearchmethods.ThedetectionresultswerestatisticallyanalyzedforevaluatingthequalitystatusofLy ̄sineHydrochlorideandCalciumHydrogenPhosphateGranules.Results㊀Allthesampleswerequalifiedaccordingtothestatutorystandard.Thequalifiedratewas83.8%byexploratoryresearchmethods.Theunqualifieditemswerelossondryingandunapprovedprescription.Conclusion㊀TheoverallqualityofLysineHydrochlorideandCalciumHydrogenPhosphateGranuleswaspoor.Thecurrentstatutorystandardwasdefectivewhichshouldbefurtherimproved.Keywords:LysineHydrochlorideandCalciumHydrogenPhosphateGranulesꎻEvaluationsamplingꎻQualityevaluation㊀㊀赖氨酸磷酸氢钙颗粒是由盐酸赖氨酸㊁磷酸氢钙和适宜辅料制成的复方制剂ꎬ主要用于生长发育促进以及钙质的补充[1]ꎮ2018年ꎬ我们对全国范围内抽取的167批赖氨酸磷酸氢钙颗粒进行了法定标准检验ꎬ包括性状㊁鉴别㊁检查及含量测定ꎬ结合探索性研究ꎬ对检验结果进行统计分析ꎬ用于风险评估ꎬ为今后质量标准及临床用药安全的提高提供参考ꎮ1㊀抽样情况1.1㊀药品剂型㊁规格与包装材料㊀此次抽检的赖氨酸磷酸氢钙颗粒为混悬颗粒ꎬ标示规格均为含盐酸赖氨酸0.1g㊁磷酸氢钙0.1gꎬ包装规格均为每袋5gꎬ内包装均为药用复合膜ꎮ1.2㊀药品抽样情况㊀从国家药品监督管理局网站查询ꎬ目前赖氨酸磷酸氢钙颗粒的生产企业共有16家ꎬ药品批准文号16个ꎮ本次共抽取167批次(148个生产批次)ꎬ涉及生产企业10家ꎬ占总生产企业的62.5%ꎬ涉及10个批准文号ꎬ占总文号数的62.5%ꎬ未涉及的批准文号共有6个ꎬ占总文号数的37.5%ꎮ企业调研结果显示ꎬ6家企业长期不生产ꎬ存在文号闲置的情况ꎮ本次抽验覆盖27个省(自㊀作者简介:咸瑞卿ꎬ男ꎬ副主任药师ꎬ研究方向:生物与医药ꎬE-mail:xianruiqing@126.com㊀通信作者:石峰ꎬ男ꎬ副主任药师ꎬ研究方向:药品质量控制ꎬTel:0531-81216563ꎬE-mail:13953175123@139.com治区㊁直辖市)ꎬ来自各类经营企业(89.2%)㊁医疗单位(0.6%)和生产企业(10.2%)ꎬ代表性较强ꎬ能较好地反映反应全国赖氨酸磷酸氢钙颗粒质量现状ꎮ2 法定检验现行«中国药典»«美国药典»«英国药典»«欧洲药典»«日本药局方»中均未收载赖氨酸磷酸氢钙颗粒的质量标准ꎮ现有15家企业执行国家标准ꎬ另1家企业执行注册标准ꎬ两者主要在处方项目上有所差异ꎬ且注册标准另含有其他氨基酸检查㊁溶出度检查及干燥失重3项检查项目ꎮ本次抽样样品均执行国家药品标准ꎬ对167批次的赖氨酸磷酸氢钙颗粒按法定质量标准进行检验ꎬ所有项目均符合规定ꎬ合格率为100%ꎮ2.1㊀性状㊀167批次样品均为类白色或淡黄色颗粒ꎬ味甜ꎬ合格率为100%ꎮ但不同企业样品颜色存在差异(见图1)ꎬ除与个别企业处方中的柠檬黄色素有关外ꎬ还与颗粒干燥工艺中干燥温度和时间相关ꎬ干温度过高或时间过长会使颗粒颜色加深ꎮ其中J企业不同批次间颜色差异显著ꎬ说明该企业生产工艺不稳定或不按照批准的处方工艺生产ꎬ结合企业提供的处方工艺资料ꎬ企业可能存在擅自添加着色剂的问题ꎬ需进一步开展探索性研究ꎮ图1㊀不同企业赖氨酸磷酸氢钙颗粒的外观性状2.2㊀鉴别㊀本品的鉴别反应均包含以下两项:①化学鉴别:利用茚三酮与α-氨基加热反应产生蓝紫色物质的原理来鉴别赖氨酸ꎻ②化学鉴别:钙盐和磷酸盐鉴别ꎮ167批次样品鉴别结果均符合规定ꎮ我们在法定检验中发现现行质量标准存在以下问题:①采用茚三酮显色反应鉴别赖氨酸ꎬ方法的专属性不强ꎬ无法区别其他氨基酸ꎬ需进一步建立专属性强㊁灵敏性高的赖氨酸鉴别方法ꎻ②因磷酸氢钙在中性水溶液中不溶ꎬ且盐酸赖氨酸的氯离子对磷酸盐鉴别①有干扰ꎬ因此现行赖氨酸磷酸氢钙颗粒各质量标准的磷酸盐和钙盐的方法灵敏低ꎬ鉴别现象不易观察ꎬ需对现行标准进行修订ꎮ2.3㊀装量差异㊀按«中国药典»2015年版(四部)通则0104进行检验ꎬ取本品10袋ꎬ分别精密称定每袋装量并计算平均装量ꎮ单样本Kolmogorov-SmirnovZ(K-S)检验表明167批样品的装量检测结果呈较好的正态分布ꎬ平均装量分布在4.6100g~5.2060g之间ꎬ装量平均值为4.9950g/袋(见图2)ꎬ均符合平均装量ʃ7%的规定限度ꎮ从不同企业的装量差异箱线图(见图3)来看ꎬ各企业的平均装量离散性均较小ꎬ但G企业出现有1批次较大离异值ꎬ说明该企业颗粒分装工艺稳定性有待提高ꎮ图2㊀装量统计结果直方图2.4㊀粒度㊀按«中国药典»2015年版(四部)通则0104颗粒剂项下的规定ꎬ取本品5袋ꎬ照粒度和粒度分布测定法(第二法双筛分法)测定ꎬ不能通过一号筛与能通过五号筛的总和不得超过15%ꎮ经过检验ꎬ167批次样品的粒度均符合规定ꎬ样品合格率100%ꎮ2.5㊀含量测定2.5.1㊀磷酸氢钙(CaHPO2 2H2O)㊀依据质量标准ꎬ采用EDTA滴定法对167批样品的磷酸氢钙进行含量测定ꎬ并对结果进行统计分析(见图4)ꎮ由图可见磷酸氢钙含量分布在94.6%~106.9%之间ꎬ平均含量为99.78%ꎬK-S检验表明含量呈良好的正态分布ꎬ均符合90.0%~110.0%的规定ꎮ根据箱线图(见图5)ꎬA企业样品含量分布范围较宽ꎬB及E企业的含量分布相对集中ꎬ但分别有2批及4批样品有较大离异值ꎮ经过对比ꎬ两家企业样品中出现较大离异值的样品平均装量均未有异常离异值ꎬ且这些批样品均属于不同的批次ꎬ说明企业的产品含量均一性仍需要加强控制ꎮ图3㊀装量统计结果箱线图图4㊀磷酸氢钙含量直方图2.5.2㊀盐酸赖氨酸(C6H14N2O2 2HCl)㊀盐酸赖氨酸含量采用紫外-可见分光光度法进行测定ꎬ结果表明(见图6)盐酸赖氨酸含量分布在91.3%~107.4%之间ꎬ平均含量为99.07%ꎬK-S检验表明含量呈良好的正态分布ꎬ167批样品结果均符合85.0%~115.0%的标准规定ꎮ根据箱线图(见图7)ꎬ各企业均未出现较大离异值ꎬA企业的样品含量分布范围略宽于其他企业ꎮ㊀㊀现行国家药品标准采用UV法(比色法)进行含量测定ꎬ该方法受试剂㊁温度㊁反应时间等因素影响较大ꎬ方法的重现性差㊁专属性不强ꎬ且限度范围设图5㊀磷酸氢钙含量箱线图6㊀盐酸赖氨酸含量直方图图7㊀盐酸赖氨酸含量箱线图置过宽ꎬ不能客观准确的的反映产品的真实含量ꎮ因此ꎬ在探索性研究中需要建立一种专属性更好的含量测定方法ꎬ对产品质量进行进一步的研究ꎬ并合理设定限度范围ꎮ3 探索性研究及结果本次研究紧紧围绕赖氨酸磷酸氢钙颗粒剂存在的安全性㊁有效性问题ꎬ以及现行质量标准存在的科学性与合理性问题ꎬ以企业提供的处方工艺信息资料为依据ꎬ以法定检验突出的质量问题为导向ꎬ结合专题调研㊁文献检索发现的问题ꎬ对影响药品安全性㊁有效性及稳定性等关键因素展开了探索性研究ꎮ3.1㊀赖氨酸鉴别试验㊀现行赖氨酸磷酸氢钙颗粒质量标准均采用茚三酮显色反应鉴别赖氨酸ꎬ该方法专属性不强ꎬ无法区别其他氨基酸ꎮ针对上述问题ꎬ我们参考文献ꎬ建立了柱前衍生HPLC法鉴别赖氨酸的方法[2-3]ꎮ专属性试验研究显示该方法空白辅料㊁衍生化试剂及其他氨基酸均无干扰ꎬ方法专属性良好(见图8)ꎮ使用该方法对167批次样品进行赖氨酸鉴别ꎬ合格率100%ꎮ图8㊀专属性试验色谱图3.2㊀有关物质研究㊀现行国家标准中赖氨酸磷酸氢钙颗粒未对有关物质进行控制ꎬ故有必要建立更适宜的方法考察赖氨酸原料及制剂中的有关物质ꎬ从而保证产品的安全性ꎮ目前ꎬ国内外文献对赖氨酸杂质研究报道较少ꎬ国内外药典仅检查盐酸赖氨酸原料中其他氨基酸含量ꎮ我们根据文献报道ꎬ选择赖氨酸中可能存在的杂质如D-赖氨酸㊁其他氨基酸及其他杂质ꎬ考察样品中的含量ꎬ必要时建立限度检查ꎮ3.2.1㊀D-赖氨酸㊀手性固定相色谱技术是对映异构体分离的一种有效方法[4]ꎮ本研究采用大赛路手性色谱柱ꎬ以高氯酸水溶液为流动相ꎬ检测波长为205nmꎬ对D-赖氨酸进行分析ꎮ本方法中ꎬD-盐酸赖氨酸和L-盐酸赖氨酸的分离度大于3.0ꎬ检测限均约为0.025μg(见图9)ꎮ通过该方法ꎬ对9家企业27批盐酸赖氨酸颗粒进行了测定ꎬ典型样品色谱图见图10ꎬ均未检出D-赖氨酸ꎬ合格率为100%ꎬ因此制剂中无须设定该项限度检查ꎮ3.2.2㊀其他氨基酸的测定㊀我们采用氨基酸分析仪ꎬ使用茚三酮进行柱后衍生ꎬ胱氨酸检测波长440nmꎬ其余均为570nmꎬ对其他氨基酸进行测定ꎮ本方法各氨基酸之间分离度大于1.5ꎬ胱氨酸检测限<16pmolꎬ其他氨基酸<3pmolꎬ各氨基酸对照品色谱图9㊀DL混合赖氨酸色谱图图10㊀D-赖氨酸检查典型样品色谱图图见图11ꎮ通过该方法对9家企业27批盐酸赖氨酸颗粒进行测定ꎬ典型样品色谱图见图12ꎬ均未检出其他氨基酸ꎬ合格率为100%ꎬ因此制剂中无须设定该项限度检查ꎮ图11㊀混合氨基酸对照品色谱图图12㊀其他氨基酸检查典型样品色谱图3.3㊀赖氨酸含量测定㊀高效液相色谱(HPLC)法具有分离度高㊁选择性好等特点ꎬ越来越广泛地应用于氨基酸的分析测定中ꎮ其中ꎬ柱前衍生与HPLC结合已成为氨基酸分离分析的有力工具之一[4-5]ꎮ我们以2ꎬ4-二硝基氟苯为衍生化试剂ꎬ使用甲醇-0.05mol L-1醋酸钠缓冲液为流动相ꎬ采用十八烷基硅烷键合硅胶为填充剂的色谱柱ꎬ在360nm波长下进行检测ꎬ建立了盐酸赖氨酸磷酸氢钙颗粒中L-盐酸赖氨酸含量测定方法ꎬ并对167批样品的赖氨酸含量进行测定ꎮ从直方图中(见图13)可以看出ꎬ全部样品的含量分布在93.2%~105.7%之间ꎬ平均含量为100.48%ꎬ合格率100%ꎮ对拟定方法(HPLC法)与法定方法(UV法)测定结果进行比较ꎬ用两种方法含量测定结果整体无显著性差异(见图14)ꎬ其中拟定方法测定的结果偏差较小ꎬ较法定标准测定值偏高ꎮ拟定方法测定结果具有更好的中位数分布ꎬ数据更加集中ꎬ离群值较明显ꎬ能够更好地区分相同厂家不同批次产品的批间差异ꎮ此外ꎬ结合拟定方法ꎬ建议将本品盐酸赖氨酸(C6H14N2O2 2HCl)含量修订为 应为标示量的90.0%~110.0% ꎮ3.4㊀颗粒剂干燥失重考察㊀赖氨酸磷酸氢钙颗粒为化学药品颗粒ꎬ根据«中国药典»2015年版制剂通则颗粒剂项下要求需检查干燥失重ꎬ现行国家标准WS-10001-(HD-0389)-2002中干燥失重检查项缺失ꎮ我们对收集的所有颗粒剂样品ꎬ按«中国药典»2015年版(四部) 干燥失重检查法 对颗粒剂干燥失重进行测定ꎬ考察各企业工艺稳定性ꎮ10家生产企业共167批样品的测定结果表明ꎬ干燥失重平均值为0.76%ꎬ其中I企业有1批不合格ꎬ合格率为99.4%ꎮ对数据分析发现有76.0%的样品干燥失重值小于1.0%ꎬ说明大部分企业的产品干燥工艺选择适宜ꎮ图13㊀盐酸氨酸含量结果直方图图14㊀盐酸氨酸含量测定结果对比图3.5㊀辅料使用合规性考察㊀我们通过处方工艺调研ꎬ发现部分生产企业现行生产处方与所执标准的处方不一致ꎬ且未能提供处方变更或备案的有效证明文件ꎬ存在擅自更改处方ꎬ违规或超限使用辅料的风险ꎬ因此我们选择可能存在风险的着色剂㊁枸橼酸㊁葡萄糖㊁乳糖㊁蔗糖及淀粉等固体制剂常用辅料ꎬ对其使用情况进行了考察ꎮ结果显示ꎬ167批次颗粒剂中25批次检出处方外辅料成分ꎬ不合格率为15.0%ꎮ3.5.1㊀着色剂㊀针对法定检验中发现各企业产品甚至同一企业不同产品颜色差异显著ꎬ可能存在违规添加着色剂的问题ꎬ参考文献ꎬ我们建立了液相色谱测定赖氨酸磷酸氢钙颗粒中柠檬黄和日落黄的方法[6]ꎮ前期处方工艺调研显示ꎬ除D企业生产颗粒处方有柠檬黄外ꎬ其他企业处方中均无柠檬黄ꎮ但J企业21批样品中有15批检出了柠檬黄ꎬ提示该企业可能存在非法添加辅料柠檬黄的行为ꎮ其他企业样品均未检出柠檬黄ꎬ与资料一致ꎮ全部样品均未检出日落黄及阿司帕坦ꎮ3.5.2㊀枸橼酸㊀我们通过建立的高效液相色谱-二极管阵列检测器测定赖氨酸磷酸氢钙颗粒中枸橼酸含量的方法ꎬ对167批样品中的枸橼酸含量进行测定ꎬ并进一步采用高分辨质谱对阳性样品进行确认ꎮ结果发现D企业有8批次样品检出了枸橼酸(见图15)ꎬ含量为(0.853ʃ0.180)mg g-1ꎬ但该企业提供的生产处方无枸橼酸ꎬ提示该企业存在擅自添加辅料行为ꎮ其他企业均未检出枸橼酸ꎬ与提供的生产处方一致ꎮ3.5.3㊀葡萄糖㊁蔗糖及乳糖含量考察㊀参考文献ꎬ我们建立了高效液相色谱-示差折光法对赖氨酸磷酸氢钙颗粒中葡萄糖㊁蔗糖及乳糖含量考察[7]ꎮ对检验结果及企业处方进行分析ꎬ结果显示F企业抽检的4批样品中两批样品的总糖量分别为604和603mg g-1ꎬ低于其执行处方中蔗糖的处方量(800mg g-1)ꎬ而另外两批次总糖含量与处方量基本一致ꎮ结合这两批次装量差异均符合规定ꎬ进一步分析ꎬ该企业这两批次产品中添加了约20%的其他辅料成分ꎬ存在违规使用辅料的风险ꎮ其他各生产企业糖含量均与处方一致ꎮ3.5.4㊀淀粉㊀通过葡萄糖㊁蔗糖及乳糖含量考察发现G企业生产的两批产品糖含量显著偏低ꎬ并且在化学鉴别和溶出度考察试验中均出现大量酸不溶性沉淀ꎬ与另外有两批次产品存在显著性差异ꎬ提示该企业可能存在改变工艺处方㊁擅自改变辅料的问题ꎮ我们进一步对颗粒剂中酸不溶物进行研究ꎬ化学鉴别显示该沉淀灼烧可燃ꎬ水中加热呈半透明糊状ꎬ加碘试液变ꎬ初步推断该辅料可能为淀粉ꎮ拉曼光谱具有快速简单的特点ꎬ广泛应用于药物分析领域[8]ꎮ因此ꎬ我们进一步采用拉曼光谱进行分析ꎬ通过搜库比对两批次样品(见图16A)均与淀粉的拉曼光谱(见图16B)高度相似ꎬ相似度0.99ꎬ因此判断两批次样品中添加了淀粉ꎬ约占处方总量的20%ꎬ这与糖含量测定结果相一致ꎬ提示该企业产品批间差异显著存在变更处方中辅料情况ꎮ3.6㊀近红外光谱快检方法研究㊀近红外光谱分析技术近年来发展迅速ꎬ具有简单㊁快速和重现性好等优点ꎬ是药品的快速检测的有效方法[9]ꎮ此次我们将收集到的10家企业的167批颗粒剂样品进行近红外光谱扫描ꎮ大于等于3批的样品建立一致性检验模型ꎬ小于3批的样品建立相关系数模型ꎮ并用其他企业相同剂型相同规格的样本进行验证ꎮ结果发现G企业颗粒剂建立的一致性检验模型通过了验证(见图17)ꎬ其余9家企业都不能通过验证ꎬ结果不理想ꎮ建立的相关系数模型ꎬ都能将其他企业的样本有效地区分ꎬ模型通过验证ꎮ图15㊀D企业典型样品一级质谱和二级质谱图图16㊀G企业产品(A)与可溶性淀粉(B)拉曼光谱图图17㊀G企业近红外一致性检验模型验证㊀㊀此外ꎬ在以E等企业样本作为参照光谱分别建立一致性模型ꎬ用F企业的4批样本作为验证光谱进行验证时发现ꎬ4批次样品中有2批均区分良好ꎬ而另外2批无法有效区分(见图18A)ꎮ进一步以F企业均区分良好的2批作为参照光谱建立一致性模型ꎬ无法有效区分的2批样本光谱作为验证光谱进行验证ꎬ结果发现参照光谱和验证光谱区分良好(见图18B)ꎬ说明辽F企业不同批次检样品处方工艺存在显著差异ꎬ与辅料使用合规性研究中发现的F企业2批次颗粒剂中糖的含量仅为处方量的75%ꎬ且添加有占处方总量20%淀粉的结果相一致ꎮ图18㊀F企业近红外一致性模型比较图4 总结4.1㊀总体评价㊀通过本次抽检的167批次赖氨酸磷酸氢钙颗粒ꎬ结合现行标准检验㊁探索性研究及综合评分的结果表明ꎬ赖氨酸磷酸氢钙颗粒整体质量状况 差 ꎮ现行标准存在鉴别方法不可行㊁鉴别及含量测定方法专属性差㊁主要控制项目缺失(干燥失重)㊁限度设置不合理等问题ꎬ质量标准总体评价为 差 ꎮ本次评价抽验发现的问题主要集中在质量标准㊁处方工艺等方面ꎬ可能对药品质量的安全性㊁有效性及稳定性产生不同程度的影响ꎮ4.1.1㊀质量标准问题㊀本品种按法定标准检验ꎬ合格率均为100%ꎬ按照探索性研究方法检验ꎬ合格率为83.8%ꎬ不合格项目为干燥失重和不按处方投料ꎬ提示颗粒剂现行质量标准不能满足质量控制的要求ꎮ目前质量标准存在问题有:①现行标准缺少颗粒剂溶出度㊁干燥失重等主要控制项目ꎻ②赖氨酸鉴别与含量测定的方法专属性差㊁重现性差ꎬ无法区别其他氨基酸ꎬ测定结果不能客观反映产品中的真实含量ꎻ③颗粒剂中钙盐㊁磷酸盐鉴别方法存在干扰且灵敏度不高ꎻ④颗粒剂盐酸赖氨酸限度过宽ꎬ不能有效控制产品质量ꎮ4.1.2㊀违规违法生产问题㊀本次结合法定检验及探索性研究结果ꎬ发现以下违规违法生产问题:①G企业颗粒剂执行标准为WS-10001-(HD-0389)-2002ꎬ但其生产处方中原料投料量仅为标准处方量的20%ꎬ按照其说明书的用法用量ꎬ有效剂量偏低ꎻ②J企业21批颗粒剂中15批检出柠檬黄ꎬ与提供的生产处方不一致ꎬ擅自添加着色剂ꎻ③D企业8批颗粒剂中均检出枸橼酸ꎬ与提供的生产处方不一致ꎬ擅自添加矫味剂或抗氧剂ꎻ④F企业4批颗粒剂中2批检出淀粉ꎬ含量高达20%ꎬ提示该企业产品批间差异显著ꎬ擅自采用淀粉替代部分蔗糖投料ꎮ4.1.3㊀其他问题㊀此外我们还发现以下几个其他问题:①I企业和J企业产品包装说明书不规范ꎻ②I企业1批颗粒剂微生物限度不合格ꎬ1批干燥失重不合格ꎻ③盐酸赖氨酸㊁磷酸氢钙与蔗糖均为粗品经精制获得ꎬ粗品生产过程不在药品监管范围内ꎬ起始原料的质量不可控ꎮ4.2㊀解决问题的建议㊀针对本次抽检发现的问题我们提出以下几点建议:①建议现(下转第232页)[18]中国产业信息网.2015年我国白芍(12119021)进出口数据统计及发展情况分析[EB/OL].http://www.chyxx.com/data/jin ̄chukou/201602/389188.html.[19]中国产业信息网.2014-2018年我国白芍(12119021)进出口贸易总量及金额统计[EB/OL].https://www.chyxx.com/shuju/201812/699554.html.[20]第一中药材网.中药材白芍现在的价格多少钱一斤:2019年白芍价格预测(白芍的功效)[EB/OL].http://www.1zy.cn/jg/2574.html.[21]中药材天地网.生产预警:山西家种芍药10万亩ꎬ白芍可能严重过剩![EB/OL].https://www.zyctd.com/zixun/202/269685.html.[22]付晓莹ꎬ孙慧峰ꎬ郭慧敏ꎬ等.赤芍和白芍本质差异及未来发展的思考[J].中国现代中药ꎬ2016ꎬ18(4):452-454.[23]王甫成ꎬ时维静ꎬ汪翠妮ꎬ等.不同加工方法对亳白芍中芍药苷及水溶性浸出物含量的影响[J].中国实验方剂学杂志ꎬ2011ꎬ17(18):75-78.[24]许源ꎬ刘培ꎬ严辉ꎬ等.白芍初加工过程中单萜苷类及多羟基化合物的变化分析[J].中药材ꎬ2014ꎬ37(5):775-780.[25]黄罗生ꎬ郭健新.不同干燥和炮制方法对白芍中芍药苷含量的影响[J].现代中药研究与实践ꎬ2003ꎬ17(5):28-29.[26]李军ꎬ孟祥松ꎬ施志顺ꎬ等.白芍的传统加工工艺各环节对其芍药苷含量的影响[J].齐鲁药事ꎬ2012ꎬ31(7):395-397.[27]周丹英ꎬ余琪ꎬ钱冬伟ꎬ等.白芍药材产地加工方法研究[J].中国现代应用药学ꎬ2009ꎬ26(9):727-729.[28]胡敏伶ꎬ任江剑ꎬ王志安ꎬ等.采收期和加工方法对杭白芍中芍药苷含量的影响[J].中国现代中药ꎬ2010ꎬ12(1):27-29. [29]石雷磊ꎬ徐建.杭白芍产地初加工方法研究[J].浙江中西医结合杂志ꎬ2017ꎬ12(27):1092-1094.[30]冯鑫.亳白芍产地加工与产业化生产技术研究[D].济南:山东大学ꎬ2008.[31]周永妍.山东产芍药现代质量控制的应用研究[D].济南:山东大学ꎬ2010.[32]张博.庆阳市中药材产业发展现状调查及对策研究[D].兰州:兰州大学ꎬ2018.[33]金传山ꎬ李素亮ꎬ吴德玲ꎬ等.白芍饮片趁鲜切制产业化生产工艺研究[J].中国中药杂志ꎬ2011ꎬ36(24):3444-3448.[34]刘耀武ꎬ齐彪ꎬ王军ꎬ等.亳白芍产地加工方法调查[J].黑龙江科技信息ꎬ2016(16):51-52.[35]李磊ꎬ赵丹丹.亳州市中药产业发展现状及对策[J].现代农业科技ꎬ2014ꎬ622(8):298-300.[36]中华人民共和国国务院办公厅.中药材保护和发展规划(2015-2020年)[EB/OL].http://www.gov.cn/zhengce/content/2015-04/27/content_9662.htm.(上接第212页)行标准修订鉴别检查㊁增订缺失项目㊁采用专属性强㊁灵敏度高的鉴别和含量测定方法ꎬ设定合理的含量限度范围ꎻ②建议企业严格按照批准的处方工艺进行生产ꎬ不得擅自变更辅料ꎻ加强生产工艺质量控制ꎬ降低微生物污染风险ꎻ③建议企业加强包装材料质量控制ꎬ规范使用包装及说明书ꎻ④建议监管部门对存在问题的生产企业进行检查ꎬ以督促企业严格执行GMP及«药品管理法»的相关规定ꎻ⑤建议监管部门加强原辅料粗品的质量监管ꎬ开展原辅材料质量控制㊁工艺控制㊁产品质量检测及产品储存环境质量控制水平专项检查ꎮ参考文献:[1]㊀史春山.赖氨酸磷酸氢钙颗粒治疗老年骨质疏松症100例临床观察[J].吉林大学学报(医学版)ꎬ2007ꎬ33(5):810.[2]张亿ꎬ朱蓉ꎬ郑萍ꎬ等.邻苯二甲醛柱前衍生化HPLC法测定复方制剂中盐酸赖氨酸的含量[J].中国药房ꎬ2015ꎬ26(15):2131-2133.[3]赵英莲ꎬ牟德华ꎬ李艳.2ꎬ4-二硝基氟苯柱前衍生HPLC检测树莓中游离氨基酸[J].食品科学ꎬ2015ꎬ36(6):178-182.[4]王觉晓ꎬ李炎ꎬ龙丽娟ꎬ等.HPLC法测定硼替佐米起始合成原料3中的对映异构体杂质[J].中国药师ꎬ2018ꎬ21(11):2073-2075.[5]胡立立ꎬ杨景明ꎬ胡爽ꎬ等.高效液相色谱法测定丹参中9种非法添加的合成色素[J].锦州医科大学学报ꎬ2017ꎬ38(3):8-11.[6]周原ꎬ刘坤ꎬ代钰ꎬ等.高效液相色谱法同时测定食品中11种添加剂[J].现代商贸工业ꎬ2018(13):182-184. [7]黄菲ꎬ黄翼飞.高效液相色谱法测定烟草及烟草制品中的三种水溶性糖[J].中国烟草科学ꎬ2012ꎬ33(2):55-59.[8]曹露ꎬ朱嘉森ꎬ管艳艳ꎬ等.拉曼光谱技术在药物分析领域的研究进展[J].光散射学报ꎬ2019ꎬ31(2):101-111. [9]孙逸威ꎬ李明华ꎬ宋丽丽.盐酸左氧氟沙星片的近红外光谱法快速检测[J].中国医药工业杂志ꎬ2018ꎬ49(6):814-817.。
大家好!华人药师临床药学专题研讨会教学护理课件

针对上述案例,从临床药学的角度出 发,分析药物治疗的有效性、安全性、 经济性等方面,提出改进建议和优化 方案。
药物利用评价案例分析
药物利用评价案例
介绍一例药物利用评价的实际案例,包括药品采购、库存管理、处方审核等方 面的评价和分析。
药物利用评价案例分析
针对上述案例,从药物经济学和药品管理的角度出发,分析药物利用的合理性、 有效性、经济性等方面,提出改进建议和优化方案。
患者教育沟通案例分析
患者教育沟通案例
介绍一例患者教育沟通的实际案例,包括患者教育计划、沟 通技巧、效果评估等方面的分析和总结。
患者教育沟通案例分析
针对上述案例,从临床药学的角度出发,分析患者教育的有 效性、实用性、可行性未来展望
临床药学发展趋势与挑战
华人药师临床药学专题研讨会 教学护理课件
CONTENTS
• 华人药师临床药学概述 • 华人药师临床药学基础知识 • 华人药师临床药学实践技能 • 华人药师临床药学案例分析 • 华人药师临床药学未来展望
01
华人药师临床药学概述
华人药师临床药学定义
华人药师临床药学是指华人药师在临床实践中,以病人为中心,以药物疗效和安 全性为重点,运用药学专业知识,为病人提供合理用药指导、监测和管理的综合 性药学服务。
措施等。
沟通技巧
运用有效的沟通技巧,确保患者充 分理解药物治疗的相关信息,增强 治疗依从性。
建立良好关系
通过良好的沟通与教育,建立药师 与患者之间的信任关系,提高医疗 服务满意度。
04
华人药师临床药学案例分析
药物治疗管理案例分析
药物治疗管理案例
介绍一例药物治疗管理的实际案例, 包括患者病情、治疗方案、药物选择、 用药调整等方面的分析和决策过程。
中国药学会2019年学术会议计划
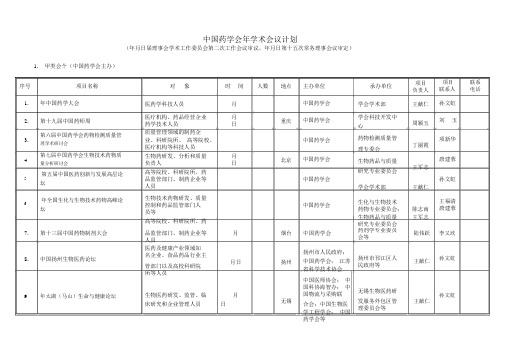
中国药学会年学术会议计划(年月日届理事会学术工作委员会第二次工作会议审议,年月日第十五次常务理事会议审定)1.甲类会个(中国药学会主办)序号项目名称1.年中国药学大会2.第十九届中国药师周第六届中国药学会药物检测质量管3.理学术研讨会第七届中国药学会生物技术药物质4.量分析研讨会第五届中国医药创新与发展高层论5.坛年全国生化与生物技术药物高峰论6.坛对象时间人数地点医药学科技人员月医疗机构、药品经营企业月重庆药学技术人员日质量管理领域的制药企业、科研院所、高等院校、医疗机构等科技人员生物药研发、分析和质量月北京负责人日高等院校、科研院所、药品监管部门、制药企业等人员生物技术药物研发、质量控制和药品监管部门人员等高等院校、科研院所、药主办单位中国药学会中国药学会中国药学会中国药学会中国药学会中国药学会承办单位项目负责人学会学术部王献仁学会科技开发中周颖玉心药物检测质量管丁丽霞理专委会生物药品与质量王军志研究专业委员会学会学术部王献仁生化与生物技术药物专业委员会;陈志南生物药品与质量王军志研究专业委员会项目联系联系人电话孙文虹刘玉项新华唐建蓉孙文虹王福清唐建蓉7.第十三届中国药物制剂大会8.中国扬州生物医药论坛9.年太湖(马山)生命与健康论坛品监管部门、制药企业等月烟台人员医药及健康产业领域知名企业、食品药品行业主月日扬州管部门以及高校科研院所等人员生物医药研发、监管、临月无锡床研究和企业管理人员日中国药学会药剂学专业委员陆伟跃会等扬州市人民政府;扬州市邗江区人中国药学会;江苏王献仁民政府等省科学技术协会中国医师协会;中国科协海智办;中无锡生物医药研国物流与采购联发服务外包区管王献仁合会;中国生物医理委员会等学工程学会;中国药学会等李又欣孙文虹孙文虹2.乙类会个(专业委员会主办)序号项目名称第三届中国药学会毒性病理专1.业委员会学术研讨会2.第十四届海洋药物学术年会中国药学会抗生素专业委员会3.学术年会对象药品、食品、化学品等相关领域的安全性评价研究毒性病理工作人员及相关人员海洋药物专业委员会委员及相关行业研究人员和学生等抗生素研究的专业人士、医生、学生、相关药学领域人员时间人数地点月下旬月广州月日上海主办单位承办单位毒性病理专业委员中国科学院上海会药物研究所中国科学院南海海洋药物专业委员海洋研究所;中国科学院热带海会洋生物资源与生态重点实验室抗生素专业委员会上海交通大学项目项目联系负责人联系人电话任进乔俊文鞠建华李国强陈代杰陈代杰第三届全国肿瘤学临床实验峰抗肿瘤药物临床研究的医月4. 师、科研机构、制药企业相北京会日关人员5. 老年药学学术研讨会老年药学科技人员月北京医药卫生领域政府部门领月6. 第三届临床中药学大会导、临床中药学等中药学相郑州日关领域专家学者年中国药学会循证药学专业委循证药学、药物流行病学、7. 医院药事管理、卫生政策、月日成都员会学术年会卫生经济学等相关专业人员8. 年中国药学会药物分析专业委高校、研究院所、药检及制月员会学术年会药企业科技人员日9. 全国药物化学学术研讨会第二中国、欧洲药物化学领域学月成都届中欧药物化学学术研讨会术、制药企业界专业人士日10. 年中国药学会药物警戒专委会生产企业、医疗机构、监测月学术年会机构相关人员药物经济学领域的专家、学11. 年中国药学会药物经济学专业者和全国医药卫生从业人员月北京委员会年会包括政府、医院及制药企业的相关工作者12. 年中国药物经济学青年学者论医药卫生从业人员包括政月北京坛府、医院及制药企业的相关抗肿瘤药物专业委员会老年药学专业委员会河南中医药大学临床中药学专业委第一附属医院;员会中国人民解放军第三二医院循证药学专业委员四川大学华西第会二医院药物分析专业委员会药物化学专业委员欧洲药物化学联会盟;四川大学药物警戒专业委员国家药品不良反会应监测中心药物经济学专业委北京大学中国卫员会生经济研究中心药物经济学专业委员会石远凯唐乐蒋建东宋丹青唐进法柏兆方张伶俐张伶俐马双成孙磊赵临襄赵临襄杨威吴桂芝刘国恩吴久鸿刘国恩吴晶序号项目名称对象时间人数地点主办单位青年学者承办单位项目项目联系负责人联系人电话中国临床研究能力提升与受试13.者保护 ()高峰论坛年中国药学会药物临床评价研14.究专业委员会学术年会生物技术药物临床研究关键技15.术研讨会创新药临床实验伦理审查与监16.督能力建设学术论坛新技术爆发期对伦理审查能力17.的挑战学术论坛年中国药学会药物流行病学专18.业委员会学术年会年中国药学会药学服务专业委19.员会学术年会暨药学服务质量和能力提升论坛20.全国药学院校教案学术研讨会第二十届药学史与本草学术研21.讨会年中国药学会医药知识产权研22.究专业委员会学术年会第届全国医院药学学术年会暨23.第届卫星会医疗机构、高等院校、药物月评价机构、制药企业等从事日药物研发相关人员药物临床研究管理、药物临月床研究、药物开发的相关人日员生物技术药物研发相关的月产、学、研相关单位科技人月员药物临床实验机构管理人员、研究者、申办者、、、医月药相关高等院校伦理委员会等药物临床实验机构管理人员、研究者、申办者、、、医月药相关高等院校伦理委员会等药师、医师及相关人员月药学领域的专家学者、医院月药师等药学院校专家领导和骨干教月师日医药领域的相关专业的专家月学者医药知识产权管理及相关法月律工作者医疗机构药师;高等院校、月研究院所及卫生行政部门专日业人员上海北京北京北京北京武汉重庆珠海长沙药物临床评价研究专业委员会药物临床评价研究专业委员会药物临床评价研究专业委员会药物临床实验伦理学研究专业委员会药物临床实验伦理学研究专业委员会药物流行病学专业委员会药学服务专业委员会药学教育专业委员会药学史专业委员会医药知识产权研究专业委员会医院药学专业委员会上海长征医院许重远陈万生首都医科大学附属北京朝阳医院西院;中国药学马迎民马迎民会《中国临床药理学杂志》军事医学科学院许重远车津晶毒物药物研究所中关村玖泰药物临床实验技术创翟晓梅王欣新联盟中关村玖泰药物临床实验技术创翟晓梅王欣新联盟武汉大学中南医院;药物流行病詹思延冼静怡学杂志社学会科技开发中安卓玲安卓玲心西南大学姚文兵樊陈琳暨南大学岭南传统中药研究中心万芳万芳等张伟波陈扬中南大学湘雅二医院;湖南省药朱珠朱珠学会序号项目名称第届全国儿科药学学术年会暨24.第届全国儿科中青年药师论文报告会第十八届全国青年药师成才之25.路论坛第九届中国药学会妇产科药学26.大会第三届中国药学会基层医院药27.学学术年会28.第七届全国眼科药学学术会议第三届中国药学会肿瘤临床药29.学论坛第十届临床药学实践与个体化30.治疗研讨会第八届中国药学会医院肿瘤药31.学大会年川藏医院药学远程学术研讨32.会第八届全国医院药学学科建设33.研讨会34.全国非公医疗药学服务研讨会35.第六届国际用药安全学术论坛创新药物成药性评价高层学术36.论坛对象儿科医师、药师及相关医护人员医院中青年药师妇产科药学专业的相关人员基层医院药学管理者、临床药师、信息药师、基层一线药师药师、临床医师及医院药学管理人员肿瘤临床药师从事医院药学相关人员肿瘤专业临床药师及相关药学人员药师、医护人员药师、医生、护士等相关人员医院药学和医药学相关专业的医院、学校、研究院所及卫生行政部门专业人员各级医疗机构药师、护士、医生及医疗管理人员药学和医学相关研究人员;新药研究和开发企业科研人员时间人数地点月兰州日月深圳日月长沙日月柳州日月太原日月北京日月苏州日月杭州日月;拉萨月成都月月成都月武汉日月北京日月杭州日主办单位承办单位医院药学专业委医院药学专业委员员会儿科药学专会业组;甘肃省妇幼保健院医院药学专业委员深圳市药学会会医院药学专业委员医院药学专业委会员会妇产科学组医院药学专业委员医院药学专业委员会基层药学学会组等医院药学专业委医院药学专业委员员会眼科药学学会组;山西省眼科医院医院药学专业委员中国医学科学院肿瘤医院国家癌会症中心医院药学专业委员苏州大学附属第会一医院医院药学专业委医院药学专业委员员会肿瘤药学学会组;浙江省肿瘤医院医院药学专业委员四川大学华西医会院医院药学专业委员四川大学华西医会院医院药学专业委员武汉亚洲心脏病会医院医院药学专业委员北京大学第三医院;北京市药学会质控中心应用药理专业委员浙江大学药学院;杭州经济技会术开发区管委会项目项目联系负责人联系人电话李智平李智平赵志刚赵志刚冯欣冯欣陈世财陈世财宫瑞中宫瑞中李国辉李国辉缪丽燕缪丽燕张艳华张艳华徐珽徐珽徐珽徐珽匡玉霞匡玉霞翟所迪刘芳杨波杨波序号项目名称37.制药工程技术创新发展论坛年中国药学会制药工程专业委38.员会学术年会姑苏对话包装创新助力医药研39.发论坛40.年生物制品年会第二届中药临床评价关键技术41.论坛一带一路传统药物资源保护与42.可持续发展研讨会年中国药学会中药和天然药物43.专业委员会学术年会中药前沿技术研讨会暨中药高44.等教育周年纪念中国药学会中医肿瘤药物与临45.床研究专业委员会年会对象时间人数地点制药企业、研究机构、药品月;月长沙法规部门人员等等制药工程及其相关领域的研月大连究开发人员日制剂企业、药包材生产企业月苏州科研人员日国内外生物药品研发、生产、月昆明质量监管及临床应用人员中旬高校、研究院所、医院、企月业和公司等从事中药临床研武汉日究与评价人员中药资源领域的科研人员、月桂林企业管理人员、研究生等。
“第五届华人药师临床药学专题研讨会”集锦

“第五届华人药师临床药学专题研讨会”集锦
阳凌燕
【期刊名称】《药学服务与研究》
【年(卷),期】2010(10)2
【总页数】2页(P101-101)
【关键词】临床药学监护;专题研讨会;药师;华人;抗肿瘤药物;抗肿瘤治疗;肿瘤科【作者】阳凌燕
【作者单位】
【正文语种】中文
【中图分类】R197.32
【相关文献】
1.关于本刊召开2008华人药师临床药学专题研讨会(CCPF2008)的通知(第1轮) [J],
2.2008华人药师临床药学专题研讨会的通知(第1轮) [J],
3.第五届世界华人药师临床药学专题研讨会南京分会场圆满成功 [J],
4.关于召开“2009华人药师临床药学专题研讨会”的通知(第1轮) [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
《中药新药与临床药理》杂志第五届编委会会议在南昌召开

《中药新药与临床药理》杂志第五届编委会会议在南昌召开佚名
【期刊名称】《中药新药与临床药理》
【年(卷),期】2004(15)6
【摘要】2004年10月30日,《中药新药与临床药理》杂志第五届编委会会议在江西南昌召开。
来自全国各地的专家、药政管理干部及企业代表共40余人参加了本届编委会会议。
江西中医学院副院长王金平教授出席了本次编委会,并致欢迎辞。
杨世林副主编主持本次会议,王宁生主任和谢培山副主编分别作了编委会和编辑部的工作总结。
【总页数】1页(PF005-F005)
【正文语种】中文
【中图分类】R
【相关文献】
1.《中药新药与临床药理》杂志第六届编委会会议纪要 [J], 本刊编辑部
2.“第五届中药新药研究与开发信息交流会暨《中草药》杂志第九届编委会”在海南省海口市召开 [J],
3.《中药新药与临床药理》第五届编委会名单 [J],
4.《中药新药与临床药理》杂志第五届编委会组成名单 [J],
5.《中药新药与临床药理》编委会成立暨第一届编委会会议纪要 [J], 黄兆胜
因版权原因,仅展示原文概要,查看原文内容请购买。
《临床药师实践》一书出版

《临床药师实践》一书出版
佚名
【期刊名称】《安徽医药》
【年(卷),期】2005(9)12
【总页数】1页(P923-923)
【正文语种】中文
【中图分类】R
【相关文献】
1.《实践与思考--七省市第十二届建筑市场与招标投标优秀论文集》一书由天津出版传媒集团、天津科技翻译出版公司出版发行 [J],
2.梅奥临床药师实践培养模式介绍及对我国临床中药师培养的启示 [J], 林志健;张冰
3.人民教育出版社推出《教育出版理论与实践》一书 [J], 傅明珠
4.《中国参与全球海洋治理的理念与实践》一书由海洋出版社正式出版发行 [J],
5.《中国参与全球海洋治理的理念与实践》一书由海洋出版社正式出版发行 [J],因版权原因,仅展示原文概要,查看原文内容请购买。
第五届亚洲药物化学联合会国际药物化学论坛将在日本召开

第五届亚洲药物化学联合会国际药物化学论坛将在日本召开佚名
【期刊名称】《中国药科大学学报》
【年(卷),期】2003(34)4
【总页数】1页(P333-333)
【正文语种】中文
【中图分类】R
【相关文献】
1.2004年中国国际矿业展览会暨国际矿业发展论坛/第二届中国矿业联合会年会将在北京召开 [J],
2.农业高效用水示范工程通过国家验收/南水北调将全面实行招投标/燃气轮机电站建设项目设备采购暨技术转让合同签字仪式在京举行/北京2008年自来水直接饮用/第三届世界水论坛开幕/第五届国际核电工业展即将在深圳举行/亚洲首家地热科普馆落成/重庆出台强制规定限制扬尘污染 [J],
3.亚洲药物化学联合会举办国际会议 [J],
4.第八届环境与发展论坛.第五届中国(国际)建设环境友好型社会成果展览会暨2012中国国际环保设备及节能产品展览会即将在浙江省义乌市召开 [J],
5.第18届国际眼科学学术会议第18届国际视光学学术会议第五届国际角膜塑形学术论坛将在上海召开 [J], 仇清晓
因版权原因,仅展示原文概要,查看原文内容请购买。
药事管理热点问题专题论坛在上海召开

药事管理热点问题专题论坛在上海召开
佚名
【期刊名称】《中国药学杂志》
【年(卷),期】2005(40)14
【摘要】由中国药学会药事管理专业委员会主办,上海市药学会、解放军药学专业委员会、第二军医大学药学院、复旦大学药学院和《药学实践杂志》社承办,上海新兴医药股份有限公司、天津天士力集团有限公司协办的“药事管理热点问题专题论坛”于2005年7月6日至9日在上海召开。
参会代表121人。
本专业委员会主任委员对开好会议提出了要求,副主任裘雪友、白慧良、闫希军等15名委员参加了会议。
资深药事管理专家吴蓬教授主持论文报告,并与中青年药事管理工作者共同交流、研讨。
【总页数】1页(P1116-1116)
【关键词】药事管理;上海市;热点问题
【正文语种】中文
【中图分类】R
【相关文献】
1.第一次全国中西医结合检验技术专题会议暨第二届京沪粤检验医学青年高峰论坛在上海市召开 [J],
2.《药事管理热点问题专题论坛》在上海举办 [J], 刘新社
3.2005年药事管理热点问题专题论坛在沪召开 [J],
4.中国药学会药事管理专业委员会关于2005年"药事管理热点问题专题论坛"的征文通知 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
2008年度全国医药学术交流会暨临床药学与药学服务研究进展培训班征文通知

2008年度全国医药学术交流会暨临床药学与药学服务研究进
展培训班征文通知
佚名
【期刊名称】《医药导报》
【年(卷),期】2007(26)10
【总页数】1页(PI0001-I0001)
【关键词】临床药学;药物学;药学服务;临床药学工作;医药
【正文语种】中文
【中图分类】R
【相关文献】
1.2008年度全国医药学术交流会暨临床药学与药学服务研究进展培训班征文通知[J],
2.2008年度全国医药学术交流会暨临床药学与药学服务研究进展培训班征文通知[J],
3.2008年度全国医药学术交流会暨临床药学与药学服务研究进展培训班征文通知[J],
4.2008年度全国医药学术交流会暨临床药学与药学服务研究进展培训班征文通知[J],
5.2008年度全国医药学术交流会暨临床药学与药学服务研究进展培训班征文通知[J],
因版权原因,仅展示原文概要,查看原文内容请购买。
本刊成功举办《药学服务与研究》杂志社青年药师沙龙

本刊成功举办《药学服务与研究》杂志社青年药师沙龙
佚名
【期刊名称】《药学服务与研究》
【年(卷),期】2009(9)3
【总页数】1页(P240-240)
【关键词】药师培训;药学服务;杂志社;上海交通大学;医院药剂科;第二军医大学;医院药学部;同济大学
【正文语种】中文
【中图分类】R192.8;R952
【相关文献】
1.倡导基于学校真实需求的理论研究——中小学管理杂志社举办“在京青年学者沙龙” [J], 孙金鑫;崔若峰;杨晓梦
2.“第八届全国药学服务与研究学术论坛暨首届全国审方药师培训班”成功举办[J], 本刊编辑部
3.《药学服务与研究》杂志社第二次青年药师沙龙成功举行 [J],
4.“第二届专科临床药师药学服务技能及病例分析论坛”和“上海市药学会2011年第一期临床药师沙龙”成功举办 [J],
5.广东省药学会举办2010年药师系列沙龙心血管及药学服务专题会议 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4 3sris f ah g n [ ] 5 tan to esJ o p
Ch n s . i e e
E] 王莉英 , s 蒋
军, 唐
震 , . 院 20 等 我 0 5年 细 菌 耐 药 性 监 测 与 分
首选 其他 敏感 药 物 , 古 霉 素 只作 为 特 殊 用 药 。经 万
干预 后 收到 明显效 果 , 半 年 的监 测 中没 有 发 现 对 下
提 出, 在肿 瘤 治 疗 之 前 , 确 定 肿 瘤 及 病 人 的 基 因 型 和 基 因 先 表 达 , 别 细 胞 毒 药 物 对 哪 些 病 人 产 生 较 高 的 毒 性 , 有 独 辨 或 特 的疗 效 , 预 测 、 化 、 导 临 床 用 药 。基 因分 析 在 乳 腺 癌 可 优 指 的 治疗 中 得 到 了 应 用 。如 美 国 学 者 对 乳 腺 癌 病 人 Onoy e ctp D x和 Ma mma r t P i 两个 基 因 系 统 的检 测 证 实 了它 们 在 预 测 n 预后 中 的价 值 , 对 治疗 应 答 的 预 测 价 值 有 待 进 一 步 的 临 床 但 试 验证 实 。 上 海 胸 科 医 院 廖 美 琳 教 授 提 出 , 非 小 细 胞 肺 癌 在
院 细 菌 耐 药 性 分 析 [ ] 中 国 抗 生 素 杂 志 , 0 8 3 ( ) 1 , J. 2 0 , 3 1 :61 9
S . 3
药或 泛 耐药 G 菌 感染 采 用 多 黏菌 素 类 与 其 他药 物
联合 治疗 。
Z o n q a Ja Be, a gW e xa g,t 1 S r el n eo h u Tig u n, i i Hu n n in e . u v ia c f a l
如小分子药物 、 甲磺 酸 伊 马 替 尼 ( 品 名 格 列 卫 ) 单 克 隆 抗 商 , 体利妥昔单抗 ( 品名 美 罗华 ) , 已在非小 细胞肺癌 、 商 等 并 慢 性髓 性 白血 病 、 性 淋 巴瘤 的 治疗 中取 得 了令 人 瞩 目的成 效 。 恶 中 国科 学 院上 海 药 物 研 究 所 丁 健 院士 在 报 告 中 提 到 , 在 对 分 子 靶 向药 物 的研 发 中 , 氨 酸激 酶 已 成 为 国际 上 各 大 制 酪 药集 团 和 研 究 机 构 关 注 的 重 要 药 靶 , 抑 制 剂 是 代 表 性 分 子 其 靶 向抗 肿 瘤 药 物 。 目前 已 有 1 o余 种 酪 氨 酸 激 酶抑 制 剂 成 功 上 市 , 小细胞肺 癌 、 在 肾癌 、 癌 等 的 治疗 中 取 得 了 较 好 的 临 肝 床 疗 效 。 目前 国 内对 于 靶 向 酪 氨 酸 激 酶 的 抗 肿 瘤 药 物 的研 究 取 得 了 一 定 的 成 果 , 广 谱 型 酪 氨 酸 激 酶 抑 制 剂 AI 8 0 如 1 3 正 在 进 行 全 面 的 临 床 前 研 究 , 已展 现 出 良好 的 应 用 前 景 。 并
E 3 时衍 同 , 守伟 , a 张 刘 伟 , . 6 等 4 9株 细 菌 耐 药 性 监 测 分 析 [] J.
山东 医 药 , 0 5 4 ( 2 : 0 4 . 2 0 , 52 )4 1
Sh n o g, a g S ou i Ii e ,e .M o t rng a d iYa t n Zh n h we , u W i ta1 ni i n o
染 管理科 及 时干 预 , 求 临 床 治 疗粪 肠 球 菌感 染 时 要
E] 何晓芳 , 4 潘 芸 . 5 4 3株 病 原 菌 监 测 及 耐 药 性 分 析 [ ] 检 验 医 J.
学 , 0 8, 3( ): 4 — 4 . 2 0 2 5 5 0 5 1
H e Xio a g, n Yun M o io i g a d d u e i t n e t s f a f n Pa . n t rn n r g r ss a c e t o
b c e i l r ss a c f o a t ra e it n e r m t e Fis Ho p t l a f it d t h rt s i fi a e o a l
肠球 菌是 医 院 内常 见 感 染 菌 , 多 种 药 物 天 然 对
耐药 。本 次监 测发 现屎 肠球 菌对 被 测药 物耐 药率 多 在 5 以上 , O 对某 些 抗菌 药 的耐 药 率 明显 高 于粪 肠
药 学 服 务 与研 究
P am a eRe 2 1 p ;1 ( ) h r C r s 0 0 A r 0 2
罗柳 荣 ,等 .10 79株 I 临床分 离 菌 的 药 敏 及 耐 药状 况 分 析 性 监 测 [] 中 国感 染 与 化 疗 杂 志 ,0 8 8 5 :2—3 . J. 2 0 ,( ) 3 53 3
析 [] 中 国药 房 ,0 7 1 ( ) l51 7 J. 2 0 ,8 2 :2 2 .
W a g I1ig,in n, n e e 1 Ba tra e itnc n yn Ja g Ji Ta g Zh n, ta . ce ilr ssa e L
万古 霉 素耐药 的粪 肠球 菌 菌株 。
对 于 突 变 型 K R S病 人 则 可 能 加 速 疾 病 进 程 。 近 几 年 受 到 A
开 。本 次研 讨 会 围绕 抗 肿 瘤 治 疗 的新 思 路 和 新 方 法 、 师 在 药 肿 瘤 治 疗 中 的作 用 及 在 肿 瘤 科 的 工 作 展 开 进 行 了 交 流 和 探 讨 , 体包 括 以 下 几 方 面 内容 。 具 1 肿 瘤 治 疗 进 入 基 于 药 物 基 因 组 学 的 个 体 化 治 疗 时代 随 着 遗 传 学 和基 因组 学 的 发 展 , 别 是 药 物 基 因组 学 研 特
W a g Fu. u De n Zh me , u Fu i i H p n,e 1 CHI t . a NET 0 7 s r e l 2 0 uvi
哌拉 西林 钠 / 唑 巴 坦钠 、 他 亚胺 培南 、 阿米 卡 星 的耐 药 率< l % 。鲍 曼不 动杆 菌对 大部 分抗 菌药物 产生 O
球 菌 。肠球 菌 对 万 古霉 素 、 莫 西林 / 拉 维 酸钾 、 阿 克 哌拉 西林钠 / 唑 巴坦 钠 敏 感 。粪 肠 球 菌 对 氨 苄 西 他
林 、 苄西 林/ 巴坦 钠 、 氨 舒 阿莫 西 林 / 拉 维 酸钾 、 克 哌
a ayi o rg ei a c f 4 9 tan o atr J . n ls f du rs tne o 6 sris fb cei ] s s a[
Sh n o g M e 2 0 4 2 : 0 4 . i s . a d n d, 0 5, 5( 2) 4 1 Ch ne e
拉 西 林 钠/ 唑 巴坦 钠 、 他 亚胺 培南 和万 古 霉 素 敏感 , 除万古 霉 素 外 其 他 药 物 可 作 为 一 线 用 药 。本 院 在 20 0 8年一 季 度监 测 到 粪 肠 球 菌 对 万 古 霉 素 耐 药 率 为 4 , 其 他 医 院 的报 道 值 相 似[ 。后 经 医 院感 与 5 j
的 治疗 中 , 物 标 志 物 如 R M 1 E C 1 B C 、 生 R 、 R C 、 R A1 TS等 已 受 到研 究 者 的 重 视 。第 二 军 医 大 学 长 海 医 院 肿 瘤 科 王 雅 杰 主 任 亦 提 到 , 床 医学 已发 展 到 “ 体 化 医 学 ” 段 , 因 检 临 个 阶 基
【 考文 献】 参
[] 汪 1 复 , 德 妹 , 付 品 , . 0 7年 中 国 C NE 细 菌 耐 药 朱 胡 等 20 H1 T
mo i r ga da ayii u o ptln2 0 E] C iaP a— nt i n n ls o r s i 0 5 J. hn h r on sn h ai
[ 文 编辑 ] 兰 本
芬
姚 春芳
“ 五届华人药师临床药学专题研讨会" 第 集锦
“ 五 届 华 人 药 师 临床 药 学 专 题 研 讨 会 一 一 肿 瘤 药 物 第 抗
临床 药 学 监 护 实 践 ” 2 1 于 0 0年 3月 1 2 日在 上 海 胜 利 召 8 0
妥 ) 野 生 型 K— S病 人 可 降 低 3 的 疾 病 进 展 风 险 , 对 RA 2 但
亚 洲 女 性 )非 吸 烟 者 , 癌 病 人 。 , 腺
2 肿瘤 的 分 子 靶 向治 疗 药 物 成 为 研 究 热 点 针 对 肿 瘤 发 生 、 展 的分 子 靶 向 药 物 的 研 发 近 年 来 呈 现 发 迅猛发展态势 , 些分 子靶 向药物 已成功研 制并 用 于f , 一 临床
( 转 第 1 4页) 下 3
测 对 于 个 体 化 治 疗 具 有 指 导 作 用 。如 一 些 研 究 发 现 , 对 结 在
直 肠 癌 的治 疗 中 , O i 方 案 + 西 妥 昔 单 抗 ( 品 6 12 3 P am aeR s 药 学 服 务 与研 究 S N 17 —8 8 hr C r e
mo h r 2 0 8( ): 2 3 . i e e wih a s r c n En l h t e , 0 8, 5 3 5 3 3 Ch n s t b t a ti g i . s
E3 周庭权 , 2 贾
蓓 , 文 祥 , . 0 6年 重 庆 医 科 大 学 附 属 第 一 医 黄 等 20
究 的 不 断 深 入 , 们 尝 试 从 基 因 水 平 认 识 疾 病 及 抗 肿 瘤 药 物 人 作 用 的 个 体 差 异 的机 制 。北 京 朝 阳 医 院药 事 部 王 鹤 尧 教 授
广泛关 注的用 于 非 小 细胞 肺癌 的 治疗 药 物 吉 非 替 尼 ( e g f ii, 品 名 易 瑞 沙 ) 对 于 E R T 功 能 区 突 变 的 病 人 inb 商 t , GF K 治 愈 率 可达 8 以 上 , o 而该 区 域 突 变 多 发 生 在 女 性 ( 别 是 特
