浸出液中钴(Ⅱ)与钴(Ⅲ)的测定
重有色冶金习题

重有⾊冶⾦习题铜冶⾦主要步骤:造锍熔炼、铜硫吹炼、⽕法精炼、电解精炼。
1.何谓造锍熔炼?造锍熔炼的⽬的是什么?定义:在1150-1250℃的⾼温下,是硫化铜精矿和溶剂在熔炼炉进⾏熔炼,炉料中的铜、硫与硫化亚铁形成液态的铜硫。
⽬的:将铜精矿中铜及其他有价⾦属(Ni、Co、Pb、Zn和贵⾦属)富集于冰铜中从⽽达到与脉⽯、部分硫铁的分离。
2.造锍熔炼时铜在渣中的损失有哪⼏种形式?并说明原因及降低渣含铜的可采取的措施。
损失形式:机械夹带、溶解两种形式。
原因:机械夹带损失是由于细颗粒冰铜未能沉降到锍层⽽夹带于炉渣中⽽引起的损失;溶解损失是由于铜的硫化物(Cu2S)及氧化物(Cu2O)溶于FeO炉渣中造成的损失,⼜分别为物理损失、化学损失。
措施:为降低渣含铜,实践中采取的主要措施是控制冰铜品位不要太⾼,渣中要有⾜够的⼆氧化硅以及良好的沉清条件和⾜够的沉清时间。
3.造锍熔炼过程中Fe3O4有何危害?⽣产实践中采⽤哪些有效措施抑制Fe3O4的形成?危害:1、Fe3O4的熔点⾼在渣中以Fe -O复杂离⼦状态存在。
当其量较多时,会使炉渣熔点升⾼,粘度增⼤,⽐重增⼤,恶化了渣与锍的沉清分离。
2、当熔体温度下降时,Fe3O4会析出沉于炉底及某些部位形成炉结,还会在冰铜与炉渣界⾯上形成⼀层粘渣隔膜层,危害正常操作。
有效措施:1.尽量提⾼熔炼温度;2.适当增加炉渣中SiO2含量;3.降低冰铜品位,控制适当的冰铜品位, 以保持⾜够的FeS量;4.创造Fe3O4与FeS和SiO2的良好接触条件。
3Fe3O4+FeS=10FeO+SO24.在吹炼过程中Fe3O4有何危害?怎样抑制其形成?危害:使炉渣熔点升⾼、粘度密度增⼤,转炉渣中Fe3O4含量较⾼时,会导致渣含铜显著增⾼,喷溅严重,风⼝操作困难。
在转炉渣回炉处理的情况下,还会给熔炼过程带来诸多问题。
抑制其形成:适当提⾼吹炼温度,勤放渣。
5.冰铜吹炼的⽬的?冰铜吹炼分哪两个阶段?并写出各阶段的主要⽅程式。
钴的物相分析知识点解说.

称取0.5g试样(溴溶液、80~100℃水浴浸取两小时)滤液(硫化物钴)残渣(盐酸-盐酸羟胺沸水浴上浸取2小时)时)滤液(氧化物钴)残渣(难溶矿物脉中的钴)钴的物相分析知识要点钴矿石物相分析,通常只测定硫化物钴、氧化物钴以及难溶矿脉中的钴。
用溴溶液分解黄铁矿、黄铜矿、方铅矿、闪锌矿等硫化矿物,以测定硫化物钴。
再采用盐酸-盐酸羟胺溶液分解赤铁矿、锰矿、针铁矿等氧化矿物,以测定氧化物钴。
用王水溶解残渣,以测定难溶脉石中的钴。
钴矿石的物相分析流程一、试剂1、溴溶液:称取溴化钠50克,溶于800毫升水中,移入1000毫升容量瓶中。
加入液体溴,剧烈摇动至有少量溴不溶为止,用水稀释至刻度。
再剧烈摇动至有少量溴不溶为止。
2、盐酸-盐酸羟胺溶液:取盐酸羟胺25克,溶于少量水中。
加盐酸300毫升,用水稀释至1000毫升。
二、分析手续1、硫化物钴的测定:称取0.5克试样,置于150毫升锥形瓶中。
加溴溶液50毫升,加盖,在80~100℃水浴上保温2小时。
取下盖子,将锥形瓶移到电热板上煮沸数分钟,赶去剩余溴。
取下,稍冷后用双层定性滤纸过滤,用水洗涤锥瓶及残渣4~5次,滤纸及残渣放回原锥瓶中留待测定氧化物钴和难溶脉石中的钴。
视钴的含量,取部分或全部滤液,加磷酸数毫升,置电热板上加热蒸发至剩有0.5~1毫升溶液,以下用亚硝基-R盐光度法进行显色,测定。
2、氧化物钴的测定:将浸取硫化物钴后的残渣及滤纸置于原锥形瓶中,加入盐酸-盐酸羟胺溶液70毫升,加盖,在沸水浴上保温2小时。
取下过滤,用水洗涤锥瓶及残渣6-8次。
视钴的含量,取部分或全部滤液,加硝酸数毫升,置电热板上加热蒸发至剩有0.5~1毫升溶液,以下用亚硝基-R盐光度法进行显色,测定。
3、难溶脉石中钴的测定:将浸取氧化物钴后的残渣及滤纸移入瓷坩埚内,低温灰化后,移入150毫升烧杯中,加氟化铵少许,用王水分解。
按亚硝基红盐比色法测定难溶脉石中的钴。
电位滴定法测定钴

电位滴定法测定钴2008-8-22 10:38:04 中国选矿技术网浏览 480 次收藏我来说两句在氨性溶液中,加入一定量的铁氰化钾,将钴(Ⅱ)氧化为钴(Ⅲ),过量的铁氰化钾用硫酸钴溶液滴定,按电位法确定终点。
其反应式如下:Co2++Fe(CN)63-→Co3++Fe(CN)64-镍、锌、铜(Ⅱ)和砷(Ⅴ)对本法无干扰。
铁(Ⅱ)和砷(Ⅱ)干扰测定,可在分解试样时,氧化至高价而消除其影响。
空气中的氧能把钴(Ⅱ)氧化成钴(Ⅲ),大量铁的存在能加速这一反应。
为防止生成大量氢氧化铁而吸附钴,须加入柠檬酸铵络合铁。
一次加入过量的铁氰化钾,用返滴定法可消除空气的影响。
锰(Ⅱ)在氨性溶液中被铁氰化钾氧化为锰(Ⅲ),因此当锰(Ⅱ)存在时,本法测得的结果系钴、锰含量。
应预先用硝酸—氯酸钾将锰分离后,再用电位滴定法测定钴。
或在含氟化物的酸性溶液中,用高锰酸钾预先滴定锰(Ⅱ)为锰(Ⅲ),由于氟化物与锰(Ⅲ)生成稳定的络合物,所以反应能定量的进行。
然后再在氨性溶液中用铁氰化钾测定钴。
有的资料认为可加入甘油和六偏磷酸钠以消除铁、空气中的氧及一定量锰的干扰,钴含量在10毫克以上时,10毫克以下的锰不影响测定。
有机物对电位滴定有严重干扰,应在分解试样时,用高氯酸除去。
本法适用于含1%以上钴的测定。
一、试剂混合溶液 100克硫酸铵和60克柠檬酸铵溶解于500毫升水中,加入氨水500毫升,混匀。
钴标准溶液称取纯金属钴克,置于250毫升烧杯中,加1∶1硝酸30毫升,加热溶解完全后,加1∶1硫酸10~15毫升,继续加热蒸发至剩少许硫酸。
冷却后,加水20~30毫升,加热溶解。
冷至室温,移入500毫升容量瓶中,用水稀释至刻度,摇匀。
此溶液每毫升含3毫克钴。
硫酸钴溶液约称取硫酸钴(CoSO4·7H2O)14克,溶解于水中并稀释至1000毫升,混匀。
此溶液每毫升约含3毫克钴。
铁氰化钾标准溶液约称取铁氰化钾克,溶于水中,用水稀释至1000毫升,混匀,贮存于棕色瓶中。
酸浸_萃取工艺从富钴结壳矿中提取钴镍铜锰

1 引 言
富钴结壳是继大洋多金属结核之后人类发现的 又一重要海底多金属矿 。与多金属结核相比 , 富钴 结壳主要赋存于水深较浅 ( 800~3000m) 的海山 、 海 脊上部斜坡上 ,富含钴 、 镍等金属 , 广泛分布于国际 海底和一些国家的专属经济区 。世界各大洋中的富 钴结壳平均含钴达 0163 %〔1〕,为多金属结核含钴的
Fig12 Effect of final p H on extraction
二氧化硫还原活化酸浸反应速度快 ,15min 内 即基本完成 ,但铁的溶出率随浸出时间的延长反而 降低 。过程释放大量反应热 , 导致体系温度迅速升 高 ,最高可升至 70 ℃。温度对有价金属的浸出影响 很小 ,但提高浸出温度对抑制铁的溶出有利 。 优化的浸出工艺条件为 : SO2 用量 01177g/ ( g 结壳 ) , 温度 30 ℃, 粒度 - 01074mm 占 77176 % , 液 固比 ( L/ S) 3mL/ g , 浸出时间 30min , 终点 p H2112 , 搅拌速度 400r/ min 。在此条件下有价金属的浸出 率 分 别 为 : Co99141 % 、Ni98110 % 、Cu92154 % 、 Mn97189 % 。 浸出渣的矿物研究表明 ,活化硫酸浸出后 ,结壳 原矿物中仅剩下化学性质比较稳定的硅酸盐类矿 物 ,而原有的富锰矿物在浸出渣中几乎全部消失 。 浸出渣的主要成分为 Fe 、Si 、Ca 、Al 等 , 各 成 分 含量为 :
但由于体系中有二氧化锰及富钴结壳带入的钠离子 存在 ,一定条件下 ,部分溶出的铁重新沉淀而返回浸 出渣中 : 3 Fe2 ( SO4 ) 3 + Na2 SO4 + 12 H2 O →
Na2 Fe6 ( SO4 ) 4 ( O H) 12 ↓+ 6 H2 SO4 2 FeSO4 + 2 H2 O + MnO2 → MnSO4 + Fe2 O3 ・ H2 O ↓+ H2 SO4
p507萃取钴的工艺流程 (3)

p507萃取钴的工艺流程
萃取钴的工艺流程主要包括以下几个步骤:
1. 矿石破碎和制粉:将含有钴的矿石进行破碎和制粉,使
其颗粒大小更加适合后续的浸出和萃取过程。
2. 浸出:将制粉后的矿石与酸溶液(通常是硫酸)进行接触,将钴和其他金属元素溶解出来形成溶液。
3. 萃取:将酸浸出溶液与有机相(通常是特定的萃取剂)
进行摇匀混合,使钴和其他金属元素萃取到有机相中形成
含钴的有机相。
4. 分离:将含钴的有机相与酸相(通常是水相)分离,通
过相分离的方式将有机相中的钴与其他金属元素分离开来。
5. 钴的还原:使用还原剂(如氨水)将有机相中的钴离子还原成钴金属,从而得到纯钴。
6. 钴的精炼:对得到的钴金属进行精炼,去除杂质,提高钴金属的纯度。
7. 钴的制品加工:将精炼后的钴金属进一步加工,制成钴合金、钴化合物等各种应用产品。
需要注意的是,不同矿石和采用的工艺流程可能会有一些差异,上述流程仅为一般性的描述。
具体的工艺流程还需要根据矿石的成分、性质和工艺要求等因素来确定。
钴的溶液浸出萃取电解法分离回收

钴的溶液浸出萃取电解法分离回收钴,作为重要的金属元素,被广泛运用于许多领域,包括电池制造、合金生产以及化工行业。
然而,钴的回收与再利用成为当今研究和关注的焦点之一。
在这个过程中,溶液浸出、萃取和电解等方法成为分离和回收钴的重要技术手段。
### 钴的溶液浸出钴通常存在于废弃电池、废旧设备或含钴矿石中。
钴的溶液浸出是指将这些含钴的物质置于溶剂中,通过化学反应将钴从固体基质中释放出来。
这个过程的效率和质量取决于溶剂的选择、温度和pH值等条件。
利用浸出技术,钴可从原始来源中被有效地提取出来。
### 萃取分离在溶液浸出的过程中,需要对混合液中的钴进行分离。
这时,萃取技术是一种关键的方法。
它通过在溶液中引入有选择性的提取剂来分离钴离子。
这些提取剂能与钴离子形成配合物,从而被分离出来。
选择合适的提取剂和调节萃取条件对于高效地分离钴至关重要。
### 电解回收萃取后得到的钴溶液需要经过电解过程来得到纯度更高的钴。
电解是将溶液置于电解槽中,施加电流使得钴离子在电极上析出,从而得到纯净的钴金属。
这个阶段的控制与操作对于生产高纯度的钴具有重要意义。
### 技术发展与前景随着科技的进步和环保意识的提高,钴的回收技术也在不断创新和改进。
有机溶剂萃取、膜分离等新技术的引入为提高钴回收率和降低生产成本提供了新思路。
此外,更加绿色和可持续的方法也在被研究,以减少对环境的影响。
### 结语钴的溶液浸出、萃取和电解法分离回收是一项复杂而关键的技术链条,对于促进资源再利用和环境保护具有重要意义。
随着科学技术的不断发展,我们可以预见这些技术会更加完善和成熟,为钴资源的高效回收和再利用提供更多可能。
通过钴的溶液浸出、萃取与电解法分离回收的过程,我们可以更好地了解这些技术在实现资源可持续利用方面的作用和重要性。
还原浸出钴萃取方法

还原浸出钴萃取方法引言:浸出钴萃取是一种常用的从含钴矿石中提取钴的方法。
通过一系列的化学和物理过程,可以将钴从矿石中分离出来,得到高纯度的钴产品。
本文将介绍浸出钴萃取的方法和过程。
一、矿石的预处理在进行浸出钴萃取之前,首先需要对矿石进行预处理。
预处理的目的是除去矿石中的杂质和有害物质,以提高钴的提取率和产品纯度。
常用的预处理方法包括破碎、磨矿和浮选等。
1. 破碎:将矿石进行机械破碎,使其颗粒度适合后续处理步骤的要求。
2. 磨矿:通过磨矿操作,将矿石细化至一定颗粒度,有利于后续的浸出过程。
3. 浮选:利用矿石中不同矿物的物理和化学性质差异,通过气体和液体的介质,使有用矿物与废石分离。
这一步骤可以大幅度提高钴的品位和回收率。
二、浸出钴的溶剂选择在浸出钴萃取过程中,选择合适的溶剂非常关键。
常用的溶剂包括盐酸、硫酸和氨水等。
这些溶剂在一定条件下可以与矿石中的钴反应,形成可溶性的配合物,从而实现钴的提取。
1. 盐酸浸出:将矿石与盐酸反应,形成可溶性的氯化钴。
盐酸浸出的优点是操作简单,成本较低,但可能伴随着一些副反应,导致产品纯度下降。
2. 硫酸浸出:将矿石与浓硫酸反应,形成可溶性的硫酸钴。
硫酸浸出的优点是溶剂选择范围广,可以适应不同类型的矿石。
但硫酸浸出过程中可能会产生大量的废酸,对环境造成一定的污染。
3. 氨水浸出:将矿石与氨水反应,形成可溶性的氨合钴配合物。
氨水浸出的优点是反应速度快,可溶性产物易于分离。
但氨水对环境的影响较大,需要进行废水处理。
三、浸出钴的操作条件在进行浸出钴萃取过程中,操作条件的选择对提取效率和产品质量有重要影响。
1. 温度:温度可以影响反应速率和平衡。
一般情况下,提高温度有利于提高钴的提取率,但过高的温度可能导致副反应的发生。
2. pH值:pH值对钴的溶解度有影响。
不同的矿石和溶剂选择需要不同的pH值范围。
3. 反应时间:反应时间可以影响钴的提取率和产品质量。
通常情况下,适当延长反应时间有利于提高钴的提取率。
钴、镍萃取分离原理与方法

钴、镍萃取分离原理与方法目前,钴镍冶金原料已由以前的硫化钴镍矿逐渐转为钴镍杂料、钴镍氧化矿(含钴、镍红土矿)等,处理工艺由传统的火法造锍、湿法分离相结合转为浸出、净化全湿法流程。
钴镍原料来源不一,浸出液成分复杂,沉淀、离子交换工艺难以实现钻、镍及钴镍与钙、镁等其他杂质离子的分离。
溶剂萃取法有选择性好、金属回收率高、传质速度快等优点,尤其根据离子性质差异及萃取理论研发的新萃取剂及萃取体系,更优化了萃取效果。
所以,从根本上找出钴、镍性质的差异,分析现有钴、镍分离工艺原理,对新萃取剂和萃取工艺的开发有指导意义。
一、钴、镍性质区别钴镍原子序数相邻,同为第四周期第Ⅷ族元素,仅外层d电子数不同,这种性质上的差异可用于萃取法分离。
(一)晶体场配位理论分析钴镍性质差异1、钴镍轨道简并钴、镍比较常见的配位数为4和6。
配位数为6时,配体呈八面体型。
由于配体之间的位置不同,5个轨道简并为2组,电子与配体顶头接近的d z2、d x2-y2作用强烈,能量较高,为6Dq;而另外的d xy、d yz、d zx轨道作用力弱得多,能量较低,为-4Dq。
配位数为4时,配体可以形成平面四方形或正四面体构型。
萃取剂的分子量较大,分子间存在较大的空间位阻,所以一般为正四面体构型。
同样,四面体场亦发生简并,但是与八面体场完全相反,d xy、d yz、d zx轨道能量较高,为1.78Dq,而d z2、d x2-y2的轨道能量较低,为-2. 67Dq。
2、钴镍轨道电子排布电子在轨道的排布遵循能量(CFSE)最低原则,其中成对的电子还需要克服能量为P或P’的成对能。
按这个规则,电子排布与对应能量大小如表1。
表1 钴镍离子不同配位数时对应的能量可以看出:6配位正八面体的稳定性大于4配位正四面体的稳定性。
Ni(Ⅱ)的6配位八面体的稳定性远大于四配位四面体的稳定性,而Co(Ⅱ)的6配位八面体的稳定性仅略强于四配位四面体的稳定性,所以,溶液中Ni(Ⅱ)仅有6配位存在,而Co(Ⅱ)的6配位或4配位都可以存在。
富钴结壳浸出液中钴镍的N235萃取分离

基金项 目: 国家大洋协会。 十一五 攻关项 目( Y 0 — 4 0 — ) D 15 0 — 1 4
的萃取曲线 , 25萃取金属离子能力的大小顺序为 N3 Z2 n >F 3 >C 2 e u >C 2 >F 2 N n , 液 中 o e > i 溶
氯化物溶 液 中的 c 2 子能与 溶液 中 的氯 离子 o 离
载有 机相 盐酸反 萃 , 到氯 化镍 和氯 化钴 的混 合液 , 得
是行 之有 效 的工 艺 。
形成 络合 阴离子 [。 ] , Ga4卜 而镍难 以形 成络阴离子 , 呈 阳离子状态存在 , 故不被 N 3 萃取 , 25 留于水相 中 , 根据 这一特 点可 实 现 钴 与镍 的 萃取 分离 , 反应 为 2 3 RN+
N2 5属 于 叔 胺 类 碱 性 阴 离 子 萃取 剂 , 3 是 ~ C 为 主 的 混 合 脂 肪 胺 ( 异 辛 胺 ) 叔 胺 的含 量 在 m 三 , 9 %以上 , 业 品为 淡 黄 色液 体 , 型物 化 性 质 为 : 7 工 典
分子 量为 3 9 密 度 0 8 5 /m3 沸 点 1 0 6 " 4, .1 g c , 8 -2 0 C, 黏度 1 0 .4×1 P ・ , 0 a S 表面 张力 2 8 N/ , .2 m2 在水 中 溶 解 度 0 0 g L 。 . 1 / EI 2
维普资讯
第5 8卷
第 3期
有
色
金
属
Vo . 8, No. 15 3
Au u t 2 0 0 6 g s
2 0 0 6 年 8 月
NOle" U i l' ¥M e as f I O tl
2020高考化学大题专项训练《化学工艺流程题(2)》及答案解析
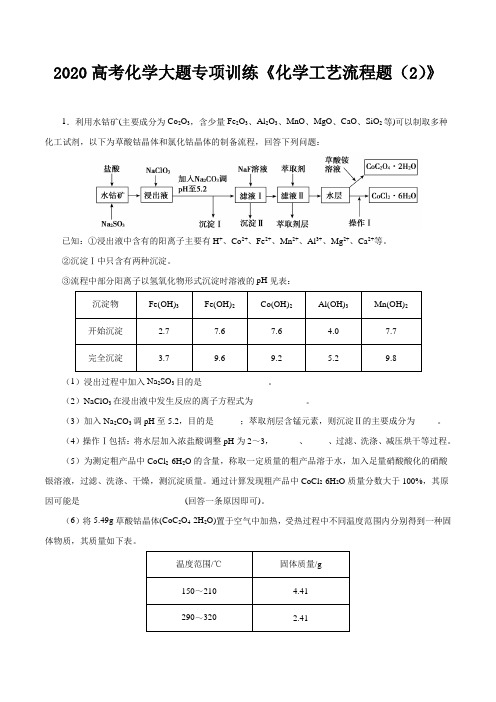
2020高考化学大题专项训练《化学工艺流程题(2)》1.利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:沉淀物Fe(OH)3Fe(OH)2Co(OH)2Al(OH)3Mn(OH)2开始沉淀 2.7 7.6 7.6 4.0 7.7完全沉淀 3.7 9.6 9.2 5.2 9.8 (1)浸出过程中加入Na2SO3目的是_______________。
(2)NaClO3在浸出液中发生反应的离子方程式为____________。
(3)加入Na2CO3调pH至5.2,目的是______;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为_____。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,______、_____、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。
通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是________________________(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃固体质量/g150~210 4.41290~320 2.41经测定,整个受热过程,只产生水蒸气和CO 2气体,则290~320℃温度范围,剩余的固体物质化学式为____。
[已知:CoC 2O 4·2H 2O 的摩尔质量为183g·mol −1] 【答案】(1)将Fe 3+、Co 3+还原(2)ClO 3-+6Fe 2++6H +=Cl -+6Fe 3++3H 2O (3)使Fe 3+和Al 3+沉淀完全 CaF 2和MgF 2 (4)蒸发浓缩 冷却结晶(5)粗产品中结晶水含量低(或粗产品中混有氯化钠杂质) (6)Co 3O 4(或CoO·Co 2O 3) 【解析】(1)、浸出过程中,Co 2O 3、Fe 2O 3与盐酸、Na 2SO 3发生反应,Co 2O 3转化为Co 2+,Fe 2O 3转化为Fe 2+,Co 、Fe 元素化合价降低,则S 元素化合价升高,SO 32-转化为SO 42-,故答案为:将Fe 3+、Co 3+还原;(2)、NaClO 3加入浸出液中,将Fe 2+氧化为Fe 3+,ClO -被还原为Cl -,反应的离子方程式为:ClO 3-+6Fe 2++6H +=Cl -+6Fe 3++3H 2O -;(3)根据工艺流程图结合表格中提供的数据可知,加Na 2CO 3调pH 至5.2,目的是使Fe 3+和Al 3+沉淀完全。
广东省韶关市昌乐一中北大公学高中2022-2023学年高三上学期期末质量检测化学试卷

昌乐一中北大公学高中高三上学期质量检测化学试题考试时间:90分钟;可能用到的相对原子量 H1 C 12 N14 O 16 S 32 Cl 35.5 Fe56 Zn65 Sb122 一、选择题:本题共10小题,每小题2分,共20分。
每小题只有一个选项符合题目要求。
1.研究发现:将2CO 溶解到含液态镓(Ga )纳米颗粒的溶剂中,再加入含纳米颗粒的固体银棒,搅拌即可引发电化学反应。
将2CO 分解成2O 和()C s ,下列有关说法错误的是 A .上述过程涉及氧化还原反应 B .上述过程涉及2种能量转化形式 C .该技术有利于“碳中和、碳达峰” D .上述分解2CO 的分散系属于胶体2.下列说法不正确...的是 A .葡萄糖、蔗糖、纤维素都是糖类物质,都可发生水解反应 B .天然植物油中不饱和脂肪酸甘油酯含量高,常温下呈液态 C .氨基酸、二肽、蛋白质均既能与强酸又能与强碱反应D .淀粉水解液加足量碱后,再加新制氢氧化铜浊液,加热,产生砖红色沉淀3. 海带中含有碘元素,可通过以下步骤提取碘单质:①灼烧;②溶解;③过滤;④氧化;⑤萃取分液等。
以上步骤不需要用到的仪器是A. B. C. D.4.尿素()和甲醛在一定条件下发生类似苯酚和甲醛的反应得到线型脲醛树脂,再通过交联形成网状结构,网状结构片段如下图所示(图中表示链延长)。
下列说法不正确...的是 A .形成线型结构的过程发生了缩聚反应 B .网状脲醛树脂在自然界中不可能发生降解 C .线型脲醛树脂结构简式可能是:D .线型脲醛树脂能通过甲醛交联形成网状结构5.元素H、C、N可组成多种杂环化合物,例如(吡啶)、(吡咯),下列说法错误的是A.电负性:H C Nsp杂化<<B.中,N为2C.、都难溶于水D.、都含有π键6.NiS具有热缩冷胀的特性,在精密玻璃仪器中掺杂NiS能抵消仪器的热胀冷缩。
实验室将H2S通入稀硫酸酸化的NiSO4溶液中,制得NiS沉淀,装置如下图所示。
高三化学下学期工艺流程题专练(附答案)

高三化学下学期工艺流程题专练一、单选题1.碘循环工艺不仅能吸收2SO 降低环境污染,同时又能制得氢气,具体流程如下:下列说法错误的是( )A.分离器中的物质分离操作为过滤B.反应器中,控制温度为20~100℃,若温度过低反应速率慢,温度过高水汽化且增大碘的流失C.该工艺中2I 和HI 的相互转化体现了“碘循环”D.碘循环工艺的总反应为22242SO 2O H H H SO +==+2.某兴趣小组利用硫酸厂产生的烧渣(主要含Fe 2O 3、FeO,还有一定量的SiO 2)来制备FeCO 3,其流程如图:已知:①FeS 2不溶于稀硫酸;②“还原”时,Fe 3+通过两个反应被还原,其中一个反应为 FeS 2 +14Fe 3+ +8H 2O =15Fe 2+ + 22-4SO +16H +。
下列说法不正确的是( )A.“还原”时另一个反应的离子方程式为2Fe 3+ + FeS 2==2S + 3Fe 2 +B.“还原”后可以用KSCN 检验Fe 3+是否反应完全C.流程中多次进行过滤,过滤所用的玻璃仪器为烧杯、漏斗、胶头滴管和玻璃棒D.所得FeCO 3需充分洗涤,可以用稀盐酸和BaCl 2溶液检验 FeCO 3是否已洗涤干净3.用软锰矿(主要成分是MnO 2)和黄铁矿(主要成分是FeS 2)为主要原料制备高性能磁性材料碳酸锰(MnCO 3)。
其工艺流程如下图。
[已知:①净化工序的目的是除去溶液中的Ca 2+、Cu 2+等杂质;②CaF 2难溶]。
下列说法不正确的是( )A .研磨矿石、适当升高温度均可提高溶浸工序中原料的浸出率B .除铁工序中,在加入石灰调节溶液的pH 前,加入适量的软锰矿,发生的反应为2++3+2+22MnO +2Fe +4H =2Fe +Mn +2H O C .副产品A 的化学式为(NH 4)2SD .从沉锰工序中得到纯净MnCO 3的操作方法是过滤、洗涤、干燥4.当今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率,将钛厂、氯碱厂、甲醇厂进行联合生产。
钴含量的实验报告

一、实验目的1. 了解钴元素在样品中的含量。
2. 掌握原子吸收光谱法测定钴含量的原理和方法。
3. 培养实验操作技能和数据处理能力。
二、实验原理原子吸收光谱法(AAS)是一种利用原子蒸气对特定波长的光产生吸收,根据吸光度的大小来定量分析样品中钴含量的方法。
该方法具有灵敏度高、选择性好、干扰少等优点。
三、实验仪器与试剂1. 仪器:原子吸收光谱仪、钴空心阴极灯、样品池、移液器、电子天平等。
2. 试剂:钴标准溶液(1μg/mL)、硝酸、盐酸、氢氧化钠、水等。
四、实验步骤1. 样品处理a. 称取一定量的样品(例如0.1g),加入适量的硝酸和盐酸,溶解后定容至50mL。
b. 将溶液过滤,取适量滤液,加入适量的氢氧化钠,调节pH值至6-7,煮沸5分钟,冷却后定容至50mL。
2. 标准溶液配制a. 分别取0.5mL、1.0mL、2.0mL、3.0mL、4.0mL的钴标准溶液,加入适量的硝酸和盐酸,定容至50mL,配制成不同浓度的标准溶液。
b. 在原子吸收光谱仪上,以钴空心阴极灯为光源,测定标准溶液的吸光度。
3. 样品测定a. 将处理好的样品溶液和标准溶液依次注入原子吸收光谱仪中,测定其吸光度。
b. 以标准溶液的吸光度为横坐标,浓度为纵坐标,绘制标准曲线。
4. 数据处理a. 根据样品溶液的吸光度,从标准曲线上查得对应的钴浓度。
b. 计算样品中钴的含量。
五、实验结果与分析1. 标准曲线绘制标准溶液的吸光度与浓度呈线性关系,相关系数R²=0.996。
2. 样品测定样品溶液的吸光度为0.506,从标准曲线上查得钴浓度为0.45μg/mL。
3. 结果计算样品中钴的含量为:0.45μg/mL × 50mL /0.1g = 2250μg/g。
六、实验讨论1. 实验过程中,应注意控制溶液的pH值,以保证钴元素在溶液中的稳定性。
2. 在样品处理过程中,要避免引入杂质,以免影响测定结果。
3. 实验结果与理论值基本相符,说明本实验方法可行。
转炉渣富钴镍浸出液镍钴分离工艺研究

转 炉渣 富 钻镍 浸 出液 镍 钴 分 离 工 艺 研 究
王 玉华 , 朱纪念 , 刘 同银
( 金 川集 团公 司 镍 钻 研 究设 计 院 , 甘 肃金 昌 7 3 7 1 0 0 )
摘要 : 以某 厂 镍 电 解 生 产 净 化 工 序 氯 气 除 钻 产 生 的钴 渣 为 氧 化 剂 , 除去 转 炉 渣 浸 出液 电积 脱 铜 后 液 中 的 钴, 实 现 转 炉 渣 富 钴 镍 浸 出液 中镍 钴 分 离 。结 果 表 明 , 在 钴 渣 含 三 价 镍 与钴 量 摩 尔 比为 4 ~5 , 反 应 温 度
中 图分 类 号 :T F 8 1 6 文 献标 志 码 : A 文章 编 号 : 1 0 0 7 - 7 5 4 5 ( 2 0 1 3 ) 0 4 - 0 0 1 7 — 0 3
Pr o c e s s St u d y o n S e pa r a t i o n o f Ni c k e l a n d Co b a l t i n
Ke y wo r d s : n i c k e l e l e c t r o l y s i s ;c o b a l t c h l o r a t i o n r e mo v i n g;c o b a l t s l a g;s e p a r a t i o n o f n i c k e l a n d c o b a l t
Ab s t r a c t : I n o r d e r t o s e p a r a t e c o b a l t f r o m c o b a l t — r i c h n i c k e l l e a c h i n g s o l u t i o n o f c o n v e r t e r s l a g,c o b a l t s l a g p r o d u c e d f r o m n i c k e l e l e c t r o l y s i s p u r i f i c a t i o n p r o c e s s o f c o b a l t r e mo v i n g wi t h c h l o r i n e wa s a p p l i e d a s o x i d i — z i n g a g e n t t o r e mo v e t h e c o b a l t f r o m c o p p e r r e mo v a l s o l u t i o n o f c o n v e r t e r s l a g l i x i v i u m. Th e r e s u l t s s h o w t h a t mo l e r a t i o o f n i c k e l a n d c o b a l t i n s e c o n d a r y c o b a l t s l a g i s d e c r e a s e d t o 1 ~ 1 . 5 u n d e r t h e f o l l o wi n g c o n —
钴的溶液浸出萃取法分离回收

钴的溶液浸出萃取法分离回收钴是一种重要的金属元素,常见于各种矿石和废弃物中。
随着工业的发展和钴的广泛应用,对于其分离和回收的方法变得至关重要。
溶液浸出萃取法是一种有效的技术,能够从废弃物或矿石中分离和回收钴,为环保和资源再利用提供了重要的手段。
### 钴的重要性及现状钴是一种重要的工业金属,广泛应用于电池制造、合金生产和化工等领域。
然而,钴资源的开采和利用一直备受关注。
钴矿石中往往伴随着其他金属元素,如镍、铜等,使其提取变得复杂。
在回收利用过程中,传统的分离方法可能存在效率低、环境影响大等问题。
### 溶液浸出原理溶液浸出是一种重要的分离技术,通过将固体物质置于溶剂中,使目标物质从固体中转移到溶液中的方法。
在钴的回收中,该方法通过溶解钴矿石或废料,将其中的钴溶于特定的溶剂中,以实现分离和回收。
### 溶出过程在溶出过程中,首先选择合适的溶剂,通常为有机酸或氨水等。
将钴矿石或废料与溶剂充分接触,利用溶剂的选择性将钴从其他金属元素中分离出来。
这一过程需要控制合适的温度、压力和溶液浓度,以提高分离效率。
### 萃取与分离随后,利用萃取方法将含钴溶液从其他溶液中分离出来。
萃取方法包括有机溶剂萃取、离子交换、萃取树脂等,通过不同物质间的相互作用,使钴与其他物质分离,最终得到纯度较高的钴溶液。
### 回收与应用获得高纯度的钴溶液后,可通过化学还原、电解等方法,将其中的钴还原出来。
这些回收的钴可以广泛应用于电池、合金、催化剂等工业领域,实现资源的可持续利用。
### 环保与可持续性相比传统的矿石开采,溶液浸出的钴回收方法对环境影响较小。
该方法能够减少对自然资源的过度开采,减少矿石废弃物对环境的污染,符合可持续发展的理念。
### 结语钴的溶液浸出萃取法分离回收作为一种环保、高效的技术,为钴资源的回收提供了重要途径。
该方法在工业应用中具有广阔前景,不仅有助于资源的可持续利用,也有利于环境保护和生态平衡的维护。
钴的浸出电解法分离回收

钴的浸出电解法分离回收钴是一种重要的工业金属,广泛应用于电池、合金、催化剂等领域。
然而,目前大多数钴资源依赖于有限的天然矿石,面临着日益紧张的供应压力。
因此,开发有效的钴回收和分离技术,对于实现钴资源的可持续利用具有重要意义。
其中,钴的浸出电解法作为一种常用的分离回收方法,具备着广阔的应用前景。
本文将就钴的浸出电解法的原理、工艺流程、优缺点以及最新研究进展进行探讨。
一、钴的浸出电解法原理钴的浸出电解法是通过化学方式将锅炉炉渣中的钴以离子形式溶解出来,再经过电解法将溶解的钴离子还原为钴金属。
该方法主要基于钴离子在电解质溶液中的特殊电化学性质,通过调节溶液的pH值、电流密度、温度等参数,实现钴离子的溶解和电还原。
二、钴的浸出电解法工艺流程(1)浸出过程:首先将钴矿石破碎,然后经过浸出剂处理,使其中的钴溶解为钴离子。
浸出过程中,常用的浸出剂有硫酸、氯化钠等。
浸出时间和温度的控制十分重要,可以通过实验确定最佳的工艺条件。
(2)电解过程:将浸出液装入电解槽中,作为阳极法还原钴离子。
通过施加恰当的电流密度,在电解质溶液中生成大量的氢气和金属钴,实现钴的回收和分离。
电解过程中,要注意控制电流密度、电解温度等因素,以提高电解效率和产物纯度。
三、钴的浸出电解法的优缺点(1)优点:a. 钴的浸出电解法能够高效地回收和分离钴金属,具有较高的原子利用率。
b. 工艺流程相对简单,易于操作和控制。
c. 可以适应不同来源的钴矿石,对原料要求较低。
d. 回收的钴金属质量优良,可直接用于工业应用。
(2)缺点:a. 浸出电解法的过程中产生大量废液,对环境造成一定的负面影响,需要进行有效的废液处理。
b. 电解槽中的电极材料容易受到钴离子的腐蚀,导致电极寿命减短,增加了生产成本。
c. 电解过程中会产生氢气,需要进行合理处理避免安全隐患。
四、钴的浸出电解法的最新研究进展近年来,为了进一步提高钴的浸出电解法的效率和环境友好性,研究人员提出了一系列的改进方法。
用P204从废锂电池酸浸液中萃取钴试验研究

Vol. 39 No. 6(Sum. 174)Dec. 2020第39卷第6期(总第174期)2020牟12月湿法冶金 .Hydrometallurgy of China 用P204从废锂电池酸浸液中萃取钻试验研究王敏1,宋亦诚2,康立武1(1.湖北工程职业学院,湖北黄石435000;2.上海大学力学与工程科学学院,上海200444)摘要:研究了以P204为萃取剂从废锂电池酸浸液中萃取钻,考察了有机相皂化率、P204体积分数、相比 (Vo/V.).水相初始pH 对萃取的影响及硫酸溶液反萃取钻的效果。
结果表明:在有机相皂化率70%、有机相 组成25%P204 + 5%TBP+70%磺化煤油、V o /V a = 2/1,水相初始pH = 3. 5条件下,Co 2+萃取率为97. 91%;负载有机相用2 mol/L 硫酸溶液反萃取20 min,Co 2+反萃取率达94.77%,获得较纯Co*溶液。
关键词:废锂电池;酸浸液;P204;溶剂萃取;钻 中图分类号:TF816;TF804.2文献标识码:A DOI : 10. 13355/j. cnki. sfyj. 2020. 06. 009废锂电池中含有大量钻(10%〜30%)等有价 金属,是重要的二次资源目前,从废锂电池 中回收金属钻的方法主要有沉淀法〔注'、离子交换 法页、电积盐析法⑷、溶剂萃取法⑷等。
其中,溶剂萃取法操作简单,金属回收率高,得到的产物纯 度高直接用P204萃取除杂,所得萃余液再经P204三级萃取,钻回收率可达99%;用KMnO 4从还原浸出液中沉淀猛,随后用丁二酮选择性提取锦,最后溶剂萃取钻,钻可以得到有 效回收何。
TBP 对P204有协同萃取作用⑴」,但用P204+TBP +磺化煤油协同体系萃取钻的研 究却不多。
因此,研究了采用此体系从废锂离子 电池酸浸液中萃取钻,以期为从废锂电池中回收钻提供一种可供选择的方法。
1试验部分1.1试验原料试验料液:废锂电池取自某废锂电池拆解厂,经放电、剥除外壳后破碎、球磨、筛分制成含钻料 粉。
超声波强化有机酸浸出废旧锂离子电池中钴的实验研究

广东化工2021年第9期·48·第48卷总第443期超声波强化有机酸浸出废旧锂离子电池中钴的实验研究钱王,张婉玉,董慧娴,施红*(荆楚理工学院化工与药学院,湖北荆门448000)Experimental Study on Ultrasonic Leaching of Cobaltfrom Waste Lithium-ion Battery with Organic AcidQian Wang,Zhang Wanyu,Dong Huixian,Shi Hong*(College of Chemical Engineering and Pharmacy,Jingchu University of Technology,Jingmen448000,China)Abstract:The cathode material in the waste lithium-ion batteries contain a large amount of valuable metals such as Co,Li,Mn.Recycling valuable metals from waste lithium-ion batteries can reduce the pollution caused by the waste lithium-ion batteries and improve the utilization rate of the waste lithium-ion batteries In this paper,Ultrasonic enhanced leaching of cobalt from waste lithium-ion battery was studied.The leaching parameters such as effects of ultrasonic time,citric acid concentration,H2O2concentration,ratio of solid to liquid,ultrasonic power,have been analyzed and compared on the leaching rate.The result indicates that the leaching of cobalt from waste lithium-ion battery with citric acid and hydrogen peroxide can be effectively promoted by ultrasonic enhanced leaching technology.Keywords:Ultrasonic;Strengthening leaching;Waste lithium-ion battery;Citric acid;H2O22020年10月国务院办公厅印发的《新能源汽车产业发展规划(2021~2035年)》中指出,到2025年新能源汽车新车销售量将达到汽车新车销售总量的20%左右,到2035年纯电动汽车将成为新销售车辆的主流,燃料电池汽车实现商业化应用[1]。
钴的溶液浸出蒸馏法分离回收

钴的溶液浸出蒸馏法分离回收钴是一种重要的金属元素,广泛应用于电池、合金、催化剂等领域。
为了获取高纯度的钴,分离和回收是必要的步骤之一。
在本文中,我们将探讨一种用于分离和回收钴的有效方法,即钴的溶液浸出蒸馏法。
**1. 引言**钴的溶液浸出蒸馏法是一种基于物理化学原理的分离技术,它适用于含有钴的复杂混合物,如矿石或废料。
该方法的核心思想是利用钴在不同温度下的挥发性差异,通过蒸馏将钴从其他成分中分离出来。
下面我们将详细介绍该方法的步骤和原理。
**2. 实验步骤****2.1 溶液制备**首先,需要准备含有钴的溶液。
这可以通过酸性浸出、矿石处理等方式来获得。
确保溶液中的钴浓度足够高以便有效分离。
**2.2 蒸馏装置**建立一个蒸馏装置,包括加热源、冷凝器和收集器。
这些组件将协同工作以实现钴的蒸馏和收集。
**2.3 加热和蒸馏**将含有钴的溶液加热至一定温度,通常在钴的挥发温度以下。
在这个温度下,钴会从溶液中蒸发出来。
蒸馏过程中,确保采取适当的安全措施,以防止有害气体的泄漏。
**2.4 冷凝和收集**蒸发的钴气体会通过冷凝器冷却并凝结成液体形式。
这些液滴将被收集到一个容器中,形成纯钴的溶液。
**2.5 溶剂回收**在分离出钴后,可以将残余的溶剂回收以减少浪费。
这可以通过再次加热回收系统中的溶剂来实现。
**3. 原理解析**钴的溶液浸出蒸馏法依赖于钴的挥发性。
在加热的作用下,钴离子将从液相转化为气相,并通过蒸馏过程分离出来。
其他组分,如杂质和废料,则通常不会在相同的温度下挥发,从而实现了有效的分离。
**4. 应用领域**这种分离和回收方法在钴的生产和回收过程中广泛应用。
它可以用于从废旧电池、废料金属、矿石中提取和回收钴。
此外,钴的溶液浸出蒸馏法也在催化剂制备中发挥重要作用。
**5. 结论**钴的溶液浸出蒸馏法是一种有效的分离和回收方法,可用于从复杂混合物中提取高纯度的钴。
通过掌握该方法的原理和步骤,我们可以更好地利用这一重要金属元素,减少资源浪费,推动可持续发展。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
书山有路勤为径,学海无涯苦作舟
浸出液中钴(Ⅱ)与钴(Ⅲ)的测定
一、方法概述在炼钴过程的氨性浸取液中,钴以二价和三价状态存在,二者的某些化学性质有明显差别。
Co(Ⅲ)能与氨形成很稳定的络合物
[Co(NH3)6]3+(Ka=2.2×10-34),此络合物甚到与EDTA 都不起作用;而Co(Ⅱ)则无比种性质。
因此,在pH5-6 的介质中,加入过量的EDTA 标准溶液,以二甲酚橙作指标剂,用锌标准溶液进行回滴,即可测得Co(Ⅱ)之含量。
另取一份浸
出液,用酸处理,Co(Ⅲ)即呈二价状态,再按同一方法测得Co(Ⅱ)与Co(Ⅲ)的
合量。
镍和铁存在时,对本法有干扰,可在滴定前加入Na2S2O3 和NH4F 予以掩蔽。
镍的存在与EDTA 能定量起反应,应取三份试液进行滴定:其一测定Ni(Ⅱ)与Co(Ⅱ)的合量;其二加酸处理,使Co(Ⅲ)转为Co(Ⅱ)之后,测定
Ni(Ⅱ)、Co(Ⅲ)的合理,其三加入NH4F 和(NH4)2S2O8,加热煮沸,使钴均氧化为三价状态之后,再测定镍的含量。
然后即可从这三份试液测定的结果,用
差减法分别计算出Co(Ⅱ)和Co(Ⅲ)的含量。
在本法的条件下,大部分元素不干扰。
其中Mn2+、Cr6+(>3mg)、Pb2+、Bi3+(>2mg)和Sb3+(>10mg)使结果偏高;CaO(>10mg)、Cr3+(>8mg)和MgO(>2mg)使结果偏低;Zn 是定量干扰,Cd 也是正干扰。
二、分析步骤Ni(Ⅱ)与Co(Ⅱ)含量的测定取适量浸出液置于锥形交互瓶中,加入20mL100g/L NH4HF2 溶液,用H2SO4(1+1)的氨水(1+1)调节试液为pH5-6,加10mL 乙酸-乙酸钠缓冲溶液,10mL Na2S2O3 溶液,摇匀,准确加穰过量EDTA 标准溶液,用锌标准溶液滴定。
Ni(Ⅱ)的测定同前取试液,加入NH4HF2,调节pH5-6,加入缓冲溶液,再加入5mL100g/L (NH4)2S2O8 溶液,加热煮沸3min,冷却,加入10mL Na2S2O3 溶液,以下步骤同Ni(Ⅱ)gn Co(Ⅱ)合量的测定步骤。
Ni(Ⅱ)、Co(Ⅱ)与Co(Ⅲ)合量的测定同前取试液,加入5mL H2SO4,加热冒烟,冷却,用少量溶解盐类,以下步骤。
