大学化学第四章_计算
大学无机化学第四章 酸与碱

酸碱质子理论的优点
与电离理论相比,扩大了酸和碱的范围。如NH4Cl
与NaAc,在电离理论中认为是盐,而质子理论认 为NH4Cl中的NH4+是酸, NaAc中的Ac-是碱。
• 酸碱反应是质子传递过程,符合这种要求的反应都
可划归为酸碱反应,从而扩大了酸碱反应的范围。
• 建立了酸碱强度和质子传递反应的辨证关系,把酸
二、 酸-水、碱-水质子传递
弱酸
HA + H2O HA
Ka
H3O+ + A H+ + A
可简写为 平衡常数
H / c A / c
HA/ c
c 1mol L1
Ka,HA
K a 酸度常数,acidity constant
弱碱
B + H2O
BH+ + OH
实质: 两对共轭酸碱对之间的质子(H+)传递反应。
第一节 质子酸碱概念
(1) 电离作用:
H+ HCl + H2O ≒H3O+ + Cl-
酸1 碱2 酸2 碱1
H+ (2) 中和反应: H3O+ + OH- ≒ H2O + H2O 酸1 碱2 酸2 碱1
H+ (3) 水解反应: H2O + Ac- ≒ HAc + OH- 酸1 碱2 酸2 碱1
酸碱的分类
一元弱酸、弱碱 多元弱酸、弱碱 两性物质
第三节 酸碱平衡中的浓度计算
一、一元弱酸、弱碱
例:试计算浓度为c的弱酸HA水溶液的[H+]。 解: (1) 忽略水的质子自递平衡,则: HA ⇋ H+ + A– 起始浓度: c 0 0 电离浓度:[H+] [H+] [H+] 平衡浓度: c - [H+] [H+] [H+]
大学化学 电解质溶液和电离平衡(第4章)

非电解质(稀 溶液的通性 溶液的通性——稀溶液定律 非电解质 稀)溶液的通性 稀溶液定律 对于非电解质(稀 溶液来说 溶液来说, 对于非电解质 稀)溶液来说,一些物理化学性 质具有特殊性:性质的值仅与溶剂物质、 质具有特殊性:性质的值仅与溶剂物质、溶液浓 度有关,而与溶质物质是什么无关——稀溶液的 度有关,而与溶质物质是什么无关 稀溶液的 依数性。 依数性。 这些性质包括:蒸气压下降、沸点升高、凝固点 蒸气压下降、沸点升高、 蒸气压下降 下降及渗透压等。 下降及渗透压等。
外界压(KPa) 103.3 沸点(K) 373 202.6 393 405.2 416 810.4 443
3.凝固点:某物质液相蒸气压和固相蒸气压达到 3.凝固点 凝固点: 相等的温度. 相等的温度.
273 温度(K) 蒸汽压(Kpa)0.61 271 269 0.52 0.44 267 0.37 265 0.31
1、溶液的蒸气压下降 、 2、沸点上升及凝固点下降 、 3、渗透压与反渗透技术 、
一 溶液的蒸气压下降
(一)纯水的蒸气压 沸点和凝固点 纯水的蒸气压 什么叫蒸发?什么叫凝聚 什么叫凝聚? 什么叫蒸发 什么叫凝聚
蒸发
水(液态 液态) 液态
凝聚
水(气态 气态) 气态
1.水的饱和蒸气压:平衡时,水蒸气所具有的压力. 1.水的饱和蒸气压 平衡时,水蒸气所具有的压力. 水的饱和蒸气压: 水的蒸气压与温度有关
沸点上升及凝固点下降: 沸点上升及凝固点下降: p/kPa B 101.325 0.611 A
∆p
O O’ ∆Tfp Tfp 0
B’ 纯水 溶液 ∆Tbp 100 Tbp T/℃ ℃ 下降多少? 下降多少?
图3-1 冰、水及溶液的蒸气压曲线
大学基础化学第四章化学热力学基础_思维导图

化学热力学基础热力学系统和状态函数热力学概念系统与环境系统定义环境定义系统类型1.开放系统定义2.封闭系统定义3.隔离系统定义状态函数与过程状态定义平衡态定义状态函数定义取决于系统所处的状态,一旦状态确定,每个状态函数有唯一确定的值状态函数的变化值并不是系统状态,其变化值与中间环节无关分类广度性质定义例子:体积,物质的量,质量,自由能等强度性质定义例子:温度,密度,压力,浓度两者关系:强×广=广,广 广=强状态方程(物态方程)定义例子:PV=nRT过程定义分类等温过程等压过程等容过程绝热过程循环过程可逆过程自发过程特征单向性(不可逆过程)具有做功的能力具有一定的限度定义能量的转化热和功热定义符号表示正值和负值分别表示功定义符号表示正值和负值分别表示注意1:热和功都不是状态函数,不是系统的性质2:只存在于系统的变化过程中,其大小与途径密切相关以理想气体的等温膨胀为例体积功定义(We)公式公式中的单位Pa,m^3例子反抗外压的过程中非体积功定义(Wf)可逆过程(可逆功Wr)与最大功最大功公式可逆过程与不可逆过程的区别系统和环境能否同时恢复到原来的状态可逆过程是不可能实现,时间无限长每一微小步环境和系统都是平衡的能量守恒和化学反应热热力学能(内能)(广度性质)定义(系统内部)(状态函数)符号表示和单位理想气体的内能和焓只与温度有关热力学第一定律(能量守恒与转化定律)表述系统热力学变化公式(封闭系统)系统的焓定义(状态函数)(广度性质)符号表示与单位焓变的定义(后-前)正负分别表示H=U+pV等容反应的热效应dU=Qv(dV=0)(封闭系统无非体积功)(等容反应热等于系统内能的变化)热效应的概念:系统发生变化时,若无非体积功,且终与始态的温度相同,则系统放出或吸收的热量就称为该过程的热效应等压反应的热效应dU=Qp+W=Qp+p外×dVQp=(U2-U1)+p外(V2-V1)=(U2+p外V2)+(U1+p外V1)Qp=H2-H1=dH封闭系统无非体积功,等压反应热等于系统焓变等压与等容的关系反应物,产物均为气体dn=0——则Qp≈Qv反应物,产物都在溶液和固体中的反应可认为dV=0——则Qp≈Qv反应进度,热化学方程式与标准状态反应进度定义(对于反应物为负值,对于生成物为正值)式子表示单位摩尔反应热书写形式定义与方程式的写法有关标准状态(标准压强100KPa)对气体(理想气体,标准压强)(混合气体的每个气体的分压都是标准压强)对纯液体和纯固体(标准压强)对溶液(标准压力,溶质浓度1mol/L理想稀溶液)对溶剂(标准压力)对生物系统(37度,PH=7)参考温度:298.15K(25°C)热化学反应方程式热化学反应方程式中的热效应符号写法(4点)注意事项(3点)盖斯定律和反应热的计算盖斯定律的运用盖斯定律(不做非体积功和等压或等容以及恒温条件下)由标准摩尔生成焓计算反应热摩尔生成焓与标准摩尔生成焓定义符号单位C的稳定单质是石墨不是金刚石稳定物质的标准摩尔生成焓为零生成物质的化学计量数要为1式子(反应式产物-反应物)(化学计量数都取正值)同一种物质不同聚集状态的标准摩尔生成焓不同由标准摩尔燃烧焓计算反应热标准摩尔燃烧焓定义单位符号式子(反应物-产物)(化学计量数都带正号)理解完全燃烧和完全氧化(其标准摩尔燃烧焓为0)熵和Gibbs自由能熵(状态函数)(广度性质)定义单位符号等温可逆过程熵与反应热的关系式温度对熵的影响热力学第三定律定义规定熵(ST)与绝对熵(S0)标准摩尔熵定义单位符号稳定物质单质的标准摩尔熵不为0,因为不是绝对零度的完整晶体对于水溶液中离子的标准摩尔熵是....标准摩尔熵的规律(6个)标准摩尔熵变(后-前)熵增加原理(热力学第二定律)定义数学表达式熵变与0的比较的含义Gibbs自由能(广度性质)(状态函数)符号表示式子吉布斯自由能变化和非体积功用吉布斯自由能变化判定反应方向标准状态下标准摩尔自由能定义符号单位稳定物质单质标准摩尔自由能为0计算两个式子(一个只能在25度时,另一个任意)注意单位统一非标准状态下式子反应商对溶液对纯气体对混合相判断反应的依据。
大学化学课后习题答案解析(第四章)

第四章电化学与金属腐蚀1.是非题(对的在括号内填“+”,错的填“-”号)(1)取两根铜棒,将一根插入盛有0.1mol·dm-3CuSO4溶液的烧杯中,另一根插入盛有1mol·dm-3CuSO4溶液的烧杯中,并用盐桥将两只烧杯中的溶液连结起来,可以组成一个浓差原电池。
( )(2)金属铁可以置换Cu2+,因此三氯化铁不能与金属铜反应。
( )(3)电动势E(或电极电势φ)的数值与反应式(或半反应式)的写法无关,而标准平衡常数Kθ的数据,随反应式的写法(即化学计量数不同)而变。
( )(4)钢铁在大气的中性或弱酸性水膜中主要发生吸氧腐蚀,只有在酸性较强的水膜中才主要发生析氢腐蚀。
( )(5)有下列原电池(-)Cd|CdSO4(1.0mol·dm-3)||CuSO4(1.0mol·dm-3)|Cu(+) 若往CdSO4溶液中加入少量Na2S 溶液,或往CuSO4溶液中加入少量CuSO4·5H2O晶体,都会使原电池的电动势变小。
( )解:(1)+;(2)–;(3)+;(4)+;(5)–。
2.选择题(将所有正确答案的标号填入空格内)(1)在标准条件下,下列反应均向正方向进行:Cr2O72 - +6Fe2++14H+=2Cr3++6Fe3++7H2O2Fe3++Sn2+=2Fe2++Sn4+它们中间最强的氧化剂和最强的还原剂是______。
(a)Sn2+和Fe3+(b)Cr2O72 -和Sn2+(c)Cr3+和Sn4+(d)Cr2O72 -和Fe3+(2)有一个原电池由两个氢电极组成,其中有一个是标准氢电极,为了得到最大的电动势,另一个电极浸入的酸性溶液[设p(H2)=100kPa]应为(a)0.1mol·dm-3HCl (b)0.1mol·dm-3HAc+0.1mol·L-1NaAc(c)0.1mol·dm-3Hac (d)0.1mol·dm-3H3PO4(3)在下列电池反应中Ni(s)+Cu2+(aq)→Ni2+(1.0mol·dm-3)+Cu(s)当该原电池的电动势为零时,Cu2+浓度为(a)5.05×10-27mol·dm-3(b)5.71×10-21mol·dm-3(c)7.10×10-14mol·dm-3(d)7.56×10-11mol·dm-3(4)电镀工艺是将欲镀零件作为电解池的();阳极氧化是将需处理的部件作为电解池的()。
大学化学 化学反应的基本原理

示。但是一种物质的绝对焓值 H 是无法测定的,
只能测定某物质从一种状态变化到另一种状态时
的焓变∆H。
在化学反应过程中,体系吸收或放出的热量, 称为化学反应的热效应或反应热,反应热也就
是反应的焓变∆H。
(3)焓和焓变
一个化学反应的焓变∆H与反应物采取什么样的
途径变成产物无关,只要这个化学反应过程的
始态和终态不变,焓变∆H就是一个固定的值,
1 H2 (g) + O2 (g) →H2O(l ) 2
∆rHm = 286 kJ· -1 mol
(4)热化学方程式
书写热化学方程式时要注意:
(1)注明反应的温度和压强条件,如果反应是在 298 K和100 kPa下进行的,习惯上不予注明。
(2)要注明反应物和生成物的聚集状态或晶形。 常用g 、l 、s分别表示气态、液态、固态。 (3)方程式中的配平系数只表示计量数,不表示 分子数,必要时可以写成分数。计量数不同时,同 一反应的反应热数值不同。 (4)正、逆反应的热效应数值相同而符号相反。
等压过程
p = 0
等容过程
V = 0
等温过程
T = 0
一、热力学中的一些常用术语
同 一 过 程 的 两 种 途 径
(Ⅰ) p1=100 kPa 加压 p2=200 kPa V2 =1 m3 终态 p =1000 kPa ( Ⅱ ) 加压 V = 0.2 m3 减压
V1 = 2 m3
始态
p= p2 - p1= 200-100 = 100 kPa, V= V2 -V1=1-2= -1m3
Ө Ө Ө rHm =∑f Hm(产物)-∑fHm(反应物)
(4-3)
要求会查表用标准生成热f Hm 数据
大学化学第4章溶液与胶体

水的离子积
通常将此平衡常数( K )称为水的离
子积( KW ),即
KW
C
(H C
)
C
(OH C
)
平
1.01014
.
KW 不随组成而变,只是温度的函数。
t/℃
5 10 15 20 25 30 50 100
K
W
/10 14
0.186 0.293 0.452 0.681 1.008 1.471 5.476
如:SO3、CO2
3、路易斯(Lewis)酸碱电子理论
与布朗斯特质子酸碱同时,路易斯提出了电子酸 碱理论:
能接受电子对的物质为酸
如:AlCl3、ZnCl2、BF3等。
能给出电子对的物质为碱
如:NH3、 Br- 、S-等。
路易斯酸碱电子理论几乎适用于所有的无机 化合物,特别是配合物,故又称为广义酸碱理论。
蒸气压
把液体置于密闭容器中,在一定温度 下,当液体的蒸发速率与蒸气的凝结速 率相等时,气、液两相达到平衡,此时 蒸气的压力叫做饱和蒸气压,简称蒸气压。
蒸汽压示意图Biblioteka 在一定温度下,若溶质是非挥发性的,则 溶剂的蒸汽压与其占据液面的比例有关。
纯溶剂
溶液
理想溶液
若溶质分子为A,溶剂分子为B。
如果分子之间A与A、A与B、B与B的作用力都 相同,则该溶液为理想溶液。
凝固点
液体的蒸气压随着温度的降低而减小。当 其等于固态的蒸气压时,液体就凝固。
此时的温度叫做凝固点。用Tf表示。在凝 固点时,通常是气、液、固三相共存。
3、具有一定的渗透压
1) 渗透现象
2) 渗透压 3) 渗透现象及应用
1) 渗透现象
南昌大学大学化学第四章习题答案 2

第四章习题答案4-1 指出下列各种酸的共轭碱:H 2O 、H 3PO 4、HCO 3-、NH 4+解: H 2O 的共轭碱是OH-H 3PO 4的共轭碱是H 2PO 42-HCO 3-的共轭碱是CO 32-NH 4+的共轭碱是NH 34-2 指出下列各种碱的共轭酸:H 2O 、HPO 42-、C 2O 42-、HCO 3-解:H 2O 的共轭酸是H 3O +HPO 42-的共轭酸是H 2PO 4-C 2O 42-的共轭酸是HC 2O 4-HCO 3-的共轭酸是H 2CO 34-3 从下列物质中找出共轭酸碱对,并按酸性由强到弱的顺序排列:H 2PO 4-、NH 3、H 2S 、-COOH 、PO 43-、H 2SO 3、HS -、NH 4+、HCOOH 、HSO 3- 解: NH 4+- NH 3,H 2S- HS -,HCOOH - -COOH ,H 2SO 3- HSO 3-酸性从强到弱的顺序排列:H 2SO 3,HCOOH ,NH 4+,H 2S4-4 试计算0.20 mol·L -1氨水在以下情况的解离度以及[OH -]:(1) 将溶液稀释一倍;(2)加入NH 4Cl ,使NH 4Cl 浓度为0.10 mol·L -1;(3)上述浓度氨水。
%34.11034.110.01034.1)(OH 23b =⨯=⨯==---c c α (2) NH 3·H 2O = NH 4+ + OH -起始浓度 0.2 0.1 0平衡浓度 0.2(1-α) 0.1+0.2α 0.2α)NH ()(OH )(NH 34b c c c K -+=1.8⨯10-5=( 0.1+0.2α)( 0.2α)/ 0.2(1-α)1-α≈1 0.1+0.2α≈0.1得: α=0.018%C(OH)= 0.2α=3.6⨯10-5 mol ⋅L -1(3)方法同(1)。
4-5 已知琥珀酸(CH 2COOH)2(以H 2A 表示)的pK a1=4.19,pK a2=5.57。
大学化学热力学第4章练习题

第四章练习题一、填空题1.在酸性范围内,K2Cr2O7、FeCl3、H2O2、Cl2中,氧化性随pH值变化的物质是。
氧化性不随pH值变化的物质是。
2.MnO-4与Fe2+反应,在酸性介质中被还原为,配平的离子反应方程式是。
3.Fe3O4中Fe的氧化值是。
按照共轭氧化还原电对的概念,氧化还原反应的实质是。
4.将两个氧化还原电对组成氧化还原反应时,氧化剂应是电极电势较的电对中的型物质。
5.根椐氧化还原电对的电极电势选择还原剂时,还原剂应是电极电势较的电对中的型物质。
6.电对Cu┃CuSO4(aq) 和Zn┃ZnSO4(aq) ,在标准条件下用盐桥连接构成原电池,电池的正极是,负极是。
若在CuSO4溶液中加入过量氨水,电动势将变_________;若在ZnSO4溶液中加入过量氨水,电池的电动势将变。
7. 标准状态下,由Cu2+/Cu+和Cu+/ Cu组成原电池符号为。
8.已知φ(Br2/Br-)>φ(I2/I-),表明的氧化能力强于的氧化能力,其能被还原为。
9.在CH4、CH3Cl、CHCl3、CCl4中,C元素氧化数为-2的物质是。
10.电对Ag+/Ag体系中加入KBr溶液,φ(Ag+/Ag)值将;而在电对Br2-Br-体系中加入AgNO3溶液,φ(Br2/Br-)值将。
11.将反应Cu+2Ag+=Cu2++2Ag设计成原电池,电动势E=,其电池组成式为。
12. 在电对Ag+-Ag体系中加入过量的氨水,φ(Ag+/Ag)值将;而在电对I2-I- 体系中加入少量Hg(NO3)2溶液使I- 过量,φ(I2/I-)值将。
13. 在标准电极电势表中,越往下电对的φθ值越大,其电对中物质的氧化能力越;越往上电对的φθ值越小,其电对中物质的越强。
14. 在标准电极电势表中,依照对角线规律,角的氧化态物质可以和角的还原态物质发生氧化还原反应。
15.已知φθ(Cu2+/Cu)>φθ(Fe2+/Fe),在这两个电对中,较强的氧化剂是;较强的还原剂是。
大学无机化学第4章 配合物

由此可知,1mol配合物中的3mmolCl-全部都位于配离子的外界。 另根据该配合物不能与NaOH发生反应放出NH3,可知NH3全在配 离子的内界,因此,该配合物的结构式应为[Cr(NH3)6]Cl3
• 五、配位化合物的命名 • 原则是先阴离子后阳离子,先简单后 复杂。 • 命名顺序: • (1)先无机配体,后有机配体 • cis - [PtCl2(Ph3P)2] • 顺-二氯· 二(三苯基磷)合铂(II)
K[Co(NO2)4(NH3)2]
2、含有配位阳离子的配合物 [Cu(NH3)4]SO4 硫酸四氨合铜(Ⅱ)
[Co(ONO)(NH3)5]SO4 硫酸亚硝酸根· 五氨合钴(Ⅲ)
[Co(NCS)(NH3)5]Cl2
[CoCl(SCN)(en)2]NO2 [Pt(py)4][PtCl4] 3、中性配合物 [Ni(CO)4] [Co(NO2)3(NH3)3] [PtCl4(NH3)2]
Au+
2, 4
四、配位化合物的类型 1. 简单配位化合物 单齿配位体与单个中心离子(或原子)所形成 的配合物 K2 [PtCl6] [Fe(H2O)6] Cl5 [Cr(H2O)6] Cl3 Na[AlF6] 2. 螯合物 环状结构 由中心离子和多齿配体结合而成的环状配合物 螯合效应: EDTA的应用
电荷
配位体负电荷增加时,配位数就越小,如SiF62- , SiO44中心离子电荷增加和配位体电荷数减小,有利于大配位数。
常见金属离子的配位数
1价金属离子 Cu+ 2, 4 Ag+ 2 2价金属离子 Ca2+ 6 Fe2+ 6 Co2+ 4, 6 Ni2+ 4, 6 Cu2+ 4, 6 Zn2+ 4, 6 3价金属离子 Al3+ 4, 6 Sc3+ 6 Cr3+ 6 Fe3+ 6 Co3+ 6 Au3+ 4
大学有机化学第四章 炔烃

二、炔烃的化学性质
炔烃中的叁键虽与双键不同,却有共同之处, 它们都是不饱和键,都由键和键构成,所以烯、 炔的性质有相同的地方,都易发生加成、氧化和聚 合反应,另外叁键碳上所连的氢也有相当的活泼性, 可以发生一些特殊的反应。
R
C≡C
H
炔氢原子 (金属炔化物的生成)
官能团(加成、氧化、聚合)
1、加成反应 (1)催化加氢
CHCH
2Cu (NH3)+2Cl
CuCCCu + 2NH4Cl + 2NH3 乙炔铜(棕红色)
此反应非常灵敏,可用来检查末端炔烃.
其他炔烃也可发生这一反应:
Ag (NH3)+2NO3
R-CCH
R-CC Ag + NH4NO3 + NH3
R-CCH
Cu (NH3)+2Cl
R-CCCu
+ NH4Cl + NH3
190-220℃
液氨
R-CC Na + NH3
炔化钠的性质活泼,可与卤代烃作用,在炔烃中 引入烷基,有机合成上用作增长碳链的一个方法。
RC CNa
RX
/
RC CR /
例:由溴乙烷和1-丁炔合成3-己烯
(2)与硝酸银或氯化亚铜的氨溶液反应
CHCH
2Ag (NH3)+2NO3
AgCCAg + 2NH4NO3 + 2NH3 乙炔银(白色)
6 5 4 3 2 H3C C C CH2 CH 1 CH2
1-己烯-4-炔 2-己烯-4-炔
6 5 4 3 H3C C C CH
2 CH
1 CH3
4-甲基-1-庚烯-5-炔
第二节 炔烃的性质 一、炔烃的物理性质
大连理工大学无机化学第四章

4.2.2 预测反应方向 4.2.3 计算平衡组成
4.2.1 判断反应程度
K 愈大,反应进行得愈完全; K 愈小,反应进行得愈不完全; K 不太大也不太小(如 10-3< K <103), 反应物部分地转化为生成物。
4.2.2 预测反应方向
反应商(reaction quotient) :
K 是量纲一的量。
K 是温度的函数,与浓度、分压无关。
* 标准平衡常数表达式必须与化学反应计 量式相对应。
H2 (g) I 2 (g)
2HI(g)
K1
[ p(HI) / p ]2 K1 [ p(H 2 ) / p ][ p(I 2 ) / p ]
1 H 2 1 I 2 (g) 2 (g) 2
第四章 化学平衡 熵和Gibbs函数
§4.1 标准平衡常数 §4.2 标准平衡常数的应用 §4.3 化学平衡的移动
§4.4 自发变化和熵
§4.5 Gibbs函数
§4.1 标准平衡常数
4.1.1 4.1.2
4.1.3
化学平衡的基本特征 标准平衡常数表达式
标准平衡常数的实验测定
4.1.1 化学平衡的基本特征
p0(Cl2)=(0.0270×8.314×373)kPa=83.7 kPa
解:
开始cB/(mol· -1) L
CO(g)+Cl2 (g)
0.0350 0.0270
COCl 2(g)
0
开始pB/kPa
又设COCl 2转化x 平衡pB/kPa
108.5
83.7
0 x x
0
83.7
假设Cl2全部转化 108.5–83.7
大学化学原理 第四章
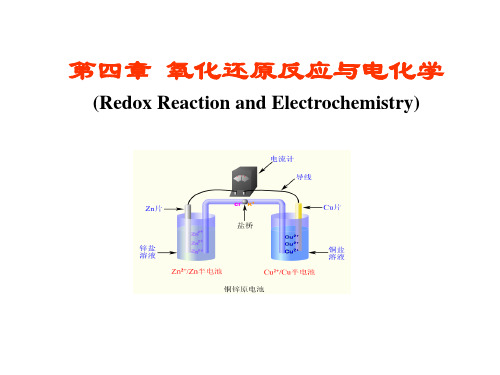
2CrO2- + 8OH- + 3ClO- + 3H2O = 2CrO42- + 4H2O
+ 3Cl- + 6OH整理: 2CrO2- + 3ClO- + 2OH- = 2CrO42- + 3Cl- + H2O
注意
配平同一方程式中,不能在反应式两边 同时出现H+和OH-。
5. 掌握金属的电化学腐蚀及防腐原理。
化学电源
电 解
电 镀 电极
心电图
本章我们主要以电极电势为核心,讨论有关 电化学的基本原理和氧化还原平衡的一般规律。 首先,我们介绍一下氧化还原反应的基本概
念和氧化还原方程式的配平。
§4.1 氧化还原反应的基本概念
( The primary concepts of redox reaction )
氧化剂:使其他物质氧化,本身被还原,元素氧化数降低。 (oxidant — electron acceptor) 还原剂:使其他物质还原,本身被氧化,元素氧化数升高。 (reductant — electron donor)
多数氧化还原反应都是在水溶液中进行的。
这样的反应我们可以把氧化过程和还原过程分开 来写:Zn+Cu2+ =Zn2++Cu
差而造成的。
氧化态物质得电子能力越强,电极电势越高; 还原态物质失电子能力越强,电极电势越低。
如果把两个电极电势不同的电极组成原电池,电子 就会从低电势处流到高电势处,形成电流。电极电势低 的一极就是负极,电极电势高的一极就是正极。原电池 的电动势也就是两极的 之差:
典型-大学化学计算题
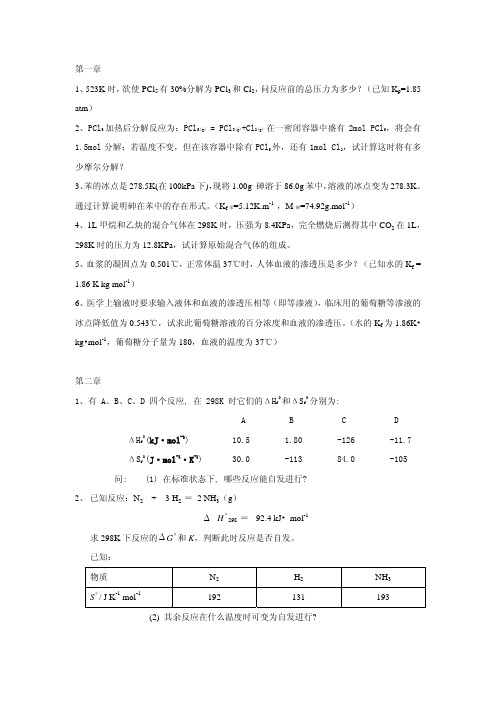
第二章 1、有 A、B、C、D 四个反应, 在 298K 时它们的ΔHf 和ΔSf 分别为: A ΔHf (kJ·mol ) ΔSf (J·mol ·K ) 问:
0 -1 -1 0 -1 0 0
B 1.80 -113
C -126 84.0
D -11.7 -105
10.5 30.0
(1) 在标准状态下, 哪些反应能自发进行? 3 H2 = 2 NH3(g)
大学化学第四章计算

(H /H2
)
-0.05917
2
V
lg
[ p(H2)/ p ] [c(H)/ c ]2
E = (+)-(-) = 1.47V
= -0.05V
解法二:总反应 2MnO4- (aq)+6H+(aq)+5H2(g)⇌2Mn2+(aq)+8H2O(l)
E
E-0.05917V 10
( Ag+/Ag ) = ?
解:
AgCl(s) ⇌ Ag+(aq) + Cl-(aq)
Ks( AgCl ) = { c(Ag+) / cӨ }{ c(Cl-) / cӨ } c(Cl-) = 1.0mol·dm-3 , c(Ag+) = Ks( AgCl )=1.77 10-10 mol·dm-3
(Hg
2Cl
2
/Hg
)
-0.05917V 2
lg[c(Cl)/
c
]2
(3) Cr2O72- (aq) +14H+ (aq) +6e- ⇌ 2Cr3+ (aq) +7H2O(l)
(Cr2O72-
/
Cr
3
)
-
0.05917V 6
lg
[c(Cr3)/ c ]2 [c(Cr2O72- ) / c ][c(H)/
大学化学第四章计算
例: 写出下列电极反应的能斯特方程式 (1)O2 (g) +2H2O(l)+4e - ⇌ 4OH- (aq)
(O2
/
OH
)
-0.05917V
大学无机化学第四版第四章课件

EMF
=
EMF
0.0592 V Z
lg
J
对于非标准态下的反应:
EMF > 0.2V EMF > 0 反应正向进行; EMF < - 0.2V EMF < 0 反应逆向进行。 0.2V < EMF < 0.2V 用 EMF 判断
例:判断在酸性溶液中H2O2与Fe2+混合 时,能否发生氧化还原反应?若能反应,写
3
4.1.2 氧化还原反应方程式的配平
配平原则:
① 电荷守恒:氧化剂得电子数等于 还原剂失电子数。
② 质量守恒:反应前后各元素原子 总数相等。
配平步骤:
①用离子式写出主要反应物和产物(气 体、纯液体、固体和弱电解质则写分子式)。
②分别写出氧化剂被还原和还原剂被氧 化的半反应。
③分别配平两个半反应方程式,等号两 边的各种元素的原子总数各自相等且电荷数 相等。
= E (Ag+ / Ag) + 0.0592V lg {c(Ag+ )} = E (Ag+ / Ag) + 0.0592V lg Ksp (AgCl) = 0.799V + 0.0592V lg1.8×1010 = 0.222V
AgCl(s)+ e Ag(s)+ Cl (aq) 当c(Cl ) = 1.0mol L1 时 , c(Ag+ ) = Ksp (AgCl)
①
MnO
4
+
SO
2 3
SO
2 4
+
Mn 2+
②
MnO
4
+ 8H +
+ 5e
=
大学有机化学第四章 链烃和环烃

2、加卤素:环丙烷、环丁烷与烯烃相似,在常温下可以与卤素发生加成反应。
3、加卤代氢:环丙烷、环丁烷及其衍生物很容易与卤化氢发生加成反应。开环发生在含氢最多和含氢最少的两个碳原子之间,加成反应遵循马氏规则。
环戊烷以上的环烷烃,在室温下难以与卤代氢发生加成反应。
炔氢也能与重金属(Ag或Cu)作用形成不溶于水的炔化物。常用试剂为硝酸银或氯化亚铜的氨溶液。
6、聚合反应
(五)、炔烃的制备
二卤代烷在强碱性条件下脱卤化氢及金属炔化物与伯卤代烃亲核取代反应是制备炔烃的常用方法。
二、二烯烃
分子中含有两个双键的开链烃称为二烯烃(diene),其通式为CnH2n-2。
(一)、分类和命名
2、其它烷烃的氯代反应
其它烷烃在相似条件下也可以发生氯代反应,但产物更复杂。
3、烷烃和其它卤素的取代反应
4、甲烷卤代反应历程
反应历程是指由反应物至产物所经历的过程。一个反应历程是根据这一反应的许多实验事实,总结归纳作出的理论假设。这种假设必须符合并能说明已经发生的实验事实。
(1)、甲烷氯代反应机制
甲烷的卤代反应历程是自由基取代反应历程。
烯烃在一定条件下,发生自身加成反应生成分子量很大的聚合物,这种反应称为聚合反应,参加反应的烯烃称为单体。
六、烯烃的制备
1、醇的脱水
2、卤代烷脱卤化氢
卤代烷与强碱(如氢氧化钾、乙醇钠)的醇溶液共热时,脱去一分子卤化氢生成烯烃。
3、邻二卤代烷脱卤化氢
邻二卤代烷与锌粉一起共热,可脱去一分子卤素生成烯烃。
第三节炔烃和二烯烃
三、烷烃的结构
根据杂化理论认为碳原子在形成甲烷分子时发生了sp3杂化,所以甲烷分子是正四面体结构。烷烃分子中的碳原子是正四面体结构,因此除乙烷外烷烃分子中的碳原子并不排布在一条直线上,而是以锯齿形或其他可能的形式存在。所以“直链烷烃”仅指不带支链的烷烃。
大学无机化学第四章试题及解答

⼤学⽆机化学第四章试题及解答第四章化学平衡本章总⽬标:1:了解化学平衡的概念,理解平衡常数的意义; 2:掌握有关化学平衡的计算; 3:熟悉有关化学平衡移动原理。
各⼩节⽬标:第⼀节:化学平衡状态1:熟悉可逆反应达到平衡的特征——反应体系中各种物质的⽣成速率分别等于其消耗的速率,各种物质的浓度将不再改变。
2:了解平衡常数、平衡转化率这两个概念的意义。
第⼆节:化学反应进⾏的⽅向学会运⽤标准平衡常数判断化学反应的⽅向:Q K θ>时,反应向逆向进⾏。
Q K θ<向正反应⽅向进⾏。
Q K θ=时体系达到平衡状态。
第三节;标准平衡常数K θ与r m G θ的关系1:掌握化学反应等温式(ln r m r m G G RT Q θ?=?+),当体系处于平衡状态的时候Q K θ=ln r m G RT K θθ??=-。
2:重点掌握运⽤公式r m r m r mG H T S θθθ?=?-?进⾏热⼒学数据之间的计算。
第四节:化学平衡的移动1:熟悉温度、浓度、压强对化学平衡的影响, 2:熟练地根据条件的改变判断平衡移动的⽅向。
习题⼀选择题1.可逆反应达平衡后,若反应速率常数k 发⽣变化,则标准平衡常数()(《⽆机化学例题与习题》吉⼤版)A.⼀定发⽣变化B. ⼀定不变C. 不⼀定变化D. 与k ⽆关2.反应:2CO (g )+O 2(g 2(g )在300K 时的Kc 与Kp 的⽐值约为()A.25B.2500C.2.2D.0.043.反应的温度⼀定,则下列的陈述中正确的是()(《⽆机化学例题与习题》吉⼤版)A.平衡常数能准确代表反应进⾏的完全程度B.转化率能准确代表反应进⾏的完全程度C. 平衡常数和转化率都能准确代表反应进⾏的完全程度D. 平衡常数和转化率都不能代表反应进⾏的完全程度4.相同温度下:2H2(g)+S2(g2S(g)Kp12Br2(g)+2H2S(g2(g)Kp2H2(g)+Br2(g)(g)Kp3则Kp2等于()A. Kp1? Kp3B.(Kp3)2/ Kp1C. 2Kp1? Kp3D. Kp3/ Kp15.下列反应中,K?的值⼩于Kp值的是()(《⽆机化学例题与习题》吉⼤版)A. H2(g)+Cl2(g)== 2HCl(g)B. 2H2(g)+S(g)== 2H2S(g)C. CaCO3(s) == CaO(s)+CO2(g)D.C(s)+O2(g)== CO2(g)6.N2(g)+3H2(g3(g),H=-92.4KJ?mol-1,473K时,三种混合⽓体达平衡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ө(Cr3+/Cr)=-0.744V
负极 正极
Zn(s)-2e- ⇌ Zn2+(aq) Cr3+(aq)+3e- ⇌ Cr(s)
2Cr3+(aq)+3Zn(s) ⇌2Cr(s)+3Zn2+(aq) (-)Zn(s)|Zn2+(aq, 1mol· -3)|| Cr3+(aq,1mol· -3)|Cr(s)(+) dm dm EӨ = Ө(+)– Ө(–)=0.019V
ceq(Cu2+) = Ki=4.78 10-14mol· -3 dm Cu2+(aq) + 2e- ⇌ Cu(s) ceq(NH3) = 1.0mol· -3 dm ceq([Cu(NH3)4]2+) = 1.0mol· -3 dm
( Cu2+/Cu ) = Ө(Cu2+/Cu ) - (0.05917/2)lg {1/[c(Cu2+)/cӨ]}
(Zn2+/Zn) =Ө(Zn2+/Zn)-(0.05917/2)lg {1/[c(Zn2+)/cӨ]}
=-0.763V -(0.05917/2)lg(1/0.01 )= -0.822V
正极 负极
则:E = (+)– (-) = 0.059V
(2)负极—氧化反应
Zn(s)-2e- ⇌ Zn2+(aq, 0.01mol· -3) dm
EӨ = Ө(+)– Ө(-)=1.21V > 0.2V
则反应正向自发进行
例: 两个Zn2+/Zn电极, Zn2+的浓度分别为0.01和1mol· -3,计算 dm 浓差电池电动势E?写出电极反应、电池反应及电池图式。
解: (1) c(Zn2+)=1mol· -3, Ө(Zn2+/Zn)=-0.763V dm c(Zn2+)=0.01mol· -3, dm
2 7 3
0.05917 V [c(Cr 3 / c ]2 0.05917 14 ) V - lg - pH 2 6 [c(Cr2O7 ) c ] / 6
pH=0 Ө(Cr2O72-/ Cr3+) =1.23V
pH=3 (Cr2O72-/ Cr3+) =0.82V pH=5 (Cr2O72-/ Cr3+) =0.54V 当电极反应中有H+参加时, c(H+) ,pH , , 氧化型的氧化能力
lgK = nE/ 0 (1)O2 (g) +2H2O(l)+4e - ⇌ 4OH- (aq)
0.05917 V [c(OH / c ]4 ) (O2 / OH ) - lg 4 [ p(O2 ) / p ]
计算说明pH对 (Cr2O72-/ Cr3+)的影响?
解:半反应式为: Cr2O72-+14H++6e- ⇌ 2Cr3++7H2O
0.05917 V [c(Cr 3 / c ]2 ) (Cr2O /Cr ) - lg 2 6 [c(Cr2O7 / c ][c(H ) / c ]14 )
= 1.47V
例:
已知 Ө( Ag+/Ag ) = 0.799V,若在Ag+/Ag的半电
池中加入NaCl会产生AgCl(s),当c(Cl-) = 1.0mol · -3时, dm ( Ag+/Ag ) = ?
解: AgCl(s) ⇌ Ag+(aq) + Cl-(aq) Ks( AgCl ) = { c(Ag+) / cӨ }{ c(Cl-) / cӨ } c(Cl-) = 1.0mol· -3 , c(Ag+) = Ks( AgCl )=1.77 10-10 mol· -3 dm dm Ag+(aq) + e- ⇌ Ag(s)
正极
负极
原电池图式: (–)
Pt |
Fe2+(1.0mol· -3) , Fe3+(1.0mol· -3) dm dm Cl2(101325Pa) | 2Cl- (+) (2.0mol· -3) dm
¦ ¦
| Pt
例:利用E(0.1852 V) 计算下列反应在298 K的平衡常数 2 Cu(s) + 2 HI (aq) ⇌ 2 CuI (s) + H2 (g)
同理:可求其他难溶盐电极的 Ө,反之可由 Ө求溶度积Ks
例: Ө(Fe3+/Fe2+)=0.769V,在Fe3+/Fe2+中加入NaOH, 平衡时c(OH-) = 1.0mol · -3, dm 求 (Fe3+/Fe2+)=? Ө[Fe(OH)3/Fe(OH)2]=? [ K s( Fe(OH)3 ) = 2.64 10-39 ; K s( Fe(OH)2 ) = 4.87 10-17]
(Fe3+/Fe2+)=Ө(Fe3+/Fe2+) -0.05917lg{[c(Fe2+)/cӨ]/[c(Fe3+)/cӨ]}
= 0.769V-0.05917lg(4.87 10-17/ 2.64 10-39 )= -0.547V Fe(OH)3(s) + e- ⇌ Fe(OH)2(s)+OH-(aq) Ө[Fe(OH)3/Fe(OH)2]=-0.547V
例:计算OH- 为0.100mol· -3时,氧的电极电势 φ(O2/OH-)。 dm 已知:p(O2)=101.325kPa,T=298.15K。 解:从附录10中可查得氧的标准电极电势:
O2(g)+ 2H2O +4e- ⇌ 4OH -(aq) φӨ(O2/OH -)=0.401V
0.05917 V [c(OH / c ]4 ) (O2 /OH ) - lg 4 [ p(O2 ) / p ]
例:将下列反应设计成原电池并以原电池图式表示。 2Fe2+(1.0mol· -3) + Cl2(101325Pa) = 2Fe3+(1.0mol· -3) dm dm +2Cl- (2.0mol· -3) dm
还原反应为:Cl2( g ,p) + 2e- ⇌ 2Cl-( aq ,c) 氧化反应为:Fe2+( aq,c ) – e- ⇌ Fe3+( aq ,c)
正极—还原反应 Zn2+(aq, 1mol· -3)+2e- ⇌ Zn(s) dm 电池反应 Zn2+(aq, 1mol· -3) ⇌ Zn2+(aq, 0.01mol· -3) dm dm
(–)Zn | Zn2+(0.01mol.dm-3) ¦Zn2+(1mol.dm-3) | Zn(+) ¦
例: 分别计算(1)标准状态下由Zn2+/Zn与Cr3+/Cr组成原电池,判断 正负极?(2)c(Zn2+)=0.1mol· -3,c(Cr3+)=0.001mol· -3时呢? dm dm
0.05917 V [0.100mol dm 3 / 1mol dm 3 ]4 0.401V- lg 4 [101.325kPa/ 100kPa]
= 0.460V 说明反应式中各物质的 化学计量数乘以一定的 倍数,对电极电势的数 值无影响。
1 O2+H2O+2e- ⇌ 2OH2
0.05917 V [c(OH / c ]2 ) (O2 /OH ) - lg 1 2 [ p(O2 ) / p ] 2
例: 判断2Fe3+(aq)+Cu(s)=2Fe2+(aq)+Cu2+(aq)能否自发进行?
解: 由氧化还原反应 Fe3+(aq)+e- ⇌ Fe2+(aq) Cu(s)-2e- ⇌ Cu2+(aq) 还原反应 氧化反应 正极 负极
Ө(+)=0.77V Ө(-)=0.34V
EӨ = Ө(+)– Ө(–)=0.43V > 0.2V
则反应正向自发进行
例: 金属Fe能否防止Fe2+(aq)氧化为Fe3+(aq)? 解: 2Fe3+(aq)+Fe(s) ⇌ 3Fe2+(aq)
Fe3+(aq)+e- ⇌ Fe2+(aq)
Fe(s)-2e- ⇌ Fe2+(aq)
还原反应
氧化反应
正极
负极
Ө(+)=0.77V
Ө(-)=-0.44V
(2)Hg2Cl2 (s)+2e- ⇌ 2Hg(l)+2Cl-(aq)
0.05917 V (Hg 2 Cl 2 /Hg ) - lg[c(Cl / c ]2 ) 2
(3) Cr2O72- (aq) +14H+ (aq) +6e- ⇌ 2Cr3+ (aq) +7H2O(l)
0.05917 V [c(Cr 3) c ]2 / 23 (Cr2O7 / Cr ) - lg 2 6 [c(Cr2O7- ) / c ][c(H ) c ]14 /
解: Fe(OH)3(s) ⇌ Fe3+(aq) + 3OH-(aq) Ks[Fe(OH)3] = { c(Fe3+)/cӨ }{ c(OH-)/cӨ}3 c(OH-) = 1.0mol· -3 , c(Fe3+) = Ks[Fe(OH)3]=2.64 10-39 mol· -3 dm dm Fe(OH)2(s) ⇌ Fe2+(aq) + 2OH-(aq) c(OH-) = 1.0mol· -3 , c(Fe2+) = Ks[Fe(OH)2]=4.87 10-17mol· -3 dm dm Fe3+(aq) + e- ⇌ Fe2+(aq)
