原子核外电子的排布-精品文档
核外电子排布张讲课文档

自主检测
三、原子的最外层电子排布与元素的化学性质的关系
最外层 电子数 稳定性 得失电 子能力
化合价
稀有气体元素 金属元素
非金属元素
8(He 为 2)
一般小于 4 一般大于或等于 4
稳定 既不易得电子, 也不易失电子
0
不稳定
不稳定
易失电子
易得电子
只有正价、0 价, 一般既有正价、0 价,
没有负价
又有负价(F 无正价)
第五页,共29页。
自主阅读
自主检测
1.元素的化学性质主要决定于( ) A.核外电子数 B.最外层电子数 C.核内质子数 D.核内中子数 解析:决定元素化学性质的是其原子最外层电子数。 答案:B 2.某元素原子的原子核外有三个电子层,最外层电子数是5。该原子核内 的质子数是( )
A.14 B.15 C.16 D.17
断的突破口。(1)10电子微粒:来自第二十二页,共29页。
探究点一
探究点二
(2)18电子微粒:
情景引入 知识点拨
典例引领
第二十三页,共29页。
探究点一
探究点二
情景引入
知识点拨 典例引领
成功体验2与氢氧根离子具有相同的质子数和电子数的微粒是( )
A.CH4
B.NH4+
C.NH2-
D.Cl-
解析:CH4 的质子数、电子数分别为 10、10;NH4+的质子数、电子
自主检测
一、核外电子的分层排布
1.依据
电子能量高低、运动区域离核远近。
2.电子层与电子能量的关系
电子层数 1 2
34
5
电子层符号 K L
MN
O
电子能量
(完整版)核外电子排布规律总结

原子核外电子排布规律①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③ 最外层最多只能容纳 8个电子(K 层为最外层时不能超过2个)次外层最多只能容纳18个电子(K 层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH 、N 、NH 、NH 、NH 、O、OH 、H O 、H O 、F 、HF 、Ne 、Na 、Mg 、Al 等。
4-3-23+4-2-23+-++2+3 ②18电子粒子:SiH 、P 、PH 、S 、HS 、H S 、Cl 、HCl 、Ar 、K 、Ca 、PH 等。
4-33-2-2-++2+4 特殊情况:F 、H O 、C H 、CH OH222263 ③核外电子总数及质子总数均相同的阳离子有:Na 、NH 、H O 等;阴离子有:++43+F 、OH 、NH ; HS 、Cl 等。
---2--前18号元素原子结构的特殊性:(1)原子核中无中子的原子:H11(2)最外层有1个电子的元素:H 、 Li 、Na ;最外层有2个电子的元素:Be 、Mg 、He(3)最外层电子总数等于次外层电子数的元素:Be 、Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li 、P(6)电子层数与最外层电子数相等的元素:H 、Be 、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li 、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He 例外)(2)在元素周期表中,同周期的ⅡA、ⅢA 族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。
课件9:1.2.1 原子核外电子的排布

3.常见的等电子、等质子微粒 (1)常见的等电子粒子。 ①2 电子粒子:H2、He、Li+、H-、Be2+。 ②10 电子粒子:Ne、HF、H2O、NH3、CH4、Na+、Mg2+、 Al3+、NH+ 4 、H3O+、N3-、O2-、F-、NH- 2 、OH-等。 ③18 电子粒子:Ar、SiH4、PH3、H2S、HCl、F2、H2O2、 C2H6、CH3OH、K+、Ca2+、Cl-、S2-、HS-、O22-等。
注意:核外电子数排布规律中的各项是相互联系的,不能孤 立地理解或应用其中的某一部分。
3.核外电子排布的表示方法——结构示意图
结构示意图是用小圆圈和圆圈内的符号及数字表示原子 核及核内质子数,弧线表示各电子层,弧线上的数字表 示该电子层上的电子数。例如:钠原子结构示意图为:
4.原子结构示意图与离子结构示意图的比较 结构示意图包括原子结构示意图和离子结构示意图。原 子结构示意图中,核内质子数等于核外电子数;离子结 构示意图中,二者则不相等。例如:
(1)单核中性微粒为原子,原子的核电荷数=核外电子 数,因此,此微粒是核电荷数为18的氩原子;
(2)具有还原性能被溴水氧化的是硫离子。
(3)氧化性很弱的+1价的是钾离子;
(4)还原性很弱的-1价的是氯离子。
【答案】 (1)Ar (2)S2- (3)K+ (4)Cl-
【点拨】 由微粒结构示意图的各部分含义,可知该微 粒共有3个电子层,共18个电子。根据题意结合组成原 子的各微粒之间的关系,可判断该微粒为中性时或分别 带正负电荷时,原子核内质子的数值。由此,熟练掌握 1~20号元素的原子核外电子的排布特点尤为重要。
(1)定义:___不__同___的区域简化成的不连续的壳层。
(2)不同电子层的表示及能量关系
原子核外电子的排布

9 3d7 4s2 10 3d8 4s2 11 3d10 4s1 12 3d10 4s2
“交流与讨论”P14
1. 氟原子核外的9个电子应该排布在哪些
轨道上?
1s22s22p5
2.用到了哪些排布原则
C
Na
3.氮、镁原子的电子排布式和轨道表示式
N 1s22s22p3
↓↓↓ 或
Mg 1s22s22p63s2
轨道表示式 计算单电子数
↑1↓s ↑2↓s ↑ 2↑p ↑ ↑1↓s ↑2↓s ↑↓ 2p 1s 2s 2p
洪特规则特例
应能用量:相能同量的相轨近道的,轨全道充的满电、子半排充布满、全 空的状态比较稳定。课本P22或练习册P5
已知3d、4s轨道能量相近,且3d>4s现在还
有6个电子,全如充何满排布p6,d体10 系f 14比较稳定?
基态原子核外电子排布遵循的原理
1.能量最低原理 ——能量不同的轨道 全
是
2.泡利不相容原理 ——同一个轨道
为 了
能
3.洪特规则 ——能量相同的多个轨道
量 最
低
4.洪特规则特例 ——能量相近的轨道
原子核外电子排布的表示
电子排布式 ①电子排布式 用原子实简化的电子排布式
外围(价)电子排布式 ②轨道表示式 ③原子结构示意图
第一次作业
作业
课本P16:1-6、8
练习册P6:3、8、9、12、13
练习
1.下列各原子或离子的电子排布式 错误的是( D ) A Al 1s22s22p63s23p1 B O2- 1s22s22p6 C Na+ 1s22s22p6 D Si 1s22s22p2
2:下列各原子或离子的电子排布式错误
电子的核外排布

≥4个
稳定(不得失)
在化学反应中 易失去电子
在化学反应中 易得到电子
总结:元素的性质,特别是化学性质,跟它的原
子的 最外层电子数
关系密切。
练习:
下面的结构示意图正确的是:( )
+3 2 1 A
+3 3 B
+11 2 8 1 +11 2 9
C
D
练习:
画出下列原子的结构示意图:
7N
12Mg
17Cl
部分金属元素的原子结构示意图
3、下列具有相似化学性质的元素组别
是: C、D
。
A.
B.
C.
D.
同学们有没有想过电子是 怎样围绕原子核做高速运
动的呢?
三、原子核外电子的不同运动区域
多电子原子核外电子的分层运动状况
核外电子分层排布
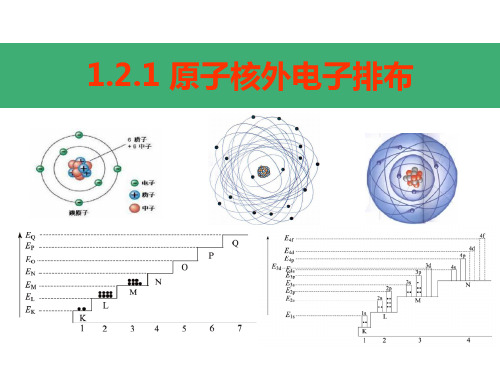
电子按能量高低在核外分层排布。 1234567 K LMNOPQ
由内到外,能量逐渐升高
核外电子的分层排布(又叫分层运动)
电子层符号 K L M N O P Q
电子层序数(n) 1 2 3 4 5 6 7
电子离核的距离 近
远
电子具有的能量 低
高
2、原子结构示意图
如: Na
核内质子数
电子层
原子核
每个电子层上的电子数
称有气体元素原子电子层排布
各电子层的电子数
核电 元素名 元素
荷数 称 符号 K
L
M
N
O
P
最外层电子 数
2
氦
He
2
2
10
氖
Ne
2
8
8
18
氩
Ar
1.2.1 原子核外电子排布
元素的金属性、非金属性。
二、元素周期律
1、概念:
元素的性质随着原子序数的递增而呈现周期性 的变化的规律叫做元素周期律。
2、本质:
元素性质的周期性变化规律是元素原子核外 电子排布周期性变化的必然结果。
随堂练习:
1、R元素形成的化合物RH3,其中R的化合价是其 最低负化合价,则R元素最高价氧化物的化学式是:
111
88
77
N(氮) O(氧) F(氟)
70
66
64
Ne(氖) —
11~17 号元素 Na(钠) Mg(镁) Al(铝) Si(硅) P(磷)
原子半
径/pm
186
160
143
117
110
S(硫) 104
Cl(氯) Ar(氩)
99
—
提示:(1)稀有气体元素原子半径的测定依据与其它元素不同,没有可比性。 (2)表中数据的单位是pm(皮米),1pm=10-12m。
1.2.1 原子核外电子排布
一、原子核外电子排布 原子结构示意图
一、原子核外电子排布
各电子层排布的电子数
电子层(从里到外为K、L、M······层) 核电荷数
原子核
一、原子核外电子排布
1、原子核外电子排布
(1)核外电子按能量高低分层排布(运动)
电子层: 根据电子的能量差异和通常运动区域离核
(能层)
〔观察思考2〕观察下表:原子序数为3~9、11~17的元素的原子 半径。用横坐标表示元素原子核外最外层电子数,以纵坐标表 示原子半径,根据数据表作图,表示出3~9、11~17的元素的 原子最外层电子数与原子半径的函数图像。
3~9号 元素
原子半 径/pm
原子核外电子的排布

1.稀有气体的不活泼性. .稀有气体的不活泼性. 稀有气体元素的原子最外层有8个电子 氦是2个 个电子( 稀有气体元素的原子最外层有 个电子(氦是 个) 处于稳定结构,因此化学性质稳定, 处于稳定结构,因此化学性质稳定,一般不跟其它物质 发生化学反应. 发生化学反应.
三,元素的性质与元素的原子核外电子排布的关系
5,9F:最外层电子数比次外层多5个;除H元素外,在短 :最外层电子数比次外层多5个;除H 周期元素中原子半径最小;只有负价而无正价;不能被任 何物质氧化;无含氧酸及含氧酸盐;气态氢化物最稳定; 能置换出水中的O的元素是F 能置换出水中的O的元素是F. 6,11Na:最外层电子数是次外层的1/8,最内层的l/2; Na:最外层电子数是次外层的1/8,最内层的l/2; 短周期元素中原子 半径最大,焰色反应显黄色的元素是Na. 半径最大,焰色反应显黄色的元素是Na. 7,12Mg:最外层电子数=最内层电子数,次外层电子 Mg:最外层电子数= 数是最外层电子数 的4倍的元素是Mg. 倍的元素是Mg. 8,13Al:最外层比次外层少5个电子;最外层电子数= Al:最外层比次外层少5个电子;最外层电子数= 电子层数;形成的 氧化物和氢氯化物能溶于NaOH溶液;地壳中含量最多的 氧化物和氢氯化物能溶于NaOH溶液;地壳中含量最多的 金属元素是Al. 金属元素是Al.
三,元素的性质与元素的原子核外电子排布的关系 9,14Si:最外层电子数是次外层的一半,是最内 Si:最外层电子数是次外层的一半, 层的两倍;单质和其最高 层的两倍; 价氧化物都是原子晶体; 价氧化物都是原子晶体;其最高价氮化物对应水 化物不溶于水的元素是Si. 化物不溶于水的元素是Si. 10,15P:最外层比次外层少3个电子;能形成 10, 最外层比次外层少3个电子; 键角为60 正四面体型单质P 的元素是P 键角为60 0正四面体型单质P4的元素是P. 11,16S:最外层比次外层少2个电子;次外层 11, 最外层比次外层少2个电子; 电子数= 电子数=最外层与最内层电 子数之和;黄色粉末状单质,易溶于CS 子数之和;黄色粉末状单质,易溶于CS2;气态 氢化物具有臭鸡蛋气味; 氢化物具有臭鸡蛋气味;最高价氧化物对应水化 物是一种常用的不挥性强酸的元素是S 物是一种常用的不挥性强酸的元素是S. 12,17Cl:最外层比次外层少1个电子,比最内 12, Cl:最外层比次外层少1个电子, 层多5个电子,单质为黄绿色气体, 层多5个电子,单质为黄绿色气体,其水溶液有漂 白性的元素是Cl. 白性的元素是Cl.
原子核外电子的排布 课件

1
单质与水(或酸)反应
最高价氧化物对应的水化物 碱性强弱
①常温或加热下遇水 Al _无__明__显__现__象__
②与酸反应__剧__烈_
Al(OH)3:_两__性__氢___氧__化__物_
结论
Na、Mg、Al的金属性逐渐_减___弱_
②硅、磷、硫、氯的非金属性的递变规律
Cl、S、P、Si
HClO4>H2SO4>H3PO4>H2SiO3
第1课时 原子核外电子的排布 元素周期律
一、原子核外电子的排布 什么是电子层?原子核外电子排布的原则是什么? 1.电子层 (1)电子层的含义。 多电子原子里,电子分别在__能__量__不__同__的区域内运动,人们把 不同的区域简化为不连续的壳层,称之为电子层。
(2)电子层表示方法。
电子层n 1 2
【典例3】(2012·大纲版全国卷)元素X形成的离子与钙离子的 核外电子排布相同,且X的离子半径小于负二价硫离子的半径。 X元素为( ) A.Al B.P C.Ar D.K 【思路点拨】解答该题要注意以下三点: (1)Ca2+、P3-、K+均为18e-结构; (2)Al3+为10e-结构,Ar是稀有气体元素; (3)相同核外电子排布的离子随核电荷数递增,离子半径递减。
的核外电子数一定不等于其核电荷数,D错误。
二、元素周期表中元素性质的变化规律
原子半径
从同周期 (从左往右)
减小
主要化合价
金属性
非金属性
单质
氧化性 还原性
+1→+7 -4→-1 减弱 增强
增强
减弱
同主族 (从上到下)
增大
相似(最高正价相同)
原子的核外电子排布

04 核外电子排布的实例
氢原子的核外电子排布
1
氢原子只有一个电子,排布在1s轨道上。
2
氢原子是所有原子中最简单的,其核外电子排布 遵循泡利不相容原理和能量最低原理。
3
氢原子核外电子排布的能量状态由主量子数n决 定,本例中n=1。
轨道表示式
轨道表示式是另一种表示原子核外电 子排布的方法,它通过图形的方式表 示电子云的分布和电子的运动状态。
轨道表示式的优点是可以直观地展示 电子云的分布情况和电子的运动状态, 有助于理解电子的行为和性质。
能级交错现象
能级交错现象是指在实际的原子核外电子排布中,有些电子 会出现在比其理论能级高的能级上,这种现象称为能级交错 。
。
05 核外电子排布的意义
对元素性质的影响
决定元素的化学性质
核外电子排布决定了元素的化学性质,因为元素的化学反应主要涉及电子的得失或偏移。
元素周期表中的位置与性质
同一周期内,随着原子序数的增加,核外电子数增多,电子填充到更高能级,元素的非金属性增强,金属性减弱。
对周期律的解释
周期表的形成
核外电子排布规律是形成元素周期表的基础,周期表中元素的排列顺序是根据核外电子排布来确定的 。
最低。
当电子从高能级跃迁到低能级时, 会释放出能量,这个能量可以通
过发射光子的方式释放出去。
洪特规则
洪特规则指出,在任何一个原子中,对于同一 能级上的电子,总是优先以等价的方式占据不 同的轨道。
这个规则的原因是,当电子以等价的方式占据 不同的轨道时,它们之间的相互作用是最小的, 从而使得整个原子的能量最低。
核外电子的排布

人生就像骑单车,想保持平衡就得往前走
•
7、
。202 0年11 月上午3 时39分 20.11.2 103:39N ovember 21, 2020
•
8、业余生活要有意义,不要越轨。20 20年11 月21日 星期六 3时39 分41秒0 3:39:41 21 November 2020
我们必须在失败中寻找胜利,在绝望中寻求希望
课题三 离子
一、核外电子的排布
原子核外的电子排布
核外电子的运动规律
• 电子是在电子层上分层排布的 • 电子层从里到外离核距离由远到近,能量由
低到高 • 电子总是尽先排在能量最低的电子层里(即
第一层排满了才排第二层,依次下去) • 每个电子层最多能容纳2n2个电子,最外层不
超过8个(如果第一层为最外层不超过2个)
钠Na 镁Mg 铝Al 硅Si 磷P 硫S 氯Cl 氩Ar 1、上面的元素的原子结构示意图排列有什么规律? 2、上面的元素中,哪些是金属元素?哪些是非金属元素? 3、元素的化学性质和原子那些结构关系最密切?
原子结构与元素性质的关系
元素的分 类
金属元素
最外层电 子数
一般小于 4
得失电子 趋势
易失去电 子
成功源于不懈的努力,人生最大的敌人是自己怯懦
•
2、
。0 3:39:41 03:39:4 103:391 1/21/2 020 3:39:41 AM
每天只看目标,别老想障碍
•
3、
。20.1 1.2103: 39:410 3:39Nov -2021-Nov-20
宁愿辛苦一阵子,不要辛苦一辈子
•
4、
。03:3 9:4103: 39:410 3:39Sat urday, November 21, 2020
第1课时 原子核外电子的排布(30张)

相等,均为 8,据此可知 A 原子的 M 层上没有电子,
则 A 原子的 L 层为最外层,且电子数为 4,故 A 的原
子序数为 6,B 的原子序数为 13,答案为 D。
3.某同学在画某种元素的一种单核微粒的 结构示意图时,忘记在圆圈内标出其质 子数,请你根据下面的提示做出自己的 判断。
(1) 该 微 粒 是 中 性 微 粒 , 这 种 微 粒 的 符 号 是 ___________________________________________。 (2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这 种微粒的符号是__________。 (3)该微粒的氧化性很弱,得到 1 个电子后变为原子, 原子的还原性很强,这种微粒的符号是__________。 (4)该微粒的还原性很弱,失去 1 个电子后变为原子, 原子的氧化性很强,这种微粒的符号是__________。
6.根据教材所附元素周期表判断,下列叙述不正确的
是
()
A.K 层电子为奇数的所有元素所在族的序数与该
元素原子的 K 层电子数相等
B.L 层电子为奇数的所有元素所在族的序数与该元
素原子的 L 层电子数相等
C.L 层电子为偶数的所有主族元素所在族的序数
与该元素原子的 L 层电子数相等
D.M 层电子为奇数的所有主族元素所在族的序数
5.原子形成阳离子或阴离子后,其电子层结构发生 了哪些变化?
答案 原子形成阳离子后,要减少一个电子层, 形成阴离子后电子层数不变,但最外层电子数增 多,它们都达到了稳定结构。
6.电子的排布与元素的性质有什么关系?
答案 最外层电子数排满 8 个(He 为 2 个)形成稳定 结构,不易得失电子,化学性质稳定。 最 外 层 电 子 较少 的 (<4) 易 失 去 电 子 ,达 到 稳 定结 构,表现出金属性;最外层电子较多的(>4)易得电 子或形成共用电子对,从而形成稳定结构,表现出 非金属性。通常,我们把最外层 8 个电子(只有 K 层时为 2 个电子)的结构,称为相对稳定结构,一 般不与其他物质发生化学反应。当元素原子的最外 层电子数小于 8(K 层时小于 2)时,是不稳定结构。 在化学反应中,具有不稳定结构的原子,总是“想 方设法”通过各种方式使自己的结构趋向于稳定 结构。
原子核外电子的

原子核外电子的
原子核外电子的排布:在多电子原子中,由于各电子所具有的能量不同,因而分布在离核远近不同的区域内做高速运动。
能量低的电子在离核近的区域内运动,能量高的电子在离核较远的区域内运动。
原子核外电子排布规律:电子总是尽先排布在能量最低的电子层里;每个电子层最多只能排布2n²个电子;K层为最外层时,最多只能容纳两个电子;其它各层为最外层时,最多只能容纳8个电子;次外层最多不超过18个电子。
原子中电子的运动是分层运动的,在含多电子的原子里,电子的能量不同能量低的,通常在离核近的区域运动。
能量高的,通常在离核远的区域运动。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
宏观、微观运动的不同
电子云
电子云:是用统计的方法对核外电子运动规律所 作的一种描述。 描述方法:用点的疏密程度表示电子在某处出现 概率的大小。 过程:给原子拍照。 结果:很像在原子核外有一层疏密不等的“云”。
氢原子的五次瞬间照相
(a)
(b)
5 张照片 100 张照 叠 印 片叠印
(c)
(d)
(e)
原子核外电子的排布
回忆: 1.化学变化中保持不变的是什么?
质子带正电荷
质子
原子核
原子
原子不带电
中子
中子不带电
核外电子
电子带负电荷
原子质量是平均分布还是集中的?
符号 AZX的含义 ?
质量数(A)=质子数(Z)+中子数(N)
质量数和相对原子质量什么关系?
质子数= 核电荷数= 原子序数= 核外电子数
在离子中,是否有这些关系?
用小黑点的 疏密程度来表
示电子在核外空间某处出现
机会的多少,称电子云。
氢原子核外电子的电子云呈 球形对称
电子层——根据电子的能量差异和通常运动 区域离核的远近不同,将能量不同的电子的 运动区域称为电子层。
第 第 第第 第 第
第
一 二 三四 五 六
七
层 层 层层 层 层
层
KL M N O P
Q
层层 层 层 层 层
倒数第三层不超过32个
课堂练习1
1.下列原子结构示意图中,正确的是( B )
A.
B.
C.
D.
2.某元素原子的原子核外有三个电子层,最外层有4个电子, 该原子核内的质子数为( A )
A.14
B.15 C.16
D.17
3.下列叙述正确的是( D)
A.原子都有质子和中子
B.电子云示意图中的小黑点表示一个电子
排布规律
1.电子总是尽先排布在能量最低的电子层 里。离核近,能量低。
2.每个电子层最多只能排2n2个电子。 3.最外层最多只能容纳8个电子。次外层最
多不超过18个电子。倒数第三层最多不 超过32个电子。注意:K层为最外层、次 外层、倒数第三层……。
1→ 2 → 3→ 4→ 5 → 6
K→ L → M→N → O → P
层
由内→外,能量由低→高
核外电子分层排布
电子按能量高低在核外分层排布。
原子结构示意图
为了形象地表示原子的结构,人们就创造了
“原子结构示意图”这种特殊的图形。
第3层 第2层
原子核
第1层
原子核带正电
核电荷数
+ 15 2 8 5
K层 L层 M层
仔细看书上第二页图1-2(核电荷数为 1-18的元素原子结构示意图),回答 下列问题: 核外电子是如何排布的,先排内还是 外? 完成第三页交流与讨论。
2→ 8 →18→32→50→ 2n2
原
由于电子能量的不同而
子 核
分层的排布 分层排布,离核由近到 远,由能量低到能量高 。
外
电 子 的 排 布
排 1.能量由低到高。 布 2.每层最多容纳电子数目是2n2。 的 3.最外层电子数目不超过8个,K 规 层为最外层时不超过2个。
律 4.次外层电子数目不超过18个,
1.什么是元素?什么决定元素种类? 具有相同核电荷数(即质子数)的同一类原 子的总称。质子数决定元素种类。
2.什么是核素?什么是同位素?
具有一定质子数和一定中子数的原子称为核 素。质子数相同而中子数不同的原子互称为 同位素。
同素异形体:同种元素形成的不同单质。
如O2和O3,金刚石和石墨,白磷和红磷。
C.次外层电子数一定是2或8
D.最外层只有一个电子的原子不一定是金属原子
