物质含量的表示方式及适用场合
物质的量是什么 有哪些应用

物质的量是什么有哪些应用
物质的量是表示含有肯定数目粒子的集合体,符号是n,单位为摩尔(mol),它是衡量物质所含粒子数多少的一个物理量。
物质的量是什么
物质的量是用来描述微观粒子的,如分子、原子、离子、质子、中子、电子等。
物质的量是国际单位制的7个基本单位之一。
国际单位制的7个基本单位包括:
长度,米(m)
质量,千克(Kg)
时间,秒(s)
电流,安培(A)
热力学温度,开尔文(K)
物质的量,摩尔(mol)
发光强度,坎德拉(cd)
物质的量在化学试验中的应用
1.物质的量浓度.
(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。
(2)单位:mol/L
(3)物质的量浓度= 溶质的物质的量/溶液的体积CB =
nB/V
2.肯定物质的量浓度的配制
(1)基本原理:依据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.
(2)主要操作
a.检验是否漏水.
b.配制溶液1计算.2称量.3溶解.4转移.5洗涤.6定容.7摇匀8贮存溶液.
(3)留意事项
选用与欲配制溶液体积相同的容量瓶.
使用前必需检查是否漏水.
不能在容量瓶内直接溶解.
溶解完的溶液等冷却至室温时再转移.
定容时,当液面离刻度线1―2cm时改用滴管,以平视法观看加水至液面最低处与刻度相切为止.
3.溶液稀释:C(浓溶液)/V(浓溶液) =C(稀溶液)/V(稀溶液)。
百分含量的符号

百分含量的符号百分含量是指物质在溶液中的质量百分比或体积百分比。
在化学、化工、生物等领域中,百分含量是一种常见的表示物质浓度或纯度的方式。
在表示百分含量时,我们需要使用一些特定的符号来表示,以确保信息的正确传达。
1. 质量百分比符号:质量百分比表示的是溶液中溶质的质量与整个溶液质量之比。
在化学和化工领域中,常用的质量百分比符号包括:- w/w:表示质量百分比,即质量与质量之比。
例如,10%w/w的NaCl溶液表示每100g溶液中有10g的NaCl。
- wt%:也表示质量百分比,是质量与质量的比例。
wt%符号常用于化工领域。
- %:也可以单独使用百分号,但在实际应用中,为了避免歧义,通常要加上w/w或wt%来明确表示质量百分比。
2. 体积百分比符号:体积百分比表示的是溶液中溶质的体积与整个溶液体积之比。
在生物、化学和化工领域中,常用的体积百分比符号包括:- v/v:表示体积百分比,即溶质体积与溶液体积之比。
例如,10% v/v的酒精溶液表示每100 mL溶液中有10 mL的酒精。
- vol%:也可以表示体积百分比,是体积与体积的比例。
vol%符号常用于化工领域。
3. 其他单位:除了质量百分比和体积百分比,还有一些其他常用的百分比单位,如摩尔百分比和体积/体积百分比。
- mol%:表示摩尔百分比,是溶质物质的摩尔数与溶液的总摩尔数之比。
mol%常用于表示化学反应中物质的比例。
- v/v%:表示体积/体积百分比,即体积与体积之比。
常用于表示气体混合物中各个气体成分的百分比。
需要注意的是,在使用质量百分比和体积百分比时,一定要明确标示溶质和溶液的单位,以免产生混淆或误解。
总之,百分含量的符号表示的是溶质在溶液中的质量百分比或体积百分比。
常见的符号包括w/w、wt%、%(需搭配w/w或wt%)、v/v、vol%、mol%和v/v%。
这些符号在化学、化工、生物等领域中被广泛使用,用于表示物质的浓度或纯度,确保信息的准确传达。
“含量”、“浓度”、“分数”、“比”的规范用法
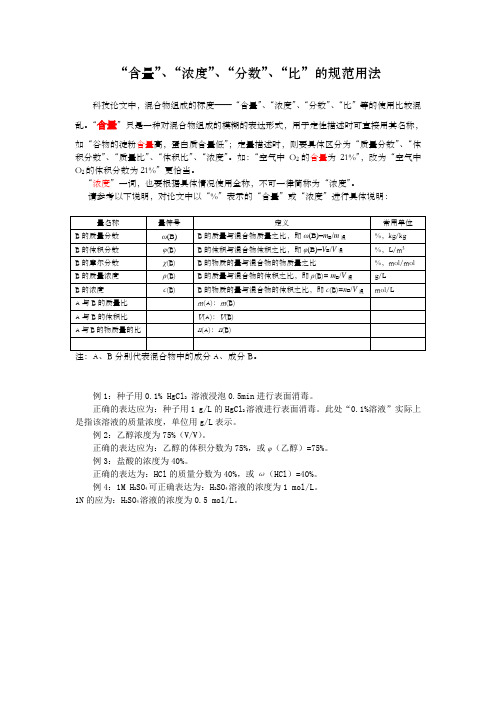
“含量”、“浓度”、“分数”、“比”的规范用法
科技论文中,混合物组成的标度——“含量”、“浓度”、“分数”、“比”等的使用比较混乱。
“含量”只是一种对混合物组成的模糊的表达形式,用于定性描述时可直接用其名称,如“谷物的淀粉含量高,蛋白质含量低”;定量描述时,则要具体区分为“质量分数”、“体积分数”、“质量比”、“体积比”、“浓度”。
如:“空气中O2的含量为21%”,改为“空气中O2的体积分数为21%”更恰当。
“浓度”一词,也要根据具体情况使用全称,不可一律简称为“浓度”。
请参考以下说明,对论文中以“%”表示的“含量”或“浓度”进行具体说明:
例1:种子用0.1% HgCl2溶液浸泡0.5min进行表面消毒。
正确的表达应为:种子用1 g/L的HgCl2溶液进行表面消毒。
此处“0.1%溶液”实际上是指该溶液的质量浓度,单位用g/L表示。
例2:乙醇浓度为75%(V/V)。
正确的表达应为:乙醇的体积分数为75%,或φ(乙醇)=75%。
例3:盐酸的浓度为40%。
正确的表达为:HCl的质量分数为40%,或ω(HCl)=40%。
例4:1M H2SO4可正确表达为:H2SO4溶液的浓度为1 mol/L。
1N的应为:H2SO4溶液的浓度为0.5 mol/L。
质量含量单位

质量含量单位以质量含量单位为标题的文章:质量含量单位是用来衡量物质中某种成分的含量的单位。
它是化学分析、质量控制和质量保证等领域中非常重要的概念。
本文将介绍一些常见的质量含量单位,包括百分比、质量分数、摩尔分数和体积分数,并探讨它们在实际应用中的意义和用途。
一、百分比百分比是最常见的质量含量单位之一,它表示某种成分在物质中所占的百分比。
百分比可以用于描述溶液中溶质的浓度、合金中元素的含量等。
例如,如果某种溶液中溶质的质量为10克,溶液的总质量为100克,则溶液中溶质的质量百分比为10%。
二、质量分数质量分数是指某种成分在物质中的质量与总质量之比。
它是质量含量的一种常用表示形式。
质量分数可以用于描述溶液中溶质的浓度、固体混合物中成分的含量等。
例如,如果某种溶液中溶质的质量为10克,溶液的总质量为100克,则溶液中溶质的质量分数为0.1。
三、摩尔分数摩尔分数是指某种成分在物质中的摩尔数与总摩尔数之比。
它常用于描述气体混合物中各种气体的分布情况。
摩尔分数可以用于计算气体的分压、浓度等。
例如,如果某种气体在混合气体中的摩尔数为10,总摩尔数为100,则该气体的摩尔分数为0.1。
四、体积分数体积分数是指某种成分在物质中的体积与总体积之比。
它常用于描述气体混合物中各种气体的分布情况。
体积分数可以用于计算气体的体积浓度、体积分数等。
例如,如果某种气体在混合气体中的体积为10升,总体积为100升,则该气体的体积分数为0.1。
以上是一些常见的质量含量单位,它们在化学分析和实验中有着重要的应用。
通过测量和计算物质中某种成分的含量,我们可以了解和控制物质的组成和性质,从而实现质量控制和质量保证的目标。
质量含量单位的选择要根据具体情况和需要来确定。
在实际应用中,我们需要根据实验目的和研究要求来选择适合的质量含量单位,并进行准确的测量和计算。
同时,我们还需要注意质量含量单位之间的转换关系,以便在不同单位之间进行换算和比较。
含量测定方法

含量测定方法含量测定方法是一种用于确定物质中某种成分含量的分析方法。
在化学、药学、食品科学等领域,含量测定是非常重要的,它可以帮助我们了解样品中特定成分的含量,从而进行质量控制、研究分析等工作。
下面将介绍几种常见的含量测定方法。
首先,常用的含量测定方法之一是色度法。
色度法是利用物质溶液的颜色深浅来确定其中某种成分含量的方法。
通过比较样品溶液的颜色与标准溶液的颜色深浅,可以确定样品中某种成分的含量。
色度法操作简便,成本较低,因此在实际应用中得到了广泛的应用。
其次,滴定法也是一种常见的含量测定方法。
滴定法是通过向待测溶液中滴加已知浓度的滴定液,通过滴定反应的终点来确定待测溶液中某种成分的含量。
滴定法操作简单,准确性高,特别适用于酸碱含量的测定。
另外,光谱法也是一种常用的含量测定方法。
光谱法是通过分析物质对光的吸收、发射或散射来确定其中某种成分含量的方法。
常见的光谱法包括紫外-可见吸收光谱法、红外光谱法、荧光光谱法等。
光谱法操作简便,灵敏度高,可以用于各种物质的含量测定。
此外,还有重量法、电化学法、色谱法等多种含量测定方法,它们各具特点,适用于不同类型的样品和成分含量的测定。
在选择含量测定方法时,需要根据待测成分的性质、浓度范围、样品类型等因素进行综合考虑。
在进行含量测定时,还需要注意样品的制备、仪器的校准、实验条件的控制等方面的工作,以确保测定结果的准确性和可靠性。
总之,含量测定方法在科学研究和生产实践中发挥着重要作用,不同的含量测定方法各具特点,可以根据具体情况进行选择和应用。
希望本文介绍的含量测定方法对您有所帮助。
含量和标示含量

含量是样品的纯度的体现,标示量是含量除以产品规格后的得到的.如一个样品阿莫西林胶囊(规格0.25g),其中阿莫西林的含量为85%,那它的标示含量就等于(胶囊的装量*85%)/0.25.药物标示量,指该剂型单位剂量的制剂中规定的主药含量,通常在该剂型的标签上表示出来。
例如:一片剂中应含有主药0.1g,但是总有误差的,一般规定在90%—110%,所以你测出主药是0.09g至1.10g/片,都是符合要求1、抗生素的效价抗生素的剂量常用重量和效价来表示。
化学合成和半合成的抗菌药物都以重量表示, 生物合成的抗生素以效价表示, 并同时注明与效价相对应的重量。
效价是以抗菌效能(活性部分)作为衡量的标准, 因此, 效价的高低是衡量抗生素质量的相对标准。
效价以“单位”来表示。
世界上第一个抗生素青霉素, 最初是以“稀释U”(牛津U)来衡量其质量的。
在标准情况下, 能在50ml 肉汤内完全抑制金黄色葡萄球菌(牛津标准菌)生长的青霉素最低含量称1个牛津U。
随着提取纯化技术的提高, 获得青霉素纯品, 1944年, 国际联盟卫生组织规定, 以苄青霉素钠重量作为抗菌活力的标准, 按重量标准, 1μg相当U。
由于以前用牛津U,改成重量U后, 引起临床使用不便, 决定将1个牛津U相当于0.6μg苄青霉素钠所具有的活力, 作为1个国际单位(IU), 即1mg相当于1670IU。
链霉素效价也是从未获纯品时的Waksman稀释U过渡到重量U, 1μg纯链霉素(碱)的抗菌活力为1个链霉素U。
稀释U测定时需无菌操作,样品处理繁复, 误差大;所得结果是两种浓度的范围值, 不能获得绝对值,在应用上受到很大限制, 而逐渐被重量U所取代。
重量U分两类。
一类是以抗生素的活性部分重量为准,1μg=1U,1mg=1000U,如链霉素、土霉素、红霉素等。
另一类是以纯抗生素盐重量作为计算依据,如盐酸四环素、盐酸金霉素, 1μg=1U。
其抗菌活力的衡量, 包括无生物活性的盐酸在内。
食品包装添加物的含量标识单位

食品包装添加物的含量标识单位
食品包装添加物的含量标识单位通常是以重量或体积的形式表示。
常见的含量标识单位有以下几种:
1. %(百分比):表示添加物相对于食品总量的百分比。
例如,某食品添加剂含量标识为1%,表示该添加剂占食品总量的1%。
2. g/kg(克/千克):表示添加物相对于食品总量的重量比例。
例如,某食品添加剂含量标识为5 g/kg,表示该添加剂每千克
食品中的重量为5克。
3. mg/kg(毫克/千克):表示添加物相对于食品总量的重量比例。
例如,某食品添加剂含量标识为200 mg/kg,表示该添加
剂每千克食品中的重量为200毫克。
4. mL/kg(毫升/千克):表示添加物相对于食品总量的体积比例。
例如,某食品添加剂含量标识为10 mL/kg,表示该添加
剂每千克食品中的体积为10毫升。
需要注意的是,具体的食品包装添加物的含量标识单位会根据不同的法规和标准而有所差异。
在购买食品时,应仔细阅读包装上的标签和说明,了解添加物的含量和单位。
表示含量的量,符号与单位

表示含量的量,符号与单位
"含量"是一种量度单位,它代表某种物质在某种测量样品中的绝对或相对比例。
例如,当指定以物理重量或比例测量时,它可以是某种元素的含量,例如重金属含量或重金属含量;也可以是某种活性物质的含量,例如有机氯农药含量。
含量的表达方式可以是比例含量,例如重金属含量的比例表示为总量的百分比,一般以‰(千分之一)表示;也可以是含量量,例如有机氯农药含量,以克每升(g/L)表示。
含量指标是衡量水质龄和水污染程度的重要指标,它可以反映水质形态、污染
特式和水质衰减特征。
例如,污染指数测量的水质污染程度可以衡量有机污染物含量的极限,而发光材料污染指数则可以衡量重金属含量的极限和重金属的稳定性极限。
含量的评估及其衡量标准都十分重要,它可以作为指导管理决策和水质保护的参考。
不仅如此,对于质量及卫生检验中的含量表示方法来说,含量也占据着极其重
要的地位。
质量及卫生检验采用含量表示来确定检测项目在产品样品中的含量水平,即以比例或绝对数来确定检测项目的相对和绝对含量,一般也以‰或g/L表示。
综上所述,含量是一种量度单位,表示某种物质在某种样品中的绝对或相对比例。
在衡量水质龄和水污染程度、质量及卫生检验以及各种行业检验中,含量的评估和衡量标准均十分重要,表示方式以‰或g/L表示,是一种重要的量度单位和量化标准。
百分含量的符号

百分含量的符号百分含量是描述化学物质成分浓度的常见单位之一。
通常用符号“%”表示,表示的是某种物质在总物质中所占的比例。
用百分比表示含量,是因为该单位易于理解和比较,广泛应用于化学、生物学、医学、工程等领域中。
在化学领域中,百分含量指的是某种化学物质在总质量中所占的百分比。
有时,这个含量还可以用质量分数、体积分数、摩尔分数等形式表示。
质量分数是指某种物质所占的质量与总质量的比值;体积分数是指某种物质所占的体积与总体积的比值,通常用于气体中;摩尔分数是指某种物质的物质量与总物质量的摩尔数之比,通常用于溶液中。
在生物学领域中,百分含量用于描述生物活性物质的纯度。
例如,蛋白质的百分含量表示蛋白质在总样品中所占的百分比,纯度越高,百分含量越高。
在医学领域中,百分含量是描述药物有效成分含量的常见单位。
例如,某种药物含有5%的有效成分,意味着每100克药物中含有5克的有效成分。
在工程领域中,百分含量用于描述物质的成分比例。
例如,混凝土的配合比中,用百分含量表示每种物质的占比,以保证混凝土的强度和稳定性。
除了百分含量,还有其他常见的浓度单位,如:1. 摩尔浓度:用摩尔表示溶液中溶质的浓度,即一升溶液中溶质的物质量。
2. 质量浓度:用质量表示溶液中溶质的浓度,即一升溶液中溶质的质量。
3. 体积浓度:用体积表示溶液中溶质的浓度,即一升溶液中溶质的体积。
4. 摩尔分数:某种组分的摩尔数与总摩尔数之比。
总之,百分含量是一种广泛应用于化学、生物学、医学和工程领域中的浓度表示单位,通常用符号“%”表示。
在实际应用中,还需要根据具体情况选择其他不同的浓度单位。
待测组分含量的表示方法

待测组分含量的表示方法随着科技的不断进步,人们对各种物质的含量进行精确测量的需求越来越高。
在实验室、生产现场等各种场合,我们需要准确地知道待测组分的含量,以便做出正确的决策。
本文将介绍几种常见的待测组分含量表示方法,以及它们的优缺点。
一、质量分数质量分数是指单位质量的混合物中,某种组分所占的质量与混合物总质量之比。
例如,一瓶500g的饮料中含有50g的糖,那么它的糖的质量分数为50g/500g=0.1。
质量分数是最为常用的待测组分含量表示方法之一,它具有以下优点:1. 直观易懂:质量分数表示的是待测组分在混合物中所占的比例,这个比例越大,含量就越高,直观易懂。
2. 精度高:质量是一种物理量,可以通过称量等方法进行精确测量,因此质量分数的测量精度很高。
但是,质量分数也存在一些缺点:1. 受样品质量影响:质量分数的计算依赖于样品的总质量,如果样品质量不稳定,那么计算结果也会不稳定。
2. 容易受到杂质干扰:如果混合物中存在其他组分,那么待测组分的质量分数就会受到干扰,不够准确。
二、体积分数体积分数是指单位体积的混合物中,某种组分所占的体积与混合物总体积之比。
例如,一瓶500ml的饮料中含有50ml的糖水,那么它的糖的体积分数为50ml/500ml=0.1。
体积分数也是常用的待测组分含量表示方法之一,它具有以下优点:1. 直观易懂:体积分数表示的是待测组分在混合物中所占的比例,这个比例越大,含量就越高,直观易懂。
2. 适用范围广:体积分数适用于液体、气体等状态的混合物,而质量分数只适用于固体、液体等状态的混合物。
但是,体积分数也存在一些缺点:1. 受温度影响:体积分数的计算依赖于混合物的体积,而混合物的体积受到温度的影响,如果温度变化较大,那么计算结果也会不稳定。
2. 受压力影响:对于气体混合物,体积分数的计算还要考虑压力的影响,这增加了计算的复杂度。
三、摩尔分数摩尔分数是指单位摩尔的混合物中,某种组分所占的摩尔数与混合物总摩尔数之比。
物质成分检测元素单位

物质成分检测元素单位
在物质成分检测中,元素的测量通常使用不同的单位,具体的单位取决于测量的上下文和实验室的标准。
以下是一些常见的元素测量单位:
质量单位:
毫克(milligrams,mg):通常用于测量微量的元素含量。
克(grams,g):通常用于较大量的元素含量。
体积单位:
微升(microliters,μL):通常用于测量极小量的元素,特别是在液体样品中。
毫升(milliliters,mL):通常用于测量液体中的元素。
浓度单位:
毫摩尔(millimoles,mmol):通常用于描述物质的摩尔浓度,即单位体积或单位质量中的摩尔数。
微摩尔(micromoles,μmol):用于描述较小浓度的摩尔浓度。
百分比(%):通常用于表示元素在样品中的百分比,即相对于样品总质量或体积的百分比。
原子单位(atomic units):
原子质量单位(atomic mass unit,amu):用于描述元素的相对原子质量。
这只是一些常见的测量单位,具体使用哪一种取决于实验的需要和国际标准。
在分析化学、化学工程、生物化学等领域,科学家们通常会选择最适合他们实验目的的单位。
待测组分含量的表示方法

待测组分含量的表示方法待测组分含量是指在样品中需要测量的化学物质的浓度或含量。
由于化学物质的浓度或含量会对样品的性质和功能产生重要影响,因此需要精确测定待测组分含量。
以下是几种常见的待测组分含量的表示方法:1. 质量分数:待测组分的质量所占总质量的比例。
通常用百分数表示,即质量分数=(待测组分质量÷总质量)×100%。
例如,硫酸铜溶液中的Cu质量分数为12.5%。
2. 摩尔浓度:待测组分的摩尔数量与溶液体积的比例。
通常用mol/L表示,即摩尔浓度=待测组分的摩尔数量÷溶液体积。
例如,1 M的HCl溶液中的H+离子摩尔浓度为1 mol/L。
3. 比表面积:待测组分在单位质量或体积内的分布面积。
通常用m²/g或m²/mL表示,即比表面积=待测组分分布面积÷单位质量或体积。
例如,颗粒材料的比表面积可以通过氮气吸附法测量得到。
4. 活性:待测组分发挥作用的能力。
通常用活性系数表示,即活性系数=实际浓度÷理论浓度。
例如,酶活性可以通过测量催化反应速率来确定。
5. 相对分子质量:待测组分相对于碳-12的质量比。
通常用相对分子质量来表示化学物质的分子量。
例如,氧气的相对分子质量为32。
6. 浓度比:待测组分浓度之间的比例关系。
通常用比值表示,即浓度比=高浓度/低浓度。
例如,葡萄糖和果糖的浓度比可以反映蜜蜂采取花蜜时主要采取的糖类成分。
以上是常见的待测组分含量的表示方法。
在实际分析中,不同的组分和应用领域需要选择不同的表示方法,以便更准确地描述化学物质的性质和功能。
五室下午第3组 物质含量的表示方式及适用场合

物质含量的表示方式及适用场合2015.12.5刘行云张文李生振刘昊宇潘勋韩畅口腔医学院一、摘要本文总结了有关物质含量的表示方法,并结合实验讨论了各个方法的适用场合。
物质含量的常用表示法有质量分数、质量比、体积分数、体积比、摩尔分数、摩尔比、质量摩尔浓度、质量体积浓度、物质的量浓度、ppm和ppb。
由于称量方法不同,当涉及到固体时,常用和质量有关、和体积无关的表示法;涉及到气体液体时常用和体积有关、和质量无关的表示法;而和物质的量有关的表示法往往都适用;微量成分常用ppm和ppb。
二、前言1、含量与浓度含量是用于定性描述混合物组成的一个大概念,它没有物理量的确切定义,但包括了表示物质含量和成分的所有量。
这一概念与人们熟知的“浓度”的概念很相似。
浓度是物理化学领域中的一个物理量,规定了组分的相对量。
《辞海》(上海辞书出版社,1989年版)中对浓度作了这样的定义:表达溶液中溶剂与溶质存在相对量的一种数量标记。
该词条还列出了浓度常用的4种表示方法:①以溶质和溶剂的质量比值表示的浓度;②摩尔分数;③质量摩尔浓度;④物质的量浓度,亦称物质的浓度。
美国麦格劳·希尔图书公司(McGraw·Hill)出版的《科学技术百科全书》则列举了3种浓度的标度(concent-ration scales):①百分比浓度:a)质量百分比浓度,常用于医药溶液,如or%的盐水;b)体积百分比浓度,气体混合物难以称重,常表示为体积百分数,如空气含氮78%,液体溶于液体的溶液(如酒精),也可用体积百分数表示。
②体积摩尔浓度,每升溶液中溶质的摩尔数,mol/L。
③质量摩尔浓度,每千克溶液中溶质的摩尔数(mol/kg)。
[1]2、混合分散体系及溶液把一种或几种物质分散在另一种物质中就构成分散体系。
其中:被分散的物质称为分散相或分散质;另一种物质称为分散介质或分散剂。
分散质及分散剂都可以是气相或液相或固相。
按照分散相和分散介质的状态可分为多种不同体系。
化学含量符号

化学含量符号及其应用1. 引言化学含量符号是描述化学物质组成中各组分比例的一种简洁表示方法。
它在化学分析、质量控制和规格说明等领域有着广泛的应用。
本文将介绍常用的化学含量符号及其应用,并探讨其在不同情境下的解读方式。
2. 常见的化学含量符号2.1. 百分数(%)百分数是一种最常见的化学含量符号,表示某种化学物质在整体中的质量百分比。
例如,如果某样品中的某种元素含量为20%,则表示该元素占整个样品的质量的20%。
2.2. 体积百分数(% (v/v))体积百分数是指溶液中溶质占据的体积与整个溶液体积之比。
如果一个溶液中某种溶质的体积百分数为10% (v/v),则表示该溶质占整个溶液体积的10%。
2.3. 摩尔分数(X)摩尔分数指的是某种组分的物质在整体中的摩尔比例。
摩尔分数可以由质量百分数和相对分子质量推算得到。
例如,如果一个样品中某种化学物质的摩尔分数为0.5,则表示该物质在整体中的摩尔比例为50%。
2.4. 重量百分比(w/w)重量百分比表示某种物质的质量占整个混合物的质量的百分比。
例如,在一个混合物中,某种某种物质的重量百分比为30% (w/w),则表示该物质占整个混合物质量的30%。
3. 化学含量符号的应用3.1. 化学分析化学含量符号在化学分析中起着至关重要的作用。
通过测量和计算被分析物质的化学含量,可以评估其纯度、确定其组成以及判断其适用性。
化学分析广泛应用于药品、食品、环境监测等领域。
3.2. 质量控制化学含量符号被广泛用于质量控制过程中,尤其是在生产过程中对原材料和成品的检验。
通过控制原材料中各组分的化学含量,可以确保产品的质量稳定性和一致性。
3.3. 规格说明在产品规格说明中,化学含量符号被用于描述产品的组成和质量要求。
这有助于客户了解产品的成分以及其是否符合其特定需求。
4. 解读化学含量符号在解读化学含量符号时,需要注意以下几点:4.1. 必须了解符号的含义不同的化学含量符号表示不同的含量信息,必须清楚各符号之间的区别,才能准确解读。
制剂 含量表示方法

制剂含量表示方法制剂含量表示方法一、引言制剂含量是制药过程中一个重要的指标,用于评估药品的质量和稳定性。
正确的制剂含量表示方法对于药品的研发、生产和质量控制非常关键。
本文将介绍常见的制剂含量表示方法,以及它们的特点和应用范围。
二、质量百分含量法质量百分含量法是最常见和常用的制剂含量表示方法之一。
它是通过计算制剂中所含活性成分的质量与总质量之比,来表示制剂含量的百分比。
例如,一种片剂中含有100mg的活性成分,总质量为500mg,那么该片剂的质量百分含量为20%。
质量百分含量法的优点是简单易行,适用于大多数制剂,尤其是固体制剂。
但是,它不能反映制剂中活性成分的分布情况,也不能区分不同制剂之间的差异。
因此,在一些需要更精确表示制剂含量的情况下,需要使用其他方法。
三、相对含量法相对含量法是一种基于对照品的制剂含量表示方法。
它是通过计算制剂中活性成分与对照品中活性成分的相对含量差异,来表示制剂的含量。
相对含量法常常用于对比制剂之间的差异,或者用于评估制剂的稳定性。
相对含量法的优点是能够直观地反映制剂与对照品之间的差异,适用于制剂含量的比较和评估。
但是,它不能准确表示制剂中活性成分的绝对含量,因此在一些需要准确测定含量的情况下,需要使用其他方法。
四、色度法色度法是一种根据溶液的颜色强度来评估制剂含量的方法。
它是通过比较制剂与标准溶液的颜色强度差异,来判断制剂中活性成分的含量。
色度法常常用于颜色显著的制剂,如染料、颜料等。
色度法的优点是快速简便,适用于颜色显著的制剂。
但是,它不能准确测定活性成分的绝对含量,且对于颜色较浅或颜色差异较小的制剂不适用。
五、含量均匀度法含量均匀度法是一种评估制剂含量均匀性的方法。
它是通过测定制剂中不同位置的样品含量,来评估制剂中活性成分的均匀性。
含量均匀度法常用于液体制剂和悬浮剂。
含量均匀度法的优点是能够评估制剂中活性成分的均匀性,适用于液体制剂和悬浮剂。
但是,它不能准确测定活性成分的绝对含量,且对于固体制剂不适用。
百分含量的符号

百分含量的符号百分含量的符号是指用来表示一个物质在混合物中所占比例的符号。
它通常以“%”为符号,表示百分之几。
在化学、生物、医药等领域中,百分含量的符号被广泛应用。
下面将从以下几个方面详细介绍百分含量的符号。
一、百分含量的定义百分含量是指一个物质在混合物中所占比例,通常以百分数表示。
例如,如果一个混合物中某种化学物质的质量为50克,而这种化学物质在混合物中所占比例为20%,那么这种化学物质的百分含量就是20%。
二、百分含量的计算方法计算一个物质在混合物中的百分含量需要先知道该物质在混合物中所占的重量和混合物总重量。
然后将该物质在混合物中所占重量除以混合物总重量,并将结果乘以100即可得到该物质在混合物中的百分含量。
例如,如果某个混合物总重为200克,其中某种化学成分占据了30克,则这种化学成分在该混合液体中的百分含量可计算为:(30 ÷ 200) × 100% = 15%三、百分含量的应用百分含量广泛应用于化学、生物、医药等领域。
在化学实验中,百分含量常用于计算溶液浓度。
在生物学中,百分含量常用于计算蛋白质含量和细胞密度等参数。
在医药领域中,百分含量常用于计算药品的配方。
四、其他表示百分的符号除了“%”符号以外,还有一些其他表示百分的符号。
例如,“‰”符号表示千分之几,“ppm”(parts per million)表示每一百万份中有几份等。
五、注意事项在使用百分含量时需要注意以下几点:1. 在进行计算时要确保所占重量是同一单位,如克或毫克等。
2. 百分含量只能表示一个物质在混合物中所占比例,并不能反映该物质与其他成分之间的相互作用。
3. 在使用其他表示百分的符号时要注意区别其单位和意义。
总结:本文介绍了关于百分含量的定义、计算方法、应用及注意事项等方面的内容。
通过本文的介绍,相信读者对百分含量的符号有了更加深入的了解。
在实际应用中,我们需要根据不同的领域和具体情况选择合适的百分含量符号,并注意计算方法和注意事项,以确保计算结果准确可靠。
含量方法对比依据

含量方法对比依据在化学分析中,含量测定是极其重要的环节,它关乎到物质的质量控制、产品品质以及生产工艺的优化。
为了确保准确度、精密度与可靠性,必须采用科学有效的方法来进行含量测定。
以下是对不同含量方法进行对比的依据。
一、原理对比每种含量方法都有其特定的原理,这是其操作和应用的基础。
比较各种方法的原理,我们可以得出以下几点结论:1. 滴定法:滴定法依据的是酸碱中和反应,通过滴定剂的加入来测定待测物质的含量。
其优点是操作简便、准确度高,缺点是需要消耗大量试剂,且反应速度较慢。
2. 分光光度法:该方法基于朗伯-比尔定律,通过测定物质对光的吸收程度来确定物质含量。
优点是准确度高、操作简便,缺点是只适用于特定波长的光,且干扰因素较多。
3. 原子吸收光谱法:该方法基于原子能级跃迁原理,通过测定特定元素对光的吸收程度来测定元素含量。
优点是准确度高、操作简便,适用于多种元素分析,缺点是仪器价格昂贵,维护成本高。
4. 色谱法:色谱法依据的是物质在固定相和流动相之间的分配平衡原理,通过色谱柱分离后进行检测。
优点是分离效果好、灵敏度高,缺点是分析时间较长,且对色谱柱和检测器要求较高。
二、准确度与精密度对比含量测定的准确度和精密度是评价一个方法好坏的重要指标。
不同方法的准确度和精密度有所差异:1. 滴定法:滴定法的准确度较高,但由于人为操作误差的存在,精密度相对较低。
2. 分光光度法:该方法的准确度和精密度都较高,尤其在有标准曲线的情况下更为准确。
3. 原子吸收光谱法:该方法的准确度和精密度都很高,干扰因素少,适用于痕量元素分析。
4. 色谱法:色谱法的分离效果好,定性能力强,但其准确度和精密度相对较低,受到色谱柱性能、操作条件等因素的影响。
三、适用范围对比不同的含量测定方法适用于不同的场合和物质类型:1. 滴定法:适用于酸碱中和反应的物质,尤其在废水处理、化工生产等领域应用广泛。
2. 分光光度法:适用于大多数有机物和无机物的测定,如重金属离子、有机酸等,在环境监测、食品分析等领域应用广泛。
“含量”、“浓度”、“分数”、“比”的规范用法

“含量”、“浓度”、“分数”、“比”的规范用法
科技论文中,混合物组成的标度——“含量”、“浓度”、“分数”、“比”等的使用比较混乱。
“含量”只是一种对混合物组成的模糊的表达形式,用于定性描述时可直接用其名称,如“谷物的淀粉含量高,蛋白质含量低”;定量描述时,则要具体区分为“质量分数”、“体积分数”、“质量比”、“体积比”、“浓度”。
如:“空气中O2的含量为21%”,改为“空气中O2的体积分数为21%”更恰当。
“浓度”一词,也要根据具体情况使用全称,不可一律简称为“浓度”。
请参考以下说明,对论文中以“%”表示的“含量”或“浓度”进行具体说明:
例1:种子用0.1% HgCl2溶液浸泡0.5min进行表面消毒。
正确的表达应为:种子用1 g/L的HgCl2溶液进行表面消毒。
此处“0.1%溶液”实际上是指该溶液的质量浓度,单位用g/L表示。
例2:乙醇浓度为75%(V/V)。
正确的表达应为:乙醇的体积分数为75%,或φ(乙醇)=75%。
例3:盐酸的浓度为40%。
正确的表达为:HCl的质量分数为40%,或ω(HCl)=40%。
例4:1M H2SO4可正确表达为:H2SO4溶液的浓度为1 mol/L。
1N的应为:H2SO4溶液的浓度为0.5 mol/L。
质量含量单位

质量含量单位质量含量单位是用来描述物质中某种成分的含量的单位。
在科学研究和工业生产中,准确地测定和描述物质中的成分含量是非常重要的。
本文将从质量含量单位的不同类型和其在实际应用中的意义等方面进行描述,以增强读者对质量含量单位的理解。
质量含量单位可以分为百分数、千分数、百万分数等。
百分数是最常见的一种质量含量单位,它表示某种成分在整个物质中所占的比例,以百分号(%)表示。
例如,如果一种物质中含有60%的水分,就表示每100克物质中有60克是水。
而千分数是指某种成分在整个物质中所占的比例,以千分号(‰)表示。
百万分数是指某种成分在整个物质中所占的比例,以百万分之一(ppm)表示。
这些质量含量单位的使用,可以让我们更准确地描述物质中的成分含量。
质量含量单位在实际应用中有着广泛的意义。
首先,它在化学分析中起到了重要的作用。
化学分析是研究物质中各种成分含量及其相互关系的方法。
通过使用质量含量单位,可以准确地测定和描述物质中各种成分的含量,从而揭示物质的组成和性质。
化学分析广泛应用于医药、环境保护、农业等领域,为相关科学研究和工业生产提供了重要的依据。
质量含量单位在食品安全监测中也发挥着重要的作用。
食品安全是人们生活中的重要问题,而质量含量单位可以用来衡量食品中的有害物质的含量。
例如,食品中的农药残留、重金属含量等,都可以用质量含量单位来描述。
通过对食品中各种成分含量的检测和监测,可以保证食品安全,保障人民的身体健康。
质量含量单位还在工业生产中得到广泛应用。
在许多工业生产过程中,需要对原材料和成品进行质量检测和控制。
通过使用质量含量单位,可以对原材料和成品中的各种成分进行准确的测定和描述,从而确保产品质量的稳定性和一致性。
质量含量单位的使用不仅可以提高产品的质量,还可以降低生产成本,提高生产效率。
质量含量单位是用来描述物质中某种成分的含量的单位。
它在科学研究和工业生产中具有重要的意义。
通过使用质量含量单位,可以准确地测定和描述物质中的成分含量,揭示物质的组成和性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质含量的表示方式及适用场合
完成日期:2015.12.03 一、摘要
本文主要从本实验出发,讨论、总结并归纳物质含量的表示方式及其适用场合。
二、前言
物质含量的表示方式是化学中很重要的内容。
由于物质含量表示方式很多,不同的方式适用的场合有有所不同,所以相对比较繁杂。
在本实验中,我们涉及到了三价铁离子的含量表示方法,不少同学一开始不知用什么方式表示而使实验数据处理进行的不是那么顺利,本文将详细地总结物质含量的表示方式及其适用场合,以帮助大家熟练地运用这些知识。
三、内容
(一)物质含量的表示方式及大致适用范围
物质含量的表示方式多种多样,较为繁杂,大致可分为以下两类:一类是用溶质与溶剂或溶液的相对量表示,它们的量可以是克(g)、摩尔(mol)、体积(L)等;另一类是用一定体积溶液中所含溶质的量表示。
(注:凡是两种或两种以上的物质混合形成均匀稳定的分散体系叫做溶液。
按此定义,溶液可以是液态,也可以是气态或固态。
)具体可以分为以下几类:
1、质量分数:溶质的质量与溶液质量之比,符号为w,无量纲,可用分数或
百分数表示。
主要适用于固态及液态溶液。
2、摩尔分数或物质的量分数:溶质与溶剂的物质的量之比,符号为x,无量
纲,可用分数或百分数表示。
由于在化学反应中物质的质量比是很复杂
的,但是其间物质的量之比是很简单的,用摩尔分数表示可以直接和化学
反应联系起来。
因此主要适用于化学反应过程中,对固、液、气三态都适
用。
3、质量摩尔浓度:溶质的物质的量除以溶剂的质量,符号为m,国际单位为
mol/kg。
由于物质的质量摩尔浓度与温度无关,在解释非电解质溶液的依
数性时通常使用该浓度表示方式,在热力学处理中也比较方便,在电化学
中也主要采用该浓度表示电解质的浓度。
4、质量浓度:单位体积混合物中某组分的质量称为该组分的质量浓度,以符
号ρn表示,国际单位为kg/m3。
因为涉及溶液体积,这种方法主要适用于
液态溶液。
实验中我们所用的就是这个浓度,只是考虑到选取较适合的单
位,我们所用的单位为mg/mL。
5、体积分数:相同温度、压力下,溶液中某组分混合前的体积与混合前各组
分的体积总和之比,符号为φ,无量纲,可用分数或百分数表示。
主要是用温度、压力条件相同的液态和气态溶液,但是由于气体混合之后体积改变比较大,所以更适用于液态溶液。
6、物质的量浓度:溶液的单位体积所含溶质物质的量,符号为c,单位为
mol/L(或mol/dm3)、mmol/mL(或mmol/cm3)。
由于涉及溶液的体积,广泛用于液态溶液,在固态和气态溶液中基本不使用。
该种表示方式是实验室最常用的表示方式,但是由于溶液的密度或体积随温度会发生一定的变化,因此在精确测量时可能会造成一定的差别,但是基本不会有影响。
7、比例浓度:实验室常用1:1的盐酸来溶解矿物样,这种比例表示的浓度称
为比例浓度,在此是指市售浓盐酸和水按体积比1:1配制的。
这样的表示方法很简单,这样的溶液也最容易配制。
但是由于商品的精度是有限的,所以不适合精确度较高的场合。
这种方法也适用于硝酸、硫酸、氨水等市售液态试剂的配制。
8、波美度:表示溶液浓度的一种方法。
把波美比重计浸入所测溶液中,得到
的度数就叫波美度。
波美比重计有两种:一种叫重表,用于测量比水重的液体;另一种叫轻表,用于测量比水轻的液体。
当测得波美度后,从相应化学手册的对照表中可以方便地查出溶液的质量百分比浓度。
例如,在15℃测得浓硫酸的波美度是66°Bé,查表可知硫酸的质量百分比浓度是98%。
显然,这种方法只适合在测量液态溶液。
9、ppm和ppb:这种表示方式其实是一种比例关系,用ppm(10-6,百万分之
一)和ppb(10-9,十亿分之一)来表示,可以指质量,也可以指物质的量,
有时也指体积。
适用于气、液、固三态溶液,对气态物质常指物质的量或体积,对固态和液态物质,往往指质量。
由于其表示的浓度极小,所以经常用来指微量成分的含量。
我们实验中用此来表示摩尔盐中三价铁离子的含量正是因为这个原因。
但是,按国际纯粹与应用化学联合会的现行规定,这两种方式已经不再使用。
值得注意的是,尽管表示物质含量的方式很多,但是在很多情况下有些表示方式之间是可以相互换算的,在适当的场合可以将其联系起来。
(二)某些特定情况下的含量表示方式选择(以本实验为例)
本实验涉及物质含量的主要是比尔-朗伯定律。
其中吸光度可以由A=ε·l·c,其中ε为比例常数,l为溶液层厚度,c为溶液的浓度,浓度的单位一般为mol/L或g/L。
当介质厚度以cm 为单位,吸光物质浓度以g/L为单位时,ε称为吸收系数,其单位为L·g-1·cm-1。
当介质厚度以cm 为单位,吸光物质浓度以mol/L为单位时,ε称为摩尔吸收系数,其单位为L·mol-1·cm-1。
这是可以互换的,并且得到的A-c工作曲线将会是一条直线,数据
十分直观。
但是,如果溶液的浓度用质量分数、摩尔分数等表示,A-c曲线不再是线性相关的直线,显然就不能直观地表示吸光度A与浓度c之间的关系,这会给实验数据的测量造成一定的困难。
同时,在实验过程中,因为溶液体积为mL,浓度采用单位mg/mL也使得实验数据的处理变得十分简单,不必进行数量级之间的转换。
所以我们应该在不同的场合进行详细的分析,选择其适合的物质含量的表达方式。
四、结论
物质含量的表示方式多种多样,较为繁杂,但是都表明了溶剂与溶质的相对含量。
有些表示方式之间是可以相互换算的,在适当的场合可以将其联系起来。
但是,不同的含量表示方式也有不同的适用场合,我们要学会根据不同的需要,区别并采用不同的表示方式。
五、参考文献
[1]华彤文,陈景祖.普通化学原理[M].北京:北京大学出版社,2010:50-53.
[2]liuguang008.朗伯比尔定律维基百科[OL].2011:1.。
