《强酸与强碱的中和滴定》人教版
人教版高中化学第二册必修酸碱中和滴定

酸碱中和滴定[学习目标]1.理解酸碱中和滴定的原理。
2.初步了解酸碱中和滴定的操作方法。
3.掌握有关酸碱中和滴定的简单计算。
[学习重点]酸碱中和滴定的原理教学难点酸碱中和滴定的计量依据及计算教学过程什么叫定性分折 ____________________________________________________________什么叫定量分折 ____________________________________________________________酸碱中和滴定 ____________________________________________________一:酸碱中和滴定的原理:1.酸、碱反应的本质为:H++OH==H2O例:HCl+NaOH===NaCl+H2O贝卜nHCl)=伏“⑺」(v为化学计量数)如用A代表酸,用B代表碱,则有: n (NaOH) v (NaOH) 1又因c = n所以n=cV v*VA2二 3 二7, c(B)=咧. 3A) c (B )V (B)则上式可表示为: 如为一元酸和一元碱中和时:v (B) v (A) V (B)B c (A)V (A)由于v(B) = 1,则有:c(B)= '二二),因此c(B)的大小就决定于V (A)的大小。
v (A) V ( B )二、酸碱中和滴定的操作滴定步骤及误差分析:[实验3—13]用已知浓度的HCl滴定未知浓度的NaOH溶液。
1.准备工作:①洗涤锥形瓶。
(用水洗净即可,如用待测液润洗,结果会偏大)②洗涤滴定管、检查是否漏水。
(滴定管用标准液润洗,否则结果偏大)2.滴定阶段:加液、排气泡、调整液面、加指示剂、滴定、观察、记录、数据处理。
3复滴定2〜3次。
4总结提高]1.通过化学反应掌握滴定原理。
5.掌握滴定误差大小的关键V (A)。
关于酸碱中和滴定的一些问题1.等当点当滴加的标准溶液和被测物质恰好反应时,这一时刻称为等当点。
人教版高中化学选择性必修第1册 《酸碱中和滴定》教学设计

《酸碱中和滴定》教学设计一、教材分析本节内容属于分析化学的知识,主要讨论定量分析中强酸与强碱的中和滴定,酸碱中和滴定操作简单、快速,并且有足够的准确性,因此,该方法具有很大的实用价值,在工农业生产和科学研究中被广泛应用。
在定量分析中,实验误差是客观存在的,需要对所得实验数据精选处理和评价,培养学生实事求是的科学态度。
二、学情分析学生已经掌握了酸碱中和反应的实质,同时具备一定的酸碱指示剂使用的知识,对中和滴定使用的部分仪器也有了初步了解。
具备一定的对定量实验现象的分析、描述、探讨能力和应用化学知识解决实际问题的能力。
具备少量定量实验的基础,比如“配制一定物质的量浓度的溶液”、“硫酸铜结晶水含量的测定”、“中和热的测定”等定量实验。
三、素养目标【教学目标】1.理解酸碱中和滴定原理,了解酸碱中和滴定的基本操作。
2.能进行酸碱中和滴定的相关计算。
3.通过中和滴定实验数据的处理和计算,培养实事求是的实验态度。
【评价目标】1.通过了解生产生活、科研中的定量分析方法,认识分析化学方法在科研中重要性,发展定量研究的意识。
2.通过实验操作,数据分析等多种思维活动,培养定量分析的科学态度。
3.能基于酸碱中和滴定的基本操作,实现对氧化还原滴定,沉淀滴定等分析化学方法的认识。
四、教学重点、难点1.教学重点:酸碱中和滴定的原理,滴定的操作。
2.教学难点:酸碱中和滴定的计量依据及计算。
五、教学方法讲解、演示实验 六、教学设计思路本节课以简单的酸碱中和反应的计算入手,引出对酸碱中和滴定原理的理解。
以问题为导向,通过探究活动一:滴定实验的关键问题是什么?引出对实验仪器的认识,掌握滴定管的结构和酸碱式滴定管的区别.通过探究活动二:如何恰好判断滴定终点?引出指示剂的选择相关知识点.通过探究活动三:计算滴定前后溶液PH 的变化.引出对滴定突变的理解,作出滴定过程中溶液PH 变化图像,判定滴定终点等问题.实验具体操作过程,结合课本上的实验步骤, 通过视频展示给学生.最后通过实验数据的处理,培养学生严谨的科学态度. 七、教学流程 教学目标目标3目标2目标1教学环节设计意图八、教学过程 酸碱中和滴定终点如何通过直观现象表征出来?以问题为向导引导学生阅读教材,分析归纳,探寻酸碱指示剂的选择关键点,正确选择合理的指示剂.通过观看实验操作视频,以及阅读课本中的实验步骤相结合的方式,进一步熟悉实验操作细节.通过对实验数据的处理,培养学生严谨的科学态度.通过滴定前后溶液PH 的计算,让学生充分认识到滴定过程中溶液PH 变化图像,进一步理解指示剂突变点前后颜色的变化. 以PH 在实际生产生活中的应用为情境引入课题,引导学生了解PH 的发展史。
人教版《酸碱中和滴定》课件PPT

① 强酸——强碱: 选酚酞或甲基橙都可以
② 强酸滴定弱碱: 滴定终点为酸性,选甲基橙
③ 强碱滴定弱酸: 滴定终点为碱性,选酚酞
⑷滴定终点的判断:当滴入最后一滴××标准溶液后,溶液由
××色变成××色,且半分钟内不变色,说明达到滴定终点。
酚 酞
甲基橙
强碱滴定强酸
无色→浅红色
橙色→黄色
强酸滴定强碱
红色→无色
10mol/L HCl中滴加0.
酸碱指示剂的颜色在此pH值突跃范围发生明显的改变,则就能以较小的误差指示出滴定终点的到达。
0mL
B.
①检查:先检查酸、碱滴定管是否漏水。
2、滴定管的使用方法:
依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。
00 mL,取出部分溶液后,俯视液面,读数为11.
由 红色突变为无色,且半分钟内不变色 ,说明达到滴定终点。
②若用甲基橙作指示剂,当滴入最后一滴盐酸时,溶液的颜色
由 黄色变为橙色,且半分钟内不变色
,说明达到滴定终点。
特别提醒:1.中和滴定终点是指示剂颜色发生突变的点,但不
一定是酸碱恰好中和的点。通常有一定误差(允许误差)。
(3)实验数据的处理重复实验2~3次,取消耗标准液体积的平
0mL
B.
黄色变为橙色,且半分钟内不变色
1mL,允许估计到0.
①检查仪器:使用前先检查滴定管活塞是否漏水。
依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。
①若用酚酞作指示剂,当滴入最后一滴盐酸时,溶液的颜色由
,说明达到滴定终点。
④调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满反应液,并使液面处于“0”刻度或以下某刻度,读数并记录。
《第三章 实验活动2 强酸与强碱的中和滴定》学历案-高中化学人教版19选修1

《强酸与强碱的中和滴定》学历案(第一课时)一、学习主题本节课的学习主题为“强酸与强碱的中和滴定”。
这一主题旨在让学生掌握中和反应的基本原理,理解滴定实验在化学分析中的应用,并能够通过实验操作掌握滴定实验的技巧和注意事项。
二、学习目标1. 掌握中和反应的基本原理,理解强酸与强碱中和反应的实质。
2. 了解滴定实验的基本原理和在化学分析中的应用。
3. 学会使用滴定管进行实验操作,掌握滴定实验的技巧和注意事项。
4. 培养学生的实验操作能力和观察记录能力,提高学生的科学素养。
三、评价任务1. 学生对中和反应原理的理解程度,能够准确解释强酸与强碱中和反应的过程。
2. 学生掌握滴定实验的原理和操作技巧,能够独立完成滴定实验并记录实验数据。
3. 学生观察记录的能力,能够准确记录实验现象和数据,并进行分析和总结。
四、学习过程1. 导入新课:通过回顾酸碱指示剂的使用,引出中和反应的概念,为学习强酸与强碱的中和滴定做铺垫。
2. 学习新知:讲解中和反应的原理,介绍强酸与强碱中和反应的特点;讲解滴定实验的原理和在化学分析中的应用,让学生了解滴定实验的重要性和实用性。
3. 实验操作:演示滴定实验的操作步骤,包括滴定管的使用、滴定过程的注意事项等;学生分组进行实验操作,教师巡视指导,及时纠正学生的错误操作。
4. 数据分析:学生根据实验数据,绘制滴定曲线,分析滴定终点,计算酸碱浓度;教师引导学生对实验数据进行讨论和分析,加深学生对中和滴定的理解。
5. 课堂小结:总结本节课的学习内容,强调强酸与强碱的中和滴定在化学分析中的应用和重要性;布置课后作业,要求学生完成实验报告的撰写。
五、检测与作业1. 完成实验报告:学生根据实验过程和结果,撰写实验报告,包括实验目的、步骤、数据记录与分析、结论等。
2. 课堂小测验:对中和反应及滴定实验的相关知识进行小测验,检测学生对本节课的掌握情况。
3. 预习下一课:要求学生预习下一课的内容,为下一节课的学习做好准备。
人教版高中化学选择性必修第1册 实验活动2 强酸与强碱的中和滴定 教学设计

实验活动2 强酸与强碱的中和滴定教学设计一. 教材分析本节内容选自人教版选择性必修一实验活动2。
酸碱中和滴定操作简便,快速,有足够的准确性,因此,该方法在工农业生产和科学研究中被广泛使用。
中和滴定是继配置一定物质的量浓度溶液以后的一个定量实验,也是教材中的三个定量实验之一,本节内容主要是演示实验以及学生动手实验将前期所学的酸碱中和理论知识应用于实践,培养学生的动手能力与严肃认真的科学态度和科学素养。
二.学情分析在进行本节实验活动前,学生已经学习了酸碱中和的理论知识,了解了酸碱滴定管的使用,酸碱指示剂的变色范围和应用,物质的量浓度的计算,溶液的pH等知识,因此学生在教师的演示实验下,是有能力自己进行相关的实验操作的。
本节内容主要是培养学生理论联系实际,自己动手实验的能力,以及体量定量实验在化学研究中的作用。
三.素养目标【教学目标】(1)通过练习中和滴定的实验操作,理解中和滴定原理,培养变化观念与平衡思想、科学探究与创新意识等学科核心素养。
(2)通过实验进一步掌握数据分析的方法,体会定量实验在化学研究中的作用,培养宏观辨识与微观探析等学科核心素养。
【评价目标】(1)通过对实验的操作,诊断学生实验的动手能力以及实验的规范能力。
(2)通过对实验数据的分析,诊断学生的对实验原理的理解,发展学生处理数据并进行分析的能力。
四.教学重难点重点:酸碱中和滴定的实验操作与误差分析难点:实验误差的分析五.教学方法教法:演示实验法讲授法学法:小组合作法六.教学设计思路本节内容是在学生已经学习了酸碱中和滴定的基本原理上进行展开的。
因此本节课主要内容是实验教学。
由酸碱中和滴定在生产生活中的应用引入,让学生了解酸碱中和滴定的学习并不是纯粹的理论,也是有实际应用的。
实验教学通过教师的演示实验带领着学生熟悉实验的过程,通过对错误实验操作的辨析,进一步强化学生对酸碱中和滴定实验操作的认识,结合错误的实验操作来诊断可能造成的实验误差。
人教版酸碱中和滴定课件ppt

NaOH 溶液的体积( )
A.大于20 mL BA.小于20 mL
C.等于20 mL D.等于5 mL
3、下列是一段关于中和滴定的实验叙述:
⑴ 取一锥形瓶,用待测NaOH溶液润洗两次;
⑵ 在锥形瓶中放入25.00 ml待测液NaOH溶液;
⑶ 加入几滴石蕊试剂作指示剂;
⑷ 取一支酸式滴定管,洗涤干净后;
正确的是 A.在量筒的上端
( B)
B.在滴定管上端
C 在托盘天平刻度尺的正中
D 在托盘天平刻度尺的右边
2.(2001天津12)在一支25 mL的酸式滴定管中盛
入0.lmol·L-1 HCl溶液,其液面恰好在5 mL的刻
度处,若把滴定管中的溶液全部放入烧杯中,然后
以0.lmol·L-1 NaOH 溶液进行中和.则所需
加入少量水检查活塞或橡 胶管是否漏水,再检查活塞 转动是否灵活。
2、滴定管和锥形瓶的洗涤(2次)
洗涤剂
自来水
标准液润洗
(2~3次)
蒸馏水
锥形瓶不能用待测液润洗
3、向滴定管和锥形瓶中加液
1)、取标准盐酸溶液: 注入标准液至“0”刻度线以上; 固定在滴定管夹上;
迅速转动活塞将尖嘴气泡排除并调整液面在“0”刻度
读数
20
20
20
21
21
21
平视:凹液面 俯视
仰视
视线与凹液面最低点相切
20
或在同一水平线上
21
仪器的使用
答案:
25.60mL
3、酸碱中和滴定的操作步骤
1、检查。
2、洗涤、润洗(2~3次)。
3、加液、调节起始刻度。
4、加入指示剂。(并在瓶底衬一张白纸)
高二化学酸碱中和滴定人教版

高二化学酸碱中和滴定人教版【本讲教育信息】一. 教课内容:酸碱中和滴定二. 要点、难点1.使学生掌握酸碱中和的原理和相关计算。
2.初步掌握中和滴定的实验操作方法。
3.学会对中和滴定过程中的偏差进行剖析,培育学生的思想能力。
三. 知识剖析酸碱中和滴定原理1.观点(1)定性剖析和定量剖析定性剖析:判定物质的成分定量剖析:测定各成分的含量(2)酸碱中和滴定用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的实验方法。
2.酸碱中和滴定原理(1)本质: H + +OH -= H 2O(2)原理:在中和反响中使用一种已知物质的量浓度的酸(或碱)溶液与未知物质的量浓度的碱(或酸)溶液完整中和,测出二者所用的体积,依据化学方程式中酸碱物质的量比求出未知溶液的物质的量浓度。
(3)要点:正确测定参加反响的两种溶液的体积和正确判断中和反响能否恰巧完整。
正确测定参加反响的两种溶液的体积所用的仪器是滴定管。
正确判断中和反响能否恰巧完整部是借助酸碱指示剂。
(4)酸、碱指示剂的选择计算题:在 0.1000mol / L 的盐酸 20.00mL 中逐滴滴入0.1000mol / L 氢氧化钠溶液40.00mL 。
①判断以下状况下溶液的pH。
a. 未滴氢氧化钠溶液时盐酸溶液的pH ( pH1)b.滴加氢氧化钠溶液到完整反响相差一滴( 1 滴溶液的体积是0.04mL )这时溶液的pH ( pH4)c. 完整反响后再多加1滴氢氧化钠溶液时的pH ( pH10)d. 逐滴加入氢氧化钠溶液40.00mL 时溶液的pH ( pH12.5)② 跟完整反响所需氢氧化钠溶液相差一滴(或多加一滴),对计算盐酸的浓度有没有影响?(经过计算说明)解:0.10000.02000.1002(mol / L) 跟本质浓度0.1000mol / L 对比,偏差很小。
C酸0.019960.1000mol / L 氢氧化钠溶液逐滴加入20.00mL0.1000mol / L 盐酸溶液时,溶液 pH 的变化曲线和指示剂的变色状况。
人教版《酸碱中和滴定》优质ppt课件

目录
酸碱中和滴定和概念和原理 实验仪器及方法 实验试剂
滴定操作 数据处理
目录
酸碱中和滴定和概念和原理 实验仪器及方法 实验试剂
滴定操作 数据处理
酸碱中和滴定和概念和原理
标准溶液
待测溶液
➢酸碱中和滴定 滴定管实际滴出的溶液体积=滴定后的读数-滴定前的读数
岂能尽如人意,但求无愧我心.
A.在量筒的上端 B.在滴定管上端
滴定终点判断的答题模板
当 滴 入 最 后 一 滴 ××× 标 准 溶 液 后 , 溶 液 由 ×× 色 变 成 ××色,且半分钟内不褪色,说明达到滴定终点。
用标准碘溶液滴定溶有 SO2的水溶液,以测定水中SO2的含 量,应选取什么溶液作指示剂?达到滴定终点的现象是什么?
提示:淀粉溶液。当滴入最后半滴碘标准液时,溶液由无色变为蓝色,且半分钟 内不褪色。
滴定操作 数据处理
数据处理
第一次和第三次的平均值:V ( NaOH)== 20.11+20.09 == 20.10mL
2
c(NaOH)·V ( NaOH)
0.1000×20.10
c(HCl ) ==
==
== 0.1005mol/L
V ( HCl )
20.00
及时练习
例:(2021·石家庄高二测试)取20.00 mL 0.50 mol·L-1 NaOH溶
01 00
利用中和反应,用已知浓度的 mL,最后一位为估读值。
mL酸性KMnO4溶液
酸
(
或
碱
)来测定未知浓度的碱(或酸)
c(NaOH)·V ( NaOH)
的实验方法。 01 mL,最后一位为估读值。
用标准碘溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,应选取什么溶液作指示剂?达到滴定终点的现象是什么?
3.2强酸与强碱的中和滴定-酸碱中和滴定教学设计2023-2024学年高二上学期化学人教版2019

第三章第二节实验活动2强酸与强碱的中和滴定-酸碱中和滴定【教材分析】本节是普通高中课程标准实验教科书化学选择性必修1《 化学反应原理》第三章第二节内容。
第一课时教材从溶液的酸碱性和PH的计算角度来让学生有初步的印象,本节内容是高中学生初次接触的分析化学的内容,从PH的应用等角度简单介绍测试和调控溶液的PH对公农业科学研究,以及日常生活和医疗保健都具有重要意义,引入酸碱滴定概念及使用价值,在此基础上,教材转入对本节重点内容及酸碱中和滴定的原理的介绍,中和滴定是继配置一定物质的量浓度溶液以后的一个定量实验,也是教材中三个定量实验之一。
本节内容综合了物质的量浓度的计算,溶液的PH,酸碱指示剂的变色范围和应用滴定仪器的使用等知识介绍了一种定量分析的方法,综合滴定使化学研究,从定性分析转化为定量分析,解释了什么叫酸碱中和滴定以及酸碱中和滴定的使用价值,重点讨论了酸碱中和滴定原理的三个含义,第一,酸碱中和反应的实质,第二,酸碱中和滴定的计量依据和计算,具体展示了进行中和滴定的有关计算的格式,第三,准确判断中和反应是否恰好进行完全,接着教材以盐酸滴定未知浓度的氢氧化钠溶液为例,详细的讨论了滴定过程中溶液PH的变化,以及溶液从碱性经中性突变到微酸性的过程,说明可以选择合适的指示剂,并根据指示剂在酸性或碱性溶液中的颜色变化来判断来准确判断中和反应是否恰好进行完全。
教材第二部分主要是利用演示实验,将理论应用于实践,不仅将整个滴定过程由教师向学生示范一遍,而且连同如何实验数据,如何利用测得的实验数据来进行有关的计算等,都较详细的介绍给了学生,培养了学生严肃认真的科学态度和科学素养。
在本教材中没有利用数字化实验来进行酸碱中和滴定,所以学生不能很好的理解滴定突变,无法进行直观的认识。
所以在本节教学中引入了数字化实验,不仅能够培养学生的观察能力,还能够深化学生对事物变化中量的关系的认识,理解化学变化的本质。
教学内容设置是以定量实验为基础,利用专用仪器和化学反应计量关系来认识客观世界。
3.2.3酸碱中和滴定高二上学期化学人教版(2019)选择性必修1(共38张PPT)

【练一练】
4、以甲基橙为指示剂,用标准的盐酸来滴定未知浓度的氢 氧化钠溶液,滴定达终点时,溶液颜色变化是( C ) A、由黄色到红色 B、由橙色到红色 C、由黄色到橙色 D、由红色到橙色
二、酸碱中和滴定误差分析
1、误差分析依据
中和滴定实验中,产生误差的途径主要有操作不当、读数不 准等,分 析误差要根据计算式分析,c (标准) ·V(标准)=c (待测) ·V(待测),所以
a
b带玻璃球的橡胶塞
仪器a 是酸式滴定管,仪器b是碱式滴定管 标注温度、量程
“0”刻度线在上
50-
玻璃塞 a
b
带玻璃球的橡胶塞
③规格:滴定管的最小分度是0.1 mL ,实验室中常用滴定管的规格有 25 mL 和50 mL 两种 ④滴定管的 读数方法 0刻度在上,从上往下 读,读数时取小数点后两位,估读 至0.01 mL ; 如 :24.00 mL、 23.38 mL
②润洗仪器:滴定管在加入酸、碱反应液之前,先用蒸馏水洗涤干净, 然后分别用待装液润洗2~3次 (润洗)润洗的方法:从滴定管上口加入 3~5 mL所要盛装的酸或碱,倾斜着转动滴定管,使液体润湿全部滴定 管内壁。然后,一手控制活塞(轻轻转动酸式滴定管的活塞;或者轻轻挤 压碱式滴定管中的玻璃球),将液体从滴定管下部放入预置的烧杯中
中和滴定记忆口决 先查漏液再润洗,装液排气调液面; 左手活塞右手瓶,瓶不润洗要记清; 眼看颜色手不停,三十秒钟要记清。
5、指示剂的选择
思考 2、为什么要用酸碱指示剂? 加入指示剂是为了确定化学反应的终点
3、如何选择合适的指示剂?
(1)中和滴定曲线:以滴加酸(或碱)的量为横坐标,以溶液的pH 为纵 坐标绘出一条溶液的pH 随酸(或碱)的滴加量而变化的曲线
《强酸与强碱的中和滴定》 说课稿

《强酸与强碱的中和滴定》说课稿尊敬的各位评委老师:大家好!今天我说课的题目是《强酸与强碱的中和滴定》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程、板书设计以及教学反思这几个方面来展开我的说课。
一、教材分析“强酸与强碱的中和滴定”是高中化学中的重要实验内容,它位于人教版高中化学选修 4《化学反应原理》第三章第四节。
这部分内容是在学生已经学习了酸碱中和反应的基础上,进一步深入探究定量分析酸碱反应的方法。
通过本实验,学生能够更深刻地理解酸碱中和的本质,掌握定量分析的基本技能,为后续学习化学平衡和溶液中的离子平衡等知识奠定基础。
教材首先介绍了中和滴定的原理,即利用酸碱中和反应,通过已知浓度的标准溶液来测定未知浓度溶液的浓度。
然后详细阐述了实验仪器和试剂、实验操作步骤以及数据处理和误差分析等方面的内容。
教材内容编排合理,逻辑清晰,注重培养学生的实验操作能力和数据分析能力。
二、学情分析学生在之前的学习中已经掌握了酸碱中和反应的基本概念和化学方程式的书写,也具备了一定的实验操作基础。
但是,对于定量分析实验的设计和操作,学生还比较陌生,需要在教师的引导下逐步掌握。
此外,学生在数据处理和误差分析方面的能力还有待提高,需要通过实际操作和练习来加强。
三、教学目标1、知识与技能目标(1)理解中和滴定的原理,掌握中和滴定的操作方法和步骤。
(2)学会使用酸式滴定管和碱式滴定管,能够准确读取滴定管的读数。
(3)掌握数据处理和误差分析的方法,能够根据实验数据计算未知溶液的浓度。
2、过程与方法目标(1)通过实验探究,培养学生的观察能力、动手操作能力和分析解决问题的能力。
(2)通过数据处理和误差分析,培养学生的逻辑思维能力和科学严谨的态度。
3、情感态度与价值观目标(1)培养学生实事求是的科学态度和勇于探索的精神。
(2)让学生体会化学实验在化学研究中的重要性,激发学生学习化学的兴趣。
四、教学重难点1、教学重点(1)中和滴定的原理和操作步骤。
人教版高中化学选择性必修第1册 实验活动2 强酸与强碱的中和滴定
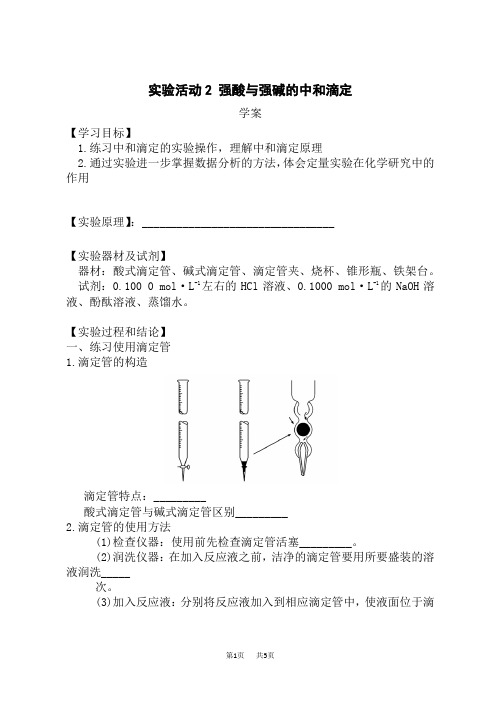
实验活动2 强酸与强碱的中和滴定学案【学习目标】1.练习中和滴定的实验操作,理解中和滴定原理2.通过实验进一步掌握数据分析的方法,体会定量实验在化学研究中的作用【实验原理】:_________________________________【实验器材及试剂】器材:酸式滴定管、碱式滴定管、滴定管夹、烧杯、锥形瓶、铁架台。
试剂:0.100 0 mol·L-1左右的HCl溶液、0.1000 mol·L-1的NaOH溶液、酚酞溶液、蒸馏水。
【实验过程和结论】一、练习使用滴定管1.滴定管的构造滴定管特点:_________酸式滴定管与碱式滴定管区别_________2.滴定管的使用方法(1)检查仪器:使用前先检查滴定管活塞_________。
(2)润洗仪器:在加入反应液之前,洁净的滴定管要用所要盛装的溶液润洗_____次。
(3)加入反应液:分别将反应液加入到相应滴定管中,使液面位于滴定管刻度“0”以上________处。
(4)调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满反应液,然后调节滴定管液面,使其处于某一刻度,并记录读数。
(5)放出反应液:根据实验需要从滴定管中逐滴放出一定量的液体。
二、用已知浓度的强碱滴定未知浓度的强酸3.【思考与讨论】1.在进行中和滴定时,为什么要用酸(或碱)润洗酸式(或碱式)滴定管2~3次?2.滴定用的锥形瓶是否也要用待测的碱(或酸)润洗?锥形瓶装待测液前是否需要保持干燥?为什么?3.用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L左右的HCl溶液的相关数据如下表所示:请以NaOH溶液的体积为横坐标,pH为纵坐标,在坐标纸上绘制NaOH溶液滴定HCl溶液过程中,溶液pH随NaOH溶液体积变化的曲线图。
【实验误差分析】1.用氢氧化钠标准溶液滴定盐酸,下列哪些操作会使盐酸浓度测定结果偏高( )【双选】A.锥形瓶用蒸馏水洗净后再用待测液润洗B.酸式滴定管用蒸馏水洗净后再用标准液润洗C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失D.滴定前读数正确,滴定后俯视滴定管读数2.下列错误操作中,能造成中和滴定,待测液浓度计算结果偏低的是( )A.用滴定管放入标准液开始滴定,开始时平视,滴定后仰视B.盛标准液的滴定管尖嘴部分有气泡未排出就开始滴定C.往锥形瓶中加待测液时,对滴定管读数,开始时仰视,量取后平视D.振荡时锥形瓶中液滴飞溅出来【课堂练习】1.下列实验操作不会引起误差的是( )A.酸碱中和滴定时,用待测液润洗锥形瓶B.酸碱中和滴定时,用冲洗干净的滴定管直接盛装标准溶液C.锥形瓶洗净后未干燥D.用标准盐酸测定未知浓度NaOH溶液结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡2.欲测定某HCl溶液的物质的量浓度,可用0.1000 mol·L-1NaOH标准溶液进行中和滴定(用酚酞作指示剂)。
《第三章 实验活动2 强酸与强碱的中和滴定》作业设计方案-高中化学人教版19选修1

《强酸与强碱的中和滴定》作业设计方案(第一课时)一、作业目标:1. 理解和掌握强酸与强碱的中和反应过程;2. 掌握滴定实验的基本操作和仪器使用;3. 学会中和滴定的基本实验设计和操作流程。
二、作业内容:1. 实验设计:学生自行设计一个中和滴定的实验方案,要求选择合适的指示剂,确定滴定剂的种类和用量,并详细说明实验步骤和操作要点。
实验完成后,提交实验报告,包括实验数据和结果分析。
2. 理论作业:完成以下题目:a. 中和反应的化学方程式及其反应热效应;b. 中和滴定实验中的误差分析。
3. 复习与讨论:回顾中和滴定实验的基本原理和方法,讨论常见的滴定误差原因及处理方法,并提出可能的改进措施。
三、作业要求:1. 实验作业需真实完成并拍照上传至学习平台;2. 理论作业需在规定时间内提交,并确保答案正确;3. 复习讨论部分需认真撰写,字数不少于500字。
四、作业评价:1. 实验作业:根据实验报告的质量和实验操作的规范性进行评价;2. 理论作业:根据答案的准确性和理解深度进行评价;3. 复习讨论:根据讨论的质量和问题回答的准确性进行评价。
五、作业反馈:请学生在完成作业后,针对作业中存在的问题或疑惑,提出反馈意见,以便教师了解学生的学习情况,及时调整教学策略。
作业内容:1. 实验操作部分:请描述在中和滴定实验过程中需要注意的几个关键步骤(例如:洗瓶操作、滴定操作等),并说明每个步骤的目的和注意事项。
同时,请描述如何确保滴定剂的准确加入。
2. 理论部分:请分析以下几种可能的中和滴定误差原因,并提出相应的处理方法:(1)滴定剂过量;(2)指示剂选择不当;(3)滴定管漏液;(4)溶液浓度不稳定。
3. 请讨论在实际应用中,如何提高中和滴定的准确性和可靠性?可以从哪些方面进行改进?作业要求:1. 实验操作部分:请详细描述并拍照上传相关操作过程图片,字数不少于200字;2. 分析误差原因及处理方法部分:需认真撰写,并结合理论知识进行合理的分析和解释,字数不少于300字;3. 讨论改进措施部分:可以从实际应用角度出发,提出合理的改进建议,字数不限。
人教版高中物理课件-酸碱中和滴定

1
滴定前俯視,滴定後仰視。
分析:V標偏大,導致C測偏大。
滴定前
讀
實
出
際
值
值
滴定後
1
二、錐形瓶 6、錐形瓶內用蒸餾水洗滌後,再用待測氫
氧化鈉潤洗 2-3次,將潤洗液倒掉,再裝 NaOH溶液(偏高 ) 7、錐形瓶用蒸餾水洗後未倒盡即裝NaOH 溶液( 無影響 ) 8、滴定過程中搖動錐形瓶,不慎將瓶內的 溶液濺出一部分。(偏低 ) 9、指示劑滴加過多(偏高 )
3、滴定管尖嘴處有氣泡,滴定後氣泡消失( 偏高) 4、滴定操作時,有少量鹽酸滴於錐形瓶外(偏高)
5、滴定前仰視刻度,滴定後俯視刻度(偏低)
你若去死記這些結論一定累死你沒的商
量,怎麼辦?必須依靠運算式通過產生
原因判斷
1
滴定前仰視,滴定後俯視。
分析:V標偏小,導 致C測偏小。
滴定前
實
讀
際
出
值 滴定後值
13、同上情況,若氫氧化鈉中含有少量的 碳酸鈉,結果如何( 偏低 )
如果含有氯化鈉呢?
1
1
▪ 三、堿式滴定管 ▪ 10、堿式滴定管用水洗後,未用待測液
潤洗 (偏低 )
▪ 11、取待測液時,未將盛待測液的堿式 滴定管尖嘴的氣泡排除。取液後滴定管 尖嘴充滿溶液( 偏低 )
1
四、含雜質 12、在配製待測氫氧化鈉溶液過程中,稱
取一定品質的氫氧化鈉時,內含少量的 氫氧化鉀,用標準鹽酸溶液進行滴定。 ( 偏低 )
紅5 紫 8藍 1
(1)甲基橙和酚酞的變色範圍較小: 4.43.1=1.3 10-8=2 對溶液的酸鹼性變化較靈敏
(2)溶液使指示劑改變顏色,發生的化學變 化。指示劑滴加太多比將消耗一部分酸堿溶液 (一般為1~2滴)。
