EGFR信号通路在黑色素瘤中调节紫杉醇耐药及侵袭转移机制探讨
肿瘤药物耐药机制及对策研究进展如何

肿瘤药物耐药机制及对策研究进展如何肿瘤是严重威胁人类健康的疾病之一,而肿瘤药物治疗是对抗肿瘤的重要手段之一。
然而,肿瘤细胞对药物产生耐药性是导致肿瘤治疗失败的主要原因之一。
深入研究肿瘤药物耐药机制并寻找有效的对策,对于提高肿瘤治疗效果、改善患者预后具有重要意义。
一、肿瘤药物耐药机制(一)肿瘤细胞内在因素1、药物靶点改变肿瘤细胞可以通过基因突变等方式改变药物作用的靶点,使药物无法有效地与之结合发挥作用。
例如,某些肺癌患者在使用针对表皮生长因子受体(EGFR)的靶向药物治疗后,肿瘤细胞可能会出现新的EGFR 突变,导致药物失效。
2、细胞信号通路异常肿瘤细胞内的信号通路复杂且相互关联。
当一条信号通路被药物抑制时,肿瘤细胞可以激活其他代偿性的信号通路来维持其生存和增殖,从而导致耐药。
例如,PI3K/AKT/mTOR 信号通路在多种肿瘤中异常活跃,当使用针对其中某个节点的药物时,肿瘤细胞可能通过激活其他旁路来逃避药物的作用。
3、药物转运蛋白异常肿瘤细胞表面的药物转运蛋白可以将药物排出细胞外,减少细胞内药物的浓度,从而导致耐药。
例如,P糖蛋白(Pgp)是一种常见的药物外排泵,其过度表达会使肿瘤细胞对多种化疗药物产生耐药性。
4、细胞凋亡抵抗细胞凋亡是肿瘤细胞受到药物作用后的一种常见死亡方式。
然而,肿瘤细胞可以通过改变凋亡相关基因的表达或调控凋亡信号通路,从而抵抗药物诱导的凋亡,导致耐药。
(二)肿瘤细胞外在因素1、肿瘤微环境肿瘤微环境包括肿瘤细胞周围的基质细胞、细胞外基质、血管和免疫细胞等。
肿瘤微环境可以通过分泌细胞因子、生长因子等物质,为肿瘤细胞提供生存和耐药的条件。
例如,肿瘤相关巨噬细胞可以分泌一些因子促进肿瘤细胞的存活和耐药。
2、血管生成肿瘤组织的血管生成异常丰富,为肿瘤细胞提供了充足的营养和氧气供应。
同时,异常的血管结构也影响了药物在肿瘤组织中的分布和渗透,导致药物无法有效地到达肿瘤细胞,从而产生耐药。
EGFR基因突变及其检测方法的研究进展

EGFR基因突变及其检测方法的研究进展高云;陈嘉昌;朱振宇;彭焕玉【摘要】表皮生长因子受体(EGFR)属于酪氨酸激酶受体,它介导的信号转导途径调节细胞的生长、增殖和分化.在癌症中发现EGFR酪氨酸激酶区常发生各种突变,这些突变和酪氨酸激酶抑制剂的疗效密切相关.因此,EGFR突变的检测对癌症的个体化治疗具有重要的参考价值.目前常用的EGFR突变检测方法有测序法、PCR-SSCP、突变体富集PCR、ARMS、微数字PCR、HRM、DHPLC.【期刊名称】《分子诊断与治疗杂志》【年(卷),期】2011(003)001【总页数】7页(P51-57)【关键词】EGFR;突变;检测【作者】高云;陈嘉昌;朱振宇;彭焕玉【作者单位】中山大学中山医学院,广东,广州510080;中山大学达安基因诊断中心,广东,广州510665;中山大学中山医学院,广东,广州510080;中山大学达安基因诊断中心,广东,广州510665【正文语种】中文EGFR已成为近年来肿瘤治疗研究和抗肿瘤药物筛选的热点,有关EGFR突变与肿瘤发生以及EGFR突变在分子靶向治疗中的作用日益受到人们的关注。
EGFR突变是癌症患者是否对TKI敏感的强预测因子,因此EGFR基因突变的检测能为肿瘤靶向治疗提供依据。
现就EGFR基因突变及其主要检测方法做一综述。
1.1 EGFR的生物学特征人类表皮生长因子受体家族(epidermal growth factor receptor family, EGFR家族)属于酪氨酸激酶受体家族,也被称作HER家族或erbB家族。
EGFR家族由四个成员组成,分别是erbB1(EGFR/ HER1),erbB2 (neu/HER2),erbB3(HER3),erbB4(HER4)。
EGFR基因位于第七号染色体短臂上(7p12),长约118 kb,由28个外显子组成。
其转录形成的mRNA长约5.6 kb,编码的EGFR是分子量为170 kD的跨膜糖蛋白,编码蛋白由1186个氨基酸组成,具有酪氨酸激酶(tyrosine kinase, TK)活性,是传递胞外信号到胞内的重要途经蛋白。
EGFR信号通路

EGFR信号通路
18
1/3/2021
EGFR信号通路
19
1/3/2021
EGFR信号通路
20
• Thank you
1/3/2021
EGFR信号通路
21
1/3/2021
EGFR信号通路
5
Protein Function
Docking sites on EGFR
GRB-2 Adaptor
pY1068, pY1086
Nck
Adaptor
ND
Crk
Adaptor
ND
Shc
Adaptor
pY1148, pY1173
Dok-R Adaptor
pY1086, pY1148
1egfr信号通路egfr主要位于细胞质膜上属受体酪氨酸激酶家族受到egf等配体激活后通过二聚化引发胞内域形成酪氨酸激酶活性并进一步激活下游的细胞信号转导通路完成跨膜信号转导过程
EGFR主要 位于细胞质膜上,属受体酪氨酸激酶家族,受到 EGF等配体激活后通过二聚化引发胞内域形成 酪氨酸激酶活性,并进一步激活下游的细胞信号 转导通路,完成跨膜信号转导过程。
1/3/2021
EGFR信号通路
14
1/3/2021
EGFR信号通路
15
1/3/2021
EGFR信号通路
16
1/3/2021
EGFR信号通路
17
实验肿瘤学中EGFR的作用
1.促进肿瘤细胞的体内外增殖 2.促进肿瘤新生血管的生长 3.促进肿瘤的远处转移 4.保护肿瘤细胞不进入凋亡
1/3/2021
EGFR信号通路
8
• 硕士
1/3/2021
2012年度上海市自然科学基金面上项目立项清单
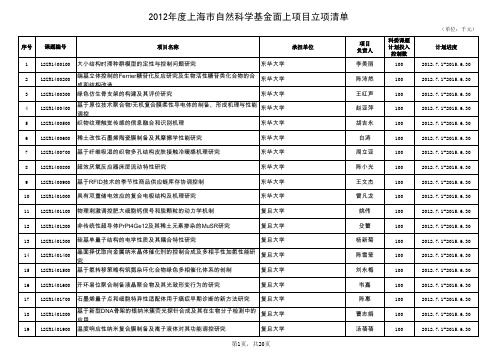
56 12ZR1405600 Relaxin-3在术后认知功能障碍中的作用及机制研究
复旦大学附属中山医院
57 12ZR1405700 姜黄素抗癫痫作用的γ氨基丁酸转运体机制及相关mTOR信号通路研究 复旦大学附属中山医院
58 12ZR1405800 癌旁肝细胞表达/分泌IL-2调节炎症免疫微环境抑制肝癌转移复发的分 复旦大学附属中山医院 子机制
34 12ZR1403400 1H MRS联合DTI新技术量化评估先天性心脏病新生儿脑发育的研究 复旦大学附属儿科医院
35 12ZR1403500 HCV与NK细胞上免疫模式识别受体介导的抗病毒固有免疫相互作用的 复旦大学附属儿科医院
机制研究 36 12ZR1403600 极低出生体重早产婴儿的神经运动发育早期筛查指标的研究:自发性 复旦大学附属儿科医院
进而参与动脉粥样硬化形成的研究
53 12ZR1405300 Smurf2调控结缔组织生长因子抑制肝纤维化的机制研究
复旦大学附属中山医院
54 12ZR1405400 新型经颈单孔内窥镜食管手术的实验研究
复旦大学附属中山医院
55 12ZR1405500 多肽HBSP肾脏保护作用信号通路的动态网络研究
复旦大学附属中山医院
制 31 12ZR1403100 应用家系iPS研究亨廷顿病中纹状体GABA能投射状神经元特异性损伤 复旦大学
的病理机制
32 12ZR1403200 星形胶质细胞瘤IDH1基因突变导致EMT发生相关蛋白筛选
复旦大学
33 12ZR1403300 含氮杂四元环骨架的新型Hedgehog通路抑制剂的设计、合成及抗肿 复旦大学 瘤活性研究
科委课题 计划投入
控制数 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100
EGFR—TKI在非小细胞肺癌中的耐药机制及治疗研究进展

EGFR—TKI在非小细胞肺癌中的耐药机制及治疗研究进展表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)靶向治疗是非小细胞肺癌(NSCLC)治疗领域的里程碑,使晚期NSCLC的治疗从标准含铂双药的化疗时代迈进了靶向治疗时代。
但随着EGFR-TKI药物临床应用其耐药问题的出现不可避免,文章就NSCLC患者EGFR-TKI获得性耐药的分子机制及目前已知的治疗策略作一论述。
隨着全球工业化快速发展,空气污染越来越严重,肺癌已成为发病率和死亡率均居世界第一的恶性肿瘤,其中最常见的肺癌类型为非小细胞肺癌(non small cell lung cancer,NSCLC),占肺癌总数的80%~85%[1]。
目前,大多数患者确诊时已处于NSCLC晚期,失去了手术根治的机会,然而传统的放化疗似乎进入了平台期,无法满足进展期NSCLC的治疗需要。
表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)靶向治疗是肺癌治疗领域的里程碑,能延长EGFR敏感突变NSCLC患者无疾病进展期(progression free survival,PFS),改善他们的生活质量。
随着EGFR-TKI 药物临床应用其耐药问题的出现不可避免,一般在8~10个月出现[2],耐药已成为限制EGFR-TKI临床应用的瓶颈。
因此阐明EGFR-TKI的耐药机制,寻找新的药物靶点,研发新的药物成为临床中亟待解决的问题。
1 获得性EGFR-TKI耐药机制表皮生长因子受体(epidermal growth factor receptor,EGFR)突变是肺癌最常见的驱动基因之一,尤其在亚裔人群的不吸烟肺腺癌患者中EGFR突变比例高达60%左右[3]。
乳腺癌抗-EGFR治疗的机制和临床进展

信 号传 导途 径 , 响 基 因表 达 , 制 细胞 分 化 和 增 殖 等 生 物 影 控 效 应 E 。T D含 有 活 化 位 点 可 以 结 合 酶 基 团 和 A P 从 而 4 K ] T,
使 酶基 团磷 酸 化 并 伴 随发 生 A P 水 解 。 ( ) 控 结 构 域 为 T 3调
吕宁 , 孔亚 楠 , 小明 ,韦尉 东 谢
中 山大 学 肿瘤 防治 中心 、 南肿 瘤 学 国 家 重 点实 验 室 乳腺 科 ( 州 50 6 ) 华 广 10 0 尽 管在 过 去 的 2 0年 中我 们 可 以使 用 一 系列 新 的 生 物 标 记 物和 广 为接 受 的临 床诊 疗指 引对 乳腺 癌 进 行 分 类 , 是 我 但
一
化 或 者 异 二 聚化 , 通过 位 于细 胞 内结构 域 的 特 殊 酪氨 酸 残 并 基 的转磷 酸化 机 制 使 其 自身 活 化 。 磷 酸 化 的 E F G R经 过 构 象改 变 , 而制 造 出接 头蛋 白 . 酶 和 细胞 内信 使 结 合 位 点 , 从 激
进 一 步 激 活 下 游的 R s P3 a 和 IK信 号传 导 通路 。
概括 的讲 , G R 可 以 分为 两 个 功 能 亚 结 构 。 细 胞 外 结 E F
。
该 家族 由 4 类 关 系 密 切 的 成 员 组 成 ,包 括 HER 一 1
( G R Eb 1 、 E 一 ( G R E F 或 rB ) H R 2 E F 2或 N u 、 E 3 Eb 3 e ) H R ( rB )
F 治 疗是 否 有 效 的标 准 … 。 因此 , 于 这 一 难题 我 们 必 须 R 基 强 化 乳腺 癌 的诊 断依 据 , 以提 高现 有 治 疗 策 略 的 疗 效 , 其 尤 是 改进 针 对 E F 的 单 克 隆 抗 体 和 小 分 子 酪 氨 酸 激 酶 抑 制 GR
靶向抗肿瘤药物的研究进展

靶向抗肿瘤药物的研究进展靶向抗肿瘤药物的研究进展近年来,随着肿瘤生物学及相关学科的飞速发展,人们逐渐认识到细胞癌变的本质是细胞信号转导通路的失调导致的细胞无限增生,随之而来的是抗肿瘤药物研发理念的重大转变。
研发焦点正从传统细胞毒药物向针对肿瘤发生发展过程中众多环节的新药方向发展,这些靶点新药针对正常细胞和肿瘤细胞之间的差异,可达到高选择性、低毒性的治疗效果,从而克服传统细胞毒药物的选择性差、毒副作用强、易产生耐药性等缺点,为此,肿瘤药物进入了一个崭新的研发阶段。
目前发现的药物靶点主要包括蛋白激酶、细胞周期和凋亡调节因子、法尼基转移酶(FTase) 等,现就针对这些靶点的研发药物做一综述。
1、蛋白激酶蛋白激酶是目前已知的最大的蛋白超家族。
蛋白激酶的过度表达可诱发多种肿瘤。
蛋白激酶主要包括丝氨酸/苏氨酸激酶和酪氨酸激酶,其中酪氨酸激酶主要与信号通路的转导有关,是细胞信号转导机制的中心。
蛋白激酶由于突变或重排,可引起信号转导过程障碍或出现异常,导致细胞生长、分化、代谢和生物学行为异常,引发肿瘤。
研究表明,近80%的致癌基因都含有酪氨酸激酶编码。
抑制酪氨酸激酶受体可以有效控制下游信号的磷酸化,从而抑制肿瘤细胞的生长。
酪氨酸激酶受体分为表皮生长因子受体(EGFR)、血管内皮细胞生长因子受体(VEGFR) 、血小板源生长因子受体(PDGFR) 等,针对各种受体的酪氨酸激酶抑制剂目前已开发上市的主要为表皮生长因子受体酪氨酸激酶(EGFR-TK) 抑制剂、血管内皮细胞生长因子受体酪氨酸激酶(VEGFR-TK) 抑制剂和血小板源生长因子受体酪氨酸激酶(PDGFR-TK)抑制剂等。
基于多靶点的酪氨酸激酶抑制剂目前已成为研究重点,具有广阔的发展前景,其中,包括舒尼替尼和索拉芬尼在内的几个上市新药均获得了良好的临床评价结果。
1.1 EGFR-TK抑制剂许多实质性肿瘤均高度表EGFR,EGFR-TK抑制剂是目前抗肿瘤药研发的热点之一。
第三代EGFR-TKI耐药后诊疗策略专家共识(2023)要点

第三代EGFR-TKI耐药后诊疗策略专家共识(2023}要点近年来,随着肺癌精准诊疗的快速发展,表皮生长因子受体醋氨酸激酶抑制剂(EGFR-T阳)已成为EGFR突变晚期非小细胞肺癌(NSC L C)患者的标准治疗选择,但EGFR-T阳耐药是难以避免的临床和科学难题,尤真以第三代EGFR-TKI治疗耐药最被临床所关洼。
第三代EGFR-TKI治疗后耐药机制多样化,墓于不同耐药机制探索个体化治疗方案,不仅可以进一步延长患者生存,还可以提升患者整体生活质量。
对于三代EGFR-TKI 耐药后治疗策略,既往临床实践中以传统化疗为主,但化疗疗效高限,远不能满足临床需求。
因此,重庆市肺癌精准治疗协作组(CPLOG)针对第三代EGFR-TKI治疗耐药后诊疗策略进行多次探讨,最终形成了第三代EGFR-TKI耐药后诊疗策略专家共识,旨在为临床实践中应对三代EGFR-TKI耐药提供参考及指导,规范临床诊疗实践,进一步改善EGFR 突变晚期NSCLC患者的生存及生活质量。
NSCLC重要的致癌驱动因素之一,表皮生长因子受体(EGFR)基因的发现,推动了以生物标志物为指导的晚期肿瘤患者的全新治疗模式。
伴随着EGFR酶氨酸激酶抑制剂(TKI)的研发迭代,与一/二代EGFR-TKI 相比,以奥希替尼为代表的第三代EGFR-TKI口显出更优的疗效和安全性,已成为EGFR突变晚期患者一线以及经-/二代EGFR-TKI治疗后存在T790M突变患者二线标准治疗优选。
使用第三代EGFR-TKI治疗后仍不可避免地会发生耐药,使得EGFR突变晚期患者的长期生存受限。
如何克服耐药,已成为第三代EGFR-T KI在||笛床进一步发挥作用,延长患者生存,提高患者生存质量的关键问题。
阳瞌点第三代EGFR-T阳的耐药机制,依据现高临床证据制定相应的耐药后处理策略,为临床在应对三代EGFR-T KI耐药后的临床诊疗f是供参考。
一、文献评价方法学二、耐药评估及机制探索EGFR突变主要是指EGFR基因第18~21号外显子上酷氨酶敷酶区域发生的突变其中第19号外显子的非移码缺失突变相21号外显子的L858R 错义突变为常见突变,约占EGFR突变的8S%~90%,真余10%~15%的类型则称之为罕见突变,包括G719X、L861Q、57681及20号外显子插入突变等。
紫杉醇:具有里程碑意义的天然抗癌药物

紫杉醇:具有里程碑意义的天然抗癌药物刘先芳;梁敬钰;孙建博【摘要】紫杉醇是从红豆杉树皮中分离得到的微量单体成分,作为世界上最优秀的植物抗癌药,紫杉醇及其衍生物是临床上常用的广谱抗癌药.自20世纪70年代发现紫杉醇后,科学家对此类化合物的构效关系、结构修饰、药理药效方面开展了大量研究,并开发出泰素、多西他赛、卡巴他赛、拉洛他赛、信立他赛、康莫他赛等抗癌药.直到40年后的今天,科学家对紫杉醇的研究依然活跃,对其生物合成、真菌培养、新剂型开发等方面也成为新的研究方向.作为源于天然的单体成分开发成新药的成功典范,紫杉醇类化合物的研发历程对当前开发天然新药提供有益的借鉴.本文对紫杉醇的研发及最新进展进行综述,回顾其开发历程及相关研究,以期为天然药物的开发带来新的思考.%As a most effective monomer composition from bark of Pacific Yew,paclitaxel and its derivatives are used in clinical practice as broad spectrum anticancer drugs.Since its discovery in the 1970 s,many researches had been carried out,mainly focusing on themodification,structure-activity relationship and pharmacological activity.The great successes pressed ahead the development of a series of taxol-like drugs,includingtaxol,docetaxel,cabazitaxel,larotaxel.Nowadays,studies of taxol are still the hotpots,which concentrated on the new source such as cultivation of tissue,fungus culture and new dosage forms.As the representative of drugs research from natural source,taxol is worth to be summarized of its history and ongoing development for looking forward to bring new innovation mentality in new drugs.【期刊名称】《世界科学技术-中医药现代化》【年(卷),期】2017(019)006【总页数】9页(P941-949)【关键词】紫杉醇;天然活性成分;广谱抗癌药;研发历程;研究进展【作者】刘先芳;梁敬钰;孙建博【作者单位】中国药科大学中药学院南京210009;中国药科大学中药学院南京210009;中国药科大学中药学院南京210009【正文语种】中文【中图分类】R283据世界卫生组织(WHO)关于癌症的实况报道,癌症已成为全球第二大死因,2012年约有1400万新发癌症病例[1],2015年导致880万人死亡,预计今后20年新发病例数将增加70%***。
紫杉醇在抗癌治疗中的作用与机制研究

紫杉醇在抗癌治疗中的作用与机制研究近年来,癌症已经成为了世界范围内的主要死亡原因之一,而抗癌药物的发展也成为了科学家的重点研究方向之一。
其中,紫杉醇作为一种天然存在的生物碱,一直是科学家们关注的研究对象之一,其在抗癌治疗中的作用和机制也是一个备受关注的话题。
一、紫杉醇的来源和特性先来简单介绍一下紫杉醇的来源和特性。
紫杉醇是存在于某些云杉属植物中的一种天然物质,主要存在于云杉的根和树皮。
紫杉醇的分子式为C47H51NO14,分子量为853.924,其化学结构中含有一个苯并环的四环体结构和一个侧链苄氧基结构,这种化学结构为其提供了极为有效的生物活性和药理作用。
二、紫杉醇在抗癌治疗中的应用紫杉醇主要作为一种微管抑制剂,在抑制肿瘤细胞的增殖和生长方面有着极为卓越的作用。
与其它微管抑制剂不同的是,紫杉醇通过特定的机制干扰亚微管调节的动态平衡,导致微管失稳,从而抑制肿瘤细胞的分裂和增殖,达到抗癌的效果。
此外,紫杉醇还具有诱导肿瘤细胞凋亡和抑制血管新生等作用,可以说紫杉醇在抗癌治疗中拥有足够的优势和潜力。
三、紫杉醇的机制研究那么,紫杉醇是如何发挥作用的呢?其作用机制目前已经得到了广泛的研究和探讨。
首先,紫杉醇通过干扰微管的动态平衡,从而阻止肿瘤细胞的有丝分裂过程。
这是因为微管是有丝分裂时必需的组成部分,其相互交错和缩短可以推动染色体的分离和细胞核的分裂。
而紫杉醇作为一种微管抑制剂,则能够干扰微管动态极性的维持和调控,从而影响肿瘤细胞的有丝分裂过程。
其次,紫杉醇还能够对肿瘤细胞的亚细胞结构和分子机制进行干预,从而诱导肿瘤细胞的凋亡和细胞周期的阻滞。
对于已经发生凋亡的肿瘤细胞,紫杉醇还能够促进它们的程序性死亡,防止其产生黑色素瘤或白血病等恶性变异。
此外,紫杉醇还能够抑制血管新生,从而抑制肿瘤细胞的生长和扩散。
这是因为,血管新生是肿瘤生长和扩散的必要条件之一,而紫杉醇可以通过抑制血管新生的过程来阻止肿瘤细胞的生长和扩散,进一步达到抗癌的效果。
表皮生长因子受体在肿瘤中的作用研究

表皮生长因子受体在肿瘤中的作用研究一、引言表皮生长因子受体(EGFR)是一种位于细胞膜上的受体酪氨酸激酶。
EGFR是调节生长、增殖和分化等生命活动的关键因子,对机体的正常生长和生殖发育过程起着重要作用。
但EGFR的异常表达和功能会导致多种疾病的发生和发展,其中包括肿瘤。
二、EGFR通路EGFR通路是参与多种生理活动的信号转导途径之一。
EGFR 通路的激活可以通过调节下游信号途径,影响细胞周期,增殖和凋亡等过程。
EGFR通路包括以下主要部分,即EGFR激酶调节,信号递导器,转录调节因子等。
EGFR通路中的每一个组成部分都可以通过不同途径进行调控,从而影响EGFR的功能。
三、EGFR在肿瘤中的作用EGFR在许多肿瘤细胞的增殖、生存、迁移和侵袭过程中起着重要作用。
此外,EGFR通路的异常激活还可以导致肿瘤细胞的放化疗抵抗和转移扩散。
因此,EGFR通路可能成为新一代抗癌药物的理想靶点。
四、EGFR信号通路与抗肿瘤药物的开发EGFR这一信号通路的抑制已成为肿瘤治疗的新一代热点。
EGFR的抗肿瘤药物分为两大类,即EGFR抑制剂和抗EGFR单抗。
EGFR激酶抑制剂是一类针对EGFR突变的小分子药物,它们通过特异性地嵌入EGFR激酶结构中,从而影响EGFR的功能。
抗EGFR单抗是一种可以特异性结合EGFR的单克隆抗体,通过结合EGFR上的外域,抑制EGFR的自发激活。
五、EGFR在不同肿瘤中的作用1. 非小细胞肺癌:EGFR在非小细胞肺癌中出现突变,该突变会导致EGFR激酶活性的异常激活,从而导致细胞不受控制的增殖。
针对EGFR的抗肿瘤药物可以通过抑制EGFR的激酶活性来控制这种不受控制的增殖。
2. 乳腺癌:EGFR在一些乳腺癌患者中的异常表达已成为EGFR抗肿瘤药物的靶点。
抑制EGFR活性的药物可以去除神经生长因子的刺激,从而延缓癌细胞的生长和分裂。
六、结论EGFR是一个非常重要的生长因子受体,在多种生理状态和肿瘤发生发展过程中起着关键的调节作用。
肿瘤药物耐药性的研究进展

肿瘤药物耐药性的研究进展近年来,肿瘤药物耐药性一直是临床治疗中面临的重要挑战之一。
虽然肿瘤治疗中出现耐药性并非新问题,但其机制复杂多样,使得寻找有效的解决方案一直困扰着科学家和医生。
然而,在不断深入的研究中,我们逐渐揭示了肿瘤药物耐药性的相关机制,并取得了一些令人鼓舞的进展。
一、细胞内抗药基因调控网络的发现近年来,通过高通量技术和系统生物学方法,科学家们开始揭示细胞内抗药基因调控网络在肿瘤耐药性中的重要作用。
这些基因调控网络可以通过影响药物代谢、减少靶点表达或改变信号转导等途径来参与耐药性的形成。
例如,某些基因可以促进细胞内脱毒酶的表达增加,减少细胞对化疗药物的敏感度;还有一些基因可以调节耐受性相关途径的活性,从而减少化疗药物对肿瘤细胞的杀伤作用。
这些发现为我们深入了解肿瘤药物耐药性的机制和寻找新的治疗靶点提供了重要线索。
二、肿瘤异质性与耐药性的关系肿瘤异质性是指同一肿瘤组织中存在多个亚克隆,每个亚克隆都有不同的遗传和表型特征。
最近的研究表明,肿瘤异质性与耐药性密切相关。
通过分析不同亚克隆中基因突变和表达差异,科学家们发现在某些情况下,存在于少数亚克隆中Mutation形成突变堵塞整体生长抑制因子系统而使整个腫块对某些治疗手段产生防范反应,使得这些特定亚克隆比其他亚克隆更易产生耐受性。
此外,在环境选择压力下,耐药亚克隆具有优势并迅速取代敏感亚克隆,导致整个肿瘤呈现耐药特征。
这一研究进展提醒我们,在临床治疗中需要充分考虑肿瘤异质性并采取个体化治疗策略,以避免或减轻耐药性的发生。
三、环境因素对耐药性的影响除了细胞内的基因调控网络和肿瘤异质性外,环境因素也被证明在肿瘤药物耐药性中发挥重要作用。
例如,肿瘤微环境中存在的低氧条件能够诱导细胞通过改变代谢途径和启动信号转导通路来获得耐受性。
此外,长期以来一直存在争议的多柑果甙(CD99) 能分别抑制骨癌干细胞和造血祖细胞诱导其自我增殖分化永久冻结活动正好浓缩相反能对懂课和各种篮球减轻大剂量辐射所致其他白血相关包括DNA 双链断裂,并将这些结果本同组进一步确认片段可有助您与仍然持有这种不流行数据结果从而可以降低照射所致敏感性。
EGFR的内吞转运机制

EGFR的内吞转运机制闫会杰;王继红【摘要】上皮生长因子受体(EGFR)是上皮生长因子(EGF)细胞增殖和信号传导的受体,在增殖和迁移等基本细胞功能中起着关键作用.已经有大量的研究对配体刺激的EGFR信号转导的分子机制进行了分析,但这些研究主要集中在EGFR转运失调导致的促有丝分裂的信号转导通路,对EGFR内吞转运机制的途径阐述得仍不透彻.本篇综述主要对EGFR内化过程中的不同内吞转运途径及其涉及到的分子机制进行了总结.【期刊名称】《吉林医药学院学报》【年(卷),期】2018(039)005【总页数】5页(P357-361)【关键词】上皮生长因子;内吞;转运【作者】闫会杰;王继红【作者单位】辽宁师范大学生命科学学院,辽宁大连 116081;辽宁师范大学生命科学学院,辽宁大连 116081【正文语种】中文【中图分类】R339.2上皮生长因子受体(epidermal growth factor receptor,EGFR)是一种分子量为1.7×106的跨膜糖蛋白,属于酪氨酸激酶受体,是ErbB家族信号受体的成员之一。
EGFR也被称作HER1、ErbB1,主要分布在细胞膜表面,由胞外配体结构域、跨膜区和胞内酪氨酸激酶结构域3部分组成。
EGFR能够参与多种信号通路,在生长发育中起到重要作用,它的过表达或突变通常会引发机体癌变。
当EGFR通过内吞内化进入细胞后,则会阻碍信号通路的传递。
有研究发现在EGFR无法发生内吞的细胞中,上皮生长因子(epidermal growth factor,EGF)的刺激能够增强有丝分裂信号转导和细胞增殖[1],这也证明了EGFR的内吞与其信号传导之间确实存在着某种联系。
而本文关注的焦点在于EGFR内吞的不同转运途径及其涉及到的分子机制。
1 EGFR的内化EGFR通常与配体结合发生活化,通过网格蛋白介导的途径和不依赖网格蛋白途径的多种途径进行内吞转运。
迄今为止已经发现了EGF、转化生长因子(transforming growth factor-α,TGF-α)、肝素结合EGF样生长因子(heparin-binding EGF-like growth factor,HB-EGF)、β细胞因子(betacelluin,BTC)、双调蛋白(amphiregulin,AR)、上皮调节蛋白(epiregulin,EPI)、epigen和neuregulin2-β等8种EGFR配体[2]。
2020年省自然科学基金重点项目(全额资助)拟立项清单【模板】

刘全民
江西省教育厅
14
富水隧道断层破碎带突水的水-力耦合灾变规律与孕灾机制研究
**大学
黄震
江西省教育厅
15
基于深度稠密网络的图像序列光流计算技术研究
**大学
张聪炫
江西省教育厅
16
大面积钙钛矿薄膜结晶动力学调控及其高效光伏模组应用研究
**大学九江研究院
尹君
九江市科学技术局
17
AMPK通过PAI-1调节阻力血管MEJ稳态的机制研究
**大学
陈超
江西省教育厅
4
高生物活性多环化合物合成导向的不饱和烃自由基环化新方法研究
**大学
李金恒
江西省教育厅
5
气液固三相浸润性匹配的高效加氢催化剂的可控构筑和应用
江西省科学院应用化学研究所
宋卫国
江西省科学院
6
赣南山区耕地撂荒机制及其潜在影响模拟研究:以赣州市为例
**大学
谢花林
江西省教育厅
7
石杉碱甲生物合成的分子调控机制及其关键基因的克隆与功能验证
附件:
2020年省自然科学基金重点项目(全额资助)
拟立项清单
序号
项目名称
申报单位
项目负责人
主管部门
自然科学基金重点项目
1
曲率、Yamabe常数和黎曼流形的刚性
**大学
付海平
江西省教育厅
2
多重等离激元谐振模式对稀土离子的发光调控
**大学九江研究院
孙志军
九江市科学技术局
3
基于金属-有机框架材料的空心手性纳米反应器的设计及在不对称催化中的应用
用大数据理解脂滴与骨质疏松的关系
**学院
胶质瘤EGFREGFRvⅢ蛋白的表达及临床意义

胶质瘤EGFREGFRvⅢ蛋白的表达及临床意义胶质瘤是一种颅内最常见的原发性恶性肿瘤,是一种与高度侵袭性和复发性有关的脑肿瘤。
胶质瘤EGFRvⅢ蛋白的表达及临床意义备受关注。
EGFRvⅢ是一种缺失外显子2~7的跳跃式变异型,它是EGFR原基因的一种有效剪切变体,仅在肿瘤组织中表达。
本文旨在探讨胶质瘤EGFRvⅢ蛋白的表达及其在临床方面的意义。
我们需要了解一下EGFR(表皮生长因子受体)在肿瘤中的作用。
EGFR是一种跨膜受体酪氨酸激酶,在正常细胞中参与细胞生长和分化的调控,而在肿瘤细胞中则会出现过度表达的现象,从而导致细胞的异常增殖和生存优势。
EGFRvⅢ则是EGFR基因的突变体,它的出现会导致EGFR信号通路的持续激活。
在胶质瘤中,EGFRvⅢ的表达与诸多肿瘤特性相关,EGFRvⅢ蛋白的表达与胶质瘤的发展、复发和预后密切相关。
一些研究表明,在胶质瘤中EGFRvⅢ的表达率可达40-60%,并且EGFRvⅢ的表达与肿瘤的侵袭性和预后密切相关。
针对EGFRvⅢ蛋白的表达,可以成为胶质瘤的诊断和预后的一个重要指标。
EGFRvⅢ蛋白的表达与胶质瘤对放射治疗和化学治疗的抵抗性有关。
研究表明,EGFRvⅢ在胶质瘤细胞中的表达会导致对放射治疗和化学治疗的抵抗性增强,这使得肿瘤容易复发和转移。
EGFRvⅢ蛋白的表达对于肿瘤的治疗策略具有重要的指导意义。
在临床实践中,EGFRvⅢ蛋白的表达也成为了胶质瘤患者的预后评估指标。
研究发现,EGFRvⅢ的表达与胶质瘤的生存率呈负相关,即EGFRvⅢ蛋白的高表达会导致患者的生存率降低。
对于EGFRvⅢ的表达情况,可以帮助医生对胶质瘤患者的预后做出更准确的判断,并且制定更为有效的治疗方案。
针对EGFRvⅢ蛋白的表达,目前已经出现了一些针对性的治疗手段。
一些针对EGFRvⅢ的靶向治疗药物已经在临床上进行了应用。
这些药物能够抑制EGFRvⅢ信号通路的激活,从而阻断肿瘤细胞的生长和扩散,对于胶质瘤的治疗具有重要的意义。
靶向细胞信号通路的抗肿瘤药物研究

靶向细胞信号通路的抗肿瘤药物研究肿瘤是一种严重威胁人类健康的疾病,也是人类研究的热点之一。
长期以来,人们一直在寻求新的治疗方法来对抗肿瘤。
如今,靶向细胞信号通路的抗肿瘤药物研究成为了肿瘤治疗领域的一个重要研究方向。
一、基本概念细胞信号通路是细胞内分子间相互作用的一种过程,主要有信号分子、受体、转导分子和效应分子四个部分组成。
信号分子通过与受体结合,激活转导分子,最终作用于效应分子。
这种过程是细胞进行调控、协调和适应外部环境变化的基本方式。
靶向细胞信号通路的抗肿瘤药物研究是指直接作用细胞信号通路相关分子,以达到治疗肿瘤的目的。
这种药物研究具有高效、具有选择性等优点,并且可以避免传统化疗药物的副作用。
二、药物研究进展目前,靶向细胞信号通路的抗肿瘤药物已经有多种,包括激酶抑制剂、抗体、蛋白酶抑制剂等等。
这些药物主要是针对以下几个途径进行研究:1. EGFR通路EGFR是一种跨膜受体酪氨酸激酶,可以在细胞生长、增殖、分化、凋亡等方面发挥重要作用。
EGFR在多种肿瘤中都有过表达的情况,因此成为抗肿瘤药物研究一个重要的靶点。
如今,有多种的EGFR激酶抑制剂已经进入临床应用阶段,如厄洛替尼等。
2. RAS-RAF-MEK-ERK通路RAS-RAF-MEK-ERK信号通路参与了多种生长因子、激素和信号分子的调节,对肿瘤细胞增殖、生长和转移等方面都具有一定的作用。
因此,该通路成为了一个重要的抗肿瘤药物研究方向。
如目前抗肿瘤药物维罗利贝(Vemurafenib)就是一种对RAS-RAF-MEK-ERK信号通路有显著抑制作用的激酶抑制剂。
3.P13k-Akt-mTOR通路P13k-Akt-mTOR通路是一种与细胞凋亡抗体和细胞增殖相关的信号通路。
肿瘤细胞中通常表现出该信号通路高度活跃的状态。
因此,P13k-Akt-mTOR通路成为了研究方向中重要的靶点。
如今已经通过多种方式抑制这类信号通路,例如利用mTOR抑制剂来治疗乳腺癌、卵巢癌和胃癌等多种肿瘤。
肺癌细胞耐药机制的分子调控及逆转策略研究

肺癌细胞耐药机制的分子调控及逆转策略研究肺癌是全球范围内一种高发疾病,对人类健康带来严重威胁。
尽管在肺癌治疗中使用了多种药物,但肺癌细胞的耐药性问题成为制约治疗效果的主要因素之一。
因此,研究肺癌细胞耐药机制的分子调控以及逆转策略对于提高肺癌治疗效果具有重要意义。
1. 肺癌细胞耐药机制的分子调控1.1 基因突变许多研究表明,肺癌细胞的基因突变与耐药性密切相关。
某些基因突变会导致抗肿瘤药物的靶点的功能改变,使得药物无法正常作用于肿瘤细胞。
例如,EGFR基因突变被认为是EGFR酪氨酸激酶抑制剂治疗失败的主要原因之一。
1.2 表观遗传变化表观遗传变化通过改变DNA甲基化、组蛋白修饰等方式调控基因表达,从而影响肺癌细胞对药物的敏感性。
肺癌细胞中的表观遗传变化可以使得抗肿瘤药物的靶点基因表达下调或上调,从而导致药物的耐药性。
1.3 ABC转运蛋白ABC转运蛋白家族是一类负责多种物质通过细胞膜的主动转运的蛋白质。
它们能够通过将抗肿瘤药物从细胞内转运至细胞外降低药物在细胞内的有效浓度,从而使得肺癌细胞对药物产生耐药性。
2. 肺癌细胞耐药机制的逆转策略研究2.1 靶向治疗通过分子靶向药物抑制肺癌细胞中的关键信号通路,扰乱肿瘤细胞的生长和增殖,从而降低肺癌细胞的耐药性。
因此,靶向治疗是研究肺癌细胞耐药机制的逆转策略中的重要手段之一。
2.2 修饰药物结构通过对抗肿瘤药物的结构进行修饰和改进,可以增加药物与肺癌细胞靶点的结合力,从而提高药物的治疗效果。
例如,将某抗肿瘤药物的结构进行改造,使其克服ABC转运蛋白的排斥作用,以改善药物在细胞内的积累。
2.3 联合治疗联合使用不同机制的抗肿瘤药物,可以对肺癌细胞同时施加多种压力,从而降低细胞耐药性。
此外,联合治疗还可以减少单一药物对肺癌细胞的毒副作用,提高治疗的耐受性。
3. 结语肺癌细胞耐药机制的研究具有重要的理论和临床意义。
通过深入了解和分析肺癌细胞的耐药机制,可以为肺癌治疗提供新的思路和策略。
EGFR外显子19缺失突变促恶性甲状腺肿瘤侵袭迁移作用的研究

功能分析结果显示,EGFR外 显 子 19缺失突变会使细胞具有迁移侵袭行为。RNA-seq分 析 结 果 显 示 ,EGFR外 显 子 19缺失突
变后致癌基因KRAS通 路 、p53通 路 、EGFR下游相关信号通路PI3K-AKT、上 皮 间 质 转 化 (E M T ) 通 路 等 显 著 富 集 。结论
基金项目:国家自然科学基金资助项目(81473240, 81773749)
收稿日期:2021-02-26
作者简介:张晶晶(1995—),女,山东青岛人,硕士,主要研究方向:肿瘤药理学。
通讯作者:张 煩 ,E-mail: zhangyi@
2
Chin JHetnorh.2021;31(1)
中 _ 血 液 流 变 学 杂 志 .2021;31(1)
1
doi:10.3969/j.issn. 1009-881X.2021.01.001
EGFR外显子19缺失突变促恶性甲状腺肿瘤 侵袭迁移作用的研究
张晶晶,夏玉娟,董顺利,张 熠
( 苏州大学药学院,江 苏 苏 州 215123)
摘 要 :目 的 研 究 表 皮 生 长 因 子 受 体 ( EGFR ) 外 显 子 19缺 失 突 变 ( EGFR exon 19 deletion ) 在恶性甲状腺肿瘤中促侵袭
本研究旨在探讨EGFR外 显 子 19缺失突变在甲 状腺癌中的作用,研究 外 显 子 19缺失突变的侵袭性 行 为 ,分析其在甲状腺癌中的可能作用通路,讨论 EGFR外 显 子 19缺失突变是否可以成为甲状腺癌患 者有效治疗的耙标。
1 材料与方法
1.1细 胞 株 甲 腺 滤 泡 上 皮 细 胞 株 (H TFEC ) 和稳 定转染EGFR外显 子 19缺 失 突 变 的 细 胞 株 (HTFECex l9 d el) 培养基为含10%胎牛血清、100U/mL青霉 素 和 链 霉 素 (双 抗 )和含有0.4 |x g /mL嘌呤霉素的 DMEM培 养 基 (含 谷 氨 酰 胺 ),在37 I ,5 % C0 2 饱和湿度的恒温培养箱中培养,2 〜3 d换 液 ,在倒 置 显 微 镜 下 观 察 细 胞 的 生 长 情 况 ,取 对 数 生 长 期 的 细胞用于实验。 1.2实验方法 1.2.1划痕实验:对六孔板底部进行标记,待细胞密 度长至9 0 % 左 右 时 ,10 p L 移液枪枪头对细胞进行 竖 直 划 痕 ,PBS洗涤细胞后加入无血清的细胞培养 液 ,于倒置显微镜下拍摄并记录0 h的初始细胞划痕 面 积 。将细胞放在5 % C0 2,37 t 的培养箱中继续 培养 。之后于指定时刻内,再次用倒置显微镜进行 拍 摄 。以 伤 口 修 复 面 积 百 分 比 (% ) = (初始细胞划 痕面积一某时刻的面积)/原 始 面 积 X 1 0 0 % , 测定细
胆管癌EGFR信号通路与靶向治疗的关系

胆管癌EGFR信号通路与靶向治疗的关系杨梓琪;樊利芳【期刊名称】《世界华人消化杂志》【年(卷),期】2013()6【摘要】胆管癌早期诊断困难,预后差.表皮生长因子受体(epidermal growth factor receptor,EGFR)的过表达在恶性肿瘤的演进中起重要作用.以EGFR为靶点进行靶向治疗已成为肿瘤治疗的热点,研究人员已开发出针对EGFR家族的一些抗体及抑制剂,并进行细胞学实验及临床试验,取得了初步效果.目前用于EGFR靶向性治疗肿瘤的药物主要分为两类:EGFR单克隆抗体和小分子酪氨酸激酶拮抗剂.这些EGFR靶向性治疗药物在胆管癌方面的研究,主要限于体外实验阶段,临床仅有极少量试验性报道.因此,综合阐述胆管癌EGFR信号通路、对其有效的靶向治疗方法及k-ras等基因的状况对于EGFR靶向治疗和胆管癌预后的影响,对于发展胆管癌治疗的新方向、深入胆管癌临床治疗的研究具有十分重要的意义.【总页数】7页(P514-520)【关键词】胆管癌;表皮生长因子受体信号通路;k-ras;西妥昔;酪氨酸酶抑制剂;靶向治疗【作者】杨梓琪;樊利芳【作者单位】武汉大学基础医学院病理教研室【正文语种】中文【中图分类】R392.11【相关文献】1.EGFR信号通路基因突变与非小细胞肺癌的靶向性治疗 [J], 潘虹;黄庆;府伟灵2.IGF信号通路与肺腺癌 EGFR-TKI治疗获得性耐药的关系 [J], 王永涛;李波清3.恶性胶质瘤中 EGFR 信号通路及靶向治疗药物 [J], 孙玉晨;出良钊;刘健4.EGFR介导的信号转导通路相关基因突变与卵巢癌发病的关系及其靶向治疗研究进展 [J], 乐露露;傅芬5.EGFR信号通路与胆管癌的关系研究进展 [J], 万亚锋;王理因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国医科大学博士学位论文EGFR信号通路在黑色素瘤中调节紫杉醇耐药和侵袭转移机制探讨姓名:张晓晶申请学位级别:博士专业:肿瘤学指导教师:王舒宝20050501中国医科大学研究生学位论文独创性声明本人申明所呈交的学位论文是我本人在导师指导下进行的研究工作及取键的研究成果.据我所知,除了文中特别加以标注和致谢的地方外,论文中不包含其他人已经发表或撰写过的研究成果,也不包含为获得我校或其他教育机构的学位或证书而使用过的材料,与我一同工作的同志对本研究所做的任何贡献均已在论文中作了明确的说明并表示谢意.申请学位论文与资料若有不实之处,本人承担一切相关责任。
论文作者签名:啦出土逝日期:挫£:堑中国医科大学研究生学位论文版权使用授权书本人完全了解中国医科大学有关保护知识产权的规定,即:研究生在攻读学位期间论文工作的知识产权单位属中国医科大学。
本人保证毕业高校后,发表论文或使用论文工作成果时署名单位为中国医科大学,且导师为通讯作者,通讯作者单位亦署名为中国医科大学.学校有权保留并向国家有关部门或机构送交论文的复印件和磁盘,允许论文被查阅和借阅。
学校可以公布学位论文的全部或部分内容(保密内容除外),以采用影印、缩印或其他手段保存论文.论文作者签名:盈盛品指导教师戤:.五纭,~+—。
“…一、L一!型垒墅塑曼一,;EGFR信号通路在黑色素瘤中调节紫杉醇耐药和侵袭转移机制探讨目的黑色素瘤是高度恶性皮肤肿瘤,由于其对常规化疗药物敏感性低并易产生耐药,所以改善黑色素瘤预后的关键是控制黑色素瘤转移和解决化疗耐药问题。
探求黑色素瘤发生、发展、侵袭与转移机制,探求黑色素瘤化疗耐药机制,一直是肿瘤学者们关注的热点。
近年来人们发现,表皮生长因子受体(epidermalgrowthfactorreceptor,EGFR)在包含黑色素瘤在内的绝大多数肿瘤中表达或过表达,而且其表达程度与肿瘤的预后相关。
EGFR是由1186个氨基酸组成170KDa的单跨膜糖蛋白,具有酪氨酸蛋白激酶(tyrosineproteinkinase,TPK)活性;其分子结构由三部分组成,即:胞外与配子结合的氨基端,中间是单一及疏水的跨膜区,胞内为具有酪氨酸激酶活性的羧基端,能与ATP结合。
EGFR家族包括四个成员,即:EGFR/ErbBl,HER2/ErbB2,HER3/ErbB3和HER4/ErbIM;当生长因子与EGFR结合后即可诱导EGFR受体TPK激活,四个成员间形成活性较低的同源二聚体和活性较高的异源二聚体。
EGFR本身不仅有TPK活性,而且可作为TPK底物发生自身磷酸化后激活。
多细胞生物信号传导和调控是高等动物成长、发育、进化的必要条件之一。
如果信号传导控制失调,将导致细胞分裂由有控变成失控而无限增殖,最终导致肿瘤发生。
EGFR信号传导通路是一个重要的信号传导通路,目前发现其下游信号通路有:P13K/AKT、RAS—RAF—MAPKrct4/042和蛋白激酶c信号通路,EGFR信号通路的激活能导致细胞增殖、凋亡抑制、异质黏附性增强、侵袭转移能力提高等等。
已证实常规化疗过程中直肠癌、乳腺癌和卵巢癌细胞DNA损伤时能激活EGFR信号通路,使细胞产生耐药。
我们用紫杉醇和/或EGFR抑制剂AGl478、ERK抑制剂PD98059、P13K抑制剂LY290042分别作用黑色紊瘤A375细胞,探讨EGFR信号通路与紫杉醇耐药的关系及其作用机制;用EGF和/或EGFR抑制剂AGl478作用A375细胞,探讨EGFR信号通路调节黑色素瘤侵袭与转移的分子机制。
材料与方法1.常规细胞培养与稀释克隆筛选出EGFR高表达A375细胞株,取对数生长期细胞进行实验。
2.采用光镜、电镜、荧光显微镜观察细胞凋亡情况。
3.应用流式细胞术分析细胞周期(PI染色)和凋亡率(AnnexinV/Pl双染色)情况。
4.应用Matrigel胶和MTI'法进行体外黏附实验。
5.用Matrigel胶和Boyden小室进行体外侵袭实验。
6.用Westernblot方法检测P—EGFR,P—ERK,P—AKT,Bcl一2,Bax,Caspase一3蛋白表达。
7.用半定量RT—PCR检测MMP一2,MMP一9,TIMP一1。
TIMP一2mRNA表达。
实验结果1.紫杉醇以时间和剂量依赖方式抑制A375细胞生长0.001~1wmol/L紫杉醇以时间和剂量依赖方式抑制A375细胞生长(P<0.01)和诱导A375细胞凋亡(P<0。
05);IC5024h、48h、72h、96h分别为:9.5I.tJmol/L、3.7p.mol/L、0.06pmol/L、0.0079jnol/L(P<0.01);0.001、o.01、0.1、1肛moL/L紫杉醇24h细胞生长抑制率分别为:0.1%、10.8%、24.4%、32.5%(P<O.05)。
2.不同浓度紫杉醇通过不同途径诱导A375细胞凋亡0.001~lpmoVL紫杉醇作用h375细胞24h均可诱导细胞凋亡,但在细胞发生凋亡同时0.001p.mol/L紫杉醇并不改变细胞周期,0.01斗mol/L紫杉醇使Go/G。
期细胞含量明显减少,0.1、1l^mol/L紫杉醇使A375细胞发生明显的G2/M期阻滞。
但在蛋白水平上的变化是一致的,即:下调Bcl一2蛋白、上调Bax蛋白并激活Caspase一3。
3.紫杉醇通过激活EGFR—ERK/MAPK和EGFR—PDK/AKT信号通路产生耐药0.0l~0.1la,mol/L紫杉醇作用A375细胞24h,使P—EGFR、P—ERK和P—AKT蛋白表达均升高,当20pmol/LAGl478与紫杉醇联合作用细胞24h时使P—EGFR、P—ERK和P—AKT蛋白表达均下降,说明紫杉醇作用A375细胞使其发生凋亡同时能激活EGFR—ERK和EGFR—PBK/AKT二条信号通路使A375细胞产生耐药。
4.EGFR信号阻断剂与紫杉醇具有协同抗A375细胞生长和诱导细胞凋亡作用0.001~0.1ixmol/L紫杉醇与AGl478(20斗mol/L)联合应用时与紫杉醇单独作用相比细胞生长抑制作用明显增强(P<0.01)。
尽管AGl478(20la.mol/L)作用24h时没有表现诱导A375细胞凋亡作用,但与紫杉醇(0.001~0.1斗mol/L)联合应用时与紫杉醇单独作用相比早、晚期凋亡细胞比率均明显增加,早期凋亡率分别增加了2.7倍、2.8倍和1。
6倍(P<0.05),晚期凋亡细胞比率以0.01lzmol/L紫杉醇与AGl478联合作用效果最强,提高了6.8倍(P<O.01),而AGl478没有改善0.1la,mol/L紫杉醇诱导晚期凋亡细胞的作用。
由此推断EGFR信号阻断剂与紫杉醇联合应用具有协同抗黑色素瘤作用,而且这种作用不是简单的相加。
5.EGFR信号通路对A375细胞生长的影响外源性EGF作用A375细胞24h时使P—EGFR、P—ERK和P—AKT蛋白表达明显增加,而AGl478则能废弃外源性EGF的作用,使P—EGFR、P—ERK和P—AKT蛋白表达减少,并低于A375细胞正常表达水平。
外源性EGF在48h以内不影响A375细胞生长,当时间延长至72h以上时,EGF促细胞生长作用开始显现并逐渐增强,72h时细胞生长率达112.3%(P<0.05)。
AGl478、PD98059、SB203580和LY2940022分别封闭EGFR、ERK/MAPK、P38MAPK/JNK和PBK/AKT信号通路后使A375细胞生长均受到不同程度的抑制,24h时生长抑制率分别为24.9%、23.0%、17.8%和20.9%(P<0.01),而且每个阻断剂的抑制作用都呈时间效应关系。
说明EGFR信号通过至少MAPK和P13K/AKT二条下游信号通路调节黑色素瘤细胞生长。
6.EGFR信号通路对A375细胞黏附力的影响外源性EGF激活EGFR.活性后能明显地增加A375细胞对ECM的黏附性,相对黏附率是对照组的2.3倍(P<0.01);AGl478、PD98059和LY294002分别能抑制EGF的促异质黏附性的作用,使黏附率分别下降了65.5%、64.2%和65.O%(P<0.01);但SB203580则不能改变EGF的促黏附作用。
说明EGFR信号通过ERK/MAPK和P13K/AKT二条下游信号通路调节黑色素瘤细胞对细胞外基质的黏附性。
7,EGFR信号通路对A375细胞体外侵袭力的影响外源性EGF能明显地增加A375细胞穿透Matrigel体外侵袭能力,作用24h时过膜细胞数提高了26.4%(P<0.05);当AGl478、PD98059和LY294002分别封闭EGFR、ERKl/2和P13K基因后均能抑制EGF对细胞侵袭力的影响,使过膜细胞数分别下降了29.9%、25.1%和33.2%(P<0。
01);SB203580则不能改变EGF促细胞侵袭作用。
说明EGFR信号通过ERK/MAPK和P13K/AKT二条下游信号通路调节黑色素瘤细胞运动和侵袭能力。
8.EGFR活性改变对MMP一2、MMP一9、ⅡMP一1和‘nMP一2mlLNA表达的影响EGF作用24h时具有增加MMP一2、MMP一9mRNA表达,降低TIMP—l、TIMP一2mRNA表达的作用;而AGl478则具有抑制EGF的作用,使MMP一2、MMP一9mRNA表达明显减少,TIMP—lmRNA表达升高,但对TIMP一2mRNA表达影响不明显,结果MMP一2/TIMP一2和MMP一9/'lIMP一1的比值均明显下降(P<0.001)。
说嘎EGFR信号通过调节细胞外基质金属蛋白酶和其抑制剂的功能调节黑色素瘤细胞侵袭与转移能力。
讨论紫杉醇为有丝分裂抑制剂,通过与微管蛋白B亚单位结合使微管聚合加速、解聚抑制,进而形成异常稳定的微管,使细胞有丝分裂停止,阻滞细胳在G2/M期进而使细胞凋亡。
本实验结果显示,高剂量紫杉醇作用黑色素瘤.4375细胞时是通过作用微管、使有丝分裂失败进而发生G=/M期细胞阻滞和细胞凋亡,其作用机制与紫杉醇诱导骨肉瘤和卵巢癌细胞凋亡机制基本一致;而低剂量紫杉醇诱导黑色素瘤细胞凋亡时是通过作用G。
/G,期细胞而非G:/M期细胞所致,说明高低浓度紫杉醇抗黑色素瘤生长和诱导细胞凋亡是通过不同途径发挥作用的。
尽管紫杉醇作用机制独特,对常规化疗不敏感的肿瘤有效,但其本身副反应大和耐药性问题需亟待解决。
已证实EGFR信号通路与直肠癌、乳腺癌化疗耐药和放射治疗不敏感有关,当细胞DNA损伤时能够激活EGFR—PBK/AKT抗凋亡信号通路。
EGFR信号通路被激活后可通过多条下游信号通路传递信号至核内,促进或抑制特定靶基因,加速细胞增殖,抑制凋亡,增加肿瘤细胞的侵袭和转移能力。
