常见物质的分离提纯和检验学案(dy)
物质的分离、除杂和提纯(教案)

物质的分离、除杂和提纯教学目标:1. 理解物质的分离、除杂和提纯的概念。
2. 掌握常见的分离、除杂和提纯方法。
3. 能够运用所学的知识解决实际问题。
教学内容:第一章:物质的分离1.1 物质的分离概念1.2 常见的分离方法:过滤、沉淀、蒸馏、萃取等1.3 分离方法的选用原则第二章:除杂2.1 除杂的概念2.2 常见的除杂方法:吸附、离子交换、膜分离等2.3 除杂方法的选用原则第三章:提纯3.1 提纯的概念3.2 常见的提纯方法:结晶、蒸发、蒸馏等3.3 提纯方法的选用原则第四章:实验操作技巧4.1 实验操作的基本原则4.2 实验操作的注意事项4.3 实验操作技巧的培养第五章:实际应用案例分析5.1 物质的分离、除杂和提纯在工业中的应用5.2 物质的分离、除杂和提纯在环境保护中的应用5.3 物质的分离、除杂和提纯在科学研究中的应用教学方法:1. 讲授法:讲解物质的分离、除杂和提纯的基本概念、方法和应用。
2. 实验法:进行实际操作,培养学生的实验技能和实验操作技巧。
3. 案例分析法:分析实际应用案例,让学生更好地理解物质的分离、除杂和提纯的应用。
教学评价:1. 课堂参与度:观察学生在课堂上的发言和提问情况,评估学生的参与度。
3. 期末考试:设置相关试题,评估学生对物质的分离、除杂和提纯的理解和应用能力。
教学资源:1. 教材:选用合适的教材,提供详细的知识点和实例。
2. 实验器材:准备实验所需的器材和试剂,让学生进行实际操作。
3. 多媒体教学:利用PPT、视频等教学辅助工具,增强学生的学习兴趣和理解能力。
教学安排:1. 第一章:2课时2. 第二章:2课时3. 第三章:2课时4. 第四章:1课时5. 第五章:1课时物质的分离、除杂和提纯教学目标:1. 理解物质的分离、除杂和提纯的概念。
2. 掌握常见的分离、除杂和提纯方法。
3. 能够运用所学的知识解决实际问题。
教学内容:第六章:物质的检测与分析6.1 物质的检测概念6.2 常见的检测方法:光谱分析、色谱分析、电化学分析等6.3 检测方法的选用原则第七章:物质的纯度评价7.1 纯度评价的概念7.2 常见的纯度评价方法:光学纯度、化学纯度、物理纯度等7.3 纯度评价方法的选用原则第八章:物质的分离、除杂和提纯的综合应用8.1 综合应用的概念8.2 常见的综合应用案例:制药工业、食品工业、环境监测等8.3 综合应用的策略与方法第九章:实验设计与操作9.1 实验设计的基本原则9.2 实验操作的步骤与注意事项9.3 实验结果的分析和讨论第十章:新技术在物质的分离、除杂和提纯中的应用10.1 新技术的发展趋势10.2 常见的新技术:膜分离技术、色谱技术、纳米技术等10.3 新技术在实际应用中的优势和挑战教学方法:1. 讲授法:讲解物质的检测与分析、纯度评价、综合应用的概念、方法和应用。
课时二物质的分离和提纯(教学案)

课时二物质的分离和提纯(教学案)第一篇:课时二物质的分离和提纯(教学案)课时一物质的分离与提纯(导学案)【新授课】物质的分离方法一、根据物质溶解性差异1.过滤2.结晶3.萃取二、根据挥发性的差异蒸馏蒸发升华一、过滤1.两种固体,一种可溶于水,另一种不溶,我们就可以利用其溶解性的差异,通过过滤的方法实现分离。
2.分离难溶性固体与液体的混合物3.定量滤纸的孔径为:10-6~10-4m4.用滤纸能否分离胶体和溶液?二、结晶利用混合物中各组分的溶解度随温度变化而不同,用降温方法将溶解度随温度变化大的组分结晶析出,再过滤。
KNO3(NaCl)NaCl(KNO3)小结:混合物的分离方法取决于混合物各组分性质的差异三、萃取:溶解度不同的可溶性混合物的分离观察溴水与溴的四氯化碳溶液现象分析:由于溴在CCl4中的溶解度比在水中大,使得溴在CCl4中的颜色较深。
思考:向溴水中加入四氯化碳,充分振荡,现象如何?萃取的要求:1.有机溶剂与水互不相溶2.溶质在萃取剂中的溶解度大于在水中的溶解度操作注意:充分振荡,充分静止,然后分液;(萃取之后一般还要进行分夜)四、分液两种互不相溶液体的分离(适用于互不混溶的有机物和无机物的分离)操作注意:分液时保持漏斗内与大气压一致;下层溶液下口出,上层溶液上口出五、蒸馏1.分离沸点相差较大的互溶液体混合物2..将蒸出的水蒸气通过冷凝管,再收集起来,这种方法我们称为蒸馏【巩固练习】1、分离下列混合物,按溶解、过滤、蒸发顺序进行的是()A、氧化铜、木炭B、碳酸钙、氯化钠C、硝酸钾、氯化钠D、乙醇、水3、用于分离或提纯物质的已学方法有:A.萃取B.分液C.过滤D.加热分解E.蒸发F.蒸馏下列各组混合物的分离或提纯应选用上述哪种方法最合适?(把选用方法的标号填入括号内)(1)除去Ca(OH)2溶液中悬浮的Ca (OH)2 颗粒(c)(2)把饱和食盐水中的食盐提取出来(e)(3)除去酒精中溶解的微量食盐(f)(4)把溴水中的溴提取出来(a)(5)用自来水制取医用蒸馏水(f)(6)除去氧化钙中的碳酸钙(d)(7)分离柴油和水的混合物(b)4、现有三组溶液(1)汽油和氯化钠溶液(2)酒精和水的混合溶液(3)氯化钠和单质溴的溶液以上混合溶液分离的正确方法依次是()A、分液、萃取、蒸馏B、萃取、蒸馏、分液C、分液、蒸馏、萃取D、蒸馏、萃取、分液4.下列实验操作,不能用以分离提纯物质的是()A.萃取B.称量C.蒸馏D.结晶5.下列关于混合物分离的方法中,能够分离KNO3和NaCl的是()A.溶解过滤B.结晶C.蒸馏D.萃取阅读下列材料,按要求回答问题:酒精、苯、CCl4、煤油都是有机溶剂,有机溶剂之间大都能互溶;碘(I2)难溶于水,易溶于有机溶剂,其溶液呈紫色;溴(液溴)的性质与碘相似,其溶液呈橙色。
物质的分离和提纯教学案
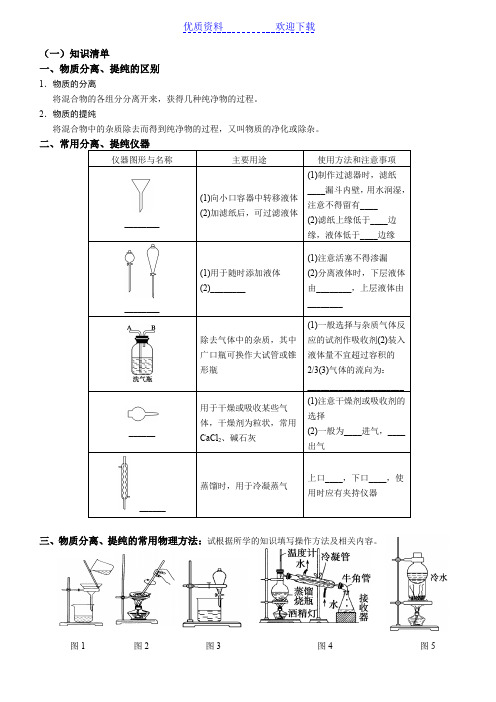
(一)知识清单一、物质分离、提纯的区别1.物质的分离将混合物的各组分分离开来,获得几种纯净物的过程。
2.物质的提纯将混合物中的杂质除去而得到纯净物的过程,又叫物质的净化或除杂。
______三、物质分离、提纯的常用物理方法:试根据所学的知识填写操作方法及相关内容。
图1图2图3 图4图5(1)如图1,方法、装置的名称:________。
适用范围:把不溶性________________进行分离。
注意事项:①一贴:________紧贴漏斗内壁;二低:滤纸上缘低于____________,液面低于滤纸边缘;三靠:烧杯紧靠____________,玻璃棒轻靠____________处,漏斗下端紧靠__________。
②若滤液浑浊,需____________________。
浑浊的原因可能是________________________。
(2)结晶是____________________的过程,对溶解度受温度变化影响________的固态溶质,采用____________的方法,而对溶解度受温度变化影响相当大的固态溶质,采用冷却饱和溶液的方法。
如图2,方法、装置的名称:____________。
适用范围:溶解度随温度变化较小物质注意事项:①玻璃棒的作用:______________________________________________;②________________________________________________________________________而不能直接蒸干。
(3)如图3,方法、装置的名称:________。
适用范围:①萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来;②分液:两种液体互不相溶且易分层。
注意事项:①溶质在萃取剂中的溶解度比在原溶剂中大;②萃取剂与原溶剂不反应、不相溶;③萃取剂与溶质不反应。
(4)如图4,方法、装置的名称:__________。
物质的分离和提纯学案(含试题)

物质的分离和提纯知识点:一、混合物的分离方法其它如:加酸(某液体)转化法:溶液中的杂质遇酸转化为溶液中的主要成分或气体,如加硝酸除去硝酸钾溶液中的碳酸钾;通过量CO2除去NaHCO3溶液中的Na2CO3 吸附法:混合物中的某种组分易被某种吸附剂吸附,如用木炭使蔗糖溶液脱去有机色素加氧化剂或还原剂转化法:溶液中的杂质易被氧化或还原为所需成分,如通氯气除去FeCl3溶液中的FeCl2,加铁除去FeCl2中的FeCl3二、常见物质除杂方法除杂题除杂选择试剂的原则是:不增、不减、不繁。
序号原物所含杂质除杂质试剂主要操作方法1N2O2灼热的铜丝网用固体转化气体2CO2H2S CuSO4溶液洗气3CO CO2NaOH溶液洗气4CO2CO灼热CuO用固体转化气体注意的问题:(1)需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
(2)除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2溶液,因为Ca(OH)2是微溶物,石灰水中Ca(OH)2浓度小,吸收CO2不易完全。
(3)除杂装置与气体干燥相同。
(4)有机物的实验往往副反应比较多,导致产物中的杂质也多,为了保证产物的纯净,必须注意对产物进行净化除杂。
如“乙烯的制备实验”中乙烯中常含有CO2和SO2等杂质气体,可将这种混合气体通入到浓碱液中除去酸性气体;再如“溴苯的制备实验”和“硝基苯的制备实验”,产物溴苯和硝基苯中分别含有溴和NO2,因此,产物可用浓碱液洗涤。
除杂方法:1.杂质转化法:欲除去苯中的苯酚,可加入氢氧化钠,使苯酚转化为酚钠,利用酚钠易溶于水,使之与苯分开。
欲除去Na2CO3中的NaHCO3可用加热的方法。
2.吸收洗涤法:欲除去二氧化碳中混有的少量氯化氢和水,可使混合气体先通过饱和碳酸氢钠的溶液后,再通过浓硫酸。
3.沉淀过滤法:欲除去硫酸亚铁溶液中混有的少量硫酸铜,加入过量铁粉,待充分反应后,过滤除去不溶物,达到目的。
物质的分离和提纯教案

物质的分离和提纯教案教案标题:物质的分离和提纯教学目标:1. 理解物质的分离和提纯的概念。
2. 掌握常见的物质分离和提纯方法。
3. 能够应用所学知识解决实际问题。
教学内容:1. 物质的分离:过滤、蒸馏、结晶、离心、萃取等方法。
2. 物质的提纯:结晶、升华、溶解结晶等方法。
教学步骤:引入活动:1. 通过展示一些混合物的图片或实物,引发学生对物质分离和提纯的思考和讨论。
知识讲解:2. 解释物质的分离和提纯的概念和重要性。
3. 介绍常见的物质分离和提纯方法,并结合实例进行讲解。
示范实验:4. 进行一个简单的示范实验,如通过过滤和蒸馏分离混合物中的固体和液体成分。
小组合作探究:5. 将学生分成小组,给予每个小组一个混合物样品,要求他们设计合适的分离和提纯方法,并进行实验操作。
6. 学生之间交流和分享实验结果,讨论各自方法的优缺点。
概念巩固:7. 通过课堂讨论,总结各种物质分离和提纯方法的特点和适用场景。
拓展应用:8. 提供一些实际生活中的问题,要求学生运用所学知识解决,如如何从海水中提取盐等。
课堂练习:9. 分发练习题,让学生独立完成,检验他们对所学知识的理解和运用能力。
课堂总结:10. 对本节课的重点内容进行总结,并强调物质的分离和提纯在日常生活和科学研究中的应用。
课后作业:11. 布置相关的课后作业,如阅读相关教材内容、解答问题或设计实验等。
教学评估:12. 结合课堂练习和课后作业,对学生的学习情况进行评估。
教学资源:- 混合物的图片或实物- 示范实验所需材料和设备- 小组合作实验所需材料和设备- 练习题和答案- 相关教材和参考资料教学反思:根据学生的实际情况和学习进度,适当调整教学步骤和方法,确保教学效果。
同时,引导学生思考物质分离和提纯的实际应用,培养他们的创新思维和问题解决能力。
人教版高中化学学案-物质的分离、提纯与检验

【專題九】物質的檢驗、分離、提純【考點突破】考點1 物質的分離和提純1.分離和提純的區別(1)分離:通過一定的方法,把混合物中的幾種物質分離開的操作。
(2)提純:通過適當方法,把混合物中的雜質除去以得到純淨物質的操作。
2.物理方法分離和提純物質(1)過濾:過濾是除去溶液中不溶於溶劑的雜質的方法。
過濾時應注意:①一貼:濾紙緊貼漏斗內壁,中間不留有氣泡,否則會降低過濾速率。
②二低:濾紙邊緣低於漏斗邊緣,防止液面高於漏斗邊緣而溢出;漏斗中的液面低於濾紙邊緣,防止過濾液從濾紙和漏斗之間流下,造成過濾出的液體不純。
③三接觸:燒杯應與玻璃棒接觸,防止過濾液溢出漏斗;玻璃棒與濾紙的三層相接觸,防止液體衝破濾紙;漏斗的下端與接受過濾的燒杯內壁接觸,加快過濾速率。
(2)蒸發和結晶①蒸發結晶:把溶液中的溶劑蒸幹得到溶質晶體,如蒸發飽和食鹽水得到NaCl晶體。
②冷卻結晶:根據混合物中各成分在某種溶劑中隨溫度變化,溶解度改變不同,製成某種溶質的熱飽和溶液後,降溫使其中一種溶質大部分析出,而餘下的溶質仍留在溶液中的分離方法。
如冷卻結晶的方法分離NaCl和KNO3的混合物。
蒸發液體時,要用玻璃棒攪拌,防止由於局部過熱液體濺出,當蒸發過程中出現較多固體時,應停止加熱,用餘熱使剩下的溶劑蒸幹,如果後期仍加熱,固體會從容器中濺出。
(3)蒸餾蒸餾是提純或分離沸點不同的液體混合物的方法。
用蒸餾原理分離幾種成分的混合液體叫分餾。
分餾時注意:在蒸餾燒瓶中加入碎瓷片,防止液體暴沸。
溫度計水銀球應與蒸餾燒瓶支管下沿在同一水平線上。
(4)分液和萃取分液是把兩種互不相溶的密度不同的液體分離開的方法。
萃取是利用溶質在互不相溶的溶劑中溶解度的不同,用一種溶劑把溶質從它與另一種溶劑所組成的溶液中提取出來的方法。
萃取劑的選擇應符合以下要求:①萃取劑與原溶劑不能互溶(如用酒精從碘水中萃取I2的方法不妥);②溶質在萃取劑中的溶解度遠大于在原溶劑中的溶解度;③萃取劑不能揮發(如用乙醚從溴水中萃取Br2的方法不妥)。
中考化学实验专题复习:物质的分离、除杂和提纯(教案)

中考化学实验专题复习——物质的分离、除杂和提纯一、教学目标1. 理解物质的分离、除杂和提纯的基本原理;2. 掌握常用的物质分离和提纯方法,如过滤、蒸馏、萃取、分液等;3. 能够分析实际问题,选择合适的分离和提纯方法;4. 提高实验操作能力和实验思维。
二、教学内容1. 物质的分离方法:过滤、蒸馏、萃取、分液等;2. 物质的除杂方法:吸附、沉淀、离子交换等;3. 物质的提纯方法:蒸发、结晶、吸收等;4. 实际问题分析与解决。
三、教学过程1. 引入:通过生活中的实例,引出物质的分离、除杂和提纯的概念;2. 讲解:详细讲解各种分离、除杂和提纯方法的原理和操作步骤;3. 演示:进行实验演示,让学生直观地理解各种方法的操作过程;4. 练习:给出一些实际问题,让学生运用所学知识进行分析;5. 总结:对本节课的内容进行总结,强化学生的记忆。
四、教学评价1. 学生能熟练掌握各种分离、除杂和提纯方法的原理和操作步骤;2. 学生能独立分析实际问题,选择合适的分离和提纯方法;3. 学生能完成相关的实验操作,具备一定的实验能力。
五、教学资源1. 实验室设备:显微镜、漏斗、烧杯、蒸馏器等;2. 实验试剂:食盐水、酒精、碘酒等;3. 教学课件:物质的分离、除杂和提纯的相关课件;4. 教学参考书:中考化学实验专题复习资料。
六、教学重点与难点教学重点:1. 掌握过滤、蒸馏、萃取、分液等基本分离方法的操作步骤和适用条件。
2. 理解吸附、沉淀、离子交换等除杂方法的原理和应用。
3. 学会通过实验操作对混合物进行有效的提纯。
教学难点:1. 蒸馏和分液的原理理解及操作技巧。
2. 针对不同混合物选择合适的分离提纯方法。
3. 实验中可能出现的意外情况的处理。
七、教学方法1. 采用问题驱动的教学方法,引导学生通过实验观察和思考。
2. 使用案例分析和小组讨论的方式,提高学生的参与度和合作能力。
3. 通过实验演示和实操练习,增强学生的动手能力和实验技能。
物质的分离、除杂和提纯(教案)

物质的分离、除杂和提纯一、教学目标:1. 让学生了解物质分离的基本方法,包括过滤、蒸馏、萃取、离子交换等。
2. 使学生掌握除杂和提纯的原则,能够根据物质的性质选择合适的分离方法。
3. 培养学生实验操作的能力,能够独立完成物质的分离、除杂和提纯的实验。
二、教学内容:1. 物质的分离方法:过滤、蒸馏、萃取、离子交换等。
2. 除杂和提纯的原则:选择合适的分离方法,尽量减少物质的损失。
3. 实验操作:如何进行物质的分离、除杂和提纯。
三、教学重点与难点:1. 重点:物质分离的基本方法,除杂和提纯的原则。
2. 难点:实验操作,如何选择合适的分离方法。
四、教学准备:1. 实验室用具:烧杯、漏斗、滤纸、蒸馏器、萃取剂等。
2. 实验材料:食盐水、酒精、碘酒、石蜡等。
五、教学过程:1. 导入:通过实例介绍物质分离的重要性,引发学生兴趣。
2. 讲解:介绍物质分离的基本方法,讲解除杂和提纯的原则。
3. 演示实验:进行过滤、蒸馏、萃取等分离方法的演示实验。
4. 学生实验:学生分组进行物质的分离、除杂和提纯的实验。
6. 作业:布置相关练习题,巩固所学知识。
六、教学评估:1. 评估学生对物质分离方法的理解程度,通过课堂提问和作业练习。
2. 评估学生在实验操作中的技能掌握情况,包括正确使用实验室用具和遵循实验步骤。
3. 评估学生对除杂和提纯原则的运用能力,通过实验报告和问题解答。
七、教学拓展:1. 介绍现代物质分离技术,如色谱法、质谱法等。
2. 探讨物质分离在科学研究和工业应用中的重要性。
3. 引导学生思考物质分离技术的创新和发展。
八、教学资源:1. 教案、PPT课件和教学视频。
2. 实验指导书和实验试剂清单。
3. 相关科学文章和研究报告。
九、教学反馈:1. 收集学生对教学内容的反馈,了解学生的学习需求和困惑。
2. 根据学生反馈调整教学方法和内容,提高教学效果。
3. 鼓励学生提出问题和建议,促进教学相长。
十、教学反思:1. 反思教学过程中的有效性和学生的参与程度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见物质的分离、提纯和检验
一、物质分离的方法
1.物理分离提纯法
常见的物理分离提纯法有:过滤、结晶(重结晶)、蒸馏(分馏)等。
例:在下列括号中填写适当的物理分离提纯方法。
① 除去石灰水中悬浮的碳酸钙( )
② 从自来水中制得蒸馏水( )
③ 从氯化钠和硝酸钾中提取硝酸钾( )
2.化学方法分离和提纯物质
对物质的分离可一般先用化学方法对物质进行处理,然后再根据混合物的特点用恰当的分离方法进行分
离。
用化学方法分离和提纯物质时要注意:
用化学分离和提纯物质时要注意:
① 不引入新的杂质;
② 不能减少被提纯物质的质量;
③ 操作简便,试剂价廉,现象明显,易于分离。
对于无机物溶液常用下列方法进行分离和提纯:
(1)生成沉淀法:
(2)生成气体法:
(3)置换法:
(4)加热法:
二、物质的除杂方法
物质(杂质) 操作方法 发生的化学反应
H2(水蒸气)
CO2(CO)
CO2(HCl)
CO(CO2)
CuO(C)
Cu(Fe)
Cu(CuO)
FeSO4(CuSO4)
NaCl(Na2CO3)
NaCl(Na2SO4)
NaCl(NaOH)
NaOH(Na2CO3)
NaNO3(NaCl)
NaCl(KNO3)
KNO3(NaCl)
CO2(水蒸气)
三、物质的检验
物质的检验通常有鉴定、鉴别和推断三类,它们的共同点是:依据物质的特殊性质和特征反应,选择
适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、
火焰的颜色等,进行判断、推理。
鉴定通常是指对于某一种物质的定性检验,根据物质的化学特性,分别检出阳离子、阴离子,鉴别通
常是指对分别存放的两种或两种以上的物质进行定性辨认,可根据一种物质的特性区别于另一种,也可根
据几种物质的颜色、气味、溶解性、溶解时的热效应等一般性质的不同加以区别。推断是通过已知实验事
实,根据性质分析推求出被检验物质的组成和名称。我们要综合运用化学知识对常见物质进行鉴别和推断。
1.常见气体的检验
常见气体
检验方法
氧气
氢气
一氧化碳
甲烷
二氧化碳
氨气
水蒸气
2.几种重要阳离子的检验
(l)H+
(2)Ba2+
(3)Mg2+
(4)Ag+
(5)NH4+
(6)Fe2+
(7)Cu2+
3.几种重要的阴离子的检验
(1)OH-
(2)Cl-
(3)SO42-
(4)CO32-
(5)HCO3-
4.用一种试剂或不用试剂鉴别物质
用一种试剂来鉴别多种物质时,所选用的试剂必须能和被鉴别的物质大多数能发生反应,而且能产生
不同的实验现象。常用的鉴别试剂有NaOH溶液、Na2CO3溶液、稀H2SO4、稀HCl 、FeCl3溶液等。
不用其他试剂来鉴别一组物质,一般情况从两个方面考虑:
①利用某些物质的特殊性质(如颜色、气味、溶解性等),首先鉴别出来,然后再用该试剂去鉴别其
他物质。
②采用一种试剂与其他物质相互反应的现象不同,进行综合分析鉴别。
四、典型例题
1、仅用水就能鉴别的一组物质是( )
A.乙醇、醋酸、植物油 B.食盐、苏打、小苏打
C.大理石、生石灰、胆矾 D.氧化铜、二氧化锰、高锰酸钾
2、为了除去粗盐中的 Ca2+、Mg2+、SO42-及泥砂,可将粗盐溶于水,然后进行下列五项操作。其中正确的
操作顺序是( )
①过滤 ②加过量的 NaOH溶液 ③加适量盐酸 ④加过量 NaCO3溶液 ⑤加过量 BaCl2溶液
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.⑤②④①③
加热
溶解
加BaCl2 加Na2CO3 过滤
加热煮沸
① ② ③ ④ ⑤ 3、下列除去杂质的方法中,正确的是 4、为了将混有硫酸钠、碳酸氢铵的氯化钠提纯,并制得纯净的氯化钠溶液,某学生设计如下实验: (1)操作②能否用硝酸钡溶液?说明理由 。 (2)进行操作②后,如何判断SO42-已除尽,方法是 。(3)操作③的目的是 ;为什么不先过滤而后加碳酸钠溶液,其理由是 。 (4)此设计方案是否严密,说明理由 。 5、有下列实验装置示意图: A B C D E F G H 请回答下列问题: (1)实验室用氯酸钾制取氧气,应选用的发生装置是 (填装置代号)。 (2)若用B装置制备氢气,且产生的气体中不含酸性杂质气体,则试剂X常用 ,用G装置收集氢气,②应与 (填接口序号)相连。 (3)现有如下资料:①实验室用FeS固体与稀H2SO4在常温下反应制取H2S气体。 ②通常状况下,H2S是一种密度比空气大的有毒气体,能溶于水,水溶液能使紫色石蕊试液变红,能与碱溶液反应。 若在实验室中用上述装置制备并收集一瓶干燥的H2S气体,且符合“绿色化学”理念,所选装置从左到右的连接顺序为(填接口序号) 。 选项 物质(括号内为杂质) 去除杂质的方法 A NaCl溶液(Na2CO3) 加入适量的CaCl2溶液、过滤 B CaO(CaCO3) 加水、过滤 C Fe(Zn) 加过量FeSO4溶液、过滤 D HNO3溶液(H2SO4) 加适量BaCl2溶液、过滤 NaCl Na2SO4 NHHCO
残 留 物 悬 浊 液 滤
液
纯净的NaCl
溶液
溶
液
