标准溶液标定原始记录
标准溶液配制标定记录 基准物标定

0.050
8.150
8.450
温度补正系数 mL/L
温度补正值
mL 20℃时标液耗用校正
体积
(V1-V2) mL 20℃时标液浓度的计
算值c,mol/L
-0.005 8.445 0.01186
-0.005 8.145 0.01184
-0.005 8.445 0.01186
单人四平行标液浓度 的平均值, mol/L
4.347
0.01353 0.01353 0.01352
0.01352
0.08
0.13
差,单人四平行≤0.15%,双人八平行≤0.18%。 平行平均值,保留四位有效数字为标定结果。
:
审核:
标准溶液配制标定原始
标准溶液名 称
配制及日期
基准物质及 摩尔质量M 配制标定依
据
仪器用具
0.05mol/L氢氧化钠溶液
120℃至恒重
2个月
室温℃
23
乙标定者
0.0054 0.0053
8.650
8.500
0.050
8.600
8.450
-0.005 -0.005
8.595
8.445
0.01188 0.01186
0.01188
0.42
0.56
行≤0.15%,双人八平行≤0.18%。 保留四位有效数字为标定结果。
核:
标准溶液配制标定原始记录
干燥条件 标准溶液有效期
0.0055 8.800
0.0057 9.100
8.750
9.050
-0.6
-0.005 -0.005
8.745
9.045
0.01189 0.01191
盐酸标准溶液配制与标定原始记录2019年

CDC -JYZX -L -JL -030疾病预防控制中心盐酸准溶液配制与标定原始记录————————————————————————————————————————— 一、依据标准:GB/T601-2002、GB/T13025.7-2012二、主要仪器设备:BTP221S 万分之一电子天平(仪器编号:PBCDC-JD-5-JYZX-002)三、试剂:无水碳酸钠 基准 上海虹光化工厂 920212盐酸 GR 重庆川东化工有限公司 20130904四、溶液配制: 1、盐酸标准溶液()0.050.5/c HCl mol L配制人: 配制日期: 年 月 日 五、标定 :1、标定方法:称: g(精确至0.0001g)于180 ℃干燥恒重的无水碳酸钠(Na 2CO 3),放入150mL 锥形瓶中,加50mL 蒸馏水溶解,加4滴甲基橙指示剂,用上述盐酸溶液滴定到溶液由黄色突变为橙红色,即达终点,记录消耗盐酸溶液的毫升数(V)。
盐酸溶液的浓度按式)计算: 计算公式:12()×0.05299mc HCl V V()c HCl—盐酸标准滴定溶液的浓度,单位为摩尔升(mol/L);()c m —无水碳酸钠质量,单位为(g ); 0.05299—与1.00mL 盐酸标准溶液[c(HCl)=1.000 mol/L]相当的以克表示的 Na 2CO 3 的质量。
1V ——盐酸标准溶液的用量,单位为毫升(mL);2V —空白试验盐酸标准溶液的用量,单位为毫升(mL ); 2、标准温度(20℃)下盐酸标准溶液补正体积:201000C fV VV20C V —标准温度(20℃)下盐酸标准溶液补正体积,ml ; V —室温下消耗盐酸标准溶液体积,ml ;f —不同温度下盐酸标准溶液体积的补正值(GB/T601-2002附录A ),ml/L 。
CDC -JYZX -L -JL -030————————————————————————————————————————— 3、标定记录:(1)标定人一: 标定日期: 年 月 日 盐酸标准溶液温度: ℃ 查表得f =盐酸标准溶液的盐酸标准溶液温度: ℃ 查表得f =盐酸标准溶液的盐酸标准溶液的平均浓度:()2C A BHCl (mol/L )A —标定人一标定盐酸标准溶液的平均浓度;B —标定人二标定盐酸标准溶液的平均浓度。
标准溶液配制与标定原始记录(氢氧化钠)

邯郸市丛台区安东食品加工厂
标准溶液配制与标定原始记录
标准溶液的配制
标准溶液名称预配浓度配制方法配制日期
氢氧化钠标准溶液0.1 mol/L GB/T601-2002年月日
标准溶液的标定
基准物名称温度℃湿度%所用仪器及试剂
邻苯二甲酸氢钾(99.9%)
1酚酞指示剂
2无二氧化碳水
3烘箱
标定标定日期:年月日
序号基准物质的质
量m ; (g)
消耗标准溶液的
体积V1 ; (ml)
空白消耗标准溶液
的体积V0 ;(ml)
计算结果
mol/L
平均结果
mol/L
1
2
3
4
复标复标日期:年月日1
2
配制人:标定人:复标人:如有侵权请联系告知删除,感谢你们的配合!。
标准溶液标定原始记录

标准溶液标定原始记录实验日期,2022年10月15日。
实验地点,化学实验室。
实验目的,通过标定标准溶液的浓度,掌握标定方法,熟练掌握分光光度计的使用。
实验仪器,分光光度计、10ml瓶、蒸馏水、标准溶液、待测溶液、移液管、吸光皿。
实验原理,标准溶液是已知浓度的溶液,通过分光光度计测量其吸光度,可以确定待测溶液的浓度。
标定过程中,首先使用分光光度计测量标准溶液的吸光度,然后根据比例关系计算待测溶液的浓度。
实验步骤:1. 准备工作,清洗吸光皿,用蒸馏水冲洗10ml瓶,并用标准溶液预洗移液管。
2. 标定标准溶液,取一定量的标准溶液,转移至吸光皿中,使用分光光度计测量其吸光度,并记录数据。
3. 测定待测溶液,取一定量的待测溶液,转移至吸光皿中,使用同一分光光度计测量其吸光度,并记录数据。
4. 计算浓度,根据标定曲线和标准溶液的吸光度,计算待测溶液的浓度。
实验数据:标准溶液吸光度,0.75。
待测溶液吸光度,0.45。
计算结果,待测溶液浓度为0.6mol/L。
实验总结:通过本次实验,我掌握了标定标准溶液的方法和步骤,熟练掌握了分光光度计的使用。
在实验中,我注意到了一些细节问题,比如吸光皿的清洗和操作技巧,这些都是需要进一步改进和注意的地方。
同时,实验数据的记录和计算也需要仔细检查,以确保结果的准确性。
在今后的实验中,我会更加细致地进行操作,提高实验的准确性和可靠性。
总之,本次实验对我来说是一次很好的实践机会,让我更加深入地理解了标定原始记录的重要性和实验操作的技巧。
希望通过不断的实验实践和学习,我能够更加熟练地掌握实验技术,为将来的科研工作打下坚实的基础。
试剂标定原始记录
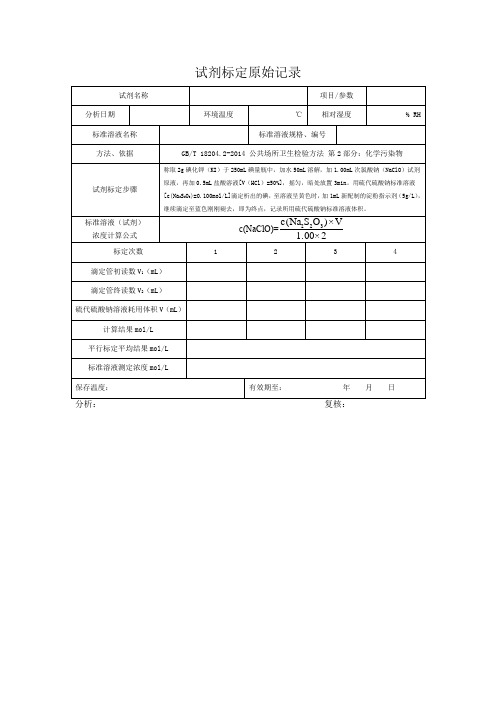
浓度计算公式
c(NaClO)=
标定次数
1
2
3
4
滴定管初读数V1(mL)
滴定管终读数V2(mL)
硫代硫酸钠溶液耗用体积V(mL)
计算结果mol/L
平行标定平均结果mol/L
标准溶液测定浓度mol/L
保存温度:
有效期至: 年 月 日ຫໍສະໝຸດ 分析:复核:试剂标定原始记录
试剂名称
项目/参数
分析日期
环境温度
℃
相对湿度
% RH
标准溶液名称
标准溶液规格、编号
方法、依据
GB/T 18204.2-2014 公共场所卫生检验方法 第2部分:化学污染物
试剂标定步骤
称取2g碘化钾(KI)于250mL碘量瓶中,加水50mL溶解,加1.00mL次氯酸钠(NaClO)试剂原液,再加0.5mL盐酸溶液[V(HCl)=50%],摇匀,暗处放置3min。用硫代硫酸钠标准溶液[c(Na2S2O3)=0.100mol/L]滴定析出的碘,至溶液呈黄色时,加1mL新配制的淀粉指示剂(5g/L),继续滴定至蓝色刚刚褪去,即为终点,记录所用硫代硫酸钠标准溶液体积。
标准溶液的配置标定记录

标准溶液的配置标定记录氢氧化钠标准滴定溶液的配置滴定记录① 配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用时用塑料管虹吸上层清液。
氢氧化钠标准溶液:量取毫升氢氧化钠饱和溶液,注入毫升不含二氧化碳的水中,摇匀。
② 标定:称取克于105℃--110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0002克。
溶于毫升不含二氧化碳的水中,加2滴1酚酞指示液,用氢氧化钠溶液滴定至溶液呈粉红色,并保持30s。
同时做空白试验。
③ 计算:氢氧化钠标准滴定溶液的浓度[c(NaOH)],数值以摩尔每升(mol/L)表示,按下列公式计算:c(NaOH)=m 1000(V1 V2)M式中:m-----邻苯二甲酸氢钾的质量的准确数值,单位为克(g); V1----氢氧化钠溶液的体积的数值,单位为毫升(mL); V2---空白试验氢氧化钠溶液的体积的数值,单位为毫升(mL);M----邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)[M(*****4)= 204.22 ]容量分析原始记录检验:审核:检验日期:① 配制:盐酸标准溶液,量取毫升盐酸,注入毫升水中。
② 标定:称取克于270℃--300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,称准至0.0002克。
,溶于50mL水中,加10滴溴甲酚绿一甲基红指示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色,同时做空白试验。
③ 计算:盐酸标准滴定溶液的浓度[c(HCl)]数值以摩尔每升(mol/L)表示,按下列公式计算:c(HCl)=m 1000(V1 V2)M式中:m----无水碳酸钠的质量的准确数值,单位为克(g) V1---盐酸溶液的体积的数值,单位为毫升(mL)V2---空白试验盐酸溶液的体积的数值,单位为毫升(mL) M---无水碳酸钠的摩尔质量的数值,单位为克每摩尔(g/mol)[M (12 Na2CO3)=52.994]容量分析原始记录检验:审核:检验日期:① 配制:硫酸标准溶液,量取毫升硫酸,注入毫升水中。
标准溶液配制标定及复标记录

滴定液标定记录标准溶液名称亚硝酸钠滴定液配制浓度 mol/L 基准物名称基准对氨基苯磺酸配制时间年月日配制温度℃配制人标定时间年月日标定温度℃标定人复标时间年月日复标温度℃复标人配制方法取亚硝酸钠 g,加无水碳酸钠(Na2CO3) g,加水适量使溶解成ml,摇匀。
标定方法取在120℃干燥至恒重的基准对氨基苯磺酸约0.5g,精密称定,加水30ml与浓氨试液3ml,溶解后,加盐酸(1→2)20ml,搅拌,在30℃以下用本液迅速滴定,滴定时将滴定管尖端插入液面下约2/3处,随滴随搅拌,至近终点时,将滴定管尖端提出液面,用少量水洗涤尖端,洗液并入溶液中,继续缓缓滴定,用永停法指示终点。
每1ml亚硝酸钠滴定液(0.1mol/L)相当于17.32mg的对氨基苯磺酸。
根据本夜的消耗量与对氨基苯磺酸的取用量,计算:F=W样×1000V×17.32×100%称量与标定计算结果 W样1 V1 F1 =××=W样2 V2 F2 =××=W样3 V3 F3 =××=RD = % 0.1%标定平均F值相对偏差是否符合规定是否称量与标定计算结果W样1 V1 F1 =××=W样2 V2 F2 =××=W样3 V3 F3 =××=RD = % 0.1%复标平均F值相对偏差是否符合规定是否二次相对偏差是否符合规定是否标准溶液F值有效期至年月日。
20标准溶液配制、标定原始记录(COD用)

标定后实际浓度
mol/L
取样体积(mL)
10.00
平行实验
名称
1
2
3
标准溶液滴定毫升数
V始
V终
V耗
V始
V终
V耗
V始
V终
V耗
标准溶液浓度(mol/L)
平均浓度(mol/L)
计算公式
C=0.0250×10.00∕V
配制人员/日期:标定人员/日期:复核人员:
V终
V耗
V始
V终
V耗
V始
V终
V耗
标准溶液浓度(mol/L)
平均浓度(mol/L)
计算公式
C=0.2500×10.00∕V
配制人员/日期:标质
名称
重铬酸钾标准溶液
名称
硫酸亚铁铵标准溶液
试药用量
1.2258g
试药用量
7.9g
配制总体积
1L
配制总体积
2L
标定后实际浓度
化验室记录
标准溶液配制、标定原始记录
记录编号:
基准物质
标准物质
名称
重铬酸钾标准溶液
名称
硫酸亚铁铵标准溶液
试药用量
12.2580g
试药用量
79.0g
配制总体积
1L
配制总体积
2L
标定后实际浓度
0.2500mol/L
标定后实际浓度
mol/L
取样体积(mL)
10.00
平行实验
名称
1
2
3
标准溶液滴定毫升数
V始
标准溶液‘配制’及‘标定’原始重点学习的记录.docx
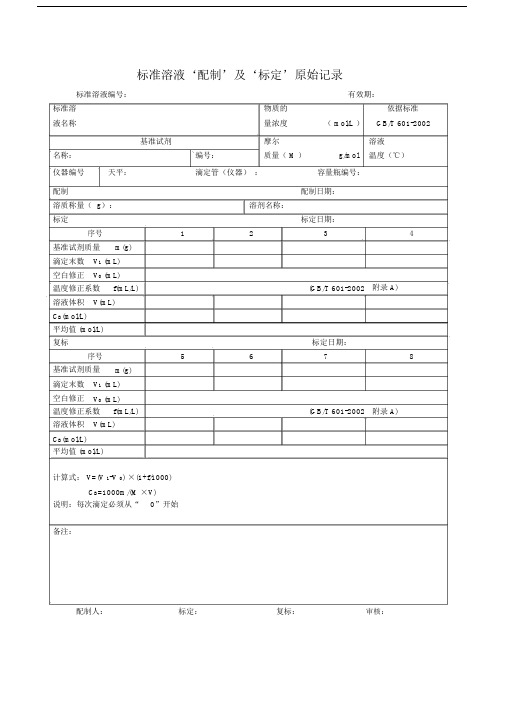
标准溶液‘配制’及‘标定’原始记录标准溶液编号:有效期:标准溶物质的依据标准液名称量浓度( mol/L )GB/T 601-2002基准试剂摩尔溶液名称:编号:质量( M )g/mol温度(℃)仪器编号天平:滴定管(仪器):容量瓶编号:配制配制日期:溶质称量( g):溶剂名称:标定标定日期:序号1234基准试剂质量m(g)滴定末数V1 (mL)空白修正V0 (mL)温度修正系数f(mL/L)(GB/T 601-2002附录 A)溶液体积V(mL)C B(mol/L)平均值 (mol/L)复标标定日期:序号5678基准试剂质量m(g)滴定末数V1 (mL)空白修正V0 (mL)温度修正系数f(mL/L)(GB/T 601-2002附录 A)溶液体积V(mL)C B(mol/L)平均值 (mol/L)计算式: V=(V 1-V 0) ×(1+f/1000)C B=1000m/(M ×V)说明:每次滴定必须从“0”开始备注:配制人:标定:复标:审核:标准物质配制(标定)记录编号: CHEC/ QBG-075名称:、配制方法:使用天平型号编号室温℃、湿度%RH配制:取定溶mL标定:取份:⑴⑵⑶⑷用溶液滴定,滴定消耗量( mL)V1=、 V2=、 V3=、V4=、V0=。
标准溶液浓度计算公式: C=计算结果():C1=C2=C3=C4= C =相对偏差( %):S1=S2=S3=S4=备注:。
配制人:复核人:配制日期:年月日有效期年月日标准溶液配制记录编号: CHEC/QBG-147标准溶液名称:规格:配制方法:仪器名称:溯源标准:温度:℃、湿度:%RH标准溶液拟配浓度:配制或稀释过程:配制日期:年月日有效期:年月日配制人:复核人:0.1mol/L盐酸标准滴定溶液的标定编号: JL/LJ-001-01一、标定方法: GB/T5009.1-2003二、使用仪器: AEL-200 电子天平(仪器编号: JYB001)马弗炉 (仪器编号:JYC009)三、操作1、量取 9ml 盐酸,加适量水并稀释至 1000ml 。
标准溶液‘配制’及‘标定’原始记录【范本模板】
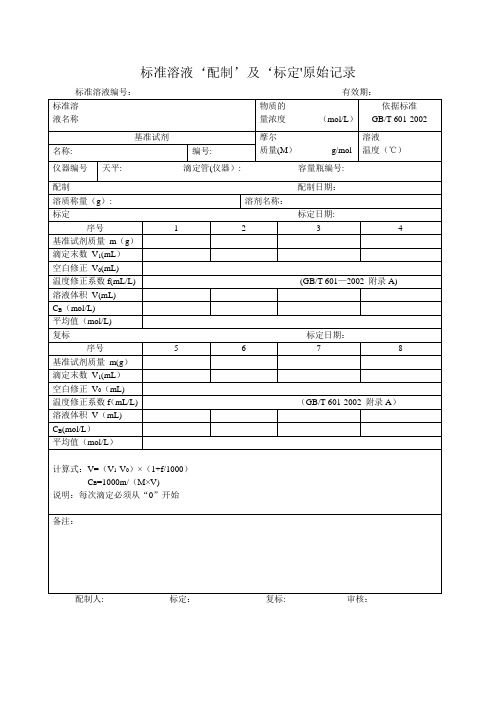
标准溶液‘配制’及‘标定'原始记录配制人: 标定:复标: 审核:标准物质配制(标定)记录编号: CHEC/QBG-075名称:、配制方法:使用天平型号编号室温℃、湿度%RH 配制:取定溶mL 标定:取份:⑴⑵⑶⑷用溶液滴定,滴定消耗量(mL) V1= 、V2= 、V3= 、V4= 、V0= 。
标准溶液浓度计算公式:C=计算结果():C1= C2= C3= C4= C =相对偏差(%):S1= S2= S3= S4=备注:.配制人:复核人:配制日期:年月日有效期年月日标准溶液配制记录编号: CHEC/QBG—147标准溶液名称:规格:配制方法:仪器名称:溯源标准:温度: ℃、湿度:%RH标准溶液拟配浓度:配制或稀释过程:配制日期:年月日有效期:年月日配制人:复核人:0。
1mol/L盐酸标准滴定溶液的标定编号:JL/LJ-001-01一、标定方法:GB/T5009。
1-2003二、使用仪器:AEL—200电子天平(仪器编号:JYB001)马弗炉(仪器编号:JYC009)三、操作1、量取9ml盐酸,加适量水并稀释至1000ml。
混匀,待标定.2、标定:精密称取约0.15g在270~300℃干燥至恒量的基准无水碳酸钠,加50ml水使之溶解,加10滴溴甲酚绿-甲基红混合指示液,用本溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色.四、记录和结果1、计算公式:c(HCl)=m/[(V1-V2)×0。
0530]0。
0530……与1.00ml盐酸标准滴定溶液[c(HCl)=1mol/L]相当的基准无水碳酸钠的质量,g配制人: 复核人:配制日期:复核日期:标准溶液(滴定液)管理工作的基本要求关键词(必填项目):标准溶液、滴定液目的(必填项目):对标准溶液的使用等制定统一的要求,便于统一的管理.背景知识(选填项目):无。
原理(选填项目):无主体内容(操作步骤,必填项目):1 内容1.1 标准溶液的配制1.1。
化学试剂标准溶液标定记录表

试验室名称:第 页 共 页
标准溶液名称
配制依据
配制日期
标定依据
标定日期
用途
配制体积
标准溶液配制过程
标准溶液标定过程
标准溶液的标定
1#标定员
2#标定员
1#
2#
3#
4#
5#
6#
7#
8#
V0(mL)
V0(mL)
V1(mL)
V1(mБайду номын сангаас)
△V(mL)
△V(mL)
空白标定
1#标定员
2#标定员
1#
2#
3#
4#
5#
6#
7#
8#
V0(mL)
V0(mL)
V1(mL)
V1(mL)
△V(mL)
△V(mL)
标定计算公式:
标定溶液浓度
(mol/L)
1#
2#
3#
4#
5#
6#
7#
8#
八次平均标准溶液浓度(mol/L)
最终标准溶液浓度(mol/L)
备注:取两人八次平行测定结果的平均值为测定结果,在计算过程中保留五位有效数字, 浓度值最终结果取四位有效数字。
氢氧化钠标准滴定溶液原始记录

计算公式
A
B
1
2
3
4
1
2
3
C ( NaOH
)
(V1-V2
)(1
m 1000 + V0 /1000) ×204.22
C(NaOH)——氢氧化钠标准溶液的浓度,mol/L; m——邻苯二甲酸氢钾质量,g; 204.22——邻苯二甲酸氢钾的摩尔质量[M(KHC8H4O4)=204.22],g/mol。
标定 mol/L氢氧化钠(NaOH)标准滴定溶液原始记录
标定日期 方法依据
粗溶液配制
氢氧化钠溶液的配制
氢氧化钠 重量ml
无二氧化碳 的水体积ml
配制日期
环境温度
温度体积补正值V0
氢氧化钠滴定溶液的配制
氢氧化钠 体积ml
无二氧化碳 的水体积ml
配制日期
试验次数 (2人比对 每人4平行)
邻苯二甲酸氢钾质量 m(g)
≤0.18%(CrR95(8)×100/C)
CB=
修约值(mol/L)
实测误差 (每人4平行) (Cmax-Cmin)100/Ci
△CA △CB
实测误差 (两人8平行) (Cmax-Cmin)100/C
标定人(A1—4):
对标人(B1—4):
4
CB4
0.15 0.15 0.18
氢氧化钠标准溶液
CA1
CA2
CA3
CA4ol/L)
平均值(mol/L)
CA=
氢氧化钠标准溶液 的浓度(mol/L) C=(CA+CB)/2
允许误差 (每人4平行) (Cmax-Cmin)100/Ci
标准溶液配制标定记录

溶液名称:
最终浓度:
配制时间:
配制方法:
标定方法:
配制人:
有效期限:
基准物质名称:
称取样重W= W1-W2g
滴定消耗标准溶液体积mL
滴定管校正值mL
校正为20℃时滴定消耗标准溶液体积mL
溶液浓度Cmol/L
溶液平均浓度Cmol/L
标定人:
复核记录
平行样序号
1
2
3
4
相对极差
第一次称量W1g
第二次称量W2g
称取样重W= W1-W2g
滴定消耗标准溶液体积mL
滴定管校正值mL
校正为20℃时滴定消耗标准溶液体积mL
基准物质批号:
加热仪器名称:
加热后基准物质量:g
滴定管检定编号:
仪器型号:
恒重基准物质量:g
温度计检定编号:
仪器编号:
计量仪器名称:
标准溶液温度:℃
仪器温度设定:℃
仪器型号:
温度补正值:
空白消耗标准溶液体积:mL
仪器编号:
标定时环境温度:℃
标定记录
平行样序号
1
2
3
4
相对极差
第一次称量W1g
第二次称量W2g
溶液浓度Cmol/L
溶液平均浓度Cmol/L
复核人:
备注:
edta标准溶液的配制和标定数据记录

edta标准溶液的配制和标定数据记录 EDTA(乙二胺四乙酸)是一种常用的配位试剂,广泛应用于化学分析和环境监测等领域。
为了准确测定目标物质的含量,必须配制和标定EDTA标准溶液。
本文将详细描述EDTA标准溶液的配制过程和标定数据记录方法,以期为读者提供准确、可靠的实验结果。
一、EDTA标准溶液的配制1. 根据实验需求确定所需浓度和体积。
2. 准备清洁、干燥的容器,精确称量所需质量的EDTA固体。
注:应使用分析纯的EDTA以确保溶液的纯度和精确度。
3. 将EDTA固体加入容器中,加入适量的去离子水溶解,定容至所需体积。
注:在溶解过程中应充分搅拌,确保EDTA充分溶解并均匀分布。
二、EDTA标准溶液的标定1. 标定前的准备工作:a. 清洁、干燥容器,准备所需量的标定溶液。
b. 根据实验需求,选择相应的指示剂和溶剂。
c. 准备一定浓度的化学指示剂溶液(例如:钙碳酸盐指示剂等)。
d. 准备一定浓度的酸溶液(例如:0.1 mol/L盐酸溶液)用于调节溶液的pH值。
e. 清洁、干燥滴定管和滴定管架。
2. 标定过程: a. 取一定体积的待测样品(例如:10 mL)加入滴定瓶中。
b. 加入适量的酸溶液调节待测样品的pH值。
确保待测样品中没有其他影响滴定反应的离子。
c. 加入一定体积的化学指示剂溶液,使其与待测样品反应产生可观察的颜色变化。
d. 使用滴定管分次向待测样品中滴定EDTA标准溶液,直至颜色变化,记录滴定所用的EDTA标准溶液的体积(V1)。
e. 等颜色变化稳定后,再缓慢滴定,直到颜色消失,记录滴定所需的EDTA标准溶液的体积(V2)。
f. 重复上述滴定步骤2-3次,计算平均用量,提高测量结果的准确性。
三、标定数据记录 1. 记录待测样品用量、酸溶液浓度、化学指示剂体积以及EDTA 标准溶液滴定数据。
例如:待测样品用量:10 mL,酸溶液浓度:0.1 mol/L,化学指示剂体积:2 mL,EDTA标准溶液滴定体积:V1 = 8.5 mL,V2 = 12.3 mL。
标准溶液配制与标定记录

实验员甲 平行试验编号 1 称量瓶+基准物质质量(前),g 称量瓶+准物质质量(后),g 基准物质质量,m /g 滴定管初度数,mL 滴定管终度数,mL 消耗滴定溶液体积,mL 温度(20℃)校正后滴定液体积, V /mL 空白试验消耗滴定液体积,V 0 /mL 基准物质的摩尔质量,M /(g/mol) 标准溶液浓度,C /(mol/L) 2 3 4 1 2
标准溶液配制与标定记录
编号:
标准溶液名称 配置日期 试剂名称 试剂质量
第 页溶剂名称
共 页配置体积
标定 拟标定溶液浓度或原标 定溶液浓度 基准物质名称 基准物质干燥条件 主要仪器 规格型号 标定日期或 原标定日期 基准物质纯 度 环境条件 精度 标定依据 指示剂 温度: ℃, 湿度: %RH
仪器编号
实验员乙 3 4
C
m 1000 (V V0 )M
四平行浓度的平均值,mol/L 四平行=
X max X min 100 X X max X min 100 X
,%
八平行浓度的平均值,mol/L 八平行= ,%
标准溶液浓度,C /(mol/L) 备注:四平行测定结果极差的相对值不得大于0.15%;八平行测定结果极差的相对值不得大于0.18% 校核: 年 月 日 复核: 标定:
高锰酸钾标准滴定溶液
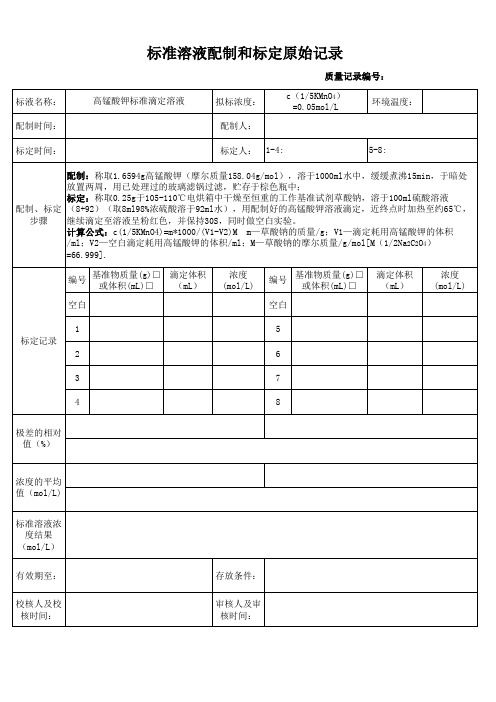
浓度的平均 值(mol/L) 标准溶液浓 度结果 (mol/L) 有效期至: 校核人及校 核时间: 存放条件: 审核人及审 核时间:标准溶液配制和标定原始记录
质量记录编号: 标液名称: 配制时间: 标定时间: 高锰酸钾标准滴定溶液 拟标浓度: 配制人: 标定人: 1-4: 5-8: c(1/5KMnO4) =0.05mol/L 环境温度:
配制:称取1.6594g高锰酸钾(摩尔质量158.04g/mol),溶于1000ml水中,缓缓煮沸15min,于暗处 放置两周,用已处理过的玻璃滤锅过滤,贮存于棕色瓶中; 标定:称取0.25g于105-110℃电烘箱中干燥至恒重的工作基准试剂草酸钠,溶于100ml硫酸溶液 配制、标定 (8+92)(取8ml98%浓硫酸溶于92ml水),用配制好的高锰酸钾溶液滴定,近终点时加热至约65℃, 步骤 继续滴定至溶液呈粉红色,并保持30S,同时做空白实验。 计算公式:c(1/5KMnO4)=m*1000/(V1-V2)M m—草酸钠的质量/g;V1—滴定耗用高锰酸钾的体积 /ml;V2—空白滴定耗用高锰酸钾的体积/ml;M—草酸钠的摩尔质量/g/mol[M(1/2Na2C2O4) =66.999]. 编号 空白 1 标定记录 2 3 4 极差的相对 值(%) 6 7 8 基准物质量(g)□ 滴定体积 或体积(mL)□ (mL) 浓度 (mol/L) 编号 空白 5 基准物质量(g)□ 或体积(mL)□ 滴定体积 (mL) 浓度 (mol/L)
标准溶液配制与标定原始记录(氢氧化钠)

邯郸市丛台区安东食品加工厂
宇文皓月
尺度溶液配制与标定原始记录
尺度溶液的配制
尺度溶液名称预配浓度配制方法配制日期氢氧化钠尺度溶液0.1 mol/L GB/T601-2002 年月日
尺度溶液的标定
基准物名称温度℃湿度%所用仪器及试剂
邻苯二甲酸氢钾(99.9%) 1 酚酞指示剂
2 无二氧化碳水
3 烘箱
标定标定日期:年月日
序号基准物质的质
量m ; (g)
消耗尺度溶液的
体积V1 ; (ml)
空白消耗尺度溶液
的体积 V0 ;(ml)
计算结果
mol/L
平均结果
mol/L
1
2
3
4
复标复标日期:年月日1
2
3
4
计算公式: m×1000
C (NaOH) = -------------
(V
1
-V0)×M 注: M=204.22 g/mol
配制人:标定人:复标人:。
标准溶液标定原始记录
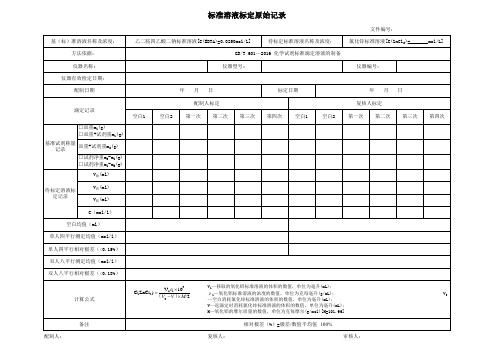
相对极差(%)=极差/数值平均值×100%
mol/L] 第四次
V3
配制人:
复核人: 第 页;共 页
审核人:
V始(ml)
待标定溶液标 定记录
V终(ml) V耗(ml)
C(mol/l)
空白1
空白均值(ml)
单人四平行测定均值(mol/l)
单人四平行相对极差(<0.15%)
双人八平行测定均值(mol/l)
双人八平行相对极差(<0.18%)
标准溶液标定原始记录
文件编号:
邻苯二甲酸氢钾
待标定标准溶液名称及浓度
氢氧化钠标准溶液[C(NaOH)=
标准溶液标定原始记录
文件编号:
基(标)准溶液名称及浓度: 方法依据:
乙二胺四乙酸二钠标准溶液[C(EDTA)=0.0250mol/L]
待标定标准溶液名称及浓度:
氯化锌标准溶液[C(ZnCl2)=
GB/T 601—2016 化学试剂标准滴定溶液的制备
仪器名称:
仪器型号:
仪器编号:
仪器有效检定日期:
配制日期
GB/T 601—2016 化学试剂标准滴定溶液的制备
仪器型号:
仪器编号:
mol/L]
年月日 配制人标定
空白2 第一次 第二次
第三次
标定日期 第四次 空白1
空白2
年月日 复核人标定 第一次 第二次 第三次
第四次
计算公式
C(NaOH) (Vm1 V120)00M
m—邻苯二甲酸氢钾质量,单位为克(g); V1—氢氧化钠溶液体积,单位为毫升(mL); V2—空白试验消耗氢氧化钠溶液体积,单位为毫升( mL); M—邻苯二甲酸氢钾的摩尔质量,单位为克每摩尔(g/mol)[M(KHC8H4O4)=204.22]
