人教版高中化学必修二第三章第二节《乙烯》课件[2020年最新]
人教版高中化学必修二课件第三章第二节第1课时乙烯(共52张PPT)

【互动探究】 (1)据乙烯的结构推测CH2=CH—CH=CH2分子中所有原子共平 面吗? 提示:每个“CH2=CH—C”单元是共平面的,而碳碳单键可以旋 转,故两个平面可能共平面。 (2)D项分子与CH2=CBr2的分子式都是C2H2Br2,二者是同一种物 质吗?若不是,二者是什么关系? 提示:CHBr=CHBr与CH2=CBr2不是同一种物质,二者互为同分 异构体。
二、乙烯的氧化反应和加成反应 1.氧化反应: (1)燃烧:化学方程式:C2H4+3O22C点O燃2+2H2O ①现象及应用:乙烯燃烧时火焰明亮且伴有黑烟,据此可鉴别乙 烯与甲烷。 ②反应特点: a.当温度高于100℃时H2O为气态,乙烯燃烧前后的混合气体体 积相等。 b.乙烯完全燃烧生成的CO2和H2O的物质的量之比为1∶1。
【变式备选】与乙烯所含碳、氢元素的百分含量相同,但与乙 烯既不是同系物又不是同分异构体的是( )
A.
B.乙烷
C.甲烷
D.CH3CH=CH2
【解析】选A。A、D的分子式均为C3H6,碳、氢元素的百分含量
与乙烯相同,但CH3—CH=CH2与乙烯属于同系物,故选A。
类型二乙烯的性质 【典例】下列说法中错误的是( ) A.乙烯与Br2的加成,乙烯使酸性KMnO4溶液褪色,都与分子内含 有碳碳双键有关 B.用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙 烷 C.相同物质的量的乙烯和甲烷完全燃烧消耗的氧气的量相同 D.利用燃烧的方法可以鉴别乙烯和甲烷
产物 至少为两种产物,产物复 只有有机产物,产物相对较
特点 杂,为混合物
纯净
【学而后思】 (1)能否利用氢气除去乙烷中混有的乙烯杂质? 提示:不能。虽然乙烯能与氢气反应生成乙烷,但易引入新的杂 质氢气,反应物的用量不易控制。 (2)乙烯分别通入溴水和溴的四氯化碳中,现象相同吗? 提示:不完全相同,溶液都褪色,但是前者溶液分层,下层是油状 液体,而后者溶液不分层。
人教版高中化学必修二3.2 乙烯课件

nCH2=CH2 催化剂 ─[ CH2 ─ CH2]─ n
乙烯
聚乙烯
说明:1、聚乙烯无固定熔沸点。 2、聚乙烯等白色塑料废弃物,微生物 不能降解,是白色污染物。
由不饱和的相对分子质量小的化合物分子结合成 相对分子质量大的化合物的分子,这样的反应是加成 反应同时又是聚合反应,简称加聚反应。
四、乙烯的用途
方法二:由乙烯制备氯乙烷
方程式: CH2=CH2+HCl→ CH3CH2Cl 反应类型: 加成反应
哪种方法好?为什么?
3、
CH2 = CH2 + H2 一定条件 CH3CH3
乙烷
CH2 = CH2 + Cl2
CH2ClCH2Cl 1,2-二氯乙烷
CH2=CH2 + HCl 一定条件 CH3CH2Cl 氯乙烷
CH2=CH2 + Br ─Br
CH2 ─ CH2 Br Br
Br Br 1,2-二溴乙烷
加成反应:有机物分子里不饱和的碳原子跟其它 原子或原子团直接结合生成别的物质的反应。
规律:乙烯分子中的碳碳双键断开一个, 2个Br分别 直接与2个价键不饱和的C结合
乙烯分子之间可否发生加成反应呢?
3、 加聚反应
CH2=CH2 + Br ─Br 加成反应:__________________________________________ 3、 加聚反应
nCH2=CH2
_____________________________
加聚反应:由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的化合物的分子,这样
乙烯是最简单的烯烃
什么叫烯烃?
(一)烯烃定义:含有碳碳双键的烃
CC
(二)、乙烯
高中化学(新人教版)必修第二册:乙烯【精品课件】

【课堂练习】
2. 下列说法错误的是(C)
A.无论是乙烯与Br2的加成反应,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有 的碳碳双键有关 B.溴的四氯化碳溶液和酸性KMnO4溶液都可以鉴别乙烯和甲烷 C.相同质量的乙烯和甲烷完全燃烧后生成水的质量相同 D.乙烯的化学性质比乙烷的化学性质活泼
【课堂练习】
乙烯
学习目标 1、会写乙烯的分子式、结构式、结构简式、电子式。 2、知道乙烯能够发生氧化反应、加成反应、聚合反应。 3、理解加成反应的概念。
核心素养 1、微观探析:认识乙烯的组成、结构、性质和变化,形成“结构决定性质”的观念 2、证据推理:通过分析、推理认识乙烯发生加成反应时的断键和成键情况。
目录
二、乙烯的化学性质
1.氧化反应
(1)燃烧
点燃
CH2=CH2 + 3O2
2CO2 + 2H2O
现象:火分数较高,燃烧时碳并没有 完全被氧化,而本身被烧成炽热状态,故火焰明亮;又 由于一部分碳呈现游离态,所以有黑烟冒出。可以据此 检验乙烯和甲烷。
二、乙烯的化学性质
3.长途运输水果时,常常将浸泡有高锰酸钾溶液的硅土放置在盛放水果的容
器中,其目的是(C )
A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变 B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂 C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟 D.利用高锰酸钾溶液的氧化性,催熟水果
【课堂练习】
碳碳单键 C、H不全在一个平面内
2C2H6+7O2 ―点――燃→ 4CO2+6H2O C2H6+Cl2 ―光 ―→ C2H5Cl+HCl
不反应
碳碳双键 6个原子都在同一平面内
C2H4+3O2 ―点――燃→2CO2+2H2O CH2==CH2+Br2―→CH2BrCH2Br 因发生氧化反应而使其褪色
人教版高中化学必修二课件:3.2 乙烯(共28张PPT)

5、除去乙烷中混有的少量乙烯的方法,正确的 是( B ) A.通入氯气后进行光照 B.通入溴水 C.通入澄清的石灰水 D.点燃
6、1mol C2H4与Cl2完全加成,再与Cl2彻底取代, 两过程共用Cl2( ) C A.2 mol C.5mol B.4mol D.6mol
6.哪个有机物中碳原子都在同一平面内? A.CH3-CH=C-CH3 CH3
阅读课本 P 66 思考与交流有关内容
石油分馏中得到的石蜡油进一步加热会得 到什么?
科学探究
阅读课本P67
石蜡油分解实验
石蜡油的分解实验
① 石蜡油:17个C以 上的烷烃混合物 酸性:增强氧
化性。 ②碎瓷片:催化剂
③加热位置:碎瓷片 ④将生成气体通人酸性 高锰酸钾溶液中。
褪色,为什么? ⑤生成的气体通入溴的四氯化碳溶液褪色,为什么?
思考:该烯烃的双键在哪两个碳原子之间 只能是③④之间
1.工业上的乙烯主要来源于 石油化工 ,它是一 难 溶于水。 种 无 色、 稍有气味 味的气体,____ 实验室制取乙烯时用 排水 法收集。 2 .下列物质不可能是乙烯加成产物的是 (B ) A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
H2O 聚合
CH3—CH2Cl
CH3—CH2OH
[ CH2—CH2]n
?你能想出几种方法鉴别C H 和CH
2 4
4
1.分别点燃两种气体,燃烧时有黑烟的是乙烯 2.分别通入酸性高锰酸钾溶液中,能使溶液 褪色的是乙烯 3.分别通入溴水中,能使溴水褪色的是乙烯
知识小结(重点掌握)
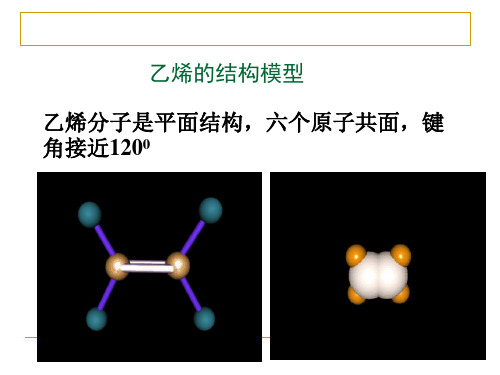
一、乙烯的结构(平面型分子)
[ CH2—CH2 ]n
聚合反应:
nCH2=CH2
2020人教版高中化学必修二3.2.1《乙烯》ppt课件

第三章有机化合物课前预习—、烯桂1.概念:分子中含有一个的链桂,如乙烯二、乙烯1.烯桂的工业制取原理的实验2.乙烯的结构乙烯的分子结构①分子式:________②电子式:________③结构式:________ (结构简式:_______④模型图:比例模型球棍模型⑤分子结构特点:a.乙烯是— _______ 。
b.碳原子间以_________ _______ o c.碳氢键夹角_________ <_____ 结构,所有原子处于—结合,其中有一个键3•乙烯的物理性质通常状况下,乙烯是颜色、________ 气味的气体。
在标准状况下密度为1-25 g/L,比空气___________ , ________ 于水, 于四氯化碳等有机溶剂。
4.乙烯的化学性质与分子中只含碳碳单键的烷坯相比,碳碳双键的存在使乙烯与酸性高猛酸钾溶液、漠的四氯化碳溶液均能发生化学反应, 表现出较活泼的化学性质。
(1)乙烯的氧化反应:①乙烯的燃烧:乙烯在空气或氧气中燃烧,火焰 _________ 同时放出大量的热。
化学方程式为:注意:a.乙烯是可燃性气体,所以点燃乙烯前要验纯。
b.乙烯燃烧时火焰明亮,但与甲烷燃烧时相比有更大的黑烟,这是因为乙烯的含碳量比较大,未完全燃烧,产生碳的小颗粒而造成的。
②乙烯能被酸性高猛酸钾溶液氧化,而使酸性高猛酸钾溶液的 _______ 褪去。
注意:a•利用该性质可区别CH4(烷灼和。
2比(烯桂)。
b.乙烯被酸性高猛酸钾氧化的产物是CO2,因此CH4中混有C2H4(2)乙烯的加成反应:①加成反应: ______________________________________ __________________________________ 的反应叫做加成反应0②乙烯能使漠的四氯化碳溶液的红棕色褪去,也能使漠水的橙色褪去,生成无色的 _______ O化学方程式为:___________注意:a.证明乙烯与Br2发生的反应是加成反应而不是取代反应的方法是滴加AgNO3溶液或测溶液的pH o b.利用乙烯能使漠水褪色而甲烷(烷炷)不能使漠水褪色,既可以区别乙烯和甲烷(烷桂),也可以除去甲烷(烷桂)中混有的乙烯气体,以提纯甲烷(烷桂)。
人教版高中化学必修2-乙烯(共33张PPT)

Br Br CH2CH2 1,2-二溴乙烷
——可用于鉴别或除杂。 Br Br (CH2BrCH2Br) 无色油状液体, 密度比水大,
不溶于水,易溶于CCl4 。
迁移应用
试写出乙烯与H2 、HCl 、H2O发生加成反应 的化学方程式。
催化剂
CH2=CH2 + H-H △
CH3-CH3 乙烷
催化剂
CH2=CH2 + H-Cl
石油裂解气: 主要成分是乙烯, 还含有丙烯、异丁 烯、甲烷、乙烷、 异丁烷、硫化氢和 碳的氧化物等。
一、乙烯的分子结构
分子式
C2H4
球棍模型
电子式
结构式 结构简式 CH2= CH2
CH2CH2
比例模型
空间构型: 平面型分子 6个原子共平面
( 键角约120° )
六个原子共面
约120°
约120°
约120°
研究表明,石蜡油分解的产物 主要是烯烃和烷烃的混合物
资料卡片 石油的裂化、裂解
催化剂
CC168HH3146
△
催化剂
C8CH81H8 16
△
C4H10 C4H10
催化剂
△
催化剂
△
CC8H4H1810++CC8H4H168 辛烷 辛烯
C4H10 + C4H8 丁烷 丁烯
C2H4 + C2H6 乙烯 乙烷 CH4 + C3H6 甲烷 丙烯
• 8、普通的教师告诉学生做什么,称职的教师向学生解释怎么做,出色的教师示范给学生,最优秀的教师激励学生。上午10时55分 53秒上午10时55分10:55:5324.3.4
实验 通入酸性高锰酸钾溶液中
人教版-必修二-化学乙烯课件ppt
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
注意问题:
(1)浓硫酸:浓硫酸与乙醇的体积比为3:1 (2)对反应温度的要求:170℃以下及170 ℃以上不能 有效脱水,故必须迅速将温度升致170℃并保持恒温。 140 ℃时分子间脱水生成乙醚和水 170℃以上浓硫酸使乙醇脱水炭化
现象、 用途
CH2=CH2 +H-Cl →CH3CH2Cl
CH2=CH2
+
H-OH
催化剂 加热、加压
CH3CH2OH
加成反应:
有机物分子中双键或叁键两端的碳原子与其他原 子或原子团直接结合生成新的化合物的反应。
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
△
C2H5OH+2H2SO4(浓)==2C+2SO2↑+5H2O
△
C2H5OH+4H2SO4(浓)==2CO↑+4SO2↑+7H2O
△
C2H5OH+6H2SO4(浓)==2CO2↑+6SO2↑+9H2O
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
4、烯烃的命名
(1)在分子中含有多个双键时,选择满 足有尽可能多的双键的最长的碳链的为主 链,并命名为某烯; (2)从最靠近双键的这一端开始编号; (3)其它命名同烷烃。
高中化学人教版必修二第三章第二节:乙烯 课件 (共18页)

1 、乙烯的分子式、结构式、电子式。 提出问题:乙烯从哪里来,从石油 与甲烷反应的现象相同吗?为什么? 乙烯的这种结构决定乙烯有什么样的性质呢? 中能制得乙烯吗? 2、乙烯分子是什么样的结构?有什么样的化学键?
教学设计
情境 引入 学案 导学 互动 交流 点拨 释疑 小结 评价 达标 训练
乙烯 用途
蛋白质
糖类
油脂
学情分析
本节 知识 问题 困难
生活 经验 学生 特点
已有 能力
已有 知识
学习 兴趣
学习目标
知识与 技能 过程与 方法 情感态 度与价 值观
课 标 要 求
学习重难点
学科模式
我校采用“三五五”教学模式
三种课型:基础课、应用课、巩固课 五个环节:学案导学、互动交流、点拨释疑、 小结评价、达标训练 五个突出:突出学生主体、突出面向全体、 突出合作探究、突出过程与方法、 突出思维训练
课程资源
石蜡油加热分解的视频 乙烯的碳碳双键3D动画 乙烯与溴加成反应视频 乙烯与酸性高锰酸钾溶液反应视频 乙烯与溴加成反应3D微观动画 乙烯发生加聚反应微观Flash动画 各种相关图片Fra bibliotek五个环节
学案导学 互动交流 点拨释疑 小结评价 当堂训练
教师提出要求,学生依据学案完成问题导学。
五个环节
学案导学 互动交流 点拨释疑 小结评价 当堂训练
展示交流学习结果
五个环节
学案导学 互动交流 点拨释疑 小结评价 当堂训练
教师针对学生问题点拨释疑
2020人教版化学必修2 第3章 第2节 第1课时 乙烯

第二节⎪⎪来自石油和煤的两种基本化工原料第一课时 乙 烯—————————————————————————————————————— [课标要求]1.了解烯烃的概念。
2.了解乙烯的物理性质、工业制取原理和在化工生产中的作用。
3.掌握乙烯的分子结构,初步体会其结构特点对性质的影响。
4.掌握乙烯的化学性质,认识加成反应的特点。
1.乙烯的结构简式为CH 2===CH 2,分子中所有原子处于同一平面上。
2.烯烃的分子通式为C n H 2n (n≥2),乙烯能使溴水和酸性KMnO 4溶液褪色,两者反应原理不同,前者属于加成反应,后者属于氧化反应。
3.加成反应是指有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
4.必记“四反应”:(1)CH 2===CH 2+Br 2―→CH 2BrCH 2Br (2)CH 2===CH 2+H 2――→催化剂△CH 3CH 3 (3)CH 2===CH 2+HCl ――→催化剂CH 3CH 2Cl (4)CH 2===CH 2+H 2O ――→催化剂加热、加压CH 3CH 2OH烯烃 乙烯的工业制取原理1.烯烃(1)概念:分子中含有一个碳碳双键的链烃,属于不饱和烃。
乙烯是最简单的烯烃。
(2)分子通式:C n H 2n (n≥2)。
2.乙烯的工业制取原理如下图所示,将浸透了石蜡油(液态烷烃混合物)的石棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面发生反应,生成一定量的气体。
[特别提醒](1)试管中碎瓷片的作用是催化剂。
(2)酸性高锰酸钾溶液和溴的四氯化碳溶液的用量不宜太多,浓度不宜太大,否则溶液颜色变化不明显。
1.烷烃(如甲烷)能使溴水和酸性高锰酸钾溶液褪色吗?提示:不能。
2.在石蜡油分解实验中,哪些现象证明生成物可能具有不同于烷烃的性质?提示:生成物能与酸性KMnO4溶液和溴的四氯化碳溶液反应而使之褪色,这一点与烷烃的性质不同。
人教版高中化学必修二课件:第3章 第2节 第1课时乙烯 (共29张PPT)

-18-
第1课时 乙烯
探究一
探究二
首页
课前篇 自主预习
课课堂堂篇篇 探探究究学学习习
随堂演练
解析除杂时要注意不能引入新杂质。此题为气体除杂,应用洗气 装置,通过反应除掉杂质气体。A选项,两种气体都不能与水反应且 无明显现象,不正确;B选项,乙烷不与溴水反应,乙烯与溴水发生加 成反应,使溴水褪色,所以可以鉴别出来,并且通过洗气瓶时乙烯留 在溶液里生成CH2BrCH2Br,正确;C选项,乙烷不与H2反应,乙烯与H2 可在催化剂Ni的作用下反应生成乙烷,并不是简单的混合就可以反 应,而且会引入H2杂质气体,不正确;D中,乙烷不与酸性高锰酸钾溶 液反应,乙烯能使酸性高锰酸钾溶液褪色,所以可以用来鉴别乙烷 和乙烯,但乙烯被酸性高锰酸钾溶液氧化时有CO2生成,会引入新的 杂质,不正确。
随堂演练
-4-
第1课时 乙烯
知识铺垫
新知预习
自主预测
二、乙烯的性质和用途 1.乙烯的物理性质 颜色 状态 气味 无色 气体 稍有气味
2.乙烯的化学性质 (1)氧化探究学习
随堂演练
水溶性 难溶于水
密度 比空气略小
-5-
第1课时 乙烯
首页
课前篇 自主预习
课堂篇 探究学习
-11-
第1课时 乙烯
探究一
探究二
首页
课前篇 自主预习
课课堂堂篇篇 探探究究学学习习
随堂演练
乙烯的结构和性质
问题探究
1.乙烯的空间构型是什么?其键角为多少?
答案平面结构;键角为120°。
2.
分子中所有原子共平面吗?
答案乙烯中的一个氢原子被氯原子取代,所有原子共平面。
3.能用溴的CCl4溶液除去乙烷中的乙烯吗? 答案不能。因为乙烷能溶于CCl4中。
高级中学高中化学必修二人教版:3.2 乙烯 课件

⑵CH4中混有C2H4, 欲除去C2H4得到CH4, 最好依
C 次通过哪一组试剂 (
)
A. 澄清石灰水、浓硫酸
B. KMnO4酸性溶液、浓硫酸 C. Br2水、浓硫酸 D. 浓硫酸、KMnO4酸性溶液
AB ⑶能用于鉴别甲烷和乙烯的试剂是 (
)
A.溴水
B.酸性高锰酸钾溶液
C.苛性钠溶 D.四氯化碳溶液
⑴ 氧化反应
①燃烧 ——火焰明亮,少量黒烟 CH2=CH2 + 3O2 点燃 2CO2 + 2H2O
②被KMnO4氧化 将乙烯通入酸性KMnO4溶液中: 现象: 紫红色褪去
KMnO4 + H2SO4+ C2H4 → MnSO4 + K2SO4 + CO2 + H2O
⑵ 加成反应
将乙烯通入溴水,溶液褪色。
1、来源、地位、制法
● 来源——石油及石油产品的分解 ● 国家石油化工的水平——乙烯的年产量 ● 制法——
2、物理性质
无色、稍有气味的气体, 难溶于水,比空气轻。
•1、所有高尚教育的课程表里都不能没有各种形式的跳舞:用脚跳舞,用思想跳舞,用言语跳舞,不用说,还需用笔跳舞。 •2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 •3、教育始于母亲膝下,孩童耳听一言一语,均影响其性格的形成。 •4、好的教师是让学生发现真理,而不只是传授知识。 •5、数学教学要“淡化形式,注重实质.
HH
HH
H · C × C H + Br··Br
HH
H
·BC·r
·C ×
Br
H
H · C × C H + BB·rr··BB·rr
⑵ 加成反应
