同位素(6页41题)
同位素习题

1.下列各组物质中,互为同位素的是()A重氢、超重氢 B 氧、臭氧 C 红磷、白磷 D 乙酸、丙酸2.下列各组粒子中,互为同位素的是()A O2和O3B SO2和SO3C12C和13C D D2O和T2O3.甲乙两种微粒都只含有一个原子核,且核内具有相同数目的质子,这两种微粒定是()A 同种原子B同种元素C 互为同位素D 具有相同的核外电子排布4.13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,发明人为此获得2002年诺贝尔化学奖。
下面有关13C、15N叙述正确的是()A 13C与15N有相同的中子数B 13C与C60互为同素异形体C15N与14N互为同位素 D 15N的核外电子数与中子数相同5.最近,医学家们通过用放射性14C原子标记的C60示踪发现,C60的一种羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS)病毒。
其中,关于放射性14C 的叙述中正确的是()A 与C60中普通碳原子的化学性质不同 B 与14N中所含中子数相同C 与C60互为同素异形体D与12C互为同位素6.14C是宇宙射线与大气中的氮通过核反应产生的,它和12C以一定比例混合存在于空气中的二氧化碳里。
14C随生物体的吸收代谢,经过食物链进入活的生物体中。
当生物死亡之后新陈代谢停止,在以后年代里,12C通常不再发生变化,其数量固定下来,而14C具有放射性,仍不断衰变减少。
与其有关的说法中不正确的是()A 14C与12C互为同位素B 等物质的量的14C与12C所含的中子数不同C 0.012kg的14C中含有NA 个碳原子数(NA表示阿伏加德罗常数)D 可根据14C在生物体内的含量来计算生物体的死亡年代7.某金属元素的一种同位素R的质量数为52,已知R离子含有28个中子、21个电子、由这种离子组成的化合物的化学式正确的是( )A .RCl2B. R(OH)3C.RO28.非金属元素R其质量数为127,又知R离子含有74个中子,54个电子,则该元素最高化合价组成的化合物是( )A.R(OH)3B.R2O7C.HRO3D.H2R9.溴有两种同位素,原子个数比约为1:1,已知溴的近似原子量为80,这两种同位素的中子数分别为( )A.44和 45 B.45和 46 C.44和 46 D.79和8110.原子序数为47的银元素有两种同位素,它们的原子百分比近似相等。
同位素

同位素一、单选题1.16O和18O是氧元素的两种核素,N A表示阿伏加德罗常数,下列说法正确的是()A.16O2与18O2互为同分异构体B.16O与18O核外电子排布方式不同C.通过化学变化可以实现16O与18O间的相互转化D.标准状况下,1.12 L16O2和1.12 L18O2均含有0.1N A个氧原子2.金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。
下列有关Ti和Ti的说法中正确的是()A.Ti和Ti的质量数相同,互称为同位素B.Ti和Ti的质子数相同,互称同位素C.Ti和Ti的质子数相同,是同一种核素D.Ti和Ti核外电子数相同,中子数不同,不能互称为同位素3.下列关于35Cl的说法正确的是()A.35Cl2与37Cl2互为同位素B.和互为同分异构体C.与37Cl的得电子能力相同D.35Cl-和与它核外电子排布相同的微粒化学性质相同4.2010年4月7日,俄罗斯科学家宣布在实验中获得了Un和Un两种新原子。
下列有关这两种原子的说法错误的是()A.质量数均超过质子数的两倍B.互称为同位素C.中子数分别为176、177D.是同一种核素5.下列有关化学用语表示正确的是()A.硫离子的结构意示图:B.某有机物的名称:2-乙基-2-丁烯C. CH4分子的比例模型:D.间硝基甲苯的结构简式:6.下列描述正确的是()A.硝酸的标签上应标注和B.硫离子结构示意图:C. HClO的电子式:D.239Pu比235U原子核内多4个中子答案解析1.【答案】D【解析】同种元素的不同单质是同素异形体,16O2与18O2是同一种物质,A错误;16O与18O是氧元素的不同核素,质子数相同、核外电子排布方式相同,B错误;16O与18O间的相互转化是原子间的转化,不能通过化学变化实现,C错误;16O2和18O2是双原子分子,物质的量相同,原子个数相同,D正确。
2.【答案】B【解析】A项二者质量数不同,C项中子数不同,属于不同核素,D项质子数相同,互称同位素。
同位素标记法专项练习
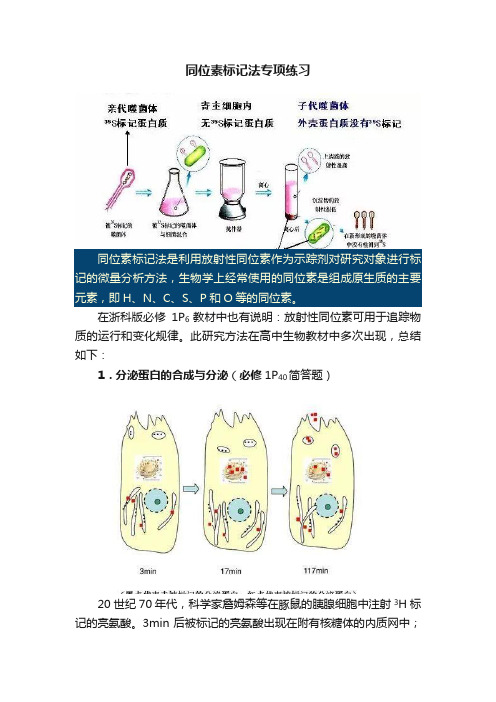
同位素标记法专项练习同位素标记法是利用放射性同位素作为示踪剂对研究对象进行标记的微量分析方法,生物学上经常使用的同位素是组成原生质的主要元素,即H、N、C、S、P和O等的同位素。
在浙科版必修1P6教材中也有说明:放射性同位素可用于追踪物质的运行和变化规律。
此研究方法在高中生物教材中多次出现,总结如下:1.分泌蛋白的合成与分泌(必修1P40简答题)20世纪70年代,科学家詹姆森等在豚鼠的胰腺细胞中注射3H标记的亮氨酸。
3min后被标记的亮氨酸出现在附有核糖体的内质网中;17min后,出现在高尔基体中;117min后,出现在靠近细胞膜内侧的囊泡中及释放到细胞外的分泌物中。
由此发现了分泌蛋白的合成与分泌途径:核糖体→内质网→高尔基体→囊泡→细胞膜→外排。
(2019·全国高一月考)下列关于分泌蛋白的合成与分泌,叙述错误的是()A.线粒体参与分泌蛋白的合成和运输B.高尔基体在该过程中起着重要的交通枢纽作用C.分泌蛋白从合成到分泌至细胞外共穿过5层生物膜D.科学家常用同位素标记法研究分泌蛋白的合成和分泌【答案】C【解析】分泌蛋白合成与分泌过程:核糖体合成蛋白质→内质网进行粗加工→内质网“出芽”形成囊泡→高尔基体进行再加工形成成熟的蛋白质→高尔基体“出芽”形成囊泡→细胞膜,整个过程还需要线粒体提供能量。
【详解】A、线粒体为分泌蛋白的合成和运输提供能量,A正确;B、高尔基体在该过程中起着重要的加工和运输作用,B正确;C、分泌蛋白在内质网上的核糖体中合成,核糖体无膜结构,进入内质网后以出芽的形式通过囊泡在内质网膜、高尔基体膜、细胞膜互相融合,此过程并没有穿过磷脂双分子层,所以此过程分泌蛋白通过了1层生物膜,C错误;D、科学家用同位素标记法研究分泌蛋白的合成和分泌,D正确。
【点睛】解答此题要求考生识记细胞中各种细胞器结构、分布和功能,掌握分泌蛋白的合成与分泌过程,能结合所学的知识准确判断各选项。
2.光合作用中氧气的来源1939年,鲁宾和卡门用18O分别标记H2O和CO2,然后进行两组对比实验:一组提供H2O和C18O2,另一组提供H218O和CO2。
完整版同位素

《医用同位素示踪学》复习题一、名词解释1.放射性核素:指可自发地发生核衰变并可发射一定类型和能谱的射线,由一种核衰变变成另一种核的核素2.放射性示踪(radioactive trace):利用放射性核素或其他标记物作为示踪剂,在生物体内或体外研究各种物质或现象的运动规律,利用辐射检测仪器进行定量或定位分析,追踪物质动态变化规律。
3.同位素(isotope):具有相同原子序数但质量不同的核素4.同质异能素(isomer):具有相同质量数和原子序数,处于不同核能态的一类核素,处于亚稳态或激发态的原子与其相应的基态原子互称为同质异能素5.放射性示踪剂(radioactive tracer):以具有放射性为其鉴别特性的示踪剂,它是化合物分子中,同一位置上的稳定的同位素的原子被同一元素的放射性同位素的原子所取代,在分子的性质结构上没有任何的变化。
6.α衰变:原子核放射α粒子的放射性衰变7.β衰变:原子核放射出β粒子或俘获轨道电子的放射性衰变8.γ衰变:原子核发射γ射线的衰变过程9.α、γ、β射线:空气射程:α<β<γ软组织中:α<β<γ体内电离密度:α>β>γ所以外照射对人体伤害:α<β<γ内照射对人体伤害:α>β>γ10.物理半衰期Tp:指放射性核素原子核数目衰变到原有的一半需要的时间生物半排期Tb:指进入体内的核素通过生物体自然排除一半所需的时间有效半减期Te:由于放射性衰变和生物排除共同作用,使体内核素原始放射性活度减少一半所需的时间关系:Te=Tb*Tp/(Tb+Tp)11.放射性活度:指放射性核素在单位时间内发生核衰变的原子数目(Bq,简称贝可)12.比活度:指单位质量的某种物质的放射性活度(Bq/mol及Bq/g)13.放射性活度:指某种物质单位体积的放射性活度(Bq/ml)14.吸收剂量:表征物质吸收射线能量的电离辐射量15.当量剂量:指电离辐射对组织或器官效应的一种度量。
某一组织或器官的吸收剂量的平均值,并按辐射的性质加权16.有效剂量:是人体所有组织与器官加权后的当量剂量之和17.辐射危险度:单位当量剂量辐射诱发随机性效应的发生几率18.Cpm:每分钟计数率19.恒量标记实验:在实验系统中加入相对过量的示踪物,实验过程中示踪物的实际消耗是极小部分,故示踪物浓度基本不变,分析结果时可不考虑示踪物浓度变化的影响20.脉冲标记实验:在实验过程中,只使被研究的系统与示踪物接触一个短时间,随即将示踪物出去,再继续观察,此类实验大多数是将示踪剂作为原料进行定位的标记物合成,以合成的物质作为示踪物而观察其运动转化规律21.均相测量:样品以真溶液的形式存在于闪烁夜中测量,是最理想的测量方式22.闪烁液:主要由溶剂,闪烁体以及某些添加剂组成,是射线能转化为光子的场所23.闪烁剂:闪烁液中的发光物质,能有效地接受溶剂分子中的能量,并发射出特征光谱的光子24.淬灭:指快速冷却,用来防止低温相变、提高金属硬度等,还可以用于制备金属玻璃。
同位素习题

同位素习题1.某金属元素的一种同位素R 的质量数为52,已知R 离子含有28个中子、21个电子、由这种离子组成的化合物的化学式正确的是( )A .RCl 2 B. R(OH)3 C.RO 2 D.K 2R 2O 72.非金属元素R 其质量数为127,又知R 离子含有74个中子,54个电子,则该元素最高化合价组成的化合物是( )A .R(OH)3B .R 2O 7C .HRO 3D .H 2R3.溴有两种同位素,原子个数比约为1:1,已知溴的近似原子量为80,这两种同位素的中子数分别为 ( )A .44和 45B .45和 46C .44和 46D .79和814.原子序数为47的银元素有两种同位素,它们的原子百分比近似相等。
已知银元素的近似原子量为108,则每种同位素原子里的中子数分别为( )A .110和106B .57和63C .53和73D .60和625..已知自然界氧的同位素有16O 、17O 、18O ,氢的同位素有H 、D ,从水分子的原子组成来看,自然界的水一共有()A 3种 B 6种 C 9种 D 12种 6.氢的三种同位素:H 、D 、T ,氯有两种同位素: 35Cl 、37Cl ;当组成氯化氢分子时,其分子量所得的数值有()A 5种B 6种C 7种D 8种7.已知氢元素有1H 、2H 、3H 三种同位素,氧元素也有16O 、18O 二种同位素。
它们之间形成化合物的种类有()A 30种B 18种C 21种D 33种8.某元素构成的双原子单质分子有3种,其分子量分别为158、160、162。
在天然单质中,此三种单质的物质的量之比为1︰1︰1,由此推断的以下结论中正确的是()A 此元素有三种同位素B 其中质量数为79的同位素原子占原子总数的1/2C 其中一种同位素的质量数为80D 此元素的单质的平均分子量为1609.氯气只有35Cl 、37Cl 两种稳定的同位素,他们在氯气中的原子个数之比为3:1则相对分子质量为70、72、74的氯气分子数之比为( )A 、5:2:1B 、5:2:2C 、9:3:1D 、9:3:210..氯元素构成的双原子分子有三种,其相对分子质量分别为70、72、74。
同位素__专题练习

同位素 专题练习1、有六种微粒分别就是4019X,4020Y,4018Z,4019Q +,4020K 2+,4020M,它们隶属元素的种类 ( )A.2种B.3种C.4 种D.5种2、4018Ar 、4019K 、4020Ca 三种原子, 它们具有相同的 ( )A.电子数B.中子数C.电子层数D.质量数3、下列各组物质中,互为同位素的就是 ( )A.O 2、、O 3 、O 4B.H 2、D 2、T 2C.H 2O 、D 2O 、 T 2OD.6329Cu 与6529Cu4、下列关于原子的几种描述中,不正确的就是 ( )A.18O 与19F 具有相同的中子数B.16O 与17O 具有相同的电子数C.12C 与13C 具有相同的质量数D.15N 与14N 具有相同的质子数5、分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素的原子核内的中子数就是 ( )A.12B.14C.16D.186、人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可作为今后核聚变的重要原料之一。
氦的这种同位素应表示为 ( )A.He 43B.He 32C.He 42D.He 337、(2004上海)据报道,月球上有大量3He 存在,以下关于3He 的说法正确的就是 ( )A.就是4He 的同素异形体B.比4He 多一个中子C.就是4He 的同位素D.比4He 少一个质子8、(1994上海)某微粒用R A Z n +表示,下列关于该微粒的叙述中正确的就是 ( ) A.所含质子数=A -n B.所含中子数=A -ZC.所含电子数=Z +nD.质子数=Z +A9、(1998上海)钛(Ti)金属常被称为未来钢铁。
钛元素的同位素Ti 4622、Ti 4722、Ti 4822、Ti 4922、Ti5022中,中子数不可能为 ( )A.30B.28C.26D.2410、(1999上海)据报道,上海某医院正在研究用放射性同位素碘12553I 治疗肿瘤。
初中地理同位素知识点总结

初中地理同位素知识点总结同位素是指具有相同原子序数但质量数不同的同一元素的不同种类。
地理上的同位素主要应用在石油、矿产、环境、气候等领域,通过同位素的测定可以探究地球演化、地质过程、自然界的功能等。
一、同位素的定义和基本知识1. 同位素的概念:同位素是指具有相同原子序数(即原子核中质子的数目相等)但质量数不同(即原子核中质子与中子的总数不同)的同一元素的不同种类。
例如,氢的同位素有氘(质量数为2)和氚(质量数为3)。
2. 同位素的命名:同位素的命名以元素符号后加上质量数来表示,如氧的三个同位素分别为氧-16、氧-17和氧-18。
3. 同位素的相对丰度:地球上不同同位素的相对丰度是可以测定的。
例如,自然界中碳元素主要存在于两种同位素形式,碳-12(约占98.9%)和碳-13(约占1.1%)。
4. 同位素的稳定性和放射性:同位素可分为稳定同位素和放射性同位素两类。
稳定同位素指在地球上存在时间极长,可以长期稳定存在的同位素,如氢-1、氧-16等;放射性同位素指存在于地球上时间较短,通过自发核变而释放掉额外粒子和能量的同位素,如铀-235、铀-238等。
二、同位素在地质研究中的应用1. 同位素年代学:同位素年代学是地质学中常用的一种年代测定方法。
通过测定岩石或化石中的同位素含量,可以推断它们的年代。
例如,锆石中含有稳定的铀同位素和放射性的铅同位素,测量二者的相对丰度可以确定锆石的年龄。
2. 同位素地球化学:同位素地球化学研究地球上各个部分同位素的分布、转化和迁移,探究地球演化过程中的地质作用和环境变化。
例如,通过测量大气中氡同位素的含量,可以研究大气对氡同位素的吸附和释放过程。
3. 同位素地貌学:同位素地貌学研究地貌形成机制、历史演变和现代地理过程,利用同位素测定土壤、矿物、水体等中的同位素含量。
例如,通过测量河流水体中氧同位素的含量,可以揭示水文循环的过程和特点。
三、同位素在环境科学中的应用1. 同位素示踪技术:同位素示踪技术是环境科学研究中常用的一种方法,通过标记特定同位素来追踪和分析物质在环境中的迁移、转化和作用过程。
同位素、同素异形体、同系物、同分异构体和同种物质的比较练习题

同位素、同素异形体、同系物、同分异构体和同种物质的比较同位素同素异形体同系物同分异构体定义质子数相同,中子数不同的原子(核素)由同一种元素组成的不同单质结构相似,分子组成相差一个或若干个CH2基团的物质分子式相同,结构不同的化合物对象原子单质有机化合物化合物(有机、无机)化学式元素符号表示不同元素符号表示相同,分子式可以不同不同相同结构电子层结构相同,原子核结构不同单质的组成或结构不同相似不同性质物理性质不同,化学性质相同物理性质不同,化学性质相同物理性质不同,化学性质相似物理性质不同,化学性质不一定相同举例、、或H、D、T O2和O3、金刚石和石墨、红磷和白磷注意:H2和D2不是甲烷和正戊烷甲烷和新戊烷正戊烷、异戊烷、新戊烷强化练习:1、有下列各组微粒或物物质A、O2和O3B、C和 CC、CH3CH2CH2CH3和 CH3CH2CH(CH3)CH3D、Cl—CH2—Cl和H—CCl2—H E、CH3CH2CH2CH3和CH3—CH(CH3)—CH3(1)组两种微粒互为同位素;(2)组两种物质互为同素异形体;(3)组两种物质属于同系物;(4)组两物质互为同分异构体;(5)组两物质是同一物质。
2、在热核反应中没有中子辐射,作为能源时不会污染环境。
月球上的储量足够人类使用1000年,地球上含量很少。
和两者互为()A.同素异形体B.同位素C.同系物D.同分异构体3、美国和墨西哥研究人员将普通纳米银微粒分散到纳米泡沫碳(碳的第五种单质形态)中,得到不同形状的纳米银微粒,该纳米银微粒能有效杀死艾滋病病毒(HIV-1)。
纳米泡沫碳与金刚石的关系是()A.同素异形体 B.同分异构体 C.同系物 D.同位素4.下列各对物质中属于同分异构体的是()。
A.C与 CB.O2与O35.下列各组物质中一定互为同系物的是()。
A.C3H8、C8H18B. C2H4、C3H6C. C2H2、C6H6D. C8H10、C6H6。
化学元素周期表中的同位素练习题详解

化学元素周期表中的同位素练习题详解在学习化学元素周期表中的同位素练习题前,我们首先来了解一下同位素的概念。
同位素是指具有相同原子序数(即原子核中质子数相同)但具有不同中子数的元素,它们在化学性质上基本相同,但物理性质上略有差异。
同位素的存在使得元素周期表更加完善,也在科学研究和应用中发挥着重要的作用。
为了更好地理解同位素的性质和相关概念,下面我们将通过一些练习题来详细解析。
1. 氢元素有3种同位素,分别是质子数分别为1、2、3的氢同位素。
请问这3种氢同位素的中子数分别是多少?解析:氢元素的质子数永远为1,因此中子数等于质量数减去质子数。
第一种氢同位素的质量数为1,中子数为0;第二种氢同位素的质量数为2,中子数为1;第三种氢同位素的质量数为3,中子数为2。
2. 铀元素的同位素主要有两种,分别是质量数为235和238的铀同位素。
请问这两种铀同位素的中子数分别是多少?解析:铀元素的质子数为92,根据定义可知,质量数等于质子数加上中子数。
第一种铀同位素的质量数为235,中子数为235-92=143;第二种铀同位素的质量数为238,中子数为238-92=146。
3. 氧元素有3种同位素,分别是质量数为16、17、18的氧同位素。
请问这3种氧同位素的中子数分别是多少?解析:氧元素的质子数永远为8,根据定义可知,质量数等于质子数加上中子数。
第一种氧同位素的质量数为16,中子数为16-8=8;第二种氧同位素的质量数为17,中子数为17-8=9;第三种氧同位素的质量数为18,中子数为18-8=10。
4. 钠元素的同位素主要有两种,分别是质量数为23和24的钠同位素。
请问这两种钠同位素的中子数分别是多少?解析:钠元素的质子数为11,根据定义可知,质量数等于质子数加上中子数。
第一种钠同位素的质量数为23,中子数为23-11=12;第二种钠同位素的质量数为24,中子数为24-11=13。
通过以上练习题的解析,我们可以发现同位素的中子数可以通过质重数减去质子数得到。
《同位素》练习题课件

15.生物在有生命时,同位素碳-14 在生物体内的质量分数与外界环境中 的质量分数是相等的(即碳-14 在所有碳原子中所占的质量分数是恒定的)。 生物 一旦死亡,便不会再从环境中吸收碳-14。经科学实验证明,经过 5730 年(即半 衰期), 其碳-14 的含量恰好减少一半。 利用碳-14 的含量减少一半所需的时间, 1 即可推测出生物的死亡年代。某一植物化石中碳-14 的含量是新鲜植物的32,
个质子和7个中子,C原子核内有6个质子和8个中子。下列说法正确的是( C )
A.A和C的核电荷数不同
B.B和C的核外电子数相同 C.A和C是同种元素 D.B和C互为同位素原子
9.(原创题)614C是宇宙射线与大气中的氮通过核反应产生的,它和612C以 一定比例混合存在于空气中的二氧化碳里。614C随生物体的吸收代谢,经过 食物链进入活的生物体中,当生物死亡之后新陈代谢停止,在以后年代里,
中子数 的总数标出,如: 质子数和________ 3.为区别同种元素的同位素原子,可把______
3H C-14 氚(__ );或表示为碳-14(__________) 等。 1__
国防等方面有 工业 医疗、____ 有 同位素,同位素在 4.大多数元素都____ ____、农业 ____、____ 着广泛的应用,如可以利用碳-14测定年代 ____。
1.(齐齐哈尔中考)不同种元素最本质的区别是( B )
A.中子数不同 B.质子数不同
C.相对原子质量不同 D.核外电子数不同
2.(威海中考)碳-12、碳-13、碳-14都是碳元素的原子,它们的主要 差别在于( B ) A.电子数目不同 B.中子数目不同 C.质子数目不同 D.化学性质不同
3.(温州中考)氚是氢的一种同位素,氚原子含有1个质子和2个中子。下列示 意图能正确表示氚原子结构的是( ) A
同位素习题与答案

同位素示踪技术应用习题一、填空1.原子核的质子总数常用字母Z表示,核子总数常用字母A表示。
2.同质异能素的表示方法是在质量数之后加字母m。
3.原子核自发地放出辐射的现象称为放射性。
4.因放射性而使一种原子核转变为另一种原子核的过程称为核衰变。
5.通常将衰变前的核称为母核,衰变后的核称为子核。
6.α粒子实际上就是4He的原子核。
7.衰变能可由衰变前后系统的质量差求得。
8.3H和18F的衰变依次称为β−衰变和β+衰变。
9.通常根据特征X射线和俄歇电子来记录电子俘获过程。
10.1 Ci = 3.7 × 1010 Bq = 3.7 × 1010 s−1。
11.能量较高的电子射入介质后的辐射损耗有轫致辐射和切伦柯夫辐射两种形式。
12.标记化合物分为同位素标记物和非同位素标记物。
13.放射免疫分析既有抗体和抗原反应的高度特异性,又有放射性同位素检测的高度灵敏性。
14.稳定性核素的测定主要采用质谱法。
15.1 Gy = 1 J/kg = 100 rad。
16.1 R = 2.58×10−4 C/kg。
17.1 Sv = 1 J/kg = 100 rem。
18.可用放射自显影法观察32P标记转基因花粉的生长。
19.应用放射免疫分析测定配种后第19天和第23天的2个奶样的孕酮含量,即可判断奶牛是否怀孕。
20.测定钙吸收率的方法中应用最广的是双稳定同位素示踪技术。
21.18F-FDG是PET研究中应用最为广泛的放射性显像剂。
22.正电子随着能量降低湮灭几率增大,此时产生的2个γ光子向相反方向飞出,能量均为0.511 MeV。
23.患者口服13C-尿素,在20 min后呼气出现13CO2升高,表明有幽门螺杆菌感染。
24.测定DNA加合物的最主要方法是32P-后标记法。
二、名词解释1.同位素示踪技术—用同位素示踪剂(标记原子或标记化合物)研究被追踪物质的运动和转化规律的技术。
2.统一原子质量单位—等于一个游离的、静止的、处于基态的碳12原子质量的1/12。
'同位素

合格考分层训练专题合格考分层训练专题1:同位素【知识框架】同位素同位素的表示方法质子数/中子数/质量数/电子数/核电荷数/原子序数之间的关系【知识梳理】1. 判断是否互称同位素看三点:一必须是同种元素,故C 146、N 147不互称同位素;二必须用元素符号表示(即元素符号右下角没有数字),故211H 、221H 不互称同位素;三注意特殊性:H (H 11)、D (H 21)、T (H 31)也互称同位素。
2. 比较质子数、中子数、质量数、电子数、核电荷数、原子序数之间的关系主要明确两点: (1)熟悉元素符号左上角、左下角、右上角数字表示的含义:如图所示:(2)熟记三个关系式①质量数 = 质子数 + 中子数②原子序数 = 核电荷数 =③离子所带电荷数及电性 = 质子数 – 核外电子数 如图所示:技巧点拨:以质子数为核心,以不变应万变【练习巩固】1.(2016年T7)铀-235(U 23592)是常用的核燃料,U 23592核外电子数为 ( )A .327B .235C .143D .922.(2014年T3)关于146C 的叙述错误的是 ( )A. 质子数为6B. 电子数为6C. 中子数为6D. 质量数为143.(2013年T3)钼可用于制造导弹,钼的同位素9442Mo 所含的中子数是 ( ) A. 42B. 47C. 52D. 94RABn ±质量数 质子数离子所带电荷数4.(2011年T7)放射性同位素13153I ,其左上角数字“131”表示 ( )A .质量数B. 中子数C. 质子数D.电子数5.人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来聚变的重要原料之一。
氦的该种同位素应表示为 ( )A .He 43B .He 32 C .He 42 D .He 336.科学研究中,经常用到碳-12(或C -12)原子。
2011年3月,日本地震后发生了核电站核泄漏事故,在环境中测到了碘-131。
同位素地球化学复习题

同位素地球化学复习题1.1同位素地球化学的基本任务1)研究自然界同位素的起源、演化和衰亡历史;3)利用放射性同位素的衰变定律建立一套行之有效的同位素计时方法,测定不同天体事件和地质事件的年龄,并作出合理的解释,为地球和太阳系的演化确定时标。
4)研究同位素分馏与温度的关系,建立同位素温度计,为地质体的形成与演化研究提供温标。
1.2同位素地球化学的一些基本概念核素同位素同量异位素稳定同位素放射性同位素重稳定同位素轻稳定同位素2.1质谱仪的基本结构四个部分:进样系统离子源质量分析器离子接收器2.2衡量质谱仪的技术标准有哪些质量数范围分辨率灵敏度精密度与准确度2.3固体质谱分析为什么要进行化学分离具相同质量的原子和分子离子的干扰;主要元素基体中微量元素的稀释;低的离子化效率;不稳定发射。
2.5同位素稀释法是用于元素含量分析还是用于同位素比值分析?元素含量分析2.6氢气的制取方法?(有哪些还原剂)U-还原法Zn-还原法Mg-还原法Cr-还原法2.7氧同位素的制样方法有哪些?1.大量水样氧同位素制样方法?2.硅酸盐氧同位素的BrF5法制样原理?3.碳酸盐样品的磷酸盐制样法(McCrea法)2.8水中溶解碳的提取与制样McCrea法2.9硫化物硫同位素直接制样法2.10硫酸盐的硫同位素制样法(直接还原法)把硫酸盐、氧化铜、石英粉按一定比例混合(置于石英管中)在真空条件下加热到1120℃左右时,硫酸盐被还原而转变成二氧化硫。
2.11了解下列质谱仪1.热电离质谱仪(MAT260,261,262,Triton,GV354)2.气体质谱仪(MAT251,252,253,DeltaPlu,GVIoprime等)3.惰性气体质谱仪,如MM1200、MI1201-IG、GV54004.MC-ICP-MS(LA-MC-ICP-MS):如Neptune、NuPlama5.SHRIMP:SHRIMPII离子探针质谱本章重点同位素分析结果的表达方式稳定同位素(C、H、O、S)的国际标准同位素分馏基本理论–热力学分馏–动力学分馏分馏系数α及其与δ值之间的关系同位素相对富集系数(△)及其加和性同位素地质温度计3.1同位素分析结果的表达方式δ‰=(R样-R 标)/R标某1000=(R样/R标-1)某1000δ‰=(R样-R标)/R标某1000=(R 样/R标-1)某10003.3分馏系数α及其与δ值之间的关系1.定义:αA-B=RA/RB2.1000lnα≈△A-B=δA-δB3.4同位素相对富集系数(△)及其加和性某同位素在A-B-C三种矿物中有δA>δB>δC,则△A-C=△A-B+△B-C△B-C=△A-C-△A-B△A-B=△A-C-△B-C3.5同位素地质温度计同位素分馏方程1000lnα=A某106/T2+B同位素馏分曲线注意:分馏方程中T为绝对温度(OK)3.5同位素地质温度计1000lnα石英-水=3.38某106/T2-3.401000lnα石英-方解石=0.6某106/T21000lnαPy-Gn=1.03某106/T21000lnαPy-Sp=0.3某106/T24.本章重点1.氢-氧同位素的纬度效应、大陆效应、高度效应、季节效应6.火成岩的氢氧同位素组成特征、演化规律及其与矿物序列的关系?7.影响火成岩氢氧同位素组成特征的因素有哪些?8.Z=2.048(δ13C+50)+0.498(δ18O+50)是利用碳氧同位素来判别碳酸盐岩的沉积环境的判别方程,临界值是120。
同位素 专题练习

同位素 专题练习1、有六种微粒分别是4019X ,4020Y ,4018Z ,4019Q +,4020K 2+,4020M ,它们隶属元素的种类 ( ) A .2种 B .3种 C .4 种 D .5种2、4018Ar 、4019K 、4020Ca 三种原子, 它们具有相同的 ( )A .电子数B .中子数C .电子层数D .质量数3、下列各组物质中,互为同位素的是 ( )A .O 2、、O 3 、O 4B .H 2、D 2、T 2C .H 2O 、D 2O 、 T 2O D .6329Cu 和6529Cu4、下列关于原子的几种描述中,不正确的是 ( )A .18O 与19F 具有相同的中子数B .16O 与17O 具有相同的电子数C .12C 与13C 具有相同的质量数D .15N 与14N 具有相同的质子数5、分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg ,该同位素的原子核内的中子数是 ( )A .12B .14C .16D .186、人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可作为今后核聚变的重要原料之一。
氦的这种同位素应表示为 ( )A .He 43B .He 32C .He 42D .He 337、(2004上海)据报道,月球上有大量3He 存在,以下关于3He 的说法正确的是 ( )A .是4He 的同素异形体B .比4He 多一个中子C .是4He 的同位素D .比4He 少一个质子8、(1994上海)某微粒用R A Z n +表示,下列关于该微粒的叙述中正确的是 ( )A .所含质子数=A -nB .所含中子数=A -ZC .所含电子数=Z +nD .质子数=Z +A9、(1998上海)钛(Ti )金属常被称为未来钢铁。
钛元素的同位素Ti 4622、Ti 4722、Ti 4822、Ti 4922、Ti 5022中,中子数不可能为 ( )A .30B .28C .26D .2410、(1999上海)据报道,上海某医院正在研究用放射性同位素碘12553I 治疗肿瘤。
同位素标记题

同位素标记题目1 蚕豆根尖细胞在含3H标记的胸腺嘧啶脱氧核苷培养基中完成一个细胞周期,然后在不含放射性标记的培养基中继续分裂至中期,其染色体的放射性标记分布情况是( )A.每条染色体的两条单体都被标记B.每条染色体中都只有一条单体被标记C.只有半数的染色体中一条单体被标记D.每条染色体的两条单体都不被标记2 用32P标记了玉米体细胞(含20条染色体)的DNA分子双链,再将这些细胞转入不含的培养基中培养,在第二次细胞分裂的中期、后期,一个细胞中的染色体总条数和被标记的染色体条数分别是( )A.中期20和20、后期40和20 B.中期20和10、后期40和20C.中期20和20、后期40和10 D.中期20和10、后期40和103 如果将含有1对同源染色体的精原细胞的DNA分子用15N标记,并提供14N的原料,则该精原细胞产生的四个精子中没有放射性同位素15N的有( )A.0个B.1个C.2个D.4个4 如果将含有一对同源染色体的精原细胞的两个DNA分子都用15N标记,并只供给精原细胞含14N的原料,则该细胞进行减数分裂产生的四个精子中(不考虑交叉互换现象),含15N、14N标记的DNA分子的精子所占比例依次为( )A.100%、0 B.50%、50% C.50%、100% D、100%、100%拓展:细胞进行一次有丝分裂后再减数分裂产生的8个精子中(不考虑交叉互换现象),含15N、14N标记的DNA分子的精子所占比例依次为( )5.果蝇一个精原细胞中的一个核DNA分子用15N标记,在正常情况下,其减数分裂形成的精子中,含有15N的精子数占( )A.1/16 B.1/8 C.1/4 D.1/26. 现将含有两对同源染色体且核DNA都已用32P标记的一个细胞,放在不含32P的培养基中培养,若该细胞连续进行4次有丝分裂,则含32P的子细胞数量最少和最多分别是(不考虑交叉互换)( )A.2,16B.2,8C.4,8D.4,167. BrdU能替代T与A配对,而渗入新合成的DNA链中。
高三生物专题复习——同位素专题

放射性同位素放射线 半衰期同位素示踪技术细胞(结构与功能) 食物链生物考古新陈代谢 放疗 环境污染诱变育种 DNA 胚胎发育矿质元素15N测序复制细胞核 基因工程光合作用呼吸作用 有机物代谢途径 研究遗传物生物膜 细胞器同位素专题知识体系网络结构图高三专题复习-------放射性同位素在生物学中的应用教学目标:教学重点:1、 梳理知识的思维方法(由网络结构图发散思维引导联想思维能力的训练)2、 解题过程和解题方法的训练 教学难点:例2和例3的解题过程及方法 教学过程:一、梳理知识体系,形成网络结构同位素用于追踪物质运行和变化过程时,叫示踪元素。
用示踪元素标记的化合物,其化学性质不变。
人们可以根据这种化合物的放射性,对生物体内各种复杂的生理、生化过程进行追踪的方法,就是放射性同位素示踪法。
如示踪原子追踪光合作用、呼吸作用的过程、胚胎发育过程、细胞的结构和功能、蛋白质(酶)的形成以及遗传物质的研究等等。
14C 、18O 、15N 、3H 、32P 、35S 等都是常用的示踪原子。
二、 同位素技术的考题类型及解法(一) 学科内综合分析题*T加某物质例1 同位素示踪技术在生物学的研究中被广泛应用。
分析下列有关实验:细胞数目相等的两组小鼠肝细胞,用含有3H标记的胸腺嘧啶脱氧核苷酸的培养液培养,A组加入某物质,B组不加,经过一段时间培养后,洗去培养液,分别取出两组的全部细胞,测量每组的总放射性强度,结果A组显著大于B组。
请回答:A 组加入的物质的作用是_______。
3H标记的胸腺嘧啶脱氧核苷酸用于细胞中_________的合成,它在细胞中主要分布的部位是____________。
解析:通过审题可以简略绘图示。
答案:促进细胞分裂DNA 细胞核本题主要考查细胞分裂及细胞核内DNA分子复制(时间、场所、原料或组成单位)。
[解综合分析题的思路]:1、确认题干的中心知识点(内容)2、依题意分解中心知识为各分枝知识3、分析各知识点的内在联系,将中心知识变通扩展4、针对性作答。
同位素的判别和应用练习题

同位素的判别和应用练习题1. 介绍同位素是指具有相同原子序数但不同质量数的元素。
同位素的存在使得我们能够进行同位素的判别和应用。
本文将通过练习题的形式来深入探讨同位素的判别和应用。
2. 练习题一:同位素的判别a. 下列元素中,哪个元素具有不同的同位素?b. 如何判别两个同位素的不同?c. 为什么同位素的判别对于科学研究和应用具有重要意义?3. 练习题二:同位素的应用a. 同位素在生物医学中的应用有哪些?b. 同位素在环境监测中的应用有哪些?c. 同位素在能源开发中的应用有哪些?d. 同位素在考古学和地质学中的应用有哪些?4. 练习题三:同位素的实验技术a. 描述同位素标记的实验技术及其原理。
b. 简述同位素分离技术的应用。
c. 解释同位素示踪法在化学研究中的应用。
5. 练习题四:同位素的影响因素a. 影响同位素稳定性的因素有哪些?b. 同位素分析中,如何保证数据的准确性和可靠性?c. 同位素的使用是否会对环境和生物造成影响?请说明原因。
6. 练习题五:同位素的前景和挑战a. 同位素技术在未来的发展趋势是什么?b. 同位素技术面临的挑战有哪些?c. 如何解决同位素技术发展中遇到的挑战?7. 总结通过本文的练习题,我们了解了同位素的判别和应用。
同位素的判别对于科学研究和应用具有重要意义。
同位素的应用广泛涉及生物医学、环境监测、能源开发、考古学和地质学等领域。
同位素的实验技术包括同位素标记、同位素分离和同位素示踪法等。
同位素的稳定性、数据准确性和环境生物影响是同位素研究中需要考虑的因素。
同位素技术在未来有着广阔的前景,但也面临着挑战。
解决这些挑战需要进一步的研究和技术创新。
同位素技术的发展将为科学研究和工业应用提供更多的可能性。
同位素知识点训练专题

同位素知识点训练专题及详细解答1、由16O、17O 、18O 、11H 、21H 、31H 六种原子,可以构成双氧水分子,其种类有种。
2、有H、D、T 三种原子,它们之间的关系是,(1)在标况下,它们的单质的密度之比是,(2)1mol各单质中,它们的质子数之比是,中子数之比;(3)1g各单质中,它们的质子数之比是,中子数之比;(4)在标况下,1L各单质中,它们的电子数之比。
3、氯有两种同位素3517Cl 和3717Cl ,已知3517Cl 和3717Cl的原子个数比为3∶1,则氯气的相对分子质量分别为70、72、74的单质分子个数比为()A、6∶6∶1 B、3∶3∶1C、6∶3∶1D、9∶3∶14、某元素M所形成的气态分子M2有三种,其相对分子质量分别为70、72、74,它们的分子数之比9∶6∶1,下列判断正确的是()A、M元素有三种同位素B、M的一种同位素原子的质量数为36 C、质量数为35的同位素占的原子个数百分比为75% D、M2的平均相对分子质量为725、铜有两种天然同位素6329Cu 和6529Cu ,参考铜的相对原子质量(63.5),估算6329Cu的百分含量约是()A、20% B、25%C、50%D、75%6、硼元素的近似平均相对原子质量为10.8,则硼在自然界的两种同位素105B 和115B的原子个数比为()A、1∶1B、1∶2C、1∶3D、1∶47、溴有两种同位素,在自然界中这两种同位素大约各占一半,已知溴的原子序数为35,相对原子质量为80,则溴的这两种同位素的中子数分别为()A、79、81 B、45、46C、44、46D、34、368、由2311Na分别跟3517Cl和3717Cl所构成的10g氯化钠中含3717Cl的质量为()A、1.14gB、1.58gC、1.52gD、1.49g9、已知3517Cl的相对原子质量是34.969,丰度为75.77% , 3717Cl的相对原子质量是36.966, 丰度为24.23% ,求:氯元素的平均相对原子质量及近似相对原子质量10、K35ClO 3与K37Cl 在酸性溶液中反应生成氯气,则该氯气的平均相对分子质量为 ( )A.70.7B.71.0C.72.0D.73.3解析部分: 1、[答案]36。
同位素例题——精选推荐

《同位素》习题1.钛(Ti )金属常被称为未来钢铁。
)金属常被称为未来钢铁。
钛元素的同位素钛元素的同位素Ti 4622、Ti 4722、Ti 4822、Ti 4922、Ti 5022中,中子数不可能为(中子数不可能为( )A .30 B .28 C .26 D .24 2.填表。
.填表。
微粒微粒 电子数电子数 质子数质子数 中子数中子数 质量数质量数 最外层电子数最外层电子数1737Cl 818O 1327Al 1634S 2-3.O 元素有16O 、17O 、18O ,H 元素有1H 、2H 、3H 。
则过氧化氢分子有则过氧化氢分子有 种;用仪器测它们的相对分子质量,不同的值有用仪器测它们的相对分子质量,不同的值有 种。
种。
4.已知镁有三种同位素,各同位素的原子个数含量如下:2412Mg (占78.70%), 2512Mg(占10.13%), 2612Mg (占11.17%)。
请计算镁元素的近似相对原子质量。
请计算镁元素的近似相对原子质量。
5.氯只有3517Cl 和3717Cl 两各稳定同位素,它们在氯气中的原子数之比3517Cl ∶3717Cl 为3∶1。
则分子量为70、72、74的氯气分子数之比可能是(的氯气分子数之比可能是( )A .5∶2∶1 B .5∶2∶2 C .9∶3∶1 D .9∶3∶2 6.已知X 元素能形成相对分子质量分别为a 、b 、c 的三种双原子分子,其分子个数之比为m :n :q ,且a>b>c ,则X 元素存在元素存在 种同位素,其质量数分别为其质量数分别为 ; 其中质量数大的同位素原子占该元素原子总数的百分比为其中质量数大的同位素原子占该元素原子总数的百分比为 。
7.将某文献资料上记载的相对原子质量的数据摘录如下:.将某文献资料上记载的相对原子质量的数据摘录如下:35Cl 34.969 75.77% 35Cl 35 75.77% 37Cl 36.966 24.23% 37Cl 37 24.23% 平均平均35.453 平均平均35.485 试回答下列问题:试回答下列问题: (1)34.969是表示:是表示: (2)35.453是表示:是表示: (3)35是表示:是表示: (4)35.485是表示:是表示: (5) 24.23%是表示:是表示:8.已知:KClO3+6HCl=KCl+3Cl2↑+3H2O,现用K37ClO3和H35Cl反应,求制备的Cl2的摩尔质量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
同位素A组1.有五种微粒分别是4019X、4018Z、4019Q+、4020R2+、4120M,它们属于几种元素A 2种B 3种C 4种D 5种2.下列各组物质中,互为同位素的是A 重氢、超重氢B 氧、臭氧C 红磷、白磷D 乙酸、丙酸3.下列各组粒子中,互为同位素的是A O2和O3B SO2和SO3C 12C和13CD D2O和T2O4.下列各组中,互为同位素的是A 金刚石石墨BC H2O D2OD 白磷红磷5.下列属于同位素的是A 金刚石和石墨B 和CaC C和 CD O2和O36.若用M代替任意一种元素的符号,那么,在①、②、③、④四种原子中,可互称同位素的是A ①和③B ②和③C ①和②D ②和④7.甲、乙两种微粒都只含有一个原子核,且核内具有相同数目的质子,这两种微粒定是A 同种原子B 同种元素C 互为同位素D 具有相同的核外电子排布89.钛是21世纪广泛使用的一种金属,它有多种同位素,如22Ti、4722Ti、4822Ti、4922Ti、5022Ti,在以上这些同位素原子中,其中子数不可能可能为A 24B 26C 28D 3010.元素X的一种同位素为,元素y的一种同位素为,已知a>c,b>d,则元素X与元素Y的中子数大小的关系是A X>YB X<YC X=YD 不能确定11.a X和b Y分别是元素X和Y的一种同位素,已知a>b,元素X和元素Y的原子量A 大于B 等于C 小于D 不能确定12.32He在热核反应堆中,没有中子辐射,这就意味着有32He生产能源时不会污染环境。
地球上32He含量很少,而在月球上却有充足的32He。
根据科学家介绍,月球上的32He储量足够人类使用1000年。
32He和42He两者是A 同系物B 同位素C 同素异形体D 同分异构体13.据最新科技报道,用10B合成的10B20有非常好的抗癌、治癌作用,下列有关说法正确的是A 10B和10B20互为同位素B 10B20是一种高熔点硬度大的物质C 10B和10B20互为同分异构体D 10B中子数与核外电子数相同14.Se是人体必需微量元素,下列关于的说法正确的是A 互为同素异形体B 互为同位素C 分别含有44和46个质子D 都含有34个中子15.136C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关136C的说法不正确的是A 该粒子不显电性B 核外有13个电子,其中4个能参与成健C 在周期表中与126C占同一位置 D 相对原子质量约等于1316.136C-NMR(核磁共振)可以用于含碳化合物的结构分析。
136C表示的碳原子A 核外有13个电子,其中最外层有4个电子B 核内有6个质子,核外有7个电子C 质量数为13,原子序数为6,核内有7个质子D 质量数为13,原子序数为6,核内有7个中子17.13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW üthrich等人为此获得2002年诺贝尔化学奖。
下面有关13C、15N叙述正确的是A 13C与15N有相同的中子数B 13C与C60互为同素异形体C 15N与14N互为同位素D 15N的核外电子数与中子数相同18.最近,医学家们通过用放射性14C原子标记的C60示踪发现,C60的一种羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS)病毒。
其中,关于放射性14C的叙述中正确的是A 与C60中普通碳原子的化学性质不同B 与14N中所含中子数相同C 与C60互为同素异形体D 与12C互为同位素19.14C是宇宙射线与大气中的氮通过核反应产生的,它和12C以一定比例混合存在于空气中的二氧化碳里。
14C随生物体的吸收代谢,经过食物链进入活的生物体中。
当生物死亡之后新陈代谢停止,在以后年代里,12C通常不再发生变化,其数量固定下来,而14C具有放射性,仍不断衰变减少。
与其有关的说法中不正确的是A 14C与12C互为同位素B 0.012kg的14C中含有N A个碳原子数(N A表示阿伏加德罗常数)C 等物质的量的14C与12C所含的中子数不同D 可根据14C在生物体内的含量来计算生物体的死亡年代20.已知自然界氧的同位素有16O、17O、18O,氢的同位素有H、D,从水分子的原子组成来看,自然界的水一共有A 3种B 6种C 9种D 12种21.氢的三种同位素:H、D、T,氯有两种同位素:35Cl、37Cl;当组成氯化氢分子时,其分子量所得的数值有A 5种B 6种C 7种D 8种22.已知碳有三种常见的同位素12C、13C、14C,氧也有三种位素16O、17O、18O,由这六种微粒构成的二氧化碳分子中,其式量最多有A 18种B 6种C 7种D 12种23.据测,哈雷彗星上碳的两种位素12C和13C的原子个数比为65︰1,而地球上12C 和13C的原子个数比为89︰1。
地球上碳元素的原子量是12.011,那么哈雷彗星上碳元素的原子量应是A 12.000B 12.009C 12.015D 12.98024.由2311Na、3517Cl、3717Cl(氯元素的平均原子量为35.5)构成11.7克氯化钠中含的质量为A 1.85克B 8.70克C 1.775克D 5.325克25.某氯化镁晶体是由Mg2+、35Cl-、37Cl-构成,在熔融条件下,将1mol这种氯化镁电解,测得产生的气体的质量是相同状况下相同体积氧气质量的2.22倍,则这种氯化镁的晶体中35Cl-的物质的量的百分含量约为A 25%B 40%C 50%D 75%26.某元素构成的双原子单质分子有3种,其分子量分别为158、160、162。
在天然单质中,此三种单质的物质的量之比为1︰1︰1,由此推断的以下结论中,正确的是A 此元素有三种同位素B 其中质量数为79的同位素原子占原子总数的1/2C 其中一种同位素的质量数为80D 此元素的单质的平均分子量为16027.某元素的天然同位素有A和A,如果该元素的近似相对原子质量为10.8,那么A和A的原子个数比为A 3︰1B 1︰3C 4︰1D 1︰428.分子由2个相同的氢原子和一个氧原子(16O)构成的化合物2克,完全分解产生氧气1.6克,则此种化合物中的氢原子是A HB HC HD T29.电解含有重水(D2O)的普通水时,在两极共收集到气体18.5g,其体积恰好是33.6L(S.T.P.)。
这些气体中普通氢和重氢(D)的原子个数比为A 1︰1B 2︰1C 3︰1D 4︰130.在恒定温度下,向100克饱和Ba(OH)2溶液中加入1.55克由18O组成的氧化钡粉未,充分反应后静置,在溶液下部有白色固体出现,下列叙述正确的是A 溶液质量与白色固体的质量均保持不变B 溶液浓度和pH值均保持不变,溶液下部是1.73克氢氧化钡固体C 溶液中钡离子与氢氧根离子的数目均保持不变,18O存在于溶液和固体中,固体质量大于1.73克D 溶液中钡离子与氢氧根离子的物质的量的浓度保持不变,18O存在于溶液和固体中,固体质量小于1.73克31.①硼有两种天然同位素,10B和11B,原子百分含量分别是20%和80%,求近似原子量。
②硼有两种天然同位素,10B和11B,原子个数比为1︰4,求近似原子量。
③硼有两种天然同位素,10B和11B,物质的量之比为1︰4,求近似原子量。
32.①硼有两种天然同位素,10B和11B,近似原子量为10.8,求10B和11B的原子百分比。
②硼有两种天然同位素,10B和11B,近似原子量为10.8,又知其原子百分含量分别为20%和80%,求10B和11B在天然同位素中的原子个数比。
③硼有两种天然同位素,10B和11B,近似原子量为10.8,求10B和11B在天然同位素中的物质的量之比。
33.①硼有两种天然同位素,10B和x B,近似原子量为10.8,又知其原子百分含量分别为20%和80%,求它们的中子数。
②硼有两种天然同位素,10B和x B,近似原子量为10.8,又知其原子个数之比为1︰4,求它们的中子数。
③硼有两种天然同位素,10B和x B,近似原子量为1008,又知其物质量之比为1︰4,求它们的中子数。
34.已知银有两种天然同位素107Ag和109Ag,银元素的近似原子量是107.8;碘元素只有一种原子127I,某化工厂制造出10吨90%的碘化银用于人工降雨(杂质中不含碘和银)。
求:(1)原料中含109Ag 吨;(2)产品中含107Ag 吨。
B组35.氢元素有三种同位素H、D、T,氯元素有两种同位素35Cl、37Cl当用一种仪器分别测定20000个氯化氢分子的质量,所得数值有A 2种B 3种C 5种D 6种36.K35ClO3晶体与H37Cl溶液反应生成氯气、氯化钾和水,实验测得此反应生成的氯气的分子量是A 73.3B 73C 72D 7137.硼有两种天然同位素、,硼元素的原子量为10.80,则对硼元素中的质量百分比含量的判断正确的是A 20%B 略大于20%C 略小于20%D 80%38.设阿伏加德罗常数为N A,若H2O和D2O分别与金属钾反应完全,它们的电子转移数均为1/nN A,则下列各叙述中的有关化学量不相等的是A 消耗H2O和D2O的物质的量B 同温同压下生成气体的体积C 反应后生成的溶液百分比浓度D 参加反应的钾的质量39.完全电解19g含有重水(D2O)的普通水时,共产生气体33.6L(标准状况),下列说法正确的是A 所得气体的质量为18gB 该水的物理性质和普通水完全相同C 电解前H2O和D2O的物质的量之比是1︰1D 如果得到的氢气只有H2和D2两种,则它们的质量之比是1︰140.已知氢元素有1H、2H、3H三种同位素,氧元素也有16O、18O二种同位素。
它们之间形成化合物的种类有A 30种B 18种C 21种D 33种41.目然界中,碳除了有2种稳定同位素12C和13C外,还有一种半衰期很长的放射性同位素14C,丰度也十分稳定,如下表所示(注:数据后括号里的数字是最后一位或两位的精确度,14试问:为什么通常碳的相对原子质量只是其稳定同位素的加权平均值而不将14C也加入取平均值?C组参考答案(29)1 B2 A3 C4 B5 C6 A7 B8 B9 D10 D11 D12 B13 D14 B15 B16 D17 C18 D19 B20 C21 A22 C23 C24 A25 C26 B、D27 D28 B29 C30 D31 ①10.8 ②10.8 ③10.832 ①20% 80% ②1︰4 ③1︰433 ①5 6 ②5 6 ③5 634 (1)1.67 (2)5.3835 C36 A37 C38 C39 C40 D41 14C不加权不会影响计算结果的有效数字,因其丰度太低了。
