化学 酸碱盐氧化物关系图(整理简洁版)
单质氧化物酸碱盐之间的相互关系.ppt

② Fe+CuSO4=FeSO4+Cu
③ C+2CuO
2Cu+CO2↑
复分解反应及复分解反应发生的条件
(1)复分解反应是具备一定前提条件的化 学反应。这些前提条件是:①反应物是两种 化合物;②生成物是两种化合物;③生成的 两种化合物是参加反应的两种化合物相互交 换成分的结果。
判断下列反应能否发生置换反应, 不能反应的请说明理由,能的请写出 化学方程式。
①Cu+HCl= 不能反应,因为铜排在H的后面
② Fe+HCl= 能反应,Fe+2HCl=FeCl2+H2↑
③Al+H2SO4= 能反应,2Al+3H2SO4=Al2(SO4)3+3H2↑ ④ Cu+AgNO3= 能反应,Cu+2AgNO3=Cu(NO3)2+2Ag ⑤Fe+CuSO4= 能反应,Fe+CuSO4=FeSO4+Cu ⑥ Cu+ZnSO4=不能反应,因为铜排在锌的后面
置换反应规律小结:
1、这类反应以金属活动性顺序表为依 据去判断能否进行。
在金属活动性顺序中,位于氢前面的金属能置 换出盐酸、稀硫酸中的氢;
在金属活动性顺序中,位于前面的金属能把位 于后面的金属从它们化合物的溶液(盐溶液)里 置换出来。
2、有铁参加的置换反应均生成亚铁盐。
已知:化合物甲+单质乙 化合物丙+单质丁。试回答:写出三个符 合此表达式的化学方程式(要求:甲在不 同的化学方程式中所属类别不能相同)
单质、氧化物、酸、碱、 盐之间的相互关系
单质、氧化物、酸、碱、盐之间的相互关系
金属氧化物
复 分
酸
+碱 +盐
常见的酸碱盐知识网络图

常见的盐
2019 POWERPOINT
2018年12月12日星期三3
SUCCESS
2019 ANK YOU
2018年12月12日星期三4
SUCCESS
第八单元 常见的酸、碱、盐 单元知识结构图
粤教版 九年级 下册
定性:确定溶液是否呈酸碱性:石蕊、酚酞等酸碱指示剂变色 溶液的 酸碱性
确定溶液酸碱性的强弱:PH 定量: 酸性(H+) 酸性增强 常 见 的 酸 、 碱 、 盐 分类 酸 常见物质 盐酸、硫酸 代表物质 浓硫酸脱水性 特点 常见 的酸 和碱 (1)石蕊变红,酚酞无色 (2)酸+金属氧化物 盐+水 溶液通性 (3)酸+碱 盐+水 (4)酸+盐 新酸+新盐 (5)酸+金属 盐+氢气 特点:由金属离子和酸根离子构成。 (1)盐+碱 新盐+新碱 (2)盐+酸 新酸+新盐 通性 (3)盐+盐 新盐+新盐 中性 碱性(OH-) 碱性增强 碱 烧碱、熟石灰 烧碱强腐蚀性、潮解性 (1)石蕊变蓝,酚酞变红 (2)碱+非金属氧化物 盐+水 (3)酸+碱 盐+水 (4)碱+盐 新碱+新盐 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
单质、氧化物、酸、碱和盐的相互关系
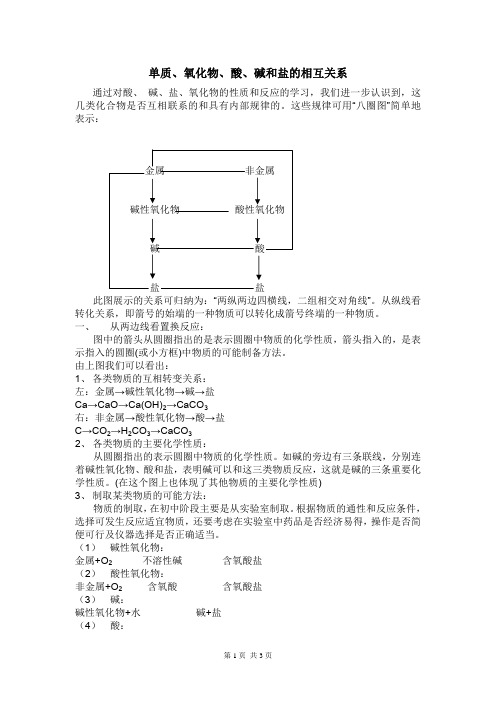
单质、氧化物、酸、碱和盐的相互关系通过对酸、碱、盐、氧化物的性质和反应的学习,我们进一步认识到,这几类化合物是否互相联系的和具有内部规律的。
这些规律可用“八圈图”简单地表示:此图展示的关系可归纳为:“两纵两边四横线,二组相交对角线”。
从纵线看转化关系,即箭号的始端的一种物质可以转化成箭号终端的一种物质。
一、 从两边线看置换反应:图中的箭头从圆圈指出的是表示圆圈中物质的化学性质,箭头指入的,是表示指入的圆圈(或小方框)中物质的可能制备方法。
由上图我们可以看出:1、各类物质的互相转变关系:左:金属→碱性氧化物→碱→盐Ca→CaO→Ca(OH)2→CaCO3右:非金属→酸性氧化物→酸→盐C→CO2→H2CO3→CaCO32、各类物质的主要化学性质:从圆圈指出的表示圆圈中物质的化学性质。
如碱的旁边有三条联线,分别连着碱性氧化物、酸和盐,表明碱可以和这三类物质反应,这就是碱的三条重要化学性质。
(在这个图上也体现了其他物质的主要化学性质)3、制取某类物质的可能方法:物质的制取,在初中阶段主要是从实验室制取。
根据物质的通性和反应条件,选择可发生反应适宜物质,还要考虑在实验室中药品是否经济易得,操作是否简便可行及仪器选择是否正确适当。
(1) 碱性氧化物:金属+O2不溶性碱含氧酸盐(2) 酸性氧化物:非金属+O2含氧酸含氧酸盐(3) 碱:碱性氧化物+水碱+盐(4) 酸:酸性氧化物+水酸+盐(5) 盐:常见的十种成盐方法:① 金属+非金属→无氧酸盐② 碱性氧化物+酸性氧化物→含氧酸盐③ 碱性氧化物+酸→盐+水④ 酸性氧化物+碱→盐+水⑤ 酸+碱→盐+水⑥ 碱+盐→碱+盐⑦ 酸+盐→酸+盐⑧ 盐+盐→盐+盐⑨ 金属+酸→盐+氢气⑩ 金属+盐→金属+盐例1:用五种不同的方法制取硫酸锌,写出有关的化学反应方程式。
分析:解答物质制备题的思维程序是:(1) 确定物质的类别;(2) 从无机化学反应的初步规律中找出能生成这类物质的几类反应;(3) 结合每类反应的发生条件,选择适当的常见物质,使反应确实能发生并得到要制的物质;(4) 如果可能的方法超过题中要求的数量,则要去掉原料较贵或较难进行的反应。
单质 氧化物 酸 碱 盐之间的相互关系

单质氧化物酸碱盐之间的相互关系
1.纵向(2条):表示了各类物质之间相互转化(衍生)的关系
例1:Na →Na2O →NaOH →NaCl
例2:C →CO2→H2CO3→CaCO3
例3:Cu →CuO →Cu(OH)2→CuSO4
横向(10条):表示了各类物质之间相互反应的关系
㈠金属+ 非金属→盐(无氧盐)㈡碱性氧化物+ 酸性氧化物→盐(含氧盐)
㈢碱性氧化物+ 酸→盐+ 水
㈣酸性氧化物+ 碱→盐+ 水
㈤碱+ 酸→盐+ 水
㈥碱+ 盐→碱+ 盐
㈦酸+ 盐→酸+ 盐
㈧盐+ 盐→盐+ 盐
㈨金属+ 盐→金属+ 盐
㈩金属+ 酸→盐+ 氢气
3、表示了各类物质的主要化学性质
碱性氧化物的主要化学性质有3条
酸性氧化物的主要化学性质有3 条
碱的主要化学性质3条
酸的主要化学性质4条
盐的主要化学性质4条
4、表示了各类物质的可能制法
如:从图看盐有十种可能的制法
练习:
写出制取ZnSO4的所有可能制法,用化学方程式表示
写出制取MgCl2的所有可能制法,用化学方程式表示。
单质氧化物酸碱盐关系

单质、氧化物、酸、碱、盐之间的相互关系:基本关系:金属 + 氧气 → 金属氧化物 非金属 + 氧气 → 非金属氧化物2Mg + O 2 ==== 2MgO C + O 2 ===== CO 22Cu + O 2 ==== 2CuO S + O 2 ===== SO 23Fe + 2O 2 === Fe 3O 4 4 P + 5O 2 === 2P 2O 5金属氧化物 + H 2O → 碱(可溶) 非金属氧化物 + H 2O → 酸(含氧)CaO + H 2O === Ca(OH)2 CO 2 + H 2O ==== H 2CO 3 Na 2O + H 2O === 2NaOH SO 2 + H 2O ==== H 2SO 3 K 2O + H 2O === 2KOH SO 3 + H 20 ==== H 2SO 4说明:⑴、可溶性碱能由对应的金属氧化物与水反应生成,但受热不分解;如:CaO+H 2O == Ca(OH)2 。
不溶性碱不能由金属氧化物与水反应生成,但受热能分解生成对应的金属氧化物和水。
如:Cu(OH)2====CuO + H 2O ,但CuO 不能与H 2O 反应。
⑵、含氧酸可由对应的非金属氧化物与水反应化合生成;无氧酸则只能由非金属与H 2化合生成气体后再溶于水得到。
如:H 2 + Cl 2 ==== 2HCl ,HCl 溶于水形成盐酸。
⑶能与酸反应生成盐和水的金属氧化物也叫碱性氧化物,能与碱反应生成盐和水的非金属氧化物也叫酸性氧化物(CO 不能与碱反应,不属于酸性氧化物);⑷、图中反应①可理解为金属与非金属反应生成无氧酸盐,如:2Na + Cl 2 === 2NaCl ;图中反应④可理解为金属氧化物与非金属氧化物生成含氧酸盐,如:CaO + SO 2 ==== CaSO 3 。
点燃 点燃△ 点燃△点燃高温点燃 点燃。
初三化学上学期单质酸碱盐氧化物的关系鲁教版

碱
盐
非金属 酸性氧 化物
酸
盐
金属
碱性氧 化物
无氧酸盐
非金属
酸性氧 化物
碱
酸
盐
盐
金属
碱性氧 化物
无氧酸盐 含氧酸盐Байду номын сангаас
非金属
酸性氧 化物
碱
酸
盐
盐
金属 碱性氧 化物
碱
无氧酸盐 含氧酸盐
盐和水
非金属 酸性氧 化物
酸
盐1
盐2
金属 碱性氧 化物
碱
盐1
无氧酸盐 含氧酸盐
盐和水
盐3+盐4
非金属 酸性氧 化物
金属 碱性氧 化物
碱
盐1
无氧酸盐 含氧酸盐
盐和水
盐3+盐4
非金属
盐
酸性氧 和
化物
氢
气
酸
盐2
课堂练习
用七种方法制取氯化镁或硫酸锌
酸
盐2
家具如何保养
1.用蛋清擦拭弄脏了的真皮沙发可用一块干净的绒布蘸些蛋清擦拭,既可去除污迹,又能使皮面光亮如初。2.用牙膏擦拭冰箱外壳冰箱外壳的一般污垢,可用软布蘸些牙膏擦拭,既可去除污迹 奶擦木制家具取一块干净的抹布在过期不能饮用的牛奶里浸一下,然后用此抹布擦抹桌子、柜子等木制家具,去污效果非常好,最后再用清水擦一遍。油漆过的家具沾染了灰尘,可用湿纱布包裹 去擦,或用冷茶水擦洗,会更加光洁明亮。4.白萝卜擦料理台切开的白萝卜搭配清洁剂擦洗厨房台面,将会产生意想不到的清洁效果,也可以用切片的小黄瓜和胡萝卜代替,不过,白萝卜的效果 5.酒精清洗毛绒沙发毛绒布料的沙发可用毛刷蘸少许稀释的酒精扫刷一遍,再用电吹风吹干,如遇上果汁污渍,用1茶匙苏打粉与清水调匀,再用布沾上擦抹,污渍便会减退。6.苹果核去油污厨 池常常有一层油污,碰巧刚吃完苹果就可用果核将油垢擦洗掉,这是因为果核中含有果胶,而果胶则具有去除油垢的作用。7.用盐去地毯上的汤汁有小孩的家庭,地毯上常常滴有汤汁,千万不能 擦。应先后用洁净的干布或手巾吸干水分,然后在污渍处撒些食盐,待盐面渗入吸收后,用吸尘器将盐吸走,再用刷子整平地毯即可。8.冰块去除口香糖有些孩子喜欢吃口香糖,不小心会弄到地 在地毯上的口香糖很不容易取下来,可把冰决装在塑料袋中,覆盖在口香糖上,约30分钟后,手压上去感觉硬了,取下冰决,用刷子一刷就可刷下。9.巧用保鲜膜这是一则懒人小妙方。在厨房临 墙面上张贴保鲜膜。由于保鲜膜容易附着的特点,加上呈透明状,肉眼不易察觉,数星期后待保鲜膜上沾满油污,只需轻轻将保鲜膜撕下,重新再铺上一层即可,丝毫不费力。对于平日忙碌的主 不失为一个方便偷懒的好方法。10.原木家具光洁法原木家具可用水质蜡水直接喷在家具表面,再用柔软干布抹干,家具便会光洁明亮。如果发现表面有刮痕,可先涂上鱼肝油,待一天后用湿布 外,用浓的盐水擦拭,可防止木质朽坏,延长家具的寿命。 科学实验加盟
单质、氧化物、酸碱盐的相互转化关系(导图版)

单质、氧化物、酸碱盐的相互转化关系(导图版)为4⽉6⽇晚8:30,在uc聊天室[化学教与学]房间的讲座准备的PPT,还在不断的修改中!本次开始实践思维导图在复习课中的运⽤,很多功能还不是很熟悉,希望各位同⼈多提宝贵建议!很多试题的答案是⽤的强调变⾊显⽰,还有很多ppt动画不能显⽰,待最终版完成会给⼤家直接提供下载地址!可以尝试将本⽂稿放到google共享⽂档中,与各位同仁协作修改!期待你的建议ing……幻灯⽚1幻灯⽚2涛声依旧 1 年, 11 ⽉前说: 主要内容⼀⽬了然,看起来也很美,给学⽣美感,愉悦有助提⾼兴趣。
幻灯⽚3潇潇⾬ 1 年, 11 ⽉前说: ⼀⽬了然,学⽣⽬前记忆这个总是有问题涛声依旧: CaSO4 AgSO4 微溶保存取消删除幻灯⽚4幻灯⽚5涛声依旧 1 年, 11 ⽉前说: 是不是增加Cl-zhangyanxia 1 年, 11 ⽉前说: 都从阴离⼦⾓度总结,可以避免重复。
幻灯⽚6涛声依旧: 此处为什么不分别画出⾦属氧化物和⾮⾦属氧化物保存取消删除幻灯⽚7涛声依旧 1 年, 11 ⽉前增加标注: 此处为什么不分别画出⾦属氧化物和⾮⾦属氧化物潇潇⾬ 1 年, 11 ⽉前说: ⾦属氧化物与酸反应属于复分解反应,碱性氧化物与碱反应不属于,此处没有表⽰出来⽹络飞翔 1 年, 11 ⽉前说: @涛声依旧: 这是按照物质分类的基础上划分的,没有进⾏再区分!⽹络飞翔 1 年, 11 ⽉前说: @潇潇⾬: ⾦属氧化物与酸的反应是不是复分解反应,⽼教材认为是,现在存在争议,考试是不会考的,⼲脆不把这些模糊地概念给学⽣!幻灯⽚8涛声依旧 1 年, 11 ⽉前增加标注: 此处为什么不明确⾦属单质?冲浪者 1 年, 11 ⽉前增加标注: 应该是活泼⾦属单质。
幻灯⽚11幻灯⽚12涛声依旧 1 年, 11 ⽉前增加标注: 是否该增加SO3与NaOH的反应,教材中有,学⽣也易写错。
涛声依旧 1 年, 11 ⽉前增加标注: 应为氨⽓+⽔幻灯⽚13幻灯⽚14幻灯⽚15zhangyanxia 1 年, 11 ⽉前说: 是不是应该说上盐不能⽤钡盐、三价铁盐、钾盐、钠盐、钙盐呢?幻灯⽚18幻灯⽚19涛声依旧: 丢掉了BaCl2,NaCO3误写保存取消删除幻灯⽚20。
化学 酸碱盐氧化物关系图(整理简洁版)

复分解反应,生成物有水
精选ppt
11
非金属氧化物+水
CO2+H2O SO3+H2O
酸(含氧酸)
H2CO3 H2SO4
精选ppt
12
碱+非金属氧化物=盐+H2O
2NaOH+SO3=Na2SO4+H2O 2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+CO2=CaCO3↓+H2O 2KOH+SO2=K2SO3+H2O
+酸 +盐ห้องสมุดไป่ตู้
+盐 +碱
盐
精选ppt
盐
4
点燃
金属+氧气 或△ 金属氧化物
2Mg+O2点燃 2MgO
4Al +3O2 点燃 2Al2O3
3Fe+2O2 点燃 Fe3O4
2Cu +O2 △ 2CuO
精选ppt
5
金属氧化物+水
CaO+H2O Na2O+H2O
碱(可溶)
Ca(OH)2 2NaOH
精选ppt
6
并且反应物要全溶才能反应!
精选ppt
17
Mg(OH)2+Na2CO3≠
Al(OH)3+FeCl3≠
解释:因为反应物有沉 淀存在,不能进行
精选ppt
18
盐 + 盐 = 新盐 + 新盐
AgNO3+NaCl=AgCl↓ +NaNO3
CaCl2+Na2CO3=CaCO3↓+2NaCl
Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
复分解反应,生成物要有沉淀, 并且反应物要全溶才能反应!
酸+金属=盐 +H2↑
H2SO4+Fe=FeSO4+H2↑
H2SO4+Zn=ZnSO4+H2↑ 2HCl+Mg=MgCl2+H2↑
3H2SO4+2Al=Al2(SO4)3+3H2↑
金属活动顺序表氢前的金属才能 和酸发生置换反应,但硝酸不能 发生置换反应。
2Mg+O2点燃 2MgO
4Al +3O2 点燃 2Al2O3
3Fe+2O2 点燃 Fe3O4
2Cu +O2 △ 2CuO
金属氧化物+水
CaO+H2O Na2O+H2O
碱(可溶)
Ca(OH)2 2NaOH
碱 +酸 盐 碱 +盐 盐
NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2=K2SO4+2H2O
H2SO4+BaCl2=BaSO4 ↓ +2HCl
HCl+AgNO3=AgCl↓ +2HNO3
碱+盐= 盐+ 碱
3 NaOH + FeCl3 = 3NaCl+Fe(OH)3↓
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
碱+酸==盐+H2O
NaOH+HCl=NaCl+H2O 2NaOH+H2SO4=Na2SO4+2H2O
碱+非金属氧化物=盐+H2O 2NaOH+SO3=Na2SO4+H2O 2NaOH+CO2=Na2CO3+H2O Ca(OH)2+CO2=CaCO3↓+H2O 2KOH+SO2=K2SO3+H2O
非复分解反应,没有交换成分
碱+酸==盐+H2O NaOH+HCl=NaCl+H2O 2NaOH+H2SO4=Na2SO4+2H2O Cu(OH)2+2HCl=CuCl2+2H2O 2Fe(OH)3+3H2SO4=Fe2(SO4)3+
金属 金属氧化
物 碱
盐
非金属 非金属氧
化物 酸
盐
金属
非金属
+O2 +C/CO/H2
金属氧化 物
+O2
非金属氧 化物
+H2O
碱
△ +H2O
酸
+酸 +盐
盐
+盐 +碱
盐
方程式举例
金属
非金属
+O2 +C/CO/H2 金属氧化
物
+O2
非金属氧 化物
+H2O
碱
△ +H2O
酸
+酸 +盐
盐
+盐 +碱
盐
点燃
金属+氧气 或△ 金属氧化物
复分解反应,生成物要有沉淀, 并且反应物要全溶才能反应!
Mg(OH)2+Na2CO3≠
Al(OH)3+FeCl3≠
解释:因为反应物有沉 淀存在,不能进行
盐 + 盐 = 新盐 + 新盐
AgNO3+NaCl=AgCl↓ +NaNO3
CaCl2+Na2CO3=CaCO3↓+2NaCl
Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO
高温
Fe2O3+3CO 2Fe+3CO2 古代炼铁方法之一
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
3NaOH+FeCl3= 3NaCl+Fe(OH)3↓
点燃
非金属+氧气
非金属氧化物
4P+5O2 点燃 2P2O5
点燃
C+O2
CO2
S+O2 点燃 SO2
2H2+O2 点燃 2H2O
酸 +碱 盐 酸 +盐 盐 HNO3+NaOH=NaNO3+H2O
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
(4)碱+酸==盐+H2O
NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2SO4+2H2O
酸(不稳定)
H2CO3
非金属氧化物+水
CO2↑+H2O
高温
2CuO+C 2Cu+CO2↑
古代炼铜的△方法之一
CuO+H2 Cu+H2O
高温 2Fe2O3+3C 4Fe+3CO2↑
BaSO4+HCl ≠ AgCl+HNO3 ≠
解释:因为硫酸钡和氯 化银不溶于酸
碱 +盐=盐+碱
2NaOH+CuCl2=2NaCl +Cu(OH)2↓ 3NaOH+FeCl3=3NaCl+Fe(OH)3↓
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
盐+金属=盐 +金属
CuSO4+Fe=FeSO4+Cu 2AgNO3+Cu=Cu(NO3)2+2Ag 3CuCl2+2Al=2AlCl3+3Cu CuSO4+Zn=ZnSO4+Cu
金属单质必须比盐溶液中的金属 元素活动性强。K、Ca、Na除外
(2)碱+非金属氧化物=盐+H2O 2NaOH+SO3=Na2SO4+H2O 2NaOH+CO2=Na2CO3+H2O (3)碱 +盐=新碱+新盐
酸+金属氧化物==盐 +H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O CuO+H2SO4=CuSO4+H2O MgO+H2SO4=MgSO4+H2O K2O+H2SO4=K2SO4+H2O
复分解反应,生成物有水
非金属氧化物+水
CO2+H2O SO3+H2O
酸(含氧酸)
H2CO3 H2SO4
2H2O
复分解反应,生成物有水
酸 +盐=盐+酸
H2SO4+BaCl2=2HCl +BaSO4 ↓ HCl+AgNO3=HNO3 +AgCl↓
H2SO4+Na2CO3=Na2SO4+CO2↑+H2O
2HCl+CaCO3=CaCl2+CO2↑+H2O
复分解反应,生成物要有沉淀或
气体或水,但碳酸盐肯定能反应
