DS实验报告
韦氏成人智力测试实验报告

韦氏成人智力测试实验报告一.实验目的和要求➢目的:掌握韦氏成人智力测验的实施、记分及结果解释方法。
➢要求:本测验施测时一般注意事项与其他智力测试的要求相同。
测试应当在适宜的场所进行,要求光线适宜,安静无噪声,周围无人物图画,桌椅的大小高低恰当。
主试注意与被试的合作、建立融洽的关系。
以适当的信息让被试被试明确测验的任务。
严格按照施测程序和指导语施测。
二.实验内容和原理➢原理和内容智力(Intelligence)是指生物一般性的精神能力。
指人认识、理解客观事物并运用知识、经验等解决问题的能力,包括记忆、观察、想象、思考、判断等。
这个能力包括以下几点:理解、计划、解决问题, 抽象思维, 表达意念以及语言和学习的能力。
智力在狭窄的定义中是以智力测验来衡量(见智商)。
这些测验是最准确的(可靠及有效的)心智量度测验,但是它们不是用来量度创造力、个性、性格或智慧。
智力测验有很多方式,但全都是量度相同的智力。
韦氏成人智力量表(简称WAIS)由美国心理学家大卫.韦克斯勒编,1949年出版。
这是继比奈测验之后在世界上影响最大、应用最广泛的智力量表。
中国修订韦氏成人智力量表(WAIS-RC)是以WAIS为蓝本,保持原测验的结构,只对某些不适合中国文化背景的项目作了修改,并通过全国取样,制定了域、乡两套常模。
韦氏成人智力量表包括十一个分量表。
(言语量表六个:常识29项、理解14项、算术14项、相似13项、背数19项、词汇40项;操作量表五个:填图21项、积木10项、图法排列8项、数字符号90项、图形拼凑4项)。
➢关于测验分数和等级的说明:1.被测试者在本测验中的原始总分为11个分测验分数及其合,由于所有各个原始分数都是未经标准化的,因此不同测试者的原始分数之间的比较是没有意义的。
2.被测试者的量表分体现的是被测试者的实际智力水平在同龄人中所处的位置,量表分是经过标准化的,因此可以在同龄和不同龄的人之间直接进行比较。
3.被测试者的智力等级定性的说明了被测试者的智商水平。
ds区元素实验报告

ds区元素实验报告DS区元素实验报告导言:DS区(Discovered and Studied Zone)是指科学家们在研究中发现并深入研究的区域。
在这个实验报告中,我们将探索DS区中的元素,了解它们的性质和特点,以及它们在自然界和人类生活中的应用。
一、氢元素的探索和性质氢是宇宙中最常见的元素之一,它在地球上以气体的形式存在。
氢具有轻质、可燃、无色无味等特点,是一种非常重要的元素。
在实验中,我们通过电解水的方法制取氢气,并观察了氢气的燃烧现象。
氢气的燃烧产生的唯一产物是水,这使得氢成为一种清洁的能源选择。
二、氧元素的探索和性质氧是地球上最常见的元素之一,它占据了地球大气中的大部分。
氧是一种无色、无味、无臭的气体,对于维持生命至关重要。
在实验中,我们通过加热高锰酸钾制取氧气,并观察了氧气对燃烧的促进作用。
氧气是一种强烈的氧化剂,许多物质在氧气中能够燃烧。
此外,氧气还广泛应用于医疗、工业和冶金等领域。
三、碳元素的探索和性质碳是地球上最丰富的元素之一,它存在于各种有机物中。
碳具有多种形态,如石墨、金刚石等。
在实验中,我们通过加热蔗糖制取活性炭,并观察了活性炭对吸附的作用。
碳具有良好的导电性和热导性,因此被广泛应用于电池、电子产品和高温材料等领域。
四、铁元素的探索和性质铁是地球上最常见的金属元素之一,它广泛存在于地壳和岩石中。
铁具有良好的导电性和磁性,是一种重要的结构材料。
在实验中,我们通过还原铁矿石制取铁,并观察了铁的磁性。
铁在建筑、交通工具和机械制造等领域有着广泛的应用。
五、硫元素的探索和性质硫是地球上一种常见的非金属元素,它存在于地壳、水体和生物体中。
硫具有黄色,有刺激性的气味,以及较低的熔点和沸点。
在实验中,我们通过加热硫磺制取硫酸,观察了硫酸的酸性反应。
硫在化学工业、农业和医药领域有着广泛的应用。
结论:通过对DS区中的元素进行实验探索,我们深入了解了它们的性质和特点,以及它们在自然界和人类生活中的应用。
ds实验报告4

实验报告格式要求 实验报告 班级______________姓名_______________学号_______________ 一、实验四:拓扑排序------打印输出计算机本科专业4年每学期的课表 二、实验的目的和要求: 1.采用C++实现; 2.熟练掌握图的应用; 3.熟练掌握图的邻接表存储结构以及拓扑排序的基本思想。 4.上机调试程序,掌握查错、排错使程序能正确运行。 三、实验的环境:指硬件和软件环境 1.硬件环境: 2.软件环环境:包括操作系统,编译系统的版本的特点,编辑软件特点等。 四、算法描述:可用特殊符号加自然语言或算法框图(程序流程图、PAD图 等)或伪语言(like C++)。 五、源程序清单: 六、运行结果: 七、实验运行情况分析(包括算法、运行结果、运行环ห้องสมุดไป่ตู้等问题的讨论)。 ▲要求:实验报告的所有内容一律用计算机打印,拒收手写报告。
四川大学计算机学院
学生实验报告
实验名称: 指导教师: 姓名: 学号: 班级: 日期:
实验报告格式要求 实验报告
班级______________姓名_______________学号_________
一、实验号题目: 二、实验的目的和要求: 三、实验的环境: 四、算法描述: 五、源程序清单: 六、运行结果: 七、实验运行情况分析(包括算法、运行结果、 运行环境等问题的讨论)。 ▲要求:实验报告的所有内容一律用计算机打 印,拒收手写报告。
无机化学实验报告-D

无机化学实验报告-DS区元素实验11 ds 区元素(铜、银、锌、镉、汞)的性质一、实验目的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的生成和性质; 6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理IB IIBCu Zn Cu (+2,+1) Zn(+2) Ag Cd Ag (+1) Cd(+2) Au Hg Au (+1,+3) Hg(+2,+1) 蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO 。
AgOH 在常温下极易脱水而转化为棕色的Ag 2O 。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg 2O(I)。
易形成配合物是这两副族的特性,Cu 2+、Ag +、Zn 2+、Cd 2+与过量的氨水反应时分别生成[Cu(NH 3)4]2+、[Ag(NH 3)2]+、[Zn(NH 3)4]2+、[Cd(NH 3)4]2+。
但是Hg 2+和Hg 22+与过量氨水反应时,如果没有大量的NH 4+存在,并不生成氨配离子。
如:HgCl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ 2 NH 4Cl Hg 2Cl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ Hg↓黑+NH 4Cl(观察为灰色)Cu 2+具有氧化性,与I -反应,产物不是CuI 2,而是白色的CuI :Cu2++ I - = 2CuI↓白 + I 2将CuCl 2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl 2]-的溶液。
将溶液稀释,得白色CuCl 沉淀:Cu + Cu2++ 4Cl - = 2[CuCl 2]-[CuCl 2]-←稀释→CuCl↓白 + Cl -卤化银难溶于水,但可利用形成配合物而使之溶解。
例如:AgCl + 2NH 3 = [Ag(NH 3)2]++ Cl -红色HgI 2难溶于水,但易溶于过量KI 中,形成四碘合汞(II)配离子:HgI 2 + 2I -= [HgI 4]2-黄绿色Hg 2I 2与过量KI 反应时,发生歧化反应,生成[HgI 4]2-和Hg :Hg 2I 2+ 2I - = [HgI 4]2-+ Hg↓黑三、实验内容 1、氧化物的生成和性质(1) C u 2O 的生成和性质Cu 2+ + 2OH - =Cu(OH)2↓ 蓝色 Cu(OH)2 + 2OH - = [Cu(OH)4]-2- 蓝色2[Cu(OH)4]2-+ C 6H 12O 6 (葡萄糖) =Cu 2O↓(红) + 4OH -+C 16H 12O 7+2H 2O或:2Cu 2+ + 5OH - +C 6H 12O 6 = Cu 2O↓+ C 6H 11O 7- + 3H 2O (须加热)分析化学上利用此反应测定醛,医学上利用此反应检查糖尿病。
ds区元素化合物的性质实验报告

ds区元素化合物的性质实验报告实验目的:通过实验,探究DS区元素化合物的性质,理解其化学性质和物理性质。
实验原理:DS区元素化合物是指以硫、硒、碲为主元素所形成的化合物。
DS区元素具有典型的金属和非金属的特征,同时也具有一定的半导体特性。
DS区元素化合物的性质与其化学键的性质密切相关。
硫化物中的硫原子具有六个孤对电子,形成-2 价离子和两性离子;碲化物中的碲原子具有四个孤对电子,形成 +2 价离子和 -2 价离子;硒化物中的硒原子则可以彩蝶为+2 价或-2 价离子,也可以形成六配位的复合离子。
实验步骤:1、实验前准备将所需的DS区元素化合物样品称取好,准备好所需的实验设备和试剂。
2、测量熔点取一定量的DS区元素化合物样品,放入实验室专用的熔融点测定仪中,升温至样品融化,记录下样品的熔点。
3、测量电导率将一定量的DS区元素化合物样品溶解在水中,用电导仪测定其电导率。
记录下测得的电导率值。
4、测量硬度取一定量的DS区元素化合物样品,用硬度仪进行硬度测量。
记录下所测得的硬度值。
实验结果:以硫、碲、硒为主元素所形成的DS区元素化合物,其熔点各不相同。
这些化合物一般都是固体,不易溶于水,但它们的电导性却存在一定的差异。
硫化物具有较佳的电导性,碲化物的电导性极低,而硒化物的电导性介于它们之间。
此外,不同的DS区元素化合物具有不同的硬度。
硫化物比较硬,碲化物则相对较软。
硒化物的硬度介于它们之间。
实验结论:DS区元素化合物具有一定的半导体特性,其电导性能与硫、碲、硒之间的化学键种类密切相关。
DS区元素化合物的物理性质也各有不同,其硬度值与其它硫族元素化合物差别不大。
DS区元素化合物的性质实验结果为我们深入了解这类元素化合物提供了具体的实验数据支持。
实验:ds 区元素

实验二十:ds区金属(铜、银、锌、镉、汞)〔实验目的〕1.了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性;2.掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件;3.试验并熟悉铜、银、锌、镉、汞的配位能力,以及Hg22+和Hg2+的转化。
〔实验原理〕铜族元素包括铜、银、金,位于周期表ⅠB族;锌族元素包括锌、镉、汞,位于周期表ⅡB 族。
由于铜、锌族元素价电子层构型为(n-1)d10ns1、(n-1)d10ns2,都属ds区,故一并进行讨论。
一、铜族元素已知铜族元素价电子构型为(n-1)d10ns1,铜族元素原子不仅可以失去ns电子,也可进一步失去部分d电子。
因此铜族元素都有+1、+2、+3三种氧化态。
但由于其稳定性不同,铜常见的氧化态为+2,银为+1,金为+3。
1.铜的化合物①Cu(Ⅰ)的化合物:Cu(Ⅰ)的化合物在固态晨稳定性高于Cu(Ⅱ),但在溶液中容易被氧化为Cu(Ⅱ)。
Cu溶液为无色。
几乎所有的Cu(Ⅰ)化合物都难溶于水,其溶解度顺序为:CuCl>CuBr>CuI>CuSCN>CuCN>Cu2S物质颜色溶解性化学性质Cu2O 红色不溶于水。
弱碱性;对热稳定。
CuOH 黄色或橙色不溶于水。
不稳定,生成后立即分解为Cu2O。
CuX 白色CuCl、CuBr、CuI都不溶于水,溶解度按顺序降低Cu2+ + 2Cl- + Cu = 2CuCl→H[CuCl2] CuCl + CO + HCl → Cu(CO)Cl5H2OCu2S 黑色在盐Cu(Ⅰ)中是最小的3Cu2S+16HNO3(浓)=6Cu(NO3)2+4NO+8H2O+3SCu2S + 4CN- = 2[Cu(CN)2]-+ S2-配合物无色溶于水,由于为d10型离子,因此一般为无色。
[Cu(NH3)2]+ + O2→[Cu(NH3)4]+ [Cu(NH3)2]+ + CO → [Cu(NH3)2(CO)]+②Cu(Ⅱ)的化合物:Cu(Ⅱ)为d9构型,它的化合物或配合物因Cu2+可发生d-d跃迁而呈现颜色。
无机化学实验报告

无机化学实验报告以下是给大家整理收集的无机化学实验报告,仅供参考。
无机化学实验报告1Ds区元素(铜、银、锌、镉、汞)【学习目标】认知目标:把握铜、银、锌、镉、汞的氢氧化物或氧化物的酸碱性,硫化物的溶解性及配位性。
技能目标:把握Cu+ \ Cu2+及Hg22+\ Hg2+相互转化条件,正确使用汞;思想目标:培养学生观察现象、思考题目的能力。
【教学安排】一课时安排:3课时二实验要点:1、铜、银、锌、镉、汞氢氧化物或氧化物的天生和性质;2、锌、镉、汞硫化物的天生和性质;3、铜、银、锌、汞的配合物;4、铜、银、汞的氧化还原性。
【重点、难点】Cu+ \ Cu2+及Hg22+\ Hg2+相互转化条件;这些元素的氢氧化物或氧化物的酸碱性,硫化物的溶解性及配位性。
【教学方法】实验指导、演示、启发【实验指导】一、铜、银、锌、镉、汞氢氧化物或氧化物的天生和性质1、铜、锌、镉操纵:0.5mL 0.2 mol;L-1MSO4;2 mol;L-1NaOH;; ;2 mol;L-1H2SO4; ;;2 mol;L-1 NaOH指导:离子Cu2+实验现象H2SO4NaOH溶解释及原理Cu2+ +OH-=Cu(OH)2; Cu(OH)2+2H+=Cu2++2H2O Cu(OH)2++OH-=[Cu(OH)4]2-Zn2+ +OH-=Zn(OH)2;方程式同上溶溶浅蓝; 溶Zn2+Cd2+结论白; 白; 溶不溶Cd2+ +OH-=Cd(OH)2; Zn(OH)2、Cu(OH)2具有两性,以碱性为主,能溶于浓的强碱中天生四羟基合M(Ⅱ)酸根配离子。
Cd(OH)2碱性比Zn(OH)2强,仅能缓慢溶于热浓强碱。
2、银、汞氧化物的天生和性质操纵::0.5 mL 0.1 mol;L-1 AgNO3 ;2 mol;L-1NaOH;;;+ 2 mol;L-1HNO3(2 mol;L-1 NH3;H2O):0.5 mL 0.2 mol;L-1 Hg(NO3)2 ; 2 mol;L-1NaOH;;;+ 2 mol;L-1HNO3(40% NaOH) 指导:离子实验现象解释及原理Ag+Ag2O褐;HNO3溶溶无色氨水溶NaOH 不溶Ag2O+ 4NH3 + H2O =2Ag(NH3)2+ +2OHHgO + 2H+=Hg2+ +H2O-Hg2+HgO 黄;结论AgOH、Hg(OH)2沉淀极不稳定,脱水天生成碱性的Ag2O、HgO。
ds实验报告3

5 3 1 2 2 3
6 3
7
2 3
1
合并3和3
排序
11
7
11 5 6 3 1 2 3 3
5
2 3 3
6
3
7
2
1 2
合并5和6
排序
(2) 构造Huffman树: 右分枝标1:
18 7 11
(3) 在左分枝标0,
0 7
A
18 0
1 11
1 0 3
5
2 1 3 2 3
6
3
F 0
0 2
5
1 3
6
1
D
1T 2
实验报告格式要求 实验报告 班级______________姓名_______________学 号_______________ 一、实验三:Huffman编码(二叉树应用) 二、实验的目的和要求: 1.要求对文件进行Huffman编码的算法,以及对 乙编码文件进行解码的算法,为简单起见,可 以假设文件是存放在一个字符向量; 2.熟练掌握二叉树的应用;具体要求如下:
E
1 3
R
合并7和11
(4) 确定Huffman编码:
Huffman树
字符 频度 编码
A 7 0
D E F 1 2 2 1010 1011 100
T 3 110
R 3 111
特点:任一编码不是其它编码的前缀
0 7
18 0
1 11
如何译码? 5
0 2
A
1
0 3 6 1 3
R
F 0
1 3
1
1T 2
D E Huffman树来自
.最小冗余码/哈夫曼码 ● ASCII码/定长码
无机化学实验第四版实验二十一:ds区金属(铜,银,锌,镉,汞)
实验名称:ds区金属(铜,银,锌,镉,汞)实验日期:温度:气压:
一、实验目的
1.了解铜,银,锌,镉,汞氢氧化物或氧化物的酸碱性,硫化物的溶解性;
2.掌握铜(1+)和铜(2+)重要化合物的性质及相互转化条件;
3.试验并熟悉铜,银,锌,镉,汞的配位能力,以及Hg22+和Hg2+的转化。
二、实验内容
1.铜,银,锌,镉,汞氢氧化物或氧化物的生成和性质
1)铜,锌,镉氢氧化物的生成和性质
2)银,汞氧化物的生成和性质
a.氧化银的生成和性质
b.氧化汞的生成和性质
2.锌,镉硫化物的生成和性质
根据实验现象并查阅有关数据,填充下表,并对铜,银,锌,镉,汞硫化物的溶解情况作出结论,并写出有关反应方程式。
3.铜,银,锌,汞的配合物1)氨合物的生成
2)汞配合物的生成和性质
4.铜,银,汞的氧化还原性1)氧化亚铜的生成和性质
2)氯化亚铜的生成和性质
3)碘化亚铜的生成和性质
4)汞(2+)和汞(1+)的相互转化
a.Hg2+的氧化性+转化为Hg22+和Hg2+的歧化反解。
实验二十一ds区金属

实验二十一ds区金属一、实验目的1、掌握铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性;2、掌握Cu (Ⅰ)、Cu (Ⅱ)重要化合物的性质及相互转化条件;3、试验铜、银、锌、镉、汞的配位能力以及亚汞离子和汞离子的转化。
二、实验内容(一)、铜、银、锌、镉、汞氢氧化物或氧化物的生成和性质:1 、铜、锌、镉氢氧化物的生成和性质(1)Ag2O的生成和性质:Ag++OH-===AgOH↓白色→Ag2O+H2OAg2O+2HNO3===2AgNO3+H2OAg2O+2NH3.H2O==2[Ag(NH3)2]++2OH-+H2OAg2O微溶于水,溶液呈微碱性。
它的△f H m﹩很小,不稳定,加热易分解,具有氧化性。
(2)HgO的生成和性质Hg2++2OH-==Hg(OH)2==HgO↓+H2OHgO+2HNO3==Hg(NO3)2+H2OHgO+NaOH(40℅)-----不溶HgO 有黄色和红色变体,结构相同,颜色差别完全是由于其颗粒的大小不同所致,黄色HgO晶粒较细小,红色颗粒较大。
(二)、铜、银、锌、镉、汞硫化物的生成和溶解说明:1.生成的CdS中,个别学生得到的沉淀是黄色中夹有白色沉淀,有可能是CdS晶形不一样,或有可能是生成Cd(OH)2白色沉淀。
补充:CdS沉淀颜色变化与溶液的酸度及温度有很大关系。
在冷氨性、中性或弱酸性溶液中,其沉淀为淡黄;若H+浓度增大,则沉淀将加变为深黄色。
2.在Hg(NO3)2中加入Na2S,开始生成白色沉淀,再加Na2S后变黑。
对白色沉淀再加热也不会再变化。
个别学生得到白中带有黄色的沉淀。
在中性或酸性汞盐溶液中加入S2-,即首先形成一个白色的复合物(HgCl2·2HgS):3Hg2++2Cl-+2S2-====HgCl2·2HgS若再加S2-,则白色沉淀→ 黄色→ 棕色→ 黑色:2HgCl·2HgS+S2-====3HgS+2Cl-此沉淀不溶与其它,只溶于王水、Na2S。
无机化学实验报告-ds区元素

无机化学实验报告-ds区元素实验名称:ds区元素实验实验目的:通过实验了解ds区元素的性质,并掌握ds区元素的化学反应。
实验步骤:1. 实验前准备:取出实验器材和试剂,清洗干净。
2. 实验1:铑(Rh)和铱(Ir)颜色对比实验。
将Rh和Ir放在白纸上比较颜色的不同。
Rh呈现银白色,而Ir呈现黄色,可以清晰地区分这两种元素。
先将Rh粉磨成粉末状,并称取一定量的Rh,加入200毫升的盐酸中。
在加热的过程中,观察Rh在盐酸中的反应。
Rh在盐酸中反应,生成RhCl3的无色溶液,并放出氢气。
反应方程式:2Rh + 6HCl → 2RhCl3 + 3H2。
4. 实验3:铱(Ir)的化学反应实验。
将Ir和硫在空气中加热时,会发生强烈的反应,生成黑色的IrS2。
IrS2是一种比较稳定的化合物,可以在空气中保存。
反应方程式:2Ir + 3S → IrS2。
实验结果及分析:通过这些实验,我们可以发现ds区元素的某些性质和化学反应式。
Rh和Ir颜色的对比实验,让我们比较容易地区分这两种元素。
在Rh的化学反应实验中,我们可以清晰地看到Rh粉末加入盐酸中反应时,生成RhCl3的无色溶液,同时放出氢气。
而在Ir的实验中,我们可以发现,在空气中加热Ir和硫时,会形成黑色的IrS2,是一种比较稳定的化合物,可以在空气中保存。
结论:通过本次实验,我们了解了ds区元素的某些性质和化学反应式,学会了如何区分Rh和Ir的颜色差别,并掌握了Rh和Ir的化学反应过程。
同时,通过实验过程中的观察和分析,将理论知识和实际操作紧密结合起来,有助于更好地理解和掌握相关科学知识。
ds实验报告1.

构造函数
构造函数可以有多个吗 class array { public: array(); array( int value); void input(); int getmax(); void print(); private: int a[3]; int max; };
什么是构造函数
– 作用 完成对象的初始化 – 语法 class_name (参数) { 语句; }
构造函数
class array { public: array(); void input(); int getmax(); void print(); private: int a[3]; int max; };
I/O流类列表
类 名 包含文件
ios iostream.h istream
说 明
流的抽象基类 通用输入流类和 其他输入流的基类 输入文件流类 输出文件流类 通用输入/输出流类和 其他输入/输出流的基类 输入/输出文件流类 fstream.h fstream.h fstream.h
iostream.h
实验报告格式要求
实验报告 班级______________姓名_______________学号_______________ 一、实验一:A Text Editor Imlementation 二、实验的目的和要求: 1.采用C++的ASCII码文件和串函数实现; 2.熟练掌握串运算的应用; 3.熟练掌握计算机系统的基本操作方法,了解如何编辑、编译、链接和运 行一个C++程序; 4.上机调试程序,掌握查错、排错使程序能正确运行。 三、实验的环境:指硬件和软件环境 1.硬件环境: 2.软件环环境:包括操作系统,编译系统的版本的特点,编辑软件特点等。 四、算法描述:可用特殊符号加自然语言或算法框图(程序流程图、PAD图 等)或伪语言(like C++)。 五、源程序清单: 六、运行结果: 七、实验运行情况分析(包括算法、运行结果、运行环境等问题的讨论)。 ▲要求:实验报告的所有内容一律用计算机打印,拒收手写报告。
ds区

② +0.1 mo1〃L1 Hg2(NO3)2+ 2.0 mo1〃L1 NaOH
观察现象 (黑色↓)
沉淀+2mol〃L-1HNO3 沉淀+过量40%NaOH 观察现象 (无色溶液) 观察现象 (不溶解)
反应方程式:
HgO+2H+ = Hg2+ + H2O HgO+OH- 不反应 Hg22+ +2OH- =H2O+ Hg2O Hg2O →HgO +Hg 黑 HgO+2HNO3= Hg(NO3)2+ H2O 3Hg+8HNO3=3Hg(NO3)2+2NO↑+4H2O
6.0),H2S(饱和),CuSO4(0.1,0.2),CuCl2(1.0),
AgNO3(0.1),Cd(NO3)2(0.1),Hg(NO3)2(0.1), Hg2(NO3)2(0.1),Zn(NO3)2(0.1,0.5),KI(0.1,饱和), K4[Fe(CN)6](0.1),Na2S2O3(0.2),SnCl2(0.1),Na2S(0.1), FeCl3(0.1),Cu(NO3)2(0.1),NH4Cl(0.1),H2O2(3%),甲
Cu2+、Ag+、Zn2+、Cd2+、Hg2+、与NaOH反应的产物 及产物的酸碱性。
Cu2+ Ag+ Zn2+ Cd2+ Hg2+ Cu(OH)2 ↓(浅蓝) 2Ag(OH)↓(白) Zn(OH)2↓ (白色) Cd (OH)2↓(白色) HgO+Hg 两性偏碱 碱性 两性 两性偏碱 碱性
2. 铜、银、锌、镉、汞盐和氨水的反应
5滴01mo1l20滴01mo1lki观察现象黄菊黄继续4滴02mo1l观察现象菊黄白色溶解沉淀上滴加饱和ki观察现象沉淀溶解22滴01mo1l1滴01mo1lki观察现象桔红或金红色继续过量ki溶液观察现象溶解呈无色溶液上述溶液中再加几滴40naoh溶液即为奈斯勒试剂1滴nhcl观察现象红棕色3小试管中13水2滴01mo1lki先将ki稀释1滴01mo1l观察现象瞬间可看到黄绿色或灰绿色再过量ki离心后观察现象溶解呈无色溶液hg10mo1l5滴01moll1cdno01moll1ki观察现象淡黄ki过量观察现象呈无色溶液反应方程式
DS_上机实验的目的、要求和评分标准

DS_上机实验的目的、要求和评分标准第一篇:DS_上机实验的目的、要求和评分标准上机实验的目的、要求和评分标准一、实验目的上机实践是各位对本门课程所学知识的一种全面、综合的能力训练,是与课堂听讲、自学和练习相辅相成的必不可少的一个教学环节,也是对课堂教学与实践教学效果的一种检验。
通常,实验题中的问题比平时的习题复杂得多,也更接近实际。
实验着眼于原理与应用的结合,使你们学会如何把书上学到的知识运用于解决实际问题的过程中去,培养从事软件开发设计工作所必需的基本技能;另一方面,能使书上的知识变“活”,起到深化理解和灵活掌握教学内容的目的。
平时的练习较偏重于如何编写功能单一的“小”算法,而实验题是软件设计的综合训练,包括问题分析(需求分析)、总体结构设计和用户界面设计(概要设计)、程序设计基本技能和技巧等,即一整套软件工程规范的训练和科学作风的培养。
此外,还有很重要的一点是:机器是比任何教师都严厉的主考者。
为了达到上述目的,本课程共安排了10个实验单元,各单元的训练重点在于基本的数据结构,而不强调面面俱到。
各实验单元与教科书的各章具有紧密的对应关系。
二、要求:⒈ 做好每一次上机前的准备以提高上机效率:① 预先认真阅读相关实验内容,做到心中有明确的目的要求和任务,要有备而来,应该自己独立的思考和设计你的算法和程序,并争取在规定的时间内如期完成上机工作任务。
对于个别目前基础较差的同学,实在是没法完成任务的建议你先参考其他同学的算法,勤学好问,最终自己独立完成,以增强你的感性认识,强化你的实践基础,提高你的实践能力。
② 按照实验内容规定的习题题目,事先在实验预习报告上编写好源程序及运行程序所需的典型数据,并经人工静态检查认为无误;手编程序应书写整齐,应在每个题目之间留出一定的空间,以备记录上机调试情况和运行结果等;对程序中自己有疑问的地方,应作出记号,以便上机时给以注意。
③ 将想要上机验证的问题草拟提纲;制定一个简捷的程序调试计划。
无机化学实验报告-DS区元素

⽆机化学实验报告-DS区元素实验11 ds 区元素(铜、银、锌、镉、汞)的性质⼀、实验⽬的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的⽣成和性质; 6、掌握铜、银、锌、汞离⼦的分离与鉴定⽅法。
⼆、实验原理IB IIBCu Zn Cu (+2,+1) Zn(+2) Ag Cd Ag (+1) Cd(+2) Au Hg Au (+1,+3) Hg(+2,+1)蓝⾊的Cu(OH)2呈现两性,在加热时易脱⽔⽽分解为⿊⾊的CuO 。
AgOH 在常温下极易脱⽔⽽转化为棕⾊的Ag 2O 。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱⽔⽽转变为黄⾊的HgO(II)和⿊⾊的Hg 2O(I)。
易形成配合物是这两副族的特性,Cu 2+、Ag +、Zn 2+、Cd 2+与过量的氨⽔反应时分别⽣成[Cu(NH 3)4]2+、[Ag(NH 3)2]+、[Zn(NH 3)4]2+、[Cd(NH 3)4]2+。
但是Hg 2+和Hg 22+与过量氨⽔反应时,如果没有⼤量的NH 4+存在,并不⽣成氨配离⼦。
如:HgCl 2 + 2NH 3 = Hg(NH 2)Cl↓⽩+ 2 NH 4Cl Hg 2Cl 2 + 2NH 3 = Hg(NH 2)Cl↓⽩+ Hg↓⿊+NH 4Cl(观察为灰⾊)Cu 2+具有氧化性,与I -反应,产物不是CuI 2,⽽是⽩⾊的CuI :Cu2+ +I- =2CuI↓⽩+I2将CuCl2溶液与铜屑混合,加⼊浓盐酸,加热可得黄褐⾊[CuCl2]-的溶液。
将溶液稀释,得⽩⾊CuCl沉淀:Cu +Cu2+ +4Cl-=2[CuCl2]-[CuCl2]-←稀释→CuCl↓⽩+Cl-卤化银难溶于⽔,但可利⽤形成配合物⽽使之溶解。
例如:AgCl +2NH3 =[Ag(NH)2]+ +Cl-红⾊HgI2难溶于⽔,但易溶于过量KI中,形成四碘合汞(II)配离⼦:HgI2 +2I- =[HgI4]2-黄绿⾊Hg2I2与过量KI反应时,发⽣歧化反应,⽣成[HgI4]2-和Hg:Hg2I2+2I- =[HgI4]2-+Hg↓⿊三、实验内容1、氧化物的⽣成和性质(1)Cu2O的⽣成和性质Cu2++2OH-=Cu(OH)2↓蓝⾊Cu(OH)2+2OH- = [Cu(OH)4]-2-蓝⾊2[Cu(OH)4]2-+C6H12O6(葡萄糖) =Cu2O↓(红) +4OH-+C16H12O7+2H2O或:2Cu2+ + 5OH- +C6H12O6 = Cu2O↓+ C6H11O7- + 3H2O (须加热)分析化学上利⽤此反应测定醛,医学上利⽤此反应检查糖尿病。
实验十d区、ds区重要化合物的性质

实验十 d 区、ds 区重要化合物的性质【实验目的】1. 掌握Cu 2+ 、Ag + 的重要化合物的性质。
2. 掌握Cu(Ⅰ)和Cu(Ⅱ)等重要化合物的性质及相互转化的条件。
3. 熟练掌握混合离子的分离以及Cu 2+ 、Ag + 的鉴定。
【实验原理】CuSO 4·5H 2O 和3AgNO 是铜和银的重要可溶性盐。
2Cu(OH)是淡蓝色两性偏碱的氢氧化物,它溶解于较浓的NaOH (6 mol·L -1)中,受热分解成黑色的CuO 。
224Cu(OH)2OH [Cu(OH)]--+→(淡蓝色)O H CuO OH Cu ℃290802)(+−−→−-AgOH 是碱性氢氧化物,很不稳定,只有在- 45℃下才能存在。
常温下Ag +与NaOH 反应只能生成褐色2Ag O 。
它能溶于硝酸和氨水,后一反应的离子方程式为:23232Ag O 4NH H O 2[Ag(NH )]2OH +-++→+2Cu +具有一定的氧化性,与还原性较强的I -反应生成白色的CuI 和2I 。
222Cu 4I 2CuI I +-+→↓+2Cu +不能将Cl -氧化,但在较浓盐酸中,2Cu +与金属铜反应可生成黄色的2[CuCl ]-。
在此反应中,Cu 是还原剂(H )22Cu Cu 4Cl 2[CuCl ]++--++−−−→ 在碱性溶液中,2Cu +能氧化醛或糖类,生成暗红色的2Cu O :O H OH O H C O Cu O H C OH Cu 27116261262433])([2+++↓−→−+--∆-葡萄糖酸根葡萄糖Ag +的氧化性较强,其典型实例是银镜反应,32[Ag(NH )]+也可将醛或糖类氧化,本身被还原为金属银:OH NH Ag HCOO OH HCHO NH Ag 23232423])([2++↓+→++--+ 2Cu +、Ag +均能与3NH 形成氨合物。
4CuSO 与适量氨水反应生成浅蓝色的碱式硫酸铜,氨水过量则生成深蓝色的234[Cu(NH )]+:+-++↓→⋅++4422232422)(22NH SO OH Cu O H NH SO Cu22224343442Cu (OH)SO 6NH 2NH 2[Cu(NH )]SO 2H O ++-++→++Ag +与少量的氨水反应可生成褐色的2Ag O ,继续加氨水,2Ag O 溶于氨水生成32[Ag(NH )]+。
实验七ds区金属铜、银、锌、镉汞
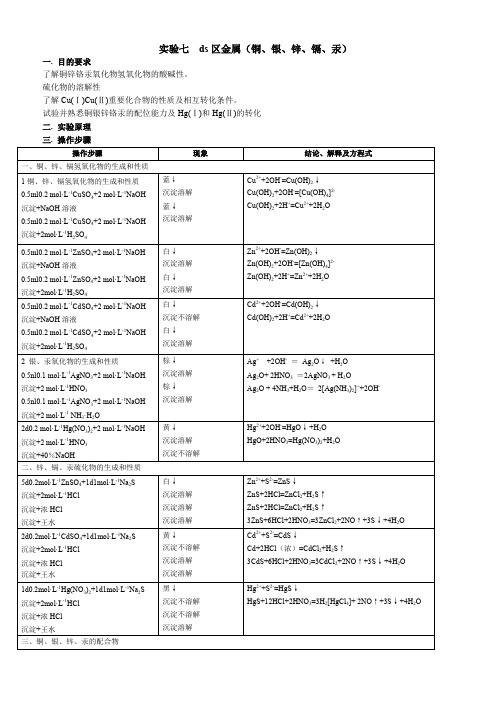
蓝↓
沉淀溶解
2Cu2++SO +2NH3·H2O= Cu2(OH)2SO4↓+2NH
Cu2(OH)2SO4+6NH3+2 NH = 2[Cu(NH3)4]2-+SO +2H2O
0.5ml0.2mol·L-1AgNO3+2mol·L-1NH3·H2O
沉淀+2mol·L-1NH3·H2O
Ag2O+4NH3+H2O=2[Ag(NH3)2]++2OH-
2d0.2mol·L-1Hg(NO3)2+2mol·L-1NaOH
沉淀+2mol·L-1HNO3
沉淀+40%NaOH
黄↓
沉淀溶解
沉淀不溶解
Hg2++2OH-=HgO↓+H2O
HgO+2HNO3=Hg(NO3)2+H2O
二、锌、镉、汞硫化物的生成和性质
2.氯化亚铜的生成和性质
5ml0.5mol·L-1CuCl2+1.5ml浓HCl+少量铜屑,加热至沸腾出现棕色溶液+50m水
沉淀+2ml浓NH3·H2O
沉淀+2ml浓HCl
棕色溶液 白↓
白↓ 无色溶液 蓝色溶液
白↓ 棕色溶液
CuCl2+Cu+4HCl 2[CuCl2]-+4H+
[CuCl2]-+H2O=CuCl↓+Cl-
+过量0.2mol·L-1SnCl2
白↓
黑↓
Hg(NO3)2+ SnCl2+2Cl-=Hg2Cl2↓+[SnCl6]2-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《算法与数据结构》实验报告
实验一约瑟夫环问题(2学时)
将编号为1,2,…,n的n个人按顺时针方向围坐一圈,每人持有一个密码(正整数)。
一开始任选一个正整数作为报数上限值m,从第一个开始按顺时针方向自1开始报数,报到m时停止报数。
报m的人出列,从他在顺时针方向上的下一个人开始重新从1报数,如此下去,直至所有人全部出列为止。
试设计一个程序求出出列顺序。
实验二链表的操作(4学时)
编一程序:①建立一个数据域为1至10的带头结点的链表;
②将此链表就地逆转。
链表的类型说明如下:
#include <iostream.h>
#include <stdlib.h>
class Node{
public:
int data;
Node *next;
Node( ){next=0;}
friend class LinkList;
};//Node
class LinkList {
Node *head;
public:
LinkList( ) { head=new Node(); }
void Create(); //创建长度为n的单链表
int GetElem(int i); //返回第i个元素值
Node* Locate(int e); //返回第一个与e匹配的元素结点指针
bool IsEmpty( ) {return (head->next==0);} //判断是否为空链表
void Insert(int x, int i ); //在第i个结点之前插入元素值为x的结点
int Delete ( int i ); //删除第i个结点,并返回其元素值
void Clear( ); //清空链表
void print( );
};// LinkList
实验三栈的应用-中缀表达式的求值(4学时)
表达式求值是计算机实现程序设计语言中的基本问题之一,也是栈应用的一个典型例子,通过本实验,对输入的一个表达式进行求值。
说明:表达式中只包含+、-、×、/ 运算及(和)。
)操作数为0~9之间的一位的数。
实验四二叉树的遍历(6学时)
树和二叉树是最常用的非线性结构(树型结构),其中以二叉树最为常见,本实验题要求实现二叉树的最基本操作,其中遍历二叉树是二叉树各种操作的基础。
实验五图的遍历(6学时)
建立一个图,然后用深度优先或广度优先的方式对其进行遍历。
实验六图的应用(6学时)
如要在n个城市之间建设通信网络,只需架设n-1条线路即可。
如何以最低的经济代价建设这个通信网,是求一个无向网的最小生成树问题。
利用Prim算法求无向网的最小生成树。
实验八实现排序和查找操作(6学时)
排序方法选择方案:
第一组:直接插入和希尔排序;第二组:冒泡排序和快速排序;
第三组:简单选择排序和堆排序;
每位同学至少选择一组排序算法进行实现;然后再使用顺序查找和折半查找算法分别对待排序
数据序列和已排序数据序列进行查找,即现实其查找算法。
实验九链表综合算法设计-集合运算(6学时)
有两个集合A、B,要求它的交集、并集和差集C。
用两个链表L1、L2存储集合A、B,用链表L3存储集合C。
实验十将中缀表达式转换为后缀表达式并进行计算(6学时)
中缀表达式是最普通的一种书写表达式的方式,而后缀表达式不需要用括号来表示,计算机可简化对后缀表达式的计算过程,而该过程又是栈的一个典型应用。
