205试剂、试液标签
化验室药品试剂标签

品名:浓度:
配置人:管理人:
配制日期:有效日期:
存储条件:
使用要求:
普洱永吉生物技术有限责任公司
品名:浓度:
配置人:管理人:
配制日期:有效日期:
存储条件:
使用要求:
普洱永吉生物技术有限责任公司
品名:浓度:
配置人:管理人:
配制日期:有效日期:
存储条件:
使用要求:
普洱永吉生物技术有限责任公司
配置人:管理人:
配制日期:有效日期:
存储条件:
使用要求:
普洱永吉生物技术有限责任公司
品名:浓度:
配置人:管理人:
配制日期:有效日期:
存储条件:
使用要求:
普洱永吉生物技术有限责任公司
品名:浓度:
配置人:管理人:
配制日期:有效日期:
存储条件:
使用要求:
普洱永吉生物技术有限责任公司
品名:浓度:
配置人:管理人:
配制日期:有效日期:
存储条件:
使用要求:
品名:浓度:
配置人:管理人:
配制日期:有效日期:
存储条件:
使用要求:
普洱永吉生物技术有限责任公司
品名:浓度:
配置人:管理人:
配制日期:有效日期:
存储条件:
使用要求:
普洱永吉生物技术有限责任公司
品名:浓度:
配置人:管理人:
配制日期:有效日期:
存储条件:
使用要求:
普洱永吉生物技术有限责任公司
品名:浓度:
试剂试药试液的管理规程

标准操作规程目的:建立化验室化学试剂配制管理规程,保证检验工作的质量。
范围:适用于QC。
责任者:QC化验员、QC主任。
规程:1. 本规程试剂、试药及试液尚包括指示剂(指示液)及缓冲液。
2. 一般的化学试剂分为基准试剂、优级纯、分析纯、化学纯4个等级试剂,选用时候应参考以下原则:A.标定滴定液用基准试剂;B.制备滴定液,可采用分析纯或化学纯试剂,但不经标定直接称重计算浓度者,则应采用基准试剂;C.制备杂质限度检查用的标准溶液,采用优级纯或分析纯试剂;D.制备试液、缓冲液等可采用分析纯或化学纯试剂。
3. 试液(包括指示剂、指示液、缓冲液)的配制。
. 试液的配制应按批准的书面规程进行,尚未有书面规程的应按照《中国药典》附录中的要求配制。
. 建立“试剂配制记录”,由配制人员在操作过程中逐项填写。
内容包括:(1). 配制试剂名称、浓度、配制总量、配制日期、使用截止日期。
(2). 配制试剂配比。
(3). 所用试剂级别、浓度、pH值。
(4). 配制方法、加入顺序。
(5). 配制溶液及必要的处理。
(6). 配制者签名、复核者签名。
(7). 指示液、指示剂的配制填写“指示剂配制记录”(R-QC-020-01)。
. 配制人员在配制前首先检查所领试剂、试药与该试剂配制规程的一致性,瓶签完好,试剂外观符合要求,在规定的使用期内,方可进行配制。
标准操作规程. 试剂的恒重:固体化学试剂在贮存中易吸潮而增加重量,故配制时需恒重。
恒重除另有规定外,系指供试品连续两次干燥或炽灼后的重量差异在以下的重量。
干燥至恒重的第二次及以后的各次称重均应在规定的条件下继续干燥1小时后进行;炽灼至恒重的第二次称重应在继续炽灼30分钟后进行。
. 称重:称重是决定所配试剂准确性的关键步骤,必须准确无误。
. 配制时所用操作器具必须洁净、无痕迹,最好选用一等品容量瓶、一等品吸管配制和稀释。
. 严格按配制操作规程进行,实验操作符合规定要求。
. 按一定使用周期配制试剂,不要多配。
化验室各种试剂、对照品和培养基标签

JL-ZL-QC-050-00
试剂配制标签
名称/浓度:
配制人:
复核人:
配制日期:年月日有效期至:年月日
JL-ZL-QC-049-00
对照品配制标签
名称:
浓度:
配制人:
配制日期:年月日
有效期至:年月日
JL-ZL-QC-048-00
滴定液配制标签
名称:
浓度:
F 值:
配制人:
标定人:
复标人:
配制日期:年月日标定日期:年月日有效期至:年月日中药材标签
***********股份有限公司品名科名
药用部位产地
拼音收集日期
鉴定人备注
仪器自检标签
仪器编号:
检定单位:*********股份有限公司
检定日期:
下次检定日期:
检定人:
培养基瓶签
JL-ZL-QC-083-00
培养基瓶签
名称:
批号:
配制人:
复核人:
配制日期:年月日
有效期至:年月日
培养基开启标签
JL-ZL-QC-084-00
培养基开启标签
名称:
批号:
开启日期:年月日
有效期至:年月日。
化学试剂配置标签
试剂名称苯甲酸-无水乙醇配置日期到期日期备注配置人复核人xxxxxxx中心试验室试剂名称苯甲酸-无水乙醇配置日期到期日期备注配置人复核人xxxxxxx中心试验室试剂名称苯甲酸-无水乙醇配置日期到期日期备注配置人复核人xxxxxxx中心试验室试剂名称苯甲酸-无水乙醇配置日期到期日期备注配置人复核人xxxxxxx中心试验室xxxxxxx 中心试验室试剂名称 苯甲酸-无水乙醇配置日期到期日期备注配置人复核人xxxxxxx 中心试验室试剂名称 重液配置日期到期日期备注配置人复核人xxxxxxx 中心试验室试剂名称 重液配置日期到期日期备注配置人复核人xxxxxxx 中心试验室试剂名称 重液配置日期 到期日期 备注配置人复核人xxxxxxx 中心试验室试剂名称重液配置日期到期日期 备注配置人复核人xxxxxxx 中心试验室xxxxxxx 中心试验室 试剂名称重液配置日期 到期日期 备注配置人复核人 xxxxxxx 中心试验室试剂名称 有机物标准溶液配置日期到期日期备注配置人复核人xxxxxxx 中心试验室试剂名称有机物标准溶液配置日期 到期日期备注配置人复核人xxxxxxx 中心试验室试剂名称 有机物标准溶液配置日期 到期日期 备注配置人复核人xxxxxxx 中心试验室试剂名称 有机物标准溶液配置日期 到期日期 备注 配置人复核人xxxxxxx中心试验室试剂名称有机物标准溶液配置日期到期日期备注配置人复核人xxxxxxx中心试验室试剂名称有机物标准溶液配置日期到期日期备注配置人复核人。
质量控制实验室与物料系统—10.试剂及试液的管理

10 试剂及试液的管理【法规要求】药品生产质量管理规范(2010年修订)GMP-226 试剂、试液、培养基和检定菌的管理应至少符合以下要求:(一)试剂和培养基应当从可靠的供应商处采购,必要时应当对供应商进行评估;(二)应当有接收试剂、试液、培养基的记录,必要时,应能在试剂、试液、培养基的容器上标注接收日期;(三)应当按照相关规定或使用说明配制、贮存和使用试剂、试液和培养基。
特殊情况下,在接收或使用前还应当对试剂进行鉴别或其他检验。
(四)试液和已配制的培养基应当标注配制批号、配制日期和配置人员姓名,并有配置(包括灭菌)记录。
不稳定的试剂、试液和培养基应当标注有效期及特殊贮存条件。
标准液、滴定液还有应当标注最后一次标化的日期和校正因子,并有标化记录;(五)配制的培养基应当进行适用性检查,并有相关记录。
应当有培养基使用记录。
(六)应当有检验所需的各种检定菌,并建立鉴定菌保存、传代、使用、销毁的操作规程和相应记录;(七)检定菌应当有适当的标识,内容至少包括菌种名称、编号、代次、传代日期、传代操作人;(八)检定菌应当按照规定的条件贮存,贮存的方式和时间不应当对检定菌的生长特性有不利影响。
10.1 定义和应用范围试剂又称化学试剂或试药。
主要是实现化学反应、分析检验、研究试验、教学实验、化学配方使用的纯净化学品。
试验用的试剂,除另有规定外,均应根据《中国药典》附录试药项下规定,选用不同等级并符合国家标准或国务院有关行政主管部门规定的试剂标准。
试液、缓冲液、指示剂与指示液等,是按照规定方法配制的溶液,均应符合《中国药典》附录的规定或按照附录的规定制备。
试药或试剂、实验用水、实验耗材是实验室对物料或产品进行质量控制的重要组成部分。
欧盟GMP实施指南明确要求,不管试剂将用于定量分析还是定性分析,都应该确保试剂质量并按批准的方法配置试液。
化学试剂用于质量控制的各个分析阶段,根据使用领域不同,可以选择不同级别的试剂。
实验用水,除另有规定外,均系指纯化水。
试液、缓冲液、贮备液、指示剂及指示液标准管理规程

目的:规定中心化验室试液、缓冲液、贮备液、指示剂及指示液管理,保证检验质量。
应用范围:试液、缓冲液、试纸、指示剂与指示液。
责任人:QC、QC主任。
内容:1 配制1.1 应按中国药典或批准的书面规程中指定的方法配制。
1.2 配制时所用的操作器具必须洁净、无痕迹,量器应选用经校正的一等品;按配制要求选用适当的天平;配制用水应用检验合格的纯化水。
1.3 按配制规程的要求选用试验相符合的试剂级别并在使用期内的试药。
1.3.1 试剂常用级别有基准试剂、优级纯、分析纯、化学纯1.3.1.1 基准试剂(JZ,绿标签):作为基准物质,标定标准溶液。
1.3.1.2 优级纯(GR,绿标签,一级品)主成分含量高、纯度很高,适用精确分析如杂质限度检查。
有的可作为基准物质。
1.3.1.3 分析纯(AR,红标签,二级品)主成分含量高、纯度较高,干扰杂质很低,适用化学实验重要分析实验如配制试液、缓冲液等。
1.3.1.4 化学纯(CP,蓝标签,三级品)主成分含量高、纯度较高,存在干扰杂质,适用一般分析实验如配制试液、缓冲液等。
1.4 按配制规程配制好的试液、缓冲液、储备液、指示剂及指示液应及时填写配制记录,并在配制好的容器外壁贴上相应标签,标签上应有试剂名称、数量、有效期、配制日期、配制依据、配制温度、配制人、复核人。
2 贮存2.1 配好的试液、缓冲液、贮备液、指示剂及指示液应按要求贮存在具塞、洁净的适宜容器内,见光易分解的试剂要装于棕色瓶中,挥发性试剂其瓶塞要严密,易侵蚀或腐蚀玻璃的溶液,不能在玻璃瓶内贮存。
遇空气易变质的试剂应用蜡封口。
2.2 配好的试液、缓冲液、指示剂及指示液应贮存在操作室试剂架或橱柜内,贮存环境按有关规定执行,一般以贮存三个月为宜。
3 使用3.1 使用前应先检查试剂(液)的名称、浓度、使用期限,无瓶签或瓶签字迹不清、超过使用期限的试液、缓冲液、贮备液、指示剂及指示液不得使用。
观察其性状、颜色等物理外观性状,外观性状不符的、变质不得使用。
SMP-10023-00 试液、指示液、缓冲液标准管理规程

试液、指示液、缓冲液管理规程一、目的:建立QC检验室试液、指示液、缓冲液的管理规程。
二、职责:质量管理部负责本规程的起草,检验员严格执行本文件的要求。
三、适用范围:本程序适用于QC检验室各类试剂、试液、指示剂、滴定液的管理。
四、总体要求:1、试液、指示液、缓冲液的配制必须符合药典及相关规定。
2、试液、指示液、缓冲液配制所用试剂的纯度无特殊规定的情况下,一般使用分析纯,色谱分析用色谱纯。
溶剂一般用蒸馏水。
3、试液、指示液、缓冲液的标签须标明品名、浓度、配制时间和配制人,有失效期者须注明失效期,无失效期者一般试用期不超过一年。
4、各种试液、指示液、缓冲液要避免阳光直射,须避光的要用黑色纸包和棕色瓶盛装。
5、有毒的需在标签上注明。
五、具体内容:1.1.试液、指示剂、缓冲液、贮备液的管理1.1.1.试剂应当从可靠的供应商处采购,必要时应当对供应商进行评估。
1.1.2.应当有接收试剂、试液的记录,必要时,应当在试剂、试液容器上标注接收日期。
1.1.3.试液、指示剂、缓冲液、贮备液配制1.1.3.1.试液、指示剂、缓冲液、贮备液配制均应符合《中国药典》附录的规定或按照附录的规定制备,并有配制记录。
1.1.3.2.试液、指示剂、缓冲液、贮备液应当标注配制批号(按年月日6位数编制,如110503表示2011年5月第三次配制)、配制日期和配制人员姓名,并有配制记录。
不稳定的试剂、试液应当标注有效期及特殊贮存条件。
标准液、滴定液还应当标注最后一次标化的日期和校正因子,并有标化记录。
1.1.3.3.按一定使用周期配制,不得多配,特别是危险品、剧毒品应随用随配。
1.1.3.4.制备试液与缓冲液等可采用分析纯或化学纯试剂。
1.1.3.5.配制前检查所领试药、试剂瓶签的完好性、封口是否严密、有无污染、是否在规定的使用周期内,并同时检查液体试剂有无沉淀、浑浊、变色、混杂等异常现象。
严禁将多取的试药、试剂放回原瓶中。
配制所用的一切器具必须洁净、干燥。
试剂、试液、培养基管理制度

1、目的:制订试剂、试液、培养基管理制度,规范检验用试剂、试液、培养基的日常管理,保证其质量不受影响。
2、范围:适用于试剂、试液、培养基的管理。
3、职责:3.1 QC负责本规程的实施。
3.2 QA负责监督管理。
4、内容:4.1试剂、试液4.1.1液体试剂开瓶后有效期为1年,固体试剂开瓶后有效期为5年,配制试液有效期为6个月。
试剂开瓶后应及时贴上启封标签(见附表1),内容包括试剂名称、启封日期、有效期、启封人、复核人。
4.1.2试液应用新制沸水冷却后配制,配制后应有配制记录,复核人签名后生效,记录保存至用完后一年。
4.1.3试液的配制批号:编制原则为XX-AABBCCDD ,其中XX代表溶液代号(试液用SY表示),AA代表年份,BB代表月份,CC代表日,DD代表流水号。
例如:SY-13022701表示2013年02月27日配制的第1份试液。
4.1.3试液配制后根据其性质及用量盛装于适宜的洁净容器中,见光易分解的试液应装入棕色瓶中,整齐排列于试剂柜上,定置定位管理。
容器上贴有试液标签(见附表2),内容包括名称、批号、浓度、配制日期、有效期、贮存条件、配制人、复核人。
4.1.4使用试剂时,应先核对其名称、贮存条件及有效期是否正确,观察试剂性状、颜色、透明度、有无沉淀、有无长菌等,已变质的试液一律不得使用。
4.2标准溶液4.2.1配制4.2.1.1配制标准溶液所用的试剂应为分析纯以上试剂,配制前检查封口及包装情况是否无污染,且在规定的使用期内。
4.2.1.2配制标准溶液时,一般先配制成标准贮备液,然后稀释至所需浓度。
4.2.1.3标准溶液的配制批号:编制原则为XX-AABBCCDD ,其中XX代表标准溶液、滴定液代号(标准溶液用BZ表示),AA代表年份,BB代表月份,CC代表日,DD代表流水号。
例如:BZ-13022701表示2013年02月27日配制的第1份标准溶液。
4.2.1.4标准溶液配制必须使用灵敏度在万分之一的天平称重。
试剂、试液管理规定

山东聊城阿华制药有限公司 SOP-QMP 09 01Shandong Liaocheng EHua Medicine CO.,LTD1.范围本标准规定了检验用试剂、试液及滴定标准液的购买或配制、贮存及发放的程序。
2.职责2.1中心化验室化验员负责试液及滴定标准溶液的配制。
2.2化验班长负责滴定标准溶液的复标及试液、滴定标准溶液的发放。
3. 管理程序3.1计划的申报及验收3.1.1化验班长根据年生产计划拟订检验计划和文字说明,制定标准品、试剂使用计划,经质量部部长审核,分管经理批准后,交生产供应部购买。
3.1.2标准品、试剂购来后,仓库保管员检查外包装及标签是否完好清楚,并填写验收记录。
3.2领取化验室领取试剂时,应先到质量部开领料单,然后到仓库领取。
3.3配制3.3.1配前先检查试剂瓶应完好、封口严密、无污染,在规定的使用期,符合规格要求。
3.3.2严格按照配制方法进行操作并建立配制记录。
3.3.3配好的滴定标准液,按规定程序进行标定,其相对平均偏差≤0.1%,并由第二人复标,标定与复标相对平均偏差≤0.15%,否则重标。
3.3.4配制、标定、复核标定的操作应有记录,配制过程有状态标识。
3.3.5复核标定合格的标准液须贴标签,内容:品名、浓度、配标者、配标日期;复标者、复标日期;有效期、编号等。
试液标签内容:品名、规格、配制人:复核人;配制日期等。
3.3.6复标:标准液自配制日期起每隔一段时间(根据标准液的性质和稳定性)需进行一次复标。
配置量多者尽可能使用两个周期硝酸银标准液复标周期3个月,有效期6个月,硫代硫酸钠标准液配置后一个月后复标,再次复标周期3个月,有效期6个月,氢氧化钠标准液复标周期3个月,有效期6个月,----------------------------精品word文档值得下载值得拥有----------------------------------------------山东聊城阿华制药有限公司 SOP-QMP 09 01Shandong Liaocheng EHua Medicine CO.,LTD盐酸标准液复标周期3个月,有效期6个月,碘标准液复标周期3个月,有效期6个月,硫酸亚铁铵标准液临每次用前必须重新再次进行标定,有效期3个月,高氯酸标准液复标周期1个月,有效期2个月。
试剂标签
M4:备用
N
N1:过硫酸钠、亚硫酸氢钠
亚硫酸钠、EDTA
N2: 亚硝酸钠、磷酸氢二钠
高碘酸钠、碳酸钠
N3: 氯化钠、碘化钠、硫化钠
硫代硫酸钠、柠:硫酸镁
O3:硫酸铜
O4:备用
固体试剂柜
(P-R)
P
P1:硫酸联氨、
P2:磺胺、对氯苯胺、硫代乙酰胺
(共4层)
Ⅴ-F-1:定氮瓶
Ⅴ-F-2:定氮瓶
Ⅴ-F-3:试剂瓶
Ⅴ-F-4:试剂瓶
Ⅴ-G物料架
(共4层)
Ⅴ-G-1:备用
Ⅴ-G-2:备用
Ⅴ-G-3:鞋套
Ⅴ-G-4:温湿度计
Ⅵ-A物料架
(共4层)
Ⅵ-A-1:
Ⅵ-A-2:封口机
Ⅵ-A-3:
Ⅵ-A-4:
Ⅵ-C物料架
(共4层)
Ⅵ-C-1:
Ⅵ-C-2:电炉
Ⅵ-C-3:
液体试剂柜
(A-C)
A
A1:pH缓冲液
(1.68、4.01、6.86、9.18、12.46)
A2:pH缓冲液
(2.00、4.01、7.00、9.21)
A3:电导率缓冲液
(5us/cm、1.3us/cm)
A4:灭菌注射用水
B
B1:无水甲醇
B2:丙三醇
B3:无水乙醇
B4:备用
C
C1:备用
C2:甲酸乙酯
C3:苯酚
Ⅱ-B-3:试管30*200
Ⅱ-D物料架
(共3层)
Ⅱ-D-1:移液管(未校验)
Ⅱ-D-2:比色管
Ⅱ-D-3:蓝盖瓶
Ⅱ-A物料架
(共3层)
Ⅱ-A-1:三角烧瓶150ml
实验室试液标签
未检 □
在检 □
留样 □
检毕 □
溶液名称__________ ______________
化学描述
___
溶 液 浓 度 ___________________________
配制日期_________ 保存方式
配制人员________ 有效期限__ _
□
溶液名称__________ ______________
样 品 来 源 ______________________________
样品名称
样品编号 ______________________________
接收时间 ___________ 保存条件
未检 □
在检 □
留样 □
检毕 □
样 品 来 源 ______________________________
配制人员_______ _____有效期限__ _
□
_____ ____
溶液名称__________
化学描述
溶液浓度__ ___________
_
配制日期________________保存方式
配制人员_______ _____有效期限__ _
□
_____ ____
溶液名称__________
化学描述
□
_____ ____
样品来源_________________________
样品名称
样品编号_________________________
接收时间_________保存方式________
未检 □
在检 □
留样 □
检毕 □
样品来源_________________________
QC实验室标签管理SOP

QC实验室标签管理SOP1.目的:规范实验室内部各种标签的使用。
2.范围:需要贴标签的各种试液、各种指示液、各种滴定液、各种流动相等3.责任:QC部门分析人员;4.内容与程序:4.1实验室里的标签应该规范使用,不得使用不规范的标签。
4.2试剂开启后,应及时贴上试剂开启标签,写明开启人和开启日期,以方便在有效期内使用。
4.3配制好各种溶液包括试液、指示液、滴定液、流动相等,应及时贴上相应的标签,配制溶液需有第二者复核。
4.4废液瓶和废液桶应贴上废液标签,以免混用。
4.5一级标准品到货验收合格后,需及时贴上入库标签。
4.6标签书写要求字迹要工整、清晰,不得涂改。
4.7旧版本标签未使用完的待使用完后再更换。
4.8 标签样张4.9试剂、试药有效期的规定:4.9.1 未开启化学试剂、试药储存有效期:化学试剂、试药生产厂商明确规定有效期的,必须在其规定的时间内使用;生产厂商没有明确规定有效期只有生产日期的该试剂、试药的有效期暂定为5年(从生产日期开始算起);生产厂商既没有规定有效期也没有生产日期的,这类试剂、试药有效期暂定为五年(从采购后入库开始算起)。
4.9.2常规试剂、试药开启后有效期暂定2年;易挥发的、易吸水等的液体试剂,如盐酸、硝酸、高氯酸、双氧水等,开启半年后若需再次使用,应测试其有效成分。
试剂、试药使用和检查过程中若发现已明显受污染、分解变质、受潮等情况时,应报告QC主管,停止使用并按规定程序报废、销毁。
4.9.3发现试剂、试药虽未过有效期但已明显受污染、分解变质、受潮等的或已过有效期限的,应报告QC主管后按规定程序报废处理,不得挪作他用。
4.10滴定液有效期规定4.10.1化学性质相对比较稳定滴定液的有效期为3个月,如过了有效期还有大量配制的滴定液没有使用,可允许进行复标。
复标的程序按4.4(同标定)进行,复标后的滴定液有效期为2个月,但不可进行二次复标。
4.10.2化学性质比较不稳定的、容易吸收空气中二氧化碳和易被氧化等其它原因,导致滴定液浓度发生变化的:高氯酸滴定液、氢氧化四丁基铵(醇)滴定液、碘滴定液、盐酸滴定液等的有效期为2个月,不可进行复标,过期后剩余滴定液应弃去。
试剂与试液配置

一、试剂的分类和规格
表1—5列出了环境监测实验室常用试剂的分类。
表1—5 环境监测与分析实验室常用化学试剂分类
名称 无机试剂 有机试剂 基准试剂 仪器分析用试剂
特效试剂
常见化学试剂 金属、非金属试剂,酸、碱、盐类,氧化、还原试剂等
各种烷、烯、醇、醚、酮、酯等 配制各种标准溶液,pH 标定试剂等 色谱仪、原子吸收仪等仪器分析所用的色谱纯及光谱纯试剂 用于指示特定化学反应的终点,鉴别特殊物质是否存在的试剂,包括指示剂、
(2)间接配制法 很多试剂不符合基准物质的条 件,不能用直接法配制标准溶液,但可将其先 配成一种所需的近似浓度溶液,然后用基准物 质(或已知准确浓度的另一溶液)来标定它的准 确浓度。
配制近似浓度的溶液时,由于只需准确1~2位 有效数字,故称量质量和量取体积的相对误差 可以大一些。这时,称量固体试剂使用托盘天 平即可,而不必用分析天平;量取液体试剂可 使用量筒。但是,在标定溶液的整个过程中, 所有一切操作要严格、准确。所用标定的溶液 的体积和要参加计算的溶液的体积均要用容量 瓶、移液管、滴定管准确操作,切不可粗心大 意。
2、一般溶液的配制和保存原则
监测实验中有时用(1+1)、(1+2)、(1+3)等 体积比表示浓度,例如(1+1)H2SO4溶液, 即量取一份体积浓H2SO4与一份体积的水混 合均匀。又如(1+3)HCL,即量取1份体积浓 盐酸与3份体积的水混匀。
3、配制溶液时的注意项
(1)配制溶液时,首先要合理选择试剂的级 别,决不许超规格使用试剂,以免造成浪 费。
环境监测
环境监测
化学试剂是分析监测实验室必不可少的物质。对试剂的性 质、分类、用途及配制方法是否充分了解,将直接影响分 析监测的结果。实验过程中,应根据实际需要合理选用试 剂,按照规定正确配制。试剂和配好的试液(也称溶液)还 应按规范分类放置,妥善保存。注意交叉污染及空气、温 度、光线等对试剂、试液的影响。
试剂试液配置,使用,登记流程

试剂试液配置,使用,登记流程英文版Reagent and Test Solution Preparation, Usage, and Registration Process1. Reagent and Test Solution Preparation:Ensure that all reagents and test solutions are properly labeled and stored in designated areas.Follow manufacturer's instructions for mixing and diluting reagents.Use clean, sterile containers for storing prepared reagents and test solutions.Regularly check the expiration dates of reagents and dispose of expired ones promptly.2. Usage:Wear appropriate protective gear, such as gloves and goggles, when handling reagents and test solutions.Ensure that the correct reagent or test solution is used for the intended purpose.Follow laboratory safety procedures when dispensing and using reagents.Keep records of reagent usage, including date, time, user, and purpose.3. Registration Process:Maintain a dedicated reagent inventory system or database.Each time a reagent or test solution is prepared or used, update the inventory system with the relevant details.Include information such as reagent name, batch number, expiration date, preparer's name, and date of preparation.Regularly audit the inventory system to ensure accuracy and to identify any discrepancies.Conclusion:The reagent and test solution configuration, usage, and registration process are crucial for ensuring the safety, accuracy, and efficiency of laboratory work. By adhering to strict safetyprocedures, maintaining accurate records, and regularly auditing the reagent inventory, laboratories can minimize errors, risks, and waste.中文版试剂试液配置、使用、登记流程1. 试剂试液配置:确保所有试剂和试液都有明确的标签,并储存在指定区域。
化学试剂标签
化学试剂标签附注1正庚烷-MSDS化学品安全技术说明书品名正庚烷; 庚烷; n-Heptane; Heptane; CAS:142-82-5理化性质:无色易挥发的液体,有汽油味。
分子式C7-H16。
分子量100.21。
相对密度0.684(20/4℃)。
熔点-90.7℃。
沸点98.4℃。
闪点-3.89℃(闭杯)。
自燃点222.78℃。
蒸气密度3.45。
蒸气压5.33kPa(40mmHg 22.3℃)。
蒸气与空气混合物爆炸限1.05~6.7% 。
不溶于水; 微溶于醇; 与乙醚、氯仿混溶。
遇热、明火、磷、氯、强氧化剂易燃烧、爆炸。
接触机会从石油镏分中分离本品时,用作溶剂、有机合成及测定辛烷值的标准时可有接触。
侵入途径主要经呼吸道吸收。
毒理学简介人吸入TCLo: 1000 ppm/6M。
大鼠吸入LC50: 103 gm/m3/4H。
小鼠吸入LCLo: 59 gm/m3/41M。
毒性低,主要有麻醉和刺激作用。
人在 4.09g/m^3浓度下6分钟或在8.18g/m^3下4分钟有轻度眩晕;20.45g/m^3下4分钟,有明显眩晕,15分钟有眩晕、恶心、厌食、欣快感和步态蹒跚等,30分钟意识丧失。
对皮肤有轻度刺激作用。
IDLH: +750 ppm. [R4]临床表现急性中毒可表现为眩晕、酒醉状态、甚至昏迷。
处理脱离接触。
对症处理。
标准车间空气卫生标准:美国ACGIH TLV-STEL 2050 mg/m3 (500 ppm)美国ACGIH TLV-TWA 1640 mg/m3 (400 ppm)美国MSHA STANDARD-air: TWA 500 ppm (2000 mg/m3)美国OSHA PEL(所有行业): 8H TWA 500 ppm (2000 mg/m3)澳大利亚: TWA 400 ppm (1600 mg/m3), STEL 500 ppm (2000 mg/m3)比利时: TWA 400 ppm (1640 mg/m3), STEL 500 ppm (2050 mg/m3)丹麦: TWA 400 ppm (1600 mg/m3)芬兰: TWA 300 ppm (1200 mg/m3), STEL 500 ppm (2000 mg/m3)法国: TWA 400 ppm (1600 mg/m3)德国: TWA 500 ppm (2000 mg/m3)日本: TWA 200 ppm (820 mg/m3)荷兰: TWA 400 ppm (1600 mg/m3)菲律宾: TWA 500 ppm (2000 mg/m3)波兰: TWA 200 mg/m3俄罗斯: TWA 200 ppm瑞典: TWA 200 ppm (800 mg/m3), STEL 300 ppm (1250 mg/m3)瑞士: TWA 400 ppm (1600 mg/m3), STEL 800 ppm土耳其: TWA 500 ppm (2000 mg/m3)英国: TWA 400 ppm (1600 mg/m3), STEL 500 ppm保加利亚,哥伦比亚,约旦,韩国参照美国ACGIH TLV;新西兰,新加坡,越南参照美国ACGIH TLV危规:GB3.2 类32006。
实验室常用试剂标签标示方法作业指导书

实验室常用试剂标签表示方法编制:审核:批准:1目的提供标签参考模式,统一规范填写试剂标签。
2范围仅限本检测中心内使用。
3职责3.1各室主任负责监督检查;3.2每个检验员负责各自项目使用试剂标签。
4定义4.1物质的量浓度:单位体积中所含溶质B的物质的量;4.2质量浓度:作为溶质的物质的质量除以混合物(即溶液)体积.5内容5.1标准溶液摩尔浓度(物质的量浓度)物质的量浓度定义:单位体积中所含溶质B的物质的量.符号:c(B). B代表作为溶质的物质.物质的量浓度单位:计量单位为"mol/m3"及其倍数,实验室中常用的单位是“mol/L”或“mmol/L”.几种常见标准溶液浓度表示法实例:①c(NaOH)=0.1015mol/L氢氧化钠溶液,小括号内的NaOH是指溶液中溶质的基本单元,c(NaOH)是表示基本单元为NaOH的物质的量浓度.等号右边的0.1015mol/L表示物质的量浓度数数值为0.1015摩尔每升,即每升含氢氧化钠1×氢氧化钠分子量×0.1015克.②c(1/2H2SO4)=0.2042mol/L硫酸溶液,表示基本单元为1/2H2SO4的物质的量浓度为0.2042摩尔每升.即每升含硫酸1/2×硫酸分子量×0.2042克.③c(1/5KMnO4)=0.1000mol/L高锰酸钾溶液,表示基本单元为1/5KMnO4的物质的量浓度为0.1000摩尔每升.即每升含高锰酸钾1/5×高锰酸钾分子量×0.1000克.④c(1/6K2Cr2O7)=1.0042mol/L重铬酸钾溶液,表示基本单元为1/6K2Cr2O7的物质的量浓度为1.0042摩尔每升.即每升含重铬酸钾1/6×重铬酸钾分子量×1.0042克.⑤c(1/2Ca2+)=1.0035mol/L钙阳离子溶液,表示基本单元为1/2Ca2+的物质的量浓度为1.0035摩尔每升.即每升含钙阳离子1/2×钙原子量×1.0035克.附:标签中的介质表示法①水,可写可不写;④乙醇5.2标准溶液质量浓度质量浓度定义:作为溶质的物质的质量除以混合物(即溶液)体积,符号:ρ(B)实验室常用质量浓度单位"g/L","mg/L","mg/mL","μg/mL"等.质量浓度表示法实例:①ρ(B)表示法:ρ(Na2CO3)=0.5021mg/mL碳酸钠标准滴定溶液,表示碳酸钠标准滴定溶液的质量浓度为0.5021毫克每毫升.②Ρ(A/B)表示法: A代表被测物质;B代表滴定溶液中有效物质分子式.ρ(Cl-/AgNO3)=0.5000mg/mL硝酸银标准滴定溶液表示1mL硝酸银标准滴定溶液相当于0.5000mg的氯离子.③用ρ(B)表示元素标准溶液的浓度时,只写整数及小数点后的非零数字.这种表示法不考虑有效数字的规定.如: ρ(Zn2+)=2μg/mL不写成ρ(Zn2+)=2.000μg/mL;ρ(Ag)=1.5μg/mL不写成ρ(Ag)=1.500μg/mL.5.3一般溶液的浓度5.3.1 物质的量浓度c(B)检测方法标准上是使用物质的量浓度c(B)表示这类溶液的浓度.如: c(HCl)=4mol/L盐酸溶液5.3.2 质量浓度ρ(B)对用质量浓度ρ(B)表示浓度的溶液,用"g/L",如:20g/LKI溶液的一般溶液时,则不必写出量符号.所用的单位,一般是单位的分母不带系数.例如,100mL的KI溶液中含KI时,表示为:20g/LKI溶液,而不表示为2g/100mL.5.3.3质量分数质量分数ω(B)为溶液中溶质的质量与溶液的质量之比.它是无量纲量,可以用"%"符号表示它的单位为"1"的浓度值.如:表示100g的HCl溶液含10g的HCl时,则其浓度表示为: ω(HCl)=10%5.3.4体积分数φ(B)用体积分数表示浓度的溶液若是单独使用的溶液时,必须加量符号φB;若是出现在另外溶液的标签上作为介质时,不加量符号.如:每100mL中含75mL乙醇的溶液表示为:φ(C2H5OH)=75%乙醇当100mL中含HNO31mL的溶液单独作为溶液时,其浓度表示为:φ(HNO3)=1%的HNO3;5.3.5 V1+V2形式表示浓度这种表示方法是表示两种或两种以上溶液或液体相混成为另一溶液的浓度表示法,被混合者均以体积表示.①混合前仅有两种液体且其一为水时,表示混合后的溶液时,水可不表示出来,仅表示出其中的非水②当被混合者是非水液体必须表示出来.例如:3体积的苯与7体积的醋酸乙酯相混后的溶液表示为:③两种或两种以上的液体与水相混时,应将被混合者水表示出来.例如:1.5体积的浓H2SO4,1.5体积的浓H3PO4与7体积的水按操作要求相混合而成的溶液表示为:5.4 一般溶液的标签书写内容及格式5.4.1 用物质的量浓度cB表示一般溶液的标签(灰色字体为参考)5.4.2 用质量浓度ρB表示浓度的一般溶液标签5.4.3 用质量分数表示浓度的一般溶液标签5.4.4 用体积分数φB表示浓度的一般溶液标签5.4.5 用V1+V2形式表示浓度的一般溶液标签5.4.6 缓冲溶液的标签缓冲溶液的标签不便与上述标签一致.缓冲溶液的标签内容及格式举例如下.5.4.7 有剧毒,易燃,易爆溶液的标签凡有剧毒,易燃,易爆的溶液,必须使用红框标签,以警示谨慎使用。
如何写溶液配制的标签

21如何写溶液配制的标签
标准溶液
标准溶液的配制,标定,校验及稀释等都要有详细的记录,应该与检测原始记录⼀样要求,标签书写内容要求齐全,字迹清晰,符号要准确。
标准溶液标签的书写内容包括标准溶液名称、浓度类型、浓度值、介质、配制⽇期、配制温度、瓶号、校核周期和配制⼈、注意事项及其他须注明的事项等。
实例
①代表瓶号;溶液名称;溶液浓度;2% H 2SO 4为溶液介质;XXX 为配制⼈姓名;18℃为配制时温度;2009-12-01为时间;7天为溶液的校核周期。
2代表瓶号;18℃是配制时的室温;XXX 为配制⼈姓名;2009-12-01为配制⽇期。
⼀般溶液
溶液的浓度要求不太严格,不需要⽤标定或其他⽐对⽅法求得其准确浓度。
在化验⼯作中,它们的浓度和⽤量不参与被测组分含量的计算,通常是⽤来作为“条件”溶液,如控制酸度、指⽰终点、消除⼲扰、显⾊、络合等。
按⽤途⼜可分为显⾊剂溶液、掩蔽剂溶液、缓冲溶液、萃取溶液、吸收溶液、底液、指⽰剂溶液、沉淀剂溶液、空⽩溶液等。
⼀般溶液标签的书写内容应包括名称、浓度、纯度、介质、⽇期、配制⼈及其他说明。
实例:
第⼀⾏缓冲溶液名称;第⼆⾏试剂级别;pH 值⼤⼩;XXX 为配制⼈;2009-12-01为配制时间。
DZG20-1 p.85 代表按地矿部规程《岩⽯矿物分析》85页⽅法配制。
第⼀⾏溶液名称及浓度;分析纯为试剂级别;XXX 为配制⼈;2009-12-01为配制⽇期。
0090试剂、试液、指示液、溶液、缓冲液的配制操作规程
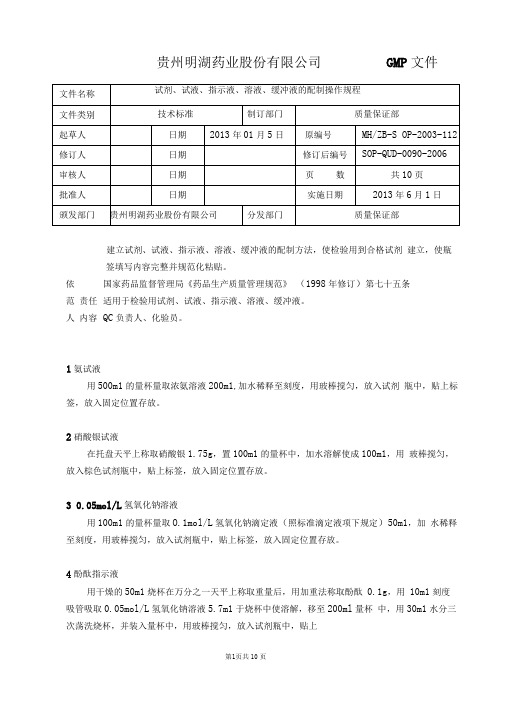
贵州明湖药业股份有限公司GMP 文件第1页共10页建立试剂、试液、指示液、溶液、缓冲液的配制方法,使检验用到合格试剂 建立,使瓶签填写内容完整并规范化粘贴。
国家药品监督管理局《药品生产质量管理规范》 (1998年修订)第七十五条适用于检验用试剂、试液、指示液、溶液、缓冲液。
QC 负责人、化验员。
1氨试液用500m1的量杯量取浓氨溶液200m1,加水稀释至刻度,用玻棒搅匀,放入试剂 瓶中,贴上标签,放入固定位置存放。
2硝酸银试液在托盘天平上称取硝酸银1.75g ,置100m1的量杯中,加水溶解使成100m1,用 玻棒搅匀,放入棕色试剂瓶中,贴上标签,放入固定位置存放。
3 0.05mol/L 氢氧化钠溶液用100m1的量杯量取O.1mol/L 氢氧化钠滴定液(照标准滴定液项下规定)50m1,加 水稀释至刻度,用玻棒搅匀,放入试剂瓶中,贴上标签,放入固定位置存放。
4酚酞指示液用干燥的50m1烧杯在万分之一天平上称取重量后,用加重法称取酚酞 0.1g ,用 10m1刻度吸管吸取0.05mol/L 氢氧化钠溶液5.7m1于烧杯中使溶解,移至200ml 量杯 中,用30m1水分三次荡洗烧杯,并装入量杯中,用玻棒搅匀,放入试剂瓶中,贴上依 范 责任人 内容标签,放入固定位置存放。
5 甲基红指示液用干燥的50m1 烧杯在万分之一天平上称取重量后,用加重法称取甲基红指0.1g,用10m1 刻度吸管吸取0.05mol/L 氢氧化钠溶液7.4ml 于烧杯中使溶解,移至200m1 量杯中,用30m1 水分三次荡洗烧杯,并装入量杯中,用玻棒搅匀,放入试剂瓶中,贴上标签,放入固定位置存放。
6 溴甲酚绿指示液用干燥的50m1 烧杯在万分之一天平上称取重量后,用加重法称取溴甲酚绿指示液0.1g,用10m1刻度吸管吸取0.05mol/L氢氧化钠溶液2.8m1于烧杯中使溶解,移至200m1 量杯中,用30m1 水分三次荡洗烧杯,并装入量杯中,用玻棒搅匀,放入试剂瓶中,贴上标签,放入固定位置存放。
内部标签管理规程

1.目的规范内部标签的分类、设计、审批及使用控制等活动,防止差错与混淆。
2.适用范围本规程适用于标识物料、产品、试剂、仪器、设备、废弃物等的内部标签的管理,不包括用于产品包装的标签的管理。
3.职责3.1. 质量管理部:负责本规程的起草、修订、审核、培训、实施和监督。
3.2. 总经理:负责本规程的批准。
3.3. 相关部门:负责本规程的审核和实施。
4.定义内部标签:指在工作过程中用于标识物料、产品、试剂、仪器、设备、废弃物等的基本信息的一种标签,不包括用于产品包装的标签。
5.引用标准无6.材料6.1.仪器设备无6.2.器材、用具无6.3.其他无7.流程图无8.内容8.1.内部标签的分类8.1.1. 物料类标签8.1.1.1 物料标签贴在物料、中间产品或待包装产品的包装上,用于表明其品名、批号、数量等基本信息的一种标签。
8.1.2. 质量状态标签用于表示物料、产品质量状态基本信息的标签,分为合格、不合格。
8.1.3. 设备标签:用于表明设备、仪器基本信息资料的标签。
8.1.4. 取样证:用于表明取样信息的标签。
8.1.5. 样品标签:用于表示所取样品信息的标签,如:样品标签。
8.1.6. 试剂类标签:用于表明入库试剂和实验室所用的试剂、试液、溶液、储备液、滴定液、对照品等基本信息的标签。
8.1.7. 校验类标签:用于仪器、仪表,表明所处校验的状态,由国家计量单位颁发或内部校验后签发。
外部校验的使用计量测试部门颁发的标签,内部校验合格的粘贴“校准合格证”。
8.1.8. 其它标签:以上未列出的,如清场合格证、废弃物标签、润滑剂标签等。
8.2. 内部标签样稿的设计标签由主要使用部门根据需要自行设计。
8.2.1. 内部标签的内容应能反映出所表示对象的基本信息,如名称、规格、数量、批号等,有特殊要求的还应有操作人、复核人、日期、工序、部门等要求,设备标签应有公司名称及徽标,具体内容由使用部门根据用途自定;格式无特殊要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
- 1 -
制作要求: 1. 不要“试剂、试液标签”这几个字
2. 框线及内字体为黑色
3. 规格尺寸(㎝):7.5×
4.5 4. 制作材料:不干胶
试剂、试液标签
名 称 配制者 配置量 配制时间 有效期至
四川锡成药业有限公司
名 称 批 号 浓 度 配制者 复核者 配制时间 有效期至
四川锡成药业有限公司
名称
批号浓度
配制者复核者
配制时间有效期至
四川锡成药业有限公司名称
批号浓度
配制者复核者
配制时间有效期至
四川锡成药业有限公司
名称
批号浓度
配制者复核者
配制时间有效期至
四川锡成药业有限公司名称
批号浓度
配制者复核者
配制时间有效期至
四川锡成药业有限公司
名称
批号浓度
配制者复核者
配制时间有效期至
四川锡成药业有限公司名称
批号浓度
配制者复核者
配制时间有效期至
四川锡成药业有限公司
名称
批号浓度
配制者复核者
配制时间有效期至
四川锡成药业有限公司名称
批号浓度
配制者复核者
配制时间有效期至
四川锡成药业有限公司
名称
批号浓度
配制者复核者
配制时间有效期至
四川锡成药业有限公司名称
批号浓度
配制者复核者
配制时间有效期至
四川锡成药业有限公司
名称
批号浓度
配制者复核者
配制时间有效期至
四川锡成药业有限公司
名称
批号浓度
配制者复核者
配制时间有效期至
四川锡成药业有限公司
- 2 -。
