Western blot步骤实验蛋白提取及定量、相关试剂配制、电泳转膜及显色过程(全) (1)
Western Blot实验指导教程

蛋白免疫印迹杂交(Western Blot,WB)一、蛋白提取与样本制备(一)操作步骤1.提前解冻RIPA(蛋白裂解液),一定要完全融化;2.根据样本数配制混合溶液:PMSF(丝氨酸蛋白酶抑制剂):RIPA=1:100,现用现配);3.裂解组织:每个样品称取50mg,加1ml混合液,在冰上用组织剪剪减为碎屑,电动匀浆后4 ℃静置2h使其充分裂解,离心12000g,4 ℃15min,取上清;4.蛋白定量:1)取少量上清稀释10倍:2ul上清,加18ul生理盐水;2)标准品按5ug/ul至0.3125ug/ul的梯度进行倍比稀释(制作平行样的标准曲线:5mg/ml标准品取80ul + 生理盐水80ul);3)配制显色剂BCA混合液:a液:b液=50:1。
配制量=200ul*(孔数+6);4)加入稀释完成的各样到酶标板的孔中及BCA混合液200ul/孔;5)贴上封口胶,37℃震荡混匀30min;6)562nm波长处测吸光度OD;7)根据数据制图、添加趋势线、方程及R2。
5.样品OD值带入方程,计算出各样本原液蛋白浓度;6.样本蛋白浓度均一化(一般样品蛋白浓度为3-4mg/ml);7.100℃变性5min。
8.分装并存于-20 ℃,避免反复冻融。
二、配置相关试剂(一)10%的SDS(戴口罩称取):试剂剂量SDS (g)10双蒸水(ml)80用磁力加热搅拌助溶,然后定容至100ml。
室温保存,如在长期保存中出现沉淀,加温溶化后,仍可使用。
(二)1.5M Tris/HCl(pH8.8)试剂剂量Tris base (g)18.17双蒸水(ml)80用浓盐酸调至pH 8.8,最后定容至100ml。
室温下保存。
(三)0.5M Tris/HCl(pH6.8)试剂剂量Tris base (g) 6.06双蒸水(ml)80用浓盐酸调至pH6.8,最后定容至100ml。
室温下保存。
(四)丙/双丙(戴口罩称取)试剂剂量丙烯酰胺(Acr)(g)75亚甲双丙烯酰胺(g) 2去离子水(ml)230加热溶解后,定容至250ml,4℃棕色瓶避光保存。
WesternBlot相关试剂配方及详细实验步骤

WesternBlot相关试剂配方及详细实验步骤Western Blot详细实验步骤及试剂配方1. 溶液配置1.1 5×SDS-PAGE上样缓冲液(Loading buffer)药品用量1 M Tris-HCl (PH=6.8) 1.25 mLSDS 0.5 gBPB(溴酚蓝,有毒)25 mg甘油 2.5 mL去离子水up to 5 mL分装至1.5 mL离心管中,每管500 μL,室温保存,使用前每管加入25 μL的β-巯基乙醇。
1.2 10×SDS-PAGE电泳缓冲液(Running buffer 母液)药品用量Tris 30.3 gGlycine (甘氨酸) 144.2 gSDS 10 gddH2O up to 1 L室温保存即可,使用时稀释为1×的工作液,可回收反复使用4~5次。
1.3 Tris-HCl缓冲液(1)1.5 M Tris-HCl (PH=8.8)→制分离胶Tris (MW: 121.14) 45.43 gH2O up to 250 mL浓盐酸调PH 8.8(2)1.0 M Tris-HCl (PH=6.8)→制浓缩胶Tris (MW: 121.14) 30.29 gH2O up to 250 mL浓盐酸调PH 6.8二者高压灭菌后,置于室温保存即可。
1.4 10% SDS (十二烷基硫酸钠)SDS 10 gddH2O up to 100 mL室温保存即可。
1.5 10% AP (过硫酸铵)→1.5 mL 离心管配制过硫酸铵(刺激性,腐蚀性) 0.1 g超纯水up to 1 mL混匀后,锡箔纸包住,避光处理,置于-20℃保存。
1.6 30% 丙烯酰胺溶液丙烯酰胺 150 g甲叉双丙烯酰胺 4 gMilli-Q水 30 mL滤纸过滤,Milli-Q水定容至500 mL,装入棕色瓶子中,4℃保存。
1.7 10×转膜缓冲液(Trans buffer 母液)Tris (MW: 121.14) 30.3 gGlycine (甘氨酸) 144 g去离子水 up to 1 L室温保存即可,其1×的工作液配制为:100 mL母液+200 mL甲醇(有毒)+700 mL水。
westernblot法

Western blot,也称为蛋白质印迹或免疫印迹,是一种常用的生物化学技术,用于分析样品中特定蛋白质的存在、细胞中特异蛋白质的半定量分析以及蛋白质分子的相互作用研究等。
下面是Western blot的基本步骤和注意事项:一、实验步骤蛋白样品制备:从细胞或组织中提取蛋白质样品,常用的方法有细胞裂解、组织匀浆等。
蛋白定量:使用BCA蛋白浓度测定法等对蛋白质样品进行定量,以便后续的Western blot分析。
凝胶电泳:将蛋白质样品在聚丙烯酰胺凝胶中电泳分离,根据蛋白质的大小和电荷进行分离。
转膜:将电泳分离后的蛋白质样品转移到硝酸纤维素膜上,以便进行后续的免疫检测。
免疫检测:使用特异性抗体对转移后的蛋白质样品进行免疫检测,抗体与目标蛋白质结合后,通过显色反应呈现阳性结果。
数据分析:对免疫检测结果进行定量和定性分析,如条带大小、灰度值等。
二、注意事项实验前要充分了解实验原理和操作流程,确保实验的正确性和可行性。
蛋白样品制备过程中要保证细胞或组织充分裂解和匀浆,以获得更纯的蛋白质样品。
在进行Western blot分析前,要对蛋白质样品进行定量,以保证实验结果的准确性。
在转膜过程中,要选择合适的转移缓冲液和转移时间,以保证蛋白质样品的完整转移。
在免疫检测过程中,要选择合适的抗体和显色试剂,以保证免疫检测结果的特异性。
在数据分析过程中,要选择合适的分析方法和软件,以保证数据分析的准确性和可靠性。
总之,Western blot是一种常用的生物化学技术,在蛋白质分析领域具有广泛的应用价值。
在进行Western blot实验时,要严格遵守实验步骤和注意事项,以保证实验结果的准确性和可靠性。
Western blot步骤实验蛋白提取及定量、相关试剂配制、电泳转膜及显色过程(全) (1)培训讲学

W e s t e r n b l o t步骤实验蛋白提取及定量、相关试剂配制、电泳转膜及显色过程(全)(1)Western blot实验蛋白提取及定量、相关试剂配制、电泳、转膜及显色过程步骤高征2014年6月第一部分细胞核蛋白与细胞浆蛋白抽提过程 (碧云天试剂盒)一、原理在研究细胞时经常要研究细胞的不同组份,而研究得最多的两个细胞组份就是细胞核和细胞浆。
分离细胞核蛋白和细胞浆蛋白,不仅可以用于研究蛋白在细胞内的定位,而且很多时候分离出来的核蛋白可以用于转录调控方面的研究,例如EMSA(也称gel shift),footprinting等。
细胞核蛋白与细胞浆蛋白抽提试剂盒(Nuclear and Cytoplasmic Protein Extraction Kit)提供了一种比较简单、方便的从培养细胞或新鲜组织中抽提细胞核蛋白与细胞浆蛋白的方法。
约90分钟就可以完成培养细胞的细胞核蛋白与细胞浆蛋白的分离。
抽提得到的蛋白可以用于Western,EMSA,footprinting,报告基因检测以及酶活力测定等后续操作。
本试剂盒是通过细胞浆蛋白抽提试剂A和B,在低渗透压条件下,使细胞充分膨胀,然后破坏细胞膜,释放出细胞浆蛋白,然后通过离心得到细胞核沉淀。
最后通过高盐的细胞核蛋白抽提试剂抽提得到细胞核蛋白。
本试剂盒可以抽提50个样品,如果每个样品的数量为约二百万细胞或约30-50毫克组织。
二、注意事项1.需自备PMSF。
PMSF一定要在抽提试剂加入到样品中前2-3分钟内加入,以免PMSF在水溶液中很快失效。
2.抽提蛋白的所有步骤都需在冰上或4℃进行。
3.本试剂盒对于组织样品,仅适合于新鲜组织,对冻存过的组织抽提效果很差。
可以抽提的组织样品数通常不足100个。
4.使用本试剂盒抽提到的细胞核蛋白与细胞浆蛋白均可直接用碧云天生产的BCA蛋白浓度测定试剂盒(P0009/P0010/P0010S/P0011/P0012/P0012S)测定蛋白浓度。
Western blot步骤实验蛋白提取及定量、相关试剂配制、电泳转膜及显色过程(全) (1)

Western blot实验蛋白提取及定量、相关试剂配制、电泳、转膜及显色过程步骤高征2014年6月第一部分细胞核蛋白与细胞浆蛋白抽提过程(碧云天试剂盒)一、原理在研究细胞时经常要研究细胞的不同组份,而研究得最多的两个细胞组份就是细胞核和细胞浆。
分离细胞核蛋白和细胞浆蛋白,不仅可以用于研究蛋白在细胞内的定位,而且很多时候分离出来的核蛋白可以用于转录调控方面的研究,例如EMSA(也称gel shift),footprinting等。
细胞核蛋白与细胞浆蛋白抽提试剂盒(Nuclear and Cytoplasmic Protein Extraction Kit)提供了一种比较简单、方便的从培养细胞或新鲜组织中抽提细胞核蛋白与细胞浆蛋白的方法。
约90分钟就可以完成培养细胞的细胞核蛋白与细胞浆蛋白的分离。
抽提得到的蛋白可以用于Western,EMSA,footprinting,报告基因检测以及酶活力测定等后续操作。
本试剂盒是通过细胞浆蛋白抽提试剂A和B,在低渗透压条件下,使细胞充分膨胀,然后破坏细胞膜,释放出细胞浆蛋白,然后通过离心得到细胞核沉淀。
最后通过高盐的细胞核蛋白抽提试剂抽提得到细胞核蛋白。
本试剂盒可以抽提50个样品,如果每个样品的数量为约二百万细胞或约30-50毫克组织。
二、注意事项1.需自备PMSF。
PMSF一定要在抽提试剂加入到样品中前2-3分钟内加入,以免PMSF在水溶液中很快失效。
2.抽提蛋白的所有步骤都需在冰上或4℃进行。
3.本试剂盒对于组织样品,仅适合于新鲜组织,对冻存过的组织抽提效果很差。
可以抽提的组织样品数通常不足100个。
4.使用本试剂盒抽提到的细胞核蛋白与细胞浆蛋白均可直接用碧云天生产的BCA蛋白浓度测定试剂盒(P0009/P0010/P0010S/P0011/P0012/P0012S)测定蛋白浓度。
但不适合用Bradford法测定蛋白浓度。
5.为了您的安全和健康,请穿实验服并戴一次性手套操作。
western blot步骤

蛋白质免疫印迹技术及常见问题分析Western Blot基本原理:在电场的作用下将电泳分离的多肽从凝胶转移至一种固相支持体,然后用这种多肽的特异抗体来检测。
Western Blot应用:目的蛋白的表达特性分析,目的蛋白与其它蛋白的互作,目的蛋白的组织定位,目的蛋白的表达量分析。
Western Blot 流程:蛋白样品的制备,制胶,SDS聚丙烯酰胺凝胶电泳,转膜,封闭,一抗杂交,二抗杂交,底物显色。
(一)蛋白样品的制备:提取总蛋白:所有操作在冰上进行,且所有操作要对着容器壁操作,防治将细胞吹落;操作前先用PBS将细胞洗2变。
1.将原瓶/皿中放入5ml生理盐水或PBS,根据细胞团块大小加入100-300μl RIPA裂解液,吹匀后,4℃摇床30min。
2. 4℃,12000×g 15min,离心后取上清,测浓度。
BCA蛋白浓度测定方法:原理碱性条件下,蛋白将Cu2+还原为Cu+,Cu+与BCA试剂形成紫颜色的络合物,测定其在570nm 处的吸收值,并与标准曲线对比,即可计算待测蛋白的浓度。
特点1. 灵敏度高,检测浓度下限达到25微克/毫升,最小检测蛋白量达到0.5微克,待测样品体积为1-20微升。
2. 在50-2000微克/毫升浓度范围内有较好的线性关系。
步骤(标准品为BSA,标准品稀释液为生理盐水)①50体积BCA试剂A(碧云天)加1体积BCA试剂B(碧云天)(50:1)配制适量BCA工作液,充分混匀;②完全溶解蛋白标准品(即BSA),取10微升稀释至100微升(生理盐水稀释) ,使终浓度为0.5mg/ml;③将标准品按0,1,2,4,8,12,16,20微升加到96孔板的标准品孔中,加标准品稀释液补足到20微升(此时浓度分别为0 0.5 1 2 4 6 8 10);④加适当体积样品(1微升)到96孔板的样品空中,加标准品稀释液到20微升;⑤各孔加入200微升BCA工作液,37℃放置30分钟;⑥测定570nm处的波长也可接受。
(完整版)WesternBlot(免疫印迹法)实验方法步骤

Western Blot(免疫印迹法)实验方法步骤发布日期:2008-8-25 热门指数:4360Western Blot(免疫印迹法)主要包括以下4个基本步骤:n 样品制备n 电泳分离n 蛋白的膜转移n 免疫杂交与显色――蛋白检测溶液和试剂n 1X 磷酸盐缓冲液(PBS)n Modified RIPA bufferTris-HCl: 50 mM, pH 7.4 ; NP-40: 1% ;Na-deoxycholate: 0.25% ;NaCl: 150 mM ;EDTA: 1 mM ;P MSF: 1 mM ;Aprotinin, leupeptin, pepstatin: 1 microgram/ml each ;Na3VO4: 1 mM ;NaF: 1 mMn 1X SDS 样品缓冲液62.5 mM Tris-HCl (pH 6.8 于25°C), 2% w/v SDS, 10%甘油,50 mM DTT, 0.01% w/v溴酚蓝n 转移缓冲液25 mM Tris base, 0.2 M 甘氨酸, 20%甲醇(pH 8.3)n 10X Tris缓冲盐(TBS)准备1L 10X TBS: 24.2 g Tris base, 80 g NaCl;用1N HCl调pH为7.6n 脱脂奶粉或BSAn 甲醇n TBS/T缓冲液1X TBS, 0.1% Tween-20n 封闭缓冲液(TBS/T)1X TBS, 0.1% Tween-20加5% w/v脱脂奶粉或BSAn 一抗的稀释1X TBS, 0.1% Tween-20 加5% BSA (多抗)或5%脱脂奶粉(单抗)Note:一般来说, BSA被推荐用于多克隆抗体,脱脂奶粉用于单克隆抗体,这样可得到较高的信噪比。
抗体的稀释度参考抗体说明书或根据实验确定。
n 预染的蛋白质Marker,可用于监测转膜的效率样品制备原始样品可为细胞、组织、培养上清、免疫沉淀或亲和纯化的蛋白,以下为定性检测目的蛋白时细胞样品的处理方法,其余的样品制备方法参阅相关文献。
Western blot 试剂配制及实验步骤

Western印迹法这种技术是把电泳分离的组分从凝胶转移到一种固相支持体,并以针对特定氨基酸序列的特异性试剂作为探针检测之。
Western使用的探针是抗体,它与附着于固相支持体的靶蛋白所呈现的抗原表位发生特异性反应。
这种技术的作用是对非放射性标记蛋白组成的复杂混合物中的某些特异蛋白进行鉴别和鉴定。
仪器:高压锅、玻璃匀浆器、高速离心机、分光光度仪、—20℃低温冰箱、垂直板电泳转移装置、恒温水浴摇床、多用脱色摇床。
试剂:单去污剂裂解液、0.01mol/L PBS (pH7.3)、10%分离胶、4%浓缩校、G250考马斯亮蓝溶液、0.15mol/L NaCl 溶液、2X(5X)SDS上样缓冲液、电泳缓冲液、转移缓冲液、10X丽春红染液、封闭液、TBST、TBS、洗脱抗体缓冲液、显影液、定影液、抗体、化学发光试剂。
杂品与耗材:各种规格的吸头、离心管和加样器;各种规格的烧杯、量筒和平皿等玻璃器材;硝酸纤维素膜,乳胶手套,保鲜膜,搪瓷盘(>20×20cm),X-光片夹,X-光片,玻棒长短各一根,计时器,吸水纸,试剂配制:(一)母液1.0mol/L Tris·HClTris (MW121.14) 30.29g蒸馏水 200ml溶解后,用浓盐酸调pH至所需点(见下所示),最后用蒸馏水定容至250ml,高温灭菌后室温下保存。
PH HCl7.4 约17ml7.5 约16m7.6 约15ml8.0约10ml1.74mg/ml (10mmol/L)PMSFPMSF 0.174g异丙醇 100ml溶解后,分装于1.5ml离心管中,-20℃保存。
0.2mol/L NaH2PO4NaH2PO4(MW119.98) 12g蒸馏水至 500ml溶解后,高压灭菌,室温保存。
0.2mol/LNa2HPO4Na2HPO4·12H2O(MW 358.14) 71.6g蒸馏水至 1000ml溶解后,高压灭菌,室温保存。
western blot实验实验步骤

western blot实验实验步骤
Western blot实验步骤如下:
收集蛋白样品:使用细胞裂解液,对贴壁细胞、悬浮细胞或组织样品进行裂解。
然后测定每个蛋白样品的蛋白浓度。
SDS-PAGE凝胶配制:参考一些文献资料进行配制。
样品处理:在收集的蛋白样品中加入适量浓缩的SDS-PAGE蛋白上样缓冲液。
例如2X或5X的SDS-PAGE蛋白上样缓冲液。
使用5X的SDS-PAGE蛋白上样缓冲液可以减小上样体积,在相同体积的上样孔内可以上样更多的蛋白样品。
5X的SDS-PAGE蛋白上样缓冲液可以参考相关文献资料配制,100℃或沸水浴加热3-5分钟,以充分变性蛋白。
上样与电泳:将处理后的蛋白样品冷却到室温后,直接上样到SDS-PAGE胶加样孔内即可。
实验记录-Western-Blot之蛋白的提取与定量

细胞蛋白的提取与测定一、蛋白提取原理: 蛋白质是一切生命活动的承担者, 为了研究及探索蛋白质的功能、特异性蛋白表达水平、翻译后修饰(甲基化磷酸化等)、蛋白-蛋白或蛋白-核酸之间相互作用的研究, 进一步阐明众多疾病的机制, 同时为疾病治疗提供理论依据, 因此需要提取目的蛋白, 由于蛋白质种类繁多, 结构复杂, 需要通过一些步骤使细胞裂解、杂志去除、蛋白纯化来得到目的蛋白。
贴壁细胞蛋白的提取: (所有操作均在冰上进行)准备相应数量的EP管标记后放放冰上备用裂解液制备: 每1ml蛋白裂解液(RIPA)加入10ul蛋白酶抑制剂(如PMSF保护蛋白, 使其免于被蛋白酶降解), 配好后冰上备用;2.此处以6孔板为例, 吸掉培养基后每孔加入1-2ml冰PBS溶液, 清洗 2-3次, 吸净残余BPS(如果有残留的话有可能使提取的蛋白稀释);3.加入适当体积的裂解液, 让裂解液与细胞充分混匀, 冰上裂解30min;4.裂解完成后, 用细胞刮刀将细胞刮下, 将细胞及裂解液吸入离心管, 放离心机4℃12000rpm 离心30min(离心机提前预冷), 上清即为蛋白溶液, 细胞碎片沉降于底部;5.蛋白提取完成后a.可放置于-20℃保存(长期保存放于-80℃);b.可取出部分进行BCA 定量分析;c.做western blot, 需要对蛋白进行变性处理后储存于-20℃或-80℃的冰箱中保存(根据蛋白变性条件不同有所不同, 例如在100℃的高温下水浴锅煮5-10分钟)。
二、组织中总蛋白的提取:1.将已称重的冷冻组织(约50g)放入预冷好的研钵中, 用研杵快速研磨组织, (有的需要加入液氮), 直至组织被研磨成匀浆(无明显颗粒);2.裂解液制备: 取250ulRIPA裂解液+2.5ul 100mmol/L蛋白酶抑制剂+2.5ul蛋白酶抑制剂复合物Cocktail(多种小分子组成的抑制剂混合物能更好的保护蛋白不被蛋白酶降解);3.取适量研磨的匀浆放入离心管, 加入配好的裂解液, 冰上孵育40min;4.离心: 4℃ 12000rpm 离心15min 保留上清;5.将蛋白溶液防止于-20℃保存(长期保存放于-80℃)。
western blot实验内容

western blot实验内容Western Blot实验内容可以简单描述为一种生物化学分析技术,主要用于检测特定蛋白质在细胞或组织中的存在和表达水平。
该实验通常包括以下步骤:1. 样品制备:首先,从细胞培养物或组织中提取蛋白质。
这可以通过细胞裂解和蛋白质提取试剂盒等方法来完成。
2. SDS-PAGE电泳:将提取的蛋白质样品通过SDS-PAGE凝胶电泳进行分离。
在SDS-PAGE中,样品中的蛋白质按照大小被分离成不同的带状条带。
3. 转印:将分离的蛋白质通过电泳转印技术转移到聚丙烯酰胺薄膜(或称为膜)上。
膜可以是尼龙膜或聚乙烯膜。
4. 阻断:将膜置于含有蛋白质阻断剂(如牛血清蛋白或脱脂奶粉)的缓冲液中,以阻止非特异性结合。
5. 一抗孵育:将膜与特异性抗体(一抗)一起在某种缓冲液中孵育。
这些一抗可以结合到目标蛋白质上。
6. 洗涤:通过多次洗涤,去除与一抗非特异性结合的蛋白质。
7. 二抗孵育:膜与与一抗的物种不同的次级抗体(二抗)一起在缓冲液中孵育。
二抗与一抗结合,形成复合物。
8. 洗涤:去除与二抗非特异性结合的蛋白质。
9. 显色:将特定酶底物添加到膜上,使目标蛋白质变色。
例如,常用的酶底物是辣根过氧化物酶(HRP)和4-氨基乙基硅烷(DAB),可以生成棕色的色斑。
10. 图像获取和分析:使用相应的设备(如基于膜的成像系统)捕捉膜的图像,并使用分析软件定量分析蛋白质的表达水平。
通过Western Blot实验,研究人员能够检测和定量不同细胞组分中蛋白质的存在和表达水平,从而深入了解生物系统的功能和调控机制。
Western blot具体实验操作步骤
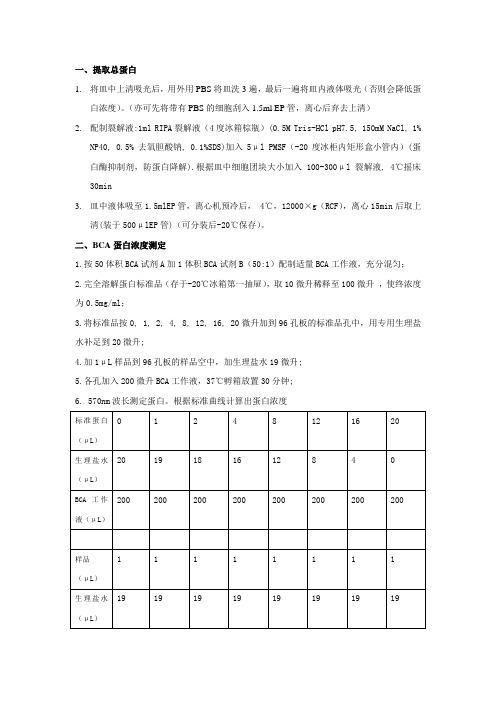
一、提取总蛋白1.将皿中上清吸光后,用外用PBS将皿洗3遍,最后一遍将皿内液体吸光(否则会降低蛋白浓度)。
(亦可先将带有PBS的细胞刮入1.5ml EP管,离心后弃去上清)2.配制裂解液:1ml RIPA裂解液(4度冰箱棕瓶)(0.5M Tris-HCl pH7.5, 150mM NaCl, 1%NP40, 0.5% 去氧胆酸钠, 0.1%SDS)加入5μl PMSF(-20度冰柜内矩形盒小管内)(蛋白酶抑制剂,防蛋白降解).根据皿中细胞团块大小加入100-300μl裂解液, 4℃摇床30min3.皿中液体吸至1.5mlEP管,离心机预冷后, 4℃,12000×g(RCF),离心15min后取上清(装于500μlEP管)(可分装后-20℃保存)。
二、BCA蛋白浓度测定1.按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA工作液,充分混匀;2.完全溶解蛋白标准品(存于-20℃冰箱第一抽屉),取10微升稀释至100微升,使终浓度为0.5mg/ml;3.将标准品按0, 1, 2, 4, 8, 12, 16, 20微升加到96孔板的标准品孔中,用专用生理盐水补足到20微升;4.加1μL样品到96孔板的样品空中,加生理盐水19微升;5.各孔加入200微升BCA工作液,37℃孵箱放置30分钟;6. 570nm波长测定蛋白。
根据标准曲线计算出蛋白浓度EXCEL详细过程:标曲:上一行吸光度,下一行浓度(0,0.5,1,2,4,6,8,10),以此作标曲,标曲相关系数须达两个9,以这次的样品为例,算得两样品浓度分别为4.09和5.26 因为须上样100μg,所以算得须上样的蛋白体积=100/4.09=24.5μL所以上样须补水30-24.5=5.5μL及βme:6×SDS(2:3)为10μL现此样品蛋白体积足够煮10份,即按照245μL蛋白样品+55μL水+100μLβme:SDS(2:3)来配注意:SDS很粘,须涡旋再低速离心,使用枪时须慢吸三、煮蛋白:加样配制: 总体积:40μL(含蛋白液与dH2O混合物30μL+β-meSDS10μL)1.β-巯基乙醇(β-me):6×SDS(2:3)样品缓冲液10μL2.蛋白取量取一组蛋白中,样品蛋白加的体积=蛋白浓度最低的浓度*30μL/每个样品浓度3.剩余的体积即30μL-样品蛋白加的体积,即为各管需补加水的体积4.多加一点防煮时蒸发部分混和后file22-start100℃煮沸5 min。
Western Blot 详细实验步骤

Western Blot protocol1,制样:将获得的细胞用PBS洗涤,300gx4℃x5min,弃去上清。
加SDS loading buffer 搅拌转移到1.5ml离心管。
放到干浴锅100℃煮10min,放入冰上5min,最后存入-20℃冰箱待用。
2,将样品取出待用,可100℃煮2min,待上样。
3,配胶:浓缩胶5%,分离胶8%,10%或12%(分子大用低浓度,分子小用高浓度Caspase3 35kD,12%浓度(活性形式17kD);DAPK1/p-DAPK1 160KD 18%浓度):ddH2O,30%Acrylamide, 1.0M/1.5MTris-HCL, 10%SDS, 10% AP, TEMED按比例加。
1)夹好板子,用ddH2O捡漏,5min。
2)按照顺序加入试剂配胶配分离胶(50ml管子),混匀。
3)加胶7ml,大致与夹子的门平齐。
随后轻轻加3ml乙醇液封页面。
静置30min。
4)将乙醇倒掉,用ddH2O清洗3遍。
5)制备浓缩胶,加入3ml左右只玻璃板界面,插入梳子。
6)静置30min后拔掉梳子。
取下玻璃板用ddH2O 冲洗边缘。
7)若不立即使用可用保鲜膜将其包好放在4℃冰箱。
(TEMED在灌胶前加入)4,上样:1)固定好玻片,加入running buffer 没过底板,盖上盖子。
2)浓缩胶75-80V 30min左右,分离胶100V-120V 1h左右。
5,转膜:1)取出玻璃板,用切胶器轻轻撬动取掉小玻片,切去浓缩胶(将分离胶放入放入ddH2O水中浸泡5min,重复三次)再放入trans buffer中放置10min。
2)剪一块与胶一样大的PVDF膜放在甲醇中浸泡,使其带正电。
3)将PVDF,海绵垫,滤纸放入trans buffer浸泡几分钟。
4)在黑色面板依次放入海绵垫,至少3层滤纸,胶,转移膜,注意不能有气泡,再放滤纸,海绵垫形成夹心结构。
(大分子用0.4 um PVDF 膜,小分子用0.25um PVDF膜)。
Western Blot试验流程

Western Blot试验流程1、蛋白质抽提实验材料为组织样品,取适量(250~500mg)保存的组织样品,加1ml含蛋白酶抑制剂的总蛋白抽提试剂(裂解液),然后按照总蛋白抽提试剂盒抽提总蛋白。
蛋白位置推荐裂解液全细胞NP-40或RIPA胞浆(可溶性蛋白)Tris-HCl胞浆(骨架结合蛋白)Tris-Triton膜蛋白NP-40或RIPA核蛋白RIPA或核蛋白提取试剂盒线粒体蛋白RIPA或线粒体分离试剂盒在裂解液中加入合适的蛋白酶抑制剂,避免蛋白降解,从而保证检测的准确性。
2、蛋白质定量按BCA蛋白质定量试剂盒操作说明操作,测定样品浓度。
3、变性聚丙烯酰胺不连续凝胶电泳(SDS-PAGE)根据待测蛋白分子量大小确定凝胶(分离胶)浓度蛋白分子量(KDa)凝胶浓度(%)4-40 20%12-45 15%10-70 12.5%15-100 10%25-200 8%3.1 清洗玻璃板,准备电泳槽一只手扣紧玻璃板,另一只手蘸点洗衣粉轻轻擦洗。
两面都擦洗过后用自来水冲,再用蒸馏水冲洗干净后立在筐里晾干。
3.2 灌胶玻璃板对齐后放入夹中卡紧。
然后垂直卡在架子上准备灌胶。
(操作时要使两玻璃对齐,以免漏胶。
)3.2.1 配10%分离胶,加入TEMED后立即摇匀灌胶。
灌胶时,待胶面升到绿带中间线高度时即可。
然后胶上加一层去离子水,加快凝胶(灌胶时开始可快一些,胶面快到所需高度时要放慢速度。
操作时胶一定要沿玻璃板流下,防止气泡。
加水液封时要很慢,否则胶会被冲变型)。
3.2.2当水和胶之间有一条折射线时,说明胶已凝了。
待胶充分凝固就可倒去胶上层水并用滤纸将水吸干。
3.2.3配4%的浓缩胶,加入TEMED后立即摇匀灌胶。
将剩余空间灌满浓缩胶然后将梳子插入浓缩胶中。
灌胶时也要使胶沿玻璃板流下以免胶中有气泡产生。
插梳子时要使梳子保持水平。
待到浓缩胶凝固后,两手分别捏住梳子的两边竖直向上轻轻将其拔出。
3.2.4用水冲洗一下浓缩胶,将其放入电泳槽中。
Western_Blot过程步骤详解

做了五个月的Western Blot ,有一点点小心得,给新手点经验.蛋白提取:1.总蛋白提取(胞膜,胞浆,胞核):组织匀浆后,15000g, 4度, 20分钟后,取上清.Buffer:NP40 750ul, 脱氧胆酸钠0.5克, SDS 0.1克, 加1*PBS 至100ml. 再加入PMSF(7.4mg/ml) 0.1ml. (现用现加)7.4mg/ml PMSP异丙醇溶液: 取A mg PMSF 加A/7.4 ml 异丙醇.工厂-20度储存2.组织膜蛋白提取:所在操作冰上进行(1)取组织,用PBS冲洗干净组织上的血液. 加入10ml Buffer A , 用剪刀尽可能剪碎组织,于冰上充分匀浆。
每次30秒,重复3-5次.(2)离心机1000rpm,4℃离心10min 后,所得上清液转入超速离心管。
(去掉大块组织及结缔组织)(3)100000g,4℃离心1hr, 弃去上清.(此为胞浆蛋白,若只提取胞浆蛋白,可用10000rpm, 4度, 30分钟离心,取上清即可)。
沉淀用适量的Buffer B重悬,4度过夜后,分装至EP管,Eppendorf 台式离心机10000rpm,4℃离心30min。
(4)收集所得上清液即为膜组份。
Buffer A:0.32M 蔗糖,5mM Tris-HCl(PH 7.5),120mM KCl,1mM EDTA, 1mM EGTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
Buffer B 20mM HEPES(PH 7.5),10% 甘油,2% Triton X-100, 1mM EDTA, 1mM EGTA, 0.2mM,PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
所得蛋白分装EP管(每管约50ul),取一管测蛋白浓度,其它放入-70度深冻冰箱保存。
WesternBlot实验步骤

WesternBlot实验步骤Western Blot实验步骤Western Blot操作步骤:(一)蛋白样品制备选TRIZOL 法(二)蛋白含量的测定(1)制作标准曲线1、从-20℃取出1mg/ml BSA,室温融化后,备用。
2、取18个1.5ml离心管,3个一组,分别标记为0 g,2.5 g,5.0g ,10.0 g ,20.0 g ,40.0 g。
4、混匀后,室温放置2min。
在生物分光光度计(Bio-Photometer,Eppentoff)上比色分析。
5、(2)检测样品蛋白含量1、取足量的1.5ml离心管,每管加入4℃储存的考马斯亮蓝溶液1ml。
室温放置30min后即可用于测蛋白。
2、取一管考马斯亮蓝加0.15mol/L NaCl溶液100 l,混匀放置2分钟可做为空白样品,将空白倒入比色杯中在做好标准曲线的程序下按blank测空白样品。
3、弃空白样品,用无水乙醇清洗比色杯2次(每次0.5ml),再用无菌水洗一次。
4、取一管考马斯亮蓝加95 l 0.15mol/L NaCl NaCl溶液和5 l待测蛋白样品,混匀后静置2min,倒入扣干的比色杯中按sample检测样品。
注意:每测一个样品都要将比色杯用无水乙醇洗2次,无菌水洗一次。
可同时混合好多个样品再一起测,这样对测定大量的蛋白样品可节省很多时间。
测得的结果是5 l样品含的蛋白量。
(1)清洗玻璃板:一只手扣紧玻璃板,另一只手蘸点洗衣粉轻轻擦洗。
两面都擦洗过后用自来水冲,再用蒸馏水冲洗干净后立在筐里晾干。
(2)灌胶与上样1、玻璃板对齐后放入夹中卡紧。
然后垂直卡在架子上准备灌胶。
(操作时要使两玻璃对齐,以免漏胶。
)2、按前面方法配10%分离胶,加入TEMED后立即摇匀即可灌胶。
灌胶时,可用10ml枪吸取5ml胶沿玻璃放出,待胶面升到绿带中间线高度时即可。
然后胶上加一层水,液封后的胶凝的更快。
(灌胶时开始可快一些,胶面Western Blot实验步骤快到所需高度时要放慢速度。
蛋白质印迹(Western blotting)实验操作步骤

蛋白质印迹/Western blotting实验操作步骤一、总蛋白的提取单层贴壁细胞总蛋白的提取:1)吸除培养液2)每皿细胞加4℃预冷的 PBS。
平放轻轻摇动 1min 洗涤细胞,然后弃去洗液。
重复上操作两次,共洗细胞三次以洗去培养液。
将PBS弃净后把培养瓶置于冰上。
(PBS会降低细胞裂解液的效价和总蛋白的浓度)3)加裂解液于冰上裂解 30 min,为使细胞充分裂解,培养瓶要经常来回摇动(可放置在4℃摇床裂解)。
4)裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),然后用枪将细胞碎片和裂解液移至 1.5mL 离心管中。
(整个操作尽量在冰上进行)5)在EP管中将细胞震碎(10s/次,3次)6)于4℃下 12000rpm 离心 20-30 min。
(离心机提前预冷至4℃)7)将离心后的上清分装转移倒 1.5mL 的离心管中放于-20℃保存。
二、BCA法测蛋白浓度1)将BCA protein assay每孔 A液200μL,B液4μL混合,96孔板每孔加入22.5μLdd水,2.5μL蛋白提取液,200μLA+B混合液2)在烘箱中37℃,90r,孵育30min3)使用酶标仪测出吸光度后,使用公式y=0.9154x-0.118计算出蛋白浓度(浓度需要×10)4)将蛋白配成等浓度等体积(使用配置好的裂解液配),按照4:1加入5X loading buffer然后煮5min(100℃),放入-20℃保存三、SDS-PAGE电泳板子1.5mm,梳子1.5mm1)清洗玻璃板:一只手扣紧玻璃板,另一只手蘸点洗衣粉轻轻擦洗。
两面都擦洗过后用自来水冲洗2)验漏:玻璃板对齐后放入夹中卡紧,然后垂直卡在架子上,加满水验漏3)灌胶:验漏结束后用纸吸干水分,按方法配制下层胶(4mL+4mL+80μLAP),灌胶时,可用 1mL 枪吸取胶沿玻璃放出,待胶面升到绿带中间线高度时即可。
然后胶上加1 mL水,液封后的胶凝的更快。
westernblot操作流程

Western Blotting 操作指南【基本操作流程】提取细胞或组织蛋白、测定含量↓制备SDS-PAGE胶↓蛋白样品变性、电泳↓电泳转膜↓封闭↓一抗↓TBST洗涤↓HRP标记的二抗↓TBST洗涤↓ECL试剂作用↓X-光片曝光、显影↓结果分析以下实验中提及仪器为:BIO-RAD mini电泳、湿转、半干转系统抗体:一抗推荐进口品牌Abcam、CST、santcruz【主要试剂配置】试剂可自行配置或购买现成商品化试剂1、 30%丙烯酰胺储存液:29.0g丙烯酰胺(Acr),1.0g亚甲双丙烯酰胺(Bis),混匀后加ddH2O,定容至100ml,棕色瓶保存于4℃。
(注意:未聚合的丙烯酰胺有神经毒性,须在通风橱内小心操作)。
2、 1.5M Tris-HCl(pH 8.0): 18.17g Tris碱加ddH2O溶解,盐酸调pH至8.0,定容至100ml,4℃保存。
3、 1.5M Tris-HCl(pH 8.8):18.17gTris碱加ddH2O溶解,盐酸调pH至8.0,定容至100ml,4℃保存。
4、 1M Tris-HCl(pH 6.8): 12.11 gTris碱加ddH2O溶解,盐酸调pH至6.8,定容至100ml,4℃保存。
5、 2×上样缓冲液(10ml):0.6ml 1mol/L Tris-HCL (pH6.8),4ml甘油,2ml10% SDS, 2ml 1mol/L 二硫苏糖醇(DTT),1ml 1%溴酚蓝,0.9ml ddH2O,可在4℃存放数周,或在-20℃保存数月。
6、 10% (w/v) SDS:电泳级SDS 10.0 g加ddH2O, 68℃助溶,盐酸调至pH 7.2,定容至100ml,室温保存。
7、 10%过硫酸铵(AP): 0.1gAP加ddH2O至1ml,-20℃保存一个月左右或4℃一星期。
8、 5×电泳缓冲液(1L): 15.1g Tris碱, 94g甘氨酸,50ml 10%SDS,加ddH2O溶解,调pH 8.3定容至1L,临用前稀释5倍。
Westernblot试剂配制及操作流程

Western-Blot操作流程试剂配制1.RIPA裂解液:50mM Tris(MW121.14,PH7.5)3.02g150mM NaCl 4.38g1%TritonX-100 5ml1%脱氧胆酸钠5g0.1%SDS 0.5g蒸馏水至500ml。
调pH值至7.5。
混匀后4℃保存,长期保存于-20℃。
使用时,加入蛋白酶抑制剂cooktail。
2. 蛋白酶抑制剂cooktail所需母液成分:(1)100mmol/L PMSFPMSF 17.4mg异丙醇1ml溶解后,分装于1.5ml离心管中,-20℃保存。
(2)10mM 亮肽素leupeptin:-20℃保存(3)2.1mg/ml 抑肽素Aprotinin:4℃保存配制:成分终浓度每ml裂解液所加母液量PMSF 1mmol/L(储存浓度稀释100倍)10ulLeupeptin 0.1mmol/L(储存浓度稀释100倍)10ulAprotinin 1ug/ml (储存浓度稀释2000倍)0.5ul各成分直接加入所用的RIPA裂解液中,之后按照60ul/孔(12孔板)提取蛋白。
1. G250考马斯亮蓝溶液(蛋白定量专用)考马斯亮蓝G250 100mg95%乙醇50ml85%磷酸100ml蒸馏水至1000ml配制时,先用乙醇溶解考马斯亮蓝染料,再加入磷酸和水,混匀后,用滤纸过滤,4℃保存于棕色瓶中。
2.牛血清白蛋白B SA储存液(1mg/ml):100mg BSA粉末溶于20 ml双蒸水,定容至100 ml,加少量防腐剂,4℃保存。
1.4X上样缓冲液1.0 mol/L Tris·HCl(pH6.8)2mlSDS 0.8g溴酚蓝0.04g甘油4ml去离子水定容至10ml。
混匀后,分装于1.5ml离心管中,4℃保存。
使用时稀释成1X。
2.1.0 mol/L二硫苏糖醇(DTT)(10X)用20 ml 0.01 mol/L乙酸钠溶液(pH5.2)溶解3.09g DTT,分装成1ml小份储存于-20 C。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Western blot实验蛋白提取及定量、相关试剂配制、电泳、转膜及显色过程步骤高征2014年6月第一部分细胞核蛋白与细胞浆蛋白抽提过程(碧云天试剂盒)一、原理在研究细胞时经常要研究细胞的不同组份,而研究得最多的两个细胞组份就是细胞核和细胞浆。
分离细胞核蛋白和细胞浆蛋白,不仅可以用于研究蛋白在细胞内的定位,而且很多时候分离出来的核蛋白可以用于转录调控方面的研究,例如EMSA(也称gel shift),footprinting等。
细胞核蛋白与细胞浆蛋白抽提试剂盒(Nuclear and Cytoplasmic Protein Extraction Kit)提供了一种比较简单、方便的从培养细胞或新鲜组织中抽提细胞核蛋白与细胞浆蛋白的方法。
约90分钟就可以完成培养细胞的细胞核蛋白与细胞浆蛋白的分离。
抽提得到的蛋白可以用于Western,EMSA,footprinting,报告基因检测以及酶活力测定等后续操作。
本试剂盒是通过细胞浆蛋白抽提试剂A和B,在低渗透压条件下,使细胞充分膨胀,然后破坏细胞膜,释放出细胞浆蛋白,然后通过离心得到细胞核沉淀。
最后通过高盐的细胞核蛋白抽提试剂抽提得到细胞核蛋白。
本试剂盒可以抽提50个样品,如果每个样品的数量为约二百万细胞或约30-50毫克组织。
二、注意事项1.需自备PMSF。
PMSF一定要在抽提试剂加入到样品中前2-3分钟内加入,以免PMSF在水溶液中很快失效。
2.抽提蛋白的所有步骤都需在冰上或4℃进行。
3.本试剂盒对于组织样品,仅适合于新鲜组织,对冻存过的组织抽提效果很差。
可以抽提的组织样品数通常不足100个。
4.使用本试剂盒抽提到的细胞核蛋白与细胞浆蛋白均可直接用碧云天生产的BCA蛋白浓度测定试剂盒(P0009/P0010/P0010S/P0011/P0012/P0012S)测定蛋白浓度。
但不适合用Bradford法测定蛋白浓度。
5.为了您的安全和健康,请穿实验服并戴一次性手套操作。
三、使用说明1. 准备溶液:室温融解试剂盒中的三种试剂,溶解后立即放置在冰上,混匀。
取适当量的细胞浆蛋白抽提试剂A备用,在使用前数分钟内加入PMSF,使PMSF 的最终浓度为1mM。
取适当量的细胞核蛋白抽提试剂备用,在使用前数分钟内加入PMSF,使PMSF的最终浓度为1mM。
(蛋白酶抑制剂可酌情翻倍)2. 对于贴壁细胞:用PBS洗一遍,用细胞刮子刮下细胞,或用EDTA溶液(0.5%处理5min)处理细胞使细胞不再贴壁很紧,并用移液器吹打下细胞。
离心(1400 r/min 5min)收集细胞,尽最大努力吸尽上清,留下细胞沉淀备用。
尽量避免用胰酶消化细胞,以免胰酶降解需抽提的目的蛋白。
3. 对于悬浮细胞:用PBS洗一遍,离心收集细胞,尽最大努力吸尽上清,留下细胞沉淀备用。
4. 每20微升细胞沉淀加入200微升添加了PMSF的细胞浆蛋白抽提试剂A。
(对于二百万Hela细胞,其细胞沉淀的体积大约为20微升或40毫克。
)5. 最高速剧烈涡旋震荡5秒,把细胞沉淀完全悬浮并分散开。
(如果细胞沉淀没有完全悬浮并分散开,可以适当延长震荡时间。
)(时间可稍长,保证细胞破碎)6. 冰浴10-15分钟。
7. 加入细胞浆蛋白抽提试剂B 10微升。
最高速剧烈V ortex 5秒,冰浴1分钟。
8. 最高速剧烈V ortex 5秒,4℃12,000-16,000g离心5分钟。
9. 立即吸取上清至一预冷的塑料管中,即为抽提得到的细胞浆蛋白。
可以立即使用,也可以冻存。
(千万不要触及沉淀,可以在沉淀上方保留极小体积的上清,以免触及沉淀。
)10. 对于沉淀,完全吸尽残余的上清,加入50微升添加了PMSF的细胞核蛋白抽提试剂。
(不吸尽上清会带来细胞浆蛋白的污染。
)11. 最高速剧烈V ortex 15-30秒,把细胞沉淀完全悬浮并分散开。
然后放回冰浴中,每隔1-2分钟再高速剧烈V ortex 15-30秒,共30分钟。
12. 4℃12,000-16,000g离心10分钟。
13. 立即吸取上清至一预冷的塑料管中,即为抽提得到的细胞核蛋白。
可以立即使用,也可以-70℃冻存。
14. 对于新鲜组织:A. 把组织尽可能切成非常细小的碎片。
按照20:1的比例混合适当量的细胞浆蛋白抽提试剂A和B(例如200微升细胞浆蛋白抽提试剂A中加入10微升抽提试剂B)。
并加入PMSF至最终浓度为1mM配制成组织匀浆液。
按照每60mg组织加入200微升组织匀浆液的比例混合组织和组织匀浆液,并在玻璃匀浆器内充分匀浆。
匀浆需在冰浴或4℃进行。
B. 匀浆后把匀浆液转移到塑料离心管内,冰浴放置15分钟。
C. 4℃1,500g离心5分钟。
把上清转移至一预冷的塑料管中,为抽提得到的部分细胞浆蛋白。
(吸上清时千万不要触及沉淀。
)D. 对于沉淀,到了这一步已经充分匀浆,但很多细胞还没有破碎。
接下去按照使用说明的步骤4开始操作,即把沉淀当做已经离心收集好的细胞沉淀操作,按照步骤4至步骤13抽提得到细胞浆蛋白和细胞核蛋白。
抽提得到的细胞浆蛋白可以和步骤14C中抽提得到的细胞浆蛋白合并。
第二部分蛋白定量-BCA 法(南京建成试剂盒)一、实验仪器:试管、微量移液器、旋涡混匀器、37℃水浴箱(气浴箱)、可见分光光度计(562nm)二、适用范围:本试剂盒可测各种动物血清(浆)、组织、培养细胞、细胞培养上清及植物等样本中的蛋白含量。
三、试剂组成及配制试剂一:粉剂2支、稀释液12.5 ml 2瓶试剂一应用液的配制:取试剂一粉剂1支与试剂一稀释液1瓶混匀,溶解完全后4度待用。
试剂二:250μl 2支工作液的配制:按试剂一应用液:试剂二=50:1的比例配制,混匀后待用,用多少配多少。
试剂三:终止剂储备液20ml 1瓶终止剂应用液:取终止剂储备液用双蒸水5倍稀释后备用,4度冷藏试剂四:563 ug/ml 蛋白标准液0.2ml 1支,4度保存1个月(可分装-20冷冻)四、操作步骤:1、样本前处理:①、动物组织样本:准确称取组织重量,按重量(g):体积(ml)=1:9 的比例,加入9倍体积的生理盐水,冰水浴条件下机械匀浆,2500 转/分,离心10 分钟,取上清液,待测。
②、植物组织样本:准确称取组织重量,按重量(g):体积(ml)=1:9 的比例,加入9 倍体积的匀浆介质,冰水浴条件下机械匀浆,3500 转/分,离心10 分钟,取上清液,待测。
③、血清(浆)样本:按血清(浆)︰生理盐水=1︰49的比例稀释,待测。
④、其它液体样本:按比例稀释,测定范围为20~2000μg/ml,(不同的样本稀释度不一样),请在批量测试前先做1~2 个样本的预实验。
2、操作表:空白管标准管测定管双蒸水(μl)20 0 00 20 0563μg/ml 标准品(μl)待测样本(μl)0 0 20工作液(μl)250 250 250漩涡混匀,37℃孵育30 分钟终止剂应用液(μl)750 750 750漩涡混匀,静置5 分钟,562nm 波长,水调零,0.5cm 光径测各管OD 值五、计算公式:六、测定原理:碱性条件下,蛋白将Cu2+还原为Cu+,Cu+与BCA试剂形成紫色的络合物,562nm 处有最大吸收峰,依据吸光度与浓度成比例,通过测吸光度即可计算待测蛋白的浓度。
七、检测范围检测浓度下限达到20μg/ml,最小检测蛋白量达到0.5μg,在20~2000μg/ml 浓度范围内有良好的线性关系。
标准曲线范围:标准品浓度(μg/ml)绝对OD值0~2500 0~0.499Western blot相关试剂配制A.30%聚丙烯酰胺储备液(Acr/Bis):丙烯酰胺(Acr),29g;N,N-亚甲基双丙烯酰胺(Bis),1g,去离子水溶解,37℃水浴助溶,定容至100mL。
0.45μm滤器过滤,棕色瓶4℃避光保存。
B.10%十二烷基硫酸钠(SDS):SDS,10g;H2O,80mL。
68℃加热溶解,浓HCl调pH至7.2,定容至100mL,室温保存。
C.10%过硫酸铵(AP):AP,1g;H2O,10mL。
避光,4℃保存。
(4℃2周)D.分离胶缓冲液(1.5MTris-HCl pH8.8):Tris,18.17g;H2O 80mL。
用浓HCl 调pH至8.8,定容至100mL,4℃保存。
E.浓缩胶缓冲液(1.0MTris-HCl pH6.8):Tris,12.11g;H2O 80mL。
用浓HCl 调pH至6.8,定容至100mL,4℃保存。
F.电泳缓冲液(10×):甘氨酸(Glycine),188g;Tris 30.2g;SDS,10g;H2O,800mL。
调节pH至8.3,定容至1L,4℃保存(用时稀释为1×)。
G.5×SDS-PAGEloadingBuffer(5mL):1MTris-HCl(pH6.8),1.25mL;SDS,0.5g;溴酚蓝(BPB),25mg;甘油,2.5mL;加去离子水定容至5mL。
充分混匀,分装成500μL/份,室温保存。
使用前每份加入25μLβ-巯基乙醇(2-ME),加入2-ME的loading buffer可在室温下保存一个月左右。
H.考马斯亮蓝染色固定液:40%双蒸水, 10% 醋酸, 50%甲醇,室温保存I.考马斯亮蓝染色液:考马斯亮蓝R-250,250mg;甲醇,45ml;冰醋酸,10ml;H2O,定容至100ml。
室温保存。
J.考马斯亮蓝染色脱色液:醋酸,100ml;乙醇,50ml;dH2O 850ml,充分混合,室温保存K.膜转移缓冲液:甘氨酸,2.9g;Tris,5.8g;SDS,0.37g;加H2O 600mL充分溶解,加200mL甲醇,混匀,定容至1L,室温保存。
L.TBS缓冲液:NaCl,8.8g;1M Tis-HCL(pH 8.0),20ml,加入约800 H2O搅拌溶解,定容至1L,4℃保存。
M.TBST缓冲液:NaCl,8.8g;1M Tis-HCL(pH 8.0),20ml,加入约800 H2O 搅拌溶解,加入0.5 ml Tween 20后充分混匀,去离子水定容至1L,4℃保存。
N.1M Tis-HCL(pH 8.0):Tris 121.1g 置于1L烧杯,加入约800ml去离子水,充分搅拌,加入浓HCL约42ml ,定容至1L,高压灭菌,室温保存。
Western blot电泳、转膜及显色过程1、清洗将玻璃板洗净,用ddH2O冲洗,然后晾干。
封板时保证支架与底座胶条契合,固定时两边同时均匀用力旋动齿轮把手,固定即可,不要用力过大以免压碎玻璃。
封好后可装ddH2O试试,确定不漏后再灌胶。
2、制胶①SDS-PAGE分离胶配方表(12% Gel)各种组分名称各种凝胶体积对应的各种组分的取样量(ml)10 ml 15 ml 20 mlH2O 3.3 4.9 6.630%Acrylamide4.0 6.0 8.01.5MTris-Hcl(pH8.8)2.53.8 5.010% SDS 0.1 0.15 0.210%过硫酸铵(AP)0.1 0.15 0.2TEMED 0.004 0.006 0.008②SDS-PAGE浓缩胶(5% Acrylamide)配方表各种组分名称各种凝胶体积对应的各种组分的取样量(ml)4 ml5 ml6 mlH2O 2.7 3.4 4.1 30%Acrylamide0.67 0.83 1.01.0MTris-Hcl(pH6.8)0.5 0.63 0.7510% SDS 0.04 0.05 0.06 10%过硫酸铵(AP)0.04 0.05 0.06TEMED 0.004 0.005 0.0063、封胶①按前面方法配分离胶,加入TEMED后立即摇匀即可灌胶。
