元素化学2_04.5.6_
元素周期表化合价口诀优秀课件

相对原 23 24 27 28 31 32 35.5 40 39 40 子质量
化合价口诀
钾钠银氢 正一价, 钙镁钡锌 正二价。 三铝 四硅 五价磷, 二三铁,二四碳。 二四六七锰都占, 负二、四六硫都齐全, 负三、二四五氮全占。 铜汞一二最常见, 氟氯溴碘记负一, 莫忘单质价为零。
K Na Ag H +1
元素周期表化合价口诀优秀课 件
元素周期表(前20号元素)
元素 氢 氦 锂 铍 硼 碳 氮 氧 氟 氖
名称
元素 符 4 7 9 11 12 14 16 19 20 子质量
元素 钠 镁 铝 硅 磷 硫 氯 氩 钾 钙
名称
元素 Na Mg Al Si P S Cl Ar K Ca 符号
Ca Mg Ba Zn +2 3 Al 4 Si 5价P 2、3 Fe 2、4 C 2、4、6、7 Mn 都占 -2,4、6 S 都齐全 -3,2、4、5 N 全占 Cu、Hg 1、2最常见 F Cl Br I -1 莫忘单质价为零。
化学元素周期表

(一)
N 氮O氧S 硫,C 碳P 磷金Au;
K 钾I 碘Al 铝,钨的符号W。
……
(二)
H He Li Be B (氢氦锂铍硼), C N O F Ne (碳氮氧氟氖) Na Mg Al Si P (钠镁铝硅磷) ,S Cl Ar K Ca (硫氯氩钾钙) 五个五个背,比较顺口。
(三)
化合价:
一价请驴脚拿银,(一价氢氯钾钠银),
二价羊盖美背心。
(二价氧钙镁钡锌)
一价钾钠氢氯银,二价氧钙钡镁锌;
三铝四硅五价磷,二三铁、二四碳;
一至五价都有氮,铜汞二价最常见。
正一铜氢钾钠银,正二铜镁钙钡锌;
三铝四硅四六硫,二四五氮三五磷;
一五七氯二三铁,二四六七锰为正;
碳有正四与正二,再把负价牢记心;
负一溴碘与氟氯,负二氧硫三氮磷。
初中常见原子团化合价口决:
负一硝酸氢氧根,负二硫酸碳酸根,
还有负三磷酸根,只有铵根是正一。
氢氦锂铍硼,碳氮氧氟氖;
钠镁铝硅磷,硫氯氩钾钙。
记化合价,我们常用下面的口诀:
一价氢氯钾钠银,二价钙镁钡氧锌。
二铜三铝四七锰,二四六硫二四碳,
三价五价氮与磷,铁有二三要记清。
记金属活动性顺序表可以按照下面的口诀来记:钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金。
分组背诵:
H He Li Be B (氢氦锂铍硼)3 C N O F Ne(碳氮氧氟氖) 4
Na Mg Al Si P (钠镁铝硅磷) 5 S ClAr K Ca (硫氯氩钾钙)6
Sc Ti V Cr Mn (钪钛钒铬锰)7 Fe Co Ni Cu Zn (铁钴镍铜锌)。
元素周期表(Easy To Read)

序号符号中文读音原子量外层电子常见化合价分类英文名英文名音标其它1H氢轻11s11、-1主/非/其Hydrogen ['haidrədʒən]最轻2He氦害41s2主/非/稀Helium['hi:liəm]最难液化3Li锂里72s11主/碱Lithium['liθiəm]活泼4Be铍皮92s22主/碱土Beryllium[be'riliəm]最轻碱土金属元素5B硼朋112s2 2p13主/类Boron['bɔ:rɔn]硬度仅次于金刚石的非金属元素6C碳探122s2 2p22、4、-4主/非/其Carbon['kɑ:bən]硬度最高7N氮蛋142s2 2p3-3 1 2 34 5主/非/其Nitrogen['naitrədʒən]空气中含量最多的元素8O氧养162s2 2p4-2、-1、2主/非/其Oxygen['ɔksidʒən]地壳中最多9F氟福192s2 2p5-1主/非/卤Fluorine ['fluəri:n]最活泼非金属,不能被氧化10Ne氖乃202s2 2p6主/非/稀Neon['ni:ɔn]稀有气体11Na钠那233s11主/碱Sodium['səudiəm]活泼12Mg镁每243s22主/碱土Magnesium[mæɡ'ni:ziəm]轻金属之一13Al铝吕273s2 3p13主/金/其Aluminum [,ælju'minjəm]地壳里含量最多的金属14Si硅归283s2 3p24主/类Silicon['silikən]地壳中含量仅次于氧15P磷林313s2 3p3-3、3、5主/非/其Phosphorus ['fɔsfərəs]白磷有剧毒16S硫留323s2 3p4-2、4、6主/非/其Sulfur['sʌlfə]质地柔软,轻。
化学元素表带拼音

第02 号元素: 氦[化学符号]He, 读“亥”第03 号元素: 锂[化学符号]Li, 读“里”第04 号元素: 铍[化学符号]Be, 读“皮”第05 号元素: 硼[化学符号]B, 读“朋”第06 号元素: 碳[化学符号]C, 读“炭”第07 号元素: 氮[化学符号]N, 读“淡”第08 号元素: 氧[化学符号]O, 读“养”第09 号元素: 氟[化学符号]F, 读“弗”第10 号元素: 氖[化学符号]Ne, 读“乃”第11 号元素: 钠[化学符号]Na, 读“纳”第12 号元素: 镁[化学符号]Mg, 读“美”第13 号元素: 铝[化学符号]Al, 读“吕”第14 号元素: 硅[化学符号]Si, 读“归”第15 号元素: 磷[化学符号]P, 读“邻”第16 号元素: 硫[化学符号]S, 读“流”第17 号元素: 氯[化学符号]Cl, 读“绿”第18 号元素: 氩[化学符号]Ar,A, 读“亚”第19 号元素: 钾[化学符号]K, 读“甲”第20 号元素: 钙[化学符号]Ca, 读“丐”第21 号元素: 钪[化学符号]Sc, 读“亢”第22 号元素: 钛[化学符号]Ti, 读“太”第23 号元素: 钒[化学符号]V, 读“凡”第25 号元素: 锰[化学符号]Mn, 读“猛”第26 号元素: 铁[化学符号]Fe, 读“铁”第27 号元素: 钴[化学符号]Co, 读“古”第28 号元素: 镍[化学符号]Ni, 读“臬”第29 号元素: 铜[化学符号]Cu, 读“同”第30 号元素: 锌[化学符号]Zn, 读“辛”第31 号元素: 镓[化学符号]Ga, 读“家”第32 号元素: 锗[化学符号]Ge, 读“者”第33 号元素: 砷[化学符号]As, 读“申”第34 号元素: 硒[化学符号]Se, 读“西”第35 号元素: 溴[化学符号]Br, 读“秀”第36 号元素: 氪[化学符号]Kr, 读“克”第37 号元素: 铷[化学符号]Rb, 读“如”第38 号元素: 锶[化学符号]Sr, 读“思”第39 号元素: 钇[化学符号]Y, 读“乙”第40 号元素: 锆[化学符号]Zr, 读“告”第41 号元素: 铌[化学符号]Nb, 读“尼”第42 号元素: 钼[化学符号]Mo, 读“目”第43 号元素: 碍[化学符号]Tc, 读“得”第44 号元素: 钌[化学符号]Ru, 读“了”第45 号元素: 铑[化学符号]Rh, 读“老”第46 号元素: 钯[化学符号]Pd, 读“巴”第48 号元素: 镉[化学符号]Cd, 读“隔”第49 号元素: 铟[化学符号]In, 读“因”第50 号元素: 锡[化学符号]Sn, 读“西”第51 号元素: 锑[化学符号]Sb, 读“梯”第52 号元素: 碲[化学符号]Te, 读“帝”第53 号元素: 碘[化学符号]I, 读“典”第54 号元素: 氙[化学符号]Xe, 读“仙”第55 号元素: 铯[化学符号]Cs, 读“色”第56 号元素: 钡[化学符号]Ba, 读“贝”第57 号元素: 镧[化学符号]La, 读“兰”第58 号元素: 铈[化学符号]Ce, 读“市”第59 号元素: 镨[化学符号]Pr, 读“普”第60 号元素: 钕[化学符号]Nd, 读“女”第61 号元素: 钷[化学符号]Pm, 读“颇”第62 号元素: 钐[化学符号]Sm, 读“衫”第63 号元素: 铕[化学符号]Eu, 读“有”第64 号元素: 钆[化学符号]Gd, 读“轧”第65 号元素: 铽[化学符号]Tb, 读“忒”第66 号元素: 镝[化学符号]Dy, 读“滴”第67 号元素: 钬[化学符号]Ho, 读“火第68 号元素: 铒[化学符号]Er, 读“耳”第69 号元素: 铥[化学符号]Tm, 读“丢”第71 号元素: 镥[化学符号]Lu, 读“鲁”第72 号元素: 铪[化学符号]Hf, 读“哈”第73 号元素: 钽[化学符号]Ta, 读“坦”第74 号元素: 钨[化学符号]W, 读“乌”第75 号元素: 铼[化学符号]Re, 读“来”第77 号元素: 铱[化学符号]Ir, 读“衣”第78 号元素: 铂[化学符号]Pt, 读“伯“第79 号元素: 金[化学符号]Au, 读“今”第80 号元素: 汞[化学符号]Hg, 读“拱”第81 号元素: 铊[化学符号]Tl, 读“他”第82 号元素: 铅[化学符号]Pb, 读“千”第83 号元素: 铋[化学符号]Bi, 读“必”第84 号元素: 钋[化学符号]Po, 读“泼”第85 号元素: 砹[化学符号]At, 读“艾”第86 号元素: 氡[化学符号]Rn, 读“冬”第87 号元素: 钫[化学符号]Fr, 读“方”第88 号元素: 镭[化学符号]Ra, 读“雷”第89 号元素: 锕[化学符号]Ac, 读“阿”第90 号元素: 钍[化学符号]Th, 读“土”第91 号元素: 镤[化学符号]Pa, 读“仆”第92 号元素: 铀[化学符号]U, 读“由”第93 号元素: 镎[化学符号]Np, 读“拿”第95 号元素: 镅[化学符号]Am, 读“眉”第96 号元素: 锔[化学符号]Cm, 读“局”第97 号元素: 锫[化学符号]Bk, 读“陪”第98 号元素: 锎[化学符号]Cf, 读“开”第99 号元素: 锿[化学符号]Es, 读“哀”第100 号元素: 镄[化学符号]Fm, 读“费”第101 号元素: 钔[化学符号]Md, 读“门”第102 号元素: 锘[化学符号]No, 读“诺”第103 号元素: 铹[化学符号]Lw, 读“劳”第104 号元素: 鐪[化学符号]Rf, 读“卢”第105 号元素: 钅杜[化学符号]Db, 读“杜”第106 号元素: 钅喜[化学符号]Sg , 读”喜“第107 号元素: 钅波[化学符号]Bh, 读"波“第108 号元素: 钅黑[化学符号]Hs, 读”黑“第109 号元素: 钅麦[化学符号]Mt, 读"麦"第110 号元素: 鐽[化学符号]Ds, 读”达“第111 号元素: 钅仑[化学符号]Rg, , 读”伦“第112 号元素: uub(112)第113 号元素: uut(113)第114 号元素: uuq(114)第115 号元素: uup(115)第116 号元素: uuh(116)22. (10分)如图,在Rt △ABC 中,∠B=90°,BC=53,∠C=30°.点D 从点C 出发沿CA 方向以每秒2个单位长的速度向点A 匀速运动,同时点E 从点A 出发沿AB 方向以每秒1个单位长的速度向点B 匀速运动,当其中一个点到达终点时,另一个点也随之停止运动.设点D 、E 运动的时间是t 秒(t >0).过点D 作DF ⊥BC 于点F ,连接DE 、EF.(1)求证:AE=DF ;(2)四边形AEFD 能够成为菱形吗?如果能,求出相应的t 值;如果不能,说明理由. (3)当t 为何值时,△DEF 为直角三角形?请说明理由. 22.(1)在△DFC 中,∠DFC =90°,∠C=30°,DC =2t ,∴DF =t.又∵AE=t ,∴AE=DF.…………………………………………………………………………2分(2)能.理由如下:∵AB ⊥BC ,DF ⊥BC ,∴AE ∥DF.又AE=DF ,∴四边形AEFD 为平行四边形.…………………………………………………3分∵AB =BC ·tan30°=3535,210.3AC AB 10 2.ADAC DC t 若使AEFD Y 为菱形,则需10.102,.3AE AD t t t 即即当103t 时,四边形AEFD 为菱形.……………………………………………………5分(3)①∠EDF =90°时,四边形EBFD 为矩形. 在Rt △AED 中,∠ADE=∠C=30°,∴AD=2AE.即10-2t=2t ,52t.………………7分②∠DEF=90°时,由(2)知EF ∥AD ,∴∠ADE=∠DEF =90°.∵∠A=90°-∠C=60°,∴AD=AE ·cos60°.即1102, 4.2t t t …………………………………………………………………………9分③∠EFD =90°时,此种情况不存在. 综上所述,当52t 或4时,△DEF 为直角三角形.……………………………………10分。
化学元素中英日对照表
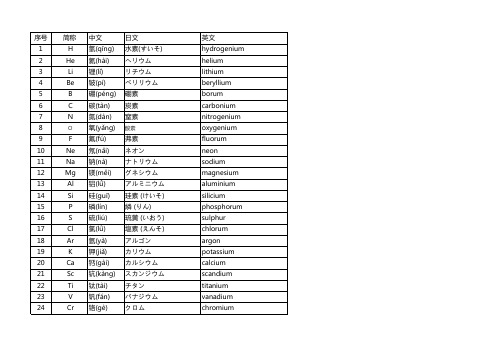
レ二ウム オスミウム イリジウム 白金 (はっきん) 金 (きん) 水银 (すいぎん) タリウム 鉛(なまり) ビスマス ポロニウム アスタチン ラドン フランシウム ラジウム アクチニウム トリウム プロトアクチニウム ウラン ネプツニウム プルトニウム アメリシウム キュリウム バークリウム カリホルニウム アインスタイニウム
Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In
锰(měng) 铁(tiě) 钴(gǔ) 镍(niè) 铜(tóng) 锌(xīn) 镓(jiā) 锗(zhě) 砷(shēn) 硒(xī) 溴(xiù) 氪(kè) 铷(rú) 锶(sī) 钇(yǐ) 锆(gào) 铌(ní) 钼(mù) 锝(dé) 钌(liǎo) 铑(láo) 钯(bā) 银(yín) 镉(gé) 铟(yīn)
stannum antimony tellurium iodium xenon cesium barium lanthanum cerium praseodymium neodymium promethium samerum europium gadolinium terbium dysprosium holmium erbium thulium ytterbium lutetium hafnium tantalum tungsten
manganese ferrum cobalt nkckel cuprum zincum gallium germanium arsenium selenium bromium krypton rubidium strontium yttrium zirconium niobium molybdenum technetium ruthenium rhodium palladium argentum cadmium indium
元素周期表(word版)

1H
2He
氢
1.0079
nA
mA
vA
vA
wA
皿A
氦
4.0026
3Li
锂
6.941
4Be
铍
9.0122
非金属
碱金属
碱土
金属
镧系
元素
锕系
元素
过渡
金属
主族
金属
类金属
5B硼10.811
6C
碳
12.011
7N
氮
14.007
8O氧
15.999
9F
氟
18.998
10Ne
氖
20.17
卤素
元素
惰性
气体
•气体
180.947
183.8
186.207
190.2
192.2
195.08
196.967
200.5
204.3
207.2
208.98
(209)
(201)
(222)
87Fr
钫
(223)
88Ra
镭
226.03
89-103
Ac-Lr
锕系
104Rf
鑪
(261)
105Db
釒杜
(262)
106Sg
釒喜
(266)
107Bh
91Pa
92U
93Nb
94Pu
95Am
96Cm
97Bk
98Cf
99Es
100Fm
101Md
102No
103Lr
锕
钍
镤
铀
镎
钚
镅
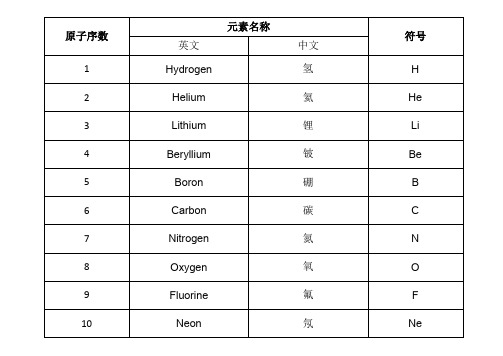
化学元素表
镝 钬 铒 铥 镱 镥 铪 钽 钨 铼 锇
Dy Ho Er Tm Yb Lu(Cp) Hf Ta W Re Os
77 78 79 80 81 82 83 84 85 86 87
Iridium Platinum Aurum (Gold) Hydrargyrum (Mercury) Thallium Plumbum (Lead) Bismuth Polonium Astatine Radon Francium
鐽 錀 鎶
Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo
镭 锕 钍 镤 铀 镎 钚 镅 锔 锐 锎
Ra Ac Th Pa U Np Pu Am Cm Bk Cf
99 100 101 102 103 104 105 106 107 108 109
ium Lawrencium Rutherfordium Dubnium Seaborgium Bohrium Hassium Mietnerium
铱 铂 金 汞 铊 铅 铋 钋 砹 氡 钫
Ir Pt Au Hg Tl Pb Bi Po At Rn Fr
88 89 90 91 92 93 94 95 96 97 98
Radium Actinium Thorium Protactinium Uranium Neptunium Plutonium Americium Curium Berkelium Californium
锿 镄 钔 锘 铹 鑪
Es Fm Md No Lr Rf Db Sg Bh Hs Mt
110 111 112 113 114 115 116 117 118
Darmstadtium Roentgenium Copernicium Ununtrium Ununquadium Ununpentium Ununhexium Ununseptium Ununoctium
化学元素表

化学元素表化学元素表是一张列出所有已发现的化学元素的表格,按照原子序数从小到大排列。
以下是化学元素表及其相关信息:1. 氢(H):原子序数为1,为最轻的元素,常见于气态,常用于制作气球。
2. 氦(He):原子序数为2,为惰性气体,广泛用于灯泡、氦气球等。
3. 锂(Li):原子序数为3,是一种负电性极强的金属元素,可被用于锂电池。
4. 钠(Na):原子序数为11,是一种极易氧化的金属元素,广泛用于调味、洗涤和制取夜光材料。
5. 镁(Mg):原子序数为12,是一种轻金属元素,广泛用于合金、芯片和制作火柴。
6. 铝(Al):原子序数为13,是一种轻质高强度金属元素,广泛用于建筑、交通工具等制造。
7. 硅(Si):原子序数为14,是一种半金属元素,广泛用于半导体器件、太阳能电池板等制造。
8. 磷(P):原子序数为15,是一种非金属元素,广泛用于制造农药、肥料和火药等。
9. 硫(S):原子序数为16,是一种非金属元素,广泛用于制造硫酸、制革等。
10. 氯(Cl):原子序数为17,是一种常见的卤素元素,广泛用于水处理、消毒等。
11. 钾(K):原子序数为19,是一种极易氧化的金属元素,广泛用于普通肥料和印刷电路板。
12. 钙(Ca):原子序数为20,是一种常见的金属元素,广泛用于建筑、造纸、铸造等制造。
13. 铁(Fe):原子序数为26,是一种常见的金属元素,广泛用于制造钢铁、建筑等。
14. 镍(Ni):原子序数为28,是一种具有良好延展性的白银色金属元素,广泛用于制造合金。
15. 铜(Cu):原子序数为29,是一种常见的金属元素,广泛用于电气导线、制管等。
16. 锌(Zn):原子序数为30,是一种具有良好延展性和耐腐蚀能力的金属元素,广泛用于制造合金、防腐涂层等。
17. 银(Ag):原子序数为47,是一种具有良好导电性和光学性能的稀有金属,广泛用于制造器具、珠宝等。
18. 铂(Pt):原子序数为78,是一种具有高度稳定性和化学活性的金属元素,广泛用于制造催化剂、电极等。
化学元素一览表

ㄧㄡˇ
有
europium
64
Gd
釓
ㄍㄚˊ
軋
gadolinium
65
Tb
鋱
ㄊㄜˋ
特
terbium
66
Dy
鏑
ㄉㄧ
滴
dysprosium
67
Ho
鈥
ㄏㄨㄛˇ
火
holmium
68
Er
鉺
ㄦˇ
耳
erbium
69
Tm
銩
ㄉㄧㄡ
丟
thulium
70
Yb
鐿
ㄧˋ
意
ytterbium
71
Lu
鎦
ㄌㄧㄡˊ
留
lutetium
72
如
rubidium
38
Sr
鍶
ㄙ
思
strontium
39
Y
釔
ㄧˇ
乙
yttrium
40
Zr
鋯
ㄍㄠˋ
告
zirconium
41
Nb
鈮
ㄋㄧˊ
尼
niobium
42
Mo
鉬
ㄇㄨˋ
目
molybdenum; molybdenium*
43
Tc
鎝
ㄊㄚˇ
塔
technetium; technium*
44
Ru
釕
ㄌㄧㄠˇ
了
ruthenium
107
Bh
【金+波】
ㄆㄛ
波
bohrium
108
Hs
【金+黑】
ㄏㄟ
黑
hassium
元素周期表(word版)
(261)
105Db
釒杜
(262)
106Sg
釒喜
(266)
107Bh
釒波
(264)
108Hs
釒黑
(269)
109Mt
釒麥
(268)
110Ds
鐽
(271)
111Rg
錀
(272)
112
Uub
(285)
113
Uut
(284)
114
Uuq
(289)
115
Uup
(288)
116
Uuh
(292)
117
Uus
118
锇
190.2
77Ir
铱
192.2
78Pt
铂
195.08
79Au
金
196.967
80Hg
汞
200.5
81TI
铊
204.3
82Pb
铅
207.2
83Bi
铋
208.98
84Po
钋
(209)
85At
砹
(201)
86Rn
氡
(222)
7
87Fr
钫
(223)
88Ra
镭
226.03
89-103
Ac-Lr
锕系
104Rf
氖
20.17
2
卤 素
元 素
惰 性
气 体
● 气体
●液体
● 固体
● 人工合成元素
● 未发现元素
3
11Na
钠
22.9898
12Mg
镁
24.305
ⅢB
26个化学元素周期表

26个化学元素周期表
26个化学元素:H(氢)、He(氦)、Li(锂)、Be(铍)、B(硼)。
C(碳)、N(氮)、O(氧)、F(氟)、Ne(氖)。
Na(钠)、Mg (镁)、Al(铝)、Si(硅)、P(磷)。
S(硫)、Cl(氯)、Ar (氩)、K(钾)、Ca(钙)
扩展资料:
原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电子层数相同的元素放在同一行,将最外层电子数相同的元素放在同一列。
元素周期表中每一个横行叫作一个周期,每一个纵行叫作一个族(8、9、10纵行为一个族)。
这8个周期又可分成短周期(1、2、3)、长周期(4、5、6、7)和不完全周期(8)。
共有16个族,又分为7个主族(ⅠAⅡA ⅢA ⅣA ⅤA ⅥA ⅦA), 7个副族(ⅠB ⅡB ⅢB ⅣB ⅤB ⅥB ⅦB),Ⅷ族(包括三个纵行),一个零族。
化学元素周期表(EXCEL表)

4d10 4d105s1 4d105s2 5s25p1 5s25p2 5s25p3 5s25p4 5s25p5 5s25p6 L
8 18 18 8
6
85.47 87.62 88.91 55 Cs 56 Ba 57-71
铯 钡 La-Lu
91.22 72 Hf
铪
92.91 95.94 73 Ta 74 W
39.95 36 Kr
氪
K
N M
28Βιβλιοθήκη 184s14s2 3d14s2 3d24s2 3d34s2 3d54s1 3d54s2 3d64s2 3d74s2 3d84s2 3d104s1 3d104s2 4s24p1 4s24p2 4s24p3 4s24p4 4s24p5 4s24p6 L
8
39.10 40.08 44.96 47.87 50.94 52.00 54.94 55.85 58.93 58.69 63.55 65.39 69.72 72.61 74.92 78.96 79.90 83.80 K 2
138.9 140.1 140.9 144.2 [147] 150.4 152.0 157.3 158.9 162.5 164.9 167.3 168.9 173.0 175.0
89 Ac 90 Th 91 Pa 92 U
锕锕 钍 镤 铀
93 Np
镎
94 Pu
钚
95镅Am*
96锔Cm*
97 Bk
锫*
87 Fr 88 Ra 89-103 104 Rf 105 Db 106 Sg 107 Bh 108 Hs 109 Mt 110 Ds 111 Rg
7 钫 镭 Ac-Lr 钅卢* 钅杜* 钅喜* 钅波* 钅黑* 钅麦* 钅达* 钅仑*
前二十号元素及初中化学方程式

一、前二十号元素名称及符号1氢(H) 2氦(He) 3 锂(Li) 4铍(Be) 5硼(B) 6碳(C) 7氮(N) 8氧(O) 9氟(F) 10氖(Ne) 11钠(Na) 12镁(Mg) 13铝(Al) 14硅(Si) 15磷(P) 16硫(S) 17氯(Cl) 18氩(Ar) 19钾(K) 20钙(Ca) 二、常见元素的主要化合价(可根据化合价口诀记忆) 金属元素: 非金属元素: 钾 K +1 钠 Na +1 氢 H +1银 Ag +1 锌Zn +2 氟 F -1 溴Br -1 钙Ca +2 镁 Mg +2 氧 O -2 硅 Si +4钡Ba +2 铜Cu +2、+1 碳 C +2、+4 磷 P -3、+3、+5 铝Al +3 铁Fe +2、+3 硫S -2、+4、+6锰Mn +2、+4、+6、+7 氯 Cl -1、+1、+5、+7 氮 N -3、+2、+3、+4、+5 注意:①所有单质中,元素化合价都为0;②金属元素都显正价(除在单质中为0价之外);③未知元素的化合价可以由已知的来计算,原则是化合物中正负化合价的代数和为0,如在Al 2O 3中,(+3)×2+(-2)×3=0。
三、常见的化学式 1.单质(只含一种元素) (1)气体单质:H 2(氢气) N 2(氮气) O 2(氧气) F 2(氟气) Cl 2(氯气)规律:一般气体单质的右下角都有下标“2”,但稀有气体,如He(氦气)、Ne(氖气)、Ar(氩气)的单质直接用元素符号表示。
(2)金属单质(除汞外,都带“釒”旁):Na(钠) Mg(镁) Al(铝) K(钾) Ca(钙) Fe(铁) Zn(锌) Cu(铜) Ba(钡) Ag(银) (3)非金属固体单质(带“石”旁): B(硼) P(磷) Si(硅) C(碳) S(硫)2.氧化物(由两种元素组成,其中一种为O ,O 写在右边,读作“氧化某”): (1)非金属氧化物:H 2O(水) CO(一氧化碳) CO 2(二氧化碳) NO(一氧化氮) NO 2(二氧化氮) SO 2(二氧化硫) SO 3(三氧化硫) (2)金属氧化物:Fe 2O 3(三氧化二铁) Fe 3O 4(四氧化三铁) MgO(氧化镁) CaO(氧化钙) MnO 2(二氧化锰) CuO(氧化铜) Al 2O 3(三氧化二铝,或简称氧化铝) 四、常见的离子符号 离子的形成:原子−−−→−失去电子阳离子(如Na −−→−-e1失去Na +)原子−−−→−得到电子阴离子(如S −−→−-2e得到S 2-) (1)阳离子(带正电的离子):Na +(钠离子) K +(钾离子) H +(氢离子) Ag +(银离子) Mg 2+(镁离子) Cu 2+(铜离子) Ca 2+(钙离子) Ba 2+(钡离子) Al 3+(铝离子) Fe 3+(铁离子) Fe 2+(亚铁离子) NH 4+(铵根离子) (2)阴离子(带负电的离子):F -(氟离子) Cl -(氯离子) S 2-(硫离子) O 2-(氧离子)原子团(切记..!): SO 42-(硫酸根) SO 32-(亚硫酸根) HSO 3-(亚硫酸氢根) NO 3-(硝酸根) OH -(氢氧根) CO 32-(碳酸根) HCO 3-(碳酸氢根) CH 3COO -(醋酸根)注意:离子所带电荷数与对应元素(或者原子团)的化合价数值相等,但是所标位.置.不一样,而且顺序..相反。
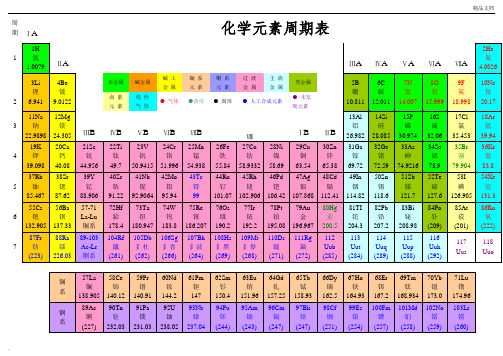
化学元素周期表超清可打印之欧阳美创编

周期
IA
1
元素周期表
0
18
电子层
0族电子数
1
1H
氢
1.008
IIA
2
金属
元素
原子序数元素符号(红色表示放射性元素)
元素名称(注*的表示人造元素)
相对原子质量(加括号的数据为该放
非金属
元素
92U
铀
238.0
射性元素半衰期最长同位素的质量数)
IIIA
13
IVA
14
VA
15
VIA
16
VIIA
17
2He
氦
4.003
K
2
2
3Li
锂
6.941
4Be
铍
9.012
5B
硼
10.81
6C
碳
12.01
7N
氮
14.01
8O
氧
16.00
9F
氟
19.00
10Ne
氖
20.18
L
K
8
2
3
11Na
钠
22.99
12Mg
镁
24.31
IIIB
3
IVB
4
VB
5
VIB
6
VIIB
7
VIII
8910
IB
11
IIB
12
13Al
铝
26.98
14Si
铜
63.55
30Zn
锌
65.41
31Ga
镓
69.72
32Ge
锗
72.64
33As
砷
化学元素表带拼音

第 02 号元素: 氦 [化学符号]He, 读“亥”第 03 号元素: 锂 [化学符号]Li, 读“里”第 04 号元素: 铍 [化学符号]Be, 读“皮”第 05 号元素: 硼 [化学符号]B, 读“朋”第 06 号元素: 碳 [化学符号]C, 读“炭”第 07 号元素: 氮 [化学符号]N, 读“淡”第 08 号元素: 氧 [化学符号]O, 读“养”第 09 号元素: 氟 [化学符号]F, 读“弗”第 10 号元素: 氖 [化学符号]Ne, 读“乃”第 11 号元素: 钠 [化学符号]Na, 读“纳”第 12 号元素: 镁 [化学符号]Mg, 读“美”第 13 号元素: 铝 [化学符号]Al, 读“吕”第 14 号元素: 硅 [化学符号]Si, 读“归”第 15 号元素: 磷 [化学符号]P, 读“邻”第 16 号元素: 硫 [化学符号]S, 读“流”第 17 号元素: 氯 [化学符号]Cl, 读“绿”第 18 号元素: 氩 [化学符号]Ar,A, 读“亚”第 19 号元素: 钾 [化学符号]K, 读“甲”第 20 号元素: 钙 [化学符号]Ca, 读“丐”第 21 号元素: 钪 [化学符号]Sc, 读“亢”第 22 号元素: 钛 [化学符号]Ti, 读“太”第 23 号元素: 钒 [化学符号]V, 读“凡”第 25 号元素: 锰 [化学符号]Mn, 读“猛”第 26 号元素: 铁 [化学符号]Fe, 读“铁”第 27 号元素: 钴 [化学符号]Co, 读“古”第 28 号元素: 镍 [化学符号]Ni, 读“臬”第 29 号元素: 铜 [化学符号]Cu, 读“同”第 30 号元素: 锌 [化学符号]Zn, 读“辛”第 31 号元素: 镓 [化学符号]Ga, 读“家”第 32 号元素: 锗 [化学符号]Ge, 读“者”第 33 号元素: 砷 [化学符号]As, 读“申”第 34 号元素: 硒 [化学符号]Se, 读“西”第 35 号元素: 溴 [化学符号]Br, 读“秀”第 36 号元素: 氪 [化学符号]Kr, 读“克”第 37 号元素: 铷 [化学符号]Rb, 读“如”第 38 号元素: 锶 [化学符号]Sr, 读“思”第 39 号元素: 钇 [化学符号]Y, 读“乙”第 40 号元素: 锆 [化学符号]Zr, 读“告”第 41 号元素: 铌 [化学符号]Nb, 读“尼”第 42 号元素: 钼 [化学符号]Mo, 读“目”第 43 号元素: 碍 [化学符号]Tc, 读“得”第 44 号元素: 钌 [化学符号]Ru, 读“了”第 45 号元素: 铑 [化学符号]Rh, 读“老”第 46 号元素: 钯 [化学符号]Pd, 读“巴”第 48 号元素: 镉 [化学符号]Cd, 读“隔”第 49 号元素: 铟 [化学符号]In, 读“因”第 50 号元素: 锡 [化学符号]Sn, 读“西”第 51 号元素: 锑 [化学符号]Sb, 读“梯”第 52 号元素: 碲 [化学符号]Te, 读“帝”第 53 号元素: 碘 [化学符号]I, 读“典”第 54 号元素: 氙 [化学符号]Xe, 读“仙”第 55 号元素: 铯 [化学符号]Cs, 读“色”第 56 号元素: 钡 [化学符号]Ba, 读“贝”第 57 号元素: 镧 [化学符号]La, 读“兰”第 58 号元素: 铈 [化学符号]Ce, 读“市”第 59 号元素: 镨 [化学符号]Pr, 读“普”第 60 号元素: 钕 [化学符号]Nd, 读“女”第 61 号元素: 钷 [化学符号]Pm, 读“颇”第 62 号元素: 钐 [化学符号]Sm, 读“衫”第 63 号元素: 铕 [化学符号]Eu, 读“有”第 64 号元素: 钆 [化学符号]Gd, 读“轧”第 65 号元素: 铽 [化学符号]Tb, 读“忒”第 66 号元素: 镝 [化学符号]Dy, 读“滴”第 67 号元素: 钬 [化学符号]Ho, 读“火第 68 号元素: 铒 [化学符号]Er, 读“耳”第 69 号元素: 铥 [化学符号]Tm, 读“丢”第 71 号元素: 镥 [化学符号]Lu, 读“鲁”第 72 号元素: 铪 [化学符号]Hf, 读“哈”第 73 号元素: 钽 [化学符号]Ta, 读“坦”第 74 号元素: 钨 [化学符号]W, 读“乌”第 75 号元素: 铼 [化学符号]Re, 读“来”第 77 号元素: 铱 [化学符号]Ir, 读“衣”第 78 号元素: 铂 [化学符号]Pt, 读“伯“第 79 号元素: 金 [化学符号]Au, 读“今”第 80 号元素: 汞 [化学符号]Hg, 读“拱”第 81 号元素: 铊 [化学符号]Tl, 读“他”第 82 号元素: 铅 [化学符号]Pb, 读“千”第 83 号元素: 铋 [化学符号]Bi, 读“必”第 84 号元素: 钋 [化学符号]Po, 读“泼”第 85 号元素: 砹 [化学符号]At, 读“艾”第 86 号元素: 氡 [化学符号]Rn, 读“冬”第 87 号元素: 钫 [化学符号]Fr, 读“方”第 88 号元素: 镭 [化学符号]Ra, 读“雷”第 89 号元素: 锕 [化学符号]Ac, 读“阿”第 90 号元素: 钍 [化学符号]Th, 读“土”第 91 号元素: 镤 [化学符号]Pa, 读“仆”第 92 号元素: 铀 [化学符号]U, 读“由”第 93 号元素: 镎 [化学符号]Np, 读“拿”第 95 号元素: 镅 [化学符号]Am, 读“眉”第 96 号元素: 锔 [化学符号]Cm, 读“局”第 97 号元素: 锫 [化学符号]Bk, 读“陪”第 98 号元素: 锎 [化学符号]Cf, 读“开”第 99 号元素: 锿 [化学符号]Es, 读“哀”第 100 号元素: 镄 [化学符号]Fm, 读“费”第 101 号元素: 钔 [化学符号]Md, 读“门”第 102 号元素: 锘 [化学符号]No, 读“诺”第 103 号元素: 铹 [化学符号]Lw, 读“劳”第 104 号元素: 鐪 [化学符号]Rf, 读“卢”第 105 号元素: 钅杜[化学符号]Db, 读“杜”第 106 号元素: 钅喜 [化学符号]Sg , 读”喜“第 107 号元素: 钅波 [化学符号]Bh, 读"波“第 108 号元素: 钅黑 [化学符号]Hs, 读”黑“第 109 号元素: 钅麦 [化学符号]Mt, 读"麦"第 110 号元素: 鐽 [化学符号]Ds, 读”达“第 111 号元素: 钅仑 [化学符号]Rg, , 读”伦“第 112 号元素: uub(112)第 113 号元素: uut(113)第 114 号元素: uuq(114)第 115 号元素: uup(115)第 116 号元素: uuh(116)22. (10分)如图,在Rt △ABC 中,∠B =90°,BC C =30°.点D 从点C 出发沿CA 方向以每秒2个单位长的速度向点A 匀速运动,同时点E 从点A 出发沿AB 方向以每秒1个单位长的速度向点B 匀速运动,当其中一个点到达终点时,另一个点也随之停止运动.设点D 、E 运动的时间是t 秒(t >0).过点D 作DF ⊥BC 于点F ,连接DE 、EF .(1)求证:AE =DF ;(2)四边形AEFD 能够成为菱形吗?如果能,求出相应的t 值;如果不能,说明理由.(3)当t 为何值时,△DEF 为直角三角形?请说明理由.22.(1)在△DFC 中,∠DFC =90°,∠C =30°,DC =2t ,∴DF =t .又∵AE=t ,∴AE=DF.…………………………………………………………………………2分(2)能.理由如下:∵AB ⊥BC ,DF ⊥BC ,∴AE ∥DF .又AE =DF ,∴四边形AEFD 为平行四边形.…………………………………………………3分∵AB =BC ·tan30°=5,210.3AC AB =∴==102.A D A C D C t ∴=-=-若使A E F D 为菱形,则需10.102,.3A E A D t t t ==-=即 即当103t =时,四边形AEFD 为菱形.……………………………………………………5分(3)①∠EDF =90°时,四边形EBFD 为矩形.在Rt △AED 中,∠ADE =∠C =30°,∴AD =2AE .即10-2t =2t ,52t =.………………7分②∠DEF=90°时,由(2)知EF ∥AD ,∴∠ADE =∠DEF =90°.∵∠A =90°-∠C =60°,∴AD =AE ·cos60°. 即1102, 4.2t t t -==…………………………………………………………………………9分 ③∠EFD =90°时,此种情况不存在. 综上所述,当52t =或4时,△DEF 为直角三角形.……………………………………10分。
(2021年整理)初中化学必记元素表

初中化学必记元素表
编辑整理:
尊敬的读者朋友们:
这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(初中化学必记元素表)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为初中化学必记元素表的全部内容。
化学必记知识一、元素符号
二、常见元素化合价表。
初中化学元素周期表及规律

初中化学元素周期表及规律
周期表内容
氢(H),氦(He),锂(Li),铍(Be),硼(B),碳(C),氮(N),氧(O),氟(F)氖(Ne),钠(Na),镁(Mg),铝(Al),硅(Si),硫(S),氯(Cl),氩(Ar),钾(K),钙(Ca)。
元素化合价规律
1.除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价)。
2.同一主族的元素的最高正价、负价均相同。
3.所有单质都显零价。
金属性与非金属性规律
1.同一周期的元素电子层数相同。
因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增。
2.同一主族元素最外层电子数相同。
因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
单质—硅 现代半导体工业的基础 单晶硅
深灰色、不透明 有光泽的晶体, 性硬脆,纯度高 10-9 杂质
硅片
普通化学
1
元素化学
单质硅很稳定,高温下可以发生反应 主要还原 Si + O2(g) = SiO2(s) Si + N2(g) = 2SiN(s)
900℃
3Si + 2N2(g) = Si3N4(s) 与卤素反应 Si + 2X2 = SiX4
仅与HF反应
SiO2 + 4HF = SiF4↑ + 2H2O 所以玻璃容器不能装HF、碱
普通化学
13
元素化学 §7.4 含氧酸及其盐
1、碳酸及其盐 二元弱酸
H2CO3 = H+ + HCO3- K1 = 4.2×10-7
HCO3- = H+ + CO32- K2 = 5.6×10-11
所以可以生成碳酸盐和碳酸氢盐
普通化学
6
元素化学
Gas Reducing Agent in liquid Solution (GRAILS)
Solvent: Diphenyl ether (b.p. 259 °C), Capping agent: Oleylamine (OAm, b.p. 350 °C), oleic acid (OA, b.p. 220 °C) Metal precursors: Pd(acac)2 and M(acac)x Temperature: 210 °C Condenser Reducing agent: CO
Cube
CO gas regulated by flow meter CO gas bubbles
Octahedron
J.B. Wu, A. Gross, H. Yang, Nano Lett., 2011, 11, 798-802.
普通化学
7
元素化学
配位性质
Fe + 5CO = Fe(CO)5 剧毒 CoCO3 + 8CO + 2H2 = Co(CO)8 + 2CO2 + 2H2O 工业上
元素化学
能分离的目前有: H2SiO3偏硅酸 (x = 1,y = 1) 二偏硅酸H2Si2O5 (x=2, y=1) 正硅酸 (x = 1 y = 2) 焦硅酸 (H6Si2O6 (x = 2, y = 3) 聚合生成—硅胶,非常复杂 SiO2 yH2O 可以吸水,干燥剂 加入 CoCl2 兰色 变色硅胶
普通化学
9
元素化学
无毒无味无色气体 非常稳定,惰性 氧化数 +4
用于灭火剂
干冰 b.p. 194.5 K -78 ℃(195 K) 升华
可以作为致冷物质。实验室中最常用
也可与其他物质混合,制成不同温度的致冷剂
丙酮 乙醚 氯仿 乙醇(100%) 乙醇(85%) 氯乙烷
最低温度 86
-77
-77
-72
B2O3 也用助焊剂 清除金属上的氧化物薄层
普通化学
28
元素化学
硼酸
B + H2O → + HNO3 → + H2SO4 →
用于医疗、杀菌、消毒 特征:少见的固体酸, 与其他含氧酸不同,本身不是 B酸,在水中是一元酸。 其质子转移平衡与B原子的
缺电子性质密切相关。
B(OH)3(aq) + 2 H2O(l) H3O+(aq) + [B(OH)4]-(aq) 普通化学
硼族元素的基本性质
元素 硼 铝 镓 铟 铊
氧化数:+ 3
金属性 变强
共价性 变弱 不易失去电子 缺电子化合物
普通化学
20
元素化学 §8.2 单质硼
自然界中的分布
硼酸盐的形式:硼砂 Na2B4O7 ∙ 10H2O
方硼石 2Mg3B8O15 ∙ MgCl2
白硼钙石 Ca2B6O11 ∙ 3H2O
1912年 Stock 制备了第一个硼氢化合物,也因此获 得了诺贝尔奖 随后60年 制备了一系列硼氢化合物,开辟了丰富的 硼化学世界 → 国防中应用
CO2
329.6 (5.065×105 Pa) 194.5 304 75.3 1.713 dm3·dm-3 (H2O) –394.6 116 531.4 1330.5 0
CO
68 (1.013×105 Pa) 81.6 132.8 34.5 0.035 dm3·dm-3 (H2O) –137.2 113 1070.3 1351.7 0.12
普通化学
25
元素化学 成键特征
BH3化合物不存在 出乎意料? 2s22p1
得电子
2s22p4
缺1对电子
B2H6 12个价电子 缺1对
二个BHB三中心键
普通化学
26
元素化学硼的最显著特征之一,被 称作亲氧元素
工业上 由硼酸和热脱水生产B2O3 2B(OH)3
只与HF反应 不能和其他酸反应 Si + 6HF(aq) = H2SiF6(aq) + 2H2 一般sp3杂化,四面体,只有与F形成八面体
普通化学
2
元素化学 §7.3 氧化物
1、 碳的氧化物
CO, CO2 氧化数 +2 , +4
制备:工业上
CaCO3(石灰石)= CaO + CO2↑ CaCO3(大理石)+ 2HCl = CaCl2 +H2O + CO2 水煤气 C + H2O = CO + H2 实验室
[Cu(NH3)2]+ + CO + NH3 = [Cu(NH3)3CO]+
毒性:O2Hb + CO = COHb + O2 K = 210 CO是最大的污染物之一,汽车、化工、排放
催化剂存在下可以发生还原和加成等反应
CO + 2H2 = CH3OH 费—托合成 , 工业上生产汽油 CO + CH3OH = CH3COOH 羰基合成 CO + CH3COOCH3 = CH3COOCOCH3 普通化学
△
B2O3 + 3H2O(g)
B2O3 是一种制造单质 B 和其他硼化物的重要化工产
品和光纤玻璃
普通化学
27
元素化学
熔融的B2O3 可溶解多种金属氧化物得到特征 的偏硼酸盐玻璃体 CuO + B2O3 → Cu(BO2)2 蓝色 NiO + B2O3 → Ni(BO2)2 绿色
硼珠实验,用于定性分析
完全打开C—O键
是非常困难的
普通化学
5
元素化学 CO + NaOH = HCOONa FeO + CO = Fe + CO2 冶金
CO + PdCl2 (l) + H2O = CO2 + 2HCl + Pd ↓
常温下遇PdCl2 水溶液变黑 → 检验CO 与金属反应 Ni + 4CO = Ni(CO)4 低价金属
普通化学
19
A 型沸石
元素化学 §8 硼族元素 §8.1 通性
价电子层结构
ns2 np1
性质 元素符号 原子序数 原子量 价电子层结构 主要氧化数 共价半径/pm 离子半径(M2+)/pm 离子半径(M3+)/pm 电离能I1/KJ∙mol-1 电离能I2/KJ∙mol-1 电离能I3/KJ∙mol-1 电子亲和能E4/KJ∙mol-1 电负性(Pauling) B 5 10.81 2s22p1 +3 82 20 800.6 2427 3660 29 2.04 Al 13 26.98 3s23p1 +3 118 50 577.6 1817 2745 48 1.61 Ga 31 69.72 4s24p1 (+1)+3 126 113 62 578.8 1979 2963 48 1.81 (Ⅲ) In 49 114.8 5s25p1 +1,+3 114 132 81 558.3 1821 2705 69 1.78 Ti 81 204.3 6s26p1 +1, (+3) 148 140 95 589.3 1971 2878 117 1.62 (Ⅰ) 2.04 (Ⅲ)
普通化学
CoCl2 ∙ 6H2O 粉红色
17
元素化学
以多种方式聚合 主要共顶点 形成各种网络结构
一维链状
二维片状—形成环
普通化学
18
元素化学
天然大量存在
橄榄石 Mg2SiO4 1 : 4
绿柱石 Be2Al2(SiO3)6六元环 透辉石 CaMg(SiO3)2 云母 KMg3(OH)2Si3AlO10 分子筛 沸石分子筛 Si 可以被 Al 取代 → 陶瓷
-68
-60
10
普通化学
元素化学
化学惰性
二氧化碳的转化是化学工业的一个重大难题
酸性氧化物
Ca2+ + 2OH - + CO2 = CaCO3(s) + H2O(l) CaCO3(s) + CO2 + H2O(s) = Ca2+(aq) + 2HCO3-(aq) CO2用途大 面包、汽水 污染,大气层 只与活泼金属发生还原反应 2Mg + CO2 = 2MgO + C 普通化学
△
甲酸、草酸分解 : HCOOH
H2C2O4
浓H2SO4
CO + H2O
CO2↑ + CO↑ + H2O
3
浓H2SO4
普通化学
元素化学
CO2 和CO的物性和结构参数
物性、结构参数
