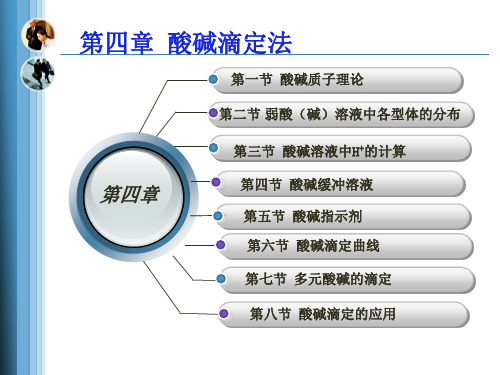
第四章 酸碱滴定法
第四章 酸碱滴定法

[H ] [A ] [OH ]
平衡常数代入得:
K a [HA] K w [H ] [H ] [H ]
[H ]2 K a [HA] K w
精确式
第四章
酸碱滴定法
化学分析
若 caKa 20K W 时:可忽略Kw,得:
2 Κ Κ a a 4ca Κ a [H ] 2
(黄与红)
(蓝与黄)
特点: 变色敏锐;变色范围窄。
第四章
酸碱滴定法
化学分析
第三节
酸碱滴定法的基本原理
第四章
酸碱滴定法
化学分析
一、强酸(碱)的滴定
强酸与强碱滴定反应:
H+ + OHKt
H2O
1 1 14 1 . 00 10 [H ][OH ] K w
滴定常数(titration constant),Kt Kt值很大,是水溶液中反应程度最完全的酸碱滴定。
(续前 )
第四章
酸碱滴定法
化学分析
注:
实际与理论的变色范围有差别,深色比浅色灵敏
指示剂的变色范围越窄,指示变色越敏锐
例: pKa 甲基橙 3.4 甲基红 5.1 酚酞 9.1 百里酚酞 10.0 理论范围 2.4~4.4 4.1~6.1 8.1~10.1 9.0~11.0 实际范围 3.1~4.4 4.4~6.2 8.0~10.0 9.4~10.6
2K a 2 0.05 ca K a1
,按一元弱酸(碱)
处理:caKa1(b1)≥20Kw,c/Ka1(b1)≥500,用最 简式:[ H ] cKa1 ;[OH ] cKb1
第四章
酸碱滴定法
化学分析
《分析化学》-图文课件-第四章

如果cKa2≥10Kw,c/Ka1≥10,即[HCO3-]≈cHCO3-,则水解 离的H+忽略,Ka1与[HCO3-]相加时可忽略,则上式可简化为
(4-7)
第二节 溶液的酸碱度和pH值的计算
【例4-5】
计算0.10 mol·L-1 NaHCO3溶液的pH值。 解:已知H2CO3的Ka1=4.12×10-7,Ka2=5.62×10-11,符合cKa2≥10Kw, c/Ka1≥10。 根据式(4-7)得
因此,同浓度的NH3和CO3-2的碱性:CO3-2>NH3。
第二节 溶液的酸碱度和pH值的计算
一、 溶液的酸碱度
溶液的酸碱度是指溶液中氢离子、氢氧根离子的活度,常用 pH、pOH表示。它与溶液的浓度在概念上是不相同的,但当溶 液浓度不太大时,可用浓度近似地代替活度。溶液酸碱度的表达 式为
(4-3) 当温度为25 ℃时,水溶液Kw=[H+]·[OH-]=10-14,所 以 pH+pOH=pKw=14。 由此可见,pH值越小,酸度越大,溶液的酸性越强;pH越 大,酸度越小,溶液的碱性越强。同理,pOH越小,碱度越大, 溶液碱性越强;pOH越大,碱度越小,溶液的酸性越强。
实际上,酸碱半反应在水溶液中并不能单独进行,一种酸给 出质子的同时,溶液中必须有一种碱来接受。这是因为质子的半 径很小,电荷的密度比较高,游离的质子在水溶液中很难单独存 在。根据酸碱质子理论,各种酸碱反应实质上是共轭酸碱对之间 水合质子的转移过程。例如:
第一节 酸碱滴定法概述
在上述的反应中,溶剂水接受HAc所给出的质子,形成水合质 子H3O+,溶剂水也就起到碱的作用。同样,碱在水溶液中的解离, 也必须有溶剂水参加。以NH3在水溶液中的解离反应为例,NH3分 子中的氮原子上有孤对电子,可接受质子形成NH4+,这时,H2O 便起到酸的作用给出质子。具体反应如下:
大学分析化学经典课件第四章酸碱滴定法

H
Ca
Ka H Ka
H Ka Ka 2 4Ca Ka 2
近似式
当 Ca Ka 500(忽略酸的离解)且 Ca Ka 20KW
H CaKa 最简式***
(2)一元弱碱(Cb)
OH Kb Kb2 4Cb Kb 2
近似式
OH Cb Kb
解: HS- + H2O
H2S + OH-
pKb2 = pKw -pKa1 = 14.00-7.02 = 6.98
第一节 酸碱溶液pH值的计算
• 强酸强碱溶液pH值的计算 • 弱酸弱碱溶液pH值的计算 • 两性物质溶液(C ) • 缓冲溶液pH值的计算
一、强酸强碱溶液pH值的计算
1.强酸(Ca )
H3O+ + OH-
H2O+ H2O
Kt
1 H OH
1 1.0 1014 Kw
OH- + HA
A- + H2O
A
Kt HA OH
1 Ka Kb KW
H3O+ + A-
HA
+ H2O HA Kt H A
1 Ka
Kb KW
讨论:
➢ 水溶液中酸碱滴定反应完全程度取决于Kt大小 强酸强碱的反应程度最高 弱酸弱碱反应程度较差
酚酞(PP)
HO
OH
O-
OH COO-
-
OH H+ pKa = 9.1
羟式(无色)
-
SO3
-
SO3
O
COO- 醌式(红色)
二、酸碱指示剂的变色范围***
HIn
H + + In -
酸式体
第4章 酸碱滴定法

三种酸强弱顺序:HCl>HAC>H2S 在共轭酸碱对中,如果酸愈易给出质子,酸性愈弱,则其共轭碱对质子的亲和 力就愈弱,就愈不容易接受质子碱性就愈弱。 其共轭碱强弱顺序:Cl-1<AC-<HS2.Ka 和 Kb 之间关系: 共轭酸碱相互依存关系 [H + ][A − ] Ka= , [HA] 例: NH 3 + H 2 O Kb= Ka 和 Kb 之间关系 Ka·Kb=Kw NH + 4 + H 2O Ka= NH 3 + H 3 O +
−
δ1 =
[HC 2 O 4 ] [HC 2 O 4 ] = 2c [H 2 C 2 O 4 ] + [HC 2 O 4 ] + [C 2 O 4 ] K a1 [ H + ] = + 2 [ H ] + K a1 [ H + ] + K a1 K a 2
[C O ] [C 2 O 4 ] δ2 = 2 4 = 2c [H 2 C 2 O 4 ] + [HC 2 O 4 ] + [C 2 O 4 ] = K a1 K a 2 [ H ] + K a1 [ H + ] + K a1 K a 2
注意:Ka 和 Kb 之间的对应关系
§4-2 不同 pH 值溶液中酸碱存在形式的分布情况--分布曲线
引言:上次课上我们对酸碱平衡的基础理论进行简要的讨论,从这节课开始我 们介绍酸碱滴定法的有关理论和应用。这堂课我们学习分布曲线,学习它可帮 助我们深入理解酸碱滴定的过程、滴定误差以及分布滴定的可能性,而且对于 了解络合滴定与沉淀反应条件也是有用的。 任意的离解反应: HB + H 2 O 达平衡时 aq 中存在 [H3O+] H 3O + + B− [HB] [B-]
分析化学四酸碱滴定法

23
2021/5/10
Ca2++C2O42-
CaC2O4
沉淀完全程度与何因素有关? 显然与C2O42的浓度有关,而C2O42的浓度又与
CH22CO2O424的- +分H析+浓度与分H布C系2O数4(- 实H际+是[HH+2C])2O有4关
HS-+ H2O pkb2 H2S+OH-
pKa1+pKb2=pKw
pKb2 = pKw- pKa1=14-7.24=6.76
14
2021/5/10
3. 多元酸碱的离解反应
H3A
Ka 1
Kb3 H2A-
Ka 2 Kb2
HA2-
Ka 3
Kb1
A3-
Kbi
Kw Ka ni1
– pKb1 = 14.00 pKa3
3、酸碱半反应
酸碱半反应: 酸给出质子和碱接受质子的反应
酸
NH4+ NH3 +
H+
HCO3- CO32- +
H+
H6Y2+ H5Y+ +
H+
碱 半 反
应
区分下列物质是酸、碱还是两性物质?并指出共轭酸碱对
HAc 、H2CO3、 H3PO4 、 NaAc 、 NaHCO3 、NaCO3 NaH2PO4 、 Na2HPO4 Na3PO4 、 (C2H5)2NH、 H2O
水的两性作用,一个水分子可以从另一个水分子中夺取 质子
共轭
H2O(酸1) +H2O(碱2) H3O+(酸2) +OH-(碱1) 共轭
仅在溶剂分子之间发生的 质子传递作用,称为溶剂的质 子自递作用
分析化学课件 第四章 酸碱滴定法

[OH-]=(0.1000×0.02)/(20.00+20.02)
= 5.0×10-5 mol·L-1 pOH=4.30, pH=14-4.30= 9.70
2020年11月7日星期六3时
37分22秒
上一页 下一页 返回
讨论:强碱滴定强酸的滴定曲线
1)滴定前加入18mL,溶液pH变化仅 为:2.28-1=1.28;而化学计量点前 后共0.04 mL(约1滴),溶液pH 变化 为:9.70-4.30=5.40 (突跃)。
碱式色
2020年11月7日星期六3时 37分22秒
上一页 下一页 返回
→甲基橙(methyl orange,MO)-双色
pH≤ 3.1,酸式色,红色; pH 4.4, 碱式色,黄色; pH 3.1-4.4,两种形式共存,为混合色,橙色。
2020年11月7日星期六3时 37分22秒
上一页 下一页 返回
上一页 下一页 返回
若±0.1%误差范围内突跃范围为 4.30~9.70
酚酞(8.0 ~ 10.0):半滴溶液, 无色变粉红。
甲基红(4.4 ~6.2):半滴溶液, 红变橙;
甲基橙(3.1 ~ 4.4):半滴溶液, 橙变黄;
3)选择指示剂的原则:
1.变色范围全部或部分在突跃范围内的指示剂指示
终点,即可保证终点误差在允许的范围。
02.00.102000 1050..130 ~9.87.070
上一页 下一页 返回
5)影响强酸强碱滴定突跃范围大小的因素
酸碱的浓度:浓度变为原1/10,则计量点前后H+、OH-的浓度均 为原来的1/10,所以突跃范围约减小2个pH单位。 故:酸碱滴定中,滴定剂和被测物溶液的浓度不低于~ 0.1mol/L
第四章 酸碱滴定法

[H+] = [OH-] +[HSO4-] +2[SO42-] [H2PO4-]+2[H3PO4]+[H+]=[NH3]+[PO43-]+[OH-]
依据质子平衡式,可以得到溶液中H+(或OH-) 浓度与有关组份的关系式,有此关系式即可计 算出酸碱平衡体系中H+的浓度。
H2PO4 H3PO4 H3O+
-
+H+
+2H+
+H+
HPO4 H2O
2-
NH4
+
-H+
-H+
-H+
NH3 PO43OH-
质子平衡式为:
[H2PO4-]+2[H3PO4]+[H3O+]=[NH3]+[PO43-]+[OH-]
注意:1、基准物质不出现在PBE中 2、注意系数 例: 0.1mol / L(NH4)2HPO4溶液的PBE
2 3 3
由上述可以看出,中性分子不包含在电荷平衡 式中。
(四)、质子平衡式(PBE) 根据酸碱质子理论,酸碱反应达到平衡时, 酸失去的质子数等于碱得到的质子数,这种 数量关系的数学表达式称为质子平衡式 (PBE)。 书写质子平衡式的方法有以下两种: 1、代入法: 根据物料平衡式和电荷平衡式联立而求得, 可参看教材。
Ka2
Kb1
C2O42Kb2
O HC2 4 H 2 C2 O4 H
已知H2C2O4的Ka1=5.9×10-2 Ka2=6.4×10-5
所以
14 Kw 1.0 10 K 1.7 10 13 b2 K 2 a 1 5.9 10
分析化学 第四章_酸碱滴定法一 图文

H2CO3 H HCO3 H CO32
H3O H H2O H OH
质子条件式为:
H 2CO 3 H 3O
C
O
2 3
O
H
分析化学
第四章 酸碱滴定法
14
• 方法要点:
• 1.从酸碱平衡体系中选取质子参考水准(又称 零水准),它们是溶液中大量存在并参与质子 转移反应的物质。
方法。 • 理论基础: • 酸碱平衡理论及酸碱质子理论。 • 优点: • 方法简单、快速,应用广泛。 • 应用: • 一般酸、碱以及能与酸、碱直接或间接发生质子
转移反应的物质。
分析化学
第四章 酸碱滴定法
2
酸碱质子理论
• 能给出质子的是酸,能接受质子的是碱,酸和 碱是相互依存和相互转化的。酸碱不是彼此独立 的,而是统一在 对质子的关系上。
9
酸碱质子理论的基本要点:
• 1. 能给出质子的是酸,能接受质子的是碱; • 2. 统一在对质子的关系上,共轭酸碱对之间具有
相互依存、相互转换的关系; • 3. 酸或碱的离解常数是物质酸或碱性强弱的定量
指标; • 4. 物质的酸碱性不仅与此物质的本质有关,还与
溶剂的性质有关; • 5. 在溶液中,质子不能单独存及其理论基础 • 第一节 酸碱溶液中氢离子浓度的计算 • 第二节 酸碱指示剂 • 第三节 酸碱滴定法的基本原理 • 第四节 滴定终点误差 • 第五节 非水溶液中的酸碱滴定法
分析化学
第四章 酸碱滴定法
1
• 酸碱滴定法的定义: • 酸碱滴定法是以质子转移反应为基础的滴定分析
分析化学
第四章 酸碱滴定法
12
• (二)电荷平衡
第四章酸碱滴定法

第四章酸碱滴定法第四章酸碱滴定法酸碱滴定法(acid-base titrations)是以⽔溶液中的质⼦转移反应为基础的滴定分析⽅法。
⼀般酸、碱以及能与酸碱直接或间接发⽣质⼦反应的物质,⼏乎都可以⽤酸碱滴定法测定。
因此,酸碱滴定法是分析化学的基础内容之⼀。
这个⽅法的关键问题是计量点的确定。
因为酸碱反应通常不发⽣外观的变化,在滴定中需选⽤适当的指⽰剂,利⽤它的变⾊作为到达计量点的标志。
因为不同的指⽰剂的变⾊有其不同的pH,⽽不同类型的酸碱反应的计量点时pH⼜不相同,为了正确地确定计量点,就需要选择⼀个刚好能在计量点时变⾊的指⽰剂。
要解决这个问题,必须了解滴定过程中溶液pH的变化情况。
因此,在学习酸碱滴定时,不仅要了解指⽰剂的变⾊原理和变⾊范围,同时也要了解滴定过程中溶液pH的变化规律和指⽰剂的选择原则,以便能正确地选择合适的指⽰剂,获得准确的分析结果。
基于上述原因,我们先讨论酸碱溶液平衡的基本原理,然后再介绍酸碱滴定中的理论及应⽤。
第⼀节⽔溶液中的酸碱平衡⼀、酸碱的质⼦理论根据质⼦理论,凡能给出质⼦(H+)的物质是酸,能接收质⼦的物质是碱。
酸碱关系可⽤下式表⽰:酸HA与碱A-处于⼀种相互依存的关系中,即:HA失去质⼦转化为它的共轭碱A-,A-得到质⼦后,转化为它的共轭酸HA,则HA与A-被称为共轭酸碱对。
如:由上述酸碱的半反应可知:酸碱可以是中性分⼦,也可以是阳离⼦或阴离⼦,酸碱是相对的。
⼜如:离⼦(H2PO4-)在H3PO4-H2PO4-共轭体系中为碱,⽽在H2PO4--HPO42-共轭体系中为酸。
同⼀物质在某些场合是酸,⽽在另⼀场合是碱,其原因是共存物质彼此间给出质⼦能⼒相对强弱不同。
因此同⼀物质在不同的环境(介质或溶剂)中,常会引起其酸碱性的改变。
既能给出质⼦⼜能接受质⼦的物质称为两性物质。
酸碱质⼦理论认为,酸碱反应的实质是质⼦转移。
例如HAc在⽔中离解,溶剂⽔就起着碱的作⽤,否则HAc⽆法实现其在⽔中的离解,即质⼦转移是在两个共轭酸碱对间进⾏。
第四章酸碱滴定法

无色→有色,浅色→有色
✓ 例: 酸滴定碱 → 选甲基橙、甲基红
碱滴定酸 → 酚酞、百里酚酞
三、混合指示剂
➢ 组成
1.指示剂+惰性染料 例:甲基橙+靛蓝(紫色→绿色) 2.指示剂+指示剂 例:溴甲酚绿+甲基红(酒红色→绿色)
✓ 特点
变色敏锐;变色范围窄
第三节 酸碱滴定法的基本原理
酸碱滴定曲线,指示剂的选择原 则,强酸、强碱和弱酸弱碱滴定。
( 2 ) SP 前 0.1% 时 ( Vb < Va ) , 加 入 NaOH 19.98mL
[H ] V V a a V V b b C a 2 2..0 0 0 0 1 1 0 0 ..9 9 9 9 0 8 8 .1 5 .0 1 5 m 0/L ol
pH4.3
(3)化学计量点时(Vb = Va) [H ][O]H K w1 7 0 m/o Ll
Na2B4O7 +2HCl+ 5H2O=2NACl+4H3BO3 00..11SmmPoo时ll/:LHpHC=l滴5定.0:7 生成H3BO3
选择指示剂? KCN,碱,pKb=4.69 HCN,酸,pKa=9.31
结论:
1. 准确滴定:Ca•Ka≥10-8或Cb•Kb≥10-8
2. Ca•Ka<10-8或Cb•Kb<10-8 ,可以用仪器检 测终点或在非水溶液中进行滴定。
四、缓冲溶液的离子浓度计算
定义:加入少量酸碱,溶液pH值无显著变化的溶液。 组成:共轭碱(酸)、或浓度较大的强酸(碱)
例: Ca mol/mL HA与Cb mol/mL NaA水溶液
质量: 电荷:
[HA] + [A-] = Ca + Cb [Na+] = Cb [Na+] + [H+]= [A-] + [OH-]
分析化学_第四章_酸碱滴定法

18:52:31
以上这些式子在酸碱质子理论中叫酸碱半反应,因为 它们只单方面地反映了酸给出质子或碱得到质子的情况。
从以上可以看出,酸给出H+后的产物,因为它或多或 少地具有了接受H+的能力,所以酸给出H+后的产物就是碱。 而碱在接受了H+以后,其产物就具有了给出H+的能力,所以 碱在获得 H+后的产物就是酸。在酸碱质子理论中,酸与碱 的这种相互依存的关系称之为共轭关系。例如, HAc 是Ac- 的共轭酸,Ac-是 HAc 的共轭碱。
NH4 H NH3
HCO-3
H
CO32-
H2O、HAc、NH4+、HCO3-都 能给出H+,所以它们是酸。
OH- H H2O Ac- H HAc
NH3 H NH4
CO32-
H
HCO
- 3
OH-、Ac-、NH3、CO32-都 能接受H+,所以它们是碱。
酸给出H+的过程和碱接受H+的过程是相互依存、同时存 在的。酸碱反应是两个共轭酸碱对共同作用的结果。
18:52:31
例1 HAc在水中的离解(或称电离)
HAc在水中的离解实际上是两个共轭酸碱对共同作用的 一个酸碱反应。
HAc给出H+的半反应 H2O得到H+的半反应
HAc
H+ + Ac-
H2O + H+
H+
H2O + H2O
H3O+ + OH-
18:52:31
当这个质子自递反应达到平衡时,按照化学平衡的原 理,其平衡常数表达式为
分析化学-第四章 酸碱滴定

1. 酸碱平衡理论基础复习 2. 当pH变化时酸碱存在形式的变化(分布曲线)(重点) 3. 酸碱溶液pH计算
酸碱滴定
4. 滴定终点指示办法 5. 一元酸碱滴定
6. 多元酸、碱滴定
(重点) (重点)
酸碱滴定 7. 酸碱滴定应用 的应用 8. ~9 示例
§4.1 酸碱平衡的理论基础
1 酸碱质子理论
7
例1:
试求 HPO42- 的 pKb2和 Kb2。
解:经查表可知 Ka2 = 6.3×10-8,即 pKa2 = 7.20
由于
Ka2·Kb2 = 10-14
所以
pKb2 = 14 - pKa2
= 14 - 7.20
= 6.80
即
Kb2=1.6×10 -7
&
8
§4.2 不同pH溶液中酸碱存在形式 的分布情况—分布曲线
以δ对pH作图,关系曲线叫分布曲线.
分布系数与溶液pH关系曲线的讨论:
基本原则: δ0 + δ1= 1 (1) [H+]>Ka, pH<pKa时, δ1>δ1(以HOAc为主);
(2) pH=pKa, [H+]=Ka时, δ0 = δ1= 0.5;
(3) [H+]<Ka, pH>pKa 时, δ1<δ0(以OAc- 为主)。
例:酸、碱在水中的解离过程:
NH3 + H2O
OH- + NH4+
HOAc + H2O
H3O+ + OAc-
2 酸碱解离平衡
一元弱酸的解离:HA + H2O
[H ][A ]
Ka HA
第四章 酸碱滴定法

∴ pH = 5.13
(3) 1. 0×10 – 5 mol· -1 NH4Cl ( Kb (NH3) = 1. 8×10 – 5 ) L
解:
K w 1.0 1014 Ka 5.6 1010 Kb 1.8 105
Kb(NaAc) = 1.0 10– 14 / 1. 8 10–5 = 5.6 10–10
2、已知 H3PO4 的Ka1 =7.6 10 – 3 , Ka2= 6.3 10 – 8, Ka3 = 4.4 10 – 13。 计算Na3PO4 的Kb1 Kb2 Kb3
解、 PO4 3 – + H2O H PO4 2 – + OHHPO4 2 – + H2O H2PO4 – + OHH2PO4 –- + H2O H3 PO4 + OH∵ Ka1 Kb3 = K w
(三)共轭酸碱对中Ka与Kb 的关系 1﹑一元弱酸弱碱的K
HA +H2O A –- + H3O+ A – + H2O HA + OH-
Ka = Kb =
ceq( H3O+ ) ceq( A– )
ceq( HA ) ceq( HA) ceq( OH– )
ceq( A– )
对于共轭酸碱对:HA --- A – KaKb = ceq(H3O+ ) ceq(OH-) = Kw pKa+ pKb = pKw= 14.00
ceq ( H+ ) + ceq ( H2CO3 ) = ceq ( NH3 ) + ceq ( CO3 2 - ) + ceq ( OH - ) (4) (NH4) 2CO3 零水准物质 —— NH4 + CO3 2 H2 O
第四章 酸碱滴定法-分析化学

HAc的解离: HAc + H2O
H3O+ + Ac-
质子理论对酸碱的总结:
xie 分 析 化 学 酸碱是相对的,在不同的化学反应中,物质是酸是碱, 取决于反应中该物质对质子亲和力的相对大小。因此 当讨论某一种物质是酸是碱时,不能脱离该物质和其 他物质(包括溶剂)的相互关系。 同一种物质在不同溶剂中可表现出不同的酸碱性。对一 定的酸,溶剂接受质子的能力越强,酸性则越强。 例如:硝酸在水中为强酸,在冰醋酸中酸性减 弱,在浓硫酸中则显碱性。
xie 分 析 化 学
例如:盐酸与氨在水溶液中的反应:
HCl + H2O H3O+ + Cl-
H3O+ + NH3
NH4+ + H2O
NH4+ + Cl-
总式
HCl + NH3
注意:
xie 分 析 化 学 质子论的酸碱中和反应没有盐的生成。因此, 盐的水解反应和电解质的离解过程都是酸碱质子 转移反应。 例如:
pKb=pKw-pKa=14.00-9.21=4.79
xie 分 析 化 学
多元酸在水中分级电离,其水溶液中存在着多
个共轭酸碱对,其共轭关系如下(以三元酸为
例): A3-+H2O HA2-+H2O H2A-+H2O HA2-+OHH2A-+OHH3A+OHKW=Kb1×Ka3 KW=Kb2×Ka2 KW=Kb3×Ka1
3 K a1 K a2 K a3 [ PO4 ] 3 C [ H ]3 K a1 [ H ]2 K a1 K a2 [ H ] K a1 K a2 K a3
第四章酸碱滴定法

解:
NH
4
NH3 H
Ka
Kw Kb
1014 1.8105
cKa 20Kw 但
5.61010 C 500 Ka
[H ] Kac Kw 5.61010 104 1014 2.6107
pH=6.58
例:求0.1mol/L NaCN溶液的pH值。
H2PO4Ka2
HPO42Ka3
H2PO4 - + H+ Kb3
HPO42- + H+ Kb2
PO43- + H+ Kb1
讨论:
多元酸碱在水中逐级离解,强度逐级递减
Ka1 Ka2 Ka3 Kb1 Kb2 Kb3
形成的多元共轭酸碱对中最强酸的解离常数 Ka1对应最弱共轭碱的解离常数Kb3 Ka1 Kb3 Ka2 Kb2 Ka3 Kb1 KW 1.01014
例 .计算0.10mol/LNa2CO3 溶液的pH值 解:已知 H2CO3 的 Ka1 4.2 107 Ka2 5.6 1011
因为
Kb1
Kw Ka2
1.8104
Kb2
Kw K a1
2.4 108
所以 可按一元碱处理 , 又
cKb1 ≥ 20Kw
C 500 Kb1
质子条件式 *
化学平衡关系 [H+]的精确表达式
近似处理 近似式
进一步近似处理
最简式
(一) 强酸(碱)溶液[H+]的计算 → 强酸溶液
质子条件式: 代入平衡关系式
[H+] = [A-] + [OH-]
第四章酸碱滴定法

1
1
K a1 [H ]
Ka1 • Ka2 [H ]2
H 2 H 2 Ka1 H
Ka1 Ka2
即: δ0 δH2C2O4
H 2C2O4 C
H 2 H 2 Ka1 H Ka1 Ka2
同理: δ1 δHC2O4
HC2O4 C
H 6 Ka1 H 5 Ka1 Ka2 H 4 Ka1 Ka2 Ka3 Ka4 Ka5 H Ka1 Ka2 Ka3 Ka4 Ka5 Ka6
第二节 酸碱溶液的pH计算
1. 一元酸(碱)溶液的氢离子浓度计算 2. 多元酸(碱)溶液的氢离子浓度计算 3. 两性物质溶液的氢离子浓度计算 4. 缓冲溶液的氢离子浓度计算
1)
[H ] [HB] [OH ]
[OH
]
Cb
Kw [OH
]
2)
[OH ] Cb Cb2 4Kw
2
(精确式)
3)
[OH - ] Cb
(近似式)
(二)弱酸(碱)溶液的氢离子浓度计算
1. 设一元弱酸(HA)浓度为Ca(mol/L),计算[H+]
HA
H+ +A-
H2O
H + + OH -
小结:
1.MBE、CBE、PBE反映的都是溶液平衡体系中各组分 平衡浓度之间的关系; 2.MBE反映的是总浓度与平衡浓度的关系,组分可以是 离子或中性分子,CBE反映的是体系中所有阴、阳离子平 衡浓度之间的关系,中性分子不包括在内。 3.PBE则反映的是得质子组分与失质子组分平衡浓度之 间的关系,它是处理酸碱平衡体系的基本关系式。
例如,C mol/L的HAc溶液。
参考水准
[H+] 得质子 H2O
分析化学酸碱第四章酸碱滴定法

δ H 3 PO4
H K H K
3 2 a1 3 2 a1
H
a1
3
K a2 H K a1K a2 K a3
2
δ H PO
2 4
H K H K
二、 溶剂的质子自递反应和水的质子自递常数
在水分子之间也可以发生质子转移作用, 这种仅在 溶剂分子之间发生的质子传递作用,称为溶剂的质子 自递反应。
H2O H2O H3O O H
该反应称为水的质子自递反应。反应的平衡常数称为水 的质子自递常数,以Kw表示。 [H3O+][OH-]= KW 水合质子H3O+常简写为H+,则 +][OH-]= KW [H 这个常数也称为水的离子积,在25℃时, [H+][OH-] = KW=1.0×10-14, pKW=14
质子 碱 HAc H Ac
酸
NH4
H NH3
即能给出质子又能接受质子的物质称为两性物质。例如: H2O 、HCO3- 、HPO42-等。 在溶液中实际上没有自由的氢离子,当溶液中一种酸给 出质子时,必定有一种碱来接受质子。例如:HCl在水中 的离解便是HCl分子与水分子之间的质子转移作用,作为溶 剂的水分子,同时起碱的作用。 HCl + H2O = H3O+ + Cl酸1 碱2 酸2 碱1
2 2 4
H 2C 2O 4
HC2O 4
C 2O 4
c
δ
H 2C 2O 4
=[H2C2O4]+[HC2O4-]+[C2O42-]
[H2C2O 4 ] [H2C2O 4 ] 2 C H 2C 2O 4 [H2C2O 4 ] [HC2O 4 ] [C2O 4 ] 1 2 [HC2O 4 ] [C2O 4 ] 1 [H2C2O 4 ] [H2C2O 4 ]
第四章 酸碱滴定法(人卫版分析化学)

第四章酸碱滴定法1.基本概念(1)混合指示剂:两种或两种以上指示剂相混合,或一种指示剂与另一种惰性染料相混合。
利用颜色互补原理,使终点颜色变化敏锐。
(2)滴定反应常数(K t):是滴定反应平衡常数。
强碱(酸)滴定强酸(碱):K t=1/K w=1014;强碱(酸)滴定弱酸(碱):K t=K a(b) /K w。
K t值越大,该滴定反应越完全,滴定突跃越大。
(3)滴定曲线:以滴定过程中溶液pH值的变化对滴定体积(或滴定百分数)作图而得的曲线。
(4)滴定突跃:化学计量点附近(±0.1%)pH的突变。
(5)滴定误差:滴定终点与化学计量点不一致引起的误差,与指示剂的选择有关。
(6)质子溶剂:能给出质子或接受质子的溶剂。
包括酸性溶剂、碱性溶剂和两性溶剂。
(7)无质子溶剂:分子中无转移性质子的溶剂。
包括偶极亲质子溶剂和惰性溶剂。
(8)均化效应和均化性溶剂:均化效应是指当不同的酸或碱在同一溶剂中显示相同的酸碱强度水平;具有这种作用的溶剂称为均化性溶剂。
(9)区分效应和区分性溶剂:区分效应是指不同的酸或碱在同一溶剂中显示不同的酸碱强度水平;具有这种作用的溶剂称为区分性溶剂。
2.基本原理(1)酸碱指示剂的变色原理:指示剂本身是一类有机弱酸(碱),当溶液的pH改变时,其结构发生变化,引起颜色的变化而指示滴定终点。
酸碱指示剂的变色范围:pH=pK HIn±1;理论变色点:pH=pK HIn(2)选择指示剂的原则:指示剂变色的pH范围全部或大部分落在滴定突跃范围内,均可用来指示终点。
(3)影响滴定突跃范围的因素:①酸(碱)的浓度,c a(b)越大,滴定突跃范围越大。
②强碱(酸)滴定弱酸(碱),还与K a(b)的大小有关。
K a(b)越大,滴定突跃范围越大。
(4)酸碱滴定的可行性:强碱(酸)滴定一元弱酸(碱):c a(b)K a(b)≥10-8,此酸、碱可被准确滴定。
多元酸(碱):c a1(b1)K a1(b1)≥10-8,c a2(b2)K a2(b2)≥10-8,则两级离解的H+均可被滴定。
第四章 酸碱滴定
浓度为0.10 mol· -1 NaHCO3溶液,溶液中存 L 在以下解离平衡: NaHCO3 = Na+ + HCO3HCO3- + H+ ⇌ H2CO3 HCO3- ⇌ H+ + CO32-
即溶液中除了存在Na+和HCO3-外,还有CO32-和 H2CO3,所以其物料平衡为:
CNa+=[Na+]=0.10 mol/L CHCO3- =[CO32-]+[HCO3-]+[H2CO3]= 0.10 mol/L
结 论
一对共轭酸碱对,其共轭酸的酸性越强(即 Ka越大),则其共轭碱的碱性就越弱(即Kb越 小);反之亦然。
例: HCl + H2O = H3O+ + ClHAc + H2O ⇌ H3O+ + AcH2S + H2O ⇌ H3O+ + HSKa 》1 Ka=1.8×10-5 Ka,1=5.7×10-8
第二节 水溶液中弱酸(碱)各型体的分布
重点 1、理解弱酸(碱)水溶液中的物料平衡、电 荷平衡和质子平衡并会写三个平衡关系式; 2、理解酸度对弱酸(碱)各型体分布的影响。
一、处理水溶液中酸碱平衡的方法
(一)分析浓度与平衡浓度 分析浓度:溶液中溶质的总浓度。又称标签浓 度。通常以物质的量浓度(mol/L)为单位,用 c 表 示。 平衡浓度:指平衡状态时,在溶液中存在的每 个物质的浓度,用符号[ ]表示。单位通常也用物 质的量浓度。
酸度是指溶液中氢离子的平衡浓度[H+](严 格说应该是活度),通常用其负对数表示,即pH 。酸的浓度是指酸的分析浓度,所以,酸的浓度 与酸度是不同的两个概念。同样,碱的浓度与碱 度也是不同的概念,碱度可用pOH表示。 pH + pOH = 14.00
第四章 酸碱滴定法

KHIn与温度有关;
如18℃时,甲基橙的变色范围为3.1~4.4,而 100℃时则为2.5~3.7。 滴定宜在室温下进行
返回
不同的溶剂中KHIn值不同; 例如甲基橙在水溶液中pKHIn=3.4,而在甲 醇中pKHIn=3.8。 溶剂中中性电解质的存在增加了溶液的离 子强度,使指示剂的表观离解常数改变, 将影响指示剂的变色范围。 同时某些盐类具有吸收不同波长光的性质, 也会改变指示剂颜色的深度和色调。 返回
第四章 酸碱滴定法
酸碱滴定法(中和滴定法): 以酸碱反应(水溶液中的质子转移反 应)为基础的定量分析法. (非水滴定单独讲解)
本章重点: (1)酸碱平衡理论 (2)各类酸碱溶液的pH值计算方法 (3)指示剂的选择和各类酸碱滴定曲线
第一节 水溶液中的酸碱平衡
一、酸碱的质子理论
凡能给出质子(H+)的物质是酸,能接收 质子的物质是碱。
子条件式中的[OH-]项可忽略,则有:
[H+]=[A-]=Ca
2.一元弱酸
[H+]=[A-]+[OH-]
K a [HA] K w [H ] [H ] [H ]
[H ]2 K a [HA] K w
C a [H ] [HA] Ca δ 0 [H ] K a
NaHCO3溶液 参考物质:HCO3-,H2O
H2CO3 H3O
+
+H +H
+ + HCO3
-H
+ + 2CO3 -
H2O
-H
OH
质子条件式: [H2CO3]+[H3O+]=[CO32-]+[OH-]
(二)一元酸碱溶液的pH计算
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[H 2 PO 4 ] δ= 2 c K a1[H + ]2 = + 3 + 2 + [H ] + K a1[H ] + K a1 K a 2[H ]+ K a1 K a 2 K a 3
−
[HPO 2− ] 4 δ= 1 c K a1 K a 2[H + ] = + 3 [H ] + K a1[H + ]2 + K a1 K a 2[H + ]+ K a1 K a 2 K a 3
[PO ] δ = 0 c K a1 K a 2 K a 3 = + 3 + 2 + [H ] + K a1[H ] + K a1 K a 2[H ]+ K a1 K a 2 K a 3
2− 4
δ +δ +δ +δ = 1 3 2 1 0
pKa
1
pKa2
pKa3
磷酸溶液中各种存在形式的分布系数与溶液pH pH的关系曲线 图4-3 磷酸溶液中各种存在形式的分布系数与溶液pH的关系曲线
根据质子理论,酸碱中和、酸碱离解、 根据质子理论,酸碱中和、酸碱离解、 盐的水解过程都是质子转移过程。 盐的水解过程都是质子转移过程。 HC1 + NH3 HOAc + H2O NH3 + H2O OAc― + H2O NH4+ + H2O NH4++ C1― H3O+ + OAc― OH― + NH4+ OH―+ HOAc H3O+ + NH3 中和 离解 离解 水解 水解
(4)pH >> pKa3, 0 >>δPO43-为主要的存在形式 δ 1,
4-4 酸碱滴定终点的指示方法 酚酞(弱酸) 1、酚酞(弱酸)
OH- OH- 强碱
无色分子
H+
无色离子
H+
红色离子
无色离子
H+
根据实验测定: 根据实验测定:pH < 8时,溶液呈无色 10时 pH >10时,溶液呈红色 变色范围:pH8 pH10 变色范围:pH8~pH10
3 pH pK δ 0, − 主 存 形 ( ) 》 a, 1 δ OAc 为 要 在 式 《
2、二元酸
c = [H 2 C 2 O 4 ] + [HC 2 O 4 ] + [C O ]
[H 2 C 2 O 4 ] [H 2 C 2 O 4 ] = δ= 2 − 2− c [H 2 C 2 O 4 ]+[HC 2 O 4 ]+[C 2 O 4 ] = 1 [HC 2 O ] [C O ] + 1+ [H 2 C 2 O 4 ] [H 2 C 2 O 4 ]
(1)pH<<pKa1 , 3 >> 2, H3PO4为主要的存在形式 δ δ
(2)pK1 <<pH<<pKa2 , 2 >> 3, 2 >> 1, H2PO4-为主要的存在形式 δ δδ δ a
(3)pK <<pH <<pKa3, 1 >> 2, 1 >> 0,HPO42-为主要的存在形式 δ δδ δ a2
OAc-+H2O
OH-+HOAc
− [HOAc][OH] Kb = [OAc ]
一元弱酸(HOAc):K
θ W
= K(HOAc)⋅ K(OAc )
θ a θ b
−
已知NH 的离解反应为: 例1 已知NH3的离解反应为: NH3+H2O NH4++OH-
的共轭酸的离解常数K 求NH3的共轭酸的离解常数 a。 已知K 已知 b=1.8×10-5 ×
-
[C 2 O 4 ] K a1K a2 = + 2 δ = 0 + [H ] + K a1[H ]+ K a1K a2 c
2-
δ +δ +δ = 1 2 1 0
pka1
pka2
图4-2 草酸溶液中各种存在形式的分布系数与溶液pH的关系曲线 草酸溶液中各种存在形式的分布系数与溶液pH的关系曲线 pH
2、甲基橙(弱碱) 甲基橙(弱碱)
H+
黄色分子
OH-
红色离子
根据实验测定: 根据实验测定:pH < 3.1时,溶液呈红色 pH > 4.4时,溶液呈黄色 变色范围:pH3 变色范围:pH3.1~pH4.4 pH4
表4-3 几种常用酸碱指示剂的变色范围
指示剂 百里酚蓝 甲基黄 甲基橙 溴酚蓝 溴甲酚绿 甲基红 溴百里酚蓝 中性红 苯酚红 酚酞 百里酚蓝 百里酚酞 变色范围pH 变色范围pH 1.2~ 1.2~2.8 2.9~ 2.9~3.0 3.1~4.4 3.1~ 3.0~ 3.0~4.6 4.0~ 4.0~5.6 4.4~ 4.4~6.2 6.2~ 6.2~7.6 6.8~ 6.8~8.0 6.8~ 6.8~8.4 8.0~ 8.0~10.0 8.0~ 8.0~9.6 9.4~ 9.4~10.6 颜色变化 红~黄 红~黄 红~黄 黄~紫 黄~蓝 红~黄 黄~蓝 红~黄橙 黄~红 无~红 黄~蓝 无~蓝
2、酸碱离解平衡 基本特性 给出质子能力愈强,酸性愈强; 给出质子能力愈强,酸性愈强; 接受质子的能力愈强,碱性愈强。 接受质子的能力愈强,碱性愈强。 酸性愈强,共轭碱愈弱; 酸性愈强,共轭碱愈弱; 酸愈弱,共轭碱愈强。 酸愈弱,共轭碱愈强。 如: 弱酸, 较强的碱; NH4+-弱酸,NH3-较强的碱; HS--弱酸,S2--强碱。 弱酸, 强碱。
(1)pH<< ,2 δ (1)pH pKa1δ>> 1,
H2C2O4为主要的存在形式
为主要存在形式; (2)pK 1 <<pH <<pKa2 , 1 >> 2, 1 >> 0,HC2O4-为主要存在形式; δ δδ δ a
(3)pH>>pKa2 , 0 >> 1, C2O42-为主要的存在形式 δ δ
+ 2 − 4 2− 2 4
−
22 4
=
1 K a1 K a1 K a 2 1+ + + + 2 [H ] [H ]
[H ] = + 2 [H ] + K a1[H + ]+ K a1 K a 2
[HC 2 O 4 ] K a1[H + ] = δ = 1 + 2 + c [H ] + K a1[H ] + K a1K a2
二 弱 ( 2CO3 : 元 酸 H ) K = K( 2CO3 ⋅ K( H ) CO )
θ W θ a1 θ b2 2− 3
K = K( 2CO3 ⋅ K( H ) CO )
θ W θ a2 θ b1
2− 3
三 弱 ( 3PO4) 元 酸 H : ⋅ K = K( 3PO4) K( H PO )
酸碱离解常数Ka、Kb描述酸碱的强弱 酸碱离解常数Ka、Kb描述酸碱的强弱 Ka
HOAc+ HOAc+H2O NH4++H2O HS―+H2O Ka=1.8× H3O++OAc― Ka=1.8×10-5 H3O++NH3 H3O++S2― Ka=5.6× Ka=5.6×10-10 Ka=7.1× Ka=7.1×10-15
[In − ] =1,中间色 [HIn]
[H + ] = K HIn ,pH = pK HIn
指示剂变色范围: 指示剂变色范围:pH= pKHIn±1
结
论
指示剂的变色范围不恰好位于7左右, 指示剂的变色范围不恰好位于7左右,而 是随各种指示剂常数值KHIn的不同而异; 是随各种指示剂常数值K 的不同而异; 各种指示剂在变色范围内显示出逐渐变化 的过渡颜色; 的过渡颜色; 各种指示剂变色范围的幅度各不相同, 各种指示剂变色范围的幅度各不相同,但 一般说来, 一般说来,1<pH单位<2。 pH单位< 单位
pH=pka=4.75
图4-1 HOAc、OAc-分布系数与溶液pH的关系曲线 HOAc、 分布系数与溶液pH的关系曲线 pH
, 与 - 占 (1)pH= pKa =4.75, δ = 1 =0.5 HOAc OAc 各 50% δ 0
HOAc为主要存在 (2)pH《 pK a,δ1 》 0 ,HOAc为主要存在形式 δ
H++OAcH+ + ClO4H+ + OH- H++SO42- H+ + NH3 质子+ 质子+ 碱
酸给出质子时溶剂水是接受质子的碱, 酸给出质子时溶剂水是接受质子的碱, 碱接受质子时溶剂水是放出质子的酸。 碱接受质子时溶剂水是放出质子的酸。
HOAc 酸1 H 2O + H + 碱2 HOAc + H2O 酸1 碱2 H+ + OAc― 碱1 H 3O + 酸2 H3O+ + OAc酸2 碱1
NH3 + H+ 碱1 H 2O 酸2 NH3 + H2O 碱1 酸2
NH4+ 酸1 H+ + OH― 碱2 OH― + NH4+ 碱2 酸1
是一种两性溶剂,一个H H2O是一种两性溶剂,一个H2O可从另一 中夺取质子而形成H H2O中夺取质子而形成H3O+和OH-。 H 2O + H 2O 质子自递常数: 质子自递常数: Kw=[H3O+][OH―] =[H+][OH― ] T=25℃时:Kw=10-14 = ℃ H3O+ + OH―
pKHIn
1.7 3.3 3.4 4.1 4.9 5.0 7.3 7.4 8.0 9.1 8.9 10.0
