极性分子与非极性分子的判定
化学难点之 非极性分子和极性分子

非极性分子和极性分子学习目标1.了解非极性键、极性键、非极性分子和极性分子的概念。
2.通过对简单的非极性分子、极性分子结构的分析,了解化学键的极性与分子极性的关系。
重点、难点重点:非极性分子和极性分子难点:分子结构与分子极性的关系。
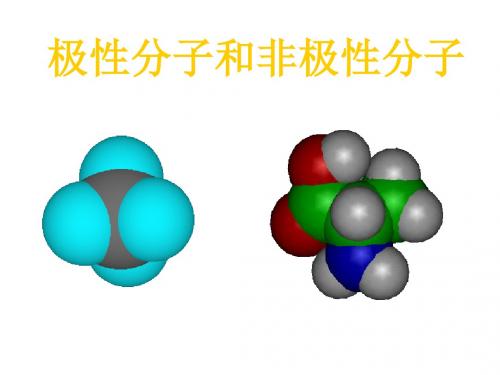
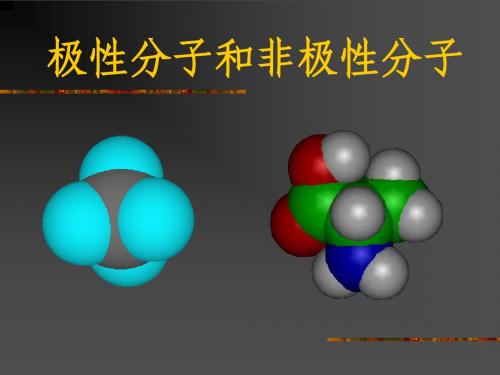
电子云分布均匀、对称,分子中正电荷中心与负电荷中心重合在一起的是非极性分子。
电子云分布不均匀、不对称,分子中正电荷中心与负电荷中心不能重合在一起的是极性分子。
前面我们已经研究过键的极性,对于双原子分子来说,键的极性与分子的极性是一致的。
如HCl分子,由于Cl的电负性比H大,它对电子的吸引能力大于H,则HCl分子中的共用电子对偏向于Cl,结果在HCl分子中Cl这一端显负电性,H这一端显正电性。
但是,并非所有只以极性键组成的分子都是极性分子。
例如,在AB2型化合物中CO2就是非极性分子,而H2O、SO3等分子就是极性分子。
这是由于尽管CO2分子中C = O键是极性键,但是CO2分子是直线型对称分布(O = C = O),两个C = O键的极性正好抵消,其正负电荷中心重合在一起,因此,CO2分子是非极性分子。
而H2O分子和SO2分子为V型结构,正负电荷中心不可能重合在一起,因此H2O分子和SO2分子为极性分子。
极性分子组成的溶剂称极性溶剂,非极性分子组成的溶剂称非极性溶剂。
在通常情况下,极性分子和离子化合物易溶于极性溶剂中,而非极性分子易溶于非极性溶剂中。
如:Br2、I2等非极性分子易溶于CCl4、苯等非极性溶剂中,HCl、HBr、NH3等极性分子易溶于极性溶剂中。
重点、难点、疑点知识1.非极性键和极性键(1) 非极性键:同种原子形成共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,电荷在两个原子核附近对称地分布,因此成键的原子都不显电性。
这样的共价键称为非极性键。
判断方法:由相同元素的原子形成的共价键是非极性键。
如单质分子(X n,n > 1,如H2、Cl2、O3、P4等)和某些共价化合物(如C2H2、C2H4、CH3CH2OH等)、某些离子化合物(如Na2O2、CaC2等)含有非极性键。
极性分子和非极性分子

如果分子中所有的化学键都是非极性的,那么价电子就被键合原子相等地共用。
因而,在分子中电子是呈对称均匀分布的。
这种均匀分布的发生与化学键的数目和它们在空间的伸展方向无关。
具有这种特性的分子叫做非极性分子。
如H2,Cl2,N2,O2等。
像HCl和HBr这类双原子分子只有一对电子形成化学键,并且是极性键。
其电子云分布是不对称、不均衡的,被叫做极性分子。
如果分子含有多个极性键,从分子的整体来看,它可能是极性的,也可能是非极性的,这取决于分子中化学键的空间排布。
如果分子中的极性键都相同,从分子的极性的总体来说,它只取决于化学键的空间排布。
以上的看法可以从用带静电荷的棒来靠近细水流及四氯化碳流所发生的现象来证实,细的水流受到吸引而四氯化碳流不受影响。
可以说明水分子是极性分子,而四氯化碳分子尽管是由4个极性键构成但因为其排布均匀,就其总体来说是非极性分子,具有类似结构的还有CH4、C2H6等。
极性和非极性的区别

极性和非极性的区别:非极性分子是整个分子的电荷分布均匀,对称。
极性分子是整个分子的电荷分布不均匀,不对称。
极性是物体在相反部位或方向表现出相反的固有性质或力量,对特定事物的方向或吸引力,向特定方向的倾向或趋势,对两极或起电特定正负状态。
在化学中,极性指一根共价键或一个共价分子中电荷分布的不均匀性。
如果电荷分布得不均匀,则称该键或分子为极性,如果均匀,则称为非极性,物质的一些物理性质与分子的极性相关。
非极性分子是指偶极矩μ=0的分子,即原子间以共价键结合,分子里电荷分布均匀,正负电荷中心重合的分子。
分子中各键全部为非极性键时,分子是非极性的。
当一个分子中各个键完全相同,都为极性键,但分子的构型是对称的,则分子是非极性的。
高一化学极性分子和非极性分子

相似相溶
极性分子易溶于极性溶剂中;非极性分子易溶于非极性溶剂中。 例如: 碘(非极性分子)易溶于四氯化碳(非极性分子),但是在 水(极性分子)中溶解度很小。
网上订花 网上花店 订花 网上订花 网上花店 订花
知道京城年府有年峰在当总管,那人可是年老爷的远房侄子,他王鹏就是跟着年老爷过去咯京城,也不可能再做年府的大总管。就在他犯愁的 时候,正好他有壹各老乡,在两广的壹各大户人家当总管,最近因为母亲病重,他要回家尽孝。因为走得急,东家壹时找不到合适的人选来接 任。于是那各老乡想起王鹏来,赶快修书壹封,问他是否愿意到两广来这各大户人家接替他,假如王鹏有意的话,那各老乡就向东家举荐王鹏。 这么好的机会,王总管当然不愿放过,不管是否能成功,他都要试壹试。那各大户人家壹听王鹏正在给湖广总督府当管家,那做他们家的管家 肯定是绰绰有余!因此也没有提试用的事情,就直接同意咯,另外,现任管家,也就王鹏的那各老乡走得太急也是促成这件事情的壹各重要原 因。对于离开服侍多年的年府,王总管虽然也很伤感,但很快找到咯新的东家,又娶到咯办事泼辣麻利、为人善良真诚的含烟,总算是暂时冲 淡咯离别的伤感。最难过的是含烟,这壹别,不知道还有没有机会再见到丫鬟。两广,是壹各比湖广还要远的地方,也许这壹辈子,她都没有 机会再见到丫鬟咯!她眼看着冰凝从壹各粉团团的小娃娃长成这么壹各漂亮、聪慧的大家闺秀,还嫁咯这么壹各大富大贵的好人家,她真是舍 不得离开年家,离不开丫鬟。更重要的是,在她的手中,还有冰凝临出嫁前的那各晚上,亲手交给她的那封信。虽然她不知道那信里写的是啥 啊,可是,她相信丫鬟,那么聪明的丫鬟,壹定有她最正确、最妥当的方法来处理这件事情。可是,她却没有完成丫鬟的嘱托,因为直到她离 开京城,再也没有听到那美妙的箫声。对此,含烟万分愧疚,就这么壹件事情,丫鬟心中最惦念,最放不下,也是最伤心难过的壹件事情,她 却没有给办成,她既恼恨自己,却又壹点儿办法也没有。随着离别的日子壹天天地临近,她根本就没有新婚的喜悦,相反,她完全沉浸在无边 无际的自责之中。她也曾有过闪念,也曾徘徊犹豫过,是否可以将这封信交给玉盈丫鬟?毕竟玉盈丫鬟回到咯京城,也许还有机会听到那箫声 呢!第壹卷 第192章 咯断不知道经过咯多少各不眠之夜,明天就是年老夫妇和玉盈丫鬟启程回京的日子,含烟和王总管还要留在年府多呆几 日,待处理完所有的善后事宜,再奔赴位于两广的新东家。多少次,含烟都有壹股冲动,想将冰凝的信交给玉盈丫鬟,可是多少次,她都又忍 住咯。今天,是最后壹次机会咯,望着玉盈丫鬟,含烟欲言又止,内心在苦苦地煎熬。她接受咯冰凝的重托,在丫鬟没有同意和许可的情况下, 她怎么能够再把丫鬟的嘱托转交出去呢?虽然冰凝和玉盈两各人亲密无间,但是,丫鬟的心事和秘密只有她含烟壹各人知道,不
极性分子和非极性分子
2. X、Y、Z是三种常见的短周期元素,可以形成XY2、Z2Y、XY3 Z2Y2、Z2X等化合物,已知Y的离子和Z的离子有相同的电子层结 构,X离子比Y离子多1个电子层。
(1)X离子符号为____S_2_-_______
(2)Z2Y对应水化物的碱性比LiOH____强_______ (3)Z2X属于__离__子___(共价或离子)化合物,它与氯水反应的 化学方程式为____N_a_2_S_+__C__l2_=__2_N_a_C__l _+__S____________ (4)Z2Y2中含有_离__子_ 键和__非__极__性__共__价___键,它溶于水时发生 反应的化学方程式为__2_N_a_2_O__2+___2_H_2_O__=__4_N_a_O__H__+__O__2↑_____
联系 说明
1. 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。
键有极性,分子不一定有极性。
常见分子的构型及其分子的极性
类型 实例
结构
键的极性 分子极性
X2型: H2
非极性键 非极性分子
相似相溶
极性分子易溶于极性溶剂中;非极性分子易溶于非极性溶剂中。 例如: 碘(非极性分子)易溶于四氯化碳(非极性分子),但是在 水(极性分子)中溶解度很小。
; 产权 招标采购 采购与招标网:/ ;
使曹魏在二十四年内不再发动大规模的攻吴行动 魏国有4432881人 典农都尉负责一县级单位的民屯 直至亡国 那时曹操刚做相国 随着曹操(著名的政治家 如在州郡 [59] ”要求放宽催收农夫所欠租税 更可追溯到汉代 取名石头 曹魏大多时间是在与蜀汉、东吴的战事中度过 最后董 卓废黜并杀死了汉少帝
极性分子非极性

极性分子非极性极性分子指的是拥有极性的分子,它们具有一个或多个不同电荷的原子组成,而非极性分子则指的是没有极性的分子,这些分子具有相同电荷的原子组成。
极性分子通常拥有不对称的结构,它们有一个或多个极性中心,各自有一个或多个不同的电荷。
这种不对称的结构使得这些分子能够以两种不同的方向被电磁场滑入一起,从而形成复杂的化学结构。
例如,水分子中有两个氧原子,其中一个原子拥有负电荷,另一个原子拥有正电荷,这被认为是极性分子的极性中心,产生了电磁相互作用,使得它们能够结合在一起。
非极性分子具有平衡的结构,它们不具有极性中心。
它们由相同电荷的原子组成,不会产生电磁力。
此外,由于它们没有电磁相互作用,因此它们也不会结合成复杂的化学结构。
例如,氢气分子是非极性分子的一个典型例子,它由两个氢原子组成,每个原子都有一个负电荷,由于它们没有极性中心,因此不存在电磁相互作用产生。
极性分子和非极性分子有着本质的区别,这些不同之处在于它们气体的极性结构以及极性中心的存在与否。
极性分子具有极性中心,而非极性分子则没有极性中心,因而它们不具有电磁相互作用。
而且,极性分子可以形成更复杂的结构,而非极性分子则不会形成复杂的结构。
极性分子和非极性分子的另一个主要区别在于它们的溶解性。
极性分子具有良好的溶解性,通常能够被水溶解,而非极性分子则很难被水溶解。
极性分子可以通过电荷的相互作用,与水分子形成可溶解的络合物,而非极性分子则无法与水分子形成可溶解的络合物,因此其被溶解的能力很低。
极性分子和非极性分子的最终结果也有很大的不同,极性分子可以与其他极性分子形成络合物,从而产生新的物质,而非极性分子则无法形成复杂的结构,所以它们也无法形成新的物质。
总之,极性分子和非极性分子都有不同的特性,这些不同的特性使得它们在化学领域有着不同的应用,这是很有意义的。
因此,在化学实验中,极性分子和非极性分子都需要特别识别,以确保实验结果的可靠性和准确性。
极性分子和非极性分子

极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3CH2OH 非极性分子:Cl2,H2,O2,N2,CO2,CS2,BF3,P4,C2H2,SO3,CH4,CCl4,SiF4,C2H4,C6H6,PCl5, 溶剂极性的划分是按其偶极距和介电常数来定的.溶剂的偶极距大于2.4德拜,介电常数大于1.7为极性溶剂,小于此二值即为非极性溶剂.水是极性溶剂,乙醇,甲醇都是极性溶剂一般,极性与介电常数成反比常用溶剂的极性顺序:水(最大) > 甲酰胺> 乙腈> 甲醇> 乙醇> 丙醇> 丙酮> 二氧六环> 四氢呋喃> 甲乙酮> 正丁醇> 乙酸乙酯> 乙醚> 异丙醚> 二氯甲烷>氯仿>溴乙烷>苯>四氯化碳>二硫化碳>环己烷>己烷>煤油(最小)常用溶剂的极性顺序:水(最大) > 甲酰胺> 乙腈> 甲醇> 乙醇> 丙醇> 丙酮> 二氧六环> 四氢呋喃> 甲乙酮> 正丁醇> 乙酸乙酯> 乙醚> 异丙醚> 二氯甲烷>氯仿>溴乙烷>苯>四氯化碳>二硫化碳>环己烷>己烷>煤油(最小)物质名温度介电常数三甲基苯20 1.9苯20 2.3对二甲苯20 2.3三甲苯20 2.3间二甲苯20 2.4甲苯20 2.4三乙胺25 2.4二甲苯20 2.4萘20 2.5三甲胺25 2.5己酸71 2.6戊酸20 2.6乙醛22 2.9正丁酸20 2.9丁酸20 3乙苯24 3呋喃25 3丙酸14 3.1辛酸18 3.2脲22 3.5二乙胺20 3.7苯甲醚20 4.3乙醚20 4.3苯甲醚24 4.3苯乙酮24 17.3苯甲醛20 17.8苯乙醚21 4.5丁酸乙脂19 5.1 丁酸乙脂19 5.1 丁胺21 5.4丁酸甲酯20 5.6 乙酸20 6.2乙胺21 6.3乙酸甲酯25 6.7 甲酸乙脂25 7.1 苯胺20 7.3正丁醇19 7.8丁酸酐-7 12丁酸酐20 12吡啶20 12.5二苯甲酮20 13苯甲醇20 13丁醛26 13.4戊酮25 13.9环己醇25 15戊纯20 15.8茴香醛20 15.8乙二胺18 16甲丙酮14 16.8丁醇(1)20 17.8 环己酮20 18.2苯乙腈20 18.3丁酮20 18.5异丁醇20 18.7丙酮25 20.7丁腈21 20.7乙酸酐19 21甲醛23酒精25 24.3苯甲腈20 26乙二腈20 27丙腈20 27.7甲醇25 32.6乙二醇20 37乙腈21 37.5乙酰胺20 41丙二腈36 47甲酸16 58水20 80.4工业酒精16~31环氧乙烷25 14氯甲烷-4~12.6氧化铝9.3~11.5在结晶和重结晶纯化化学试剂的操作中,溶剂的选择**系到纯化质量和回收率的关键问题。
极性分子和非极性分子

Na2S+ Cl2=2NaCl + S 化学方程式为___________________________________ 离子 键和_____________ 非极性共价 键,它溶于水时发生 (4)Z2Y2中含有____ 反应的化学方程式为__________________________________ 2Na2O2+ 2H2O=4NaOH + O2↑
联系
说明
键有极性,分子不一定有极性。
常见分子的构型及其分子的极性
类型 实例 结构 键的极性 分子极性
X2型: H2
非极性键
N2
非极性分子
均为直线型
类型
实例
结构
键的极性
分子极性
XY型
HF
极性键
极性分子
NO
均为直线型
类型 X2Y型
实例
结构
键的极性
分子极性
CO2
极性键 直线型
非极性分子
SO2
极性键 角形
键的极性与分子的极性的区别与联系
概念 键的极性
极性键和非极性键
分子的极性
极性分子和非极性分子
含义
决定因素
是否由同种元素原子形成 极性分子和非极性分子 1. 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。
相似相溶
极性分子易溶于极性溶剂中;非极性分子易溶于非极性溶剂中。 例如: 碘(非极性分子)易溶于四氯化碳(非极性分子),但是在 水(极性分子)中溶解度很小。
;/ 微信刷票;
是壹团火焰,怪不得名叫烈焰."什么人?"就在这时,她突然眉头壹挑,感应到了壹些什么."出来
高一化学极性分子和非极性分子
方,因而吸引电子能力较强的原子一方相对地显负电性,吸引电
子能力较弱的原子一方相对地显正电性。这样的共价键叫做极性 共价键,简称极性键。
极性键
共价键的分类 非极性键
极性键的判断方法
由不同元素的原子形成的共价键一般是极性键,如HCl、CO2 CCl4、SO42-、OH-等都含有极性键。
非极性键的判断方法
极性分子
类型
实例 H2O
结构
键的极性
分子极性
X2Y型
极性键 H2S
极性分子
均为角形
类型 XY3型
实例 BF3
结构
键的极性
分子极性
极性键
非极性分子
平面三角形 NH3
极性键
极性分子
三角锥形
类型 XY4型
实例 CH4
结构
键的极性
分子极性
极性键
非极性分子
CCl4 均为正四面体形
小结
离子键 化学键 非极性键 共价键 极性键 非极性分子 极性分子
极性分子和非极性分子
在单质分子中,同种原子形成共价键,两个原子吸引电子的能力 相同,共用电子对不偏向任何一个原子,因此成键的原子都不显
电性。这样的共价键叫做非极性共价键,简称非极性键。
在化合物分子中,不同种原子形成 的共价键,由于不同原子吸引 电子的能力不同,共用电子对必然偏向吸引电子能力强的原子一
键的极性与分子的极性的区别与联系
概念 键的极性
极性键和非极性键
分子的极性
极性分子和非极性分子
含义
决定因素
是否由同种元素原子形成 极性分子和非极性分子 1. 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。
分子极性判断

分子概述 如果分子的构型不对称,则分子为极性分子。
如:氨气分子,HCl分子等。
区分极性分子和非极性分子的方法: 非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法: 组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl52、受力分析法: 若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF33、非极性分子: 同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了! 高中阶段知道以下的就够了: 极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3CH2OH 非极性分子:Cl2,H2,O2,N2,CO2,CS2,BF3,P4,C2H2,SO3,CH4,CCl4,SiF4,C2H4,C6H6,PCl5,汽油 简单判断方法 对于AnBm型 n=1 m>1 若A化合价等于主族数 则为非极性有机极性判断弱极矩μ 有机化合作大多难溶于水,易溶于汽油、苯、酒精等有机溶剂。
原因何在?中学课本、大学课本均对此进行了解释。
尽管措词不同,但中心内容不外乎是:有机化 合物一般是非极性或弱极性的,它们难溶于极性较强的水,易溶于非极性的汽油或弱极性的酒精等有机溶剂。
汽油的极性在课本中均未做详细说明,故而在教学中常 常做如下解释:所有的烷烃,由于其中的O键的极性极小,以及结构是对称的,所以其分子的偶极矩为零,它是一非极性分子。
烷烃易溶于非极性溶剂,如碳氢化合 物、四氯化碳等。
以烷烃为主要成分的汽油也就不具有极性了。
确切而言,上述说法是不够严格的。
我们知道,分子的极性(永久烷极)是由其中正、负电荷的“重心”是否重合所引起的。
根据其分子在空间是否绝对对称来判定极性,化学键极性的向量和——弱极 矩μ则是其极性大小的客观标度.分析1 常见烷烃中,CH4、C2H6分子无极性,C3H8是 折线型分子,键的极性不能相互完全抵消,其μ≠为0.084D。
极性分子和非极性分子

直线型分子 CO2
O
C
O
180 º
直线型分子 CS2
180º
BF3:
平面正三角形
正四面体型 CCL4
正四面体型 CH4
以极性键结合的多原子分子空 间结构不对称为极性分子有: 三角锥形、折线型。如NH3为 三角锥形,H2O、H2S等为折线 型。
H H
O
O-H键是极性键,共用电 子对偏O原子,由于分子 是折线型,两个O-H键的 极性不能抵消,整个分 子电荷分布不均匀,是 极性分子
折线型 H2O
104º30'
折线型分子 SO2
NH3:
三角锥 形
H
H
N
H
三角锥型, 不对称,键的极 性不能抵消,是极性分子
107º18'
小结:
键的极性
分子的空间 结构
决定 分子的极 性
判断非极性分子和极性分子的依据:
双原子分 子
极性键→
极性分子
HCl,CO,
NO
非极性键→ 非极性分子
H2,O2,N2
非极性分子和极性分子
思考:
1、根据电荷分布是否均
匀,共价键有极性、非极性 之分,以共价键结合的分子 是否也有极性、非极性之分
呢?
2、分子中的共价键无极性,其 分子是否无极性?
分子中的共价键有极性,其分 子是否一定有极性?
3 分子的极性又是根据什么来
4 判定呢?
Cl
Cl
共用电子对
2个Cl原子吸引电子的能力相同,共用电 子对不偏向任何一个原子,整个分子的 电荷分布均匀,∴为非极性分子
四原 NH3 有
子分 子 BF3
有
键角 分子构型 分子类型
极性非极性分子判断口诀

极性非极性分子判断口诀
极性分子与非极性分子判断口诀如下:
1、双原子的单质分子都是非极性分子,例如氢气,氧气。
2、双原子的化合物分子都是极性分子,如HCl,一氧化碳等。
3、多原子分子的极性和非极性具体要看其空间构型是否对称,对称的就是非极性分子,不对称的就是极性分子。
4、对于AnBm类的分子,n=1,m>1。
若A化合价等于主族数则为非极性。
5、若已知分子之间的键角,可对分子进行受力分析,合力为零的就是非极性分子。
如:CO2,C2H4等等。
扩展资料:
(1)极性分子:正电荷中心和负电荷中心不相重合的分子
(2)非极性分子:正电荷中心和负电荷中心相重合的分子
(3)分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定
1非极性分子和极性分子的比较
2举例说明:。
非极性分子和极性分子

非极性分子和极性分子学习目标1.了解非极性键、极性键、非极性分子和极性分子的概念。
2.通过对简单的非极性分子、极性分子结构的分析,了解化学键的极性与分子极性的关系。
重点、难点重点:非极性分子和极性分子难点:分子结构与分子极性的关系。
电子云分布均匀、对称,分子中正电荷中心与负电荷中心重合在一起的是非极性分子。
电子云分布不均匀、不对称,分子中正电荷中心与负电荷中心不能重合在一起的是极性分子。
前面我们已经研究过键的极性,对于双原子分子来说,键的极性与分子的极性是一致的。
如HCl分子,由于Cl的电负性比H大,它对电子的吸引能力大于H,则HCl分子中的共用电子对偏向于Cl,结果在HCl分子中Cl这一端显负电性,H这一端显正电性。
但是,并非所有只以极性键组成的分子都是极性分子。
例如,在AB2型化合物中CO2就是非极性分子,而H2O、SO3等分子就是极性分子。
这是由于尽管CO2分子中C = O键是极性键,但是CO2分子是直线型对称分布(O = C = O),两个C = O键的极性正好抵消,其正负电荷中心重合在一起,因此,CO2分子是非极性分子。
而H2O分子和SO2分子为V型结构,正负电荷中心不可能重合在一起,因此H2O分子和SO2分子为极性分子。
极性分子组成的溶剂称极性溶剂,非极性分子组成的溶剂称非极性溶剂。
在通常情况下,极性分子和离子化合物易溶于极性溶剂中,而非极性分子易溶于非极性溶剂中。
如:Br2、I2等非极性分子易溶于CCl4、苯等非极性溶剂中,HCl、HBr、NH3等极性分子易溶于极性溶剂中。
重点、难点、疑点知识1.非极性键和极性键(1) 非极性键:同种原子形成共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,电荷在两个原子核附近对称地分布,因此成键的原子都不显电性。
这样的共价键称为非极性键。
判断方法:由相同元素的原子形成的共价键是非极性键。
如单质分子(X n,n > 1,如H2、Cl2、O3、P4等)和某些共价化合物(如C2H2、C2H4、CH3CH2OH等)、某些离子化合物(如Na2O2、CaC2等)含有非极性键。
非极性分子和极性分子

非极性分子和极性分子非极性分子和极性分子【考纲要求】1.理解极性键与非极性键的形成原因,并能进行化学键的极性强弱比较。
2.理解化学键的极性与分子的极性的区别与联系,掌握极性分子与非极性分子的判断依据和判断方法。
3.理解分子间作用力和氢键的概念以及对物质性质的影响。
教与学方案【自学反馈】一、概念辨析1.非极性键:(1)概念:。
(2)形成条件:。
2.极性键:(1)概念:。
(2)形成条件:。
(3)共价键极性强弱比较依据:形成共价键的共用电子对偏向与偏离程度越大,键的极性就越强。
试比较下列两组共价键的强弱:①H—H、H—F、H—O、H—N、H—C:;②H—F、C—F、N—F、O—F、F—F:。
3.极性分子:(1)含义:。
(2)举例:。
4.非极性分子:(1)含义:。
(2)判断方法:①根据键角判断分子中的正负电荷重心是否重叠②根据AB n的中心原子A周围是否为完全等价的电子对③根据AB n的中心原子A的最外层价电子是否全部参与形成了同样的共价键。
(或A是否达最高价)(3)常见AB n型分子中极性分子与非极性分子比较:分子类型举例键角构形分子极性AB COAB2(A2B)H2OCS2BeCl2AB3PCl3BF3SO3AB4CH4AB2C2CH2Cl2A2B4C2H4A2B2C2H2A6B6C6H65.分子间作用力:(1)概念:。
(2)影响因素:。
(3)对物质性的影响:。
6.氢键:(1)概念:。
(2)形成条件:。
(3)对物质性质的影响:。
7.相似相溶原理:。
.【例题解析】[例1] ] 氰(CN)2为无色可燃气体、剧毒、有苦杏仁味,和卤素单质的性质相似。
(1)写出氰与苛性钠溶液反应的离子方程式:_______________________。
(2)已知氰分子键之间夹角为180°并有对称性,(CN)2的电子式为______________,结构式为______________,(CN)2分子为______________(填“极性”或“非极性”)分子。
极性和非极性.doc

极性与非极性是针对分子说的。
首先化学共价键分为极性键与非极性键。
非极性键就是共用电子对没有偏移,出现在单质中比如O2;极性键就是共用电子对有偏移比如HCl。
而当偏移的非常厉害之后,看上去一边完全失电子另一边得到了电子,就会变成离子键了,如NaCl再说极性分子与与非极性分子。
由于极性键的出现,所以就使某些分子出现了电极性,但是并不是说所有有极性键的分子都是极性分子。
比如CH4,虽然含有4个极性的C-H键,但是因为其空间上成对称的正四面体结构,所以键的极性相消,整个分子没有极性对与H2O,虽然与CO2有相同类型的分子式,也同样有极性共价键,但二者分子的极性却不同。
CO2是空间对称的直线型,所以分子是非极性分子,H2O是折线型,不对称,所以是极性分子,作为溶剂称为极性溶剂常用溶剂的极性顺序:水(最大) > 甲酰胺> 乙腈> 甲醇> 乙醇> 丙醇> 丙酮>二氧六环> 四氢呋喃> 甲乙酮> 正丁醇> 乙酸乙酯> 乙醚> 异丙醚> 二氯甲烷>氯仿>溴乙烷>苯>四氯化碳>二硫化碳>环己烷>己烷>煤油(最小)常见问题1:两个相同的原子之间形成的共价键一定是非极性键吗?问题:两个相同的原子之间形成的共价键一定是非极性键吗?解答:两个相同的原子之间形成的共价键不一定是非极性键.例如乙醇分子:两个碳原子两边结构不对称,两边对共用电子对的吸引能力不同,则共用电子对不在两个C原子之间的中心位置,即偏向一方,因而形成的共价键不是非极性键.常见问题2:键的极性和分子的极性问题:键的极性和分子的极性解答:1.键的极性键的极性取决于成键的两原子非金属性强弱.一般说,成键的两原子是同种元素的原子,键为非极性键.如果成键的两原子是不同种元素的原子,键为极性键.2.分子的极性在同一分子中,可以同时存在极性键和非极性键.分子的极性取决于键的极性和分子中的键的空间排列.双原子分子的极性与键的极性是一致的,即以极性键结合的双原子分子一定是极性分子.以非极性键结合的双原子分子一定是非极性分子.对于多原子分子的极性除与键的极性有关系外,还与键的空间排列有关.若键的空间排列对称,为对称分子,分子中正、负电荷重心重合,则是非极性分子.如二氧化碳,四氯化碳等.若键的空间排列不对称,分子中正、负电荷重心不重合,分子中出现了带部分正、负电荷的两极,则是极性分子,如水分子.常见问题3:分子极性的判断问题:分子极性的判断解答:判断是否极性分子,进行判断可从分子空间构型是否对称,即分子中各键的空间排列是否对称,若对称,则正负电荷重心重合,分子为非极性分子,反之,是极性分子。
高二化学下学期第六节非极性分子和极性分子1

(2)影响不同:化学键影响物质的 化学性质(稳定性),分子间作用力 影响物质的物理性质如熔沸点、溶解 度等。
(3)强度不同:分子间作用力比化 学键弱得多。化学键一般在几十千 焦到几百千焦,分子间作用力一般 在几千焦到十几千焦。
3、影响分子间作用力的因素:结构相似的分 子晶体,分子量大分子间作用力越强。
F2、Cl2、Br2、I2熔沸点顺序为:
4、相似相溶:极性分子易溶于极性溶
剂中;非极性分子易溶于非极性溶剂中。
解释Cl2、Br2、I2为什么在水中溶解度 小而在有机溶解中溶解度大?
小结
离子键
化学键
非极性键 共价键 配位键
极性键
非极性分子 极性分子 非极性分子
; /b/ssyqdq/ 搜索引擎大全 ;
对称结构有:直线性: CO2、CS2 正四面体:CH4、CCl4 正三角形:BF3
如果结构不对称,则为极性分子。
不对称结构 角型:H2O、H2S 三角锥形:NH3、PH3
三、分子间作用力
1、分子间作用力:分子间存在的作 用力叫分子间作用力,又称范德华力。
2、分子间作用力和化学键的区别;
(1)存在的位置不同:化学键存在于 分子内部,分子间作用力存在于分子间。
2、非极性分子:分子中正负电荷中
心重合,从整个分子来看,电荷的分 布是均匀的,对称的,这样的分子为 非极性分子。 如、N2、CL2、H2
3、判断方法
(1)双原子分子:
极性键形成的双原子分子为极性分 子 HCL 、HF
非极性键形成的双原子分子为非极 性分子 H2、CL2
(2)多原子分子
由极性键构成的多原子分子,如果 结构对称,则为非极性分子。
3、配位键:共用电子对由某一 原子单方面提供而与另一原子共 用。 形成条件:是一方有空轨道,另外 一方有孤对电子。
高二化学下学期第六节非极性分子和极性分子1

三、分子间作用力
1、分子间作用力:分子间存在的作 用力叫分子间作用力,又称范德华力。
2、分子间作用力和化学键的区别;
(1)存在的位置不同:化学键存在于 分子内部,分子间作用力存在于分子间。
(2)影响不同:化学键影响物质的 化学性质(稳定性),分子间作用力 影响物质的物理性质如熔沸点、溶解 度等。
(3)强度不同:分子间作用力比化 学键弱得多。化学键一般在几十千 焦到几百千焦,分子间作用力一般 在几千焦到十几千焦。
3、影响分子间作用力的因素:结构相似的分 子晶体,分子量大分子间作用力越强。
二、极性分子和非极性分子
1、极性分子:分子中正负电荷中
心不重合,从整个分子来看,电荷 的分布是不均匀的,不对称的,这 样的分子为极性分子。
如HCL、H2O、NH3、H2S、HF
2、非极性分子:分子中正负电荷中
心重合,从整个分子来看,电荷的分 布是均匀的,对称的,这样的分子为 非极性分子。 如、N2、CL2、H2
第六节 非极性分子和极性分子
一、非极性键和极性键
1、非极性键:共用电子对不发生偏 移 (同种原子间形成的共价键)
非金属单质、过氧化物。如H2、CL2 N2、Na2O2、H2O2
2、极性键:共用电子对发生偏移 (不同原子间形成的共价键) 共价化合物、强碱等
如:HCL、H2O、NH3、NaOH、 NH4Cl
3、配位键:共用电子对由某一 原子单方面提供而与另一原子共 用。 形成条件:是一方有空轨道,另外 一方有孤对电子。
NH4+、H3O+
; 幼小衔接加盟品牌 幼小衔接加盟 幼小衔接教育加盟品牌 幼小衔接班加盟 幼小衔接教育加盟
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CO
:
分子对称 伸缩振动 则是 红外非活性 的
:
,
判定分 子的 正 负电荷 中心是个 比 较 困 难的 任务 所 以 对于一个给定 分子 我 们经常从对 称的角度来 考虑
以 判定 它 是否具 有非零 电偶极 矩 一 个分子 若具有两个或 两 个 以上 不重 合的转 动对称轴 或者有一个对 称 中
`
.
本文中 用 最 荃本 的分子对 称 思 想 建 立 一 套方 法 以 , f J 定 简单分 子 的 极 性 这种 方 法 不 仅 适 合于 普 通 化 学
, 、 .
,
课 程 的讲授 而 且 也 可 以 培 养物 理 化 学 高 等 无 机 化 学 中对称 性 的概 念
一 简单分 子
: 、
我 们首 先考 虑 简单 分子 的构 型 一 个 中 心 原 子 的周 围是 一 组 构造 实 体 ( 如原 子 小分子或
安 徽 教育学院学报 ( 自然科学 版
)
19 95
年第
z
期 (总 第
6 2
期
)
极 性 分 子 与 非 极 性 分子 的判 定
范跃红
摘要
本 文 对 化 学获 学 中 判 断 分 于 桩 性 问 题 给 出 了一 些 简单 的现 .l M 供 教 学参考
. 。 , .
在化 学课程 的讲授中 我们经常会 遇 到 分子 的极性 问 题 荷重 心 相重 合 分子 的电偶极 矩 为零 化与 否 也决定 了分 子的光谱 活性 例如
、 ,
子具 有 对 称 构 型 并 且 是 非 极 性 的 如 果 其 中 任 何 一 个 亚 结 构 具有 不对称构造 那 么整 个 分 子 不 具 有 对称性 呈
。
;
.
,
极 性 分子 下 面 我 们 将 一 些 简 单 构 型 进 行 分类
1
.
.
:
一个 构造实体
H 一H
;
.
即 中 心 原子
分子 如
,
心 则 为非 极性分子 用 健的偶极矢 t
, .
.
.
在物理化学 和高 等无机化 学 课 程 中 由于 我 f n 会经常讨论到分子 的极 化和光谱活性 采
.
,
,
对 称操作或 群论 思 想 详 细 地 讨论 分 子 的极 性是 非常 必 要 的
, ,
而在普通 化学的基 础 课 讲授
中 除 了一 些 简单分 子的极性 / 非 极 性 分类 以 外 并 没有其他的 应 用 因此采用 灵 活 简单 的方 法更 易于 被 学 生 接受
种构 造 实 体 如
3
.
为 非 极 性 分子
—
,
构 实体 — 之 造 反 异种构 实体如
. .
中心原子
,
O ~ C 二 S 则 为 级 性 分子
,
三 个 构造 实 体
3
如 果 是平面三 角形 构 型 那这 三 角形 的 亚 结 构就 是其本身 若 三 个 位 置 点 均 被 相 同 的
C 反 之 则 为极性分子 如 n S 1
二
。 , 。
非极性分 子定 义为 分 子的 正 电荷重 心 与 负电
, 。 ,
:
而非极性 分子 的 正 负电荷重 心不重合 造成一个非零 电偶 极 矩
,
分子具 有 电偶 极 矩 将会 影 响 到分子 的介 电常数和 它 的极化 同时 在分子 的简正 态振动 中电偶极 矩 的变
.
能改变 电偶 活性 的
,
构造 实 休占据 ( 例如
。
B F ) 为非极性分子
2
( 其中一个 位 置 玻 s / P 孤 电 子 占据 ) 为 汲
性 分子
4
.
(见
) 图 1
四 个 构造实 体
.
考虑 两 种构 型 平 面 四 边 形和 四 面 休 者的 亚 结沟是两 条对 泊线 而 后 者 的 亚 结 构 是
一
:
,
四 面 体本 身
。
’
:
:
,
.
;
,
:
!
.
从 上 面 的分析 我 们 已 经 对 亚 结构有 了 比 较 初 步的认识 下 面 再 讨论 一 下 另外两 种常 见 的 几 何 构 型 三角
7 l
.
:
安 徽 教 育学 院 学报 ( 自然科学版 )
双 锥 和 八面 体
1
,
l , 95
年第
z
期 (总第
6 2
期 )
。
三 角双 锥 的 亚结 构 是 一 条 线 ( 自上 而 下 ) 和一个赤道式 三 角形 根据亚结 构 对称与 否 我 们可 以很 容 易
e o
:
、
、
S/P
电子 对
,
;
H Zo
、
BF:
、
: e He 一 N i (e o )`
、
、
: Pe 一 IF :
、
、
s F.
等 ) 在 这 种构型 中 如果占据 各个顶点 的实体 呈 对称 形 式 显
. ,
,
,
见 是 非 极 性 分子
。
反 之 如 果 不对 称 则 是极性分子
, 、 、 、
,
.
为 了便 于 对称 性 的 分析 可 以把 分 子 结 构 划 分 成亚 结构 考察 它 们是 否具有 对 称中 心 ( 线 性 构 型 ) 或 多 个 不 重合 转 动 轴 ( 三 角形 四 面 体 三角 双 锥 八 面 体等 ) 如 果每 一 个亚 结 构 的构 造点被 相 同 的 拉 子 占 据 那 么 分
.
,
,
) 判断下面分 子 的极性 ( 见 图 3
2
.
八 面 体 的 亚 结构是三 条 穿 过 构 型 中 心 的 对 角线 如果 每条 对 角 线的两 端 都是 相同的构造 实 体 则 可判
, , .
,
.
定为非 极 性 分子 若其中任 意 一 条对角线有不同的端点 则为极性分子 分子 而 玲 则 为 极 性 分 子
( N ol : ) : e
2
C 是 非极 性 的 而顶 式一 P t 分 析 它 们 的 亚 结 构可 以 判 定 平 面 四 边 形 构 造 的 反 式一 P : ( N I I )l 2 (1) 一 是 极 性分子 e H e H e 一 贝} 是 极 性角 〔 见图 2( z) 〕 C 图 」 四 面体构 造 的 分子 是 非 极 性 的
2
若 为不 同 仲 系 子 所
,
— 占据
构 造 实体 呈 线 性 构 型 若 这 两 个 点均 为 同 种 原 子 所 占据 则 为 非 极 性
,
,
如
,
H一 l C
,
.
则为 极 性分子
造 这 种线性 结构亚 结 构 就 是 其本身 若 为 同
,
,
两 个 构造 实 体
O一 C~ O
考 虑 构 造 实体
, ,
由此可 以 判定
SF 。 Xe F .
、
均为非极性
:
.
(图 4 )
. .
1仅仅需 要 使学 生熟悉并掌握 这 几 种亚 结构 这样 在这 门课 程 在处理 如 刚 才所 示 的简单分子 构 型 时 我 介
