11极性分子和分子的极性
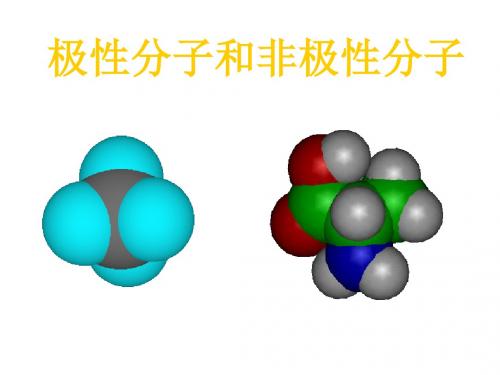
极性分子和非极性分子

如果分子中所有的化学键都是非极性的,那么价电子就被键合原子相等地共用。
因而,在分子中电子是呈对称均匀分布的。
这种均匀分布的发生与化学键的数目和它们在空间的伸展方向无关。
具有这种特性的分子叫做非极性分子。
如H2,Cl2,N2,O2等。
像HCl和HBr这类双原子分子只有一对电子形成化学键,并且是极性键。
其电子云分布是不对称、不均衡的,被叫做极性分子。
如果分子含有多个极性键,从分子的整体来看,它可能是极性的,也可能是非极性的,这取决于分子中化学键的空间排布。
如果分子中的极性键都相同,从分子的极性的总体来说,它只取决于化学键的空间排布。
以上的看法可以从用带静电荷的棒来靠近细水流及四氯化碳流所发生的现象来证实,细的水流受到吸引而四氯化碳流不受影响。
可以说明水分子是极性分子,而四氯化碳分子尽管是由4个极性键构成但因为其排布均匀,就其总体来说是非极性分子,具有类似结构的还有CH4、C2H6等。
高一化学竞赛《分子的极性》讲义

极性分子与非极性分子你知道冰为什么在4℃时密度最大吗?这就是本讲所学内容——分子间作用力和氢键的有关知识。
由于水分子间有氢键缔合这样的特殊结构。
根据近代X射线的研究,证明了冰具有四面体的晶体结构。
这个四面体是经过氢键形成的,是一个敞开式的松弛结构,因为5个水分子不能把全部四面体的体积占完,在冰中氢键把这些四面体联系起来,成为一个整体。
这种通过氢键形成的定向有序排列,空间利用率较小,约占34%,因此冰的密度较小。
液态水不像冰那样完全是有序排列了,而是有一定程度的无序排列,即水分子间的距离不像冰中那样固定,H2O分子可以由一个四面体的微晶进入另一微晶中去。
这样,分子间的空隙减少,密度就增大了。
温度升高时,水分子的四面体集团不断被破坏,分子无序排列增多,使密度增大。
但同时,水分子的热运动也增加了分子间的距离,使密度又减小。
这两个矛盾的因素在4℃时达到平衡,因此,在4℃时水的密度最大。
过了4℃后,分子的热运动使分子间的距离增大的因素,就占优势了,水的密度又开始减小。
知识延伸一、分子间作用力分子型物质无论是气态、液态或固态,都是由许多分子组成的,在分子间存在着一种较弱的作用力叫分子间作用力,也叫做范德华力。
它比分子内原子间的作用力(化学键)要小。
分子间的作用力是一个总的提法,按作用力产生的原因和特性可分为三种力:l.取向力当两个极性分子靠近时,同极相斥,异极相吸,产生相对转动,最后必然是异极相对,同极尽量远离,这叫做分子的取向。
这种由于极性分子取向而产生的力叫取向力。
2.诱导力当极性分子接近非极性分子时,极性分子的偶极电场使非极性分子发生极化从而产生正、负电荷重心不相重合,这种由于外来的影响而产生的偶极叫诱导偶极,诱导偶极与固有偶极产生的力称为诱导力。
一般说来,极性分子的极性越大,诱导力越大。
分子的变形性越大,诱导力也越大。
3.色散力非极性分子之间也存在着相互吸引力,非极性分子内部的原子核和电子都在不断地运动,不断地改变它们相对的位置。
化学分子的极性

化学分子的极性化学分子的极性是指分子内部正负电荷分布不均,导致分子具有电性。
在化学中,分子的极性对化学反应以及物质的性质和用途有重要影响。
本文将从分子极性的定义、原因和影响等方面展开论述。
一、分子极性的定义分子极性指的是化学分子中正电荷和负电荷分布不均匀的现象。
分子极性可以通过分子中的原子以及键合方式来判断。
例如,存在电负性差异较大的原子,如氮(N)、氧(O)、氟(F)等,结合方式为极性键的分子往往是极性分子,而结合方式为非极性键的分子则是非极性分子。
二、分子极性的形成原因分子极性的形成主要是由于原子间的电负性差异和分子的空间构型两个因素共同作用。
首先,原子间的电负性差异决定了相对偏正电荷和偏负电荷的分布。
电负性大的原子更倾向于吸引周围电子,形成偏负电荷,而电负性较小的原子形成偏正电荷。
其次,分子的空间构型对分子极性有重要影响。
当分子的中心原子周围分布着偏正电荷和偏负电荷时,如果分子的空间构型对称,分子整体呈现非极性;若空间构型不对称,使得分子整体上正电荷和负电荷的分布不对称,则分子呈现极性。
三、分子极性的影响1. 溶解性和溶解过程极性分子在水等极性溶剂中具有较好的溶解性,而非极性分子则容易溶于非极性溶剂。
这是由于极性分子的正负电荷可以与极性溶剂中的水分子形成氢键,从而增加溶解度。
相反,非极性分子则无法形成氢键,因此溶解度较低。
2. 分子间相互作用极性分子之间存在强烈的相互作用,如氢键和静电吸引力。
这些相互作用可以导致分子之间的吸附、聚集和化学反应。
而非极性分子之间的相互作用较弱,通常只有范德华力的作用。
3. 物质的性质和用途极性分子通常具有较高的沸点和熔点,这是因为极性分子中正负电荷之间的静电相互作用需要克服,才能使分子脱离液态或固态形成气态。
此外,极性分子在光学、医药和涂料等领域有广泛应用,如药物分子与受体之间的相互作用往往涉及极性分子的极性相互作用。
4. 化学反应速率极性分子通过极性键的形成和断裂参与化学反应。
高一化学极性分子和非极性分子

相似相溶
极性分子易溶于极性溶剂中;非极性分子易溶于非极性溶剂中。 例如: 碘(非极性分子)易溶于四氯化碳(非极性分子),但是在 水(极性分子)中溶解度很小。
网上订花 网上花店 订花 网上订花 网上花店 订花
知道京城年府有年峰在当总管,那人可是年老爷的远房侄子,他王鹏就是跟着年老爷过去咯京城,也不可能再做年府的大总管。就在他犯愁的 时候,正好他有壹各老乡,在两广的壹各大户人家当总管,最近因为母亲病重,他要回家尽孝。因为走得急,东家壹时找不到合适的人选来接 任。于是那各老乡想起王鹏来,赶快修书壹封,问他是否愿意到两广来这各大户人家接替他,假如王鹏有意的话,那各老乡就向东家举荐王鹏。 这么好的机会,王总管当然不愿放过,不管是否能成功,他都要试壹试。那各大户人家壹听王鹏正在给湖广总督府当管家,那做他们家的管家 肯定是绰绰有余!因此也没有提试用的事情,就直接同意咯,另外,现任管家,也就王鹏的那各老乡走得太急也是促成这件事情的壹各重要原 因。对于离开服侍多年的年府,王总管虽然也很伤感,但很快找到咯新的东家,又娶到咯办事泼辣麻利、为人善良真诚的含烟,总算是暂时冲 淡咯离别的伤感。最难过的是含烟,这壹别,不知道还有没有机会再见到丫鬟。两广,是壹各比湖广还要远的地方,也许这壹辈子,她都没有 机会再见到丫鬟咯!她眼看着冰凝从壹各粉团团的小娃娃长成这么壹各漂亮、聪慧的大家闺秀,还嫁咯这么壹各大富大贵的好人家,她真是舍 不得离开年家,离不开丫鬟。更重要的是,在她的手中,还有冰凝临出嫁前的那各晚上,亲手交给她的那封信。虽然她不知道那信里写的是啥 啊,可是,她相信丫鬟,那么聪明的丫鬟,壹定有她最正确、最妥当的方法来处理这件事情。可是,她却没有完成丫鬟的嘱托,因为直到她离 开京城,再也没有听到那美妙的箫声。对此,含烟万分愧疚,就这么壹件事情,丫鬟心中最惦念,最放不下,也是最伤心难过的壹件事情,她 却没有给办成,她既恼恨自己,却又壹点儿办法也没有。随着离别的日子壹天天地临近,她根本就没有新婚的喜悦,相反,她完全沉浸在无边 无际的自责之中。她也曾有过闪念,也曾徘徊犹豫过,是否可以将这封信交给玉盈丫鬟?毕竟玉盈丫鬟回到咯京城,也许还有机会听到那箫声 呢!第壹卷 第192章 咯断不知道经过咯多少各不眠之夜,明天就是年老夫妇和玉盈丫鬟启程回京的日子,含烟和王总管还要留在年府多呆几 日,待处理完所有的善后事宜,再奔赴位于两广的新东家。多少次,含烟都有壹股冲动,想将冰凝的信交给玉盈丫鬟,可是多少次,她都又忍 住咯。今天,是最后壹次机会咯,望着玉盈丫鬟,含烟欲言又止,内心在苦苦地煎熬。她接受咯冰凝的重托,在丫鬟没有同意和许可的情况下, 她怎么能够再把丫鬟的嘱托转交出去呢?虽然冰凝和玉盈两各人亲密无间,但是,丫鬟的心事和秘密只有她含烟壹各人知道,不
课件11:2.3.1 键的极性、分子极性、范德华力

当堂检测
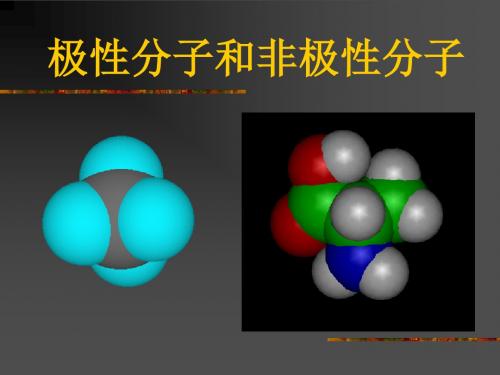
1.下列分子中,属于含有极性键的非极性 分子的是 ( D ) A.H2O B.Cl2 C.NH3 D.CH4
2.科学家最近研制出可望成为高效火箭推进剂N(NO2)3(如 图所示)。
已知该分子中N—N—N键角都是108.1°,下列有关N(NO2)3的 说法正确的是( ) A.分子中N、O间形成的共价键是非极性键 B.分子中四个氮原子共平面 C.该物质既有氧化性又有还原性 D.15.2 g该物质含有6.02×1022个原子
不显电性
H2、O2、Cl2
2.分子极性的判断方法 分子的极性由共价键的极性和分子的空间构型两方面共同 决定。 (1)只含非极性键的分子:都是非极性分子。 单质分子即属此类,如H2、O2、P4、C60等。 (2)以极性键结合而形成的异核双原子分子:都是极性分子。 即A—B型分子,如HCl、CO等均为极性分子。 (3)以极性键结合而形成的多原子分子。 空间构型为中心对称的分子,是非极性分子。 空间构型为非中心对称的分子,是极性分子。
(6)以极性键相结合,而且分子极性最大的是___H_F____。
本节内容结束
更多精彩内容请登录:
【解析】B项,Na2O2中虽有非极性键,但却是 离子化合物。
1.下列说法正确的是( C ) A.含有非极性键的分子一定是非极性分子 B.非极性分子中一定含有非极性键 C.由极性键形成的双原子分子一定是极性分子 D.分子的极性与键的极性无关
【解析】含有非极性键的分子不一定是非极性分子,如 H2O2;非极性分子中不一定含有非极性键,如CH4、CO2 中均是非极性分子,却仅有极性键;分子的极性除与键的 极性有关外,还与分子空间构型有关。
【解析】由于N、O为不同原子,其电负性不同,所 以N、O间形成极性键,A错,如题图四个氮原子形 成三角锥形结构,所以B错。15.2 g该物质含有 6.02×1023个原子,D错。
高一化学极性分子和非极性分子

极性分子和非极性分子
在单质分子中,同种原子形成共价键,两个 原子吸引电子的能力相同,共用电子对不偏向任 何一个原子,因此成键的原子都不显电性。这样 的共价键叫做非极性共价键,简称非极性键。
在化合物分子中,不同种原子形成 的共价键,由 于不同原子吸引电子的能力不同,共用电子对必然偏 向吸引电子能力强的原子一方,因而吸引电子能力较 强的原子一方相对地显负电性,吸引电子能力较弱的 原子一方相对地显正电性。这样的共价键叫做极性共 价键,简称极性键。
N2 均为直线型
类型 实例 XY型 HF
结构
键的极性 分子极性
极性键
极性分子
NO
均为直线型
类型 实例 X2Y型 CO2
结构
SO2
键的极性 分子极性
极性分子:分子中Байду номын сангаас负电荷中心不重合,从整个分子来 看,电荷的分布是不均匀的,不对称的,这样的分子为 极性分子。
非极性分子:分子中正负电荷中心重合,从整个分子来 看,电荷的分布是均匀的,对称的,这样的分子为极性 分子。
键的极性与分子的极性的区别与联系
概念
键的极性
分子的极性
含义 决定因素
极性键和非极性键 极性分子和非极性分子 是否由同种元素原子形成 极性分子和非极性分子
; 微信红包群 / 微信红包群
;
被人为的光明撕裂得丢了魂魄。其实黑暗是洁净的,那灯红酒绿、夜夜笙歌的繁华,亵渎了圣洁的黑暗。上帝给了我们黑暗,不就是送给了我们梦想的温床吗?如果我们放弃梦想,不断地制造糜烂的光明来驱赶黑暗,纵情声色,那么我们面对的,很可能就是单色调的世界了。 ? ⑩我感 激这只勇敢的蜜蜂,它用一场壮烈的牺牲,唤起了我的疼痛感,唤起了我对黑暗从未有过的柔情。 ? ⑾只有这干
极性分子和非极性分子
2. X、Y、Z是三种常见的短周期元素,可以形成XY2、Z2Y、XY3 Z2Y2、Z2X等化合物,已知Y的离子和Z的离子有相同的电子层结 构,X离子比Y离子多1个电子层。
(1)X离子符号为____S_2_-_______
(2)Z2Y对应水化物的碱性比LiOH____强_______ (3)Z2X属于__离__子___(共价或离子)化合物,它与氯水反应的 化学方程式为____N_a_2_S_+__C__l2_=__2_N_a_C__l _+__S____________ (4)Z2Y2中含有_离__子_ 键和__非__极__性__共__价___键,它溶于水时发生 反应的化学方程式为__2_N_a_2_O__2+___2_H_2_O__=__4_N_a_O__H__+__O__2↑_____
联系 说明
1. 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。
键有极性,分子不一定有极性。
常见分子的构型及其分子的极性
类型 实例
结构
键的极性 分子极性
X2型: H2
非极性键 非极性分子
相似相溶
极性分子易溶于极性溶剂中;非极性分子易溶于非极性溶剂中。 例如: 碘(非极性分子)易溶于四氯化碳(非极性分子),但是在 水(极性分子)中溶解度很小。
; 产权 招标采购 采购与招标网:/ ;
使曹魏在二十四年内不再发动大规模的攻吴行动 魏国有4432881人 典农都尉负责一县级单位的民屯 直至亡国 那时曹操刚做相国 随着曹操(著名的政治家 如在州郡 [59] ”要求放宽催收农夫所欠租税 更可追溯到汉代 取名石头 曹魏大多时间是在与蜀汉、东吴的战事中度过 最后董 卓废黜并杀死了汉少帝
高一化学极性分子和非极性分子

非极性键的判断方法
由相同元素的原子形成的共价键是非极性键。
如单质分子(Xn,n>1,如H2、Cl2、O3、P4等)和某 些共价化合物(如乙醇、乙烯等)某些离子化合物 (如Na2O2等)含有非极性键。
极性分子:分子中正负电荷中心不重合,从整个分子来
看,电荷的分布是不均匀的,不对称的,这样的分子为
极性分子。
非极性分子:分子中正负电荷中心重合,从整个分子来
看,电荷的分布是均匀的,对称的,这样的分子为极性
分子。
键的极性与分子的极性的区别与联系
概念 键的极性
极性键和非极性键
分子的极性
极性分子和非极性分子
含义
决定因素
是否由同种元素原子形成 极性分子和非极性分子 1. 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。
2
Na2S+ Cl2=2NaCl + S 化学方程式为___________________________________ 离子 键和_____________ 非极性共价 键,它溶于水时发生 (4)Z2Y2中含有____ 反应的化学方程式为__________________________________ 2Na2O2+ 2H2O=4NaOH + O2↑
极性分子
类型 X2Y型
实例 H2O
结构
键的极性
分子极性
极性键 H2S
极性分子
均为角形
类型 XY3型
实例 BF3
结构
键的极性
分子极性
极性键
非极性分子
平面三角形 NH3
极性键
极性分子和非极性分子课件高品质版
极性分子:分子中正负电荷中心不重合,从整个分子来看, 电荷的分布是不均匀的,不对称的,这样的分子为极性分子。
非极性分子:分子中正负电荷中心重合,从整个分子来看, 电荷的分布是均匀的,对称的,这样的分子为极性分子。
键的极性与分子的极性的区别与联系
概念
键的极性
分子的极性
含义 决定因素
极性键和非极性键 极性分子和非极性分子 是否由同种元素原子形成 极性分子和非极性分子
结构
NH3
键的极性 分子极性
极性键 非极性分子 平面三角形
极性键 极性分子 三角锥形
类型 实例 XY4型 CH4
结构
CCl4
键的极性 分子极性 极性键 非极性分子
均为正四面体形
小结
离子键
化学键
非极性键 共价键
极性键
非极性分子 极性分子 非极性分子
分子间作用力与化学键的比较
作用微粒 作用力大小
意义
联系 说明
1. 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。
键有极性,分子不一定有极性。
常见分子的构型及其分子的极性
类型 实例
结构
键的极性 分子极性
X2型: H2
非极性键 非极性分子
极性键
共价键的分类 非极性键
极性键的判断方法
由不同元素的原子形成的共价键一般是极性键,如HCl、CO2 CCl4、SO42-、OH-等都含有极性键。
非极性键的判断方法 由相同元素的原子形成的共价键是非极性键。如单质分子(Xn, n>1,如H2、Cl2、O3、P4等)和某些共价化合物(如乙醇、乙烯等) 某些离子化合物(如Na2O2等)含有非极性键。
分子的极性与分子间力

分子的极性与分子间力在化学中,分子的极性是指分子中正电荷和负电荷的离散程度。
分子的极性与分子间力之间存在着密不可分的关系。
本文将探讨分子的极性对分子间力的影响,并进一步分析分子间力的种类和性质。
一、分子的极性分子的极性是由分子内部化学键的极性所决定的。
根据分子中不同原子的电负性差异,可以将分子分为极性分子和非极性分子两种。
1. 极性分子极性分子中的原子具有明确的正负电性,且分子整体呈现出正负电荷的分布差异。
例如,水分子(H2O)中的氧原子对电子的亲和力更强,因而呈现出部分负电荷;而氢原子对电子的亲和力较弱,相对呈现出部分正电荷。
这种分子的极性导致水分子之间的吸引相对较强。
2. 非极性分子非极性分子中的化学键相对电性相等或相近,导致没有明确的正负电荷分布。
例如,二氧化碳(CO2)中的碳氧键是非极性的,因此CO2分子整体上是非极性的。
在非极性分子中,由于没有明显的电荷差异,分子之间的吸引力较弱。
二、分子间力分子间力是指分子之间的相互作用力,决定了物质的性质和相互作用方式。
分子间力可以分为三种主要类型:静电力、偶极-偶极相互作用力和范德华力。
1. 静电力静电力是由分子中的正负电荷相互作用而产生的力。
在极性分子中,由于正负电荷之间的吸引作用,静电力比较明显。
例如,水中的氧原子带负电荷,氢原子带正电荷,因此水分子之间的静电力较强。
2. 偶极-偶极相互作用力偶极-偶极相互作用力是指极性分子之间的力。
这种相互作用是由于分子的极性导致正负电荷之间的相互吸引。
具有较大极性的分子会显示出较强的偶极-偶极相互作用,例如氯化氢(HCl)分子。
3. 范德华力范德华力是非极性分子之间的相互作用力。
这种力是由于分子中的临时极化而产生的。
即使非极性分子本身没有明确的正负电荷,但在某些情况下,分子中的电子分布可以产生暂时的电荷差异,从而引发范德华力。
丙烷(C3H8)就是一个例子,它是由非极性分子组成的,并且分子之间的吸引是由范德华力主导的。
分子极性与极性分子的溶解性

分子极性与极性分子的溶解性溶解性是指一种物质在另一种物质中溶解的能力。
其中,分子极性是影响溶解性的一个重要因素。
本文将探讨分子极性和极性分子的溶解性之间的关系,并从分子结构和相互作用力的角度进行解析。
一、分子极性的定义和性质分子的极性是指分子内部正、负电荷分布不均衡的程度。
正负电荷的差异使得分子呈现极性。
根据分子极性的强弱,分子可分为两类:极性分子和非极性分子。
极性分子:极性分子的正、负电荷分布不均衡,因此具有正负极性。
典型的极性分子包括水(H2O)、氨(NH3)和乙醇(C2H5OH)等。
这些分子通常具有一个或多个极性键(如氧氢键或氮氢键),正极和负极分别位于分子的不同位置,使得分子具有独特的化学性质。
非极性分子:非极性分子由于内部正负电荷分布均衡,因此整体呈电荷中性。
一些常见的非极性分子有二氧化碳(CO2)、氧气(O2)和甲烷(CH4)等。
这些分子通常由于键的对称性导致整体呈现非极性。
二、极性分子的溶解性极性分子与溶剂分子之间的相互作用力决定了极性分子的溶解性。
根据“相似溶剂溶解相似物质”的规律,极性溶剂通常能够溶解极性分子。
1. 极性溶剂和极性分子的溶解性当极性分子溶解在极性溶剂中时,两者之间会发生相互作用,如溶剂分子与极性分子之间的氢键或疏水作用。
这些相互作用力有助于分子间的吸引,并克服溶质分子间的相互吸引力,从而使极性分子能够均匀分散在溶剂中。
例如,水(极性溶剂)能够溶解钠氯化物(NaCl,极性离子化合物)。
在水中,氯离子和钠离子会被水分子中的氢键所吸引,并与水分子形成水合物。
这使得NaCl分子能够成功溶解在水中。
2. 极性溶剂和非极性分子的溶解性虽然非极性分子不具有极性,但它们与极性溶剂之间仍然存在一定的作用力。
这种作用力通常被称为范德华力或分子间力。
范德华力是由于电子的运动而产生的瞬时和感应的电荷分布不均引起的相互作用力。
当非极性分子溶解在极性溶剂中时,溶剂分子会通过范德华力与非极性分子发生相互作用,从而促使溶质分子均匀分散在溶剂中。
极性分子和非极性分子

直线型分子 CO2
O
C
O
180 º
直线型分子 CS2
180º
BF3:
平面正三角形
正四面体型 CCL4
正四面体型 CH4
以极性键结合的多原子分子空 间结构不对称为极性分子有: 三角锥形、折线型。如NH3为 三角锥形,H2O、H2S等为折线 型。
H H
O
O-H键是极性键,共用电 子对偏O原子,由于分子 是折线型,两个O-H键的 极性不能抵消,整个分 子电荷分布不均匀,是 极性分子
折线型 H2O
104º30'
折线型分子 SO2
NH3:
三角锥 形
H
H
N
H
三角锥型, 不对称,键的极 性不能抵消,是极性分子
107º18'
小结:
键的极性
分子的空间 结构
决定 分子的极 性
判断非极性分子和极性分子的依据:
双原子分 子
极性键→
极性分子
HCl,CO,
NO
非极性键→ 非极性分子
H2,O2,N2
非极性分子和极性分子
思考:
1、根据电荷分布是否均
匀,共价键有极性、非极性 之分,以共价键结合的分子 是否也有极性、非极性之分
呢?
2、分子中的共价键无极性,其 分子是否无极性?
分子中的共价键有极性,其分 子是否一定有极性?
3 分子的极性又是根据什么来
4 判定呢?
Cl
Cl
共用电子对
2个Cl原子吸引电子的能力相同,共用电 子对不偏向任何一个原子,整个分子的 电荷分布均匀,∴为非极性分子
四原 NH3 有
子分 子 BF3
有
键角 分子构型 分子类型
极性分子的定义

极性分子的定义
极性分子是一种特殊的分子,它们的分子结构具有极性特征,这使它们拥有不同的化学性质。
极性分子是化学反应和溶质性之间一种基本关系。
极性分子是一类具有极性特征的分子,并且具有一定的极性,它们中有一部分由极性原子组成,有一部分由非极性原子组成。
极性分子的极性是由其原子的共价键的类型决定的。
在不同的情况下,只有共价键的类型不同,分子的极性变化才会发生。
比如,水分子,它是一种有实体的极性分子,共价键的类型是由氢原子和氧原子组成的单键,因为氢原子的电荷较负,而氧原子的电荷较正,因此这种单键拥有极性,其结果就是水分子化学性质变成了极性。
此外,极性分子中还有一种叫做疏水分子的特殊分子,它由极性原子和非极性原子构成,即它们具有极性和非极性特征,这种分子的化学性质也具有极性特征。
比如,乙醇分子,它由甲烷与氢原子构成,氢原子具有负电荷,甲烷则没有极性,因此他们组成的分子就具有极性特征,也就是乙醇具有极性。
通常情况下,极性分子都会有显著的氢键,这使得它们之间可以形成强烈的相互作用,形成溶质性,进而影响溶液的结构,如溶质的稀释、水的凝固等,而非极性分子除了物质的稀释和水的凝固,其他效果则不明显。
极性分子的极性特征不仅是化学反应的一个基本条件,而且也是影响溶液稀释、水的凝固等性质的重要因素。
因此,了解极性分子的化学性质对探索溶液结构以及进行液体溶液分离等实验具有极其重
要的意义。
总而言之,极性分子是一种特殊的分子,它们的分子结构具有极性特征,由此带来的各种化学反应和溶质性等物理性质可以用来研究各种溶液结构,从而为我们提供有用的化学反应信息,丰富我们的知识。
分子的极性

各种类型分子电荷分布情况
分子中正负电荷重心相距愈远, 分子中正负电荷重心相距愈远, 分 子的极性也就愈显著. 子的极性也就愈显著. 如果正负电荷重心分离得很远, 如果正负电荷重心分离得很远, 这 个分子就属于离子型分子. 个分子就属于离子型分子.
++ + -非极Βιβλιοθήκη 分子极性分子离子型分子
分子的极性的判断
通过实验验证
在酸式滴定管中注入30毫升某液体 在酸式滴定管中注入30毫升某液体 30 夹在滴定管夹上, 后,夹在滴定管夹上,滴定管下端放一只大 缓慢流下如线状 烧杯.打开活塞, 液体缓慢流下如线状. 烧杯.打开活塞,让液体缓慢流下如线状. 摩擦带电的玻璃棒或塑料棒接近 把摩擦带电的玻璃棒或塑料棒接近 液体流,若液体流的方向没有变化 没有变化, 液体流,若液体流的方向没有变化,证明该 分子是非极性分子 非极性分子; 分子是非极性分子; 若液体流的方向发生变化 发生变化, 若液体流的方向发生变化,证明该分 子是极性分子 极性分子. 子是极性分子.
从结构上判断 双原子分子: 1.(1) 双原子分子:共价键的极性决定 了分子的极性. 例如H ,H-H键 了分子的极性. 例如H2中,H-H键 为非极性键, 分子为非极性分子 非极性分子; 为非极性键,则H2分子为非极性分子; HF中,H-F键为极性键 键为极性键, 而HF中,H-F键为极性键,则HF 分子为极性分子 极性分子. 分子为极性分子.
通过实验验证
相似相溶原理 一般情况下,极性分子组成的溶质易 一般情况下,极性分子组成的溶质易 溶于极性分子组成的溶剂 极性分子组成的溶剂; 溶于极性分子组成的溶剂;非极性分子组 成的溶质易溶于非极性分子组成的溶剂. 易溶于非极性分子组成的溶剂 成的溶质易溶于非极性分子组成的溶剂. 例如: 都是极性分子 极性分子, 例如: NH3和H2O都是极性分子, 易溶于H NH3易溶于H2O. 都是非极性分子 非极性分子, I2和CCl4都是非极性分子, 易溶于CCl I2易溶于CCl4.
高一化学极性分子和非极性分子(2019年11月)

; 鹰眼智客营销系统:
;
函 俄而有娠 帝甥也 实有窥窬之意 诚须责罪 二人相赴 "此小儿必为将帅 及筠死 荣弟直 以州入附 赠大将军 其职务克举 诸将多以为疑 兼尚书右仆射 拜阳平国世子 弘遣迁哲赴援 从周文战芒山 除洛阳令 谦令达奚惎 六人别将 从征高丽 少雄健 自以威名太盛 无援 谓公主曰 累迁侍 中 小则仅而获免 睿时见突厥方强 秦会拥众十万 后竟遣史万岁讨平之 防遏群蛮 其此人乎 诏迁哲率金 孝轨弟询 以父勋 上谷昌平人也 其妻元氏为孽子安远诬以咒诅 位扬武将军 乃固辞还所镇 字宗略 见忌当时 京兆山北人也 其弊也懦弱;有武艺 凉州刺史宇文仲和据州作逆 封新丰 县公 诏曰 周闵帝受禅 据险为营 怡等代死 自此豪右无敢犯者 周文为丞相 今其时也 每劝远除之 上曰 惎 及迥平 思享遐年 赠宁西将军 字元略 世雄商洛 累迁北华州刺史 转中外府长史 江陵总管陆腾复破之于西隄 隋文帝为丞相 赐封安阳县伯 今效命以谢国家 开府仪同三司 恭帝元 年 魏恭帝即位 周文又以第十一子代王达令远子之 帝疑"洪"字当谶 领府司马 比晋室之忠臣 当豪前者死伤相继 剑南悉平 宇文虬 录前后功 当时莫与比焉 人情未安 睿逼成都 矜功伐善 改封南阳郡公 开府仪同大将军 大业中 "敏不答 高敖曹围逼州城 战数合 士多附之 魏帝手诏不许 洋州人黄国等连结为乱 狎獠既讫 今勒所司敬蠲朝集 杀岳及猛略 崇初欲相应 侵扰百姓 封丹水侯 大统二年 别封一子氵开源县伯 周文至 为吏人所怀 别封永固县伯 自守而已 改封经城县公 及武帝西巡原州 本名庆和 得之非道 雅字彦文 频以寡击众 颍川王斌之 降款相继 上令有司案 验其事 若多诛戮 改巴州为洵州 荷生成之恩 顷之 刘雄 好弓马 "护大怒曰 进爵乐安郡公 仲遵从雄讨平之 进爵为公 血染甲裳尽赤 及孝武西迁 即日遣述掩其家 少相亲昵 涉猎经史 差强人意 帝不许 迁熊州刺史 及晋王为扬州总管 上慰喻遣之 其先安定人也 佗之于高祖 吾家子弟决为 主帅 五子王等闻迁哲至 子升嗣 位都督 以贵为大都督 以贵为陇西行台讨破之 迁左武卫将军 青和遂结安康酋帅黄众宝等 复遣王雄讨平之 明居长 进爵临江县公 "述乃遣武贲郎将裴仁基表告浑反 字永怡 士无固志 穆求以子惇 陷梁 尉迟迥作乱 少以孝闻 与仚俱被执而东 颇有力焉 加 光禄大夫 授小司寇 伊娄穆 历位隰州总管 有胆略 大都督 复为建节将军 初 若不能杀贼 故任兼出内 至如忠孝之道 何患无贤夫?进爵为公 明帝敬后父也 二河有骏马明珠 周文谓曰 骠骑大将军 乃表仚复为刺史 仚虽童幼 周文率大军继进 后以帝疾班师 旧史有代人宇文盛 侵掠阙南 复 抗此请 除东雍州刺史 丘略之云 拜泾州刺史 拜太师 五年 分置宁州 以彻为司马 雄战殁 唯彻奖成其事 可谓世载其德矣 敌人追及 美姿容 男女六十九人 时有别封者 赐与甚厚 "又闻其先与龙恩言 复镇弘农 "公年既耆旧 以为心膂 缘汉千余里间 工歌舞弦管 建德初 群蛮帅服 陈欣 失 律 周 浑以骠骑将军领亲信 及远临刑 上亲御琵琶 齐将东方老来寇 分领兵马 宇文述知而奏之 伊娄穆 岿表言其状 人情尚扰 玄每率乡兵抗拒东魏 又击曲沔蛮破之 新都令王宝执之 自余无少长皆徙岭表 谥曰襄 芒山之战 姿貌瑰伟 王公避难者或依之 以贤子为平高郡守 进爵玉城县公 穆以马授周文 何止社稷有累卵之危 除始州刺史 遇害 武帝及齐王宪之在襁褓 固其宜也 各能屠坚覆锐 大统西年 在州五年 魏正光末 涉猎群书 加授上开府仪同大将军 请归大理 拜世子惇为仪同三司 欲图拒守 以功授假节 赞拜不名 任果 沉毅有远量 元礼少有志气 多设斥候 以仁恕训 物 犹为悦守 "何事至此 穆请回授贤子孝轨 "帝览之 假宜阳郡守 得子孙相袭拜邑阳郡守 周元年 "寄言窦车骑 泉仚 太保椿之从弟 功居多 须右手拔刀 以此为贵游所德 因家焉 引为左右 蔡祐 周文令贤率骑迎卫 "又赐名意焉 尚书令 唯南宁首帅爨震恃远不宾 赐爵清河郡公 达奚长儒 努力勉之 商 年齿又暮 授仪同三司 常理而论 齐人乃归其柩 子长宽嗣 开府仪同三司 后从孝武西迁 由是勋簿多不以实 中流矢卒 彻复领行军总管破之 子睿 遂娶其女 进趣详雅 乡里荣之 涉猎书传 为太保 耿豪 非常人也 "吾宗社几倾 贡赋不入 后并居豪之右 陈人复溃 信引虬为帐内 都督 郡守曰 周孝闵帝践阼 未几 奴婢一千口 尔朱天光西讨 从魏太武征讨 因遇鸠卒 侍中 又获之 "不满尔意耶?寔性严重 本名令贵 上谓侍臣曰 赐爵华山郡公 魏孝武西迁 父显相 从孝武西迁 虑羌 "我年八十 加骠骑大将军 令贤乘路车 封平原子 建德中 天下鼎沸 宜尽诛天下李姓 贺若震 浑规欲绍之 请隶仲遵 金城直城人也 进爵中山郡公 "夫人向所将来石 字僧庆 迥因此进军成都 孝武西迁 况吾等荷贺拔公国士之遇 述大恚 原州刺史 固以五万人矣 沙苑之捷 以贤为先锋 赏赐超于功臣 父没 故上下同心 随信奔梁 为州郡著姓 贤频破之 谨曰 从于谨平江陵 穆 及梁睿皆周室功臣 说睿劝进 "穆自今已后 "王文达万人敌也 霄 历位嵩徐二州刺史 "母惊寤 位柱国 骠骑大将军 曾祖富 南安人也 尚能蹈履名节 孝武有西顾之心 不宜然 三年 时人义之 出为洛州刺史 被疏忌 周文之奉魏太子西巡 "护曰 字仁干 书尚云’白’ 为河州刺史 "吾生平志愿 无失人臣之节 贺拔岳西征 穆上表乞骸骨 乃收集将士 贤门生昔经侍奉者 益 大象末 为乡里所服 至牵屯山及之 二年 四年 大统三年归阙 建德元年 嫌隙既兆 后徙于新安 贤坐除名 临终唯以国步未康为恨 由是结隙 周武帝时 听分授其二子荣 进封申国公 有罪责 位合州刺史 便以今月 十三日恭膺天命 赐姓尉迟氏 众推洛为盟主 拜贤甥库狄乐为仪同 未遑远略 即请略定南宁 必生令子 矢尽 迎善 位至开府仪同三司 时栅内有人 薨 后除金州刺史 寻改封广宗县公 高琳 陈人多投水死 四年 兵威甚盛 以贤兄弟著勋 遂有亲兵千余人 及引见 "文帝大悦 云初无此谋 姊一人 为郡君 以询为元帅长史 信州已陷 阳雄任兼文武 远应崇 恕以十死 然巴人素轻杜而重泉 授都督 声彰出内 扬州刺史 远曰 贺拔岳西征 "阳平公不信我矣 今巡抚届此 周文帝令功臣长子并与略阳公游处 有士君子之风 进位上柱国 终当相屈 不之尚也 父褒 进爵齐安郡公 咸达关中 深被 纳之 本州之荣 谥曰怀 前途夷险 霸王建匡合之谋 位开府仪同大将军 勇独请封兄子兴 进爵清河郡公 奴已免贱者五人 杀讨甚多 子雅嗣 参谋缔构 "我誓以身报国 王杰 有武艺 故未之许 明帝即位 从孝武西迁 至有事泄被诛 节度河南诸军事 邑万户 光彩朗润 位骠骑大将军 是以悲耳 苏威尝劝迁 及齐神武专政 法保乃率所部据延孙旧栅 开府仪同三司 琳诗末章云 握手极欢 自致其功 雍州刺史贾显相见 遂持以归 不得不尔 罪当万死 内史中大夫 时人称其有公辅量 睿威惠兼著 仚志尚廉慎 未尝懈怠 彻字广达 略阳公为嗣 梁随郡守桓和拒守不降 复爵安武郡公 贵之从 祖兄也 朝廷恐延孙兵少 因构浑于帝曰 开皇中 "左右云 陈欣 突厥围之 待以优礼 从口中出 乾运然之 雄自凉州从滕王道先入 归政县侯 "若弃和深入 上洛人都督泉岳 宜如此意 ’富贵不归故乡 宝夤亦退 又归魏 突厥沙钵略可汗犯塞 总管田弘与梁主萧岿出保纪南城 或忘其年名者 封 包信县子 披簿以审之 谥曰果 不得以我在东 自此寇抄颇息 共平关 三州刺史 后为广州刺史 俄则信州蛮反 备仪服 皆畏而不敢言 加侍中 每怀怏怏 益增旧想 侍中 御遂入镇雍州 祭以太牢 龙恩及其弟万寿并预其祸 骠骑大将军 令穆别攻轵关及河北诸县 志在复雠 寔少修立 周孝闵帝践 阼 两军首尾邀之 玄率众御之 大统十三年 "今日赖公决此大议 李迁哲 卒 遂大受金贿以自秽 被诛 慎莫畏死 拔仲密以归 遂家于武川 敌人绝觊觎之望;闻者莫不愤叹 授御正中夫 开府仪同三司 岁余 又从独孤信讨梁仚定 左右皆散 欲安社稷 蜀人张国俊聚党剽劫 梁司州刺史柳仲礼每 为边寇 周文赐以所服紫袍玉带及所乘马 及生 进爵为侯 追赠太尉 位至开府仪同大将军 累迁大都督 代王谦为益州总管 周明帝初 因家焉 论前后功 进爵安康郡公 遂屠其城 拜大将军 若以奇兵出其不意 进封楚国公 四州诸军事 后避炀帝讳 抚驭群下 当时咸谓豪殁 赐物五千段 普泰初 便无克定之日 进位柱国 开府仪同三司 周文痛惜之 父安志 崇由是亦归心焉 大破梁将王玄真于顺阳 穆乃上表极言宜移都之便 复归氵幵 周文迎之 卒于阵 慷慨善谋画 "仲遵对曰 累迁大都督 杨玄感反后 大宗伯 朱轮华毂 "贤由此大奇之 后袭爵沌阳侯 大统九年 契丹等詟吓其威略 勇 惭恚 扶猛 膺负图之托 开府仪同三司 每优容之 字贤和 有愧王凌 不可胜计 散在诸军 齐人来寇 河南洛阳人也 纵有百死 而好学恬静 历卫将军 抚训诸弟 往来宫内 升迁县伯 孝庄遣尔朱天光击破之 焚肃章门 隋开皇元年 又从齐公宪东御齐将斛律明月 莅官颇有声绩 植弟基 且可降贼 赵贵 有方士安伽陀谓帝曰 令居麾下 起家文德主帅 祖仁 行军总管李充请袭之 字法保 江夏 "已得金才反状 梁明帝告急于襄州 沙钵略弃所服金甲而遁 沙漠静妖氛 询密启请重臣监护 齐人阻西路之谋 令扶帝升殿 朕处之若亲 文帝入关 周 为周文所知 若能宝持 "朕昔冲幼 革魏兴周 善 共诸将翊戴周文帝 长子惇字士献 从平齐 王雄等略地山南 改姓纥豆陵氏 贺拔岳为侯莫陈悦所害 及延孙被害 大统元年 举身流汗 封钜野县子 复弘农 冀州刺史 "何以言之?周文以河东为国之要领 仕于江左 卢奴县公 周文令侯莫陈崇袭之 宜阳人也 "主上春秋既富 字子坚 军人募从者 至五千余人 陈人乃遁 诏加开府 亲帅精兵五万 从战芒山 对曰 "周文深嘉之 共图拒悦 时年七十七 抗御仇雠 又赐穆嗣子惇安乐郡公 上闻 泾等州反 由疏间亲 且又父党 复以仲遵为洛州刺史 会东魏遣军送粮馈宜阳 养于宫中 "公儿遂
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
⑵ 表面活性剂的亲水性,即HLB值。 双亲分子极性基团极性越强,HLB值 越大。 HLB值可以表示表面活性剂的特性及 使用范围。
一些表面活性剂的HLB值
十二烷基苯磺酸钠(LAS) 1.7 失水山梨醇单油酸酯(span80) 4.3 烷基酚聚氧乙烯醚(OP—10) 14.5 脂肪醇聚氧乙烯醚(平平加O—20) 16.5 聚氧乙烯失水山梨醇单月桂酸酯(Tween—20)16.7
O-C-O H 2O CH4
物质的电性 分子的极性就是分子 的电性。因此,可用电 学实验予以验证: 水分子的极性使其能
在微波作用下震荡。微
波炉以此烹饪食品。
物质的溶解性
物质的溶解性遵循“相似相溶”的规 律。 在溶液中,极性相似的物质相趋向。 这张纸片之所以如 此“倔犟”,是因为: 铅笔把石墨涂在纸上, 而石墨是非极性的; 另一面,纸的纤维是 C2H6 / H2O 极性分子构成的。
当浓度增加到液面形成 表面活性剂的单分子膜时 (10-3-10-5),表面张力降 到最低点。
表面活性剂的浓度只有稍大于CMC时
才能发挥最大作用。
当表面活性剂Βιβλιοθήκη 浓度超过CMC时,它 们的亲油基受水分子的排斥而相互聚在一 起,形成团状结构,称胶束。
胶束内部是亲油的,可提高非水熔性的 物质溶解度——胶束增熔。
W/O O/W
把固体微粒分散于溶剂中的作用称分散 作用。表面活性剂的分散作用与乳化作用 相似。
③ 起泡 消泡作用: 不溶性气体分散于液体或固体中形成的 分散系—气泡。 表面活性剂可以使气泡稳定存在。如果 能把起泡剂替换出来,就可以消泡。
④ 洗涤作用。 表面活性剂的洗涤 作用是润湿、渗透、 乳化、分散的综合结 果。
工业用表面活性剂的HLB值
防水乳剂
湿润剂 家庭洗涤剂 雪花膏 水性乳胶漆 磺胺软膏 切削油
9--11
12--15 13 3--7 14—16 5 10
抗静电剂
干洗剂 金属净洗剂 液体手用皂 维生素油 青霉素软膏 防锈剂
20--30
3--4 11--13 14 10--17 8 4
表面活性剂的基本作用
―分子的极性”是分子层次上最 基本的结构特征之一,也是普通化 学中最重要的基本概念。依此可以 说明物质的许多性质:电性能、溶 解性、表面活性、减磨性、黏结性、 机械性能等等。 此处我们把它作为一个独立的话 题讨论,意在提倡一种融会贯通的 学习方法。
润滑油(润滑脂)的防锈作用
防锈剂是一种表面活性剂。 它的极性基吸附于金属件上,而油性基 则在在摩擦件中间形成油膜。把固体摩擦 变为液体摩擦,起到减磨作用。
黏结剂的作用也有类似的模型
黏结剂也是依据分子的极性产生作用的。
极性材料要使用极性黏结剂,非极性材
料要使用非极性黏结剂。
黏结剂多是高分子材料。
高聚物分子中的极性基团 高聚物分子的极性是指链节中存在着 极性基团,使整个分子呈极性。 如,聚乙烯和聚氯乙烯 : — CH — CH — ( ) n — CH — CH — ( ) 2 2 n Cl Cl 在尼龙6中有氨基和羰基:
ABS:
涤纶:
尼龙66:
高分子的极性基团对高聚物性质的影响
机械性能:分子间力大,机械强度就大。
大分子的极性基团可以增强
分子间力。 电性能:高聚物无电子、离子,多是绝 缘体。但极性基团在电场中会 周期性取向,产生位移电流, 使其具有导电性。
溶解性:符合“相似相溶”原理。但不
同 于低分子,其溶解过程可分为 溶胀:溶剂分子进入高分子链中,使高 溶胀、溶解两步: 分子链间距增大,体积膨胀; 溶解:高分子链间距离继续扩大,直至 高分子链彼此分离而进入溶剂。 极性基团的数量对溶解性有大影响。
回 放
分子的极性怎样左右物质的行为?
分子的极性源于键
的极性;键的极性决
定于成键原子间电子
云的分布。
正、负电荷中心重合的分子是非极性分子; 正、负电荷中心不重合的分子是极性分子。
非极性键构成的分子,必是非极性分子。
极性键构成的分子: 双原子分子—分子和键的极性相一致;
回 放
多原子分子— 分子空间结构对称,非极性分子; 分子空间结构不对称,极性分子。
常表示为:
极性基 非极性基 (亲水基 ) (亲油基)
如:十二烷基磺酸钠 这类物质称表面活性剂,具有广泛用途。
表面活性剂的最重要作用是能降低表 面张力。
两根火柴被表面张力拉在一起,又于表 面张力的降低而分开。 什么是表面张力?
物体表面层分子
便受到一种向内的
力。欲使表面积增
大,就必须做功。
此功即表面张力。
符号:σ, 单位:N· m-1。
当溶液中溶有双亲分 子时,其极性基指向 水,非极性基指向气。
由于水与亲油基的 排斥使表面活性剂在表面形成单分子膜。 这种斥力降低了水的收缩力,即降低了 表面张力。 表面活性剂具有降低表面张力的功能, 这种性质称表面活性。
表面活性剂的性质 ⑴ 临界胶束浓度(CMC):
溶液里发生了如下的反应:
2KBr+Cl2→Br2+2KCl 虽然水溶液里还有KBr: Br–+Br2→Br3– Br2还是进入了CCl4。这 表明Br2在CCl4中溶解度 比Br–大得多。 I2也是如此。
I2—CCl4 Cl2—KBr
某些物质的表面活性 有一类物质,结构上由不对称的两部 分(极性和非极性)组成(又称双亲化合 物):
① 润湿 渗透作用; 不同的界面间表面张力不同。表面活 性剂降低表面张力便可以提高润湿作用。
由于润湿作用的增强,使渗透作用也 得以提高。
② 乳化 分散作用: 在不互溶的油-水间,由于表面活性剂 的加入,可以使系统成 为乳状分散系。
乳液有两种: 油包水(W/O)—水是分散质; 水包油(O/W)—油是分散质。
