中考化学九年级复习课件【第6课时】《溶质的质量分数及计算》ppt课件
合集下载
溶质质量分数的计算培训课件(PPT共 32张)

激励学生学习的名言格言 220、每一个成功者都有一个开始。勇于开始,才能找到成功的路。 221、世界会向那些有目标和远见的人让路(冯两努——香港著名推销商) 222、绊脚石乃是进身之阶。 223、销售世界上第一号的产品——不是汽车,而是自己。在你成功地把自己推销给别人之前,你必须百分之百的把自己推销给自己。 224、即使爬到最高的山上,一次也只能脚踏实地地迈一步。 225、积极思考造成积极人生,消极思考造成消极人生。 226、人之所以有一张嘴,而有两只耳朵,原因是听的要比说的多一倍。 227、别想一下造出大海,必须先由小河川开始。 228、有事者,事竟成;破釜沉舟,百二秦关终归楚;苦心人,天不负;卧薪尝胆,三千越甲可吞吴。 229、以诚感人者,人亦诚而应。 230、积极的人在每一次忧患中都看到一个机会,而消极的人则在每个机会都看到某种忧患。 231、出门走好路,出口说好话,出手做好事。 232、旁观者的姓名永远爬不到比赛的计分板上。 233、怠惰是贫穷的制造厂。 234、莫找借口失败,只找理由成功。(不为失败找理由,要为成功找方法) 235、如果我们想要更多的玫瑰花,就必须种植更多的玫瑰树。 236、伟人之所以伟大,是因为他与别人共处逆境时,别人失去了信心,他却下决心实现自己的目标。 237、世上没有绝望的处境,只有对处境绝望的人。 238、回避现实的人,未来将更不理想。 239、当你感到悲哀痛苦时,最好是去学些什么东西。学习会使你永远立于不败之地。 240、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴们都睡着的时候,一步步艰辛地向上爬 241、世界上那些最容易的事情中,拖延时间最不费力。 242、坚韧是成功的一大要素,只要在门上敲得够久、够大声,终会把人唤醒的。 243、人之所以能,是相信能。 244、没有口水与汗水,就没有成功的泪水。 245、一个有信念者所开发出的力量,大于99个只有兴趣者。 246、环境不会改变,解决之道在于改变自己。 247、两粒种子,一片森林。 248、每一发奋努力的背后,必有加倍的赏赐。 249、如果你希望成功,以恒心为良友,以经验为参谋,以小心为兄弟,以希望为哨兵。 250、大多数人想要改造这个世界,但却罕有人想改造自己。
初中化学人教九年级下册第九单元 溶液 中考复习——溶质质量分数PPT

积为
m45L(水的密度约为1g/mL)。
5g,所需蒸馏水的体
(2)称量:分别在天平左右两盘放上纸片,调节平衡后,应 (A 填标号)。
A.先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡。
B.先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡。
【探究一】:在称量过程中,某同学的称量操作如图所示,你认为该操作对本次实验的数据处理
图所示:
(1)100g稀盐酸中氯化氢的质量 ;
(2)完全反应后,所得溶液中溶质的质量分数?
解析:(1)稀盐酸中氯化氢的质量为 100g 7.3% 7.3g
2)设反应中的碳酸钠、氯化钠、二氧化碳的质量分别为x、y、z,
Na2CO3 + 2HCl= 2NaCl+ CO2 ↑+H2O
106
73
117
溶质的质量
× 100%
溶质的质量 + 溶剂的质量
3、两个重要的变式公式
︱
考点2 饱和溶液中溶质质量分数的计算
在饱和溶液中,溶质质量分数=
注意:
1、S表示对应温度下该溶质的溶解度,只要温度确 定,饱和溶液中溶质质量分数为定值,也就是说同温 度下的饱和溶液,溶质质量分数都相等。
2、饱和溶液中,溶质的质量分数达到该条件下 最大值。
;
d.称量时左码右物(用了游码)
e.烧杯中原来有水
︱ 考点5 化学方程式与溶质质量分数的综合计算
化学方程式表示的是纯净物之间的质量关系 ,而溶液是混合物,参加化学反应的是溶液中 的溶质,所以应求出参加反应的溶质的质量代 入化学方程式计算,或求出生成物溶质质量进 行计算。
考点1 关于溶质质量分数的计算
__溶__质____质量,实验中往往要将溶剂的质量转变为体积量取。
沪教版初中化学九下 6.2 溶质的质量分数 课件PPT

方法 一、固体的溶解
实验步骤
实验仪器
1、计算 氯化钠固体 1克 水 19mL 2、称量(量取)
3、溶解
4、装瓶
5、贴标签
要求:①烧杯中氯化钠固体已称量好,请记录称量用到的实验仪器
②小组合作,记录每一步对应的实验仪器 ③注意时间控制
请你动手
小红在实验室要用到20克5%的氯化钠 溶液,你能帮助她配制吗?
如何配制溶液
小红在实验室要用到20克5%的氯化钠 溶液,你能帮助她配制吗?
问题二: 比例的确定??
方法一:用氯化钠固体和水
20g-1g=19g
氯化钠固体20gX5%克=1g水19g÷ (1mgL/mL)=19mL
m - m m 溶质= 溶液 × C% m 水 = m溶液
溶质
方法二:用10%氯化钠浓溶液和水
- m m 水 = m稀溶液
浓溶液
如何配制溶液
小红在实验室要用到20克5%的氯化钠溶液,你能 用10%的氯化钠溶液帮助她配制吗?已知常温下 5%的氯化钠溶液密度为1.043g/cm3
方法二:用10%氯化钠浓溶液和水
20g*5%=10%*X X=10g
10%氯化钠溶液 10g÷m1L.043g/cm3≈9.6mL
20g-10g=10g
水
mL
请你动手
小红在实验室要用到20克5%的氯化钠 溶液,你能帮助她配制吗?
问题三:实验的步骤
活动一:选用氯化钠固体和水配制溶液 A 称量固体量取水 B计算 C溶解 D 装瓶 E贴标签
请你排序 BACDE 实验过程请你记录好需要用到哪些实验仪器
小红在实验室要用到20克5%的氯化钠 溶液,你能帮助她配制吗?
溶解 水 食盐 盐水的溶质质
初三化学下学期溶质的质量分数-课件

计算公式为:溶质质量分数 = (溶质质量 / 溶液质 02 量) × 100%。
单位常用百分比或ppm表示,1ppm等于1毫克/ 03 千克。
计算公式
溶质质量分数的计算公式是:(溶质质量 / 溶液质量) × 100%。
例如,如果需要计算10克食盐溶解在100克水中所形成 的食盐溶液的溶质质量分数,可以使用公式:(10克 / (100克 + 10克)) × 100% = 9.09%。
根据称量的食盐质量和测量的溶 液体积,计算溶质质量分数。注 意计算要准确,结果要保留小数 点后两位。
THANKS
感谢观看
02
用
溶液的配制
01 计算所需溶质和溶剂的量
根据所需的溶质质量分数和溶液体积,计算所需 的溶质质量和溶剂质量或体积。
02 称量溶质和溶剂
使用精确的称量工具,称量所需的溶质和溶剂。
03 溶解和混合
将溶质溶解在溶剂中,搅拌均匀,确保溶质完全 溶解。
溶液的稀释与浓缩
稀释
将浓溶液加入一定量的溶剂中,使溶质质量分数降低。
单位
01 溶质质量分数的单位常用百分比或ppm表示。
02 百分比表示的是溶质在溶液中的相对含量,而 ppm表示的是溶质的绝对含量。
02 在化学实验中,通常使用ppm来表示溶液中溶质 的浓度,例如:某溶液中某物质的浓度为 1000ppm,表示该物质在溶液中的质量为1000 毫克/千克。
溶质质量分数在化学中的应
初三化学下学期溶质 的质量分数-ppt课
件
目录
• 溶质质量分数的概念 • 溶质质量分数在化学中的应用 • 溶质质量分数与化学平衡 • 溶质质量分数与酸碱反应 • 溶质质量分数与沉淀反应 • 实验:测定某溶液的溶质质量分数
单位常用百分比或ppm表示,1ppm等于1毫克/ 03 千克。
计算公式
溶质质量分数的计算公式是:(溶质质量 / 溶液质量) × 100%。
例如,如果需要计算10克食盐溶解在100克水中所形成 的食盐溶液的溶质质量分数,可以使用公式:(10克 / (100克 + 10克)) × 100% = 9.09%。
根据称量的食盐质量和测量的溶 液体积,计算溶质质量分数。注 意计算要准确,结果要保留小数 点后两位。
THANKS
感谢观看
02
用
溶液的配制
01 计算所需溶质和溶剂的量
根据所需的溶质质量分数和溶液体积,计算所需 的溶质质量和溶剂质量或体积。
02 称量溶质和溶剂
使用精确的称量工具,称量所需的溶质和溶剂。
03 溶解和混合
将溶质溶解在溶剂中,搅拌均匀,确保溶质完全 溶解。
溶液的稀释与浓缩
稀释
将浓溶液加入一定量的溶剂中,使溶质质量分数降低。
单位
01 溶质质量分数的单位常用百分比或ppm表示。
02 百分比表示的是溶质在溶液中的相对含量,而 ppm表示的是溶质的绝对含量。
02 在化学实验中,通常使用ppm来表示溶液中溶质 的浓度,例如:某溶液中某物质的浓度为 1000ppm,表示该物质在溶液中的质量为1000 毫克/千克。
溶质质量分数在化学中的应
初三化学下学期溶质 的质量分数-ppt课
件
目录
• 溶质质量分数的概念 • 溶质质量分数在化学中的应用 • 溶质质量分数与化学平衡 • 溶质质量分数与酸碱反应 • 溶质质量分数与沉淀反应 • 实验:测定某溶液的溶质质量分数
初中九年级(初三)化学 《溶质的质量分数》课件
m 解:设稀释后溶液质量为 ,可以列出下式: m 50g × 98%= ×20%
稀释前溶液中溶质质量
m=245g
答:得到20%溶液245克。
稀释后溶液中溶质质量
稀释加水的质量: 195g-50g=145g
溶液稀释或浓缩的计算公式:
m m 浓×a1%= 稀×a2% m ρ V 溶液=
稀释或浓缩前后溶质的质量不变
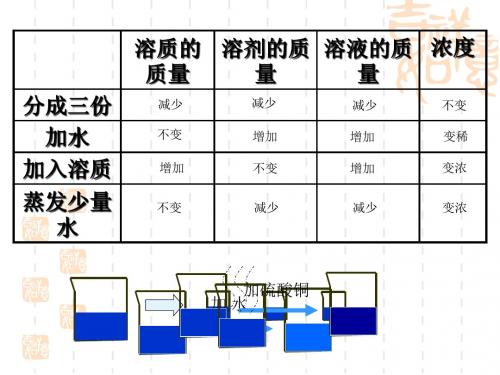
分成三份 加水
加入溶质
蒸发少量 水
溶质的 质量
减质 溶液的质 浓度
量
量
减少
减少
不变
增加
增加
变稀
不变
增加
变浓
减少
减少
变浓
加硫酸铜 加水
一、溶质的质量分数(a%)
定义:溶质的质量与溶液的质量之比。
定义式:溶质的质量分数 =
溶质质量 溶液质量
= 溶质质量
溶质质量+溶剂质量
字母式:a%=
(三)溶液稀释或浓缩的计算
例3:配制1000毫升溶质的质量分数为10%的稀硫酸,需要质量分数为98%的浓硫酸多少 毫升?
硫解酸:的查密表度得(g出/c:m130)和%硫的酸硫溶酸液的中密溶度质为的1.0质7g量/c分m数3,(%)对照表(20℃) 98%的硫酸的密度为1.84g/cm3。
密度 1.01 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84
1000ml×1.07g/cm3-59.3ml×1.84g/cm3=960.9g
例2:配制溶质的质量分数为10%的氯化钠溶液50克,问需要氯化钠多少克?水多少克?
解:
m质=50克×10%=5克
m水=50克-5克=45克
稀释前溶液中溶质质量
m=245g
答:得到20%溶液245克。
稀释后溶液中溶质质量
稀释加水的质量: 195g-50g=145g
溶液稀释或浓缩的计算公式:
m m 浓×a1%= 稀×a2% m ρ V 溶液=
稀释或浓缩前后溶质的质量不变
分成三份 加水
加入溶质
蒸发少量 水
溶质的 质量
减质 溶液的质 浓度
量
量
减少
减少
不变
增加
增加
变稀
不变
增加
变浓
减少
减少
变浓
加硫酸铜 加水
一、溶质的质量分数(a%)
定义:溶质的质量与溶液的质量之比。
定义式:溶质的质量分数 =
溶质质量 溶液质量
= 溶质质量
溶质质量+溶剂质量
字母式:a%=
(三)溶液稀释或浓缩的计算
例3:配制1000毫升溶质的质量分数为10%的稀硫酸,需要质量分数为98%的浓硫酸多少 毫升?
硫解酸:的查密表度得(g出/c:m130)和%硫的酸硫溶酸液的中密溶度质为的1.0质7g量/c分m数3,(%)对照表(20℃) 98%的硫酸的密度为1.84g/cm3。
密度 1.01 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84
1000ml×1.07g/cm3-59.3ml×1.84g/cm3=960.9g
例2:配制溶质的质量分数为10%的氯化钠溶液50克,问需要氯化钠多少克?水多少克?
解:
m质=50克×10%=5克
m水=50克-5克=45克
九年级化学课件九年级化学课件溶质的质量分数

练习:4.8g镁与100g稀硫酸恰好完 全反应,求:
1、生成氢气的质量 2、稀硫酸中溶质的质量分数 3、反应后溶液中溶质的质量分数
配制100g5%氯化钠溶液
步骤1:需要计算出氯化钠的质量和水的质量。
需要氯化钠的质量: 100g × 5% = 5g 需要蒸馏水的质量: 100g - 5g =95 g 步骤2:用天平称量5g氯化钠,用量筒量取 95ml水。 步骤3:将称量出的5g氯化钠放入烧杯中, 并将量取的95ml水倒入,用玻璃棒搅拌,使 氯化钠完全溶解。
解:甘油的质量是400g,水的质量是100g
所得溶液质量为:400g+100g=500g
溶质的质量分数=
400g 500g
X100% =80%
答:该甘油溶液的溶质的质量分数是80%
2、根据溶解度计算溶液中溶质的质量分数
例:20℃时,食盐的溶解度为36克,计算此 温度下饱和食盐水的食盐的质量分数? 溶质质量分数=100g3+6g36gX100%=26.5%
解:溶质的质量=50克×10%=5克 水的质量=50克-5克=45克
配制过程:
A、计算 B、称量 C、溶解
D、装瓶
1、将250g蓝矾(化学式为 CuSO4·5H2O)溶解在310g水中,所得 溶液溶质的质量分数为多少?
2、将5g氯化钠和4g硝酸钾同时溶解在 91g水中,求氯化钠溶质的质量分数
练习册41页:思维能力拓展
③称量物不能直接放在托盘上。称干燥固体 药品时,必须放在纸上;称易潮解的药品,必 须放在 烧杯 里称量。 ④称量质量一定的药品时,先把砝码放在右 盘,游码移至预定示数,再用药匙添加药品 ,直至天平平衡。
(3)复习量筒的使用方法,思考并回答: ①实验时不直接用天平称量液体的质量, 而是换算成体积 后用量筒量取。
初中九年级化学课精品PPT教学课件-溶质的质量分数

不变
溶剂的 质量 减少 增加 不变
减少
溶液的 质量 减少
增加 增加
减少
浓度
不变 变稀 变浓 变浓
例1:20g食盐溶液中含有 2g食盐,求:
该溶液的溶质质量分数。
解: 2g 20g
×100% =10%
答:该溶液的质量分数是10%。
例2:40g 2%的食盐溶液中含有多少g 食盐和水?
解:含食盐: 40g × 2% = 0.8 g 含 水: 40 g – 0.8g = 39.2 g
溶质的质量分数
实验一:三种不同组成的CuSO4溶 液的比较
在三支试管中各加入10mL水,然后分别 加入约0.5g、1g、1.5g固体硫酸铜。比较三 种溶液的颜色。
试管 溶液颜 溶剂 溶质 溶液 溶质质 编号 色比较 质量/g 质量/g 质量/g 量分数
1浅
10g
0.5g 10.5g 4.8%
2 较深 10g
×100%=10%
答:稀硫酸的质量分数为10%。
配制过程
1.计算:溶质和溶剂的质量;
2.称量和量取:用托盘天平称量 计算出的溶质的质量,用量筒称量出溶 剂的质量;
3.溶解:把溶质和溶剂都倒入烧 杯中,用玻璃棒搅拌至充分溶解;
4.装瓶: 配制溶液时常用仪器:托盘天平、 量筒、烧杯、玻璃棒。
配制步骤:①计算 ②称量 ③溶解 例:(溶质为固体)配制150g 20%的食盐 水。 ①计算:需食盐:150 g×20% = 30 g
需 水:150 g – 30g = 120g
②称量:用天平称量 30 g食盐;用量筒量 取120mL水。
③溶解:烧杯、玻璃棒
课堂小结
一、溶质的质量分数
溶质的质量分数 =
溶剂的 质量 减少 增加 不变
减少
溶液的 质量 减少
增加 增加
减少
浓度
不变 变稀 变浓 变浓
例1:20g食盐溶液中含有 2g食盐,求:
该溶液的溶质质量分数。
解: 2g 20g
×100% =10%
答:该溶液的质量分数是10%。
例2:40g 2%的食盐溶液中含有多少g 食盐和水?
解:含食盐: 40g × 2% = 0.8 g 含 水: 40 g – 0.8g = 39.2 g
溶质的质量分数
实验一:三种不同组成的CuSO4溶 液的比较
在三支试管中各加入10mL水,然后分别 加入约0.5g、1g、1.5g固体硫酸铜。比较三 种溶液的颜色。
试管 溶液颜 溶剂 溶质 溶液 溶质质 编号 色比较 质量/g 质量/g 质量/g 量分数
1浅
10g
0.5g 10.5g 4.8%
2 较深 10g
×100%=10%
答:稀硫酸的质量分数为10%。
配制过程
1.计算:溶质和溶剂的质量;
2.称量和量取:用托盘天平称量 计算出的溶质的质量,用量筒称量出溶 剂的质量;
3.溶解:把溶质和溶剂都倒入烧 杯中,用玻璃棒搅拌至充分溶解;
4.装瓶: 配制溶液时常用仪器:托盘天平、 量筒、烧杯、玻璃棒。
配制步骤:①计算 ②称量 ③溶解 例:(溶质为固体)配制150g 20%的食盐 水。 ①计算:需食盐:150 g×20% = 30 g
需 水:150 g – 30g = 120g
②称量:用天平称量 30 g食盐;用量筒量 取120mL水。
③溶解:烧杯、玻璃棒
课堂小结
一、溶质的质量分数
溶质的质量分数 =
中考化学复习方案 第6课时 溶质的质量分数及计算课件

冀考解读
考点聚焦
第二十一冀页,考共探二十究三页。
┃ 溶质的质量分数及计算
答案
解:反应消耗硫酸的质量为 49 g×10%=4.9 g。
设废水样品中氢氧化钠的质量为 x。
2NaOH+H2SO4===Na2SO4+2H2O
80
98
x
4.9 g
8908=4.9x g x=80×948.9 g=4 g
废水中氢氧化钠的质量分数为440gg×100%=10%。
冀考解读
考点聚焦
第八页冀,共考二探十三究页。
┃ 溶质的质量(zhìliàng)分数及计算
考点5 溶质的质量(zhìliàng)分数与化学方程式相结合的计算 此类简单的综合计算是中考最为常见的计算,计算时要注意
溶液中参加化学反应的一般是溶质,因此代入化学方程溶液的过程中,溶_质__(r_ó_ng_z_hì的) 质量不会发生变化。 计算公式:浓溶液的质量×浓溶液中溶质的质量分数=稀溶 液的质量×稀溶液中溶质的质量分数。 [注意] ①两种溶液混合时,质量可以相加减,但体积之间不 可以相加减。 ②稀释的方法可以是用水稀释,也可用稀溶液稀释浓溶液。 混合前后有下列相等关系: 浓溶液的质量×浓溶液中溶质的质量分数+稀溶液的质量× 稀溶液中溶质的质量分数=混合溶液的质量×混合溶液中溶质的 质量分数。 ③计算时要保持单位一致。
冀考解读
考点聚焦
第六页冀,共考二探十三究页。
┃ 溶质的质量(zhìliàng)分数及计算
3.误差分析
①用天平称固体质
会使固体的质量 溶液的溶质质量
(1) 加 入 溶
量时错用“左码右 物”(使用游码)
偏____小____
分数偏____小____
质的质量与 ②天平称量前没有 会 使 固 体 的 质 量 溶 液 的 溶 质 质 量
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.实验步骤 (1)用固体配溶液:________ 计算 、____________ 溶解 、装 称量和量取 、________ 瓶贴标签。 (2)用液体配溶液:________ 量取 、________ 计算 、________ 溶解 、装瓶贴 标签。
考点聚焦
冀考探究
第6课时┃ 溶质的质量分数及计算
用托盘天平称量固体质量时,数值可精确到小数点后一
位,且要注意是“左物右码”,并在两托盘上垫上相同 的纸片,若是有腐蚀性或易潮解的物质则要放在烧杯等 玻璃器皿中称量。
考点聚焦
冀考探究
第6课时┃ 溶质的质量分数及计算
3.误差分析
①用天平称固 体质量时,错 溶液的溶质 会使固体的质 小 用“左码右 质量分数偏 小 量偏____ 物”(使用游码 ________ ) 溶液的溶质 大 会使固体的质 大 质量分数偏 量偏____ ________ 溶液的溶质 小 会使固体的质 小 质量分数偏 量偏____ ________
6课时┃ 溶质的质量分数及计算
|冀考要求| 1.认识溶质质量分数的含义,能进行溶质质量分数的简 单计算。(C) 2.能配制一定溶质质量分数的溶液。(C)
考点聚焦
冀考探究
第6课时┃ 溶质的质量分数及计算
考 点 聚 焦
1 关于溶质质量分数的计算 溶质的质量分数是________ 溶质 的质量与________ 溶液 的质量之比。 有关公式: (1)溶质的质量分数=溶质的质量,溶液的质量×100% (既适用于饱和溶液的计算,也适用于不饱和溶液的计算) (2)溶液的质量=______ 溶质 的质量+______ 溶剂 的质量 (3)溶质的质量=________ 溶液 的质量×溶质的质量分数;溶液 的质量=溶液的体积×溶液的密度 (4)饱和溶液中溶质的质量分数=S,100 g+S×100%(S表示 对应温度下该溶质的溶解度)
考点聚焦
冀考探究
第6课时┃ 溶质的质量分数及计算 配制一定溶质质量分数的溶液 命题角度:配制一定质量分数溶液的实验仪器、步骤、误
差分析等。
例3 [2014· 衡阳]小刚同学在做一定溶质质量分数的氯化钠
溶液的配制实验时,进行了如图6-1所示的配制过程。
图 6-1
考点聚焦 冀考探究
第6课时┃ 溶质的质量分数及计算 试回答下列问题。 (1)写出图中有标号仪器的名称:a_______ 药匙 ,b______ 烧杯 。 (2)图示实验中有一处明显的错误是_______________ 试剂瓶塞正放 ;玻璃 棒的作用是_____________________ 。 搅拌,以加速溶解 (3)小刚同学要配制90 g质量分数为10%的氯化钠溶液,应称 取氯化钠的质量为________ g,需要量取水的体积为________ 9 81 mL(水的密度近似看作1 g/cm3)。 (4)称量氯化钠时,若将氯化钠放在天平的右盘中,砝码放在 天平的左盘中,并且在称量过程中使用了游码,则会使称取的 质量________( 小于 填“大于”或“小于”)配制溶液所需的质量。 在量取水的体积时,小刚同学俯视读数,则所配制的溶液中氯 偏大 填“偏大”“偏小”或“不变”)。 化钠的质量分数________(
考点聚焦 冀考探究
第6课时┃ 溶质的质量分数及计算 有关溶液稀释问题的计算 命题角度:稀释过程中溶质质量分数的计算。 例2 [2014·泉州]“84消毒液”广泛应用于物体表面的消 毒,其有效成分是次氯酸钠。 (1)50 g溶质质量分数为12%的次氯酸钠溶液中,需要固体次 氯酸钠________ g,水________ mL。 6 44 (2)可将上述溶液稀释成溶质质量分数为0.2%的次氯酸钠溶 液________ g。 3000
溶液的溶质 会使溶剂的质 质量分数偏 小 量偏____ 大 ________ 溶液的溶质 会使溶剂的质 质量分数偏 量偏____ 大 ________ 小
溶液的溶质 会使溶剂的质 质量分数偏 小 量偏____ 大 ________
考点聚焦
冀考探究
第6课时┃ 溶质的质量分数及计算
4 溶质的质量分数与化学方程式相结合的计算
①两种溶液混合时,质量可以相加减,但体积之间不可以相加减。 ②计算时溶液的体积要先换算成质量,要保持单位一致。
考点聚焦
冀考探究
第6课时┃ 溶质的质量分数及计算 3 配制一定溶质质量分数的溶液
烧杯 、________ 1.实验仪器:托盘天平 ________、________ 量筒 、________ 玻璃棒 、 滴管、药匙等。
例1 氯化钠不仅是必不可少的生活用品,也是重要的化工 原料。请计算: (1)若要配制1000 g 0.9%的氯化钠溶液,需要________g 氯 9 化钠,________g 水。 991 (2)已知在20 ℃时氯化钠的溶解度为36 g,则该温度下氯化 钠的饱和溶液中,溶质质量与溶剂质量的最简整数比为 ______________ 。 9∶25
考点聚焦 冀考探究
第6课时┃ 溶质的质量分数及计算
①溶质的质量分数一般用百分数来表示,不能用分数表示。 ②未溶解的物质不能计入溶质的质量。 ③饱和溶液中,溶质的质量分数达到该条件下的最大值。
考点聚焦
冀考探究
第6课时┃ 溶质的质量分数及计算
2 关于溶液稀释问题的计算
1.计算原理:溶液稀释的过程中,________ 溶质 的质量不会发生 变化。 2.计算公式:浓溶液的质量×浓溶液中溶质的质量分数=稀 溶液的质量×稀溶液中溶质的质量分数。
以化学方程式的计算为主体,融入溶质质量分数的计算。
代入化学方程式计算或根据化学方程式算出来的是 ________ 溶质 的质量,而不是溶液的质量。
考点聚焦
冀考探究
第6课时┃ 溶质的质量分数及计算
冀 考 探 究
关溶质质量分数的简单计算
命题角度:已知溶液的质量和溶质的质量分数,求溶质、溶剂
的质量或已知溶质、溶剂的质量,求溶质的质量分数。
冀考探究
(1)加入溶 质的质量与 ②称量前天平 理论溶质的 没有调平衡, 质量有差异 指针偏右 ③固体药品中 混有难溶性的 杂质
考点聚焦
第6课时┃ 溶质的质量分数及计算
①量取水时俯 视读数 (2)加入溶 ②量取水时仰 剂的质量与 视读数 理论溶剂的 质量有差异 ③将量筒中的 水转移到烧杯 中时,液体有 洒落
考点聚焦
冀考探究
第6课时┃ 溶质的质量分数及计算
解 析 (1)根据溶质质量分数的变形公式,直接算出 需要固体次氯酸钠6 g,水44 g,再把44 g水换算成体积。 (2)设0.2%的次氯酸钠溶液的质量为x,根据溶液稀释前后 溶质质量不变,列出方程:50 g×12%=x×0.2%,解得x =3000 g。 [方法点拨] 有关稀释问题的计算,不管是用加水稀释的方法 还是用浓溶液稀释的方法,解题所需的相等关系都是稀释前 后溶质的质量相等,解题时,应找准稀释前后溶液的实际质 量及各自对应的溶质质量分数。
