ValukineTM ELISA试剂盒优势及参考文献
elisa试剂盒原理

elisa试剂盒原理
Elisa试剂盒是一种常用的生化实验工具,用于检测特定物质
的存在和浓度。
其原理基于酶联免疫吸附实验(Enzyme-Linked Immunosorbent Assay,简称Elisa)。
Elisa试剂盒通常由多个试剂组成,包括包被抗原、检测抗体、酶标记的二抗和底物等。
首先,将要检测的被测物(如蛋白质、抗原等)固定在试板或试管的表面。
随后,向试样中加入检测抗体,该抗体与被测物具有高度的特异性结合。
接下来,加入酶标记的二抗,这个二抗能够与检测抗体结合。
二抗中的酶(如辣根过氧化物酶或碱性磷酸酶)使得酶标记的二抗能够与检测抗体结合在一起。
然后,通过洗涤,将非特异性结合的物质去除,以减少背景干扰。
最后,加入适当的底物,使酶被检测到并产生染色反应。
底物分解后产生的光学信号可以被读数仪器测量,信号的强度与被测物的浓度成正比。
Elisa试剂盒不仅可以用于科学研究,还广泛应用于医学诊断、药物检测和食品安全监测等领域。
通过改变试剂盒中的抗体和底物,Elisa可以灵活地检测各种不同的物质。
其简单、快速、灵敏和可靠的特点使其成为生命科学研究中的重要工具。
ELISA试验技术要点

ELISA试验技术要点ELISA(Enzyme-Linked Immunosorbent Assay)是一种常用的生物化学技术,用于检测特定蛋白质或其他分子在样本中的存在量。
ELISA试验技术是基于抗原-抗体相互作用原理的一种快速、敏感的定量方法。
在本文中,我们将讨论ELISA试验技术的要点,包括原理、步骤、优缺点以及应用范围。
一、ELISA试验的原理ELISA试验通过测定受检物质与特定抗体之间的结合来检测受检物质的存在量。
ELISA试验通常包括4个基本步骤:涂底板、孵育、洗板和检测。
在涂底板过程中,将要检测的抗原或抗体固定在底板上。
然后,在孵育过程中,将待测样本加入底板,与固定的抗原或抗体结合。
接着,在洗板过程中,清洗掉未结合的物质。
最后,在检测过程中,使用酶标记的二抗或底物来确定结合的抗原和抗体的量。
二、ELISA试验的步骤1.涂底板:将抗原或抗体固定在底板上。
2.孵育:加入待检测样本,经过特定时间让抗原和抗体发生结合。
3.洗板:清洗掉未结合的物质,防止干扰物质的干扰。
4.检测:加入酶标记的二抗或底物,测量酶标记反应的信号强度。
三、ELISA试验的优缺点1.优点:ELISA试验具有高灵敏度和特异性,能够快速、准确地检测目标物质的存在量。
此外,ELISA试验的操作简单,不需要昂贵的设备。
2.缺点:ELISA试验在一定程度上受到干扰物质的影响,有时需要多步骤操作,容易出现误差。
四、ELISA试验的应用范围ELISA试验广泛应用于医学、生物化学、环境科学、食品安全等领域。
在医学领域,ELISA试验可用于诊断感染病原体、筛查肿瘤标志物等。
在生物化学领域,ELISA试验可用于研究蛋白质的相互作用、酶活性等。
在环境科学领域,ELISA试验可用于检测水体或土壤中的污染物。
在食品安全领域,ELISA试验可用于检测食品中的残留农药、重金属等。
总之,ELISA试验技术是一种重要的生物化学技术,具有广泛的应用价值。
Human IL-6 ValukineTM ELISA操作手册说明书

PRODUCT INFORMATION&MANUAL Human IL-6Valukine TM ELISAVAL102For the quantitative determination of natural and recombinant human Interleukin6(IL-6)concentrationsFor research use only.Not for diagnostic or therapeutic procedures.Bio-Techne China Co.LtdP:+86(21)52380373P:8009881270F:+86(21)52381001**********************Please refer to the kit label for expiry date.Novus kits are guaranteed for3months from date of receiptVersion202209.5TABLE OF CONTENTSI.BACKGROUND (2)II.OVERVIEW (3)III.ADVANTAGES (4)IV.EXPERIMENT (7)V.KIT COMPONENTS AND STORAGE (8)VI.PREPARATION (10)VII.ASSAY PROCEDURE (12)VIII.REFERENCES (13)I.BACKGROUNDInterleukin6(IL-6)is a pleiotropicα-helical22-28kDa phosphorylated and variably glycosylated cytokine that plays important roles in the acute phase reaction, inflammation,hematopoiesis,bone metabolism,and cancer progression(1-5).Mature human IL-6is183amino acids(aa)in length and shares41%aa sequence identity with mouse and rat IL-6(6).Alternate splicing generates several isoforms with internal deletions,some of which exhibit antagonistic properties(7-10).Cells known to express IL-6include CD8+T cells,fibroblasts,synoviocytes,adipocytes,osteoblasts, megakaryocytes,endothelial cells(under the influence of endothelins),sympathetic neurons,cerebral cortex neurons,adrenal medulla chromaffin cells,retinal pigment cells,mast cells,keratinocytes,Langerhans cells,fetal and adult astrocytes,neutrophils, monocytes,eosinophils,colonic epithelial cells,B1B cells,and pancreatic islet beta cells(2,7,10-33).IL-6production is generally correlated with cell activation and is normally kept in control by glucocorticoids,catecholamines,and secondary sex steroids (2).Normal human circulating IL-6is in the1pg/mL range,with slight elevations during the menstrual cycle,modest elevations in certain cancers,and large elevations after surgery(34-38).IL-6induces signaling through a cell surface heterodimeric receptor complex composed of a ligand binding subunit(IL-6R)and a signal transducing subunit(gp130).IL-6binds to IL-6R,triggering IL-6R association with gp130and gp130dimerization(39).Gp130 is also a component of the receptors for CLC,CNTF,CT-1,IL-11,IL-27,LIF,and OSM (40).Soluble forms of IL-6R are generated by both alternative splicing and proteolytic cleavage(3).In a mechanism known as trans-signaling,complexes of soluble IL-6and IL-6R elicit responses from gp130-expressing cells that lack cell surface IL-6R(1,3). Trans-signaling enables a wider range of cell types to respond to IL-6,as the expression of gp130is ubiquitous,while that of IL-6R is predominantly restricted to hepatocytes,monocytes,and resting lymphocytes(1-3).Soluble splice forms of gp130 block trans-signaling from IL-6/IL-6R but not from other cytokines that use gp130as a co-receptor(3,41).IL-6,along with TNF-αand IL-1,drives the acute inflammatory response,is almost solely responsible for fever and the acute phase response in the liver,and is important in the transition from acute inflammation to either acquired immunity,or chronic inflammatory disease(1-4).It contributes to chronic inflammation in conditions such as obesity,insulin resistance,inflammatory bowel disease,inflammatory arthritis and sepsis when dysregulated,often involving IL-6trans-signaling(1,2).It also plays an important role in the differentiation of naive T cells to Th17inflammatory cells in the presence of TGF-β.IL-6modulates bone resorption and is a major effector of inflammatory joint destruction in rheumatoid arthritis through its promotion of Th17T cell activity(1).It contributes to atherosclerotic plaque development and destabilization(2). However,IL-6can also have anti-inflammatory effects,such as in skeletal muscle where it is secreted in response to exercise(2).It promotes hematopoiesis by being a growth factor for hematopoietic stem cells,induces B cell maturation to plasma cells and perpetuates multiple myeloma(1,42).IL-6also promotes,but probably does not initiate,other types of inflammation-associated carcinogenesis,such as colitis-associated cancer(1).II.OVERVIEWA.PRINCIPLE OF THE ASSAYThis assay employs the quantitative sandwich enzyme immunoassay technique.A monoclonal antibody specific for IL-6has been pre-coated onto a microplate.Standards and samples are pipetted into the wells and any IL-6present is bound by the immobilized antibody.After washing away any unbound substances,an enzyme-linked polyclonal antibody specific for IL-6is added to the wells.Following a wash to remove any unbound antibody-enzyme reagent,a substrate solution is added to the wells and color develops in proportion to the amount of IL-6bound in the initial step.The color development is stopped and the intensity of the color is measured.B.LIMITATIONS OF THE PROCEDURE♦FOR RESEARCH USE ONLY.NOT FOR USE IN DIAGNOSTIC PROCEDURES.♦This kit is suitable for cell culture supernate,serum and plasma.♦The kit should not be used beyond the expiration date on the kit label.♦Do not mix or substitute reagents with those from other lots or sources.♦If samples generate values higher than the highest standard,dilute the samples with Diluent and repeat the assay.♦Any variation in operator,pipetting technique,washing technique,incubation time or temperature,and kit age can cause variation in binding.III.ADVANTAGESA.PRECISIONIntra-assay Precision(Precision within an assay)Three samples were tested twenty times on one plate to assess intra-assay precision. Inter-assay Precision(Precision between assays)Three samples were tested in twenty separate assays to assess inter-assay precision.Intra-assay Precision Inter-assay PrecisionSample123123Mean(pg/mL)20.677.817523.983.3177Standard Deviation 1.20 3.517.33 4.2013.325.5CV% 5.8 4.5 4.217.615.914.4B.RECOVERYThe recovery of human IL-6spiked to levels throughout the range of the assay in various matrices was evaluated.Sample Type Average%Recovery RangeCell culture media(n=4)9581-104%Serum(n=3)9380-99%Plasma(n=4)9681-109%C.SENSITIVITYThe minimum detectable dose(MDD)of IL-6is typically less than1.56pg/mL.The MDD was determined by adding two standard deviations to the mean optical density value of twenty zero standard replicates and calculating the corresponding concentration.D.CALIBRATIONThis immunoassay is calibrated against highly purified E.coli-expressed recombinant human IL-6produced at R&D Systems.The NIBSC/WHO1st International Standard for IL-6(89/548),which was intended as a potency standard,was evaluated in this kit.The NIBSC/WHO standard is a CHO cell-derived recombinant human IL-6.The dose response curve of the International Standard(89/548)parallels the Valukine standard curve.To convert sample values obtained with the Valukine Human IL-6kit to approximate NIBSC89/548units,use the equation below.NIBSC(89/548)approximate value(IU/mL)=0.109×Valukine Human IL-6value (pg/mL)E.LINEARITYTo assess the linearity of the assay,samples were spiked with high concentrations of human IL-6in various matrices and diluted with Diluent1×to produce samples with values within the dynamic range of the assay.Dilution Cell culture media(n=4)Serum(n=3)Plasma(n=4)1:2Average%of Expected11210299 Range(%)105-117101-10289-106 1:4Average%of Expected111106101 Range(%)104-119102-11195-107 1:8Average%of Expected9710899 Range(%)91-105103-11693-104 1:16Average%of Expected8910998 Range(%)81-98102-11790-107 F.SAMPLE VALUESCell Culture Supernates-Human peripheral blood mononuclear cells(1×106cells/mL) were cultured in RPMI supplemented with10%fetal calf serum,50μM β-mercaptoethanol,2mM L-glutamine,100U/mL penicillin,and100μg/mL streptomycin sulfate and stimulated for3days with10μg/mL PHA.An aliquot of the cell culture supernate was removed,assayed for levels of natural IL-6,and measured6640 pg/mL.Serum-Three human serum samples were evaluated for the presence of human IL-6 in this assay.All samples measured ranged from20.5to62.5pg/mL with an average of 48.0pg/mL.Plasma-Four human plasma samples were evaluated for the presence of human IL-6 in this assay.All samples measured ranged from73.5to105pg/mL with an average of 88.6pg/mL.G.SPECIFICITYThis assay recognizes both natural and recombinant human IL-6.The following factors were prepared at50ng/mL and assayed for cross-reactivity.Preparations of the following factors at50ng/mL in a mid-range rhIL-6control were assayed for interference.No significant cross-reactivity or interference was observed.Recombinant human Recombinant mousesgp130IL-6IL-6sRIL-6sR/sgp130IV.EXPERIMENTEXAMPLE STANDARDThe standard curve is provided for demonstration only.A standard curve should be generated for each set of samples assayed.V.KIT COMPONENTS AND STORAGEA.MATERIALS PROVIDEDParts Description SizeHuman IL-6 Microplate 96well polystyrene microplate(12strips of8wells)coated with a mouse monoclonal antibodyagainst human IL-61plateHuman IL-6 Conjugate Solution of polyclonal antibody againsthuman IL-6conjugated to horseradishperoxidase1vialHuman IL-6 Standard recombinant human IL-6in a buffered proteinbase;lyophilized1vialCalibrator Diluent(5×)a5×concentrated buffered protein base1vialWash BufferConcentrate(25×)a25×concentrated solution of buffered surfactant1vial TMB Substrate TMB ELISA Substrate Solution2vials Stop Solution2N sulfuric acid1vial Plate Sealers adhesive strip3stripsB.STORAGEUnopened Kit Store at2-8°C.Do not use past kit expiration date.Opened/ Reconstituted Reagents Diluted Wash BufferMay be stored for up to1month at2-8°C.*Stop SolutionDiluent1×ConjugateTMB SubstrateStandardAliquot and store for up to1month at-20°C in a manual defrost freezer.*Avoid repeated freeze-thaw cycles. Microplate WellsReturn unused wells to the foil pouchcontaining the desiccant pack,resealalong entire edge of zip-seal.May bestored for up to1month at2-8°C.**Provided this is within the expiration date of the kit.C.OTHER SUPPLIES REQUIRED♦Microplate reader capable of measuring absorbance at450nm,with the correction wavelength set at540nm or570nm.♦Pipettes and pipette tips.♦Deionized or distilled water.♦Squirt bottle,manifold dispenser,or automated microplate washer.♦500mL graduated cylinder.D.PRECAUTIONThe Stop Solution provided with this kit is an acid solution.Wear eye,hand,face,and clothing protection when using this materialVI.PREPARATIONA.SAMPLE COLLECTION AND STORAGECell Culture Supernates-Remove particulates by centrifugation and assay immediately or aliquot and store samples at≤-20°C.Avoid repeated freeze-thaw cycles. Samples may require dilution with Calibrator Diluent1×.Serum-Use a serum separator tube(SST)and allow samples to clot for30minutes at room temperature before centrifugation for15minutes at1000x g.Remove serum and assay immediately or aliquot and store samples at≤-20°C.Avoid repeated freeze-thaw cycles.Plasma-Collect plasma using EDTA,heparin,or citrate as an anticoagulant. Centrifuge for15minutes at1000x g within30minutes of collection.Assay immediately or aliquot and store samples at≤-20°C.Avoid repeated freeze-thaw cycles.B.SAMPLE PREPARATIONSerum samples require a5-fold dilution.A suggested5-fold dilution is40μL of sample +160μL of Diluent(1×).Plasma samples require a2-fold dilution.A suggested2-fold dilution is100μL of sample+100μL of Diluent(1×).C.REAGENT PREPARATIONNote:Bring all reagents to room temperature before use.Wash Buffer-If crystals have formed in the concentrate,warm to room temperature and mix gently until the crystals have completely dissolved.Dilute20mL of Wash Buffer Concentrate(25×)into deionized or distilled water to prepare500mL of Wash Buffer. Diluent1×-Add20mL of Calibrator Diluent Concentrate5×into80mL of deionized or distilled water to prepare100mL of Diluent1×.IL-6Standard-Refer to the vial label for reconstitution volume*.This reconstitution produces a stock solution of300pg/mL.Allow the standard to sit for a minimum of15 minutes with gentle agitation prior to making dilutions.*if you have any question,please seek help from our Technical Support.Pipette667μL of Diluent1×into the100pg/mL tube.Pipette500μL of Diluent 1×into each remaining e the stock solution to produce a dilution series (below).Mix each tube thoroughly before the next transfer.The undiluted standard serves as the high standard(300pg/mL).The Diluent1×serves as the zero standard(0 pg/mL).D.TECHNICAL HINTS●When mixing or reconstituting protein solutions,always avoid foaming.●To avoid cross-contamination,change pipette tips between additions of eachstandard level,between sample additions,and between reagent additions.Also, use separate reservoirs for each reagent.●It is recommended that the samples be pipetted within15minutes.●To ensure accurate results,proper adhesion of plate sealers during incubationsteps is necessary.●TMB Substrate should remain colorless until added to the plate.Keep SubstrateSolution protected from light.Substrate Solution should change from colorless to gradations of blue.●Stop Solution should be added to the plate in the same order as the SubstrateSolution.The color developed in the wells will turn from blue to yellow upon addition of the Stop Solution.Wells that are green in color indicate that the Stop Solutionhas not mixed thoroughly with the Substrate Solution.VII.ASSAY PROCEDURENote:Bring all reagents and samples to room temperature before use.It is recommended that all samples and standards be assayed in duplicate.1.Prepare all reagents and working standards as directed in the previous sections.2.Remove excess microplate strips from the plate frame,return them to the foil pouchcontaining the desiccant pack,and reseal.3.Add100μL of Standard,sample,or control per well.Cover with the adhesive stripprovided.Incubate for2hours at room temperature.A plate layout is provided for a record of standards and samples assayed.4.Aspirate each well and wash,repeating the process three times for a total of fourwashes.Wash by filling each well with Wash Buffer(400μL)using a squirt bottle, manifold dispenser,or plete removal of liquid at each step is essential to good performance.After the last wash,remove any remaining Wash Buffer by aspirating or decanting.Invert the plate and blot it against clean paper towels.5.Add200μL of human IL-6Conjugate to each well.Cover with a new adhesive strip.Incubate for2hours at room temperature.6.Repeat the aspiration/wash as in step4.7.Add200μL of TMB Substrate to each well.Incubate for20minutes at roomtemperature.Protect from light.8.Add50μL of Stop Solution to each well.The color in the wells should change fromblue to yellow.If the color in the wells is green or if the color change does not appear uniform,gently tap the plate to ensure thorough mixing.9.Determine the optical density of each well within10minutes,using a microplatereader set to450nm.If wavelength correction is available,set to540nm or570nm.If wavelength correction is not available,subtract readings at540nm or570nm from the readings at450nm.This subtraction will correct for optical imperfections in the plate.Readings made directly at450nm without correction may be higher and less accurate.10.CALCULATION OF RESULTS:Average the duplicate readings for each standard,control,and sample and subtract the average zero standard optical density.Createa standard curve by reducing the data using computer software capable ofgenerating a four parameter logistic(4-PL)curve-fit.As an alternative,construct a standard curve by plotting the mean absorbance for each standard on the y-axis against the concentration on the x-axis and draw a best fit curve through the points on the graph.The data may be linearized by plotting the log of the IL-6 concentrations versus the log of the O.D.and the best fit line can be determined by regression analysis.This procedure will produce an adequate but less precise fit of the data.If samples have been diluted,the concentration read from the standard curve must be multiplied by the dilution factor.VIII.REFERENCES1.Naugler,W.E.and M.Karin(2008)Trends Mol.Med.14:109.2.Schuett,H.et al.(2009)Thromb.Haemost.102:215.3.Jones,S.A.(2005)J.Immunol.175:3468.4.Hodge,D.R.et al.(2005)Eur.J.Cancer41:2502.5.Rose-John,S.et al.(2006)J.Leukoc.Biol.80:227.6.Van Snick,J.et al.(1988)Eur.J.Immunol.18:193.7.Kestler,D.P.et al.(1995)Blood86:4559.8.Kestler,D.P.et al.(1999)Am.J.Hematol.61:169.9.Bihl,M.P.et al.(2002)Am.J.Respir.Cell Mol.Biol.27:48.10.Alberti,L.et al.(2005)Cancer Res.65:2.11.May,L.T.et al.(1986)A83:8957.12.Sad,S.et al.(1995)Immunity2:271.13.Cichy,J.et al.(1996)mun.227:318.14.Miyazawa,K.et al.(1998)Am.J.Pathol.152:793.15.Fried,S.K.et al.(1998)Endocrinology83:847.16.Ishimi,Y.et al.(1990)J.Immunol.145:3297.17.Jiang,S.et al.(1994)Blood84:4151.18.Xin,X.et al.(1995)Endocrinology136:132.19.Marz,P.et al.(1998)A95:3251.20.Ringheim,G.E.et al.(1995)J.Neuroimmunol.63:113.21.Gadient,R.A.et al.(1995)Neurosci.Lett.194:17.22.Kuppner,M.C.et al.(1995)Immunology84:265.23.Gagari,E.et al.(1997)Blood89:2654.24.Cumberbatch,M.et al.(1996)Immunology87:513.25.Fujisawa,H.et al.(1997)J.Interferon Cytokine Res.17:347.26.Lee,S.C.et al.(1993)J.Immunol.150:2659.fortune,L.et al.(1996)J.Neuropathol.Exp.Neurol.55:515.28.Ericson,S.G.et al.(1998)Blood91:2099.29.Melani,C.et al.(1993)Blood81:2744.cy,P.et al.(1998)Blood91:2508.31.Jung,H.C.et al.(1995)J.Clin.Invest.95:55.32.Spencer,N.F.L.and R.A.Daynes(1997)Int.Immunol.9:745.33.Campbell,I.L.et al.(1989)J.Immunol.143:1188.34.D’Auria,L.et al.(1997)Eur.Cytokine Netw.8:383.35.Yamamura,M.et al.(1998)Br.J.Haematol.100:129.36.Angstwurm,M.W.A.et al.(1997)Cytokine9:370.37.Mouawad,R.et al.(1996)Clin.Cancer Res.2:1405.38.Sakamoto,K.et al.(1994)Cytokine6:181.39.Murakami,M.et al.(1993)Science260:1808.40.Muller-Newen,G.(2003)Sci.STKE2003:PE40.41.Mitsuyama,K.et al.(2006)Clin.Exp.Immunol.143:125.42.Cerutti,A.et al.(1998)J.Immunol.160:2145.产品信息及操作手册人IL-6Valukine TM ELISA试剂盒目录号:VAL102适用于定量检测天然和重组人白介素6(IL-6)的浓度科研专用,不可用于临床诊断Bio-Techne China Co.LtdP:+86(21)52380373P:8009881270F:+86(21)52381001**********************有效期详见试剂盒包装标签Novus试剂盒确保在你收货日期3个月内有效目录I.背景 (18)II.概述 (19)III.优势 (20)IV.实验 (23)V.试剂盒组成及储存 (24)VI.实验前准备 (26)VII.操作步骤 (28)VIII.参考文献 (29)白细胞介素-6(IL-6)是一个具有α螺旋结构、22-28kDa的磷酸化和不同程度糖基化的多功能细胞因子,它在疾病急性期反应、炎症、造血、骨代谢以及癌症恶化等方面起重要作用(1-5)。
elisa试剂盒原理

elisa试剂盒原理ELISA试剂盒(Enzyme-LinkedImmunosorbentAssay,又译作免疫夹配酶联免疫吸附测定法)是一种常用的生物化学技术,它能够快速、灵敏地检测固定量的抗原或抗体。
它的原理建立在具有特异性的抗原与抗体发生免疫反应的基础上,并且利用酶联免疫吸附测定法将其特异性特性发挥到极致。
ELISA试剂盒的原理实际上是利用一种可用来衡量两种特定分子结合情况的“酶联免疫反应”,即抗体可以特异性地结合抗原(如病毒、细菌、细胞、植物体等),然后会把这种特异性关联变成数量上的增加。
这种数量上的增加是金属蛋白酶(enzyme)所带来的。
当抗原被特异性抗体结合时,同时伴随着金属蛋白酶在抗原上的结合,而金属蛋白酶又被某些特定物(如丙二醛或氯仿等)所诱导,从而使抗原上的特异性结合物产生数量上的增加。
ELISA试剂盒的工作原理以上就是ELISA试剂盒的基本原理,它主要利用酶联免疫吸附测定的特异性原理,将特定的抗原或抗体酶联到具有特异性的样品上,最后检测数量上的增加。
ELISA技术具有高灵敏度、简便快捷、操作可靠等优点,被广泛应用于疾病诊断、抗原定性与定量检测、免疫活性评价以及生物体病原学研究等诸多领域。
ELISA试剂盒的工作原理主要包括抗原与抗体的结合、酶的结合与产物的检测等环节。
首先呈现的是抗原及抗体的结合,抗原及抗体在液体相中可以特异性地结合;其后的酶的结合是将抗原及抗体结合后,利用具有特异性的金属蛋白酶,将酶与抗原结合,从而使得结合物数量上有所增加;最后一步是检测,也就是检测酶结合物产生的数量上的增加,从而获取结果。
ELISA试剂盒的优势如下:1、ELISA试剂盒测定结果灵敏,且能够进行大规模检测;2、较快,能将一个检测过程缩短到几个小时;3、机器操作简单,操作步骤以及参数设置较为容易;4、一次可进行大量检测,可降低成本;5、器具配置简单,耗材容易获得,操作较为方便;6、安全性较高,可大幅减少辐射风险;7、节省时间和成本,跨学科的分析。
意大利盐酸克伦特罗ELISA试剂盒

盐酸克伦特罗ELISA试剂盒1.简要信息此试剂盒可以定量检测血清,尿,牛奶,奶粉,肝,饲料,眼等样品中的盐酸克伦特罗浓度。
可做96个检测2.介绍β-agonists药物是用来治疗人体和兽医的喘息病,过量的摄入 β-agonists将会使脂肪转化为肌肉组织。
在欧盟,家畜养殖过程中使用这种药物是非法的。
近年来使用盐酸克伦特罗或者其他B-动物兴奋剂导致的中毒事件也有不断的报道。
检测生物样品中的盐酸克伦特罗可以使用酶联免疫方法的筛选可以在短时间内检测大批量的样品。
尿样不需要前处理可以直接使用,而饲料和其他生物样品只需要简单的前处理。
3.使用方向此试剂盒是利用竞争酶联免疫方法检测 β-agonists药物残留,适合于检测人体,牛和猪的尿样,血清,以及眼,肝,饲料,牛奶和奶粉。
不需要样品纯化,对于尿和血清样品不需要前处理直接使用,对于其他生物样品的前处理也是非常快速的。
4.检测原理此试剂盒是在包被有山羊抗兔IgG的塑料微孔板上操作,克伦特罗标准品,样品,酶联结合物以及兔抗 β-agonists抗体加入到微孔中。
在培养期间,游离的 β-agonists和标记有酶的 β-agonists竞争于抗 β-agonists抗体结合,抗克伦特罗抗体和固定在微孔壁上的山羊抗兔IgG结合。
任何没有结合的酶联结合物在冲洗阶段,酶的活性是由加入的显色酶底物的量决定。
酶把无色的染色剂转变成蓝色,加入终止液后是微孔从蓝色变成黄色,然后通过450nm酶标仪读数,颜色的密度和样品中 β-agonists的浓度成反比。
5.提供的试剂●微孔板(12×8):包被有山羊抗兔IgG●标准液:7瓶不同浓度的克伦特罗标准溶液(1ml容量),分别是0ppb, 0.15ppb, 0.3ppb, 0.6ppb, 1.25ppb,2.5ppb, 5ppb,白色盖子的玻璃瓶。
●抗 β-agonists抗体:12ml的蓝色盖玻璃瓶●酶联结合物:12ml的红色安培瓶●10倍浓缩的冲洗液:50mL的塑料瓶●底物溶液:24mL的塑料安培瓶●终止液:1瓶白色盖子的9ml溶液6.实验需要但是没有提供的材料样品准备过程:-盐酸-氢氧化钠-枯草杆菌蛋白酶-磷酸缓冲液-Ultra-turrax-平板离心机-研磨-天平-PH计检测过程:-20-200ul的可调精确微量加样枪以及加样头-50-200ul的可调多道微量加样枪以及加样头-450nm的酶标仪7.使用者需要的警告和注意点- 只能做提外检测- 试剂包含防腐剂,终止液包含硫酸具有腐蚀性。
酶联免疫吸附法(ELISA)检测鸡肉中氯霉素

酶联免疫吸附法(ELISA)检测鸡肉中氯霉素薛金英【摘要】氯霉素(Chloramphenicol,CAP)是一种广谱抗生素.具有良好的抗菌效果且价格低廉,广泛应用于家禽的各种传染性疾病的治疗.但是氯霉素对造血系统有严重不良反应,主要是抑制骨髓造血机能.因此,找到一种快速、简便而又准确的检测方法成为了业界十分关注的课题.传统上常用HPLC与TLC来作为抗生素检测的方法,但效率低、灵敏度也达不到要求.酶联免疫吸附法经笔者实践证明,操作简便、试验过程短、检测样品多,特异性高,且检测灵敏度最低可达0.01μg/L.【期刊名称】《中国动物保健》【年(卷),期】2016(018)010【总页数】2页(P79-80)【关键词】ELISA;鸡肉;氯霉素【作者】薛金英【作者单位】山东省诸城市畜牧兽医管理局山东潍坊262200【正文语种】中文采用直接竞争ELISA法检测样品中的氯霉素。
包被抗原与加入的标准品或待测样品竞争抗体,加入酶标记物,酶标记物与抗体结合。
通过洗涤除去游离的抗原、抗体及抗原抗体复合物。
加入底物液,使结合到板上酶标记物将底物转化为有色产物。
加入终止液,在450 nm处测定吸光度值与试样中氯霉素的自然对数成反比。
1)仪器耗材:微孔板酶标仪(450 nm)、电子天平、振荡器、均质机、离心机、氮吹仪、离心管和玻璃试管、可调式5 μL~50 μL、20 μL~200 μL和100 μL~1000 μL微量移液器、拍板纸。
2)试剂:乙酸乙酯(分析纯)、正己烷(分析纯)、去离子水或蒸馏水。
3)检测试剂盒组成:包有氯霉素抗体的微孔板、氯霉素标准品溶液(0号:0μg/L;1号:0.02μg/L;2号:0.06μg/L;3号:0.18μg/L;4号:0.36μg/L;5号:0.72μg/L)、20×浓缩洗涤液、10×浓缩样品复溶液、5×氯霉素标记HRP溶液、底物A溶液、底物B溶液、终止液、封板膜。
ELISA技术在生物医学研究中的应用

ELISA技术在生物医学研究中的应用ELISA(Enzyme-Linked Immunosorbent Assay)是一种灵敏、特异性强的免疫学实验技术,被广泛应用于生物医学研究中。
本文将从ELISA技术的基本原理、优势和应用实例三个方面探讨其在生物医学研究中的应用。
一、ELISA技术的基本原理ELISA技术是利用酶和抗原、抗体之间的特异性反应,通过酶的催化作用来检测分析样品中的特定抗原或抗体的一种实验技术。
该技术的基本原理包括以下几个步骤:1.样品预处理:将需要检测的样品与试剂反应前进行必要的处理,如稀释、去除干扰物等。
2.抗原或抗体的固定:将固定抗原或抗体的标板孔,分别加入待测样品以及控制样品(阳性、阴性对照)。
3.特异性结合:加入检测抗体,与待测样品中需要检测的抗原结合,在标板孔内形成复合物。
4.可视化检测:加入酶标记二级抗体,形成复合物,然后加入催化酶底物,使得酶底物转化为有色物质,最后记录检测结果。
二、ELISA技术的优势ELISA技术在生物医学研究中具有以下优势:1.高灵敏度和特异性:ELISA技术采用抗原和抗体的特异性结合,使其检测结果具有高灵敏度和特异性。
2.简单易操作:ELISA技术需要简单的操作步骤、易于标准化,使其在各种实验室中广为应用。
3.多样化应用:ELISA技术不仅可以检测抗体和抗原之间的结合情况,也可以检测其他生物大分子和小分子的相互作用,如蛋白质酶等。
4.大批量高通量:ELISA技术可以同时检测多个标本,可用于高通量的分析,包括大规模生物样本的筛查。
三、ELISA技术在生物医学研究中的应用实例1.检测疾病标志物ELISA技术可以检测人体内的不同标志物,如肿瘤标志物、生物分子等,以便于疾病的早期诊断和治疗。
2.检测病原体ELISA技术可以检测各种细菌、病毒、真菌等病原体的抗体,可用于感染性疾病的诊断和治疗。
3.酶活性分析ELISA技术可以分析不同酶的活性和酶底物的结合情况,可用于研究酶功能、酶动力学等问题。
elisa优点及用途

elisa优点及用途Elisa是一种常用的免疫学实验方法,它可以检测样本中特定抗原或抗体的存在。
Elisa具有许多优点,包括高灵敏度、高特异性、简单易操作、快速结果等。
因此,Elisa被广泛应用于生物医学研究、临床诊断和药物开发等领域。
一、Elisa的基本原理1.1 免疫反应Elisa是一种免疫学实验方法,其基本原理是利用抗原与抗体之间的特异性结合来检测样品中特定抗原或抗体的存在。
在免疫反应中,抗原与相应的抗体结合后形成不溶性复合物,这种复合物可以通过各种方式进行检测。
1.2 酶标记技术为了增强检测信号,常采用酶标记技术。
在酶标记技术中,将酶与抗体或抗原结合,并通过加入底物使其产生可检测的信号。
例如,在ELISA中常使用辣根过氧化物酶(HRP)或碱性磷酸酶(AP)作为标记酶。
二、Elisa的优点2.1 高灵敏度Elisa具有高灵敏度,可以检测到非常低浓度的抗原或抗体。
这使得Elisa成为许多疾病的早期诊断工具,例如艾滋病、乙肝和结核病等。
2.2 高特异性Elisa具有高特异性,可以区分不同种类的抗原或抗体。
这使得Elisa 成为一种非常可靠的检测方法,可以避免假阳性或假阴性结果。
2.3 简单易操作Elisa操作简单易学,不需要复杂的仪器和技术。
因此,即使是没有专业实验室背景的人也可以进行该实验,并获得准确可靠的结果。
2.4 快速结果Elisa通常可以在几小时内完成,并且可以同时处理多个样品。
这使得它成为一种快速而高效的检测方法。
三、Elisa的应用领域3.1 生物医学研究在生物医学研究中,Elisa被广泛应用于检测各种生物分子,如蛋白质、激素、细胞因子和药物等。
通过使用不同的抗体或抗原对进行标记,可以定量分析这些生物分子的含量,以及它们在不同疾病状态下的变化。
3.2 临床诊断Elisa被广泛应用于临床诊断中,例如检测传染病、肿瘤标志物、自身免疫性疾病等。
通过检测血液、尿液或其他体液中的特定抗原或抗体,可以帮助医生诊断和治疗各种疾病。
酶联免疫吸附测定法ELISA在抗生素残留检测中的应用

加强国际合作与交流
加强与其他国家和地区的合作与交流,共同推进ELISA技术在抗生素 残留检测领域的发展和应用。
07 参考文献
参考文献
1 2
参考文献1
介绍了ELISA的基本原理和在抗生素残留检测中 的应用,强调了其高灵敏度和特异性。
抗生素残留的来源
畜牧业和农业中广泛使用抗生素,导致动物产品如肉类、蛋类和奶制品中存在 抗生素残留。
ELISA技术简介
01
酶联免疫吸附测定法(ELISA)
是一种基于抗原-抗体反应的检测方法,通过酶标记技术将免疫反应与
化学信号放大相结合,实现对目标物质的灵敏检测。
02
ELISA技术的优点
高灵敏度、特异性、操作简便、适合批量检测等。
03 ELISA在抗生素残留检测 中的应用
抗生素残留检测的重要性
保障食品安全
抗生素残留超标可能对人体健康造成危害, 如产生过敏反应、耐药性等,因此对抗生素 残留进行检测是保障食品安全的重要环节。
国际贸易标准
随着国际贸易的发展,各国对抗生素残留 的检测标准日益严格,符合国际标准的检 测方法对于出口农产品的企业至关重要。
酶联免疫吸附测定法(ELISA)在 抗生素残留检测中的应用
目录
• 引言 • ELISA技术原理 • ELISA在抗生素残留检测中的应用 • ELISA技术的实验流程 • 实验结果和数据分析 • 结论 • 参考文献
01 引言
抗生素残留问题
抗生素残留对人类健康的潜在威胁
长期摄入含有抗生素残留的食物可能增加人体内耐药菌株的形成,降低抗生素 在治疗疾病时的有效性。
03
ELISA技术的基本原理
第四代酶联免疫法

第四代酶联免疫法第四代酶联免疫法(Fourth-generation enzyme-linked immunosorbent assay,简称ELISA)是一种高灵敏度的免疫测定方法,广泛应用于医学、生物学、生物工程等领域。
相比于传统的ELISA方法,第四代ELISA具有高灵敏度、快速性和高特异性的特点,因此在临床诊断和科学研究中具有非常重要的地位。
第四代ELISA相比于第三代ELISA在试剂盒和设备上有所改进,主要有以下几个方面的创新。
第四代ELISA使用了双抗体夹心法同时检测抗体和抗原,相比于第三代ELISA只检测抗体,可以提高检测的灵敏度和准确性。
传统的ELISA方法只检测抗体,可能会产生假阴性结果,而第四代ELISA可以同时检测抗体和抗原,大大降低了假阴性的可能性。
第四代ELISA在抗原检测上采用了多联抗原检测方法。
传统的ELISA方法只能检测单一的抗原,而第四代ELISA可以同时检测多种抗原,减少了检测时间和成本,提高了检测效率。
这对于快速诊断和筛查大量样本的临床实验室非常重要。
第四代ELISA最大的创新之处就是引入了光触发酶系统。
常见的ELISA方法是使用酶作为标识物,通过底物的颜色变化来检测抗体或抗原的含量。
而第四代ELISA使用了光触发酶系统,可以在短时间内产生大量的底物,从而大大提高了检测的灵敏度和准确性。
光触发酶系统使用激光或红外线激活酶,从而产生荧光信号,通过荧光信号的强弱可以确定抗体或抗原的含量。
这种方法可以检测极低浓度的抗体或抗原,对于一些重要的检测指标具有非常重要的临床意义。
第四代ELISA在医学领域的应用非常广泛。
它可以用于检测病毒、细菌、寄生虫等微生物感染,如艾滋病、乙肝、梅毒等。
此外,第四代ELISA还可以用于检测肿瘤标志物、药物残留物和激素水平等,为临床诊断和治疗提供重要的实验数据。
总结起来,第四代ELISA是一种高灵敏度、快速性和高特异性的免疫测定方法。
它采用了双抗体夹心法、多联抗原检测和光触发酶系统的创新技术,可以提高检测的准确性和灵敏度。
专家对ELISA试剂盒的评价

专家对ELISA试剂盒的评价ELISA试剂盒是一种十分常用的定性定量方法,人体和动物、体外细胞培养中超过80%蛋白定量都使用其作为检测的手段。
ELISA试剂盒价格一般非常昂贵,但各家试剂公司的质量却良莠不齐。
ELISA的试剂盒有用于科研的,也有用于临床诊断的。
应用于临床诊断的试剂盒必须有卫生部的许可文号,国家对应用于临床诊断的试剂盒有严格的规定和要求,制定相关的手则来管理试剂盒的质量。
仔细阅读说明书,对说明书的内容有一个详细的了解。
审查内容包括:1. )+(测定指标)+酶联免疫试剂盒(ELISA)”,物种和测定指标不能搞错,否则买错了就是你的事情;另外有的试剂盒说明书试剂盒名称明显与写在试剂盒上的名称不符,这要引起你的警惕。
2. 用途:应用于科研还是临床诊断,用于临床诊断的有卫生部的批准文号。
3. 测定原理:现在ELISA试剂盒除非是测定抗体的以外,一般使用的是双抗体夹心法,此种方法大多数用的是增强的双抗体夹心法,即使用生物素-亲和素系统,还有少数的指标可能使用竞争法,这类方法适用于半抗原的测定。
具有复杂结构的多表位蛋白抗原,其双抗体夹心法中的一个抗体必须用单抗,否则背景很高。
当然如果两个都是单抗(这两个单抗针对不同表位),那么测定的线性范围就较宽,试剂盒性能就较好;一个用单抗,一个用多抗,测定的灵敏度会较高。
某些简单的化合物用ELISA测定时,因为没有两个或以上的表位,一般只能作为半抗原,只能用竞争法测定。
如果你发现有测定简单化合物(如雌激素、NO、地高辛等)用双抗体夹心法作测定原理时,这个试剂盒你就要怀疑了。
另外还要说明一步双抗体夹心法与两步双抗体夹心法的区别。
一步双抗体夹心法的吸光度-剂量曲线呈钟形,随着待则标本中抗原浓度的增加而升高至一定程度后,测定吸光度即随抗原浓度的增加而开始下降直至不显色,即所谓的“钩状效应”(hook eHect),也就是我们在免疫沉淀试验中所称的“带现象”(zone phenomenon)。
氯霉素ELISA检测试剂盒的评价及初步改进的开题报告

氯霉素ELISA检测试剂盒的评价及初步改进的开题报告一、研究背景和意义氯霉素是一种广谱抗生素,常用于畜禽生产中防治疾病。
然而,氯霉素过量或滥用会导致残留,从而威胁食品安全和人民健康。
因此,监管部门需要对食品中的氯霉素残留进行监测和控制。
目前,检测氯霉素残留的方法主要有高效液相色谱法、气相色谱法和质谱法等。
但是,这些方法需要昂贵的设备和技术人员,而且耗时长、操作繁琐。
因此,建立一种简便、快速、准确的检测方法显得尤为必要。
近年来,酶联免疫吸附法(ELISA)作为一种快速、准确、经济的检测手段,已经被广泛应用于生物医学、食品安全等领域。
针对氯霉素残留的检测,已经有不少商业化的氯霉素ELISA检测试剂盒上市,但是这些商业化试剂盒仍存在一些问题,如灵敏度不高、特异性差等。
因此,有必要对商业化的氯霉素ELISA检测试剂盒进行评价,并根据评价结果对其进行改进,提高其灵敏度和特异性,以满足监管部门对氯霉素残留的检测需求。
二、研究目的和内容本研究的主要目的是对商业化的氯霉素ELISA检测试剂盒进行评价和改进,提高其灵敏度和特异性。
具体研究内容包括:1.对不同厂家生产的氯霉素ELISA检测试剂盒进行评价,包括灵敏度、特异性、准确性等指标的检测。
2.对商业化试剂盒进行改进,提高其灵敏度和特异性。
改进方法可能包括抗体筛选、反应体系优化等。
3.优化试剂盒使用的操作流程,简化操作步骤,提高检测效率。
三、研究方法1.试剂盒的评价采用标准曲线法,对不同厂家生产的氯霉素ELISA检测试剂盒进行检测,包括灵敏度、特异性、准确性等指标的评价。
2.试剂盒的改进针对商业化试剂盒存在的问题,通过抗体筛选、反应体系优化等方法进行改进,并对改进后的试剂盒进行验证。
3.操作流程的优化通过简化试剂盒的操作流程,提高试剂盒的使用效率和检测精度。
四、预期结果通过评价和改进商业化的氯霉素ELISA检测试剂盒,预计可以得到以下结果:1.对不同厂家生产的氯霉素ELISA检测试剂盒的性能进行全面评价,并筛选出性能较好的试剂盒。
ELISA实验中各种方法原理及优缺点比较
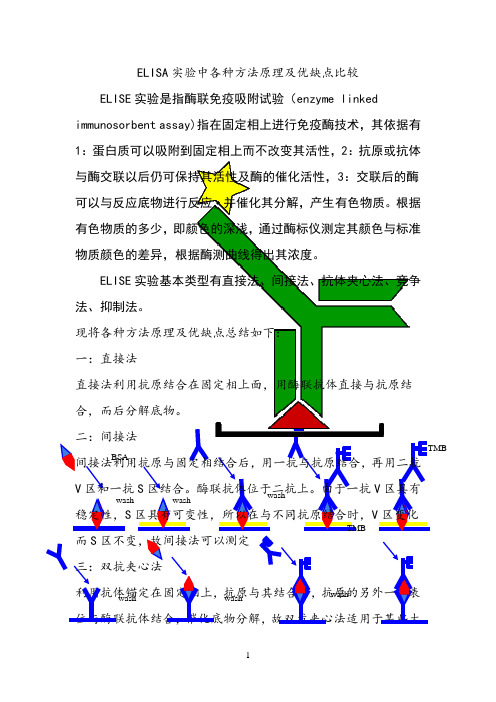
wash BSA
wash wash TMB
ELISA 实验中各种方法原理及优缺点比较
ELISE 实验是指酶联免疫吸附试验(enzyme linked
immunosorbent assay)指在固定相上进行免疫酶技术,其依据有1:蛋白质可以吸附到固定相上而不改变其活性,2:抗原或抗体与酶交联以后仍可保持其活性及酶的催化活性,3:交联后的酶可以与反应底物进行反应,并催化其分解,产生有色物质。
根据有色物质的多少,即颜色的深浅,通过酶标仪测定其颜色与标准物质颜色的差异,根据酶测曲线得出其浓度。
ELISE 实验基本类型有直接法、间接法、抗体夹心法、竞争法、抑制法。
现将各种方法原理及优缺点总结如下:
一:直接法
直接法利用抗原结合在固定相上面,用酶联抗体直接与抗原结合,而后分解底物。
二:间接法
间接法利用抗原与固定相结合后,用一抗与抗原结合,再用二抗V 区和一抗S 区结合。
酶联抗体位于二抗上。
由于一抗V 区具有稳定性,S 区具有可变性,所以在与不同抗原结合时,V 区变化
而S 区不变,故间接法可以测定
三:双抗夹心法
利用抗体锚定在固定相上,抗原与其结合后,抗原的另外一个表位与酶联抗体结合,催化底物分解,故双抗夹心法适用于某些大
TMB
wash wash
wash
分子的具有至少双表位的抗原
四:竞争法
竞争法是指针对抗原上同一抗原表位,分别用抗体与酶联抗体先后与其结合,抗体占据表位后,
故催化底物反应的能力相应下降。
子或只有一个抗原表位或重复抗原表位的抗原。
wash wash
TMB。
血清素ELISA试剂盒功能参数及相关应用文献

血清素ELISA试剂盒功能参数及相关应用文献血清素ELISA试剂盒内包含了血清素Serotonin ELISA所需的所有试剂和相关组份。
简单快捷的方案设计和优化的试剂配比,为全球科研工作者提供合适的Serotonin ELISA实验分析方案。
名称血清素ELISA试剂盒血清素ELISA试剂盒特点:1、试剂盒内含有分析所需的所有必需试剂,操作简单便捷;2、试剂盒内组分经实验优化,确保更高的检测灵敏度参考文献:1.Galectin-1 and platelet factor 4 (CXCL4) induce complementary platelet responses in vitro. Annemiek Dickhout, Bibian M E Tullemans, Johan W M Heemskerk, Victor L J L Thijssen, Marijke JE Kuijpers, Rory R Koenen.PLoS One. 2021 Jan 7;16(1):e0244736. doi:10.1371/journal.pone.0244736. eCollection 2021.2.Interleukin-33 Promotes Serotonin Release from Enterochromaffin Cells for Intestinal Homeostasis.Zuojia Chen, Jialie Luo, Jian Li, Girak Kim, Andy Stewart, Joseph F Urban Jr, Yuefeng Huang, Shan Chen, Ling-Gang Wu, Alexander Chesler, Giorgio Trinchieri, Wei Li, Chuan Wu.Immunity. 2021 Jan 12;54(1):151-163.e6. doi: 10.1016/j.immuni.2020.10.014. Epub 2020 Nov 20.3.SSRI-reduced platelet reactivity in non-responding patients with life-long Recurrent Depressive Disorder: Detection and involved mechanisms.Aleksovski B, Neceva V, VujovićV, Manusheva N, Rendevski V, Novotni A, Filipce A, Spasovska A, Sofijanova A, Aleksovski V, Gjorgoski I.Thromb Res. 2018 May;165:24-32. doi: 10.1016/j.thromres.2018.03.006. Epub 2018 Mar 10.4.Role of estrogen receptor beta in neural differentiation of mouse embryonic stem cells. Varshney MK, Inzunza J, Lupu D, Ganapathy V, Antonson P, Rüegg J, Nalvarte I, Gustafsson JÅ.ProcNatl Acad Sci U S A. 2017 Nov 13. [Epub ahead of print]5.Noradrenaline, Serotonin, GABA, and Glycine in Cerebrospinal Fluid during Labor Pain: A Cross-Sectional Prospective Study.Chalermkitpanit P, Thonnagith A, Engsusophon P, Charuluxananan S, Honsawek S.Pain Res Manag. 2017;2017:2752658. doi: 10.1155/2017/2752658. Epub 2017 Jun 18.6.Randomised clinical trial: the analgesic properties of dietary supplementation with palmitoylethanolamide and polydatin in irritable bowel syndrome.Cremon C, Stanghellini V, Barbaro MR, Cogliandro RF, Bellacosa L, Santos J, Vicario M, Pigrau M, Alonso Cotoner C, Lobo B, Azpiroz F, Bruley des Varannes S, Neunlist M, DeFilippis D, Iuvone T, Petrosino S, Di Marzo V, Barbara G.Aliment Pharmacol Ther. 2017 Apr;45(7):909-922. doi: 10.1111/apt.13958. Epub 2017 Feb 6.7.The modulation role of serotonin in Pacific oyster Crassostrea gigas in response to air exposure. Dong W, Liu Z, Qiu L, Wang W, Song X, Wang X, Li Y, Xin L, Wang L, Song L.Fish Shellfish Immunol. 2017 Mar;62:341-348. doi: 10.1016/j.fsi.2017.01.043. Epub 2017 Jan 31.。
ELISA试剂盒进口大鼠的用途和优势

ELISA试剂盒进口大鼠的用途和优势
ELISA的基础是抗原或抗体的固相化及抗原或抗体的酶标记。
结合在固相载体表面的抗原或抗体仍保持其免疫学活性,酶标记的抗原或抗体既保留其免疫学活性,又保留酶的活性。
在测定时,受检标本(测定其中的抗体或抗原)与固相载体表面的抗原或抗体起反应。
用洗涤的方法使固相载体上形成的抗原抗体复合物与液体中的其他物质分开。
再加入酶标记的抗原或抗体,也通过反应而结合在固相载体上。
此时固相上的酶量与标本中受检物质的量呈一定的比例。
加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,故可根据呈色的深浅进行定性或定量分析。
由于酶的催化效率很高,间接地放大了免疫反应的结果,使测定方法达到很高的敏感度。
ELISA可用于测定抗原,也可用于测定抗体。
然而,影响Elisa试验结果的因素很多,故加强各个环节的质量保证才能充分发挥其方法学的优点。
二.优势
1、、灵敏、特异的抗体;
2、稳定的重复性和可靠性;
3、吸附性能好,空白值低,孔底透明度高的固相载体;
4、适用血清、血浆、组织匀浆液、细胞培养上清液、尿液等等多种标本类型;
5、节省实验经费。
精品资料欢迎下载。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Valukine TM ELISA试剂盒优势及参考文献
提起R&D Systems ELISA试剂盒,圈里的伙伴们都会竖起大拇指赞不停。
众所周知,RD 是引用最广的ELISA试剂盒生产商,据统计,44个高影响因子杂志的860篇文献中有433篇使用了ELISA试剂盒,RD以41.8%的绝对优势名列第一。
Valukine TM ELISA试剂盒采用夹心法ELISA原理,用于天然和重组蛋白分子的检测,精确定量人、小鼠和大鼠中最常用的蛋白指标。
其所有组分均源自于美国,保证了ELISA检测的准确性、灵敏度、重复性和特异性。
产品优势:
✓操作简便:4h完成实验流程
✓高度优化,实验重复性高:精选最佳抗体对,严格QC把控
✓稳定性、灵敏度高和精确度高
✓较宽的检测范围:1-103 pg/ml
✓详细的产品说明书
奉上一波valukine试剂盒引用文献供大家参考:
Gao, A., et al. (2017). Biomaterials PTFE surface for antithrombogenicity, endothelialization and anti-in fl ammation. Biomaterials, 140, 201–211.
Feng, X., et al. (2017). Dying glioma cells establish a proangiogenic microenvironment through a caspase 3 dependent mechanism. Cancer Letters, 385, 12–20.
Xu, S., et al. (2017). Original Article PKC / NADPH oxidase are involved in the protective effect of pioglitazone in high homocysteine-induced paracrine dyfunction in endothelial progenitor cells. Am J Transl Res, 9(3), 1037–1048.
Li, H., et al. (2016). mTORC1-mediated downregulation of COX2 restrains tumor growth caused by TSC2 deficiency. Oncotarget, 7(19).
Carolina, N. (2015). Megalin / Cubulin-Lysosome-mediated Albumin Reabsorption Is Involved in the Tubular Cell Activation of NLRP3 Inflammasome and Tubulointerstitial Inflammation. JOURNAL OF BIOLOGICAL CHEMISTRY, 290(29), 18018–18028.
Feng, X., et al. (2015). Caspase 3 in dying tumor cells mediates post-irradiation angiogenesis. Oncotarget, 6(32).
Zhang, Q., et al. (2015). CD11b deficiency suppresses intestinal tumor growth by reducing
myeloid cell recruitment. Scientific reports, 1–12.
Zhang, J., et al. (2015). Methylation of suppressor of cytokine signalling 1 gene promoter is associated with acute-on-chronic hepatitis B liver failure. Journal of Viral Hepatitis, 307–317. Zhang, Y., et al. (2014). Expression and Functional Characterization of NOD2 in Decidual Stromal Cells Isolated during the First Trimester of Pregnancy. Plos one, 9(6), 1–9.
Jiang, W., et al. (2014). miR-146a Ameliorates Liver Ischemia / Reperfusion Injury by Suppressing IRAK1 and TRAF6. Plos one, 9(7), 1–12.
Wang, Q., et al. (2013). Soluble Interleukin-6 Receptor-Mediated Innate Immune Response to DNA and RNA Viruses, 87(20). Journal of Virology, 11244–11254.
Zuo, Q., et al. (2013). Evaluation of the Protective Immunity of a Novel Subunit Fusion Vaccine in a Murine Model of Systemic MRSA Infection. Plos one, 8(12).。
