化学化学式与化合价第三课时
化学式和化合价3
化合价的应用 —— 写离子符号
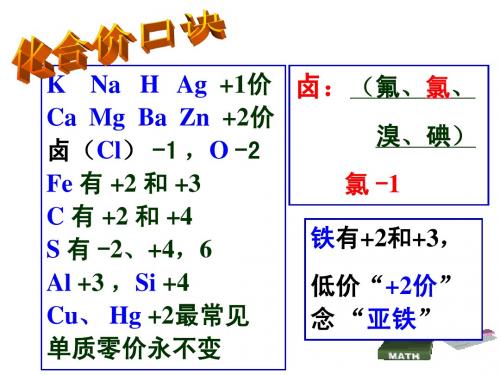
K
+ 2+
Na Mg
+ 2+
H Ba
3+
+
Ag Zn
+
2+
Ca
Cl
2+
-
O
2-
Fe 亚铁离子
2+
Fe 铁离子
S 硫离子
+16 +17 2 8 8
2-
+16 +17 2 8 6
得 2e 带2个单位负电荷
硫原子:S
硫离子:S2-
化合价的应用 —— 写离子符号
+1 -1 -1 NH4 OH NO3 铵根 氢氧根 硝酸根 -2 -2 -3 CO3 SO4 PO4 碳酸根 硫酸根 磷酸根
NH4
+
OH
-
NO3
-
CO3
2-
SO4
2-
PO4
3-
温故知新
★ 元素符号的意义: H —— 氢元素,一个氢原子
(宏观)
(微观)
★ 化学式的意义(H2O):
(1)表示水这种物质;
(2)表示水由氢元素和氧元素组成;
(3)表示一个水分子; 微观
宏观
(4)表示一个水分子由两个氢原子和一个氧原子构成。
温故知新 数字的意义
+7 +6
KMnO4 高锰酸钾
K2MnO4 锰酸钾
原子团:
MnO4 高锰酸根
-1
MnO4 锰酸根
-2
(三)求原子团中带点元素化合价
在原子团中,正负化合价的代数和也等于零吗?
NO3
SO4 -3 +5
CO3
NH4
NH4NO3
巩固练习
FeCl3 、Ca(ClO)2、KClO3、HClO4、Cl2、
化合价教案

化合价教案(总7页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--课题4 化学式与化合价一、教学目标1.知识与技能(1)、了解常见元素及原子团的化合价;(2)、能用化学式表示某些物质的组成,并能利用化合价推求化学式;(3)、了解相对分子质量的涵义,并能利用相对原子质量和相对分子质量计算物质的组成;(4)、能看懂某些商品标签或说明书上标示的物质成分和含量。
2.过程与方法:(1)、通过对图、表的观察,让学生学会对学过的知识进行整理归纳并初步运用;(2)、通过讨论交流、活动探究,培养学生利用所学的知识解决实际问题的能力和基本计算能力;3.情感、态度与价值观:(1)、通过自编化合价口诀,激发学生的学习兴趣和求知欲;(2)、通过讨论交流、活动探究,发展学生善于合作、勤于思考、勇于实践的精神。
二、教学资源分析本课题安排在第四单元的最后一部分,包括“什么是化学式”、“化合价”和“有关相对分子质量的计算”这三部分内容,它们是学习化学的重要工具,是“双基”的重要部分。
虽然有元素符号知识作为基础,但仍是初三化学学习中的知识分化点。
本课题的内容比较抽象,教材首先讲述了化学式的概念,以学生最熟悉的纯净物——水为例,介绍了化学式表示的意义;接着介绍化合价知识,并以推求五氧化二磷的化学式为例讲解推求的步骤和方法,在此基础上,介绍化学式的读法;最后是有关相对分子质量的计算。
课程标准对这些内容要求不高,故教学中不需要任意扩展与加深。
1教学策略分析在前面的学习中,学生已具有了有关元素符号的知识,用元素符号来表示某种元素,学生兴致很高;那么,对于物质能否用专门的符号来表示呢?学生对此的求知欲望很强。
但最基本的元素、原子团化合价的记忆却又是那么枯燥乏味,因此,教师要充分发挥学生的主观能动性,以试编口诀、讨论交流、活动探究等多种形式活跃课堂气氛,提高教学的效率。
2教学重、难点重点:化合价知识及其应用、有关相对分子质量的计算。
新课标人教版九年级化学化学式与化合价课件

第 一 课 时 作业
作业:P88 1 及时把前面学过的物质化学式试着写出来
订正作业: 1、4CO2 3K 8NO2 7N H2
1、将下列化学符号与示意图一一对应
A、2N
B、N2
①
②
C、2N2 ③ 2、化学式Fe3O4的读法是 ( C ) (A)铁三氧四 (B)三铁化四氧 (C)四氧化三铁 (D)三氧化二铁 3、下列符号N、N2、2N、2N2中 (1)既能表示氮气,又能表示一个氮分子的是 N2 。 (2)既能表示氮元素,又能表示一个氮原子的是 N 。 (3)只能表示2个氮原子的是 2N 。
+3 -2
PO
+3 -2
PO
+3 -2
省 略
P2O3
P2O3
(5) 写出这种化合物的化学式
化 合 价 的 计 算 小 结
问:如果碰到有原子团的化学式又怎样书写呢?如已知铝 为+3价,硫酸根(SO42-)为-2价,写出硫酸铝的化学式。 Al2(SO4)3 小 结 十字交叉法书写化学式的一般步骤: ①写出组成元素的符号:正价在前,负价在后; ②标出元素的化合价; ③定原子或原子团个数:
化合物化学式小结 原则:顺写反读 读作:某化某 注:原子个数为1省略不写
学 生 练 习
1、写出下列物质的化学式 铜 磷 氦气 四氧化三铁 氯化钠 Cu P He Fe3O4 NaCl 2、读出下列物质的名称 Au S Ne HgO KCI 金 硫 氖气 氧化汞 氯化钾 3、下列化学式中,书写错误的是 ( A ) A、氧化钙[OCa] B、氧化镁[MgO] C、三氯化铁 [FeCl3] D、三氧化硫[SO3] 4、下图表示气体分子的示意图,图中红圆圈和蓝圆圈分别 表示两种不同质子数的原子,其中表示化合物的是( D )
化学式与化合价导学案(课时3)

化学式与化合价导教案(课时3)一、学习目标(1)认识化学式的涵义,并能用化学式表示某些常有物质的组成。
(2)熟记某些常有元素及原子团的化合价。
(3)能用化合价推求化学式。
(4)认识相对分子质量的涵义,并能利用相对原子质量、相对分子质量进行物质构成的简单计算。
(5)能看懂某些商品标签或说明书上标示的物质成分及其含量。
二、学习重难点要点(1)化学式的书写(2)化学式的读写规律(3)常有元素的化合价(4)相关相对分子质量的计算难点(1)化学式的涵义(2)化合物化学式的读写规律(3)物质相对分子质量的计算三、自主研究一、学习导航二、阅读课文83-84 页,并达成以下填空1、用元素符号和数字的组合表示物质构成的式子,叫做_____。
2、写出以下物质的化学式(1)氧气 ___, (2) 水___,(3)二氧化碳 ___, (4)氮气 __, (5)氢气__, (6)四氧化三铁 ___, (7)硫___ , (8) 氯化钠 _____。
上述物质中属于单质的是 _____,属于化合物的是 _______。
3、化学式 H2O 的意义有: (1)表示 ________,(2)表示___________________, (3)表示 ___________________, (4)表示 ___________________。
4、由两种元素构成的化合物的名称,一般读作某化某。
例如 NaCl 读作 ______, P2O5 读作 ______, SO2 读作 ______。
【合作学习与研究】1、每种物质的构成是固定不变的,所以每种物质的化学式只有 ___个。
2、物质的构成是经过实验测定的,所以化学式的书写一定依照 _______。
3、化学式的书写分单质化学式书写和化合物化学式书写(1)单质化学式书写①由原子直接构成的物质,用_____表示。
比如:硫___,磷___,铁 ___,氦气 ____;②双原子分子或多原子分子构成的单质,用__________________________ 表示。
人教版九年级化学上册作业课件 第四单元自然界的水 课题4 化学式与化合价 第3课时 有关化学式的计算

16.(衡阳中考)某石灰石样品中含有不含钙元素的杂质,测得该石灰石 样品中含钙的质量分数为36%,该样品中碳酸钙的质量分数为( D ) A.36% B.40% C.72% D.90%
17.(绥化中考)蛋白质是由丙氨酸(化学式为C3H7NO2)等多种氨基酸构 成的。根据丙氨酸的化学式计算:
(1)C3H7NO2的相对分子质量是_8_9__。 (2)丙氨酸中各元素的质量比C∶H∶N∶O=___3_6_∶__7_∶__1_4_∶__3_2_______。 (3)丙氨酸中氮元素的质量分数约为__1_5_._7_%________(结果保留0.1%)。 (4)8.9 g C3H7NO2中含有氢元素的质量是____0_.7_______g。
9.(绵阳游仙区期中)早期治疗疟疾的药物是奎宁碱(化学式为 C20H24N2O2),现在普遍使用的是我国科学家发现的青蒿素(化学式为 C15H22O5),下列说法正确的是( D ) A.奎宁碱和青蒿素分别在氧气中完全燃烧的产物相同 B.奎宁碱的相对分子质量为324 g C.青蒿素是由15个碳原子、22个氢原子、5个氧原子构成的 D.奎宁碱中氮元素的质量分数约为8.64%
人教版
第四单元 自然界的水
课题4 化学式与化合价
第3课时 有关化学式的计算
知识点❶:计算相对分子质量和物质组成元素的质量比 1.相对分子质量是指化学式中___各__原__子__的__相__对__原__子__质__量__的__总__和____。 2.元素的质量比=化学式中各原子的 ______相__对__原__子__质__量_________×___相__应__原__子__个__数______之比。
19.科学家在-100 ℃条件下合成了物质X(分子模型如图,其中 代表 碳原子, 代表氢原子)。
化学式与化合价第3课时+精品教案

课题4 化学式与化合价课时3一、教学目标1.了解相对分子质量的含义,并能利用相对原子质量和相对分子质量进行物质组成的计算。
2.能看懂某些商品标签或说明书上标识的物质成分和含量。
二、教学重难点重点:进行有关相对分子质量、元素的质量比和某元素质量分数的计算。
难点:物质中某元素质量分数的计算和物质质量与元素质量之间的换算。
三、教学准备教师准备:多媒体课件四、教学过程元素的原子个数与它的相对原子质量乘积之间的比值。
如:计算二氧化碳(CO2)中碳元素(C)和氧元素(O)的质量比。
【解答】m(C):m (O)=12:(16×2)=12:32=3:8.【注意事项】在计算物质组成元素的质量比时,要注意一下几点:①看清各元素质量比的顺序;②结果约简成最简整数比;③区分元素质量比与原子个数比。
④某些物质的化学式中,同种元素并不写在一起的,这时要注意原子个数。
⑤【练习】计算:Ca(OH)2、H2O2、NH4NO3下列物质中各元素的质量比。
(H-1 C-12 N-14 O-16)Ca(OH)2中钙、氧、氢元素的质量比=40:(16×2):(1×2)=20:16:1H2O2中氢、氧元素的质量比=1×2:16×2=1:16NH4NO3中氮、氢、氧元素的质量比=(14×2) :(1×4) :(16×3)=7:1:124.计算物质中某元素的质量分数【讲解】某元素的质量分数(ω),就是该元素的质量与组成物质的元素总质量之比,可根据化学式计算。
即:如:计算NH4NO3中氮元素的质量分数。
(H-1 N-14 O-16)【解答】步骤1:NH4NO3的相对分子质量=14×2+1×4+16×3=80;步骤2:NH4NO3中氮元素的质量分数===35%。
【练习】计算:CaCO3中碳元素的质量分数。
(Ca-40 C-12 N-14 O-16)CaCO3中碳元素的质量分数=【练习】计算:某新型胃药的一个分子中含有5个氮原子,其中氮原子的质量分数约为35%,则其相对分子质量为多少?【练习】如图为某分子的结构模型,请回答下列问题:(C-12 O-16)(1)该分子的化学式为________,其相对分子质量为______。
课题4 化学式与化合价 第3课时 基本计算 有关相对分子质量的计算

相对原子质量 C-12
三、有关化学式的计算
O-16
2、计算物质组成元素的质量比 注:一般化成最简整数比 元素的质量比=各原子的相对原子质量乘以
各原子个数之后再相比
书写格式:
例2:计算二氧化碳(CO2)中碳元素和氧元素的质量比。
二氧化碳(CO2)中
C : O = 12 : (16×2)= 3 : 8
相对分子质量=各原子的相对原子质量乘以 各原子个数之后再相加 例1:计算O2、H2O、2H2O的相对分子质量 书写格式: Mr(O2) = 16×2=32 Mr(H2O) =1×2 + 16=18 Mr(2H2O)= 2×(1×2 + 16)=36
练习1
相对原子质量Cl-35.5 H-1 S-32 O-16 Ca-40 N-14
小结
1、相对分子质量的概念; 2、有关化学式的计算: ①计算相对分子质量 ②计算物质组成元素的质量比 ③计算物质中的某元素质量分数
小结
计算下列物质的相对分子质量: ①氯气(Cl2) ②氢氧化钙[Ca(OH)2]
③硫酸(H2SO4) ④硝酸铵(NH4NO3)
解:①Mr(Cl2)=35.5×2=71
②Mr[Ca(OH)2]=40+16×2+1×2=74 =40+(16+1)×2=74 ③Mr(H2SO4)=1×2+32+16×4=98 ④Mr(NH4NO3)=14+1×4+14+16×3=80 =14×2+1×4+16×3=80
课前热身
找出下列化学式中原子个数比 H2O中氢原子与氧原子的个数比为 2:1 NH4NO3中氮原子与氧原子的个数比为 2:3 Ca(OH)2中钙原子与氢原子的个数比为 1:2 Cu(NO3)2中铜原子与氧原子的个数比为 1:6 拓展 在2H2O中,共有 4 个氢原子 , 2 个氧原子
人教版九年级化学教案:4.4化学式与化合价(第3课时)教学设计

- **及时反馈**:提醒学生按时提交作业,我会对作业进行及时批改和反馈,帮助学生了解自己的学习情况。
6.注重反馈与评价,激发学生的学习积极性。
-对学生的学习成果给予及时的反馈和评价,鼓励学生积极参与课堂,提高他们的自信心。
7.融入德育教育,培养学生的社会责任感。
-在教学中,穿插讲解化学知识在环保、资源利用等方面的应用,引导学生认识到化学知识对可持续发展的重要性。
四、教学内容与过程
(一)导入新课
本节课开始时,我将通过一个简单的互动实验导入新课。实验内容为制备二氧化碳,通过观察实验现象,引导学生思考化学反应的本质。在实验过程中,我会提出以下问题:“为什么石灰石与稀盐酸反应会产生气泡?”“这些气泡是什么气体?”通过这些问题,激发学生的好奇心,为讲解化学式与化合价的概念做铺垫。
-在教学过程中,教师应鼓励学生提问,并组织课堂讨论,让学生在互动中加深对化学式与化合价知识的理解。
4.利用多媒体辅助教学,丰富教学手段。
-使用多媒体课件、视频等教学资源,直观地展示化学实验现象和化学式的书写过程,提高教学效果。
5.设计分层作业,满足不同层次学生的学习需求。
-根据学生的认知水平和学习兴趣,设计不同难度的作业,使每个学生都能在完成作业的过程中得到提高。
2.理解化合价的概念,掌握化合价的使用规律,能够运用化合价推断未知化合物的化学式。
-学生应掌握化合价是元素在形成化合物时表现出来的一种相对稳定的原子价值,能够运用化合价规律,如化合价的代数和为零,来推导未知化合物的化学式。
3.能够运用化学式和化合价进行简单的计算,解决实际问题。
-学生通过案例分析,掌握如何使用化学式和化合价进行物质组成的计算,如计算某化合物中某一元素的质量分数等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NH4NO3
= 14x2 ×100%
80
=35%
∴150千克的硝酸铵中含有的N元素的质量为
× 150千克 35化%学化学=式5与化2合.5价第千三课克时
“化合物”与“元素”互 求 二、由元素的质量求化合物的质量
例:多少吨的硝酸铵中含有100吨的氮元素? 物质质量 = 元素质量÷元素质量分数
= 3 ︰8
例题2:计算硝酸铵(NH4NO3)中各元素的质量比 书写格式:
解:在NH4NO3中各元素的质量比
N : H : O = 14×2 : (1×4 ) : (16×3)
= 28 : 4 : 48 = 7 : 1 : 12
化学化学式与化合价第三课时
练一练: 1.计算氯酸钾中各元素的质量比
解:在KClO3中各元素的质量比
相对分子质量 概念:化学式中各原子的相对原子质量的 总和,就是相对分子质量。(符号为Mr)
如何理解相对分子质量
1、是化学式中各原子的相对原子质量的总和 2、是分子的相对质量 3、它的单位也是 1
化学化学式与化合价第三课时
三、有关化学式的计算
1、计算物质的相对分子质量=(相对原子质量×原子个数)之和
=35%
硝酸铵的质量为:100吨÷35%=285.7吨
化学化学式与化合价第三课时
【小结】
“化合物”与“元素”互
求
×元素%
m化合物
÷元素%
m元素
整体
部分
化学化学式与化合价第三课时
试计算: 8吨NH4NO3与多少吨NH4HCO3的 含氮元素质量相等?
解 : NH4NO3 的相对分子质量=80 NH4HCO3的相对分子质量=79
化学化学式与化合价第三课时
⑷2H2O2 2个过氧化氢分子
⑸O2- 氧离子; 每个氧离子带2个单位的负电荷
+2
⑹MgO
氧化镁中镁元素显+2价
2、下列物质的化学式正确的是
+2 -2
MgO2
+2 -1
ZnCl
+3 -2
Fe2O3
+1 -2
KCO3
MgO
ZnCl2
化学化学式与化合价第三课时
K2CO3
5、尿素的化学式为【CO(NH2)2 】知:
K : Cl : O = 39 : 35.5 : (16×3) = 39 : 35.5 : 48
2.碳酸钠中各元素的质量比
解 :在Na2CO3中各元素的质量比
Na : C : O = 23×2 : 12 : (16×3) = 46 : 12: 48 = 23 : 6 : 24
3.燃烧爆竹产生一种污染物,其元素的质量比为1 :1,
得出铁元素的质量分数的大小
化学化学式与化合价第三课时
“化合物”与“元素”互 求 一、由化合物的质量求元素的质量
例:150千克的硝酸铵中有多少氮元素? 元素质量=物质质量 × 元素质量分数
化学化学式与化合价第三课时
应用: 150千克的硝酸铵中有多少氮元素?
解 : NH4NO3 的相对分子质量=
14x1+1x4+14x1+16x3=80
8吨NH4NO3含N元素质量为:
8吨 × Nx2 =8吨× 14x2
(1)尿素是由 碳、氧、氮、氢元素组成的,
含有 四 种元素。
(2)每个分子中含有 8 个原子。在它的 分子
中原子个数比为
C:O:N:H=1。:1:2:4
(3)尿素属于 化合物(“单质”或“化合
物”),它是由 尿素分子 构成。
构成物质的粒子:分子、原子、离子
化学化学式与化合价第三课时
课题4 化学式与化合价
(1)氯气 (2)五氧化二磷 (3) CO(NH2)2
化学化学式与化合价第三课时
练习2:已知化合物R2O3 的相对分子质量是160, 求 R的相对原子质量。
解:设R的相对原子质量为X
X×2+16×3=160 X=56
答: R的相对原子质量为56
化学化学式与化合价第三课时
2、计算物质组成元素的质量比 元素质量比=(相对原子质量×原子个数)之比 例如: 二氧化碳(CO2) 中 碳元素质量︰氧元素质量 = 12 ︰(16×2)
4化学式与化合价
课题4 化学式与化合价
第三课时
H2O
化学式的计算
化学化学式与化合价第三课时
课前热身
1、写出下列化学符号表示的意义
⑴O 氧元素、一个氧原子 ⑵2O 2个氧原子
(1)过氧化氢这种物质 (2)过氧化氢是由氢元素和氧元素组成的
⑶H2O2 (3)一个过氧化氢分子
(4)1个过氧化氢分子是由2个氢原子和2个氧 原子构成的
化学化学式与化合价第三课时
应用: 多少吨的硝酸铵中含有100吨的氮元素?
解 : NH4NO3 的相对分子质量=
14x1+1x4+14x1+16x3=80
硝酸则铵N的H4质N量O为3 中:氮元素的质量分数为
= 1==N0120H081N吨805440xN吨x.722O÷吨÷3××N111H480N0x00402xN%%2O3
书写格式:解 : NH4NO3 的相对分子质量=
14x1+1x4+14x1+16x3=80
则NH4NO3 中氮元素的质量分数为 Nx2 ×100%
NH4NO3
= 14x2 ×100%
80
=35%
化学化学式与化合价第三课时
比较Fe2O3和Fe2O3中铁元素质量分数大小
思路: 把铁原子的个数变成相等 比较相对分子质量的大小
第三课时 根据化学式的计算
化学化学式与化合价第三课时
水由什么构成的? 水有质量吗? 水分子有质量吗?
化学化学式与化合价第三课时
原水子分的子质的量质很量小是,否分可子以的用 氢质原量子也的很质小量,和原氧子原可子以的用质 量相来对表原示子呢质?量来表示它的 质量,那么分子呢?
化学化学式与化合价第三课时
该污染物是( C )
A. H2O B. CO C. SO2 化学化学式与化合价第三课时 D. NO2
3、计算物质中某一元素的质量分数
该元素的相对原子质量 × 该元素的原子个数
元素的质量分数 =
×100%
物质的相对分子质量
注意事项:质量分数——用百分数来表示
化学化学式与化合价第三课时
例题3:计算硝酸铵中氮元素的质量分数。
例题1:计算02、H2O、(NH4)2CO3的相对分子质量
书写格式:
解:O2的相对分子质量= 16×2=32 H2O的相对分子质量=1×2 + 16=18 (NH4)2CO3的相对分子质量 =(14+1×4)×2 + 12 + 16 ×3 =96
化学化学式与化合价第三课时
练习1:计算下列物质的相对分子质 量
