仪器分析武汉大学核磁-1
武汉大学仪器分析讲义教案07省名师优质课赛课获奖课件市赛课一等奖课件

可进行多元素同步分析、定性分析、定量分析、化 学状态分析、构造鉴定、无损深度剖析、微区别析等;
可进行不同形状(如平面、粉末、纤维及纳米构造) 材料,涉及有机材料旳分析(对X射线敏感材料除外), 辨别率为0.2eV。
7.2.6.2. X射线光电子能谱法旳应用
7.6. 激光共焦扫描显微镜
双光子激发是指一种分子或原子能够在同一种量 子过程中同步吸收两个光子而形成激发态,这种情况 就是双光子激发过程。
双光子共焦显微镜具有许多突出旳优点:
第一,能够采用波长比较长旳、在生物组织中穿 透能力比较强旳红外激光作为激发光源;
第二,因为双光子荧光波长远离激发光波长,所 以双光子共焦显微镜能够实现暗场成像;
4. 试样室系统和真空系统
试样预处理(如氢离子清洗等),进样系统和试样室 三部分构成了试样室系统;真空系统提供高真空环境。
7.2.6.电子能谱法旳应用
7.2.6.1.电子能谱法旳特点
1.可分析除H和He之外旳全部元素;能够直接测定来 自试样单个能级光电发射电子旳能量分布,且直接得 到电子能级构造旳信息。
1.元素定性分析
元素周期表中每一种元 素旳原子构造互不相同, 原 子内层能级上旳电子结合能 是元素特征旳反应,据此能 够进行定性分析。
2.元素定量分析
根据是光电子谱线旳强
度(光电子峰旳面积或峰高)
与元素含量有关。
(C3H7)4N+S2PF2-旳X射线光电子能谱图
7.2.6.2. X射线光电子能谱法旳应用
二次离子质谱有“静态”和“动态”两种。
7.3.2. 二次离子质谱仪
7.4. 扫描隧道显微镜和原子力显微镜
7.4.1.扫描隧道显微镜旳基本原理 基于量子力学旳隧道效应。
武汉大学第五版仪器分析仪器分析讲义

仪器分析讲义绪论(Introduction)仪器分析是化学类专业必修的基础课程之一。
通过本课程的学习,要求学生把握经常使用仪器分析方式的原理和仪器的简单结构;要求学生初步具有依照分析的目的,结合学到的各类仪器分析方式的特点、应用范围,选择适宜的分析方式的能力。
分析化学是研究物质的组成、状态和结构的科学。
它包括化学分析和仪器分析两大部份。
化学分析是指利用化学反映和它的计量关系来确信被测物质的组成和含量的一类分析方式。
测按时需利用化学试剂、天平和一些玻璃器皿。
它是分析化学的基础。
仪器分析是以物质的物理和物理化学性质为基础成立起来的一种分析方式,测按时,常常需要利用比较复杂的仪器。
它是分析化学的进展方向。
仪器分析与化学分析不同,具有如下特点:(1)灵敏度高,检出限量可降低。
如样品用量由化学分析的ml、mg级降低到仪器分析的µL、µg级,乃至更低。
它比较适用于微量、痕量和超痕量成份的测定。
(2)选择性好。
很多仪器分析方式能够通过选择或调整测定的条件,使共存的组分测按时,彼其间不产生干扰。
(3)操作简便、分析速度决,易于实现自动化。
(4)相对误差较大。
化学分析一样可用于常量和高含量成份的分析,准确度较高,误差小于千分之儿。
多数仪器分析相对误差较大,一样为5%,不适于常量和高含量成份的测定。
(5)需要价钱比较昂贵的专用仪器。
§1-1.仪器分析方式的内容和分类(Classification of Instrumental Analysis)分类:1.光学分析法以物质的光学性质为基础的分析方式(1) 分子光谱: 红外吸收可见和紫外分子荧光拉曼光谱(2) 原子光谱: 原子发射AES 原子吸收AAS 原子荧光AFS(3) X射线荧光: 发射吸收衍射荧光电子探针(4) 核磁共振顺磁共振2.电化学分析法溶液的电化学性质用于确信物质化学成份的方式(1)电导法:电导分析法电导确信物质的含量电导滴定法溶液的电导转变确信容量分析的滴定终点。
《仪器分析》课程教学大纲

《仪器分析》课程教学大纲一、课程基本信息二、课程简介仪器分析(Instrumental A nalysis)是分析化学最重要的组成部分,是医学检验专业的一门必修课程。
仪器分析是通过采用复杂或特殊的仪器设备,测量物质的某些物理或物理化学性质参数及其变化来获取物质的化学组成、含量和化学结构等信息的一类分析方法,是继《化学分析》后,学生必须掌握的现代分析技术。
本课程使学生通过本课程的学习,牢固掌握各类医学检验领域常见仪器分析方法的基本原理以及仪器的各重要组成部分,对各仪器分析方法的应用对象及分析过程要有基本了解,为学生更好地从事临床检验工作打下坚实的基础。
三、教学目标与要求仪器分析是分析化学的重要分析技术和手段,是检验专业重要的专业基础课程。
通过这门课程的学习,要求学生掌握常用仪器分析方法的原理和仪器的基本结构及使用方法,掌握各种仪器分析的基本原理,掌握各种分析误差产生的来源及消除方法。
掌握各种主要仪器的基本结构及使用方法,并初步具有应用所学方法解决相应问题的能力。
四、教材及参考书(一)教材名称及性质柴逸峰等编著.《分析化学》.第八版.人民卫生出版社,2016年(二)参考书[1]武汉大学编著.《分析化学》.第六版(下册).高等教育出版社,2018年[2]李磊,高希宝编著.《仪器分析》.第一版.人民卫生出版社,2015年[3]彭崇慧等编著.《分析化学:定量化学分析简明教程》.第三版.北京大学出版社,2014年五、课程考核方式(一)考核方式考核方式分为两项内容:过程考核(考勤、课后作业)、课终考核(闭卷考试)(二)成绩评定办法成绩构成:课终考核成绩×50% + 过程考核成绩×50%六、课外学习要求课后作业为习题,3-5次,每次作业题量2-3题,作业布置后,于一周内上交。
第一章紫外-可见分光光度法1.目的要求:掌握光学分析法的分类和基本原理;熟悉电磁波谱的分类;了解电磁辐射与物质相互作用的相关术语;掌握紫外吸收光谱的特征和电子跃迁类型及影响因素。
武汉大学仪器分析试卷及答案整理版

武汉大学仪器分析试卷及答案整理版武汉大学2005-2006学年度第一学期《仪器分析》期末考试试卷答案(A)学号姓名院(系)分数一、选择题(每题1分,共15分)1.下列说法哪一种正确? ( )a. 阳极电位越正、析出电位越正者越易在阳极上氧化b. 阳极电位越正、析出电位越负者越易在阳极上氧化c. 阳极电位越负、析出电位越正者越易在阳极上氧化d. 阳极电位越负、析出电位越负者越易在阳极上氧化2. 用色谱法对复杂未知物进行定性分析的最有效方法是 ( )a. 利用检测器的选择性定性b. 利用已知物对照法定性c. 利用文献保留数据定性3.某同学将装入电解池准备做极谱分析的溶液洒掉了一部分, 若用标准比较法进行测定, 他应 ( )a.重新配制溶液b. 取一定量的溶液, 记下体积, 再测定c.继续做d..取一定量的溶液, 加入标准溶液, 作测定校正 4.在气-液色谱分析中, 当两组分的保留值很接近, 且峰很窄, 但只能部分分离,其原因是 ( )a. 柱效能太低b. 容量因子太大c. 柱子太长d. 固定相选择性不好5.在GC和LC中, 影响柱的选择性不同的因素是 ( )a.固定相的种类b.柱温c.流动相的种类 (4)分配比 6. 先电解富集,后电解溶出的电分析方法是()a. 电导分析法b. 电重量分析法c. 电位分析法d. 溶出伏安法7.分离有机胺时,最好选用的色谱柱为 ( )a 非极性固定液柱 b. 低沸点固定液柱c. 空间排阻色谱柱 d 氢键型固定液柱8.影响谱线变宽的最主要因素是以下哪种? ()a. 自然变宽b. 热变宽c. 碰撞变宽d. 自吸变宽9. 空心阴极灯中对发射线宽度影响最大的因素是()a. 阴极材料b. 填充材料c. 灯电流d. 阳极材料 10.适合于植物中挥发油成分分析的方法是()a. 原子吸收光谱b. 原子发射光谱c. 离子交换色谱d. 气相色谱11. 原子发射光谱的产生是由于()a.原子次外层电子在不同能态间的跃迁b.原子外层电子在不同能态间的跃迁c.原子外层电子的振动和转动d.原子核的振动12. 矿石粉末的定性分析,一般选择下列哪种光源为好:()a.交流电弧b.直流电弧c.高压火花d.等离子体光源 13. 原子吸收法测定NaCl中微量K时,用纯KCl配制标准系列制作工作曲线,分析结果偏高,原因是()a.电离干扰b.物理干扰c.化学干扰d.背景干扰 14. 下列化合物中,同时有n?π*,π?π*,σ?σ*跃迁的化合物是()a.一氯甲烷b.丙酮c. 1,3-丁二醇d. 甲醇15. 随着氢核的酸性增加,其化学位移值ppm将()a. 增大b. 减小c. 不变二、填空(每空1分,共30分)1.由LaF单晶片制成的氟离子选择电极, 晶体中___ _是电荷的传递者,_______是固定在膜相3中不参与电荷的传递, 内参比电极是_________, 内参比溶液由_ _________组成。
【武汉大学分析化学下】仪器分析 第12章 核磁共振波谱法
12.1.3 核磁共振的条件
如果以一定频率的电磁波照射处于磁场 B0 中 的核,且射频频率恰好满足下列关系时: 2 0 h =ΔE ΔE=2 B0 h (核磁共振条件式) 自旋核的跃迁能量
磁性核
h =ΔE
高能级 低能级
处于低能态的核将吸收射频能量而跃迁至高 能态,这种现象叫做核磁共振现象。
12.2.2 化学位移的定义
化学位移有两种表示方法: 1. 用共振频率差( )表示,单位Hz。
样品-标准=
B0 ( 标准 样品 ) 2
(12-8)
由于是个常数,因此共振频率差与外磁场的磁感应 强度B0呈正比。这样同一磁性核,用不同磁场强度 的仪器测得的共振频率差是不同的。所以用这种方 法表示化学位移时,需注明外磁场的磁感应强度B0。
第12章 核磁共振波谱法
概论
将磁性原子核放入强磁场后,用适宜频率的 电磁波照射,它们会吸收能量,发生原子核能级 跃迁,同时产生核磁共振信号,得到核磁共振
利用核磁共振光谱进行结构测定,定性与定 量分析的方法称为核磁共振波谱法。简称 NMR
在有机化合物中,经常研究的是1H和13C的共
振吸收谱,重点介绍H核共振的原理及应用
12.3.2 自旋-自旋耦合分裂的规律
( 4)裂分峰之间的峰面积或峰强度之比符合二项展开式 各项系数比的规律。(a+b)n n为相邻氢核数 n=1 (a+b)1 1︰1
n=2 (a+b)2
n=3 (a+b)3
1︰2 ︰1
1︰3︰3 ︰1
(5)氢核邻近有两组偶合程度不等的H 核时,其中一组 有n个,另一组有n′+1个,则这组H 核受两组 H 核自旋 偶合作用,谱线裂分成(n+1)(n′+1)重峰。
仪器分析第8章核磁共振PPT

8.2.1 原子核的磁性
原子核组成(质子数p与中子数n)与自旋量子数I 的经验规则:
•p与n同为偶数,I = 0。如 12C, 16O, 32S等。 •p + n =奇数,I =半整数(1/2, 3/2等)。 如 1H, 13C, 15N, 17O, 31P等。 p与n同为奇数,I =整数。如2H, 6Li等。
38
2、化学位移产生原因及其表示方法
原因:分子中的原子核处在核外电子氛围中,电
子在外加磁场的的作用下产生次级磁场,该原子
核受到了屏蔽:
B B 0B 0(1)B 0
B为核实际受到的磁场, -由电子云密度决定的 屏蔽常数,与化学结 构密切相关.
= [(1-) B0]/ 2
即:1H核所处的化学环境不同,不同, 也不同。
➢总之,无论从何种模型看,核在 磁场中都将发生分裂,可以吸收一 定频率的辐射而发生能级跃迁.
27
8.2.4 不同核的NMR
核 天然同位素
存在比(%)
1H
99.98
13C
1.1*
19F
100
31P
100
14N
99.63
15N
0.37*
17O
0.037*
*天然丰度越低,测定越困难。
B0 = 2.35T E(J) (MHz)
或 0
2
B0
25
此式与量子力学模型导出的式子完全相 同.0称为进动频率.在磁场中的进动核有 两个相反方向的取向,可通过吸收或发射能 量而发生翻转,见下右图.
26
8.2.3 经典力学-进动模型(precession)
终于明白了!
核磁共振的产生:当电 磁波发生器的发射频率 与进动核的进动频率完 全一致时,进动核会吸 收电磁波能量。即两者 共振时产生吸收。
《仪器分析》-武汉大学版 课后习题发答案
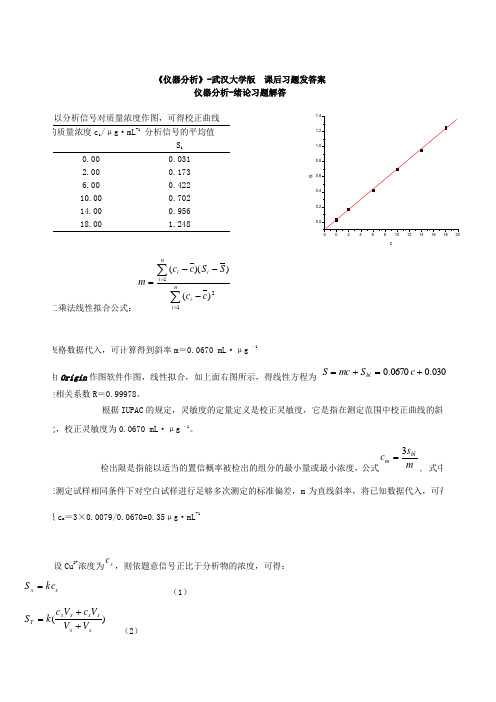
X ) ) x S =T S == =3 4 6 89.8[(M += 得.0=s /02.0光谱分析导论习题解答1、解:(1)72101067.6101050.111⨯=⨯⨯==-λσ(2)14981047.4107.670/100.3/⨯=⨯⨯==-λνc(3)303010103300/1192=⨯⨯==-σλ(4)80.1)10602.1(1095.6889100.310626.6/1910834=⨯÷⨯⨯⨯⨯===---λνhc h E2、解:由计算公式λν/hc h E ==以及各能级跃迁所处的波长范围可得能量范围分别如下:跃迁类型 波长范围 能量范围/eV 原子内层电子跃迁 10-3nm 10nm 1.261061.2102原子外层电子跃迁 200nm 750nm 6 1.7 分子的电子跃迁 200nm 750nm 6 1.7 分子振动能级的跃迁 2.5m 50m 0.50.02分子转动能级的跃迁50m100cm 210-2410-7由上表可以看出分子电子能级跃迁120eV 分子振动能级跃迁0.051eV 分子转动能级跃迁0.05eV ,其电子光谱,振动光谱以及转动光谱所对应的波长范围分别在紫外-可见区,红外区和远红外微波区。
3、解:棱镜的分光原理是光折射。
由于不同波长的光有其不同的折射率,据此能把不同波长的光分开。
光栅的分光原理是光的衍射与干涉的总效果。
不同波长的光通过光栅作用各有相应的衍射角,据此把不同波长的光分开。
光栅光谱棱镜光谱与波长成正比,所以光栅光谱是一个均匀排列的光谱 色散率与波长有关,为非均匀排列的光谱的波长越短则衍射角越小,因此其谱线从紫到红排列 长越短,其偏向角越大,因此其谱线从红到紫排列 合光通过光栅后,中央条纹(或零级条纹)为白色条纹,在中央条纹两边,对称排列着一级、二级等光谱,由于谱线间距离随光谱级数的增加而增加,出现谱级重叠现象没有谱级重叠现象光栅适用的波长范围比棱镜宽4、解:vcn r i ==θθsin sin ,式中n 为折射率,i θ为入射角,r θ为折射角,c 为光速,v 为玻璃介质中的传播速度。
要考有机和分析的学校

要考有机和分析的学校:1、南京大学{985、211、考试科目:①有机②仪器分析}2、华东理工大学{211、考试科目:①有机②分析}3、暨南大学{211、考试科目:①有机②分析(含仪器分析)}4、南昌大学{211、考试科目:①有机②分析}5、贵州大学{211、考试科目:①有机②分析}6、河南科技大学{考试科目:①有机②仪器分析}7、河南工业大学{考试科目:①有机②分析}8、浙江工业大学{考试科目:①有机②分析(含仪器分析)}8、中南民族大学{考试科目:①有机②分析}9、云南民族大学{考试科目:①有机②分析(含仪器分析)要考物化和分析的学校:1、南京大学{985、211、考试科目:①物化②仪器分析}2、东北大学{985、211、考试科目:①物化②分析}3、南昌大学{211、考试科目:①物化②分析}4、河北大学{考试科目:①物化②分析}5、中南民族大学{考试科目:①物化②分析}6、沈阳药科大学{考试科目:①物化②分析}kaoyan009 (2009-4-03 1320)本帖最后由kaoyan009 于2009-4-3 04:02 PM 编辑要考物化和无机的学校:1、厦门大学{985、211、考试科目:①物化②基础化学}2、南京大学{985、211、考试科目:①物化②大学化学}3、南京航空航天大学{211、考试科目:①物化②无机}4、南京师范大学{211、考试科目:①物化②无机}5、南昌大学{211、考试科目:①物化②无机}6、华南师范大学{211、考试科目:①物化②无机}7、中南民族大学{考试科目:①物化②无机}8、云南师范大学{考试科目:①物化②无机}注意:由于基础化学和大学化学和无机化学的内容几乎一样,故把基础化学和大学化学归为无机化学!!!kaoyan009 (2009-4-03 1348)本帖最后由kaoyan009 于2009-4-3 04:17 PM 编辑要考物化和综合化学的学校:1、复旦大学{985、211、考试科目:①物化(含结构化学)②无机和分析}2、华中科技大学{985、211、考试科目:①物化②无机及分析}3、安徽大学{211、考试科目:①物化②综合化学}4、西北大学{211、考试科目:①物化②普通大学(无机和化学分析)}5、宁夏大学{211、考试科目:①物化②综合化学(有机、《无机化学与化学分析》)}6、河南大学{考试科目:①物化②无机和有机}7、浙江师范大学{考试科目:①物化②普通化学(有机、分析、仪器分析)}8、烟台大学{考试科目:①物化②化学综合(分析、无机、有机)}9、黑龙江大学{考试科目:①物化②综合化学(无机、有机、分析)}注意:《无机化学与化学分析》为参考书。
武大仪器分析知识点总结考研,期末复习

第一部分:AES,AAS,AFSAES原子发射光谱法是根据待测元素的激发态原子所辐射的特征谱线的波长和强度,对元素进行定性和定量测定的分析方法。
特点:1.灵敏度和准确度较高2.选择性好,分析速度快3.试样用量少,测定元素范围广4.局限性(1)样品的组成对分析结果的影响比较显著。
因此,进行定量分析时,常常需要配制一套与试样组成相仿的标准样品,这就限制了该分析方法的灵敏度、准确度和分析速度等的提高。
(2)发射光谱法,一般只用于元素分析,而不能用来确定元素在样品中存在的化合物状态,更不能用来测定有机化合物的基团;对一些非金属,如惰性气体、卤素等元素几乎无法分析。
(3)仪器设备比较复杂、昂贵.术语:自吸自蚀•击穿电压:使电极间击穿而发生自持放电的最小电压.•自持放电:电极间的气体被击穿后,即使没有外界的电离作用,仍能继续保持电离,使放电持续.•燃烧电压:自持放电发生后,为了维持放电所必需的电压。
由激发态直接跃迁至基态所辐射的谱线称为共振线。
由较低级的激发态(第一激发态)直接跃迁至基态的谱线称为第一共振线,一般也是元素的最灵敏线。
当该元素在被测物质里降低到一定含量时,出现的最后一条谱线,这是最后线,也是最灵敏线。
用来测量该元素的谱线称分析线。
仪器:光源的作用: 蒸发、解离、原子化、激发、跃迁.光源的影响:检出限、精密度和准确度。
光源的类型:直流电弧交流电弧电火花电感耦合等离子体(ICP)光源蒸发温度激发温度/K 放电稳定性应用范围直流电弧高4000~7000 较差定性分析,矿物、纯物质、难挥发元素的定量分析交流电弧中4000~7000 较好试样中低含量组分的定量分析火花低瞬间10000 好金属与合金、难激发元素的定量分析ICP 很高6000~8000 最好溶液的定量分析ICP原理当高频发生器接通电源后,高频电流I通过感应线圈产生交变磁场(绿色).开始时,管内为Ar气,不导电,需要用高压电火花触发,使气体电离后,在高频交流电场的作用下,带电粒子高速运动,碰撞,形成“雪崩”式放电,产生等离子体气流。
仪器分析—核磁共振

核磁共振与紫外、红外比较
共同点都是吸收光
紫外—可见
红外
核磁共振
吸收 能量
紫外可见光 200~780nm
红外光 780nm~1000m
无线电波1~100m 波长最长,能量最 小,不能发生电子 振动转动能级跃迁
吸收峰裂分谱线增加的现象称为自旋—自旋裂分。
氢核吸收峰的裂分是因为分子中相邻氢核之间发
生了自旋相互作用,自旋核之间的相互作用称为自
旋—自旋偶合。
自旋偶合不影响化学位移,但会使吸收峰发生裂
分,使谱线增多,简称自旋裂分。
自旋裂分峰数目及强度
(1)化学环境完全相同的原子,虽然它们有很强的偶合作用, 但无裂分现象。 例:-CH3不发生裂分 (2)分子中化学位移相同的氢核称为化学等价核;把化学位 移相同,核磁性也相同的称为磁等价核。磁等价核之间虽 有偶合作用,但无裂分现象,在NMR谱图中为单峰。
自旋角动量的大小,取 决于核的自旋量子数 I。 I值得变化是不连续的, 这能是0、半整数(分 数)、整数。
实践证明:自旋量子数(I)与原子质量数(A)、质子数(Z)、中
子数(N)有关:
各种核的自旋量子数 质量数 A 偶数 奇数 奇数 偶数 原子序数 Z 偶数 奇或偶数 奇或偶数 奇数 自旋量子数 I NMR 信号 原子核
(4)裂分峰之间的峰面积或峰强度之比符合二项 展开式各项系数比的规律。(a+b)n n为相邻 氢核数
n=1 (a+b)1 1︰1
n=2 (a+b)2
1︰2 ︰1
n=3 (a+b)3
1︰3︰3 ︰1
例:
武汉大学仪器分析实验总结

仪器分析实验总结一、离子选择性电极测定天然水中的F-1、实验原理:氟离子选择电极是以氟化镧单晶片为敏感膜的电位法指示电极。
氟电极和饱和甘汞电极组成的电池:Ag,AgCl|[10-3mol/L NaF,10-1mol/L NaCl]|LaF3|F-(试液)||Kcl(饱和),Hg2Cl2|HgΦISE=E内参-E M=k±0.059/n lg a外,E M=±0.059/n lg a外,E(电池)=ΦSCE-ΦISE=K-+0.059/n lg a外离子选择性电极测定的是离子的活度,故需控制离子强度(加电解质)。
实验条件控制:(1)PH5.5~6.5,用PH缓冲溶液。
(2)控制溶液离子强度,用电解质。
(3)消除Al3+,Fe3+干扰,用掩蔽剂。
常用PH=6的柠檬酸钠还溶液控制溶液PH 和作掩蔽剂。
PH过低F-易变成HF or HF2-,过高La3+会水解为La(OH)3.所用的单晶为:LaF3·EuF2,单晶中含有F-的空位,膜具有选择性和强制性。
2、关键操作:实验操作:(1)连接氟电极、甘汞电极、mV计并预热。
(2)蒸馏水浸泡氟电极和饱和甘汞电极至读数<-300mV.(3)用逐级稀释法配制浓度为10-2、10-3、10-4、10-5、10-6mol/L的F-标准溶液,测电位(要求每相邻两组电位差小于70mV),无需清洗电极,擦干即可,读数稳定5s即可记数,绘制标准曲线。
(3)一次标准溶液加入法测定水样中F-含量。
3、结果分析:计算水样中F-含量公式:cx=(c s V s/(V x+V s))(10ΔE/S-1)-14、思考题:(1)F-选择电极在使用时应注意哪些问题:一般在低浓度F-溶液中浸泡一定时间进行活化,使用时先放入蒸馏水中至电位小于-300mV方可使用测量,且保证测量溶液的PH在5.5~6.5之间,且擦干时用滤纸吸干几个,不能摩擦膜表面。
(2)为什么要清洗F-电极,使其电极响应值负于-370mV?因为电极由记忆效应,将F-电极清洗至其相应值负于-370mV可排除其离子选择性膜上其他离子的干扰,并平衡F-电极电位。
仪器分析核磁共振波谱法1

m = -1/2
E
m = +1/2
m = -1/2 E
m = +1/2
B0
B0
磁矩沿磁场方向的分量为:
z
m
h
2
外加磁场中核的磁能级的能量E为:
E
z B0
m
h
2
B0
1H的高能级与低能级之间的能量差为:
E
m
h
2
B0
h
2
B0
2B0
B0=1.41T
E 2 2.7935.051027 1.41 3.981026
化学位移的影响因素
局部抗磁效应:屏蔽决定于相邻原子或基团的 电负性,电负性大,质子周围电子云密度小,屏 蔽程度减小,共振信号移向低场
Si(CH3)4 CH3-H CH3-N CH3-Br CH3-Cl CH3OH
b) 粘滞性液体,配成2-10%溶液
c) 固体样品直接分析,图谱常有许多互相叠合的 谱带组成,很宽,对结构分析意义不大
d) 1H NMR,样品溶液不含质子,常用CCl4、CS2 及氘代溶剂(CDCl3、D2O等,贵,溶解能力 好)
4 有机化合物结构与质子核磁共振波谱
理论上: 当一个自旋量子数不为零的核置于外磁场中,
横向驰豫:自旋-自旋驰豫,两相邻的核处于不 同能级,但进动频率相同,发生横向驰豫,各自 旋状态的总数不变,各能级上核数目的比例不变, 但确实使某些高能级的核的寿命缩短了,以驰豫 时间T2表示。
根据Heisenberg测不准原理,激发态能量E与 体系处在激发态的平均时间成反比,与谱线的宽 度成正比:
③ 探头
傅里叶变换核磁共振波谱仪的探头的结构与种 类与连续波核磁共振波谱仪相同,其接收线圈感应 出的信号是自由感应衰减信号(FID信号)。
仪器分析答案武汉大学

仪器分析答案武汉大学【篇一:分析化学》下册武汉大学等编(第五版)作业参考答案】t>第2章光谱分析法导论2-1 光谱仪一般由几部分组成?它们的作用分别是什么?参考答案:(1)稳定的光源系统—提供足够的能量使试样蒸发、原子化、激发,产生光谱;(2)试样引入系统(3)波长选择系统(单色器、滤光片)—将复合光分解成单色光或有一定宽度的谱带;(4)检测系统—是将光辐射信号转换为可量化输出的信号;(5)信号处理或读出系统—在显示器上显示转化信号。
2-2 单色器由几部分组成,它们的作用分别是什么?参考答案:(1)入射狭缝—限制杂散光进入;(2)准直装置—使光束成平行光线传播,常采用透镜或反射镜;(3)色散装置—将复合光分解为单色光;(4)聚焦透镜或凹面反射镜—使单色光在单色器的出口曲面上成像;(5)出射狭缝—将额定波长范围的光射出单色器。
2-5 对下列单位进行换算:-(1)150pm z射线的波数(cm1)(2)li的670.7nm谱线的频率(hz)-(3)3300 cm1波数对应的波长(nm)(4)na的588.995nm谱线相应的能量(ev)参考答案:(1)??1?c?1?17?1cm?6.67?10cm ?10150?103.0?101014(hz)?4.47?10(hz) (2)????7?670.7?10(3)??1??1(cm)?3.03?10?4(cm)?3030(nm) 33006.625?10?34?3.0?108(ev)?2.1(ev) (4)e?h??9?19?588.995?10?1.602?10c2-6 下列种类型跃迁所涉及的能量(ev)范围各是多少?(1)原子内层电子跃迁;(4)分子振动能级跃迁;(2)原子外层电子跃迁;(5)分子转动能级跃迁;(3)分子的电子跃迁参考答案跃迁类型原子内层电子跃迁原子外层电子跃迁分子的电子跃迁分子振动能级跃迁分子转动能级跃迁-6~1.7 6~1.7 1.7~0.02 --第10章吸光光度法(上册)2、某试液用2cm吸收池测量时,t=60%。
仪器分析武汉大学核磁-1共79页PPT资料80页PPT

谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
1、不要轻言放弃,否则对不起自己。
2、要冒一次险!整个生命就是一场冒险。走得最远的人,常是愿意 去做,并愿意去冒险的人。“稳妥”之船,从未能从岸边走远。-戴尔.卡耐基。
梦 境
3、人生就像一杯没有加糖的咖啡,喝起来是苦涩的,回味起来却有 Fra bibliotek久不会退去的余香。
仪器分析武汉大学核磁-1共79页PPT资料 4、守业的最好办法就是不断的发展。 5、当爱不能完美,我宁愿选择无悔,不管来生多么美丽,我不愿失 去今生对你的记忆,我不求天长地久的美景,我只要生生世世的轮 回里有你。
55、 为 中 华 之 崛起而 读书。 ——周 恩来
仪器分析核磁共振波谱分析课件

2024/4/7
仪器分析核磁共振波谱分析课件
图12.9
·共轭效应:影响电子云密度,如,甲氧基苯环上的H,邻位的化学位移为 6.84,对位的化学位移为6.99,间位的化学位移为7.81。杂化影响:若无其它 效应的影响,杂化轨道随S成分增加而电子云密度降低,屏蔽作用减小,化
学位移增大
2024/4/7
仪器分析核磁共振波谱分析课件
2024/4/7
仪器分析核磁共振波谱分析课件
因此,处于高能级的核必须回到低能态,才能维持处
于低能态的核的微弱的数量优势,使得核磁共振信号得以 检测。这一过程以非辐射的形式实现,称为驰豫过程,可 分为: 1、自旋--晶格驰豫,又称纵向驰豫:
自旋核与周围分子交换能量的过程,如固体的晶格, 液体则为周围的同类分子或溶剂分子。用弛豫时间T1 示。 2、自旋--自旋驰豫,又称横向驰豫:
2024/4/7
(a)在CDCl3中 (b)~(d)中为逐步加入苯 4 二甲基甲酰胺的溶剂效应
仪器分析核磁共振波谱分析课件
2024/4/7
图12.15 苯环对二甲基甲酰胺甲基的屏蔽
仪器分析核磁共振波谱分析课件
交换反应: 1.位置交换: 活泼氢,如-OH, -SH,-COOH, -NH2 2.构象交换: 环己烷平伏键与直立键
2024/4/7
图12.13 单键的各向异性
仪器分析核磁共振波谱分析课件
(二) 氢键的影响:分子形成氢键后,使质子周围电子云密度降低,产生去屏
蔽作用而使化学位移向低场移动,如醇类、胺类和酸类等。
1. 分子间氢键:受溶液浓度、温度和溶剂的影响较显著; 2. 分子内氢键:几乎不受溶液浓度、温度和溶剂的影响。 溶剂效应:如二甲基甲酰胺,随各向异性溶剂苯的加入,两个甲基化学位移 发生变化
武汉大学仪器分析讲义教案01

仪器信号放大倍数有关;而检出限与空白信号 波动或仪器噪声有关,具有明确统计含义。
1.3.3.4 动态范围(dynamic range)
定量测定最低浓度(LOQ)扩展到校准曲线偏离
线性响应(LOL)的浓度范围。 定量测定下限一般取等于10倍空白重复测定标 淮差,或10sbl。这点相对标淮差约30%,随浓 度增加而迅速降低。检测上限,相对标准差是 100%。
1.3.2.2 能源
功能:提供与被分析物或系统发生作用的探
测能源。 类型包括:电磁辐射、场、电能、机械能、 核能等。
例:光分析仪器的光源,X射线衍射仪的X光
管等。
1.3.2.3 信息发生器
检测器 转换器
信息发生器
传感器
1.3.2.3 信息发生器
检测器:通常是一个机械、电或化学装置,
分析仪器是人们感觉器官的延伸
它所测量或所获取的主要是物质的质和 量的信息。以一切可能的(化学的、物理的、 生物医学的、数学的等等)方法和技术,利 用一切可以利用的物质属性,对一切需要加 以表征、鉴别或测定的物质组分(包括无机 和有机组分)及其形态、状态(以及能态)、 结构、分布(时、空)等进行表征、鉴别和 测定,以求对样品所代表的问题有一个基本 的了解。这是当今分析科学也是分析仪器发 展所面临的任务。
仪器分析的发展趋势
科学仪器的创新是知识创新和技术创新的 重要内容。发展科学仪器应当视为国家战略。分 析仪器是科学仪器的重要组成部分。分析仪器工 业是高技术信息产业。分析仪器的发展是现代科 学、经济和社会发展的重要基础和推动力之一。 分析仪器的主要应用领域正向生物医学领域转 移.分析仪器本身将不断微型化、智能化.但人 类向时间和空间的两个极限挑战所需的高级精密 仪器也不容忽视.生命过程、生产、科研和社会 活动大量需要的将是在线、非侵入、非损坏、原 位、实时、多维分析仪器。
(完整版)武汉大学分析化学(第五版)下册答案

仪器分析部分作业题参考答案第一章绪论1-21、主要区别:(1)化学分析是利用物质的化学性质进行分析;仪器分析是利用物质的物理或物理化学性质进行分析;(2)化学分析不需要特殊的仪器设备;仪器分析需要特殊的仪器设备;(3)化学分析只能用于组分的定量或定性分析;仪器分析还能用于组分的结构分析;(3)化学分析灵敏度低、选择性差,但测量准确度高,适合于常量组分分析;仪器分析灵敏度高、选择性好,但测量准确度稍差,适合于微量、痕量及超痕量组分的分析。
2、共同点:都是进行组分测量的手段,是分析化学的组成部分。
1-5分析仪器与仪器分析的区别:分析仪器是实现仪器分析的一种技术设备,是一种装置;仪器分析是利用仪器设备进行组分分析的一种技术手段。
分析仪器与仪器分析的联系:仪器分析需要分析仪器才能达到量测的目的,分析仪器是仪器分析的工具。
仪器分析与分析仪器的发展相互促进。
1-7因为仪器分析直接测量的是物质的各种物理信号而不是其浓度或质量数,而信号与浓度或质量数之间只有在一定的范围内才某种确定的关系,且这种关系还受仪器、方法及样品基体等的影响。
因此要进行组分的定量分析,并消除仪器、方法及样品基体等对测量的影响,必须首先建立特定测量条件下信号与浓度或质量数之间的关系,即进行定量分析校正。
第二章光谱分析法导论2-1光谱仪的一般组成包括:光源、单色器、样品引入系统、检测器、信号处理与输出装置。
各部件的主要作用为:光源:提供能量使待测组分产生吸收包括激发到高能态;单色器:将复合光分解为单色光并采集特定波长的光入射样品或检测器;样品引入系统:将样品以合适的方式引入光路中并可以充当样品容器的作用;检测器:将光信号转化为可量化输出的信号信号处理与输出装置:对信号进行放大、转化、数学处理、滤除噪音,然后以合适的方式输出。
2-2:单色器的组成包括:入射狭缝、透镜、单色元件、聚焦透镜、出射狭缝。
各部件的主要作用为:入射狭缝:采集来自光源或样品池的复合光;透镜:将入射狭缝采集的复合光分解为平行光;单色元件:将复合光色散为单色光(即将光按波长排列)聚焦透镜:将单色元件色散后的具有相同波长的光在单色器的出口曲面上成像;出射狭缝:采集色散后具有特定波长的光入射样品或检测器2-3棱镜的分光原理是光的折射。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
20
(核磁共振条件式) 自旋核的跃迁能量
h
磁性核
h =ΔE
高能级 低能级
处于低能态的核将吸收射频能量而跃迁至高 能态,这种现象叫做核磁共振现象。
m h 2
I=1/2 的核发生核磁共振吸收射频 的频率,即共振频率。
1 22h 代入 2hB0得
0 2
分析测定时,样品不会受到破坏,属于 无破损分析方法
15.1核磁共振基本原理
一、原子核的磁性
原子核具有质量并带正
电荷,大多数核有自旋现象,
在自旋时产生磁矩,磁矩的
方向可用右手定则确定,核
磁矩和核自旋角动量P都是
矢量,方向相互平行,且磁
矩随角动量的增加成正比地
增加
=P
—磁旋比,不同的核具有不
△E与核磁矩及外磁场强度成正比, B0越大,能 级分裂越大, △E越大 B0外加磁场
m= -1/2 E2= B0 无磁场
△E=2 B0
m= +1/2 E1= -B0
(二)核磁共振
如 的核果,以且一射定频频频率率的电恰磁好满波足照下射列处关于系磁时场:B0中
h =ΔE ΔE=2 B0
自旋量子 数为0
无自旋
12C6,32S16 ,16O8
自旋量子 数为1,2,3
有自旋
14N7
自旋量子
1H1, 13C6
数为 有自旋 19F9,31P15
1/2,3/2,5/2
I=1/2的原子核,核电荷球形均匀分布于核 表面,如: 1H1, 13C6 , 14N7, 19F9,31P15
它们核磁共振现象较简单;谱线窄,适宜 检测,目前研究和应用较多的是1H和13C 核磁共振谱
产生核磁共振光谱的条件
(1)对自旋量子数I=1/2的同一核来说,, 因磁矩为一定值,—为常数,所以发生 共振时,照射频率的大小取决于外磁场 强度的大小。外磁场强度增加时,为使 核发生共振,照射频率也相应增加;反 之,则减小。
例:外磁场B0=4.69T(特斯拉,法定计量单位) 1H 的共振频率为
Pz为自旋角动量在Z轴上的分量
PZ
m h
2
核磁矩在磁场方向上的分量
Z
m h 2
核磁矩与外磁场相互作用而产生的核磁场作用能
E, 即各能级的能量为
E=-ZB0
E 1/2= -B0 E-1/2= B0
I=1/2的核自旋能级裂分与B0的关系
由式 E = -ZB0及图可知1H核在磁场 中,由低 能级E1向高能级E2跃迁,所需能量为 △E=E2-E1= B0 -(-B0) = 2 B0
同的磁旋比,对某元素是定值。 是磁性核的一个特征常数
例 C1:3核H的原子C =6H.=732×.681×071T0-81T·S-1-·1S-1(特[斯拉]-1 ·秒-1)
核的自旋角动量是量子化的,与核的自旋量 子数 I 的关系如下:
p2 h I(I 1 )
I可0 以 , 1, 1 , 3, 为 2等值 22
代入上式得: h I(I1) ( = P) 2
当I=0时,P=0,原子核没有自旋现象,只有I﹥0,原 子核才有自旋角动量和自旋现象
实践证明,核自旋与核的质量数,质 子数和中子数有关
质量数 为偶数
质量数 为偶数
质量数 为奇数
原子序 数为偶
数
原子序 数为奇
数
原子序 数为奇 或偶数
2 H02.6 81280 3 1.s11 44.6 9
2.00115 80s120.10M 5 H(1 zs11H)z 放在外磁场 B0=2.35T =100MHz
(2)对自旋量子数I=1/2的不同核来说,若同时
放入一固定磁场中,共振频率取决于核本身 磁矩的大小, 大的核,发生共振所需的照射 频率也大;反之,则小。例:13C的共振频率 为:
z
z
z
m =+1
m =
B0
m = +1/2
m =
m =
m =
m = 1/2
m = 1
m = 1 m = 2
I = 1/2
I=1
I=2
I=1/2的氢核 与外磁场平行,能量较低,m=+1/2, E 1/2= -B0 与外磁场方向相反, 能量较高, m= -1/2, E -1/2=B0
二、核自旋能级和核磁共振
(一)核自旋能级
把自旋核放在场强为B0的磁场中,由于磁矩 与 磁场相互作用,核磁矩相对外加磁场有不同的取 向,共有2I+1个,各取向可用磁量子数m表示
m=I, I-1, I-2, ……-I
每种取向各对应一定能量状态
I=1/2的氢核只有两种取向
I=1的核在B0中有三种取向
与紫外、红外比较
共同点都是吸收光谱
吸收 能量ຫໍສະໝຸດ 紫外-可见红外核磁共振
无线电波
紫外可见 光
红外光 1~100m波长最 长,能量最小,
780nm~1000 不能发生电子
200~780nm
m
振动转动能级
跃迁
跃迁 类型
电子能级 振动能级跃 自旋原子核发
跃迁
迁
生能级跃迁
NMR是结构分析的重要工具之一,在化 学、生物、医学、临床等研究工作中得 到了广泛的应用。
c0 6.731071s14.69
2
23.14
5.026107s150.26MHz
H0 2.681081s14.69
2
23.14
2.0015108s1 20.015MHz
三、核自旋能级分布和驰豫
(一)核自旋能级分布
1H核在磁场作用下,被分裂为m=+1/2和m=-1/2 两个能级,处在低能态核和处于高能态核的分 布服从波尔兹曼分布定律
第十五章 核磁共振波谱法
将磁性原子核放入强磁场后,用适宜频率的 电磁波照射,它们会吸收能量,发生原子核能级 跃迁,同时产生核磁共振信号,得到核磁共振
利用核磁共振光谱进行结构测定,定性与定 量分析的方法称为核磁共振波谱法。简称 NMR
在有机化合物中,经常研究的是1H和13C的共 振吸收谱,重点介绍H核共振的原理及应用
N(1)
E
h
hB0
2 e kT e kT e 2kT
N(1)
2
当 的B1H0核= 数1.4之09比T为,温度为300K时,高能态和低能态
N(1) e 2
