上海市2019年高考化学易错点(15)盐的水解(模拟题训练含答案)
高中化学盐类的水解(含答案解析)

3.3盐类的水解1.下列对盐类水解过程的说法正确的是( )A.属于氧化还原反应B.溶液的pH一定发生改变C.水的电离程度增大D.是放热的过程2.下列说法中正确的是( )A.HCO-3在水溶液中只电离,不水解B.硝酸钠溶液水解后呈中性C.可溶性的铝盐都能发生水解反应D.可溶性的钠盐都不发生水解反应3.在一定条件下发生下列反应,其中属于盐类水解反应的是( )A.Cl2+H2O H++Cl-+HClOB.NH+4+2H2O NH3·H2O+H3O+C.HS-+H+===H2SD.HCO-3+H2O H3O++CO2-34.下列离子方程式的书写正确的是( )A.硫化钠水解:S2-+2H2O H2S↑+2OH-B.亚硫酸氢钠水解:HSO-3+H2O H3O++SO2-3C.硫化钾水解:S2-+H2O===HS-+OH-D.硫酸铝溶液跟偏铝酸钠溶液反应:Al3++3AlO-2+6H2O===4Al(OH)3↓5.0.1 mol·L-1 NaHCO3溶液的pH最接近于( )A.5.6 B.7.0 C.8.4 D.13.06.pH=4的醋酸和pH=4的氯化铵溶液相比,水的电离程度较大的是( ) A.前者B.后者C.等于D.无法确定7.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:(1)从①组情况分析,HA 是强酸还是弱酸________。
(2)②组情况表明,c ________0.2(填“>”、“<”或“=”,下同)。
混合溶液中离子浓度c (A -)________c (Na +)。
(3)从③组实验结果分析,说明HA 的电离程度______NaA 的水解程度(填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是_______________。
(4)从以上实验分析,将pH =11的NaOH 溶液与pH =3的HA 溶液等体积混合,所得混合溶液中c (OH -)____________ __c (H +)(填“>”、“<”或“=”)。
高二化学盐类的水解试题答案及解析

高二化学盐类的水解试题答案及解析1.草酸是二元弱酸,草酸氢钾溶液呈酸性。
在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-)B.c(HC2O4-)+c (C2O42-) =" 0.1" mol·L-1C.c(C2O42-) < c(H2C2O4)D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)【答案】D【解析】A.根据溶液呈电中性原则,可得c(K+)+c(H+) = c(HC2O4-)+c(OH-)+2c(C2O42-),错误;B.根据物料守恒可得c(HC2O4-)+c (C2O42-) + c(H2C2O4)=" 0.1" mol/L,错误;C.草酸氢钾溶液呈酸性,说明HC2O4-的电离作用大于其水解作用,所以c(C2O42-) >c(H2C2O4),错误;D.根据物料守恒可得c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-),正确。
【考点】考查盐的水解、电离、溶液中离子浓度的大小比较的知识。
2.下列有关问题与盐的水解无关的是()A.NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂B.用NaHCO3与Al2(SO4)3两种溶液可制成泡沫灭火剂C.常温下测得NaHSO3溶液的pH小于7D.实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞【答案】C【解析】A.NH4Cl与ZnCl2都是强酸弱碱盐,水解使溶液显酸性,可以与金属氧化物反应而除锈,故可作焊接金属时的除锈剂,正确;B.NaHCO3是强碱弱酸盐,水解使溶液显碱性,而Al2(SO4)3是强酸弱碱盐水解使溶液显酸性,当用NaHCO3与Al2(SO4)3两种溶液混合时,水解相互促进,能够产生氢氧化铝沉淀和CO2气体,因此可制成泡沫灭火剂,正确;C.常温下测得NaHSO3溶液的pH小于7,是因为HSO3-的电离作用大于水解作用,与盐的水解无关,错误;D.Na2CO3是强酸弱碱盐水解使溶液显碱性,若在实验室盛放Na2CO3溶液时,试剂瓶用磨口玻璃塞,就会与玻璃的成分发生反应而是瓶与塞粘在一起,正确。
高考化学总复习考点知识专项训练16---盐类的水解

遇时可生成有刺激性气味的气体,A 溶液和 D 溶液混合时无明显现象。
的名称是 。 (1)A
________
写出 溶液和 溶液反应的化学方程式: 。 (2) C
D
_____________________________________
(3)25 ℃时,pH=9 的 A 溶液和 = pH 9 的 C 溶液中水的电离程度小的是________(填 A 或 C 的化学式)。
答案 B
5 下列物质的水溶液常温下 pH 小于 7 的是( )
.A NaCl
.B CH3COONa
.C NH4Cl
.D NaHCO3
答案 C
6.下图表示的是某离子 X 与水的反应过程,离子 X 可能是( )
.A CO23-
.B HCO-3
.C Na+
.D NH+4
答案 D
7.(2019·宜昌高二检测)广义的水解观认为水解的物质和水分别离解成两部分,然后两两重 新结合成新的物质,不出现元素化合价的变化。根据以上信息,下列物质水解后的产物错误 的是( )
1/6
酸)性
答案 C
4.(2019·武汉高二检测)下列水解的离子方程式正确的是( )
. + + A Br- H2O HBr OH-
. + + B NH+4 2H2O NH3·H2O H3O+
. + + C CO23- 2H2O H2CO3 2OH-
. + ↓+ D Fe3+ 3H2O Fe(OH)3 3H+
.A CaCl2
.B CH3COONa
.C NH3
.D K2S
答案 D
10.物质的量浓度相同的下列各物质的溶液,由水电离出的 c(H+)由大到小的顺序是( )
高考化学复习盐类的水解含答案及解析

课后作业15盐类的水解〔时间:45分钟 总分值:100分〕一、选择题〔此题包括12小题,每题5分,共60分,每题只有一个选项符合题目要求〕 1 .〔2021 •浙江新高考研究联盟第二次联考 〕以下物质的水溶液因水解而呈酸性的是〔〕.A.NaHSO C.SO 2答案B解析NaHS “水溶液中电离:NaHSONa ++H ++S -,溶液显酸性是由于电离的缘故 ,故A 错误;〔NH 4〕2SO 属于强酸弱碱盐,其水溶液中存在:N +H 2O 一^NH • hbO+H,溶液因水解显酸性,故B 正 确;SO 2与水反响生成 H 2SO,H 2SO 电离:H 2SO ^=H ++HS - ,故因电离显酸性,C 错误;H 2SO 溶液因电离显酸性,D 错误.2 .空气中直接蒸发并蒸干以下盐的溶液 :①Fe 2〔SO 4〕3;②NaCO;③KCl;④CUCI 2;⑤KHCO 可以得到相应盐〔可以含有结晶水〕的是〔〕A.①②③B.①⑤C.②④D.③④⑤答案A解析蒸干CuCl 2溶液时,CuCl 2会水解为Cu 〔OH 〕2和HCl;蒸干KHCOB 液时,KHCO 会受热分解生成 &CO 、CO 和 HQ3 .有四种物质的量浓度相同且由 +1价阳离子 A B +和-1价阴离子X -、Y -组成的盐溶液,常温下AX溶液和BY 溶液的pH 都为7,AY 溶液的pH<7,BX 溶液的pH>7,那么可能不水解的盐是〔〕A.AXB.BXC.AYD.BY答案D解析AY 溶液的pH<7,说明A +发生水解反响:A ++HaO~-AOH+H 那么Y -可能不发生水解反响或发生水解 反响,但水解程度较 A +小;BX 溶液的pH>7,说明X 发生水解反响:X -+hbB^HX+OH 那么B +可能不发生 水解反响或发生水解反响,但水解程度较X 小,综上所述,含有X -或A +的盐,如AX BX AY 均能发生 水解反响,只有BY 可能不发生水解反响.4 .盐类水解在工农业生产和日常生活中有着广泛的应用 ,以下说法与盐类水解无关的是 〔 〕A.生活中常用明矶净水B.用热的纯碱溶液洗涤餐具上的油污C.用稀硫酸除去铜器外表的铜绿D.长期使用硫酸俊化肥的土壤 ,易变酸性,可施用适量的熟石灰答案CB.(NH 4)2SO D.H 2SO解析选项A 利用明矶水解生成的氢氧化铝胶体吸附水中的杂质 ;选项B 利用碳酸根离子水解使溶液显碱性,来清洗油污;选项C 中碱式碳酸铜溶于稀硫酸生成硫酸铜 ,与水解无关;选项D 中硫酸钱水 解导致土壤显酸性,所以可用熟石灰来中和.5 .为了配制N 的浓度和Cl -的浓度比为1 : 1的溶液,可在NHCl 溶液中参加( )A,适量的HCl B.适量的NaCl C.适量的氨水D.适量的NaOH答案C解析由于N 水解使NHCl 溶液中N 的浓度和C 「的浓度比小于1 : 1,要使N 的浓度和Cl -的浓度 比为1 : 1,可通过抑制水解并且增大N 的浓度到达目的.最好的方法是参加适量的氨水抑制N水解.A 项虽可抑制水解,但增加了 Cl -,B 项引入了 Na +,增加了 Cl -;D 项促进了水解,且引入了 Na +.6 .以下说法不正确的选项是( )A.NHkCl 溶液呈酸性说明 NH 3 - H 2O 是弱电解质 8 .醋酸钠溶液中 c (Na +)> c (CH 3CO .C.常温下,在1 mol • L -1的盐酸中参加等体积等浓度的氨水,溶液导电水平减弱D.常温下相同pH 的NaOH 容液和CHCOON 溶液中水电离出的 OH 浓度相同答案D 解析NHCl 溶液呈酸性,说明NHCl 是强酸弱碱盐,即NH • H 2O 是弱电解质,故A 正确;醋酸钠溶液中CHCOQK 解,所以c (Na +)>c (CH 3COO),故B 正确;常温下,在1mol • L -1的盐酸中参加等体积等浓度的氨水,离子浓度减小,溶液导电水平减弱,故C 正确;NaOH 抑制水的电离,CH 3COON 叙进水白^电离,故D 错误.• L -1氨水中滴入0.10 mol • L -1的盐酸,溶液的pH 与所加盐酸的体积关系如A.M 〜N'司一定存在 c (Cl -)> c (N )> c (OH)> c (H +)B.M 点对应的盐酸体积为 10.0 mLC.pH=7 时,溶液中有 c (N 尸c (Cl -)=c (H +)=c (OH)D.P 点所处的溶液中存在:2 c (N )+2c (NH 3 • HO)=c (Cl -)解析 A 项,不符合电荷守恒,M~N'可应存在 c (N )>c (Cl -)>c (OH)>c (H +)或 c (N )> c (OH)> c (Cl - )>c (H +),错误;M 点pH=7,此时氨水应稍过量,故盐酸体积小于10mL,B 项错误;当溶液pH=7 时,c (H +)=c (OH),再由电荷守恒 c (N )+c (H +)=c (OH)+c (Cl -),可推知 c (N 尸 c (Cl -),故有 c (N 尸c (Cl -)>c (H +)=c (OH)C 项错误;P 点时溶液相当于等物质的量浓度的NHCl 溶液和HCl 溶液等体积混合,由物料守恒可知 c (Cl -)=2[ c (N )+c (NH 3 - H 2O)],D 项正确.8.25 C 时某些弱酸的电离平衡常数如表所示 :CHCOOHHC1OH 2CO7.向 10.0 mL 0.10 mol 图所示(假设无气体逸出) 卜列有关表达正确的选项是 ( )常温下,稀释CHCOOH HC1O两种酸时,溶液的pH随加水量变化的曲线如下图 ,以下说法正确的选项是( )A.相同浓度的CHCOON和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)> c(C1O-)> c(CH3COQ> c(OH)> c(H+)-B.图像中a、c两点所处的溶液中 --------- 相等(HP代表CHCOO或HC1O)■ 一C.图像中a点酸的浓度大于b点酸的浓度D.向NaClO溶液中通入少量二氧化碳的离子方程式为2C1O-+CO+HO 2HC1O+C -答案B解析醋酸的电离常数大于次氯酸 ,所以醋酸钠的水解程度小于次氯酸钠,醋酸钠和次氯酸钠都是强碱弱酸盐,其混合溶液呈碱性,所以相同物质的量浓度的CHCOON和NaClO的混合液中,各离子浓度-的大小关系是:c(Na+)>c(CH3CO0>c(C1O-)>c(OH)>c(H+),故A错误;在 ----------- 的分子、分母上同时■ 一乘以c(H+)可得:一,由于水的离子积和电离平衡常数只受温度影响,a、c两点对应溶液的温度相同,故该比值相等,B正确;pH相等的CHCOOH HC1O,稀释相同白倍数时,较强酸中H+浓度小于较弱酸, 那么较弱酸的pH小于较强酸,酸fCHCOOH>HC1Of以a所在曲线表示CHCOOH,b所在曲线表示HC1O, 次氯酸的电离程度小于醋酸,所以醋酸的浓度较小,次氯酸的浓度较大,a、b两点相比,参加相同体积的水后仍然是次氯酸的浓度较大,即:图像中a点酸的浓度小于b点酸的浓度,C错误;碳酸的二级电离小于次氯酸,所以HC-的酸性弱于次氯酸,那么向NaClO溶液中通入少量二氧化碳的离子方程式为C1O-+CO+H2O HC1O+HC-,D 错误.9.NaHSQ§液显酸性,溶液中存在以下平衡:HS -+H O^H S Q+OH ①向0.1 mol • L-1的NaHSO溶液中分别参加以下物质,以下有关说法正确的选项是( )A.参加少量金属Na,平衡①左移,平衡②右移,溶液中c(HS-)增大B.参加少量N&SQ固体,那么c(H+)+c(Na+)=c(HS -)+c(OH)+-c(S -) —-C.参加少量NaOhB液, ------ 、——的值均增大-D.参加氨水至中性,那么2c(Na+)= c(S -)>c(H+)=c(OH)答案C解析A项,参加少量金属Na,Na与水反响生成NaOH,NaOH^和HS -, c(HS -)减小,c(S -)增大;B项,参加NaSQ固体,根据电荷守恒,c(Na+)+c(H+)=c(OH)+c(HS-)+2c(S -);C项,参加少量NaOH^夜,-平衡②右移使 ----- 增大; -- 也增大;D项,由电荷守恒,c(Na+)+c(N )+ c(H+)=c(OH-—)+c(HS ')+2 c(S "),可知D错.10.25 C时,相同体积和pH的NaX NaY NaZ三种物质的盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如以下图所示.以下说法正确的选项是( )A.在上述三种盐的原溶液中,水的电离度大小是NaX>NaY>NaZB.在等物质的量浓度的NaX NaY NaZ的混合液中,离子浓度的大小关系是c(Z-)> c(Y-)>c(X-)C.等体积、等pH的NaX溶液和NaY溶液混合后,溶液中存在————D.在0.2 mol • L-1 NaX溶液中参加等体积0.1 mol • L-1的盐酸,所得混合液中存在c(H+)+ c(HX)=c(OH)+ c(Cl -)答案D解析加水稀释促进盐类水解,稀释相同白倍数时,pH变化越大,说明该盐的水解程度越小,其相对应的酸的酸性越强,所以这三种酸的强弱顺序是HX>HY>HZM酸根离子水解程度的大小顺序是Z>Y>X,酸根离子的水解程度越大,水的电离程度越大.A项,因原溶液pH相同,故水的电离度大小相同,错误;B项,等物质的量浓度的NaX NaY NaZ的混合液中,酸根离子的水解程度越大,其溶液中酸根离子的浓度越小,所以离子浓度的大小关系是c(Z-)<c(Y-)<c(X-),错误;C项,酸的酸性弓II弱不同,等体积等pH的NaX溶液和NaY溶液中,X-和Y的水解程度不同,一、一可分别理解为X和Y的水解百 - -分数,二者不相等,所以该选项错误;D项,相当于等物质的量浓度的NaX NaCl、HX溶液等体积混合根据电荷守恒得c(H+)+c(Na+)= c(OH)+ c(Cl -)+ c(X-),根据物料守恒得c(Na+)= c(HX)+ c(X-)=2c(Cl -), 所以得c(H+)+c(HX)=c(OH)+c(Cl -),正确.11.离子浓度是分析溶液性质的重要尺度.以下对离子浓度的分析,正确的选项是( )A.常温下,物质的量浓度均为0.1 mol • L-1的HA溶液和BOHB液,pH分别为2和13,将两溶液等体积混合,所得混合溶液中:c(A-)>c(B+)> c(H+)>c(OH-)B.常温下,pH=2的HCl溶液与pH=12的氨水等体积混合后,所得溶液的pH=9,那么混合溶液中:c(Cl- _ -+)>c(N )> c(OH)>c(H )C.NaHCO容液呈碱性,那么0.1 mol - L-1 NaHCQ溶液中存在以下关系:c(H+)+2 c(H?CO)= c(OH)+c(C -)D.少量的HA与NaB反响,最终产物为NaH解口HB;又知HC的酸性强于HA.现有pH相同的NaA NaB NaC三种溶液,其离子浓度关系为:c(C-)>c(B-)> c(A2-)答案D解析A项,HA与BOH勺物质的量相等,刚好完全反响生成BA;由0.1mol • L-1HA溶液和BOH容液的pH 分别为2和13可知,HA为弱酸、BOH^强碱,所以BA为强碱弱酸盐,A-在溶液中要发生水解,溶液呈碱性,A项错误.B 项,由于氨水物质的量浓度大于盐酸,故反响后溶液呈碱性,氨水相对于HCl溶液过量,NH3 • H2O发生电离,从而导致c(N )>c(Cl -),B项错误.根据质子守恒,NaHCO溶液中存在c(OH)=c(H+)+c(H2CO)- c(C -),故C项错误.D项,由少量的HA与NaB反响,最终产物为NaHAF口HB可知,HA-与B-不反响,说明HB的酸性强于HA的酸性,即A2-的水解程度大于B的水解程度,pH相同时,c(B-)>c(A2-);由于HC的酸性强于H2A,所以C-水解水平最弱,产生相同浓度的OH时所需浓度最大,D项正确.12 .常温下,以下图是用0.100 0 mol - L-1 NaOH溶液滴定20.00 mL 0.100 0 mol - L-1 HA溶液所得到的滴定曲线.以下相关的说法错误的选项是( )A.由图可知HA是一种弱酸,且K=1.0X10-5B.滴定到B点时,c(Na+)= c(A-)C.当NaOH§液的体积为10.00 mL 时,有c(A-)+c(OH)= c(H+)+c(HA)D.C点溶液中的离子浓度关系为c(Na+)>c(A-)答案C解析起始时溶液的pH=3,说明c(H+)=0.001mol • L-1,而HA浓度为0.1mol • L-1,故HA是弱酸;K a=-:——----------------- =1.0 X10-5,A正确.B点时溶液呈中性,那么c(H+)=c(OH)由电荷守恒c (Na +)+c (H +)=c (A -)+c (OH)可知 c (Na +)=c (A -),B 正确.假设参加 10mLNaOH^,溶液中溶质为等物质 的量HA 和NaA,由物料守值c (A -)+c (HA)=2c (Na +)和电荷守恒 c (Na +)+ c (H +)= c (A -)+ c (OH'),叠加可得 c (Na +)+c (OH)=c (H +)+ c (HA),而此时溶液呈酸性,溶液呈酸性时 c (A -)> c (Na +),那么 c (A -)+ c (OH- )>c (H +)+c (HA),C 错误;C 点溶液 pH>7,即 c (OH -)>c (H +),由电荷守恒 c (Na +)+c (H +)= c (A -)+ c (OH -),可 知 c (Na +)>c (A -),D 正确.二、非选择题(此题包括4小题,共40分)分)X 、Y 、Z 、W 分别是HNa NHNO 、NaOH NaNO 四种强电解质中的一种.下表是常温下浓-1 ,0.01 mol - L 的 X 、Y 、Z 、W§放的 pH .(1)X 、W 的化学式分别为、. (2)W 的电离方程式为_.(3)25 C 时,Z 溶液的pH>7的原因是(用离子方程式表示) (4)将X 、Y 、Z 各1 mol 同时溶于水中制得混合溶液,那么混合溶液中各离子的浓度由大到小的顺序 为(5)Z 溶液与W 溶液混合加热,可产生一种无色无味的单质气体 ,该反响的化学方程式为答案(1)NaOH NHNO(2)NH 4NO N +N— -(3)N +HO -HNO+OH(4) c (Na +)> c (N -)>c (N -)>c (OH-)> c (H +)△人(5)NaNO 2+NHNO --- NaNO+NJ +2H 2O解析从表中溶液的 pH 可知X 、Y 、Z 、底别为NaOHHNQ NaN0 NHNO .(4)所得溶液为等物质的量的NaNQ NaNO 的混合溶液,故溶液呈碱性,离子浓度大小顺序为 c (Na +)> c (N -)>c (N ')>c (OH- )>c (H +) o(5)NaNO 2与NHNO 溶液混合生成的无色无味的气体应为N 2,是由于NaNO 中+3价的氮元素与N 中-3价的氮元素发生归中反响产生的:NaNQ+NHNONaN@N4 +2HO .14.(5分)直接排放含SO 的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO .吸收液吸收SO 的过程中,pH 随n (S -) : n(HS -)变化关系如下表:13.(10 度均为(1)由上表判断,NaHSO溶液显性,用化学平衡原理解释(2)当吸收液呈中性时,溶液中离子浓度关系正确的选项是(选填字母).a.c(Na+)=2 c(S -)+c(HS -)b.c(Na+)>c(HS -)>c(S -)>c(H+)=c(OH)c.c(Na +)+ c(H+)= c(S -)+ c(HS -)+ c(OH)答案⑴酸HS-存在:HS --h f+S -和HS-+HO—~t H2SO+OH,HS -的电离程度大于水解程度(2)ab解析由表给数据n(S -) :n(HS -)=9 : 91时,溶?夜pH=6.2,所以亚硫酸氢钠溶液显酸性.亚硫酸氢根离子在溶液中存在两种变化趋势,电离趋势使溶液显酸性,水解趋势使溶液显碱性,溶液显酸性是由于电离趋势大于水解趋势;由表给数据n(S -) : n(HS -)=1 : 1时,溶液pH=7.2,可知吸收液显中性时溶液中c(S )<c(HS ),所以(2)中b项正确;依据电荷守恒:c(Na+)+c(H+)=2c(S -)+ c(HS -)+c(OH)及c(H+)=c(OH)可判断a 正确.15.(12分)某二元弱酸(简写为H2A)溶液,按下式发生一级电离和二级电离:H2A^HA+H:HA ■一^一+乩相同浓度时的电离程度 a (H2A)> a (HA-),设有以下四种溶液:A.0.01 mol - L-1的HA 溶液B.0.01 mol - L-1的NaHA§液C.0.02 mol • L-1的HCl溶液与0.04 mol • L-1的NaHA容液的等体积混合液D.0.02 mol - L-1的NaOH容液与0.02 mol • L-1的NaHA溶液的等体积混合液据此,填写以下空白(填代号).(1)c(H+)最大的,最小的.(2)c(H2A)最大的,最小的.(3)c(A2-)最大的,最小的.答案(1)A D (2)C D (3)D A16.(13分)有A、B、G D四种强电解质,它们在水中电离时可产生以下离子(每种物质只含一种阳离子和一种阴离子且互不重复)::①A、C溶液的pH均大于7,B溶液的pH小于7,A、B的溶液中水的电离程度相同;D溶液焰色反响显黄色.②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象.(1)A的名称是.(2)写出C溶液和D溶液反响的化学方程式:.(3)25 C时pH=9的A溶液和pH=9的C溶液中水的电离程度小的是 (填A或C的化学式).(4)25 C时用惰性电极电解D的水溶液,一段时间后溶液的pH(填“ >〞“<〞或“ =")7.(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反响后溶液中各种离子的浓度由大到小的顺序为(6)室温时在一定体积0.2 mol • L-1的C溶液中,参加一定体积的0.1 mol • L-1的盐酸时,混合溶液的pH=13,假设反响后溶液的体积等于C溶液与盐酸的体积之和,那么C溶液与盐酸的体积比是 _.答案⑴醋酸钾(2)Ba(OH) 2+N&SO=BaSO j +2NaOH⑶Ba(OH) 2(4)=(5)c(OH)> c(Ba2+)= c(Cl -)> c(N )> c(H+)或c(OH)> c(Cl -)= c(Ba2+)> c(N )> c(H+)(6)2 : 3解析这八种离子形成的碱性物质中一定含有OH或CHCOQ而酸性物质那么只可能含有N ,即为水解显酸性的盐,又因A、B的溶液中水的电离程度相同,那么A应为水解显碱性的物质,那么一定为CHCOO 形成的盐,C中含有OH.D中除含Na+外,另一种离子与C中的阳离子可形成白色沉淀,因此D为NaSO,而C为Ba(OH)2,B 一定为NHCl;剩余的离子形成CHCOOK溶液显碱性.盐类水解促进水的电离,而参加酸或碱将抑制水的电离.电解NaSO溶液相当于电解水,溶质的浓度增大,但溶液仍为中性.NHCl与Ba(OH)2等物质的量混合时,Ba(OH) 2过量,而不发生水解的Cl- 与Ba2+的物质的量相等.盐酸与Ba(OH)2溶液混合后显碱性,那么c(OH )= 0.1mol • L-1,即可推出V(碱):V(酸)=2 : 3.。
(完整word版)《盐类的水解》习题解析.docx

高二化学加强班教学资料专题二盐类水解[知识要点]一、 盐类水解的概念:1、 概念:在溶液屮盐的离子跟水所电离出来的H +或OH^生成弱电解质的反应。
2、 实质:盐电离出的离子(弱碱阳离子、弱酸阴离子)使水的电离平衡正向移动,促进水的电离。
3、 特点:可逆、微弱、吸热。
二、 各种盐水解的情况:强酸弱碱盐一一水解,溶液呈酸性, pH <7 强碱弱酸盐一一水解,溶液呈碱性, PH > 7 强酸强碱盐一一水解,溶液呈中性,pH=7弱酸弱碱盐一一水解程度大,溶液酸碱性看弱酸弱碱的相对强弱。
熟记口决:谁弱谁水解,谁强呈谁性。
两强不水解,溶液呈中性。
两弱双水解,溶液待分析。
三、盐类水解离子方程式的书写:1、只有弱酸根离子或弱碱根离子才能水解。
2、水解是可逆反应,要用“,而不用“二二”3、 一般情况下,水解反应程度较小,不会生成沉淀和气体,不写“(”和“ f ” o4、 多元弱酸根离子,它的水解是分步进行的 ,第一步水解趋势远大于第二步水解,因此在书写离子方程式时一般只写第一步。
四、影响盐类水解因素:1、 内因:盐的本性决定,如:酸性越弱的酸根离子,水解程度越大。
例如在相同条件下,溶液的PH值:Na2SiO3 >Na2CO3>Na 2SO3 2、 外因:①温度:温度越高,水解程度越大② 酸碱性:改变溶液的PH 值,可以抑制或促进水解。
例如在FCCl 3溶液中加酸会抑制水解。
③ 浓度:盐溶液浓度越小,水解程度越大。
五、需要考虑盐类水解的几种情况:1、判断盐溶液的酸碱性和比较溶液 PH 值大小时要考虑此盐是否水解。
例如相同浓度的① NH 4C1、②Na2CO3、③KoH 、④H2SO4、⑤Na2SO4>⑥CHsCOONa 六种 物质的溶液,它们的PH 值大小是③ >② >⑥>⑤ >① >④。
2、 分析盐溶液屮的离子种类和比较盐溶液中离子浓度大小时要考虑此盐是否水解。
高二化学盐类的水解试题答案及解析

高二化学盐类的水解试题答案及解析1.常温下,将C1 mol·L-1的盐酸和C2mol·L-1的氨水等体积混合,下列叙述错误的是A.c(NH4+)+c(H+)=c(Cl-)+c(OH-)B.当C1= C2时,c(NH4+)+c(NH3·H2O)=c(Cl-)C.当pH=7,一定是C2>C1D.当pH<7,一定是C1=C2【答案】D【解析】A、符合电荷守恒规律,正确;B、当C1= C2时,盐酸与氨水等物质的量混合,恰好生成氯化铵,根据物料守恒得c(NH4+)+c(NH3·H2O)=c(Cl-),正确;C、 pH=7溶液呈中性,氨水物质的量应大于盐酸的物质的量,正确;D、当pH<7时,盐酸与氨水恰好反应或盐酸过量都会使溶液呈酸性,C1=C2或C1>C2,错误,答案选D。
【考点】考查溶液混合的判断2.下列各离子浓度的大小比较,正确的是()A.同浓度下列溶液中:① (NH4)2SO4② NH4HCO3③ NH4Cl④ NH3·H2O,c(NH4+)由大到小的顺序是:① > ③ > ② > ④B.常温时,将等体积的盐酸和氨水混合后,pH = 7,则c (NH4+) > c (Cl-)C.0.2 mol·L-1 Na2CO3溶液中:c (OH-) =" c" (HCO3-) + c (H+) + c (H2CO3)D.0.01 mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合: c (Cl-)> c (NH4+)> c(Na+)>c (OH-)>c (H+)【答案】A【解析】A.同浓度下列溶液中:① (NH4)2SO4② NH4HCO3③ NH4Cl④ NH3·H2O,c(NH4+)由大到小的顺序是:① > ③ > ② > ④,正确;B.常温时,将等体积的盐酸和氨水混合后,pH = 7,则根据电荷守恒可得c (NH4+) ="c" (Cl-),错误;C.0.2 mol·L-1 Na2CO3溶液中:根据质子守恒可得c (OH-) =" c" (HCO3-) + c (H+) + 2c (H2CO3),错误;D.0.01 mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合,得到的是NaOH、NaCl、NH3·H2O按照4:1:1的混合物。
高考化学第一轮复习备考复习配套试题:盐类的水解(含解析)

盐类的水解(附参考答案)时间:4分钟分值:100分一、选择题(共48分,每小题4分)1.下列说法中错误的是()A.在Na2S溶液中滴入酚酞试液,呈红色B.硫酸铵溶液显酸性C.一切钾盐、钠盐、硝酸盐都不发生水解D.醋酸盐溶于水能发生水解[答案]C[解析]Na2S水解使溶液显碱性,滴入酚酞试液,呈红色;硫酸铵是强酸弱碱盐,其水解使溶液显酸性;钾的弱酸盐、钠的弱酸盐、硝酸的弱碱盐都能发生水解;醋酸盐中存在弱酸根离子(CH3COO-),溶于水时能发生水解。
2.下列运用与碳酸钠或碳酸氢钠能发生水解的事实无关的是()A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞B.泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫C.厨房中常用碳酸钠溶液洗涤餐具上的油污D.可用碳酸钠与醋酸制取少量二氧化碳[答案]D[解析]A项是因为Na2CO3水解显碱性与玻璃中的SiO2作用生成黏性的Na2SiO3;B是因为NaHCO3与Al2(SO4)3相互促进水解:Al3++3HCO-3 ===Al(OH)3↓+3CO2↑;C是因为CO2-3水解显碱性,能够除去油污;D项与盐类的水解无关。
3.在一定条件下,Na2CO3溶液存在水解平衡:CO2-3+H2O HCO-3+OH -。
下列说法正确的是( )A .稀释溶液,水解平衡常数增大B .通入CO 2,平衡向正反应方向移动C .升高温度,c (HCO -3)c (CO 2-3)减小 D .加入NaOH 固体,溶液pH 减小[答案]B[解析]温度一定,水解平衡常数不变,选项A 错;通入二氧化碳,二氧化碳与OH -反应生成HCO -3,OH -浓度减小,平衡向正反应方向移动,选项B 正确;水解反应是吸热反应,升高温度,平衡向正反应方向移动,HCO -3浓度增大,而CO 2-3浓度减小,故c (HCO -3)c (CO 2-3)增大,选项C 错误;加入NaOH ,NaOH 电离,溶液中OH -增大,pH 增大,选项D 错误。
2019年高考化学试题及参考答案(上海卷)

申论热点:政府职能转变与公共治理推进政府职能转变,需要将政府与市场、社会之间的职能重新调整、配置和组合,其总体思路是把政府职能转到经济调节、市场监管、社会管理、公共服务上来,把不应由政府行使的职能逐步转移给市场、社会。
形象地说,政府的基本职能是当好“掌舵者”和“监管者”,其他职能大都应“外移”给市场、社会。
同时,政府职能转变不仅包括政府职能内容的转变,还包括政府行使职能方式的转变、政府职能的重新配置以及相应政府机构的调整和改革。
一是政府职能的外部转移。
即政府按照发展社会主义市场经济的要求,将不应属于自己的职能移交给市场、社会,防止政府越位,同时行使好属于自己的职能,避免政府缺位。
二是政府职能的内部转移。
即政府内部纵向层级之间和横向部门之间职能的科学配置、合理划分。
职能的设计、配置、分解应遵循权责一致原则。
三是行政管理方式的转变。
包括政府部门的工作方式、工作作风、运作程序以及行政管理的手段等。
实现政府职能转变,提高公共治理能力,当前应从以下几方面着力。
实行公共物品提供主体多元化。
由政府独家提供公共物品和服务的传统模式已经不能满足公共事务和社会发展的需要。
可以借鉴国际经验,在加强宏观调控和监管的前提下,将竞争机制引入公共服务领域,在一定范围内允许和鼓励私营部门提供公共服务。
例如,在电信、电力、铁路运输、自来水和燃气供应等基础产业的一些环节就可以实行引入竞争机制的改革。
实行公共物品提供主体多元化,形成公共物品供给的竞争机制,有利于提高公共物品供给效率,更好地实现社会效益和经济效益的统一。
培育社会组织。
政府难以独自承担纷繁复杂的社会事务,其中的大量事务也不适合直接由政府处理,需要由社会组织来补位。
社会组织可以在政府部门与千千万万的居民和经济社会主体之间发挥桥梁纽带和组织协调作用。
近年来,社会组织在消除贫困、农村发展、文化教育、卫生保健、妇女儿童保护、扶持中小企业发展、赈济救灾、生态环境保护以及人道主义救援等方面的作用日益突出。
高考化学 真题透析 第3讲 盐类的水解(精讲深剖)(含解析)

第3讲盐的水解真题速递1.(2019新课标Ⅰ)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
下列叙述错误的是A.混合溶液的导电能力与离子浓度和种类有关B.Na+与A2−的导电能力之和大于HA−的C.b点的混合溶液pH=7D.c点的混合溶液中,c(Na+)>c(K+)>c(OH−)【答案】C【解析】A项、向邻苯二甲酸氢钾溶液中加入氢氧化钠溶液,两者反应生成邻苯二甲酸钾和邻苯二甲酸钠,溶液中Na+和A2—的浓度增大。
由图像可知,溶液导电性增强,说明导电能力与离子浓度和种类有关,故A 正确;B项、a点和b点K+的物质的量相同,K+的物质的量浓度变化不明显,HA—转化为A2—,b点导电性强于a点,说明Na+和A2—的导电能力强于HA—,故B正确;C项、b点邻苯二甲酸氢钾溶液与氢氧化钠溶液恰好完全反应生成邻苯二甲酸钾和邻苯二甲酸钠,邻苯二甲酸钾为强碱弱酸盐,A2—在溶液中水解使溶液呈碱性,溶液pH>7,故C错误;D项、b点邻苯二甲酸氢钾溶液与氢氧化钠溶液恰好完全反应生成等物质的量的邻苯二甲酸钾和邻苯二甲酸钠,溶液中c(Na+)和c(K+)相等,c点是继续加入氢氧化钠溶液后,得到邻苯二甲酸钾、邻苯二甲酸钠、氢氧化钠的混合溶液,则溶液中c(Na+)>c(K+),由图可知,a点到b点加入氢氧化钠溶液的体积大于b点到c点加入氢氧化钠溶液的体积,则溶液中c(K+)>c(OH—),溶液中三者大小顺序为c(Na+)>c(K+)>c(OH—),故D正确。
2.(2019北京)实验测得0.5 mol·L−1CH3COONa溶液、0.5 mol·L−1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。
下列说法正确的是A .随温度升高,纯水中c (H +)>c (OH −) B .随温度升高,CH 3COONa 溶液的c (OH −)减小C .随温度升高,CuSO 4溶液的pH 变化是K w 改变与水解平衡移动共同作用的结果D .随温度升高,CH 3COONa 溶液和CuSO 4溶液的pH 均降低,是因为CH 3COO −、Cu 2+水解平衡移动方向不同 【答案】C【解析】A.水的电离为吸热过程,升高温度,平和向着电离方向移动,水中c(H +).c(OH -)=Kw 减小,故pH 减小,但c(H +)=c(OH -),故A 不符合题意;B.水的电离为吸热过程,升高温度,进水的电离,所以c(OH -)增大,醋酸根水解为吸热过程,CH 3COOH -+H 2O 垐?噲?CH 3COOH+OH -,升高温度促进盐类水解,所以c(OH -)增大,故B 不符合题意;C.升高温度,促进水的电离,故c(H +)增大;升高温度,促进铜离子水解Cu 2++2H 2O 垐?噲?Cu(OH)2 +2H +,故c(H +)增大,两者共同作用使pH 发生变化,故C 符合题意;D.盐类水解为吸热过程,升高温度促进盐类水解,故D 不符合题意。
2019高考化学考点47 盐类的水解Word版含解析

一、盐类的水解及其规律1.定义在溶液中盐电离出来的离子跟水电离产生的H+或OH-结合生成弱电解质的反应。
2.实质3.特点4.水解的规律及类型有弱才水解,越弱越水解;谁强显谁性,同强显中性。
否中性是、酸性是CH 3COO注意:(1)弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
①若电离程度小于水解程度,溶液显碱性。
如NaHCO 3溶液中:H ++(次要),HCO 3-+H 2OH 2CO 3+OH -(主要)。
②若电离程度大于水解程度,溶液显酸性。
如NaHSO 3溶液中:HSO 3-H ++SO 32-(主要),HSO 3-+H 2OH 2SO 3+OH -(次要)。
(3)相同条件下的水解程度:正盐>相应酸式盐,如>。
(4)相互促进水解的盐>单独水解的盐>水解相互抑制的盐。
如的水解:(NH 4)2CO 3>(NH 4)2SO 4>(NH 4)2Fe(SO 4)2。
5.水解方程式的书写 (1)一般要求如NH 4Cl 的水解离子方程式为+H2O NH3·H2O+H+。
(2)三种类型的盐水解方程式的书写。
①多元弱酸盐水解:分步进行,以第一步为主,一般只写第一步水解方程式。
如Na2CO3的水解离子方程式为+H2O+OH-。
②多元弱碱盐水解:水解离子方程式一步写完。
如FeCl3的水解离子方程式为Fe3++3H2O Fe(OH)3+3H+。
③阴、阳离子相互促进的水解:水解程度较大,书写时要用“===”、“↑”、“↓”等。
如Na2S溶液与AlCl3溶液混合反应的水解离子方程式为2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑。
二、盐类水解的影响因素1.内因弱酸根离子、弱碱阳离子对应的酸、碱越弱,就越易发生水解,溶液的碱性或酸性越强。
如:酸性:CH3COOH>H2CO 3相同浓度的NaHCO3、CH3COONa溶液的pH大小关系为NaHCO3>CH3COONa。
盐类水解高考模拟题附答案
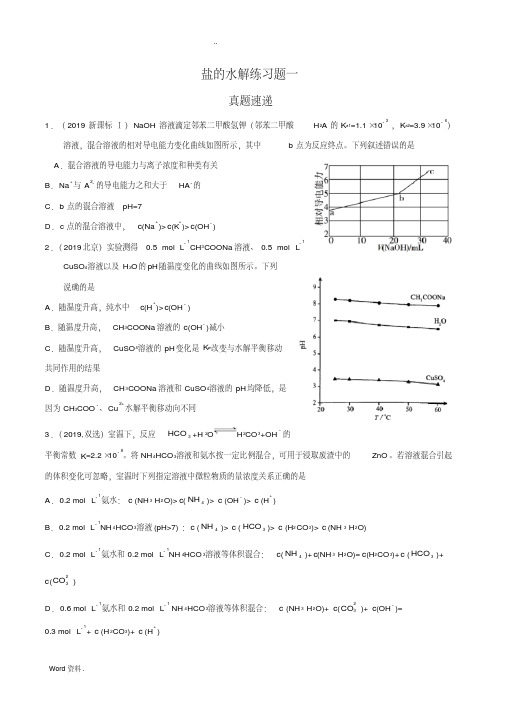
说确的是 A.随温度升高,纯水中 c(H+)> c(OH - ) B.随温度升高, CH3COONa 溶液的 c(OH - )减小
C.随温度升高, CuSO4溶液的 pH 变化是 Kw改变与水解平衡移动
共同作用的结果
D.随温度升高, CH3COONa 溶液和 CuSO4溶液的 pH 均降低,是 因为 CH3COO - 、 Cu 2+ 水解平衡移动向不同
Word 资料 .
..
-
A.常温下, c(Cl )均为 0.1mol/LNaCl 溶液与 NH 4Cl 溶液, pH 相等
B.常温下,浓度均为 0.1mol/L 的 CH3COOH 溶液与 HCl 溶液,导电能力相同
-
-
C.常温下, HCl 溶液中 c(Cl )与 CH3COOH 溶液中 c(CH3COO )相等,两溶液的 pH 相等
A. 0.1000 mol
·L- 1 H2C2O 4 溶液:
+
c(H ) =0.1000 mol
·L-
1
+
c(C2
O
2 4
-
)+ c(OH - )- c(H2C2 O4 )
+
B. c(Na ) = c(总 )的溶液:
+
c(Na
)
>
c(H2C2O 4
)
>
c(C2O
2 4
-
+
) > c(H
)
C. pH = 7
溶液的体积相等
C. 0.2 mol ?L— 1 HCOOH 与 0.1 mol ?L— 1 NaOH 等体积混合后的溶液中:
C(HCOO —) +c(OH —) =c(HCOOH) +c(H
高考盐类的水解经典习题含解析 教师

第三节盐类的水解一、单项选择题1.水中加入下列溶液对水的电离平衡不产生影响的是()A.NaHSO4溶液B.KF溶液C.KAl(SO4)2溶液D.Na I溶液解析:F-、Al3+的水解能促进水的电离;NaHSO4电离出的H+能抑制水的电离,I-对应的酸(HI)为强酸,故NaI溶液对水的电离平衡无影响。
答案:D1题变式1-1.(双选)25 ℃时,某浓度的氯化铵溶液的pH=4,下列叙述中正确的是()A.溶液中的c(OH-)=1×10-10mol·L-1B.溶液中的c(NH错误!)>c(Cl-)>c(H+)>c(OH-)C.溶液中的c(H+)+c(NH错误!)=c(Cl-)+c(OH-)D.溶液中的c(NH3·H2O)=c(NH\o\al(+,4))解析:A项中由K w可计算出c(OH-)=1×10-10mol·L-1,所以A项正确,B 项中因为NH错误!水解,故c(Cl-)>c(NH 错误!),所以B项错误;C项中符合电荷守恒,所以C项正确;D项中NH错误!的水解程度较小,故c(NH3·H2O)小于c(NH\o\al(+,4)),所以D项错误。
答案:AC2.已知某溶液中只存在OH-、Cl-、NH 错误!、H+四种离子,下列说法不正确的是()A.若溶液中c(NH错误!)=c(Cl-),则该溶液一定显中性B.若溶液中c(NH错误!)>c(Cl-)>c(OH-)>c(H+),则溶液中一定含有NH4Cl和NH3·H2OC.若溶液中c(Cl-)>c(NH错误!)>c(H+)>c(OH-),则溶液中可能含有NH4Cl 或可能含有NH4Cl和HClD.若溶液中c(Cl-)>c(H+)>c(NH 错误!)>c(OH-),则溶液中含有大量的NH4Cl和少量的HCl解析:A项,若溶液中c(NH错误!)=c(Cl -),由电荷守恒知c(OH-)=c(H+),则该溶液一定显中性;B项,溶液呈碱性,溶质只能是NH4Cl和NH3·H2O;C项,溶液呈酸性,溶质可能含有NH4Cl或可能含有NH4Cl 和HCl,但若溶质是大量的NH4Cl和少量的HCl,则c(Cl-)>c(NH+4)>c(H+)>c(OH -),D项错误。
高中化学水解知识点总结及习题(有答案)

高中化学水解知识点总结(zǒngjié)及习题(有答案)高中化学水解(shuǐjiě)知识点总结及习题(有答案)一、盐类水解(shuǐjiě)的实质盐电离出来的某些离子(一般是弱酸根离子或弱碱阳离子)跟水电离出来的H+或OH-结合(jiéhé)生成了弱电解质,促使水的电离平衡发生移动,结果溶液中c(H+)、c(OH-)发生了相对改变,从而使溶液呈一定的酸碱性。
盐类的水解(shuǐjiě)程度一般都很小,且是可逆反响,书写水解方程式时要用“〞表示。
因水解是微弱的,平衡时生成的弱电解很少,所以一般不会产生沉淀和气体,生成物不应加沉淀符号(↓)或气体符号(↑)。
二、盐类水解的类型和规律1、强碱弱酸盐水解,溶液呈碱性,pH>7,如a、NaCO3等。
多元弱酸根离子是分步水解的,且第一步水解程度>>第二步水解程度,溶液的酸碱性主要决定于第一步水解程度。
如Na2CO3在水溶液中水解应分两步写:①CO32-+H2OHCO3-+OH-,②HCO3-+H2OH2CO3+OH-多元弱酸的酸式根离子同时具备电离和水解两种趋势:HR-H+---+R2(电离,呈酸性),HR+H2OH2R+OH(水解,呈碱性),这需要具体分析。
很显然如果电离趋势占优势,那么显酸性,如:---H2PO4、HSO3,如果水解趋势占优势,那么显碱性,如:HCO3、HS-、HPO42-等。
2、强酸弱碱盐水解,溶液呈酸性,pH4、溶液的酸碱性盐类水解后,溶液会呈现不同的酸碱性。
因此,控制溶液的酸碱性可以促进或抑制盐的水解。
如在配制FeCl3溶液时常参加少量盐酸来抑制FeCl3水解。
四、盐类水解的应用水解的应用实例原理+3Al+3H2OAl(OH)3(胶明矾净水+1、净水体)+3H2、去油污用热碱水冼油污物品CO32-+H2O+△HCO3-+OH -Fe3+3H2OFe(OH)3+3H+CO32-+H2OHCO3-+-OH假设不然,那么:由MgCl26H2O制无水MgCl26H2O△Mg(OH)2+4、制备无水盐MgCl2在HCl气流中加热2HCl+4H2O△Mg(OH)2MgO+H2O①配制FeCl3溶液时常参加少量盐酸3、药品的保存②配制Na2CO3溶液时常参加少量NaOH用Al2(SO4)3与NaHCO3溶液Al3++3HCO3-=Al(OH)3↓+5、泡沫灭火器混合3CO2↑NH4+H2+H6、比拟盐溶液比拟NH4Cl溶液中离子浓度+中离子浓度的的大小c(Cl-)>c(NH4+)>c(H +)>大小c(OH)-例1、浓度为0.1mol/L的八种溶液:①HNO3②H2SO4③④Ba(OH)2⑤NaOH⑥a⑦KCl⑧NH4Cl,其pH值由小到大的顺序为。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
易错点15 盐的水解、难溶电解质的溶解平衡小题快练1.关于下列图像的说法正确的是A.图 1 表示:密闭容器中发生的反应 NH2COONH4(s)⇌2NH3(g)+CO2(g),NH3的体积分数ψ(NH3)与时间(t)的关系B.图 2 表示:一定量饱和氯水中加入 CaCO3固体,溶液中的 c(Cl-)与加入 CaCO3物质的量关系C.图3表示:NH4HSO4溶液中加入NaOH固体,溶液中的c(NH4+)与加入NaOH质量的关系D.图4表示:25℃时,Na2S溶液加水稀释,溶液中的c(H+)与加入水的体积的关系【答案】D2.下列反应中,第一步反应生成的沉淀经第二步反应后质量增加的是A.将少量FeCl2溶液加入到NaOH溶液中,再滴加H2O2溶液B.将少量AgNO3溶液滴加到NaBr溶液中,再滴加Na2S溶液C.将少量CO2(g)通入饱和Ca(OH)2溶液中,再通入过量Cl2(g)D.将少量Ba(OH)2溶液滴加到入A12(S04)3溶液中,再加入过量NaOH溶液【答案】A【解析】A、将少量FeCl2溶液加入到NaOH溶液中生成Fe(OH)2悬浊液,再滴加H2O2溶液,转化为Fe(OH)3沉淀,生成的沉淀质量增加,选项A符合;B、将少量AgNO3溶液滴加到NaBr溶液中生成AgBr沉淀,再滴加Na2S溶液,沉淀转化为Ag2S沉淀,相当于1molAgBr→ molAg2S,生成的沉淀质量减少,选项B不符合;C、将少量CO2(g)通入饱和Ca(OH)2溶液中生成CaCO3沉淀,再通入过量Cl2(g)发生反应:CaCO3+2Cl2+H2O=CaCl2+CO2+2HClO,生成的沉淀质量减少,选项C不符合;D、将少量Ba(OH)2溶液滴加到入Al2(SO4)3溶液中生成Al(OH)3和BaSO4沉淀,再加入过量NaOH溶液,发生反应:Al(OH)3+NaOH= NaAlO2+2H2O,Al(OH)3沉淀溶解,生成的沉淀质量减少,选项D不符合。
3.已知K sp(CaCO3)=3.36×10—9,K sp(CaF2)=3.45×10—11。
下列关于CaCO3和CaF2两悬浊液说法错误的是A. CaCO3悬浊液中c(Ca2+)较小B.分别滴加稀硫酸,溶度积常数均增大C.分别加入0.1mol/L的CaCl2溶液,c(CO32—)和 c(F—)均减小D. CaF2更容易转化成CaCO3【答案】B4.一定温度下,两种碳酸盐MCO3和(M分别为A和B两种离子)的沉淀溶解平衡曲线如图所示。
已知:pM=−lg c(M),p(CO32−)=−lg c(CO32−)。
已知A CO3比B CO3溶解度更大。
(不考虑阴阳离子的水解)。
下列说法正确的是( )A.线a表示A CO3的溶解平衡曲线B.该温度下,向A CO3的饱和溶液中加入Na2CO3溶液,一定能产生沉淀C.向0.1L 1mol/L的BCl2溶液中加入Na2 CO3固体,当加入Na2CO3固体的质量为116.6g时,B2+离子恰好沉淀完全(B2+离子为10—5mol/L时认为沉淀完全)D.ACO3的Ksp=10—4.4【答案】C5.下列实验对应的现象以及结论均正确的是【答案】B【解析】裂化汽油含有碳碳双键,能与溴水发生加成反应,故A错误;钠能置换出羟基上的氢,故B正确;SO2通入Ba(ClO)2溶液中,SO2被氧化为硫酸,生成白色不溶于酸的硫酸钡沉淀和盐酸,所以不能证明酸性:H2SO4>HClO,故C错误;溶度积常数越小,越难溶,向相同浓度的ZnSO4溶液和CuSO4溶液中通入H2S,前者无现象,后者有黑色沉淀生成,说明K sp(ZnS)>K sp(CuS),故D错误。
6.下列选项正确的是A.25℃时,AgBr在0.01mol/L的MgBr2溶液和NaBr溶液中的溶解度相同B. NaCN溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(HCN)C.25℃时,将0.01mol/L的醋酸溶液加水不断稀释,减小D. Na2CO3、NaHCO3溶液等浓度等体积混合后: 3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]【答案】B7.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法错误的是A.温度一定时,K sp(SrSO4)随c(SO42-)的增大而减小B.三个不同温度中,313K时K sp(SrSO4)最大C. 283K时,图中a点对应的溶液是不饱和溶液D. 283K下的SrSO4饱和溶液升温到363K后还是饱和溶液【答案】A【解析】A、K sp只与温度有关与浓度无关,故A错误;B.由图像可知313K时离子浓度最大,则313K时K SP(SrSO4)最大,故B正确;C、a点在283K的下方,属于不饱和溶液,故C正确;D、283K下的SrSO4饱和溶液升温到363K后会有晶体析出,还是属于饱和溶液,故D正确。
8.向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。
沉淀的生成的pH 列于下表(已知:偏铝酸钡易溶于水)。
以下推断正确的是A. OA段产生的沉淀为BaSO4和Fe(OH)3B.据图计算原溶液中c(Cl-)=c(SO42-)C. AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4↓+Al(OH)3↓D. C点溶液呈碱性是因为AlO2-水解,离子方程式为:AlO2-+2H2O=Al(OH)3+OH-【答案】B9.下表实验、现象和结论均正确的是+KSCNFe(SCN)【答案】B10.氯酸镁[Mg(ClO 3)2]常做催熟剂、除草剂等,实验室利用卤块制备少量Mg(ClO 3)2·6H 2O ,已知:卤块的主要成分为MgCl 2·6H 2O ,含有MgSO 4、FeCl 2等杂质。
工艺流程如下:下列说法不正确...的是 A . 可以用酸性H 2O 2溶液代替KMnO 4溶液 B . 滤渣的主要成分是BaSO 4和Fe(OH)2 C . 加入NaClO3饱和溶液发生了复分解反应D . 调节溶液pH =4,还可以防止Mg(ClO 3)2·6H 2O 结晶时Mg 2+的水解 【答案】B11.根据下列实验操作和现象所得出的结论正确的是【答案】B【解析】A. 二氧化碳能和硅酸钠反应生成硅酸沉淀,说明碳酸的酸性比硅酸强,故错误;B.碘在四氯化碳中的溶解度大于在水中的溶解度,所以可以用四氯化碳萃取碘水的碘,故正确;C.铁和硫酸铜反应生成硫酸亚铁和铜,说明铜离子氧化性强于亚铁离子,故错误。
D.混合溶液中氯离子和碘离子浓度的大小关系没有说明,不能比较碘化银和氯化银的溶度积。
12.下表是25 ℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)B.碳酸钠溶液中滴加少量氯水,反应的离子方程式为CO32-+Cl2+H2O HCO3-+Cl-+HClOC.向0.1 mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液的pH=5D.向浓度均为1.0×10-3 mol/L的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol/L的AgNO3溶液,CrO42-先形成沉淀【答案】C1 3.下列实验方案的设计能达到目的的是【答案】D1 4.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:已知转换过程中的反应为:2CrO42-(aq)+2H+(aq)Cr2O72-(aq)+H2O(l)。
转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是A.溶液颜色保持不变,说明上述可逆反应达到平衡状态B.若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7gC.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5D.常温下K sp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,应调溶液的pH =5【答案】C【解析】A.存在平衡:2CrO42-(aq,黄色)+2H+(aq)Cr2O72-(aq,橙色)+H2O(l),如颜色不变,说明浓度不变,则达到平衡状态,故说法A正确;B.若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,设需要x molFeSO4·7H2O,由氧化还原反应中氧化剂和还原剂得失电子数目相等可知×(6-3)=x·(3-2),解得x=1.65,m(FeSO4•7H2O)=1.65mol×278g/mol=458.7g,故B说法正确;C.转化后所得溶液中铬元素含量为28.6g/L,则1L废水中n(Cr)=28.6g÷52g/mol=0.55mol,CrO42-有10/11转化为Cr2O72-,则酸化后c(CrO42-)=0.55mol/L×(1-10/11)=0.05mol/L,c(Cr2O72-)=0.55mol/L×10/11×1/2=0.25mol/L,常温下转换反应的平衡常数K=1×1014,则c(Cr2O72-)/c2(CrO42-)•c2(H+)=1×1014,解得c(H+)=1×10-6mol/L,所以pH=6,故C说法错误;D.常温下K sp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,则c(Cr3+)×c3(OH-)=1×10-32,解得c(OH-)=1×10-9mol/L,pH=5,故D说法正确。
大题冲关15.25℃时,三种酸的电离平衡常数如下:回答下列问题:(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是______________________(填字母)。
a.CO32-b.ClO-c.CH3COO-d.HCO3-(3)下列反应不能发生的是________(填字母)。
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2Ob. ClO-+CH3COOH=CH3COO-+HClOc. CO32-+2HClO=CO2↑+H2O+2ClO-d. 2ClO-+CO2+H2O=CO32-+2HClO(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=___mol·L-1(填精确数值)。
