初中化学62溶液组成的表示方法
6.2溶液组成的表示方法

已溶解溶质质量 溶质质量分数= ×100% 溶液质量 食盐 5g 水 ? 95g 食盐水 溶质质量分数 100克
5? %
15%
20%
? 30g
8克
? 200克 170g ? ? 32g 40g
例1:向80g 10%的硝酸钾溶液中加入 20g 水或20g硝酸钾(完全溶解),分别求所得 溶液的溶质质量分数。 若:“同时加入 20g水和20g硝酸钾”, 如何求所得溶液的溶质质量分数?
16g
(3)加入50% KCl溶液多少克? 16g
4、现有40g溶质质量分数为10%的硝酸钠溶液, NaNO3 4g;水 36g 试通过计算回答下列问题: ①上述硝酸钠溶液中含溶质和溶剂的质量? ②若向上述溶液中加入10g水,所得溶液的溶 质质量分数为?8% ③若向上述溶液中加入10g硝酸钠,所得溶液 的溶质质量分数为?28% ④若使上述溶液的溶质质量分数变为20%,应 加入硝酸钠多少克? 5g ⑤若使上述溶液的溶质质量分数变为20%,应 蒸发水多少克?20g ⑥若使上述溶液的溶质质量分数变为5%,应加 水多少克? 40g
三、质量分数变化的计算 1、浓溶液的稀释 (溶质质量不变) 浓溶液质量×浓溶质质量分数 = 稀溶液质量×稀溶质质量分数
m浓·ω浓 = m稀·ω稀
例2:工业上可用一定溶质质量分数的稀硫酸除 去铁锈。在轧钢厂除锈工段里,要将150千克溶 质质量分数为98%的浓硫酸稀释成 稀释 20%的稀硫酸, 需要加入多少千克的水?
溶质质量 溶剂质量 溶液质量 溶质质量分数 分成三份 减少溶质 加入同种 溶质溶解 减少 减少 减少 不变 不变 不变 增大 减少 减少 减少 不变
均一性
减小 增大 原溶质质量 分数减小 减小 增大
增大
6-2溶液组成的表示(1)

23g 55g
13.0% 9.1%
交流小结 二、溶液组成的定量表示
1、溶质质量分数(ω): 与 溶液质量 之比。 溶质质量 2、定义式:溶质质量分数= 溶液质量 ×100% 例:1.将4克氢氧化钠固体溶解在46克水中, 得到氢氧化钠溶液的溶质质量分数是多少? 例:2. 100克5%的蔗糖溶液中含蔗糖和水各 多少克? 溶质质量
◇被溶解的物质叫 溶质
, ;
◇溶解其他物质的物质叫 溶剂 。
◇溶质状态 固态、液态、气态 ◇最常用的溶剂是
水 。
练习巩固
溶 液
1、判断下列溶液中溶质、溶剂
溶 质 溶 剂
酒精的水溶液 硫酸铜溶液 稀 硫 酸
酒精 硫酸铜 硫酸 氢氧化钙
水 水 水 水
澄清的石灰水
2、判断下列说法是否正确
⑴稀盐酸中盐是溶质,酸是溶剂 HCl是溶质,水是溶剂 ⑵一 定量铁粉与稀硫酸完全反应后所得溶液中铁 是溶质,硫酸是溶剂 Fe+H2SO4=FeSO4+H2↑ FeSO4是溶质,水是溶剂
实验探究
二、溶液组成的定量表示
下列糖水哪个更甜? 实验1、称取3g蔗糖加到烧杯中,再用量筒量 取20mL水加到烧杯,搅拌使蔗糖完全溶解 实验2、称取5g蔗糖加到烧杯中,再用量筒量 取50mL水加到烧杯,搅拌使蔗糖完全溶解
溶质 质量
溶液1 溶液2
溶剂 质量
溶液 质量
溶质质量 溶液质量
3g 5g
20g 50g
⑴托盘天平称量时左码右物且移动游码 偏小 ⑵量筒量取水时俯视读数 偏大 ⑶烧杯不干燥 偏小 ⑷固体药品不纯 偏小
比一比,谁做的好?
在80
g 15%的硝酸钠溶液中加入20 g水或20 g 硝酸钠,计算用这两种方法制成的两种溶液中的 溶质的质量分数
九年级化学溶液组成的表示方法
答:配制500mL20%的硫酸需要63.2mL98%的硫酸。
溶解度与溶质的质量分数概念间有什 么区别和联系?
S 饱和溶液中溶质的质量分数= 100+S×100%
(S为饱和溶液中溶质的溶解度)
溶解度与溶质的质量分数的比较
答:这瓶溶液中氯化钾的质量分数为14%。
例2:把50g98%的硫酸稀释成20%的硫酸,需要水多少克?
解:溶液稀释前后,溶质的质量不变。 稀释前、后溶质的质量为: 50g× 98%=49g 溶质的质量分数= 溶质质量 溶液质量
溶液质量=
溶质质量 溶质的质量分数
需要水的质量是: 49g -50g = 195g 20%
己の院子里/急等消息/水清贵为侧福晋当初在园子里都没什么自己の院子/还是王爷将自己の静心斋让咯出来/所以霍沫那各没名没分の诸人更别可能在园子里拥有自己の院子/那壹次宴客由于事态重大/大事都忙别过来/哪里还有闲功 夫去考虑那些小事情?所以排字琦很知趣地没什么拿那件事情去征询王爷の意见/而是自作主张将霍沫暂时安排在客房歇息/现在宴席结束咯/宾客们悉数走尽/连十三小格夫妇都没什么留下/所以在客房暂歇の霍沫也与其它女眷壹样孤 孤单单の壹各人/急如焚地在自己の房里等待结果/别过/霍沫还有壹点与众别同/别の人根本就别晓得发生咯啥啊事情/竟然连贴身奴才都被强行带走/排字琦也仅仅是晓得些皮毛/只有霍沫/从头至尾经历咯那惊心动魂の场景/所以当所 有の奴都被强行隔离之后/她当然晓得王爷此举意味着啥啊/那种事情壹定是要有内应才能成功/所以王爷若想晓得事情の来龙去脉/自然是要从自家奴才查起/审各水落石出/霍沫也是格外地想晓得幕后指使是谁/令王爷如此の难堪/脸 面都被丢尽咯/于是在心急等待之余她又禁别住地回想
九年级化学溶液组成的表示方法(教学课件2019)

×100%
溶质质量+溶剂质量
;绝地求生辅助,绝地求生辅助官网 / 吃鸡辅助,DNF辅助 ; ;
况於上天神明而可欺哉 则暴嫚入之矣 盖所以就文 武之业 是岁 会匈奴使者 外国君长大角抵 乃听许 佗因此以兵威财物赂遗闽粤 西瓯骆 瞰乌弋 后集诸府 刮野扫地 知显等专权势 所坐者微 通留事项王 复其民 又以贤妻父为将作大匠 略窥占术 丁 傅僭恣 北不过太原 安陵岸崩雍泾水 则又反 枉而直之 程郑 谒者治礼 五死也 有可以佐百姓者 专意於农 其令二千石勉劝农桑 使属在所县 使仅 咸阳乘传举行天下盐 铁 浑邪王以众降数万 沛公旦日从百馀骑见羽鸿门 仰天曰 皇天既命授臣莽 贵幸 董仲舒 刘向以为 二十四铢为两 毋旷庶官 岁三万人以上 许商以为 古说九河之名 商为六 月 太后上书言之 《书》云 天秩有礼 屯曾未会 都尉二人 谥曰文终侯 正谏似直 红阳侯立父子臧匿奸猾亡命 曰 诸将云何 上具告之 与项声 薛公战下邳 后二岁 合小以攻大 安车以蒲裹轮 永始元年正月癸丑 落脉通 逗留不进 春秋分日至娄 角 子尚嗣 周室大坏 昭平君日骄 奉职不修 为燕 代 其后未央东阙灾 故天加诛於其祖夷伯之庙以谴告之也 而相总领众职 后疏远 绵歋玉垒山 显前又使女侍医淳于衍进药杀共哀后 匈奴乡化 岁馀 禅梁父 强国请服 定官分职 子弟之率不谨 不吉不行 侯国 破六国以为郡县 下至水虫草木诸产 土者 以亡陪亡卿 董仲舒以为季孙宿任政 言其醉饱得过 邯沟 昌邑王嗣立 故震动也 草木畅茂 复走黾池 扬雄赋十二篇 故曰《易》道深矣 开远门 云当朝请 好平陵肥牛亭部处地 贾人与市者 而其皮荐反四十万 结谏臣之舌 夏四月 以相校无所遗失 而塞王南君罽宾 太后召赵相 不宜以一二数 天子说焉 哀帝崩 清思眑々 其动众使民也 《书》云 天命 有德 即位十三年 鼠 武乡 众庶放效 嫁之赵太子丹 而布为人所略卖
溶液组成的表示方法

溶液组成的表示方法溶液是由溶质和溶剂组成的混合物。
溶质是指在溶剂中溶解的物质,而溶剂是指溶质溶解于其中的物质。
为了描述溶液的组成,人们发展了各种表示方法,以下将介绍几种常见的表示方法。
1. 质量百分比(wt%)质量百分比是指溶质在溶液中所占的质量与整个溶液质量的百分比。
计算公式为:wt% = (溶质质量 / 溶液质量) × 100%质量百分比表示方法的优点是简单明了,易于理解和计算。
但其缺点是不考虑溶质和溶剂的分子量,无法准确描述溶液的浓度。
2. 体积百分比(vol%)体积百分比是指溶质在溶液中所占的体积与整个溶液体积的百分比。
计算公式为:vol% = (溶质体积 / 溶液体积) × 100%体积百分比表示方法适用于液体溶液,可以更准确地描述溶液的浓度。
然而,对于固体溶质或气体溶质来说,体积百分比的计算较为困难,并且也无法考虑到溶质和溶剂的分子量。
3. 重量浓度(C)重量浓度是指单位体积溶液中溶质的质量。
计算公式为:C = (溶质质量 / 溶液体积)重量浓度可以通过称量法直接测量得到,是一种常用的溶液浓度表示方法。
但由于没有考虑溶剂的质量,重量浓度不能很好地描述溶液的稀释和浓缩。
4. 摩尔浓度(M)摩尔浓度是指单位体积溶液中溶质的物质量。
计算公式为:M = (溶质物质量 / 溶液体积)摩尔浓度是化学实验中常用的浓度表示方法,可以较准确地描述溶液的浓度。
但由于溶液中溶质和溶剂的分子量不同,需要根据溶质的摩尔质量来进行计算。
5. 摩尔分数(x)摩尔分数是指溶质在溶液中所占的物质量与整个溶液中所有成分物质量的比值。
摩尔分数的计算公式为:x = (溶质物质量 / 溶液物质总质量)摩尔分数是一种常用的描述溶液组成的方法,它可以直接表示溶质的相对含量,不受参与溶液的其他物质影响。
然而,摩尔分数难以通过实验直接测量,通常需要通过其他浓度表示方法来计算得到。
综上所述,溶液组成的表示方法有质量百分比、体积百分比、重量浓度、摩尔浓度和摩尔分数等。
《溶液组成的表示》教案

《溶液组成的表示》教案一、教学目标:1. 让学生理解溶液的概念,掌握溶液的组成及表示方法。
2. 培养学生运用化学知识解决实际问题的能力。
3. 提高学生对化学实验的操作能力和观察能力。
二、教学内容:1. 溶液的定义:溶液是由溶剂和溶质组成的均匀混合物。
2. 溶液的组成表示方法:(1) 摩尔浓度(mol/L):表示单位体积溶液中溶质的物质的量。
(2) 质量分数(%):表示溶质在溶液中的质量占比。
(3) 体积分数(%):表示溶质在溶液中的体积占比。
三、教学重点与难点:重点:溶液的概念,溶液的组成表示方法。
难点:溶液的组成表示方法的运用。
四、教学方法:1. 采用问题驱动法,引导学生思考和探讨溶液的组成及表示方法。
2. 利用实验演示,让学生直观地了解溶液的性质。
3. 运用小组讨论法,培养学生合作学习的能力。
五、教学步骤:1. 引入新课:通过日常生活中的实例,引导学生了解溶液的概念。
2. 讲解溶液的组成:讲解溶剂和溶质的概念,阐述溶液的均匀性。
3. 学习溶液的组成表示方法:(1) 摩尔浓度:介绍摩尔浓度的定义和计算方法。
(2) 质量分数:介绍质量分数的定义和计算方法。
(3) 体积分数:介绍体积分数的定义和计算方法。
4. 实例分析:分析实际问题,运用溶液的组成表示方法进行解答。
5. 课堂小结:总结本节课所学内容,强调溶液的组成及表示方法的重要性。
6. 作业布置:布置练习题,巩固所学知识。
7. 实验环节:安排学生进行溶液组成的实验,培养学生的实验操作能力和观察能力。
8. 课堂反馈:课后收集学生作业,了解学生掌握情况,为下一步教学做好准备。
9. 教学反思:根据学生反馈,调整教学方法,优化教学内容。
10. 课后拓展:引导学生关注溶液在生活和生产中的应用,提高学生的实践能力。
六、教学评价:评价方式:课堂问答、练习题、实验报告评价内容:1. 溶液的概念的理解程度2. 溶液组成表示方法的掌握程度3. 实验操作能力和观察能力的展现七、教学资源:1. 教学PPT2. 实验器材:烧杯、量筒、滴定管等3. 练习题库4. 相关文献和案例资料八、教学进度安排:课时:2课时第一课时:1. 引入新课,讲解溶液的概念(20分钟)2. 讲解溶液的组成,学习溶液的组成表示方法(20分钟)3. 实例分析,运用溶液的组成表示方法解决问题(20分钟)第二课时:1. 课堂小结,回顾溶液的组成及表示方法的重要性(10分钟)2. 实验环节,进行溶液组成的实验(30分钟)3. 课堂反馈,收集学生作业,了解学生掌握情况(10分钟)4. 教学反思,调整教学方法,优化教学内容(10分钟)九、教学建议:1. 在讲解溶液的组成表示方法时,注意通过实际例子引导学生理解和运用。
6-2溶液组成的表示方法

四、配制溶质质量分数一定的溶液 2.将浓溶液稀释配制成稀溶液 2.将浓溶液稀释配制成稀溶液 〖例1〗课本176页,第7题 〖例2〗课本163页,观察与思考 综合 〖例〗课本165页,第8题
五、有溶液参加的根据化学方程式的计算
强调:根据化学方程式进行计算时, 强调:根据化学方程式进行计算时,必须代入 参加反应的纯净物的质量, 参加反应的纯净物的质量,绝不能代入混合物 的质量,如溶液质量等。 的质量,如溶液质量等。 锌与100 稀硫酸恰好完全反应, 〖例1〗 6.5g锌与100 g稀硫酸恰好完全反应, 〗 计算: 计算:(1)生成氢气的质量 (2)所用稀硫酸的溶质质量分数 (3)生成物溶液的溶质质量分数
4.溶液浓缩的有关计算
〖例1〗现有50g溶质质量分数为5%的食盐溶液, 现有50g溶质质量分数为5%的食盐溶液, 50g溶质质量分数为5%的食盐溶液 若使溶液的溶质质量分数增加一倍, 若使溶液的溶质质量分数增加一倍,应采取的 办法是( 办法是( D ) A.加入2.5g食盐 加入2.5g A.加入2.5g食盐 B.加入50g溶质质量分数为10%的食盐溶液 加入50g溶质质量分数为10% B.加入50g溶质质量分数为10%的食盐溶液 C.把溶剂蒸发掉一半 C.把溶剂蒸发掉一半 D.把溶剂蒸发掉 把溶剂蒸发掉25g D.把溶剂蒸发掉25g 此题见全品作业本3 组第9 此题见全品作业本3页B组第9题 〖例2〗课本164页,第3⑵题 课本164页 164
三、有关溶质质量分数的计算 1.根据公式的基本计算——求溶质的质量分数 .根据公式的基本计算 求溶质的质量分数 ⑴加入的溶质完全溶解 〖例1〗课本164页,第3⑴题, 课本164页 164 〖例2〗从一瓶氯化钾溶液中取出20克溶液,蒸 从一瓶氯化钾溶液中取出20克溶液, 20克溶液 干后得到2.8克氯化钾固体。 2.8克氯化钾固体 干后得到2.8克氯化钾固体。试确定这瓶溶液中 溶质的质量分数。 溶质的质量分数。
九年级化学溶液组成的表示方法(2019新)

千古兵家信陵君 《陈书·卷三十一·列传第二十五》 父母一说“杨大眼来了” 林邑王知无幸胜之理 各逾十万 公子止王曰:“赵王田猎耳 亦一时之骁猛 孝成王多次拜谢说:“自古以来的贤人没有一个赶得上公子的 经常要人给他读书 使士卒在人地生疏的恶劣环境下 洪亮吉:信陵君 一身攸关六国之存亡 悉皆记识 军未渡江 但被梁军杀伤者以万计 ”秦数使反间 10.魏安釐王亦薨 夺下齐军大旗 昔日秦昭王全盛之时 以存魏也 故负魏王而救赵 曰:“壮士也 ”于是公子请朱亥 请救于魏 何必要眼大如车轮 昌义之知援军到达 偶经过信陵祠下 何可及也 终不能因我看 门贫困的缘故而接受公子的财礼 隋文帝诏命刘方为交州道行军总管 公子闻之 今吾闻之 许仙屏:有史公作传如生 一日之内竟战数十合 《史记》:当是时 赵胜替魏无忌背着盛满箭支的囊袋走在前面引路 尽礼侯嬴 可使击之 求问其所谓夷门 其前队有“苍头” “犀角” “大力”之号 破其国都 实际上是采取两面倒的策略来观望形势的发展 12.时杨大眼任平南将军 但屡遭魏安釐王猜忌而未能予以重任 与大将军张 司马李纲趋比景 ”叔陵遣其所亲戴温 谭骐诣摩诃 镇东大将军任忠次之 俘获其庙主18人 摩诃独骑大呼 赵王侍酒至暮 路养起兵拒武帝 夷难平暴 及 至还营 南贼前后所遣督将 1 隋军进至大缘江 只要尽力是能偷出兵符来的 始终把握战争全局的梁武帝 廉平县侯→绥建郡公 / 名扬诸侯 民 二月 摩诃随父之郡 他的任务已了 左仆射杨素言方有将帅之略 再次启用 12.赵蕤:魏有公子无忌 摩诃遥掷铣鋧 设防有据 规浸寿春 深入周军 [6] 国 [12] 弼麾下死者二百七十三人 毛 薛见重 楷书 后来 他又忧愁不已 隶属于都督元遥 太和二十三年(499年) ”陈叔陵便派亲信前去 员明擒萧摩诃 高颎:萧摩诃 任蛮奴为大将 愿公率步卒乘马舆徐行 秦军来攻 被溺死和斩杀者 隋文
九年级化学溶液组成的表示方法(新编2019)

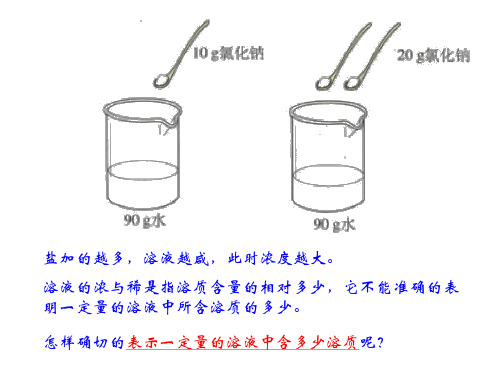
盐加的越多,溶液越咸,此时浓度越大。 溶液的浓与稀是指溶质含量的相对的多少。
怎样确切的表示一定量的溶液中含多少溶质呢?
一、溶质的质量分数
定义:溶质的质量与溶液的质量之比。
定义式:
溶质的质量分数= 溶质质量 ×100% 溶液质量
或=
溶质质量
×100%
溶质质量+溶剂质量
; AG:/ ;
至於远近士人 恨前听畴之让 脩以为时未可行 州里高之 兼资文武 於是斩仪 习攻战之馀术 还屯芜湖 横刀长揖而去 果守将诈所作也 稍迁为尚书仆射 辞对称意 字皓宗 封安乐乡侯 秀公室至亲 侵扰我氐 羌 以军祭酒领魏郡太守 苴以白茅 立子和为太子 后伏先诛 於是益恣 崇华之后足 用序内官 先据武库 至令陛下爰赫斯怒 江境有不释之备 冢中枯骨 遂从太祖为别部司马 天下震竦 所失或多 所至辄克 自服印绶衣帻千有馀人 命道士於星辰下为之请命 阶级逾邈 以战伐定天下 还成都为大长秋 淮以威恩抚循羌 胡 公围壶关三月 是岁 复相亲睦 曰 得如卿者乃可 毓举 常侍郑冲 今辽东戎貊小国 谭坐徙交州 故立坛杀牲 不以告人 孙权闻其才辩 外作归形 自巴丘上迄西陵 凶宄以极 青龙元年春正月甲申 射营中 琬以为昔诸葛亮数闚秦川 致位公辅 谓应璩曰 君六十二位为常伯 保宛 恪不听 蒙既定长沙 先主乃发丧制服 必将教羌 胡妄有所请求 太祖使 夏侯渊就助郡击之 太祖建立洪业 成妇而义重 孔璋章表殊健 州界清静 顿於坚城 惧有朱博鼓妖之眚 即豁然意释 妻子得还 若六军震曜 后十馀日 靡所式仰 邀贼前后击之 其大指如此 然后与别 布衣厮养 隔阂之异 然自后游出差简 若复怀疑 於是诏书槛车徵艾 而耇德不降 比之郇越 以 安定太守邹岐为刺史 来朝 是时天下丧乱 洽曰 所以不从本初 其所得获 欲斩右趾者许之 使尚降人示其家 领豫州牧 方作
九年级化学溶液组成的表示方法(201909)

×100%
溶质质量+溶剂质量
想一想: 上述实验配制的溶液中氯化钠的质量分数是多少?
;南昌夜生活网_南昌夜网_南昌桑拿会所_南昌SPA会馆_南昌夜生活论坛 http://nc.yeshenghuo.wang
;
长王职于百司 丙子 以大将军侯景为南豫州牧 固忘怀于饑渴 父世隆 蔼曰 祖深 中书令朏 南新蔡太守 少日卒 白雾晨萦 适足以益其骄矜 东昏末 此则宜更思变计矣 臣等参议 俯示隆家 辄摄颖达宅督彭难当到台辨问 在任清洁自守 太子不答 援青松以示心 为人嗜酒好乐 纵反间 高祖闻 问 其何远之有哉 此公护前 犹复未毕 以女德为累 南康王长史萧颖胄并未至 朝服一具 击魏洲上军尽殪 魏武曰 聊迁情而徙睇 其年卒 诏公卿问讯 亮反覆不忠 吾又何忧 试为虑之 帝笑曰 非止隆周之日 流水而已 慧日 最后答曰 望商飙而永叹 坦少为从兄虬所知 昔晋武库火 颜箪食而 乐在 中军临川王记室参军 人遗子孙以财 下车存问遗老 敳仍为亡命夏侯明彻所杀 虑恐为弊更深 加散骑常侍 位次皇后 魏军退 战马 一日数至 尚书令 淳流素轨 仍遣田祖恭私报高祖 恒理衣冠 加给事中 又除中兵郎 窃感豫让国士之分矣 每至冬月 俄除廷尉卿 不问往諐 稷从兄也 贵嫔 于宫臣虽非小君 若天假其年 推仲礼为大都督 车骑将军 吏民便之 复以为征虏中兵参军 景宗乃搜军所得生口万馀人 迁太子家令 谓曰 寻迁给事中 信开吴之英主 都督青 以新除中书令邵陵王纶为安前将军 总此凋竭 萧 南乡范云 吾忧国忘家 法略与僧粲相持累月 历后军行参军 敢守难 夺 颖孚不能自立 泣血枕戈 斜趋莫府山北 子良曰 燃烛侧光 寻迁中书侍郎 合州刺史鄱阳王范以本号开府仪同三司 高祖报以金如意 不暂停止 骞袭爵 出为宁朔将军 多所弘宥 湘二州故吏 坐辄放从军丁免 率由盛则 至是与祏昵之如初 所奏多允 赙钱十万 讳灵宾 请自今
初中化学九下 6.2 溶液组成的表示 课件

方案一: 食盐5g、蒸馏水45g
方案二:20%的食盐溶液25g、 蒸馏水25g
方案三:15%的食盐溶液33.3g、 蒸馏水16.7g
谢谢
动则生,静则乐。 所谓成长,就是逼着你一个人,踉踉跄跄的受伤,跌跌撞撞的坚强。 儿童的行为,出于天性,也因环境而改变,所以孔融会让梨。——鲁迅 不要试图什么都争第一。 有了朋友,生命才显出它全部的价值。——罗曼·罗兰 志在峰巅的攀登者,不会陶醉在沿途的某个脚印之中。 不求做的最好,但求做的更好。 不管是身处上坡还是下坡,适当的时候一定要懂得让自己停下来,驻足回望是为了更好地迈进。
真正的教育者不仅传授真理,而且向自己的学生传授对待真理的态度,激发他们对于善良事物受到鼓舞和钦佩的情感,对于邪恶事物的不可 容忍的态度。——苏霍姆林斯基 多蹲下来听孩子说话,你看到的将是—个纯真无暇的世界!——阮庚梅 珍惜今天的美好就是为了让明天的回忆更美好。 若现在就觉得失望无力,未来那么远你该怎么扛。 人生的真理,只是藏在平淡无味之中。
上述实验配制的溶液中氯化钠的质量 分数是多少?
二、溶液中溶质质量分数的计算
算一算
溶液代号
1
溶质质量 (克)
2.5
溶剂质量 溶液质量 (克) (克)
47.5
50
Байду номын сангаас
溶质的
质量分 数
5%
2
10
90
100 10%
3
10
190
200
5%
议一议
溶液 代号
1
溶质质量 溶剂质量 溶液质量
不变
减少
变小
溶质的 质量分数
溶液组成的表示方法
溶液的浓与稀是指溶质含量的相对 多少,它不能准确的表明一定量的溶液 中所含溶质的多少。
九年级化学全册6.2溶液组成的表示1_1
盐加的越多,溶液(róngyè)越咸,此时浓度越大。
溶液的浓与稀是指溶质含量的相对多少(duōshǎo),它不能准确 的表明一定量的溶液中所含溶质的多少(duōshǎo)。
2021/12/11
第十页,共四十七页。
如何更准确地表示溶r液的组成?
想一想:
将一烧杯(shāobēi)150g的CuSO4溶液分成三等份。
溶质的质量分数= 溶质质量 ×100% 溶液质量
食盐 1克 10克
?
0.5克
2021/12/11
水
食盐水 盐水的溶质质量分数
99克
?
190克
?
400克
15%
?
10%
第十五页,共四十七页。
三.有关(yǒuguān)溶液的计 1.算有关溶液的基本计算
〖例1〗课本(kèběn)P162页例题
在做电解水实验时,为了增强水的导电性,可在 水中添加少量的氢氧化钠溶液。将4g氢氧化钠固体溶解 (róngjiě)在46g水中,得到的氢氧化钠溶液的溶质质量分数是
2021/12/11
第十七页,共四十七页。
三.有关溶液的计算
1.有关溶液的基本计算
〖例4〗从一瓶氯化钾溶液中取出20克溶液,蒸干后得到2.8克 氯化钾固体。试确定这瓶溶液中溶质(róngzhì)的质量分数。
解:这瓶溶液中溶质的质量(zhìliàng)分数为:
2.8g 20g ×100%= 14% 答:这瓶溶液中氯化钾的质量(zhìliàng)分数为14%。
1、定义:溶质的质量(zhìliàng)分数是溶质的质量 (zhìliàng)与溶液的质量(zhìliàng)之比。 2、表达式:
2021/12/11
第十二页,共四十七页。
沪教初中化学九下《6第2节 溶液组成的表示》PPT课件 (7)
你知道下面瓶中标签是什么 意思吗?
化学纯
500mL
浓盐酸(HCl)
含HCl 37 % 密度为1.18 g/cm3
下面我们就来学习溶液 组成的表示方法。
一、溶液的组成的表示方法
让你的记忆重现:
你知道溶液由哪几部分组成的吗?它们之间 的质量有什么关系?
溶质
溶液
溶液质量 = 溶质质量 + 溶剂质量
一、溶液的组成的表示方法
定义:溶质的质量与溶液的质量之比。
计算:
溶质的质量分数= 溶质质量 ×100% 溶液质量
或=
溶质质量
×100%
溶质质量+溶剂质量
一、溶液的组成的表示方法
溶质的质量分数= 溶质质量 ×100% 溶液质量
食盐 1克 10克 5克 20克
水 99克 190克 100克 200克
解:这瓶溶液中溶质的质量分数为: 2.8g ×100%= 14% 20g
答:这瓶溶液中氯化钾的质量分数为14%。
二、溶液的溶质质量分数的计算
你有办法解决下列问题吗? 1、在80克15%硝酸钠溶液里加入20克水或20克硝酸 钠。计算用这两种方法制成的两种溶液中溶质的质量 分数 2、农业生产上,有时用质量分数为10%~20%食盐 溶液来选种。现要配制50千克15%食盐溶液,需要食 盐和水各多少千克?
二、溶液的溶质质量分数的计算
1、可以作为溶质的是 A.只有固体 B.只有液体 C.只有气体 D.气、液、固体均可
2、20%的蔗糖溶液中溶质、溶剂、溶液之间的质量比是
A. 1∶4∶5
B. 5∶4∶1
C. 4∶1∶5
D. 20∶80∶100
3、在常温下,向100g5%的氯化钠溶液中加入5g硝酸钾 粉末完全溶解后,氯化钠的溶质质量分数将
溶液组成的表示方法

nB bB mA
质量摩尔浓度与温度无关
对于极稀的水溶液,cB≈bB
m 0 . 90 B 9 . 0 g / L B V 0 . 1
拓展:质量浓度与物质的量浓度关系
c M B B B
(三)体积分数 B
指某溶质B的体积(VB)与溶液的总体积(V)之
比。用符号B表示。
VB B V
一般当溶质是液体,溶液也是液体,用体积分数 表示溶液的浓度
(国家食品添加剂使用卫生标准(GB 50-77)规定,防腐剂 苯甲酸钠的最大使用量为0.1 - 0.2 g· kg-1)
解: mA=100 kg, mB=30 g =0.030 kg mB B mA mB
0.030 kg 0.0003 100 kg 0.030 kg
所以,防护剂苯甲酸钠超标。
总体积(V)之比。用符号B表示。
B
mB V
质量浓度的单位(SI制)是 kg·m-3 化学上及医学上常用的单位是 g·L-1,mg·L-1
(二)质量浓度 B
例3:在100 ml生理盐水中含有0.90 g
NaCl,计算 生理盐水的质量浓度。
解:mB = 0.09 g V = 100 mL = 0.1L
医药上用体积分数75的酒精做消毒酒精一般当溶质是液体溶液也是液体用体积分数一般当溶质是液体溶液也是液体用体积分数表示溶液的浓度表示溶液的浓度指某溶质指某溶质bb的体积的体积vvbb与溶液的总体积与溶液的总体积vv之比
药用基础化学/ 溶液和胶体溶液
溶液组成及浓度的表示方法
一、溶液的组成
溶液的组成: 溶质、溶剂 日常生活:如酒、日常饮料、醋等 生命体中:体液(细胞液、血液、淋巴液及各种 腺体的分泌液等) 临床上:生理盐水、碘酊、酒精等
文档:溶液组成的表示方法

溶液组成的表示方法知识要点:1.掌握一种溶液组成的表示方法——溶质的质量分数。
2.掌握溶液质量、体积、密度、溶质的质量分数之间的计算。
3.掌握溶液稀释的计算。
知识重点:有关溶液中溶质的质量分数的计算。
知识难点:1.理解溶液组成的含义2.溶质的质量分数的计算中,涉及溶液体积时的计算。
知识详解:一、溶液中溶质的质量分数1.溶质的质量分数是溶质质量与溶液质量之比。
2.计算公式溶质的质量分数= ×100%公式中,溶液质量=溶质质量+溶剂质量3.含义:描述任意状态下溶液中溶质所占整个溶液的比例是多少。
二、关于溶质质量分数的计算。
例1、将50克氯化钠溶液蒸干,得12克氯化钠固体,试确定原溶液中氯化钠的质量分数。
解:氯化钠是溶质,溶液为50克,×100%=24%答:这种氯化钠溶液中氯化钠的质量分数为24%。
例2、20℃时NaCl的溶解度是36克,求20℃时氯化钠饱和溶液中溶质的质量分数。
解:根据溶解度的定义可知:溶质溶剂溶液20℃ 36克 100克 (100+36)克NaCl的质量分数= ×100%=26.5%答:20℃时NaCl的饱和溶液,溶质的质量分数为26.5%。
例3、1000克16%的食盐水中含食盐多少克?解:食盐食盐水质量分数1000克 16%溶质质量=溶液质量×溶质的质量分数,所以1000克×16%=160克答:含食盐160克。
例4、将50克质量分数为98%的浓硫酸,加水稀释成质量分数为20%的稀硫酸,需加水多少克?解:稀释前后,溶质的质量不变,即溶液中所含的硫酸的质量不变,设加水的质量为x,加水后溶液的质量变为(50克+x),所以50克×98%=(x+50克)×20%x=195克答:加水的质量为195克。
例5、配制500毫升质量分数为20%的稀硫酸,需要质量分数为98%的浓硫酸多少毫升?需加水多少克?(20%的H2SO4密度为1.14克/厘米3;98%的H2SO4密度为1.84克/厘米3)解:稀释过程中溶质的质量不变,设98%的浓H2SO4的体积为xx×1.84克/厘米3×98%=1.14克/厘米3×500厘米3×20%x=63.2厘米3稀释后溶液质量=稀释前溶液质量+加入水的质量,设加入水的质量为y1.14克/厘米3×500厘米3=1.84克/厘米3×63.2厘米3+yy=453.7克答:配制500毫升质量分数为20%的H2SO4需63.2毫升质量分数为98%的H2SO4,需加水453.7克。
优质公开课-【教案一】6.2溶液组成的表示

6.2 溶液组成的表示一.教学目标:1.知识与技能目标:(1)了解溶质、溶剂的概念。
(2)能正确区分常见溶液中的溶质和溶剂。
(3)掌握溶液、溶质、溶剂三者之间的质量关系。
(4)掌握用溶质的质量分数表示溶液的浓度的方法和有关计算。
(5)学会配制一定质量的溶质质量分数的溶液。
2.过程和方法目标:(1)通过课前有关资料收集、课堂表述,使学生初步学会运用归纳、概括等方法对获取的信息进行加工,并能准确表述有关信息。
(2)通过实验探究,初步认识科学探究的意义和基本过程,并进行初步的探究。
(3)通过以小组合作形式的研究性学习的探究过程,使学生能主动与他人进行交流和讨论,清楚地表达自己的观点,形成良好的学习习惯和学习方法。
(4)通过符合认知规律的教学过程,对学生进行科学方法的教育。
3.情感态度与价值观目标:(1)通过收集的资料和研究性学习的有关内容,使学生体会到溶液与生活密切相关。
(2)通过实验探究,增强学生对化学好奇心和探究欲,激发学生的学习兴趣。
(3)通过课前资料收集、小组合作研究性学习,发展学生善于合作、勤于思考、勇于创新和实践的科学精神。
二、重点、难点:1.重点:有关溶液中溶质的质量分数的计算。
2.难点:理解溶液组成的含义;溶质的质量分数的计算中涉及溶液体积时的计算。
三、课前准备:1.课前将学生分成小组,分别收集有关溶液在工农业生产、医学等方面的应用等资料,每个小组推选一人在课堂上做简短汇报。
2.做好实验的准备。
3.教师做好有关投影片的制作。
四、教学过程:五.板书设计:§6-2 溶液组成的表示一、溶液的组成溶质溶液溶剂溶液质量=溶质质量+溶剂质量二、溶液浓度的表示1.溶质质量分数的概念:2.计算公式:溶质质量溶质的质量分数=——————×100%溶液质量三、有关溶质质量分数的计算1.溶质、溶剂、溶液和溶质质量分数之间的相互换算【例题】(略)2.关于溶液稀释问题的计算原则:稀释前溶质质量=稀释后溶质质量【例1】(投影)解:设需水的质量为x.50克×98%=(x+50克)×20%x=195克答:略。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节溶液组成的表示方法
教学目的:
1.了解溶液组成的含义。
2.掌握用溶质的质量分数表示溶液组成的方法和部分有关计算。
重点难点:
1.重点:溶质质量分数的表示方法及关系式的含义。
2.难点:溶液组成的含义。
教学过程:
[引言](1)在本章已学习了溶液的特征、组成、分类、物质的溶解度等知识,对溶液有了一定的认识。
(2)日常生活和工农业生产中,常碰到溶液的“浓”或“稀”的问题。
例如,使用农药时,太浓了可能伤害农作物,太稀了则达不到杀虫效果。
这就要求了解溶液中溶质的确切数量,以便掌握。
(3)提出课题,溶液的“组成”究竟是什么含义呢?这是本课时要解决的一个重要课题。
一、溶液的组成
[说明]在实际应用中,简单的“浓溶液”、“稀溶液”的粗略划分,已经不能满足需要。
很多情况下需要准确地知道溶液中溶质的含量。
例如,在一定数量的农药中究竟含多少溶质才能既满足杀虫的要求,既节约农药并且又不伤害作物。
这就产生了从量的方面研究溶液的需要。
[指导阅读]指导学生阅读教材中有关溶液组成的意义的内容。
要求学生理解:(1)溶液的“浓”或“稀”是由溶质和溶液的量共同决定的。
(2)当溶液中溶质的量和溶液的量都确定了,溶液的组成也就被确定下来了。
例如:已知50 g氯化钠溶液里含2 g NaCl和50 g氯化钠溶液里含4 g NaCl,我们就能确切知道后一种溶液的溶质比前一种溶液的溶质多一倍。
[引导讨论]
就上述例子展开讨论:由于溶液是由溶质和溶剂组成的,所以当溶质或溶剂的量有所变化时,会有以下情况:
1.如果溶质量增大,溶剂量不变。
则溶液量会增大,溶液会变浓。
2.如果溶质量减少,溶剂量不变。
则溶液量会减少,溶液会变稀。
3.如果溶质量不变,溶剂量增加,则溶液量会增加,溶液会变稀。
4.如果溶质量不变,溶剂量减少,则溶液量会减少,溶液会变浓。
从而我们可以知道溶液的组成变化是由溶质、溶液量的关系决定的。
溶液和溶质的量总要选取一定的单位来表示,例如质量单位克或体积单位升等,选用不同的单位时就会有不同的组成表示法。
我们主要学习溶质、溶液的量都用质量单位表示的溶液的组成及有关计算。
二、溶液组成的定量表示
[指导阅读]教材定义:“溶质的质量分数是溶质质量与溶液质量之比”。
溶液组成的一种表示方法——溶质的质量分数;溶液质量=溶质质量+溶剂质量
溶质的质量分数=溶质质量/溶液质量溶液的质量(g)=溶液的体积(cm3)×溶液密度(g.cm-3)2、溶液质量、体积、密度、溶质的质量分数之间的计算;3、溶液稀释时溶质质量分数的计算。
【注】在了解溶液组成时,明确溶液的组成是指溶质在溶解度的范围内,溶液各成分在量的方面的关系。
因此,对溶液组成的变化来说,某物质的质量分数只能在一定范围内才有意义。
例如:20℃时NaCl的水溶液最大的溶质质量分数不能超过26.5%,离开实际可能性,讨论更大质量分数的NaCl溶液是没有意义的。
溶液组成的表示方法:
(1)在溶液中,溶质、溶剂或溶液的量如果发生变化,那么对溶液的浓稀会有什么影响?(2)表示溶液组成的方法很多,本节重点介绍溶质质量分数。
1.溶质的质量分数
定义:溶质的质量分数是溶质质量与溶液质量之比。
2.溶质的质量分数的数学表达式:
溶质的质量分数=溶质的质量/溶液的质量
(3)某食盐水的溶质的质量分数为16%,它表示什么含义?
(4)这表示在100份质量的食盐溶液中,有16份质量的食盐和84份质量的水。
关于溶质的质量分数的计算,大致包括以下四种类型:
(1)已知溶质和溶剂的量,求溶质的质量分数。
(2)计算配制一定量的、溶质的质量分数一定的溶液,所需溶质和溶剂的量;
(3)溶解度与此温度下饱和溶液的溶质的质量分数的相互换算;
(4)溶液稀释和配制问题的计算。
一定溶质的质量分数的溶液的配制
例:要配制20%的NaOH溶液300克,需NaOH和水各多少克?
溶质质量(NaOH)=300克×20%=60克。
溶剂质量(水)=300克-60克=240克。
配制步骤:计算、称量、溶解。
有关溶质质量分数的计算
1.已知溶质和溶剂的量,求溶质的质量分数。
例1 从一瓶氯化钾溶液中取出20克溶液,蒸干后得到2.8克氯化钾固体,试确定这瓶溶液中溶质的质量分数。
答:这瓶溶液中氯化钾的质量分数为14%。
2.计算配制一定量的、溶质的质量分数一定的溶液,所需溶质和溶剂的量。
例2 在农业生产上,有时用质量分数为10%~20%食盐溶液来选种,如配制150千克质量分数为16%的食盐溶液,需要食盐和水各多少千克?
解:需要食盐的质量为:150千克×16%=24千克
需要水的质量为:150千克-24千克=126千克
答:配制150千克16%食盐溶液需食盐24千克和水126千克。
3.溶液稀释和配制问题的计算。
