高中化学方程式(填空版)
高中化学方程式大全(完整版)

44、 2H (2 气) O(2 气) 2H 2O(液) 571.6kJ
45、 C(固) H 2 O(气)
CO (气) H (2 气) 131.3kJ
第三章 硫 硫酸
第一节 硫
46、 2Cu S
Cu 2S
47、 Fe S
FeS
48、 S H 2
H 2S
49、 S C 高温 CS2
50、 S O 2 点燃 SO2
CO 2 2SO2 2H 2O
81、 S 2H 2SO(4 浓)
3SO2 2 H 2O
82、 P H 2SO(4 浓)
H 3PO4 SO2 2 H 2O
83、 H 2S H 2SO(4 浓)
S SO 2 2H 2O
84、 Cu 2H 2SO(4 浓)
CuSO 4 SO 2 2H 2O
85、 BaCl 2 H 2SO4 BaSO 4 2HCl
第一节 摩尔
化学
38、 C O 2 CO 2
39、 Mg 2HCl MgCl 2 H 2 第二节 气体摩尔体积
40、 Zn 2HCl ZnCl 2 H 2
第三节 物质的量浓度
41、 2NaOH H 2SO 4 Na 2SO4 2H 2 O
第四节 反应热 42、 C(固) O(2 气) 点燃 CO(2 气) 393.5kJ 43、 2H (2 气) O(2 气) 2H 2O(气) 483.6kJ
10、 2NaOH Cl 2 NaClO NaCl H 2O
11、 4HCl MnO 2
MnCl 2 2 H 2 O Cl 2
12、 2KMnO 4 16HCl (浓) 2MnCl 2 2KCl 5Cl 2 13、 2HClO 见光 2HCl H 2SO(4 浓) NaHSO 4 HCl
高中必修一化学方程式归纳

高中必修一化学方程式归纳必修一化学方程式1、金属钠投到硫酸铜溶液中的化学方程式:2Na+2H2O=2NaOH+H2↑CuSO4+2NaOH=Cu(OH)2↓+Na2SO4(先冒气泡再蓝色沉淀)2、金属钠与盐酸的化学方程式:2Na+2HCl=2NaCl+H2↑3、氢氧化钠方在空气中变质的化学方程式:2NaOH+CO2=Na2CO3+H2ONa2CO3+10H2O=Na2CO3·10H2O4、金属钠放在空气的氧化:4Na+O2=2Na2O(银白色变暗)5、金属钠在空气燃烧:2Na+O2=Na2O2Δ(生成淡黄色粉末)6、过氧化钠在空气中变质:2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2=2Na2CO3+O27、过氧化钠与酸反应:2Na2O2+4HCl=4NaCl+2H2O+O2↑8、氧化钠在空气中变质:Na2O+H2O=2NaOHNa2O+CO2=Na2CO39、氧化钠与酸反应:Na2O+2HCl=2NaCl+H2O10、氧化钠在空气中燃烧:2Na2O+O2=2Na2O211、氯气与铁的反应方程式:2Fe+3Cl2=2FeCl3点燃(红棕色的烟)12、氯气与铜的反应方程式:Cu+Cl2=CuCl2点燃(棕黄色的烟)13、氯气与氢气的反应方程式:Cl2+H2=2HCl点燃(苍白色火焰,生成白雾)14、氯气与钠单质的反应方程式:2Na+Cl2=2NaCl点燃(淡黄色的烟)15、工业制漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(为Ca(OH)2石灰乳)16、氯气与水的方程式:Cl2+H2O=HCl+HClO17、消毒、处理多余的氯气、制84消毒液:Cl2+2NaOH=NaClO+NaCl+H2O18、次氯酸钠在空气中变质:2NaClO+CO2+H2O=2HClO+Na2CO3NaClO+CO2+H2O=HClO+NaHCO319、漂白粉在空气中变质:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO20、次氯酸见光分解:2HClO=2HCl+O2↑光照21、氯化铁通入沸水中制氢氧化铁胶体:FeCl3+3H2O=Fe(OH)3(胶体)+3HClΔ22、碳酸钠与盐酸的反应方程式:Na2CO3+2HCl(过)=2NaCl+CO2↑+H2ONa2CO3+HCl(少)=NaHCO3+NaCl23、碳酸氢钠与盐酸的反应方程式:NaHCO3+HCl=NaCl+H2O+CO2↑24、碳酸氢钠与碱反应方程式:NaHCO3+NaOH=Na2CO3+H2ONaHCO3+Ca(OH)2=2H2O+Na2C O3+CaCO3↓25、碳酸氢钠受热易分解:2NaHCO3=Na2CO3+CO2↑+H2OΔ26、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2+H2O=2NaHCO327、浑浊石灰水变澄清:CO2+CaCO3+H2O=Ca(HCO3)228、碳酸氢钙受热分解:Ca(HCO3)2=CO2↑+CaCO3+H2OΔ29、氢氧化亚铁在空气中变质:4Fe(OH)2+O2+2H2O=4Fe(OH)3(由白色沉淀变成灰绿色再变成红褐色沉淀) 30、泡沫灭火器原理:Na2CO3+2HCl=2NaCl+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体31、制造印刷线路板:2FeCl3+Cu=2FeCl2+CuCl22Fe3++Cu=2Fe2++Cu2+32、2FeCl2+Cl2=2FeCl32Fe2++Cl2=2Fe3++2Cl-33、Fe2O3+3CO=2Fe+3CO2高温34、Ba2++SO42+=BaSO4↓Ag++Cl-=AgCl↓35、Zn+Cu2+=Zn2++CuZn+Fe2+=Zn2++Fe36、溶洞的形成:CO2+CaCO3+H2O=Ca(HCO3)2Ca(HCO3)2=CO2↑+CaCO3+H2OΔ37、NaHCO3+BaCl2不反应(一般情况下,强酸才能制弱酸)38、工业上制取水煤气:C+H2O(g)=CO+H2高温39、自然界通过放电把氮气转化为一氧化氮:N2+O22NO放电(NO无色、难溶于水)40、工业上制备氨气:N2+3H22NH3高温、高压、催化剂41、一氧化氮在常温下被氧化:2NO+O2=2NO2(NO2红棕色、有刺激性气味的有毒气体、易溶于水)42、工业上制取硝酸、二氧化氮溶于水生成硝酸和一氧化氮:3NO2+H2O=2HNO3+NO43、氨溶解于水:NH3+H2ONH3·H2O(一水合氨、弱碱性、能使酚酞溶液变红)44、一水合氨的电离:NH3·H2ONH4++OH-45、氨与盐酸的反应:NH3+HCl=NH4Cl46、工业上制备硝酸需要的一氧化氮的方程式:4NH3+5O2=4NO+6H2O高温催化剂47、碳酸氢铵受热分解:NH4HCO3=NH3↑+CO2↑+H2OΔ(密封保存在阴凉处、施肥时埋在土下)48、氯化铵受热分解:NH4Cl=NH3↑+HCl↑Δ49、铵态氮肥不能与碱(如草木灰)混合施用:NH4++OH-=NH3↑+H2OΔ50、实验室制氨气:2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2OΔ(向上排空气法收集、湿润的红色石蕊试纸)51、硝酸受热分解:4HNO3=4NO2↑+O2↑+2H2O受热或见光(应保存在棕色试剂瓶中、阴凉处)52、铜与硝酸的反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(遇浓硝酸生成二氧化氮)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(遇稀硝酸生成一氧化氮)53、浓硝酸与木炭的反应:4HNO3(浓)+C=CO2↑+4NO2↑+2H2OΔ54、硫单质铁的反应:Fe+S=FeSΔ(硫单质的氧化性、S黄色或淡黄色固体,不溶水、微溶酒精、易溶CS2)55、硫单质与氧气的反应:S+O2=SO2点燃(硫单质的还原性、SO2有刺激性气味的有毒气体、易溶于水)56、硫粉遇碱发生歧化反应:3S+6NaOH=2Na2S+Na2SO3+3H2OΔ57、黑火药爆炸的化学方程式:S+2KNO3+3C=K2S+3CO2↑+N2↑58、二氧化硫被氧气氧化:2SO2+O22SO3催化剂Δ59、二氧化硫与硫化氢发生归中反应:SO2+2H2S=3S↓+2H2O(H2S臭鸡蛋气味)60、浓硫酸与铜加热发生反应:2H2SO4(浓)+Cu=CuSO4+SO2↑+2H2OΔ61、浓硫酸与木炭加热发生反应:2H2SO4(浓)+C=2SO2↑+CO2↑+2H2OΔ62、二氧化硫能使澄清石灰水变浑浊:SO2+Ca(OH)2=CaSO3↓+H2O63、二氧化硫与氯气发生氧化还原反应:SO2+Cl2+2H2O=H2SO4+2HCl64、酸雨的形成:2SO2+O22SO3粉尘等催化SO3+H2O=H2SO4SO2+H2OH2SO32H2SO3+O2=2H2SO465、海水提镁第一步:Mg+2H+=Mg2++H2↑(盐酸、稀硫酸)66、镁与氮气的反应:3Mg+N2=Mg3N2点燃67、镁与二氧化碳反应:2Mg+CO2=2MgO+C点燃(镁着火不能用二氧化碳扑灭)68、海水提溴单质:2Br-+Cl2=Br2+2Cl-69、半导体硅与氧气的反应:Si+O2=SiO2Δ(自然界没有游离态的硅)70、工业上制粗硅:SiO2+2C=Si+2CO↑高温(光导纤维、沙子和石英的主要成分是SiO2)71、硅与氟气的反应:Si+2F2=SiF472、硅与氢氟酸的反应:Si+4HF=SiF4+2H273、制作黏合剂:Si+2NaOH+H2O=Na2SiO3+2H2↑74、玻璃与烧碱反应:SiO2+2NaOH=Na2SiO3+H2O(Na2SiO3的水溶液称为水玻璃)75、二氧化硅与碱性氧化物的反应:SiO2+CaO=CaSiO3高温76、刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O77、工业制玻璃:CaCO3+SiO2=CaSiO3+CO2↑高温Na2CO3+SiO2=Na2SiO3+CO2↑高温78、金属铝在氧气中燃烧:4Al+3O2=2Al2O3点燃79、铝热反应:2Al+Fe2O3=Al2O3+2Fe高温(铝粉与氧化铁粉的混合物称为铝热剂,用于焊接钢轨)80、金属铝与酸的反应:2Al+6HCl=2AlCl3+3H2↑81、金属铝与碱的反应:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑(四羟基合铝酸钠)82、实验室制氢氧化铝:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl(白色沉淀)83、氢氧化铝溶于强酸中:Al(OH)3+3H+=Al3++3H2O84、氢氧化铝溶于强碱中:Al(OH)3+OH-=[Al(OH)4]-(四羟基合铝酸根离子)85、氧化铝溶于强酸:Al2O3+6H+=2Al3++3H2O(氧化铝为两性氧化物)86、氧化铝溶于强碱:Al2O3+2OH-+3H2O=2[Al(OH)4]-87、碱式碳酸铜的制取:2Cu+O2+H2O+CO2=Cu2(OH)2CO3(绿色)88、铜与氧气的反应:Cu+O2=2CuOΔ89、铜与硫粉的反应:2Cu+S=Cu2SΔ90、4CuO=2Cu2O+O2↑高温(黑色物质变为红色物质)91、CuSO4·5H2O=CuSO4+5H2O↑Δ(蓝色晶体变为白色粉末)92、氯化铝与少量的氢氧化钠反应:Al3++3OH-=Al(OH)3↓93、氯化铝与过量的氢氧化钠反应:Al3++4OH-=[Al(OH)4]-94、四羟基合铝酸根离子与酸的反应:[Al(OH)4]-+H+=H2O+Al(OH)3↓95、实验室制取氯气:4HCl(浓)+MnO2=MnCl2+Cl2↑+2H2OΔ(黄绿色气体、有毒、密度比空气大) 96、实验室制取二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑(无色无味、密度比空气大,溶于水)97、水垢形成、钟乳石的形成:2NaHCO3ΔNa2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体98、甲烷和天然气的燃烧:2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体高考化学解题有什么方法1、高考化学解题抓住关键,以新联旧填空题形式新颖,思维巧妙,很富有思考性,综合性程度很高,内容跨度大,知识的串联性强,只要抓住关键,搞清题目的条件和要求,在此基础上题目的新要求与学过的旧知识联系,进行有关知识的整体思维,答案就能顺利推出。
第五单元 化学方程式填空练习
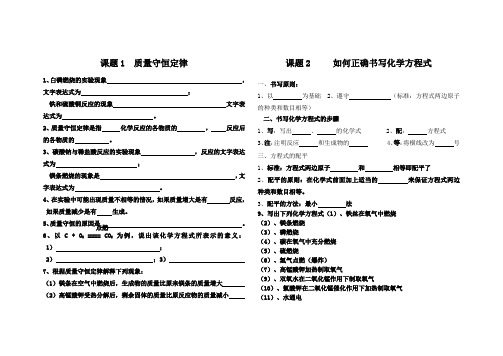
课题1 质量守恒定律1、白磷燃烧的实验现象,文字表达式为;铁和硫酸铜反应的现象文字表达式为。
2、质量守恒定律是指化学反应的各物质的,反应后的各物质的。
3、碳酸钠与稀盐酸反应的实验现象,反应的文字表达式为;镁条燃烧的现象是,文字表达式为。
4、在实验中可能出现质量不相等的情况,如果质量增大是有反应,如果质量减少是有生成。
5、质量守恒的原因是。
6、以 C + O2==== CO2为例,说出该化学方程式所表示的意义:1);2);3)7、根据质量守恒定律解释下列现象:(1)镁条在空气中燃烧后,生成物的质量比原来镁条的质量增大(2)高锰酸钾受热分解后,剩余固体的质量比原反应物的质量减小课题2 如何正确书写化学方程式一、书写原则:1、以为基础2、遵守(标准:方程式两边原子的种类和数目相等)二、书写化学方程式的步骤1、写:写出、的化学式2、配:方程式3、注:注明反应和生成物的4、等:将横线改为号三、方程式的配平1、标准:方程式两边原子和相等即配平了2、配平的原则:在化学式前面加上适当的来保证方程式两边种类和数目相等。
3、配平的方法:最小法9、写出下列化学方程式(1)、铁丝在氧气中燃烧(2)、镁条燃烧(3)、磷燃烧(4)、碳在氧气中充分燃烧(5)、硫燃烧(6)、氢气点燃(爆炸)(7)、高锰酸钾加热制取氧气(9)、双氧水在二氧化锰作用下制取氧气(10)、氯酸钾在二氧化锰催化作用下加热制取氧气(11)、水通电点燃课题3 利用化学方程式的简单计算一、依据:利用化学方程式能反映物质间的比,且比呈正比例关系。
二、步骤:①设;②根据题意写出;③根据化学方程式找出量与量的质量比;④列出,并求出;⑤答注意:①由于方程式只能反映物质间的质量比,因此代入方程式中的各个量必须是。
②由于方程式中各物质是纯净物,因此代入方程式中的量必须是的质量。
③单位必须统一。
例题:加热6克高锰酸钾可以得到氧气多少克?(1)设未知量(2)写方程式并配平(3)写出相关物质的相对分子质量和已知量、未知量(4)列比例式、求解(5)简明作答练习:1、2.4克镁完全燃烧能得到多少克氧化镁?2 10克水通电可制得氢气多少g?氧气多少g?3 把干燥纯净的KClO3和MnO2的混合物13.32克,加热至不再产生气体为止,称量剩余物质量为9.48克,求①生成氧气的质量;②剩余物质各是什么?质量分别是多少克?4、在标准状况下,6.2g磷在氧气中充分燃烧,需要氧气多少克?这些氧气的体积是多少升?能生成P2O5多少克?(已知标况下ρO2=1.43g/L)5、含锌65%的锌粒200g,与足量的稀H2SO4反应,可制得H2多少升?(标况下2Hρ=0.09g/L)6、一定质量的KClO3和MnO2的混合物中,MnO2的质量分数为20%,加热后,剩余的固体混合物中MnO2的质量分数升高至25%,则KClO3的分解率是多少?。
高中化学方程式大全(完整版)

6、 PCl 3 Cl 2 PCl 5 7、 Cl 2 H 2 O HCl HClO 8、 2Ca(OH) 2 2Cl 2 Ca(ClO) 2 CaCl 2 2H 2 O 9、 Ca(ClO) 2 CO 2 H 2 O CaCO 3 2HClO 10、 2NaOH Cl 2 NaClO NaCl H 2 O 11、 4HCl MnO2 MnCl2 2H 2 O Cl 2 12、 2KMnO4 16HCl(浓) 2MnCl2 2KCl 5Cl 2 8H 2 O 13、 2HClO 2HCl O 2
高温
50、 S O 2 SO 2
点燃
51、 3S 6KOH 2K 2S K 2SO 4 3H 2 O 第二节 硫的氢化物和氧化物 52、 H 2S H 2 S 53、 2H 2S 3O 2 (足) 2H 2 O 2SO 2
第一章
卤素
点燃
第一节 氯气 1、 2Na Cl 2 2NaCl 2、 Cu Cl 2 CuCl 2
点燃
3、 2Fe 3Cl 2 2FeCl 3
点燃
4、 H 2 Cl 2 2HCl
点燃(光照)
5、 2P 3Cl 2 2PCl3
82、 P H 2SO (浓) H 3 PO4 SO 2 2H 2 O 4 83、 H 2S H 2SO(浓) S SO 2 2H 2 O 4 84、 Cu 2H 2SO (浓) CuSO 4 SO 2 2H 2 O 4 85、 BaCl 2 H 2SO 4 BaSO 4 2HCl 86、 BaCl 2 Na 2SO 4 BaSO 4 2NaCl 87、 BaCl 2 Na 2 CO 3 BaCO 3 2NaCl 88、 BaCO 3 2HCl BaCl 2 H 2 O CO 2 89、 BaCO 3 2HNO3 Ba(NO3 ) 2 H 2 O CO 2 90、 Na 2 CO 3 H 2SO 3 Na 2S H 2 O CO 2 91、 2H 2SO 3 O 2 2H 2SO 4 92、 2Na 2SO 3 O 2 2Na 2SO 4 93、 2CaSO 3 O 2 2CaSO 4 94、 2Fe 6H 2SO (浓) Fe( ) 4 2 SO 4 3 3SO 2 6H 2 O 95、 2NaBr 2H 2SO(浓) Br2 SO 2 Na 2SO 4 H 2 O 4 96、 2NaCl H 2SO(浓) Na 2SO 4 2HCl 4
高三化学方程式大全

高三化学方程式大全
1、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4。
2、硝酸银与盐酸及可溶性盐酸盐溶液反应:Ag++Cl-=AgCl↓。
3、钠与水反应:2Na+2H2O=2Na++2OH–+H2↑。
4、甲烷在空气中燃烧:CH4+2O2=CO2+2H2O。
5、酒精在空气中燃烧:C2H5OH+3O2=2CO2+3H2O。
6、过氧化钠与水反应:2Na2O+2H2O=4Na++4OH–+O2↑。
7、一氧化碳还原氧化铜:CO+CuO=Cu+CO2。
5、一氧化碳还原氧化铁:3CO+Fe2O3=2Fe+3CO2。
7、氢氧化钙与碳酸氢镁反应:Ca2++2OH-+2HCO3-+Mg2+=Mg(OH)2↓+CaCO3↓。
8、氯化钠溶液和硝酸银溶液反应:NaCl+AgNO3=AgCl↓+NaNO3。
9、二氧化碳通过澄清石灰水:Ca(OH)2+CO2=CaCO3↓+H2O。
10、氢氧化钠和二氧化碳反应:2NaOH+CO2=Na2CO3+H2O。
11、碳酸氢钙和氢氧化钠反应:Ca2++HCO3-+OH-=CaCO3↓+H2O。
12、硫酸钠和氯化钡反应:Na2SO4+BaCl2=BaSO4↓+2NaCl。
13、石灰石与稀盐酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑。
14、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O。
15、碳酸钠与浓盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑。
高中高一化学方程式大全

高中高一化学方程式大全高中高一化学方程式大全:1、钠与氧气:常温:4na+o2=2na2o点燃:2na+o2=(△)na2o22、钠与水反应:2na+2h2o=2naoh+h2↑离子方程式:2na+2h2o=2na ++2oh-+h2↑3、钠与硫酸反应:2na+h2so4=na2so4+h2↑4、氧化钠与水反应:na2o+h2o=2naoh5、过氧化钠与二氧化碳反应:2na2o2+2co2=2na2co3+o2↑6、过氧化钠与水反应:2na2o2+2h2o=4naoh+o2↑离子方程式:2na2o2+2h2o=4na++4oh-+o2↑7、naoh溶液中通入少量co2:2naoh+co2=na2co3+h2o离子方程式:2oh-+co2=co32-+h2onaoh溶液中通入过量co2:naoh+co2=nahco3离子方程式:oh-+co2=hco3-8、①向碳酸钠溶液滴入少量稀盐酸:na2co3+hcl=nahco3+nacl向稀盐酸滴入少量碳酸钠溶液:na2co3+2hcl=2nacl+h2o+co2↑②除去碳酸氢钠溶液中混有的碳酸钠:na2co3+h2o+co2=2nahco3③碳酸钠与氢氧化钙:na2co3+ca(oh)2=caco3↓+2naoh④碳酸氢钠与盐酸:nahco3+hcl=nacl+h2o+co2↑⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中:nahco3+ca(oh)2=caco3↓+naoh+h2o少量氢氧化钙溶液滴入碳酸氢钠溶液中:2nahco3+ca(oh)2=caco3↓+na2co3+2h2o⑥除去碳酸钠溶液中的碳酸氢钠:nahco3+naoh=(△)na2co3+h2o⑦除去碳酸钠固体中的碳酸氢钠:2nahco3=(△)na2co3+h2o+co2↑⑧鉴别碳酸钠和碳酸氢钠溶液:na2co3+cacl2=caco3↓+2nacl。
高中化学方程式全

以上信息仅供参考,具体的高中化学方程式请参考化学教材或者咨询化学老师。
高中化学方程式全
高中化学方程式很多,以下是部分常见的化学方程式:
1.碳酸根离子的检验:$CaCl_{2} + Na_{2}CO_{3} = CaCO_{3} \downarrow + 2NaCl$
2.碳酸钠与盐酸反应:$Na_{2}CO_{3} + 2HCl = 2NaCl + H_{2}O + CO_{2} \uparrow$
9.钠与水反应:$2Na + 2H_{2}O = 2NaOH + H_{2} \uparrow$
10.铝与氢氧化钠溶液反应:$2Al + 2NaOH + 2H_{2}O = 2NaAlO_{2} + 3H_{2} \uparrow$
11.氧化钙与水反应:$CaO + H_{2}O = Ca(OH)_{2}$
3.木炭还原氧化铜:$2CuO + C\text{高温}2Cu + CO_{2} \uparrow$
4.铁片与硫酸铜溶液反应:$Fe + CuSO_{4} =FeSO_{4} + Cu$
5.氯化钙与碳酸钠溶液反应:$CaCl_{2} + Na_{2}CO_{3} = CaCO_{3} \downarrow Fra bibliotek 2NaCl$
6.钠在空气中燃烧:$2Na + O_{2}\text{△}Na_{2}O_{2}$
7.过氧化钠与水反应:$2Na_{2}O_{2} + 2H_{2}O = 4NaOH + O_{2} \uparrow$
高中化学方程式大全(完整版)

第一章卤素第一节氯气占燃1、2Na Cl 2> 2NaCI占燃2、Cu Cl2> CuCI 23、2Fe 3CI2 点燃、2FeCb4、H2 Cl2点燃(光照)> 2HCI5、2P 3CI2点燃、2PCI36、PCI 3 ■ CI 2 J PCI 57、CI2 H2O > HCI HCIO8、2Ca (OH )+2CI2 t Ca (CIO ) 2 +CaCI 2 + 2H 2O9、Ca (CIO)2 CO2 H2O > CaCO3":;2HCIO12NaOH CI2 > NaCIO NaCI H2O0、14HCI MnO2—MnCI 2 2H2O CI21、12KMnO 4 16HCI (浓)> 2MnCI 2 2KCI 5CI28H2O2、13、2HCIO 见光> 2HCI O2第二节氯化氢1NaCI H2SO4(浓)> NaHSO4 HCI4、1NaHSO4 NaCI—Na2SO4 HCI5、12NaCI H2SO(浓)一- Na2SO4 2HCI (14、15 结合)6、1HCI AgNO 3 > AgCI S'HNO 37、1NaCI AgNO 3 > AgCI S'NaNO381KCI AgNO 3 > AgCI X KNO 39、20、2HCI CaCO3 > CaCI2 H2O CO2第三节氧化还原反应21、CuO 亠H 2——-Cu 亠H2O22、C 4HNO3「CO2 4NO 22H 2O23、4Zn 10HNO 3(极稀)一:-'4Zn (NO/2 NH4NO3 3H2O24、11P 15CuSO424H2O > 5Cu3P 6H3PO4 15H2SO425、KClO 3 6HCl (浓)> 3Cl2 KCl 3H2O26、4Mg 1OHNO3(极稀)一-4Mg ( NO3) 2 NH 4NO3 3H 2O27、K2CQO7 + 6Fe3。
高中化学方程式大全(完整版)

高中化学方程式大全(完整版) Chapter 1: Halogensn 1: Chlorine Gas1.2NaCl → 2Na + Cl2 (n)2.Cu + Cl2 → CuCl2 (n)3.2Fe + 3Cl2 → 2FeCl3 (n)4.H2 + Cl2 → 2HCl (n under light)5.2P + 3Cl2 → 2PCl3 (n)6.PCl3 + Cl2 → PCl57.Cl2 + H2O → HCl + HClO8.2Ca(OH)2 + 2Cl2 → Ca(ClO)2 + CaCl2 + 2H2O9.Ca(ClO)2 + CO2 + H2O → CaCO3 ↓ + 2HClO10.2NaOH + Cl2 → NaClO + NaCl + H2O11.MnCl2 + 2H2O + Cl2 → Δ MnO2 + 2HClO12.2KMnO4 + 16HCl (concentrated) → 2MnCl2 + 2KCl + 5Cl2 ↑ + 8H2O13.2HClO → (light)n 2: Hydrogen Chloride14.NaCl + H2SO4 (concentrated) → NaHSO4 + HCl ↑15.NaHSO4 + NaCl → Na2SO4 + HCl ↑ (combined with 14)16.2NaCl + H2SO4 (concentrated)17.HCl + AgNO3 → AgCl ↓ + HNO318.NaCl + AgNO3 → AgCl ↓ + NaNO319.KCl + AgNO3 → AgCl ↓ + KNO320.2HCl + CaCO3 → CaCl2 + H2O + CO2↑n 3: Redox ns21.CuO + H2 → Cu + H2O22.C + 4HNO3 → CO2 ↑ + 4NO2 ↑ + 2H2O23.4Zn + 10HNO3 (very dilute) → 4Zn(NO3)2 + NH4NO3 + 3H2O24.11P + 15CuSO4 + 24H2O → 5Cu3P + 6H3PO4 +15H2SO425.KClO3 + 6HCl (concentrated) → 3Cl2 ↑ + KCl + 3H2O26.4Mg + 10HNO3 (very dilute) → 4Mg(NO3)2 + NH4NO3 + 3H2O27.K2Cr2O7 + 6Fe3O4 + 31H2SO4 → Cr2(SO4)3 +9Fe2(SO4)3 + K2SO4第四节卤族元素卤族元素是指周期表中第17族元素,包括氟、氯、溴、碘和石蕊。
高中化学方程式大全(完整版)

.第一章卤素第一节氯气1、2Na Cl点燃2NaCl 22、Cu Cl 2点燃CuCl 23、2Fe3Cl 2点燃2FeCl34、H2Cl 2点燃(光照)2HCl5、2P3Cl点燃2PCl326、PCl3Cl 2PCl 57、Cl2H 2 O HCl HClO8、2Ca(OH)22Cl 2Ca( ClO )2CaCl 22H 2O9、Ca(ClO)2CO2 H 2O CaCO 32HClO10、2NaOH Cl 2NaClO NaCl H 2 O11、4HCl MnO 2MnCl 2 2H 2 O Cl 212、2KMnO416HCl (浓)2MnCl 22KCl5Cl 28H 2 O13、2HClO见光2HCl O 2第二节氯化氢14、NaCl H 2SO(4浓)NaHSO 4HCl15、NaHSO4NaCl Na 2SO4HCl16、2NaCl H 2SO(4浓)Na 2 SO42HCl( 14、15 联合)17、HCl AgNO 3AgCl HNO 318、NaCl AgNO 3AgCl NaNO 319、KCl AgNO 3AgCl KNO 320、2HCl CaCO 3CaCl 2H 2 O CO 2第三节氧化复原反响.21、CuO H 2Cu H 2O22、C4HNO 3CO 24NO 22H 2O23、4Zn(极稀)4Zn()NH 4NO 3 3H2O 10HNO3NO3 224、11P15CuSO424H2O5Cu 3 P6H 3PO415H 2SO 425、KClO36HCl (浓)3Cl 2KCl3H 2O26、4Mg10HNO (极稀)4Mg()NH 4NO 3 3H 2O 3NO3 227、K2Cr2O76Fe3O 431H 2SO 4Cr(2 SO 4)39Fe(2 SO4)3 K 2 SO4 31H 2O28、2KNO33C S K 2S N 23CO 2第四节卤族元素29、H2F22HF30、H2Br22HBr31、H2I 22HI32、2NaBr Cl 22NaCl Br 233、2KI Cl34、2KI Br 222KCl I2KBr I2235、NaBr AgNO 3 AgBrNaNO 336、KI AgNO 3AgI KNO 337、2AgBr光照2Ag Br 2第二章摩尔反响热第一节摩尔38、C O 2CO 239、Mg2HCl MgCl 2H 2第二节气体摩尔体积40、Zn2HCl ZnCl 2H 2.第三节物质的量浓度41、2NaOH H 2SO4Na 2SO 42H 2O第四节反响热42、C(固)O(气)2点燃CO(气)2393.5kJ43、2H(气)2O(气)22H 2 O(气) 483.6kJ44、2H(气)2O(气)22H 2 O(液) 571.6kJ45、C(固)H2O(气)CO(气)H (2气)131.3kJ第三章硫硫酸第一节硫46、2Cu S Cu 2S47、Fe S FeS48、S H 2H 2S49、S C 高温CS250、S O 2点燃SO251、3S6KOH2K 2S K 2SO43H 2O 第二节硫的氢化物和氧化物52、H2S H 2S53、2H2S3O 2 (足)点燃2H 2O2SO 254、2H2S O 2( 不足)点燃2H 2O2S55、2H2S SO 2点燃2H 2O 3S56、H2S Br 2S2HBr57、FeS 2HCl FeCl 2H 2 S58、CuSO4H2S CuS H 2SO459、PbAc2H 2S PbS2HAc60、H S NaOH NaHS H O61、 NaHS NaOH Na 2 S H 2 O62、 H 2S2NaOH Na 2S 2H 2 O ( 60、61 联合) 63、 H 2S 2FeCl 3S2FeCl 2 2HCl 64、 H 2SO (4稀) FeS FeSO 4H 2 S65、 SO 2 H 2OH 2SO 366、 2SO 2 O 2 V 2O 52SO 367、 SO 3H 2O H 2SO 468、 Na 2SO3H 2SO 4 Na 2SO 4 H 2O SO 269、 SO 2 2NaOH Na 2SO 3 H 2O70、 SO 2 CaOCaSO 371、 SO 2 2Ca ( OH )CaSO3H 2O272、 SO 2 CaSO 3 H 2O Ca ( HSO 3)2 73、 SO 2 2H 2S 3S2H 2O74、 SO 2 Cl 2 2H 2O 2HCl H 2SO 4 75、 SO 2 Br 22H 2O2HBrH 2SO 476、 5SO 2 2H 2O 2KMnO 4MnSO 4K 2SO 4 2H 2SO 4第三节硫酸的工业制法77、 4FeS 2 11O 2 高温2Fe 2O 3 8SO 278、 2SO 2O 2V 2O 52SO 379、 H 2O SO 3 H 2SO 4第四节 硫酸 硫酸盐80、 C 2H 2SO (4 浓) CO 2 2SO 2 2H 2O81、 S2H 2 SO (4浓)3SO 22H 2O(浓)H 3PO4SO 22H 2O82、P H2SO483、H2S H2SO(4浓)S SO22H 2O84、Cu 2H2SO(4浓)CuSO 4SO22H 2O85、BaCl2H 2SO4BaSO 42HCl86、BaCl2Na 2 SO4BaSO42NaCl87、BaCl2Na 2 CO3BaCO 32NaCl88、BaCO32HCl BaCl 2H2O CO289、BaCO32HNO 3Ba( NO 3)2H 2O CO 290、Na2CO3H 2SO3Na 2 S H 2 O CO 291、2H2SO3O 22H 2SO 492、2Na2SO3O 22Na 2 SO493、2CaSO3O 22CaSO494、2Fe6H(浓)()2SO4Fe2 SO4 3 3SO26H 2O95、2NaBr2H 2 SO(4浓)Br 2SO2Na 2SO4 H 2O96、2NaCl H 2SO(4浓)Na 2 SO 4 2HCl97、C11H22O浓H2SO412C11H 2O 11第四章碱金属第一节钠98、4Na O 22Na 2 O99、2Na O 2Na 2O 2 100、2Na Cl 2点燃2NaCl101、2Na S 研磨Na 2S102、2Na2H 2O 2NaOH H 2103、2Na2H 2O CuSO 4Cu( OH )2 Na 2 SO4H 2第二节钠的氧化物104、Na2O H 2 O2NaOH105、2Na2O22H 2O4NaOH O 2106、Na2O CO 2Na 2 CO 3107、2Na 2O 22CO 22Na 2CO 3O 2108、Na2O2HCl2NaCl H 2 O109、Na2O24HCl4NaCl2H 2O O 2110、Na2CO32HCl2NaCl CO 2H 2 O111、NaHCO3HCl NaCl CO 2H 2 O112、2NaHCO3Na 2 CO 3CO 2H 2 O113、NaHCO3NaOH Na 2 CO 3H 2 O114、2NaHCO3Ca( OH)(少许)CaCO3Na2CO32H O22115、NaHCO3Ca( OH )(足量)2CaCO 3NaOH H 2 O 116、Na2CO3BaCl 2BaCO 32NaCl117、Na2CO3CaCl 2CaCO 32NaCl118、Ca(HCO)2HCl CaCl22CO22H2O32119、Ca(HCO3)22NaOH CaCO 3Na 2CO 32H2O 120、NaHSO3HCl NaCl SO2H 2 O第三节碱金属元素121、4Li O 2点燃2Li 2 O122、K O 2点燃KO 2123、2M X 22MX (M表示氧族元素,X代表卤族元素)124、 2M H 2 2MH125、 2M2H 2O2MOH H 2第五章 物质构造 元素周期律本章内容、性质特别,全部化学反响方程式均融在其余章节中。
高中化学方程式大全

高中化学方程式大全一、氧化还原反应方程式1.金属与非金属的氧化反应例如:2Na+Cl₂→2NaCl2Mg+O₂→2MgO2.金属与酸的反应例如:Zn+2HCl→ZnCl₂+H₂3.金属与水的反应例如:2Na+2H₂O→2NaOH+H₂4.非金属与氧气的反应例如:C+O₂→CO₂5.过氧化氢分解例如:2H₂O₂→2H₂O+O₂6.还原剂与氧化剂的反应例如:Cl₂+2KBr→2KCl+Br₂二、酸碱中和反应方程式1.强酸与强碱的中和反应例如:HCl+NaOH→NaCl+H₂O2.强酸与弱碱的中和反应例如:HCl+NH₄OH→NH₄Cl+H₂O3.弱酸与弱碱的中和反应例如:CH₃COOH+NH₄OH→CH₃COONH₄+H₂O三、水解反应方程式1.盐的水解例如:NaCl+H₂O→NaOH+HCl2.酸酐的水解例如:(CH₃CO)₂O+H₂O→2CH₃COOH3.酯的水解例如:CH₃COOCH₃+H₂O→CH₃COOH+CH₃OH四、氧气化反应方程式1.元素与氧气的直接反应例如:S+O₂→SO₂C+O₂→CO₂2.含氢的有机物燃烧反应例如:CH₄+2O₂→CO₂+2H₂O五、重组反应方程式1.单质重组反应例如:2Na+Cl₂→2NaClN₂+3H₂→2NH₃2.高低价金属的重组反应例如:Cu+2AgNO₃→Cu(NO₃)₂+2Ag3.过氧化物分解例如:2H₂O₂→2H₂O+O₂六、酸反应方程式1.均一催化酸解例如:2H₂O₂→2H₂O+O₂2.酸与金属氧化物反应例如:2HCl+Mg(OH)₂→MgCl₂+2H₂O七、氧化反应方程式1.金属与氧反应生成金属氧化物例如:2Na+O₂→2Na₂O2.非金属与氧反应生成非金属氧化物例如:C+O₂→CO₂八、盐酸与金属氧化物反应方程式例如:2HCl+CuO→CuCl₂+H₂O九、铜与含氧化剂的反应方程式例如:2Cu+O₂→2CuO。
高中化学方程式大全 (完整版)

高中化学方程式大全一、非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si) (1)二、金属单质(Na,Mg,Al,Fe)的还原性 (5)三、非金属氢化物(HF,HCl,H2O,H2S,NH3) (7)四、非金属氧化物 (9)五、金属氧化物 (12)六、含氧酸 (14)七、碱 (17)八、盐 (18)一、非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)1, 氧化性:F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属)2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2O F2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HCl Cl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HCl Cl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4 O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3 N2+3Mg===Mg3N2 N2+3Ca===Ca3N2 N2+3Ba===Ba3N2 N2+6Na===2Na3N N2+6K===2K3NN2+6Rb===2Rb3N P2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2,Cl2,Br2)PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2O C+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23,(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO3C+SiO2===SiC+2CO二、金属单质(Na,Mg,Al,Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg 4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡Fe+SnCl2==FeCl2+Sn)三、非金属氢化物(HF,HCl,H2O,H2S,NH3)1,还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O2H2O+2F2===4HF+O22H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2O2H2S+SO2===3S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H24NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H22,酸性:4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2H2S+CuCl2===CuS+2HClH2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HClH2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2===2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3)3,碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl (此反应用于工业制备小苏打,苏打)4,不稳定性:2HF===H2+F22HCl===H2+Cl22H2O===2H2+O22H2O2===2H2O+O2H2S===H2+S2NH3===N2+3H2四、非金属氧化物1.低价态的还原性:2SO2+O2===2SO32SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HClSO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HISO2+NO2===SO3+NO2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2CO+H2O===CO2+H22.氧化性:SO2+2H2S===3S+2H2OSO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2===Si+2H2OSiO2+2Mg===2MgO+Si3,与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O===2HPO3P2O5+3H2O===2H3PO4(P2O5极易吸水,可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34,与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3 CO2+C6H5ONa+H2O===C6H5OH+NaHCO3 SiO2+CaO===CaSiO3SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2SiO2+CaCO3===CaSiO3+CO2五、金属氧化物1,低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2O2,氧化性:Na2O2+2Na===2Na2O(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al. 一般通过电解制Mg和Al.Fe2O3+3H2===2Fe+3H2O (制还原铁粉)Fe3O4+4H2===3Fe+4H2O3,与水的作用:Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;2H2O2===2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2)MgO+H2O===Mg(OH)2 (缓慢反应)4,与酸性物质的作用:Na2O+SO3===Na2SO4Na2O+CO2===Na2CO3Na2O+2HCl===2NaCl+H2O2Na2O2+2CO2===2Na2CO3+O2Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2MgO+SO3===MgSO4MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O(Al2O3是两性氧化物:Al2O3+2NaOH===2NaAlO2+H2O)FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2OFe2O3+3H2S(g)===Fe2S3+3H2O3 高中所有化学方程式Fe3O4+8HCl===FeCl2+2FeCl3+4H2O六、含氧酸1,氧化性:4HClO3+3H2S===3H2SO4+4HClHClO3+HI===HIO3+HCl3HClO+HI===HIO3+3HClHClO+H2SO3===H2SO4+HClHClO+H2O2===HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)2H2SO4(浓)+C===CO2+2SO2+2H2O2H2SO4(浓)+S===3SO2+2H2OH2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O2H2SO4(浓)+Cu===CuSO4+SO2+2H2OH2SO4(浓)+2HBr===SO2+Br2+2H2OH2SO4(浓)+2HI===SO2+I2+2H2OH2SO4(稀)+Fe===FeSO4+H22H2SO3+2H2S===3S+2H2O4HNO3(浓)+C===CO2+4NO2+2H2O6HNO3(浓)+S===H2SO4+6NO2+2H2O5HNO3(浓)+P===H3PO4+5NO2+H2O6HNO3+Fe===Fe(NO3)3+3NO2+3H2O4HNO3+Fe===Fe(NO3)3+NO+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O2,还原性:H2SO3+X2+H2O===H2SO4+2HX(X表示Cl2,Br2,I2)2H2SO3+O2===2H2SO4H2SO3+H2O2===H2SO4+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2O H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl3,酸性:H2SO4(浓) +CaF2===CaSO4+2HFH2SO4(浓)+NaCl===NaHSO4+HClH2SO4(浓) +2NaCl===Na2SO4+2HClH2SO4(浓)+NaNO3===NaHSO4+HNO33H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)23HNO3+Ag3PO4===H3PO4+3AgNO32HNO3+CaCO3===Ca(NO3)2+H2O+CO2(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)等还原性气体)4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr===NaH2PO4+HBrH3PO4(浓)+NaI===NaH2PO4+HI4,不稳定性:2HClO===2HCl+O24HNO3===4NO2+O2+2H2OH2SO3===H2O+SO2H2CO3===H2O+CO2H4SiO4===H2SiO3+H2O七、碱1,低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)32,与酸性物质的作用:2NaOH+SO2(少量)===Na2SO3+H2O NaOH+SO2(足量)===NaHSO32NaOH+SiO2===NaSiO3+H2O2NaOH+Al2O3===2NaAlO2+H2O2NaOH+Cl2===NaCl+NaClO+H2ONaOH+HCl===NaCl+H2ONaOH+H2S(足量)===NaHS+H2O2NaOH+H2S(少量)===Na2S+2H2O3NaOH+AlCl3===Al(OH)3+3NaCl NaOH+Al(OH)3===NaAlO2+2H2O (AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl===NaCl+NH3+H2OMg(OH)2+2NH4Cl===MgCl2+2NH3.H2O Al(OH)3+NH4Cl 不溶解3,不稳定性:Mg(OH)2===MgO+H2O2Al(OH)3===Al2O3+3H2O2Fe(OH)3===Fe2O3+3H2OCu(OH)2===CuO+H2O八、盐1,氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应) Fe(NO3)3+Ag 不反应2FeCl3+H2S===2FeCl2+2HCl+S2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl22,还原性:2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O 3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O2Na2SO3+O2===2Na2SO43,与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4ClAlCl3+3NH3.H2O===Al(OH)3+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl4,与酸性物质的作用:Na3PO4+HCl===Na2HPO4+NaClNa2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaClNa2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl 3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl 3NaHCO3+AlCl3===Al(OH)3+3CO23NaHCO3+FeCl3===Fe(OH)3+3CO23Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S3NaAlO2+AlCl3+6H2O===4Al(OH)35,不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2+H2ONH4Cl===NH3+HClNH4HCO3===NH3+H2O+CO22KNO3===2KNO2+O22Cu(NO3)3===2CuO+4NO2+O2 2KMnO4===K2MnO4+MnO2+O2 2KClO3===2KCl+3O22NaHCO3===Na2CO3+H2O+CO2 Ca(HCO3)2===CaCO3+H2O+CO2 CaCO3===CaO+CO2MgCO3===MgO+CO2。
高中常见化学方程式填空练习试题

钾和硫酸的反应
47
钾和硫酸铜的反应
48
锂在氮气中燃烧
镁、铝及其化合物有关的化学方程式
序号
反应条件
化学反应方程式或离子方程式
1
镁在氧气中燃烧
2
镁在氮气中燃烧
3
镁在二氧化碳中燃烧
4
镁在氯气中燃烧
5
镁与硫粉共热
6
镁与硫酸反应
7
镁与氯化亚铁反应
8
工业制备镁
9
铝在氧气中燃烧
10
铝在氯气中燃烧
11
铝与硫粉共热
12
铝与稀硫酸反应
13
铝与氢氧化钠反应
14
铝与硫酸铜溶液反应
15
铝与氧化铁反应(铝热反应)
铝与二氧化锰反应
铝与五氧化二钒反应
铝与三氧化二铬反应
16
工业制备铝
17
氧化铝与盐酸反应
18
氧化铝与氢氧化钠反应
19
氢氧化铝受热分解
20
氢氧化铝酸式电离
21
氢氧化铝碱式电离
22
氢氧化铝与硫酸反应
23
氢氧化铝与氢氧化钠反应
10
氯气通入氢氧化钠溶液
11
氯气通入热的氢氧化钠溶液
12
向次氯酸钙溶液通入少量二氧化碳
52
铜生锈原理
53
铜与浓硫酸共热
54
铜与浓硝酸反应
55
铜与稀硝酸反应
56
铜与硝酸银溶液反应
57
氧化铁与稀硫酸反应
58
氧化铜与氢气加热
59
氧化亚铜与稀硫酸(歧化反应)
60
氧化亚铜与氢气共热
61
氧化亚铜与稀硝酸反应
(完整版)高中所有常见化学方程式

2Na 2 O2 + 2CO 2 = 2Na 2CO 3 + O2
5、苏打 (纯碱 )与盐酸反应
①盐酸中滴加纯碱溶液
Na 2CO 3 + 2HCl = 2NaCl + H 2O + CO 2↑
CO
2- 3
+
+
2H
=
H 2O
+
CO 2↑
②纯碱溶液中滴加盐酸,至过量
Na 2CO 3 + HCl = NaHCO 3 + NaCl
2
高中常见化学方程式
42、 NaAlO 2 溶液通入过量 CO 2
NaAlO 2 + CO 2+ 2H 2 O==Al(OH) 3↓+ NaHCO 3
AlO
-
2
+
CO 2+ 2H 2 O==Al(OH)
3 ↓+
HCO
-
3
43、硫酸铝溶液中滴过量氨水
Al 2(SO 4)3 + 6NH 3·H 2 O= 2Al(OH) 3↓+ 3(NH 4)2 SO4
高中常见化学方程式
Fe 与稀 HNO 3 反应 Fe+ 4HNO 3= Fe(NO 3)3+ NO ↑+ 2H 2O(Fe 不足 ) 3Fe+ 8HNO 3= 3Fe(NO 3)2+ 2NO ↑+ 4H 2O(Fe 过量 ) 29、 NO 2 、 O 2 的混合气通入水中无剩余气体 (了解 )
20、硫酸工业制法
+
-
2Na + 2H 2O = 2Na + 2OH + H 2 ↑
3、过氧化钠与水的反应 (放热反应、 Na 2O2 是强氧化剂,
用于漂白 )
点燃
H 2 + Cl 2
2HCl
氟气与氢气反应 (黑暗处即可爆炸 )
2Na 2O2 + 2H 2O = 4NaOH + O2 ↑ 2Na 2O2 + 2H 2O = 4Na ++ 4OH -+ O2↑ 碱性氧化物 Na 2O 与水的反应 Na 2O+ H 2O = 2NaOH 4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源, 原因是:
完整版)高中化学方程式大全(最最完整版)

完整版)高中化学方程式大全(最最完整版) 高中化学方程式总结第一章:卤素第一节:氯气1、2Na + Cl2 → 2NaCl2、Cu + Cl2 → CuCl23、2Fe + 3Cl2 → 2FeCl34、H2 + Cl2 → 2HCl5、2P + 3Cl2 → 2PCl36、PCl3 + Cl2 → PCl57、Cl2 + H2O → HCl + HClO8、2Ca(OH)2 + 2Cl2 → Ca(ClO)2 + CaCl2 + 2H2O9、Ca(ClO)2 + CO2 + H2O → CaCO3 ↓ + 2HClO10、2NaOH + Cl2 → NaClO + NaCl + H2O (光照)11、4HCl + MnO2 → MnCl2 + 2H2O + Cl2 ↑12、2KMnO4 + 16HCl (浓) → 2MnCl2 + 2KCl + 5Cl2 ↑ + 8H2O13、2HClO → 2HCl + O2第二节:氯化氢14、NaHSO4 + HCl ↑ → NaCl + H2SO415、NaCl + H2SO4 (浓) → Na2SO4 + HCl ↑14、15结合)16、2NaCl + H2SO4 (浓)17、HCl + AgNO3 → AgCl ↓ + HNO318、NaCl + AgNO3 → AgCl ↓ + NaNO319、KCl + AgNO3 → AgCl ↓ + KNO320、2HCl + CaCO3 → CaCl2 + H2O + CO2 ↑第三节:氧化还原反应21、CuO + H2 → Cu + H2O22、C + 4HNO3 → CO2 ↑ + 4NO2 ↑ + 2H2O23、4Zn(NO3)2 → 4Zn + 10NO2 ↑ + NH4NO3 + 3H2O24、11P + 15CuSO4 + 24H2O → 5Cu3P + 6H3PO4 + 15H2SO425、KClO3 + 6HCl (浓) → 3Cl2 ↑ + KCl + 3H2O26、4Mg(NO3)2 → 4Mg + 10NO2 ↑ + N2H4(NO3)222HBr S(固)27、化学方程式:K2Cr2O76Fe3O431H2SO4Cr(2SO439Fe(2SO43K2SO431H2O。
(完整版)高中有机化学方程式大全

(完整版)⾼中有机化学⽅程式⼤全光照光照光照光照⾼温 CaO △催化剂加热、加压催化剂△催化剂⾼中有机化学⽅程式⼤全1. CH 4 + Cl 2 CH3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 22OH10. CH 2 = CH 23—CH 2Br 11. CH 2 = CH 2CH 3 12. nCH 2 = CH 2 ] n13. nCH 2-CH=CH-CH 2] n14. 2CH 23CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [ CH 2-CH ] nCl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 + Br 222. + HO 2 +H 2O 23. + HO 3H+H 2O催化剂△浓硫酸170℃浓硫酸140℃催化剂△24.+ 3H2-NO22O26. 3CH≡C H27. CH3CH2Br + H228. CH3CH229. CH3CH22O30. 2CH3CH2OH+2Na 2CH3CH2ONa + H2↑31. 2CH3CH2OH+O2 2CH3CHO + 2H2O32. CH3CH2OH CH2 = CH2↑+ H2O33.C2H5OH+C2H5OH C2H5OC2H5+H2O34. 2O35. 2O -+H3O+233738. CH339. 2CH340. CH34+2Ag↓+3NH3+H2O 41CH3↓+2H2O42. 2CH3COOH+2Na 2CH3COONa+H2↑43.2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑44. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2O O OC —CO OCH2-CH246. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COO H→[ OCH2CH2C ] n +H2O50. C6H12O6 (s) + 6O2 (g)6CO2 (g) + 6H2O (l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11 + H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n + nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n + nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2C17H35COO-CH257. C17H35COO-CH2CH2-OHC17H35COO-CH +3NaOH3C17H35COONa+ CH-OHC17H35COO-CH2CH2-OH58. CH2OH COOHCH2OH COOH1.HClCl CH Cl CH+→+324光HCl Cl CH Cl Cl CH+→+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-= 9.10.11.12.13.14.15.16.17. OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+?→??18.19.20.21.⾼中有机化学知识点总结1.需⽔浴加热的反应有:(1)、银镜反应(2)、⼄酸⼄酯的⽔解(3)苯的硝化(4)糖的⽔解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不⾼于100℃的条件下反应,均可⽤⽔浴加热,其优点:温度变化平稳,不会⼤起⼤落,有利于反应的进⾏。
【高中化学方程式大全(完整版)】高中化学方程式大全

【高中化学方程式大全(完整版)】高中化学方程式大全1、硫酸根离子的检验:bacl2+na2so4=baso4↓+2nacl2、碳酸根离子的检验:cacl2+na2co3=caco3↓+2nacl3、碳酸钠与盐酸反应:na2co3+2hcl=2nacl+h2o+co2↑4、木炭还原氧化铜:2cuo+c高温2cu+co2↑5、铁片与硫酸铜溶液反应:fe+cuso4=feso4+cu6、氯化钙与碳酸钠溶液反应:cacl2+na2co3=caco3↓+2nacl7、钠在空气中冷却:2na+o2△na2o2钠与氧气反应:4na+o2=2na2o8、过氧化钠与水反应:2na2o2+2h2o=4naoh+o2↑9、过氧化钠与二氧化碳反应:2na2o2+2co2=2na2co3+o210、钠与水反应:2na+2h2o=2naoh+h2↑11、铁与水蒸气反应:3fe+4h2o(g)=f3o4+4h2↑12、铝与氢氧化钠溶液反应:2al+2naoh+2h2o=2naalo2+3h2↑13、氧化钙与水反应:cao+h2o=ca(oh)214、氧化铁与盐酸反应:fe2o3+6hcl=2fecl3+3h2o15、氧化铝与盐酸反应:al2o3+6hcl=2alcl3+3h2o16、氧化铝与氢氧化钠溶液反应:al2o3+2naoh=2naalo2+h2o17、氯化铁与氢氧化钠溶液反应:fecl3+3naoh=fe(oh)3↓+3nacl18、硫酸亚铁与氢氧化钠溶液反应:feso4+2n aoh=fe(oh)2↓+na2so419、氢氧化亚铁被水解成氢氧化铁:4fe(oh)2+2h2o+o2=4fe(oh)320、氢氧化铁加热分解:2fe(oh)3△fe2o3+3h2o↑21、实验室制备氢氧化铝:al2(so4)3+6nh3·h2o=2al(oh)3↓+3(nh3)2so422、氢氧化铝与盐酸反应:al(oh)3+3hcl=alcl3+3h2o23、氢氧化铝与氢氧化钠溶液反应:al(oh)3+naoh=naalo2+2h2o24、氢氧化铝加热分解:2al(oh)3△al2o3+3h2o25、三氯化铁溶液与铁粉反应:2fecl3+fe=3fecl226、氯化亚铁中通入氯气:2fecl2+cl2=2fecl327、二氧化硅与氢氟酸反应:sio2+4hf=sif4+2h2o硅单质与氢氟酸反应:si+4hf=sif4+2h2↑28、二氧化硅与氧化钙高温反应:sio2+cao高温casio329、二氧化硅与氢氧化钠溶液反应:sio2+2naoh=na2sio3+h2o30、往硅酸钠溶液中通入二氧化碳:na2sio3+co2+h2o=na2co3+h2sio3↓31、硅酸钠与盐酸反应:na2sio3+2hcl=2nacl+h2sio3↓32、氯气与金属铁反应:2fe+3cl2点燃2fecl333、氯气与金属铜反应:cu+cl2熄灭cucl234、氯气与金属钠反应:2na+cl2点燃2nacl35、氯气与水反应:cl2+h2o=hcl+hclo36、次氯酸光照分解:2hclo光照2hcl+o2↑37、氯气与氢氧化钠溶液反应:cl2+2naoh=nacl+naclo+h2o38、氯气与消石灰反应:2cl2+2ca(oh)2=cacl2+ca(clo)2+2h2o39、盐酸与硝酸银溶液反应:hcl+agno3=agcl↓+hno340、漂白粉长期置露在空气中:ca(clo)2+h2o+co2=caco3↓+2hclo41、二氧化硫与水反应:so2+h2o≒h2so342、氮气与氧气在放电下反应:n2+o2放电2no43、一氧化氮与氧气反应:2no+o2=2no244、二氧化氮与水反应:3no2+h2o=2hno3+no45、二氧化硫与氧气在催化剂的促进作用下反应:2so2+o2催化剂2so346、三氧化硫与水反应:so3+h2o=h2so447、浓硫酸与铜反应:cu+2h2so4(淡)△cuso4+2h2o+so2↑48、浓硫酸与木炭反应:c+2h2so4(浓)△co2↑+2so2↑+2h2o49、淡硝酸与铜反应:cu+4hno3(淡)=cu(no3)2+2h2o+2no2↑50、稀硝酸与铜反应:3cu+8hno3(稀)△3cu(no3)2+4h2o+2no↑51、氨水受到热分解:nh3·h2o△nh3↑+h2o52、氨气与氯化氢反应:nh3+hcl=nh4cl53、氯化铵受到热分解:nh4cl△nh3↑+hcl↑54、碳酸氢氨受热分解:nh4hco3△nh3↑+h2o↑+co2↑55、硝酸铵与氢氧化钠反应:nh4no3+naoh△nh3↑+nano3+h2o56、氨气的实验室制取:2nh4cl+ca(oh)2△cacl2+2h2o+2nh3↑57、氯气与氢气反应:cl2+h2熄灭2hcl58、硫酸铵与氢氧化钠反应:(nh4)2so4+2naoh△2nh3↑+na2so4+2h2o59、so2+cao=caso360、so2+2naoh=na2so3+h2o61、so2+ca(oh)2=caso3↓+h2o62、so2+cl2+2h2o=2hcl+h2so463、so2+2h2s=3s+2h2o64、no、no2的回收:no2+no+2naoh=2nano2+h2o65、si+2f2=sif466、si+2naoh+h2o=na2sio3+2h2↑67、硅单质的实验室制法:细硅的制备:sio2+2c高温电炉si+2co(石英沙)(焦碳)(粗硅)粗硅转变为纯硅:si(粗)+2cl2△sicl4sicl4+2h2高温si(纯)+4hcl。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学方程式一、非金属单质(F2Cl2O2S N2P C Si H)1、氧化性:F2+H2===________________(阴暗处爆炸)F2+Xe(过量)==________________2F2(过量)+Xe==____________ (XeF4是强氧化剂,能将Mn2+氧化为MnO4–) nF2+2M===____________(M表示大部分金属)2F2+2H2O===____________ (水是还原剂)2F2+2NaOH===____________F2+2NaCl===____________F2+2NaBr===____________F2+2NaI===____________7F2(过量)+I2===___________F2+Cl2(等体积)=== ____________ (ClF属于类卤素:ClF+H2O==HF+HClO )3F2(过量)+Cl2===____________ (ClF3+3H2O==3HF+HClO3 )Cl2+H2____________ (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸) 3Cl2+2P____________Cl2+PCl3____________Cl2+2Na____________3Cl2+2Fe____________Cl2+Cu____________Cl2+2FeCl2===____________ (在水溶液中:Cl2+2Fe2+===2Fe3++3Cl-)Cl2+2NaBr===____________Cl2+2Br-=____________Cl2+2KI===____________Cl2+2I-=____________3Cl2(过量)+2KI+3H2O===____________3Cl2+I–+3H2O=____________–5Cl2+I2+6H2O===____________5Cl2+I2+6H2O=____________Cl2+Na2S===____________Cl2+S2–=____________Cl2+H2S===____________ (水溶液中:Cl2+H2S=2H++2Cl–+S↓)Cl2+SO2+2H2O===____________Cl2+SO2+2H2O=____________Cl2+H2O2===____________Cl2+H2O2=____________2O 2+3Fe ____________O 2+K===____________S+H 2____________ 2S+C ____________ S+Zn ____________S+Fe ____________ (既能由单质制取,又能由离子制取) S+2Cu ____________ (只能由单质制取,不能由离子制取) 3S+2Al ____________ (只能由单质制取,不能由离子制取)N 2+3H 2____________N 2+3Mg ____________N 2+3Ca ____________ N 2+3Ba ____________ N 2+6Na ____________ N 2+6K ____________ N 2+6Rb ____________ N 2+2Al____________P 4+6H 2____________ P+3Na ____________2P+3Zn ____________ H 2+2Li ____________ 2、还原性 S+O 2____________S+H 2SO 4(浓) ____________ S+6HNO 3(浓) ________________________S+4H ++6==________________________ 3S+4HNO 3(稀)________________________3S+4H ++43NO ________________________N 2+O 2 ____________4P+5O 2____________ (常写成P 2O 5)2P+3X 2____________(X 表示F 2,Cl 2,Br 2)PX 3+X 2 ____________ P 4+20HNO 3(浓) ________________________ C+2F 2____________C+2Cl 2____________C+O 2(足量)____________催化剂 高温高压2C+O2(少量)____________C+CO2____________C+H2O____________ (生成水煤气)2C+SiO2____________ (制得粗硅)Si(粗)+2Cl2____________ (SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2____________Si+C____________ (金刚砂)Si+2NaOH+H2O==____________________________________Si+2OH +H2O=________________________3、歧化反应Cl2+H2O==____________(加碱或光照促进歧化)Cl2+2NaOH==________________________Cl2+2Ca(OH)2==________________________3Cl2+6KOH(浓)_______________________3S+6NaOH________________________4P+3KOH(浓)+3H2O==____________________________________11P+15CuSO4+24H2O==________________________3C+CaO____________3C+SiO2____________二.金属单质(Na Mg Al Fe Cu)的还原性2Na+H2____________4Na+O2==____________ 2Na2O+O2 ____________2Na+O2____________ 2Na+S==____________(爆炸)2Na+2H2O==____________2Na+2H2O=________________________2Na+2NH3==____________2Na+2N H3=________________________4Na+TiCl4____________Mg+Cl2____________Mg+Br2____________2Mg+O2____________Mg+S____________2Cu+S____________ (Cu2S只能由单质制备)Mg+2H2O____________2Mg+TiCl4____________ Mg+2RbCl____________2Mg+CO2____________2Mg+SiO2____________Mg+H2S==____________Mg+H2SO4==____________(Mg+2H+=Mg2++H2↑)2Al+3Cl2____________4Al+3O2===____________ (常温生成致密氧化膜而钝化,在氧气中燃烧)4Al(Hg)+3O2+2xH2O===____________(铝汞齐)4Al+3MnO2____________ 2Al+Cr2O3____________ (铝热反应)2Al+Fe2O3____________2Al+3FeO____________2Al+6HCl===____________2Al+6H+=____________2Al+3H2SO4===____________2Al+6H+=____________2Al+6H2SO4(浓)=== ______________________ (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO3(稀)=== _______________________ Al+4H++NO3–=______________2Al+2NaOH+2H2O===____________________2Al+2OH–+2H2O=____________2Fe+3Br2===________3Fe+2O2 __________2Fe+O2___________ (炼钢过程)Fe+I2____________Fe+S____________ (FeS既能由单质制备,又能由离子制备)3Fe+4H2O(g)____________Fe+2HCl===____________ Fe+2H+=____________Fe+CuCl2===____________Fe+Cu2+=____________Fe+SnCl4===________________(铁在酸性环境下不能把四氯化锡完全还原为单质锡)Fe+SnCl2==____________Fe+Sn2+=______________________三.非金属氢化物(HF HCl H2O H2S NH3) 金属氢化物(NaH)1、还原性:4HCl(浓)+MnO2________________________4H++2Cl–+MnO2________________________4HCl(浓)+PbO2________________________4H++2Cl–+PbO2________________________4HCl(g)+O2____________16HCl+2KMnO4===________________________16 H++10Cl-+2MnO4–=________________________6HCl+KClO3==________________________6H++5Cl–+ClO3–=________________________14HCl+K2Cr2O7===________________________14H++6Cl–+Cr2O72–=________________________2H2O+2F2===________________________2HCl+F2=____________ (F2气与HCl、HBr、HI、H2S、NH3气体不能共存)2HBr+Cl2=____________ (Cl2气与HBr、HI、H2S、NH3气体不能共存)2H2S+3O2(足量)____________ 2H2S+O2(少量)____________2H2S+SO2===____________H2S+H2SO4(浓)=== ____________________3H2S+2HNO3(稀)=== ____________3H2S+2H++2NO3–===_______________________5H 2S+2KMnO 4+3H 2SO 4===______________________5H 2S+2MnO 4–+6H +===_______________________ 3H 2S+K 2Cr 2O 7+4H 2SO 4===________________________3H 2S+Cr 2O 72–+8H +===_______________________ H 2S+4Na 2O 2+2H 2O===_______________________H 2S+4Na 2O 2+2H 2O===_______________________ 2NH 3+3CuO_______________________2NH 3+3Cl 2===_______________________ 8NH 3+3Cl 2===_______________________ NH 3+NaNO 2+HCl==_______________________NH 3+NO 2–+H +=_______________________ 4NH 3+3O 2(纯氧)____________4NH 3+5O 2________________4NH 3+6NO===_______________________ (用氨清除NO) NaH+H 2O===_______________________ (生氢剂)NaH+H 2O=_______________________ 4NaH+TiCl 4_____________CaH 2+2H 2O=_______________________2、酸性:4HF+SiO 2===________________(可测定矿样或钢样中SiO 2的含量,玻璃雕刻) 4HF+Si===_______________________2HF+CaCl 2===_________ H 2S+Fe===_______________________ H 2S+CuCl 2===_______________________ (弱酸制强酸的典型反应)H 2S+Cu 2+=_______________________ H 2S+2AgNO 3===_______________________H 2S+2Ag +=_______________________H 2S+HgCl 2===_______________________H 2S+Hg 2+=_______________________H 2S+Pb(NO 3)2===_______________________ (铅试纸检验空气中H 2S)H 2S+Pb 2+=_______________________H 2S+2Ag===_______________________ (银器在空气中变黑的原因)2NH 3(液)+2Na==_______________________ (NaNH 2+H 2O===NaOH+NH 3↑) 3、NH 3的碱性:NH 3+HX===_______________________ (X :F 、Cl 、Br 、I 、S) NH 3+HNO 3===___________ NH 3+H +=_____________ 2NH 3+H 2SO 4===_______________________ NH 3+H +=___________NH 3+NaCl+H 2O+CO 2===_____________(侯德榜制碱:用于工业制备小苏打,苏打) NH 3+H 2S==_________ NH 3+H 2S=_______________________ 4、不稳定性: 2HF________________2HCl_____________ 2H 2O_______ 2H 2O 2===____________ H 2S____________2NH 3____________2HI____________催化剂△催化剂四.非金属氧化物(SO 3、SO 2、N 2O 、NO 、N 2O 3、NO 2、N 2O 4、N 2O 5、CO 、CO 2、SiO 2、P 2O 3、P 2O 5、Cl 2O 、Cl 2O 3、Cl 2O 5、Cl 2O 7、ClO 2)1、低价态的还原性:(SO2、CO 、NO)2SO 2+O 2+2H 2O===____________(这是SO 2在大气中缓慢发生的环境化学反应) 2SO 2+O 2____________ SO 2+NO 2=== ____________SO 2+Cl 2+2H 2O===___________ Cl 2+SO 2+2H 2O=____________ SO 2+Br 2+2H 2O===____________ Br 2+SO 2+2H 2O===_________________ SO 2+I 2+2H 2O===____________ I 2+SO 2+2H 2O=____________ 2NO+O 2===____________NO+NO 2+2NaOH===____________(用于制硝酸工业中吸收尾气中的NO 和NO 2)NO+NO 2+2OH –=____________ 2CO+O 2____________CO+CuO____________ 3CO+Fe 2O 3____________ CO+H 2O____________2、氧化性:SO 2+2H 2S===____________ SO 3+2KI____________NO 2+2KI+H 2O===____________(不能用淀粉KI 溶液鉴别溴蒸气和NO 2) 4NO 2+H 2S===____________ 2NO 2+Cu ____________N 2O+Zn____________CO 2+2Mg ____________ (CO 2不能用于扑灭由Mg,Ca,Ba,Na,K 等燃烧的火灾) SiO 2+2H 2____________ S iO 2+2Mg____________3、与水的作用:SO 2+H 2O===____________SO 3+H 2O===____________ SO 3+H 2O=____________ 3NO 2+H 2O===____________ (NO 2不是硝酸的酸酐) N 2O 5+H 2O===____________ N 2O 5+H 2O=____________ P 2O 5+H 2O(冷水)=== ____________P 2O 5+3H 2O(热水)=== ____________ (P 2O5极易吸水,可作气体干燥剂) P 2O 5+3H 2SO 4(浓)=== ____________ CO 2+H 2O===____________ Cl 2O+H 2O==____________Cl 2O 7+H 2O==____________ Cl 2O 7+H 2O=____________ 4、与碱性物质的作用:SO 2+2NH 3+H 2O===____________SO 2+(NH 4)2SO 3+H 2O===____________催化剂 加热催化剂 加热2NH4HSO3+H2SO4===_______________ (硫酸工业尾气处理先用氨水吸收,再用H2SO4) SO2+Ca(OH)2===____________ (不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别) SO3+MgO===____________SO3+Ca(OH)2===____________CO2+NH3+H2O===____________CO2+2NH3(过量)+H2O===____________(NH4)2CO3_______________CO2+2NH3____________ (工业制取尿素)CO2+2NaOH(过量)== ____________ 2OH-+CO2=____________CO2(过量)+NaOH==____________ OH-+CO2=____________CO2+Ca(OH)2(过量)== ____________Ca2++2OH+CO2=____________2CO2(过量)+Ca(OH)2==____________OH―+CO2=____________CO2+CaCO3+H2O==____________CO2+CaCO3+H2O=____________CO2(不足)+2NaAlO2+3H2O===____________CO2+3H2O+AlO2–=____________CO2(足)+NaAlO2+2H2O===____________CO2+2H2O+AlO2–=____________CO2+C6H5ONa+H2O===____________CO2+C6H5O―+H2O=____________SiO2+CaO__________________ (炼钢造渣)SiO2+2NaOH===__________________ (常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3_________________ (制取玻璃)SiO2+CaCO3__________________ (制取玻璃)2NO2+2NaOH===__________________2NO2+2OH―===__________________NO+NO2+2NaOH===__________________ (制取硝酸工业尾气吸收)NO+NO2+2OH―===__________________五.金属氧化物1、低价态的还原性:△6FeO+O 2__________________FeO+4HNO 3===________________________FeO+4H++NO3―=________________________2、氧化性:Na2O2+2Na____________(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.一般通过电解制Mg和Al.Fe2O3+3H2__________________ (制还原铁粉)Fe3O4+4H2__________________CuO+H2__________________2Fe3O4+16HI==__________________2Fe3O4+16H++4I―=__________________Fe2O3+Fe __________________ (炼钢过程中加入废钢作氧化剂)FeO+C__________________ (高温炼钢调节C含量)2FeO+Si__________________ (高温炼钢调节Si含量)3、与水的作用:Na2O+H2O==__________________Na2O+H2O=__________________2Na2O2+2H2O===__________________2Na2O2+2H2O=__________________(此反应分两步:Na2O2+2H2O===_______________;2H2O2===________________ H2O2的制备可利用类似的反应:BaO2+H2SO4(稀)=== ________________________)MgO+H2O===________________________ (缓慢反应)4、与酸性物质的作用:Na2O+SO3==____________Na2O+CO2==____________MgO+SO3===______________Na2O+2HCl==__________________Na2O+2H+=__________________2Na2O2+2CO2==__________________Na2O2+H2SO4(冷,稀)=== ________________________MgO+H2SO4===__________________MgO+2H+=__________________Al2O3+3H2SO4===__________________Al2O3+6H+=__________________Al2O3+2NaOH===__________________(Al2O3两性氧化物)Al2O3+2OH―=__________________FeO+2HCl===__________________FeO+2H+=__________________Fe2O3+6HCl===__________________Fe2O3+6H+=__________________Fe3O4+8HCl===________________________Fe3O4+8H+=________________________六.含氧酸1、氧化性:4HClO3+3H2S===________________________ClO3–+3H2S=____________HClO3+HI===__________________ClO3–+I–=__________________3HClO+HI===__________________3HClO+I-=________________________HClO+H2SO3===__________________HClO+H2SO3=________________________HClO+H2O2===__________________HClO+H2O2=__________________(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)2H2SO4(浓)+C____________2H2SO4(浓)+S____________H2SO4+Fe(Al)室温下钝化6H2SO4(浓)+2Fe________________________ 2H2SO4(浓)+Cu__________________H2SO4(浓)+2HBr===___________________ (不能用浓硫酸与NaBr制取HBr) H2SO4(浓)+2HI===__________________ (不能用浓硫酸与NaI制取HI)H2SO4(稀)+Fe===__________________2H++Fe=________________________H2SO3+2H2S===__________________4HNO3(浓)+C↑________________________6HNO3(浓)+S________________________5HNO3(浓)+P________________________5HNO3(稀)+3P+2H2O________________________5H++5NO3-+3P+2H2O____________6HNO3(浓足)+Fe===________________________4HNO3(浓)+Fe(足)=== _______________(先得Fe3+,在Fe过量时再生成Fe2+的盐) 4HNO3(稀足)+Fe===________________________4H++NO3-+Fe=________________________30HNO3+8Fe===________________________30 H++6NO3–+8Fe=________________________36HNO3+10Fe===________________________36H++6NO3–+10Fe===________________________30HNO3+8Fe===________________________30 H++3NO3–+8Fe===________________________4Zn+10HNO3(稀)== ________________________4Zn+10H++2NO3–===________________________4Zn+10HNO3(稀)== ________________________4Zn+10H++NO3–=________________________2、还原性:H2SO3+X2+H2O===__________________ (X表示Cl2,Br2,I2)H2SO3+X2+H2O=________________________2H2SO3+O2==__________________2H2SO3+O2=__________________H2SO3+H2O2===________________________H2SO3+H2O2=________________________5H2SO3+2KMnO4===________________________5H2SO3+2MnO4–=________________________H2SO3+2FeCl3+H2O===________________________H2SO3+2Fe3++H2O=________________________3、酸性:H2SO4(浓)+CaF2 __________________ (不挥发性酸制取挥发性酸)H2SO4(浓)+NaCl__________________(不挥发性酸制取挥发性酸)H2SO4(浓)+2NaCl______________________(不挥发性酸制取挥发性酸)H2SO4(浓)+NaNO3__________________(不挥发性酸制取挥发性酸)3H2SO4(浓)+Ca3(PO4)2__________________ (强酸制弱酸酸)2H2SO4(浓)+Ca3(PO4)2__________________(工业制磷肥)3HNO3+Ag3PO4==__________________3H++Ag3PO4=________________________2HNO3+CaCO3==________________________2H++CaCO3=________________________(用HNO3和浓H2SO4不能制备H2S,HI,HBr,SO2等还原性气体)4H3PO4+Ca3(PO4)2 __________________(重钙)H3PO4(浓)+NaBr _______________ (不挥发性酸制取挥发性酸,磷酸是非氧化性酸) H3PO4(浓)+NaI__________________4、不稳定性:2HClO__________________ (保存在棕色瓶中)4HNO3__________________ (保存在棕色瓶中)H2SO3__________________ (在加热或酸性条件下分解)H2CO3__________________ (在加热或酸性条件下分解)H4SiO4__________________ H2SiO3 __________________H2S2O3(在加热或酸性条件下分解)七.碱1、低价态的还原性:4Fe(OH)2+O2+2H2O===________________________2、与酸性物质的作用:2NaOH+SO2(少量)== ________________________OH–+SO2=________________________NaOH+SO2(足)== ________________________OH-+SO2(足)= ________________________2NaOH+SiO2==________________________OH-+SiO2=________________________2NaOH+Al2O3==________________________2OH-+Al2O3=________________________2KOH+Cl2==________________________Cl2+2OH–=________________________NaOH+HCl==________________________H++OH =________________________NaOH+H2S(足)== ________________________OH–+H2S=________________________2NaOH+H2S(少量)== ________________________2OH–+H2S=________________________3NaOH+AlCl3==________________________3OH–+Al3+=________________________NaOH+Al(OH)3==________________________ (AlCl3和Al(OH)3哪个酸性强?)OH–+Al(OH)3=________________________Ca(OH)2+2NH4Cl________________________ (实验室制NH3)NaOH+NH4Cl________________________Mg(OH)2+2NH4Cl==________________________ (Al(OH)3+NH4Cl不溶解)Ba(OH)2+H2SO4==________________________2H++2OH–+Ba2++SO42–=______________________________3、不稳定性:Mg(OH)2____________2Al(OH)3____________2Fe(OH)3___________Cu(OH)2____________2AgOH==____________八.盐1、氧化性:(在水溶液中)2FeCl3+Fe==______________ 2Fe3++Fe=__________________2FeCl3+Cu===____________ (用于雕刻铜线路版) 2Fe3++Cu=__________________ 2FeCl3+Zn(少量)=== ____________2Fe3++Zn=__________________FeCl3+Ag===____________2Fe3++Cl-+2Ag=_______________Fe2(SO4)3+2Ag===__________________(较难反应) Fe(NO3)3+Ag不反应2FeCl3+H2S===__________________2Fe3++H2S=__________________2FeCl3+2KI===__________________ 2Fe3++2I-=__________________FeCl2+Mg===__________________Fe2++Mg=__________________NaNO2+NH4Cl==__________________ (实验室制氮气)NH4++NO2-=______________ 2、还原性:2FeCl2+3Cl2===____________ (在水溶液中不需加热)2Fe2++3Cl2=__________________3Na2S+8HNO3(稀)=== ________________________3S2-+8H++2NO3-=________________________3Na2SO3+2HNO3(稀)=== ________________________3SO32-+2H++2NO3-=________________________2Na2SO3+O2===__________________ (Na2SO3在空气中易变质)Na2SO3+S________________________Na2S+Cl2==______________________ (在水溶液中) S2-+Cl2=__________________ 3、与碱性物质的作用:Ca(OH)2+CuSO4==________________(波尔多液)MgCl2+2NH3·H2O==________________________Mg2++2NH3·H2O=________________________AlCl3+3NH3·H2O===________________________Al3++3NH3·H2O=________________________FeCl3+3NH3·H2O===________________________Fe3++3NH3·H2O=________________________CuSO4+2NH3·H2O(不足)== ________________________Cu2++2NH3·H2O=________________________Cu(OH)2+4NH3·H2O=________________________Cu(OH)2+4NH3·H2O=________________________ 铜氨溶液CuSO4+4NH3·H2O(足)== __________________总方程式Cu2++4NH3·H2O=________________________铜氨溶液AgNO3+NH3·H2O==__________________2AgOH=__________________ Ag2O+4NH3·H2O=________________________银氨溶液AgNO3+2NH3·H2O==________________________Ag++2NH3·H2O=________________________ 总方程式ZnSO4+2NH3·H2O(不足)== ________________________Zn2++2NH3·H2O=________________________Zn(OH)2+4NH3·H2O=________________________ZnSO4+4NH3·H2O(足)== ________________________Zn2++4NH3·H2O=________________________总方程式4、与酸性物质的作用:强酸制弱酸,或不挥发性酸制挥发性酸Na3PO4+2HCl===__________________PO43-+2H+=__________________Na2HPO4+HCl===__________________ HPO42-+H+=__________________NaH2PO4+HCl===__________________H2PO4-+H+=__________________Na2CO3+HCl===__________________CO32-+H+=__________________NaHCO3+HCl===__________________HCO3-+H+=__________________3Na2CO3+2AlCl3+3H2O==______________________(物质之间的双水解反应) 3CO32-+2Al3++3H2O=________________________3Na2CO3+2FeCl3+3H2O===__________________ (物质之间的双水解反应) 3CO32-+2Fe3++3H2O=________________________3NaHCO3+AlCl3===________________________(物质之间的双水解反应) 3HCO3-+Al3+=________________________3NaHCO3+FeCl3===________________________(物质之间的双水解反应) 3HCO3-+Fe3+=________________________3Na2S+Al2(SO4)3+6H2O===________________________(物质之间的双水解反应) 3S2-+2Al3++3H2O=________________________3NaAlO2+AlCl3+6H2O==________________________(物质之间的双水解反应) 3AlO2-+Al3++6H2O=________________________3NaAlO2+FeCl3+6H2O==________________________3AlO2-+Fe3++6H2O=________________________NaAlO2+NH4Cl+2H2O==________________________AlO2-+NH4++2H2O=________________________Na2CO3+H2O+CO2===________________________CO32-+H2O+CO2=________________________Na2CO3+H2O+2SO2==________________________(1:2)CO32-+H2O+2SO2=________________________2Na2CO3(足)+H2O+SO2==__________________ (CO2中的SO2不能用Na2CO3洗气) 2CO32-+H2O+SO2=__________________(2:1)Na2CO3+SO2==________________________(1:1)CO32-+SO2=________________________Na H CO3+SO2===__________________ (CO2中的SO2可能用NaHCO3洗气) 2HCO3-+SO2=________________________2Na H CO3+SO2==________________________2HCO3-+SO2=________________________Na2SiO3+2HCl===________________或Na2SiO3+2HCl+H2O===_________________ SiO32-+2H+=________________或SiO32-+2H++H2O=__________________Na2SiO3+CO2+2H2O===__________________SiO32-+CO2+2H2O=__________________5、盐与盐复分解反应Na2SO4+BaCl2==________________________ (沉淀不溶于盐酸、硝酸)SO32-+Ba2+=________________________Na2SO3+BaCl2==______________ (沉淀溶于盐酸,在硝酸中生成新的沉淀,沉淀不消失) SO32-+Ba2+=________________________Na2CO3+BaCl2==________________________ (沉淀溶于盐酸、沉淀消失)CO32-+Ba2+=________________________Na2CO3+CaCl2==________________________ (NaHCO3不反应)CO32-+Ca2+=________________________AgNO3+NaCl==________________ Ag++Cl-=____________AgNO3+NaBr==_________________ Ag++Br-=____________AgNO3+KI==__________________ Ag++I-=____________3AgNO3+Na3PO4==__________________3Ag++PO43-=____________CuSO4+Na2S==__________________Cu2++S2-=____________FeCl3+3KSCN==__________________Fe3++3SCN-=__________________ (血红色,用于Fe3+的特性检验)6、不稳定性:Na2S2O3+H2SO4===________________________S2O32-+2H+=________________________NH4Cl__________________NH4I__________________2HI____________NH4I__________________NH4HCO3__________________2KNO3__________________2Cu(NO3)3__________________2AgNO3__________________ (保存在棕色瓶中)5NH4NO3__________________10NH4NO3________________________ (硝酸铵爆炸反应)2KMnO4________________________2KClO3__________________2NaHCO3________________________Ca(HCO3)2__________________CaCO3__________________MgCO3__________________九、电离方程式1.酸的电离(H2SO4、HNO3、HCl、HBr、HI、H3PO4、HF、H2SO3、CH3COOH、H2CO3、H2S、HNO2、C6H5OH、HCN、HClO)H2SO4==__________________或:H2SO4+2H2O==__________________HNO3==_________________或:HNO3+H2O==__________________ (以下雷同) HCl==__________________HBr==__________________HI==__________________H3PO4____________H2PO-4__________ HPO-24____________HF____________H2SO3____________HSO-3____________CH3COOH____________H2CO3____________ -3HCO____________H2S____________-HS____________HNO2____________C6H5OH____________ (苯酚不是酸,显酸性)HCN____________HClO____________H2O____________2H2O____________2、碱的电离(NaOH、KOH、Ba(OH)2、Mg(OH)2、Al(OH)3、NH3·H2O)NaOH==____________KOH==____________Ba(OH)2==____________Mg(OH)2____________Al(OH)3____________酸式电离:Al(OH)3____________NH3·H2O____________Ca(OH)2==____________ (澄清石灰水)Ca(OH)2____________ (石灰悬浊液)3、盐的电离(NaCl、Na2SO4、NaHSO4、Na2SO3、NaHSO3、MgSO4、CaSO4、Al2(SO4)3、CuSO4、AlCl3、AgNO3、CH3COONa、NH4NO3、FeCl3、Na2CO3、NaHCO3、Na2S、NaHS、NaH2PO4、Na2HPO4、Na3PO4、KI、NaBr、NaClO、AgCl、CaCO3)NaCl==____________Na2SO4==____________NaHSO4==____________Na2SO3==____________NaHSO3==____________ (错误书写:NaHSO3==Na++H++SO42-)MgSO4==____________Al2(SO4)3==____________CuSO4==____________AlCl3==____________AgNO3==__________CH3COONa==____________NH4NO3==____________FeCl3==____________Na2CO3==____________NaHCO3==____________ (错误书写:NaHCO3==Na++H++-2CO)3Na2S==____________NaHS==____________ (错误书写:NaHS==Na++H+-2S)NaH2PO4==____________Na2HPO4==____________ (错误书写:Na2HPO4==2Na++H++PO-3)4Na3PO4==____________KI==____________NaBr==____________NaClO==____________AgCl____________ (难溶、微溶物质在水中发生微弱电离)CaCO3____________ (错误书写:CaCO3==Ca2++CO-2)3)CaSO4____________ (错误书写:CaSO4==Ca2++SO-243、熔融电离NaCl____________MgCl2____________Na2O____________Al2O3____________十、水解反应1、单水解---可逆水解NH4Cl+H2O____________NH4++H2O____________FeCl3+3H2O____________ Fe3++3H2O____________AlCl3+3H2O____________Al3++3H2O____________CuSO4+2H2O____________ (金属活动顺序表中Mg2+以后的阳离子均水解) NaHCO3+H2O____________ (NaHSO4不水解,NaHSO3电离大于水解)Na2CO3+H2O____________ CO32-+H2O____________NaHCO3+H2O____________ (第一步远远大于第二步,二步不能叠加)Na2SO3+H2O____________SO32-+H2O____________NaHSO3+H2O____________ (第一步远远大于第二步,二步不能叠加)HSO3-+H2O____________Na2S+H2O____________S2-+H2O____________NaHS+H2O____________ (第一步远远大于第二步,二步不能叠加)HS-+H2O____________Na3PO4+H2O________________PO43-+H2O________________Na2HPO4+H2O________________HPO42-+H2O________________ NaH2PO4+H2O________________ H2PO4-+H2O________________ CH3COONa+H2O________________ CH3COO-+H2O________________ C6H5ONa+H2O________________C6H5O-+H2O________________ 2、双水解CH3COONH4+H2O________________NH4F+H2O________________Al2S3+6H2O==________________ (隔绝空气,密封保存)Mg3N2+6H2O==________________ (隔绝空气,密封保存)Na3P+3H2O==________________ (隔绝空气,密封保存)Zn3P2+6H2O==________________ (Zn3P2一种老鼠药,PH3剧毒神经毒剂)CaC2+2H2O==________________ (隔绝空气,密封保存)C2H5ONa+H2O==________________十一、电解及电极方程式1、电解质溶液在惰性电极条件下,或阴极是较活泼金属电极,阳极是惰性电极条件下的电解2NaCl+2H2O____________(-)2H2O+2e-==____________ 或2H++2e-===____________(+)2Cl--2e-==____________2Cl-+2H2O____________CuCl2____________(-)Cu2++2e-==____________(+)2Cl- -2e-==____________Cu2++2Cl-____________2CuSO4+2H2O____________(-)2Cu2+ + 4e-==____________(+)2H2O - 4e-==____ ___或:4OH--4e-==______ 4H2O____________2Cu2++2H2O ____________2H2O____________(-) 4H++4e-==____________(+)4OH--4e-==____________中性电解4H2O____________-2H2O____________酸性水解:(-) 4H++4e-==____________(+)2H2O-4e-==____________4OH--4e-==____________2H2O____________碱性水解:(-) 4H2O+4e-==____________ 或:4H++4e-==____________(+)4OH--4e-==____________2H2O____________2、电镀:镀件作阴极,被镀金属作阳极,被镀金属的含氧酸盐作电解质溶液镀铜:CuSO4电镀液镀件(-) Cu2++2e-==________________纯铜(+) Cu–2e-==________________镀锌:ZnSO4电镀液镀件(-) Zn2++2e-==________________纯锌(+) Zn–2e-==________________镀银:AgNO3电镀液镀件(-) Ag++e-==________________纯银(+) Ag–e-==________________镀镍:NiSO4电镀液镀件(-) Ni2++2e-==________________纯镍(+) Ni–2e-==________________3、熔融状态下的电解:2NaCl(熔融)________________(-)2Na++2e-==________________(+)2Cl--4e-==________________2Na++2Cl-(熔融)________________2Al2O3(熔融)________________(-)4Al3++12e–==________________(+)6O2--12e-==________________4Al3+ +6O2-________________NaHF2(熔融)________________(-)2H++2e–==________________(+)2F--2e-==________________2HF________________十二、原电池反应X—Y(电解质溶液) 或X//电解质溶液//YZn极(-) Zn–2e-==________________ (氧化反应)Cu极(+) 2H++2e-==________________ (还原反应)离子方程式Zn+2H+==________________化学方程式Zn+H2SO4=________________Fe极(-) Fe–2e-==________________ (氧化反应)C极(+) 2H++2e-==________________ (还原反应)离子方程式Fe+2H+==________________ (析氢腐蚀)Fe极(-) 2Fe–4e-==________________ (氧化反应)C极(+) O2+2H2O+4e-==________________ (还原反应)化学方程式2Fe+O2+2H2O==________________ (吸氧腐蚀)4Fe(OH)2+O2+2H2O==________________铁锈的生成过程)Al极(-) 4Al–12e==________________(氧化反应)Ni极(+)3O2+6H2O+12e-==________________(还原反应)化学方程式4Al+3O(海洋灯标电池)Cl+H2O==________________________4Zn极(-) Zn–2e==____________________ (氧化反应)Cu极(+) 2MnO2+2H++2e-==________________(还原反应)化学方程式Zn+2NH4Cl+2MnO2=____________________Pb极(-) Pb+H2SO4–2e-==________________ (氧化反应)PbO2极(+)PbO2+H2SO4+2H++2e-==____________ (还原反应)化学方程式Pb+PbO2+2H2SO4==____________________Pb—PbO2(浓硫酸)充电Pb极(-) PbSO4+2H+–2e-== ________________ (还原反应)PbO2极(+)PbSO4+2H2O+2e-==________________ (氧化反应)化学方程式2PbSO4+2H2O==____________________(-) Li–e==_______________(氧化反应)(+) MnO2+Li++e-==________________(还原反应)化学方程式Li+MnO2==LiMnO2Zn极(-) Zn+2OH––2e-==________________ (氧化反应)Cu极(+) Ag2O+H2O+2e-==________________(还原反应)化学方程式Zn+Ag2O ==________________Pt极(-) 2H2+4-OH–4e-==______________ (氧化反应)Pt极(+) O2+2H2O+4e-==________________(还原反应)化学方程式2H2+O2==____________________Pt极(-) CH4+10-OH–8e-==________________ (氧化反应)Pt极(+) 2O2+4H2O+8e-==________________(还原反应)化学方程式CH4+2O2+2NaOH==____________________十三、其他方程式2、Al4C3+12H2O=___________________________ (碳化物氮化物的水解)3、3K2MnO4+2CO2=________________________4、AgNO3+NaCl=________________________2AgCl=________________________ (见光或受热)5、2Br2+3Na2CO3+H2O=________________________Br2+NaHCO3=________________________6、2FeCl3+SO2+2H2O=________________________BaCl2+H2SO4=________________________7、Ca(H2PO4)2+2Ca(OH)2=________________________8、4KO2+2CO2=________________________9、SOCl2+H2O=________________________10、HIO+HCl=________________________HIO+NaOH=________________________11、NH2Cl+H2O=________________________12、Cu2(OH)2CO3+4CH3COOH=________________________(CH3COO)2Cu+Fe=________________________14、3BrF3+5H2O=________________________15、As2O3+6Zn+12HCl=________________________16、3As2S3+28HNO3+4H2O=________________________17、Na2SO3+SO2+H2O=_______________△2NaHSO3________________________18、P2O5+2NaOH=________________________P2O5+6NaOH=________________________19、3Na2S+As2S5=__________________Na2S+SnS2=________________________20、(CN)2+2H2S→________________________21、(SCN)2+2NaOH=________________________22、HCl+KOH=____________________2HI+PbO=________________________29、2S2―+SO32―+6H+=________________________30、SiO32―+2NH4+=________________________31、3H2O2+2CrO2―+2OH―=________________________32、Al3++2SO42―+2Ba2++4OH―=________________________33、Fe2O3+6H++2I―=________________________34、Al3++3HCO3―=________________________35、2H++[Ag(NH3)2]+=________________________36、HS―+OH―=________________________37、AsO43―+2I―+2H+=________________________38、Cr2O72―+6Fe2++14H+=________________________。
