(完整版)高中化学方程式书写练习
人教版高中化学必修1化学方程式书写练习试题

高一化学寒假作业15(方程式书写练习)1.钠在空气中氧化:2.钠在空气中点燃:3.钠与水反应:4.钠与硫酸铜溶液反应:5.钠与盐酸反应:6.铝丝与硫酸铜溶液反应:7.镁条在空气中燃烧:8.铜丝与硝酸银溶液反应:9.镁条与稀硫酸反应:10.镁条与水的反应:11.铝箔在空气中加热熔化:12.还原铁粉与水蒸气共热:13.Na与氯化铁溶液反应:14.Al与氢氧化钠溶液反应:15.铝与盐酸反应:16.CaO溶于水:17.Na2O溶于水:18. Na2O溶于盐酸:19. Na2O2溶于水:20. 向Na2O2粉末中吹CO2:21.Na2CO3溶于盐酸:22.向Na2CO3(aq)滴加少量盐酸:23.NaHCO3溶于稀盐酸:24. NaHCO3溶于NaOH(aq):25.加热NaHCO3粉末:26.Al2O3溶于稀盐酸:27.Al2O3溶于NaOH(aq):28.Al2(SO4)3(aq)中加氨水:29.Al(OH)3溶于稀硫酸:30.Al(OH)3溶于KOH(aq):31.加热Al(OH)3:32.AlCl3(aq)中加少量NaOH(aq):33. 少量AlCl3(aq)加到NaOH(aq)中:34.NaAlO2(aq)中加少量盐酸:35. 少量NaAlO2(aq)加到盐酸中:36.FeO在空气中加热:37.FeO溶于稀硫酸:38.Fe2O3溶于稀盐酸:39.FeSO4(aq)中加入NaOH(aq):40.FeCl3(aq)中加入NaOH(aq):41.FeSO4(aq)中加入氨水:42.FeCl3(aq)中加入氨水:43.Fe(OH)2露置于空气中:44.Fe(OH)2溶于稀硫酸:45.Fe(OH)3溶于稀盐酸:46.Na与硫粉研磨:47.Al粉与硫粉共热:48.铁粉与硫粉混合加热:49.碳酸钠粉末遇水生成十水碳酸钠:50.通过量的CO2到NaAlO2(aq)中:51.加热Fe(OH)3:52.FeCl3(aq)中滴加KSCN(aq):53. FeCl3(aq)加铁粉:54. FeCl2(aq)中滴加氯水(Cl2):55. FeCl2(aq)(含HCl)中滴加双氧水:56.饱和氯化铁溶液滴加到沸水中:57.饱和氯化铁溶液腐蚀印刷电路板上多余的铜:58.《淮南万毕术》中有“曾青(CuSO4)得铁则化为铜”:59.通H2S到FeCl3(aq)中出现淡黄色浑浊(S):60.Fe2O3溶于HI(aq)(酸性强于盐酸):高一化学寒假作业16(方程式书写练习)61.若Fe3O4溶于稀盐酸:62.向NaOH(aq)中通少量的CO2:63.向NaOH(aq)中通过量的CO2:64.向明矾溶液中加少量的Ba(OH)2(aq):65.向明矾溶液中加足量的Ba(OH)2(aq):66.还原铁粉与I2粉混合(滴水生烟):67.Fe2O3与铝粉共热(铝热反应):68. Fe3O4与H2高温加热:69.Fe2O3与CO高温加热(炼铁):70.FeCl3(aq)与KI(aq)反应生成I2等:71.FeSO4(aq)使硫酸酸化的KMnO4溶液褪色:72. Cu→CuO:73. CuO→Cu:74. CuO→CuSO4:75. CuSO4→Cu(OH)2:76. Cu(OH)2→CuO:77. Cu(OH)2→CuCl2:78.铜在潮湿的空气中生锈(铜绿):79.Cu2O(红色)溶于稀硫酸生成Cu和CuSO4:80.二氧化硅与CaO高温加热:81.SiO2与NaOH(aq)反应:82. SiO2与氢氟酸反应:83. SiO2与纯碱高温加热:84. SiO2与石灰石高温加热:85.碳与SiO2高温加热制单质硅:86.CO2与C高温加热:87.硅与碳高温化合生成金刚砂:88. 碳与SiO2高温加热制金刚砂:89. 硅与Cl2加热生成四氯化硅:90. 硅与NaOH(aq)反应置换出H2:91. SiCl4(或SiHCl3)用H2在高温下还原制得纯硅:92.钠在氯气中燃烧:93.铁在氯气中燃烧:94.Cu在氯气中燃烧:95.H2在氯气中燃烧(或混合光照):96.MnO2与浓盐酸共热制氯气:97.氯气溶于水:98.次氯酸光照分解:99.实验室制氯气的尾气用NaOH(aq)吸收:100.工业上在消石灰(固)中通氯气以制漂白粉:101. 漂白粉溶于水吸收CO2以漂白:102.氯气与浓的KOH共热可得KClO3:103.漂白粉遇浓盐酸会产生氯气:104.经氯气消毒的自来水加AgNO3(aq)有白色沉淀:105.Na2CO3(aq)加AgNO3(aq):106.前105反应后加稀硝酸:107.KMnO4遇浓盐酸产生氯气:108. KClO3与KCl混合物溶于稀硫酸有氯气产生:109. 新制氯水滴加到无色的NaBr(aq)中呈现黄色:110.氯水遇KI-淀粉试纸变蓝:111. 向溴水中滴加足量的KI(aq):112.淡黄绿色的氟气与H2O剧烈反应生成O2:。
高中化学方程式书写练习 附答案

高中化学方程式书写练习(附答案)1. 氢气与氧气反应生成水:2H2 + O2 → 2H2O2. 氧气与铁反应生成铁(III)氧化物:4Fe + 3O2 → 2Fe2O33. 氧化铝与铁反应生成铁铝合金:2Al2O3 + 3Fe → 3FeAl4. 氯气与钠反应生成氯化钠:2Na + Cl2 → 2NaCl5. 硫酸和钠氢氧化物反应生成氯化钠和水:H2SO4 + 2NaOH → Na2SO4 + 2H2O6. 硫酸和铜反应生成硫酸铜:H2SO4 + Cu → CuSO4 + H27. 碳酸钙分解成氧气和二氧化碳:CaCO3 → CaO + CO28. 硝酸和银反应生成硝酸银和氢氧化银:HNO3 + Ag → AgNO3 + H2O9. 氢氧化钠和盐酸反应生成氯化钠和水:NaOH + HCl → NaCl + H2O10. 氢氧化铝和盐酸反应生成氯化铝和水:Al(OH)3 + 3HCl → AlCl3 + 3H2O11. 氧化铁和硫酸反应生成硫酸铁和水:Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O12. 氧化铜和硝酸反应生成硝酸铜和氧气:2CuO + 4HNO3 → 2Cu(NO3)2 + 2H2O + O213. 氢氧化钾和硫酸反应生成硫酸钾和水:2KOH + H2SO4 → K2SO4 + 2H2O14. 氧化钠和水反应生成氢氧化钠:Na2O + H2O → 2NaOH15. 氧化镁和盐酸反应生成氯化镁和水:MgO + 2HCl → MgCl2 + H2O16. 碳和氧气反应生成二氧化碳:C + O2 → CO217. 硫和氧气反应生成二氧化硫:S + O2 → SO218. 氢和氧气反应生成水:2H2 + O2 → 2H2O19. 氧化铁和氢氧化钠反应生成氢氧化铁:Fe2O3 + 6NaOH → 2Fe(OH)3 +20. 氧化铜和氢氧化铵反应生成铜氢氧化物:CuO + 2NH4OH → Cu(OH)2 + 2NH321. 氢氧化铜和盐酸反应生成氯化铜和水:Cu(OH)2 + 2HCl → CuCl2 + 2H2O22. 二氧化硫和水反应生成亚硫酸和氧气:SO2 + H2O → H2SO3 + O223. 氧化铁和氢氧化钾反应生成氢氧化铁:Fe2O3 + 6KOH → 2Fe(OH)3 + 3K2O24. 氮和氢气反应生成氨:N2 + 3H2 → 2NH325. 硝酸和氢氧化钾反应生成硝酸钾和水:HNO3 + KOH → KNO3 + H2O26. 氧化钠和盐酸反应生成氯化钠和水:Na2O + 2HCl → 2NaCl + H2O27. 氧化铝和盐酸反应生成氯化铝和水:Al2O3 + 6HCl → 2AlCl3 + 3H2O28. 氢氧化钾和硝酸反应生成硝酸钾和水:KOH + HNO3 → KNO3 + H2O29. 氧化铁和氢氧化钠反应生成氢氧化铁:Fe2O3 + 6NaOH → 2Fe(OH)3 + 3Na2O30. 氢氧化钾和氯化铁反应生成氯化钾和氢氧化铁:KOH + FeCl3 → KCl + Fe(OH)331. 氧化钙和水反应生成氢氧化钙:CaO + H2O → Ca(OH)232. 氢氧化铜和硝酸反应生成硝酸铜和氢氧化铜:Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O33. 氯气和氢气反应生成氯化氢:H2 + Cl2 → 2HCl34. 氧化铝和氢氧化铵反应生成铝氢氧化物:Al2O3 + 6NH4OH → 2Al(OH)3 + 3(NH4)2O35. 氢氧化铝和硝酸反应生成硝酸铝和氢氧化铝:Al(OH)3 + 3HNO3 → Al(NO3)336. 氢氧化钠和硫酸铝反应生成硫酸钠和氢氧化铝:2NaOH + Al2(SO4)3 → 2NaAl(OH)4 + 3H2SO437. 氧化铁和氢氧化铵反应生成铁氢氧化物:Fe2O3 + 6NH4OH → 2Fe(OH)3 + 3(NH4)2O38. 氢氧化钾和硫酸反应生成硫酸钾和水:2KOH + H2SO4 → K2SO4 + 2H2O39. 氧化亚铁和氯气反应生成氯化亚铁:FeO + Cl2 → FeCl2 + O240. 氢氧化铝和盐酸反应生成氯化铝和水:Al(OH)3 + 3HCl → AlCl3 + 3H2O41. 氢氧化锰和盐酸反应生成氯化锰和水:Mn(OH)2 + 2HCl → MnCl2 + 2H2O42. 氢氧化铜和氯化铵反应生成铜氯化物和氢氧化铵:Cu(OH)2 + 2NH4Cl → CuCl2 + 2NH3 + 2H2O43. 氢氧化钠和氯化亚铁反应生成氯化钠和氢氧化铁:2NaOH + FeCl2 → 2NaCl + Fe(OH)244. 氢氧化铜和氯化铁反应生成氯化铜和氢氧化铁:Cu(OH)2 + 2FeCl3 → CuCl2 + 2Fe(OH)345. 氢氧化钠和氯化铜反应生成氯化钠和氢氧化铜:2NaOH + CuCl2 → 2NaCl + Cu(OH)246. 氢氧化铝和硫酸反应生成硫酸铝和水:Al(OH)3 + H2SO4 → Al2(SO4)3 + 3H2O47. 氧化铁和氢氧化铜反应生成铁氢氧化物和氧气:4Fe2O3 + 3Cu(OH)2 → 8Fe(OH)3 + 3O2 + 3CuO48. 氢氧化铁和氯化铵反应生成氯化铁和氢氧化铵:Fe(OH)3 + 3NH4Cl → FeCl3+ 3NH3 + 3H2O49. 氧化亚铁和氢氧化钠反应生成氢氧化铁:2FeO + 2NaOH + H2O → 2Fe(OH)2 + 2NaOH50. 氢氧化铜和氧化亚铁反应生成铜和氢氧化铁:3Cu(OH)2 + 2FeO → Fe(OH)2 + Cu3O + H2O51. 氧化铁和氯化铜反应生成氯化铁和氢氧化铜:Fe2O3 + 6CuCl2 → 2FeCl3 + 6CuO + Cl252. 氢氧化铝和氢氧化钠反应生成氢氧化铝:Al(OH)3 + NaOH → NaAl(OH)453. 氢氧化钠和硫酸铜反应生成硫酸钠和氢氧化铜:2NaOH + CuSO4 → Na2SO4 + Cu(OH)254. 氧化铁和氢氧化铜反应生成铁氢氧化物和氧气:4Fe2O3 + 3Cu(OH)2 → 8Fe(OH)3 + 3O2 + 3CuO55. 氢氧化铜和氢氧化钡反应生成铜氢氧化物和氢氧化钡:Cu(OH)2 + Ba(OH)2 → Cu(OH)2 + Ba(O H)256. 氧化铁和氢氧化铜反应生成铁氢氧化物和氧气:4Fe2O3 + 3Cu(OH)2 → 8Fe(OH)3 + 3O2 + 3CuO57. 氢氧化铁和氧化铜反应生成铁和氢氧化铜:3Fe(OH)3 + 2CuO → Fe3O4 + 3H2O + 2Cu(OH)258. 氢氧化铝和氢氧化亚铁反应生成铝和氢氧化铁:2Al(OH)3 + Fe(OH)2 → 2Al + 2Fe(OH)3 + 3H2O59. 氧化铁和氢氧化铜反应生成铁氢氧化物和氧气:4Fe2O3 + 3Cu(OH)2 → 8Fe(OH)3 + 3O2 + 3CuOFe3O4 + 3H2O + 3Cu(OH)261. 氢氧化铝和氢氧化钡反应生成铝和氢氧化钡:2Al(OH)3 + 3Ba(OH)2 → 2Al + 3Ba(OH)462. 氢氧化铜和氢氧化锰反应生成铜和氢氧化锰:3Cu(OH)2 + 2Mn(OH)2 → Mn3O4 + 3H2O + 3Cu(OH)263. 氢氧化铝和氢氧化铜反应生成铝和氢氧化铜:2Al(OH)3 + 3Cu(OH)2 → 2Al + 3Cu(OH)464. 氧化铁和氧化锌反应生成铁和氧化锌:3Fe2O3 + 4ZnO → 6FeO + 4ZnO + 3O265. 氢氧化铜和氢氧化铅反应生成铜和氢氧化铅:3Cu(OH)2 + 2Pb(OH)2 → Pb3O4 + 3H2O + 3Cu(OH)266. 氢氧化铝和氢氧化亚铜反应生成铝和氢氧化铜:2Al(OH)3 + 3Cu(OH)2 → 2Al + 3Cu(OH)467. 氧化铁和氧化铜反应生成铁和氧化铜:Fe2O3 + 3CuO → 2FeO + 3CuO68. 氢氧化铝和氢氧化铅反应生成铝和氢氧化铅:2Al(OH)3 + 3Pb(OH)2 → 2Al + 3Pb(OH)469. 氧化铁和氧化铜反应生成铁和氧化铜:3Fe2O3 + 4CuO → 6FeO + 4CuO + 3O270. 氢氧化铜和氢氧化钡反应生成铜和氢氧化钡:3Cu(OH)2 + 2Ba(OH)2 → Ba3O4 + 3H2O + 3Cu(OH)271. 氧化铁和氧化铜反应生成铁和氧化铜:Fe2O3 + 3CuO → 2FeO + 3CuO+ 2Fe(OH)3 + 3H2O73. 氧化铁和氧化铜反应生成铁和氧化铜:Fe2O3 + CuO → 2FeO + CuO74. 氢氧化铜和氢氧化铝反应生成铜和氢氧化铝:3Cu(OH)2 + 2Al(OH)3 → Al2O3 + 3H2O + 3Cu(OH)275. 氧化铁和氧化铜反应生成铁和氧化铜:Fe2O3 + CuO → 2FeO + CuO76. 氢氧化铜和氢氧化亚铁反应生成铜和氢氧化铁:3Cu(OH)2 + 2FeO → Fe3O4 + 3H2O + 3Cu(OH)277. 氢氧化铝和氢氧化亚铁反应生成铝和氢氧化铁:2Al(OH)3 + Fe(OH)2 → 2Al + 2Fe(OH)3 + 3H2O78. 氧化铁和氧化铜反应生成铁和氧化铜:Fe2O3 + 3CuO → 2FeO + 3CuO79. 氢氧化铝和氢氧化铅反应生成铝和氢氧化铅:2Al(OH)3 + 3Pb(OH)2 → 2Al + 3Pb(OH)480. 氧化铁和氧化铜反应生成铁和氧化铜:Fe2O3 + CuO → 2FeO + CuO。
高中化学方程式配平练习大全

高中化学方程式配平练习大全配平无机物主要化学反应方程式§1◆碱金属元素Na+O2===Na2O+O2Na+O2Na+S===Na+H2O==Na2O+H2O===Na2O2+H2O===(此反应分两步:Na2O2+2H2O===2NaOH+H2O2;2H2O2===2H2O+O2.)Na2O+CO2===Na2O2+CO2===Na2CO3+HCl===NaHCO3+HCl===NaHCO3Li+O2K+H2O===NaHCO3+NaOH==Na2CO3+H2O+CO2===NaOH+CO2(少量)==NaOH+CO2(多量)==Na2CO3+Ca(OH)2=NaOH+SO2(少量)===NaOH+SO2(足量)===NaOH+H2S(足量)===NaOH+H2S(少量)===NaOH+HCl===CO2+Ca(OH)2(过量)===CO2(过量)+Ca(OH)2===Na2O+HCl===Na2O+SO3===CaCO3MgCO3Fe(OH)3Mg(OH)2Cu(OH)2Al(OH)3CaCO3+H2O+CO2=NaOH+CuSO4==NaOH+FeCl3====§2卤族元素Cl2+Cu Cl2+FeCl2+Na Cl2+H2Cl2+P PCl3Cl2+PCl3PCl5Cl2+H2O=Cl2+NaOH===Cl2+Ca(OH)2===Cl2+FeCl2===Ca(ClO)2+H2O+CO2(少量)==Ca(ClO)2+2H2O+CO2(多量)==Ca(ClO)2+HCl==HClOF2+H2===F2+H2O===Br2+H2I2+H2Cl2+NaBr===Cl2+KI===HCl+AgNO3===Br2+KI==HCl(浓)+MnO2HCl+AgNO3===NaBr+AgNO3=NaI+AgNO3===AgBr Na2SO3+H2O+Cl2==HClO+H2O+SO2=§3氧族元素H2+S Na+SFe+S Cu+SS+O2O2OH 2O2H2SH2S+SO2==H2S+O2(少量)H2S+CuSO4=SO2+H2OSO2+NaOH=Na2SO3+H2O+SO2=SO2+Ca(OH)2=SO2+O22Cl2(Br2、I2类似)+SO2+H2O=SO3+H2O=H2S+O2(足量)(Cl2、Br2、I2、SO2都可氧化)NaCl+H2SO4(浓)H2SO4(浓)+CuH2SO4(浓)+C Na2SO3+O2=FeS2+O2Na2SO3+H2SO4=FeS+HCl=FeS+H2SO4=Na2SO3+H2O+Cl2==SO2(少量)+NH3+H2O===SO2+(NH4)2SO3+H2O===即:SO2(足量)+NH3+H2O===§4碳族元素C+O2点燃C+O2点燃CO+O2点燃C+CuO高温C+Fe2O3高温CO+CuO加热CO+Fe2O3高温NaOH+CO2====NaOH+SO2====NaOH+SO3====Ca(OH)2+CO2====Ca(OH)2+SO2====CO2+H2O===C+H2O C+CO2加热2C+SiO2Si+O22F2+Si==SiF4Si+4HF==SiF4↑+2H2↑Si+NaOH+H2O= SiO2+NaOH===SiO2+HF===CaO+SiO2SiO2+Na2CO3SiO2+CaCO3Na2SiO3+HCl=Na2SiO3++H2O+CO2==§5氮族元素NH3+H2O NH3·H2O NH4++OH-NH3+O2 NH4Cl+Ca(OH)2N2+H2N2+MgN2+O2NO+O2==NO2+H2O==NO+O2+H2O==NO2+O2+H2O==HNO3Cu+HNO3(浓)==Cu+HNO3(稀)===C+HNO3(浓)==NH4ClNH3+HCl==HNO3(稀)+Fe(过量)===HNO3(稀)+Fe(不足)===NH4HCO3NO2N2O4NaOH+NH4Cl(NH4)2SO4+NaOH NH4NO3+NaOHCl2+P PCl3Cl2+PCl3PCl5P+O2P2O5+3H2O§6几种常见的金属Al+O2Al+HCl===Al+H2SO4===Al+NaOH+H2O==Al2O3+HCl==Al2O3+NaOH==Al(OH)3+HCl==Al(OH)3+NaOH==Al(OH)3(Fe(OH)3、Cu(OH)2类似)AlCl3+NH3·H2O=NaAlO2+HCl+H2O=CO2+NaAlO2+H2O=NaAlO2+AlCl3+H2O=AlCl3+NH3·H2O===Fe+S Fe+O2Fe+H2O Fe+HCl===Fe+CuCl2===FeCl3+Fe===FeCl 3+Cu===FeCl3+H2S(少量)===FeCl3+KI===Fe(OH)3FeCl2+Cl2===Fe(OH)2+H2O+O2==C+Fe2O3高温Fe2O3+HCl===Fe2O3+H2SO4===H2SO3+FeCl3+H2O===Al+Cr2O3Al+Fe2O3Al+MnO2Mg+CO2HgO2Ag2OWO3+H2Al2O32NaCl2Na+Cl2↑NaOH+FeCl3==§7其他章节CuSO4·5H2O CuSO4+5H2O====FeCl3+H2O CuCl2NaCl+H2OBa(OH)2·8H2O+NH4Cl==配平有机物主要化学反应方程式(带*的暂时不作要求)1.甲烷和氯气的反应___________________________________________________________________ _____________________________________________________________________________________2.乙烯实验室制法(浓硫酸作用___________、____________)_____________________________________________________________________________________ 3.乙烯通入溴水中_____________________________________________________________________4.乙烯和HBr的反应__________________________________________________________________5.乙烯水化制乙醇____________________________________________________________________6.制取聚乙烯_________________________________________________________________________*制取聚丙烯_________________________________________________________________________ *7.乙炔的制取_________________________________________________________________________ *其中碳化钙的电子式为____________________8.由乙炔制聚氯乙烯__________________________________________________________________9.苯与液溴反应_____________________________________________________________________10.苯的硝化反应____________________________________________________________________11.苯与氢气加成生成环己烷__________________________________________________________*12.甲苯发生硝化反应________________________________________________________________ *13.溴乙烷水解______________________________________________________________________ *14.溴乙烷消去反应__________________________________________________________________15.乙醇与钠反应____________________________________________________________________16.乙醇催化氧化____________________________________________________________________ 17.乙醇脱水(分子间、分子内)______________________________________________________*18.苯酚与氢氧化钠溶液反应__________________________________________________________ *19.苯酚钠溶液中通入二氧化碳________________________________________________________ *20.苯酚的定性检验定量测定方法______________________________________________________ *21.丙醛制1-丙醇___________________________________________________________________*22.乙醛制乙酸______________________________________________________________________ 23.乙醛的银镜反应__________________________________________________________________*甲醛的银镜反应__________________________________________________________________24.乙醛与新制氢氧化铜悬浊液________________________________________________________25.乙酸与氢氧化铜悬浊液___________________________________________________________26.乙酸乙酯制取(用饱和碳酸钠溶液收集)_____________________________________________ *27.葡萄糖与银氨溶液的反应___________________________________________________________28.蔗糖水解方程式___________________________________________________________________29.麦芽糖水解方程式_________________________________________________________________30.淀粉水解_________________________________________________________________________31.硬脂酸甘油酯皂化反应____________________________________________________________答案:无机化学方程式§1◆碱金属元素4Na+O2===2Na2O2Na2O+O22Na2O24Na+2O22Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H2↑Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2↑(此反应分两步:Na2O2+2H2O===2NaOH+H2O2;2H2O2===2H2O+O2.)Na2O+CO2===Na2CO32Na2O2+2CO2===2Na2CO3+O2Na2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO2↑Na2CO3+2HCl===2NaCl+H2O+CO2↑2NaHCO3Na2CO3+H2O+CO2↑4Li+O22Li2O2K+2H2O===2KOH+H2↑NaHCO3+NaOH==Na2CO3+H2ONa2CO3+H2O+CO2=2NaHCO32NaOH+CO2(少量)==Na2CO3+H2ONaOH+CO2(多量)==NaHCO3Na2CO3+Ca(OH)2=CaCO3↓+2NaOH2NaOH+SO2(少量)===Na2SO3+H2ONaOH+SO2(足量)===NaHSO3NaOH+H2S(足量)===NaHS+H2O2NaOH+H2S(少量)===Na2S+2H2ONaOH+HCl===NaCl+H2OCO2+Ca(OH)2(过量)===CaCO3↓+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2Na2O+2HCl===2NaCl+H2ONa2O+SO3===Na2SO4CaCO3CaO+CO2↑MgCO3MgO+CO2↑2Fe(OH)3Fe2O3+3H2OMg(OH)2MgO+H2OCu(OH)2CuO+H2O2Al(OH)3Al2O3+3H2OCaCO3+H2O+CO2=Ca(HCO3)22NaOH+CuSO4==Cu(OH)2↓+Na2SO43NaOH+FeCl3====Fe(OH)3↓+3NaCl§2卤族元素Cl2+Cu CuCl23Cl2+2Fe2FeCl3Cl2+2Na2NaClCl2+H22HCl3Cl2+2P2PCl3Cl2+PCl3PCl5Cl2+H2O==HCl+HClOCl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2OCl2+2FeCl2===2FeCl3Ca(ClO)2+H2O+CO2(少量)==CaCO3↓+2HClOCa(ClO)2+2H2O+2CO2(多量)==Ca(HCO3)2↓+2HClOCa(ClO)2+2HCl==CaCl2+2HClO(强酸制弱酸)2HClO2HCl+O2↑F2+H2===2HF2F2+2H2O===4HF+O2Br2+H2===2HBr(500o C)I2+H22HI2Cl2+2NaBr===2NaCl+Br2Cl2+2KI===2KCl+I2HCl+AgNO3===AgCl↓+HNO3Br2+2KI===2KBr+I24HCl(浓)+MnO2MnCl2+Cl2↑+2H2OHCl+AgNO3===AgCl↓+HNO3HCl+AgNO3=AgCl↓(白色)+HNO3NaBr+AgNO3=AgBr↓(浅黄色)+NaNO3NaI+AgNO3===AgI↓(黄色)+NaNO3 2AgBr2Ag+Br2(AgCl、AgI类似)Na2SO3+H2O+Cl2==Na2SO4+2HCl HClO+H2O+SO2=H2SO4+HCl§3氧族元素H2+S H2S2Na+S Na2SFe+S FeS2Cu+S Cu2SS+O2SO23O22O32O 33O22H2O22H2O+O2↑H2S H2+S2H2S+SO2==3S↓+2H2O2H2S+O2(少量)2H2O+2SH2S+CuSO4=CuS↓+H2SO4SO2+H2O H2SO3SO2+2NaOH=Na2SO3+H2ONa2SO3+H2O+SO2=2NaHSO3SO2+Ca(OH)2=CaSO3↓+H2OSO2+O22SO3Cl2+SO2+2H2O=H2SO4+2HCl(Br2、I2类似)SO3+H2O=H2SO42H2S+3O2(足量)2H2O+2SO2(Cl2、Br2、I2、SO2都可氧化)2NaCl+H2SO4(浓)Na2SO4+2HCl?2H2SO4(浓)+Cu CuSO4+2H2O+SO2↑2H2SO4(浓)+C CO2↑+2H2O+2SO2↑2Na2SO3+O2=2Na2SO44FeS2+11O22Fe2O3+8SO2Na2SO3+H2SO4=Na2SO4+SO2?+H2OFeS+2HCl=H2S↑+FeCl2FeS+H2SO4=H2S↑+FeSO4Na2SO3+H2O+Cl2==Na2SO4+2HClSO2(少量)+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3即:SO2(足量)+NH3+H2O===NH4HSO3§4碳族元素C+O2点燃CO22C+O2点燃2CO2CO+O2点燃2CO2C+2CuO高温2Cu+CO2↑3C+2Fe2O3高温4Fe+3CO2↑CO+CuO加热Cu+CO23CO+Fe2O3高温2Fe+3CO22NaOH+CO2====Na2CO3+H2O2NaOH+SO2====Na2SO3+H2O2NaOH+SO3====Na2SO4+H2OCa(OH)2+CO2====CaCO3↓+H2OCa(OH)2+SO2====CaSO3↓+H2OCO2+H2O===H2CO3C+H2O CO+H2(生成水煤气)C+CO2加热2CO2C+SiO22CO↑+SiSi+O2SiO22F2+Si==SiF4Si+4HF==SiF4↑+2H2↑Si+2NaOH+H2O=Na2SiO3+2H2↑SiO2+2NaOH===Na2SiO3+H2OSiO2+4HF===SiF4+2H2OCaO+SiO2CaSiO3SiO2+Na2CO3Na2SiO3+CO2SiO2+CaCO3CaSiO3+CO2↑Na2SiO3+2HCl==2NaCl+H2SiO3↓Na2SiO3++H2O+CO2==Na2CO3+H2SiO3↓§5氮族元素NH3+H2O NH3·H2O NH4++OH-4NH3+5O24NO+6H2O2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2ON2+H2NH3N2+3Mg Mg3N2N2+O22NO2NO+O2==2NO23NO2+H2O==2HNO3+NO4NO+3O2+2H2O==4HNO34NO2+O2+2H2O==4HNO34HNO34NO2↑+O2↑+2H2OCu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2OC+4HNO3(浓)==CO2↑+4NO2↑+2H2ONH4Cl NH3+HClNH3+HCl==NH4Cl(白烟)8HNO3(稀)+3Fe(过量)===3Fe(NO3)2+2NO↑+4H2O4HNO3(稀)+Fe(不足)===Fe(NO3)3+NO↑+2H2ONH4HCO3NH3↑+H2O+CO2↑2NO2N2O4NaOH+NH4Cl NaCl+NH3↑+H2O(NH4)2SO4+2NaOH Na2SO4+2NH3↑+2H2ONH4NO3+NaOH NaNO3+NH3↑+H2O3Cl2+2P2PCl3Cl2+PCl3PCl54P+5O2P2O5P2O5+3H2O H3PO4§6几种常见的金属4Al+3O22Al2O32Al+6HCl===2AlCl3+3H2↑2Al+3H2SO4===Al2(SO4)3+3H2↑2Al+2NaOH+2H2O==2NaAlO2+3H2↑Al2O3+6HCl==2AlCl3+3H2OAl2O3+2NaOH==2NaAlO2+H2OAl(OH)3+3HCl==AlCl3+3H2OAl(OH)3+NaOH==NaAlO2+2H2O2Al(OH)3Al2O3+3H2O(Fe(OH)3、Cu(OH)2类似)AlCl3+3NH3·H2O=Al(OH)3↓+3NH4ClNaAlO2+HCl+H2O=NaCl+Al(OH)3↓CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO33NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaClAlCl3+3NH3·H2O===Al(OH)3↓+3NH4ClFe+S FeS3Fe+2O2Fe3O43Fe+4H2O Fe3O4+4H2↑Fe+2HCl===FeCl2+H2↑Fe+CuCl2== =FeCl2+Cu2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+H2S(少量)===2FeCl2+2HCl+S↓2FeCl3+2KI===2FeCl2+2KCl+I2↓2Fe(OH)3Fe2O3+3H2O2FeCl2+Cl2===2FeCl34Fe(OH)2+2H2O+O2==4Fe(OH)33C+2Fe2O3高温4Fe+3CO2↑Fe2O3+6HCl===2FeCl3+3H2OFe2O3+3H2SO4===Fe2(SO4)3+3H2O H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl2Al+Cr2O 3Al2O3+2Cr2Al+Fe2O3Al2O3+2Fe4Al+3MnO 22Al2O3+3Mn2Mg+CO 22MgO+C2HgO2Hg+O22Ag2O4Ag+O2WO3+3H 2W+3H2O2Al2O 34Al+3O2↑2NaCl2Na+Cl2↑3NaOH+FeCl3==Fe(OH)3↓+3NaCl§7其他章节CuSO4·5H2O CuSO4+5H2O↑CuSO4+5H2O====CuSO4·5H2O FeCl3+3H2O Fe(OH)3(胶体)+3HClCuCl2Cu+Cl2↑2NaCl+2H2O H2+Cl2↑+2NaOHBa(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O(吸热反应)有机物主要化学反应方程式复习答案:1.甲烷与氯气CH4+Cl2CH3Cl+HClCH3Cl+Cl2CH2Cl2+HClCH2Cl2+Cl2CHCl3+HClCHCl3+Cl2CCl4+HCl2.乙烯实验室制法(浓硫酸作催化剂,脱水剂)CH3CH2OHH2O+CH2=CH2↑3.乙烯通入溴水中CH2=CH2+Br2CH2BrCH2Br4.乙烯和HBr的反应CH2=CH2+HBr催化剂CH3CH2Br5.乙烯水化制乙醇CH2=CH2+H2OCH3CH2OH6.制取聚乙烯、聚丙烯nCH2=CH2催化剂nCH3–CH=CH2催化剂CH37.乙炔的制取CaC2+2H2O Ca(OH)2+↑碳化钙电子式8.由乙炔制聚氯乙烯+HClH2C=CHCl n H2C=CHCl 催化剂CH2-CH2n催化剂△HC≡CHHC≡CHCH-CH2 nClCH-CH2n9.苯与液溴反应(需铁作催化剂) +Br 2+HBr10.苯的硝化反应 +HNO 3+H 2O 11.苯与氢气加成生成环己烷+3H 2催化剂 △ 12.甲苯发生硝化反应+3HONO 2浓硫酸 △ +3H 2O 13.溴乙烷水解CH 3CH 2Br+NaOHCH 3CH 2OH+NaBr14.溴乙烷消去反应CH 3CH 2Br+NaOHCH 2=CH 2+NaBr+H 2O15.乙醇与钠反应2CH 3CH 2OH+2Na2CH 3CH 2ONa+H 2↑ 16.乙醇催化氧化2CH 3CH 2OH+O 22CH 3CHO+2H 2O17.乙醇脱水(分子间、分子内)CH 3CH 2OHH 2O+CH 2=CH 2↑2CH 3CH 2OHH 2O+CH 3CH 2OCH 2CH 318.苯酚与氢氧化钠溶液反应+NaOH +H 2O 19.苯酚钠溶液中通入二氧化碳+CO 2+H 2O +NaHCO 320.苯酚的定性检验定量测定方法:+3Br 2↓+3HBr 21.丙醛制1-丙醇 CH 3CH 2CHO+H 2催化剂 △ CH 3CH 2CH 2OH 22.乙醛制乙酸2CH 3CHO+O 2 催化剂 △ 2CH 3COOH23.乙醛的银镜反应BrFe 浓H 2SO 4 55-60℃ —NO 2CH 3––NO | NO 2O 2N –– CH 3 | H 2O Cu △ —OH —ONa—ONa —OH ––Br| BrBr –– OH| OH | 醇 △浓H 2SO 4 140℃CH 3CHO+2[Ag(NH 3)2]OH H 2O+2Ag ↓+3NH 3+CH 3COONH 4甲醛的银镜反应HCHO+4[Ag(NH 3)2]OH2H 2O+4Ag ↓+6NH 3+(NH 4)2CO 3 24.乙醛与新制氢氧化铜悬浊液CH 3CHO+2Cu(OH)2Cu 2O ↓+2H 2O+CH 3COOH25.*乙酸与氢氧化铜悬浊液2CH 3COOH+Cu(OH)2=(CH 3COO)2Cu+2H 2O26.乙酸乙酯制取(用饱和碳酸钠溶液收集)CH 3COOH+CH 3CH 2OHCH 3COOC 2H 5+H 2O27.葡萄糖与银氨溶液 CH 2OH (CHOH )4CHO+2[Ag(NH 3)2]OHH 2O+2Ag ↓+3NH 3+CH 2OH (CHOH )4COONH 4 28.蔗糖水解方程式C 12H 22O 11+H 2O 催化剂C 6H 12O 6+C 6H 12O 6蔗糖葡萄糖果糖29.麦芽糖水解方程式C 12H 22O 11+H 2O催化剂 2C 6H 12O 6 麦芽糖葡萄糖30.淀粉水解(C 6H 10O 5)n+nH 2O催化剂 nC 6H 12O 6淀粉葡萄糖31.硬脂酸甘油酯皂化反应+3NaOH 3C 17H 35COONa+浓硫酸△ CH 2–OH | CH –OH |CH 2–OHC 17H 35COO─CH 2C 17H 35COO─CHC 17H 35COO─C。
(完整版)高中化学方程式书写练习(附答案)

高中化学方程式书写练习一1.钠块在空气中变暗:2.钠在空气中燃烧:3.钠与熔融四氯化钛(TiCl4)反应:4.钠与水反应:_______________________________________离子方程式:____________________________5.钠与硫酸反应:离子方程式:______________6.钠与硫酸铜溶液:7.氧化钠与水反应:___________________________________8.氧化钠与盐酸反应:离子方程式:______________9.过氧化钠与盐酸反应:离子方程式:______________10.过氧化钠与二氧化碳反应:氧化剂:还原剂:11.过氧化钠与水反应: _ 离子方程式:_______________________12.过氧化钠与二氧化硫反应:13.电解熔融氯化钠:14.NaOH溶液中通入少量CO2:离子方程式:__ ________________15.NaOH溶液中通入过量CO2:离子方程式:___________ __________16.碳酸钠与氢氧化钙:离子方程式:___________ __________ 17.碳酸氢钠与盐酸:离子方程式:___________ __________ 18.碳酸氢钠溶液与醋酸溶液混合:离子方程式:___________ __________19.除去碳酸钠溶液中的碳酸氢钠:离子方程式:___________ __________20.除去碳酸钠固体中的碳酸氢钠:21.除去碳酸氢钠溶液中混有的碳酸钠:离子方程式:___________ __________ 22.用碳酸钠溶液吸收过量SO2:离子方程式:_________________23.用碳酸钠溶液吸收少量SO2:离子方程式:___________ __________24.向碳酸钠溶液滴入少量稀盐酸:离子方程式:___________ __________ 25.向碳酸钠溶液滴入过量稀盐酸:离子方程式:___________ __________ 26.碳酸钙与醋酸反应:离子方程式:___________ __________高中化学方程式书写练习二1.铝与氧气的反应:2.铝与氧化铁反应(铝热反应):氧化剂:还原剂:3.铝和稀盐酸:_____________________________________ 离子方程式:____________________________________4.铝和NaOH溶液:____________________________________ 离子方程式:_____________________________________5.氧化铝和稀硫酸:___________________________________ 离子方程式:_______________________________6.氧化铝和NaOH溶液:________________________________ 离子方程式:_______________________________7.氢氧化铝和盐酸:_____________________________离子方程式:_______________________________8.氢氧化铝和NaOH溶液:______________________________ 离子方程式:_____________________________________9.氢氧化铝受热分解:_____________________________10.硫酸铝与过量氨水反应:_____________________________ 离子方程式:__________________________________11.AlCl3溶液中加入少量NaOH溶液:离子方程式:________________________________________ 12.AlCl3溶液中加入过量NaOH溶液:离子方程式:___________________________________13.偏铝酸钠溶液中加入少量HCl:离子方程式:____________________________14.偏铝酸钠溶液中加入过量HCl:离子方程式:_____________________ ____ 15.往偏铝酸钠溶液中通入少量CO2:离子方程式:__________________________________16.往偏铝酸钠溶液中通入过量CO2:离子方程式:___________________________ _______17.电解熔融氧化铝:18.明矾净水原因:19.明矾溶液中加入少量氢氧化钡溶液:离子方程式:__________________________________20.明矾溶液中加入过量氢氧化钡溶液:离子方程式:__________________________________21.碳酸氢钠溶液与少量石灰水反应:离子方程式:__________________________________22.碳酸氢钠溶液与过量石灰水反应:离子方程式:__________________________________23.鉴别碳酸钠和碳酸氢钠溶液:离子方程式:__________________________________24.电解熔融氯化镁:25.镁与热水反应:26.碳酸氢钙溶液与醋酸反应:离子方程式:__________________________________高中化学方程式书写练习三1.铁与氧气反应:___________________________________2.铁与硫反应:______________________________氧化剂:_______________ 还原剂:______________3.铁在氯气中燃烧:____________________________________氧化剂:_______________ 还原剂:_______________4.铁与碘反应:____________________________5.铁与盐酸反应:___________________________________离子方程式:___________________________6.铁与氯化铜溶液:___________________________________离子方程式:___________________________7.铁和水蒸气:______________________________________氧化剂:____________ 还原剂:____________8.氧化亚铁与盐酸反应:___________________________________离子方程式:_______________________________ ______9.氧化铁与盐酸反应:____________________ _离子方程式:_________________________________ ____10.CO还原氧化铁:__________________________________________11.磁铁矿与一氧化碳反应:____________________________________12.氯化铁与氢氧化钠溶液:____________________________离子方程式:_______________________________12.硫酸亚铁与氢氧化钠溶液:__________________________离子方程式:_______________________________14.氢氧化铁加热分解:__________________________________15.氢氧化亚铁在空气中被氧化:______________________________16.除去FeCl2中的FeCl3:________________________________离子方程式:___________________________氧化剂:____________ 还原剂:____________17.FeCl2和Cl2反应:____________________________________离子方程式:________________________________18.FeCl3和Cu反应:____________________________________离子方程式:_____________________________氧化剂:____________ 还原剂:____________19.氯化铁与硫氰化钾溶液反应:_______________________________20.氯化铁溶液中滴加少量碘化钾溶液:_________________________ 离子方程式:_____________________________21.氯化铁溶液跟过量氨水反应:________________________________ 离子方程式:_____________________________22.氯化铁溶液跟少量锌粉反应:________________________________ 离子方程式:_____________________________23.氯化铁溶液跟过量锌粉反应:________________________________ 离子方程式:_____________________________24.镁在二氧化碳中燃烧:_________________________氧化剂:____________ 还原剂:____________25.镁与氮气反应:_________________________氧化剂:____________ 还原剂:____________26.硫酸溶液跟氢氧化钡溶液反应:离子方程式:_______________________________________高中化学方程式书写练习四1.用氯化铁与沸水反应制氢氧化铁胶体:_________________________2.硫化氢气体与氯化铁溶液反应:_______________________________ 离子方程式:____________________________________3.硫化亚铁与盐酸反应:___________________________________4.四氧化三铁溶于浓盐酸:_____________________ ______离子方程式:________________________________________5.硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:____ ______ ____________________________________________________离子方程式:________________________________________6.硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:__ ______ ____________________________________________________离子方程式:____________________________________________ 7.氧化铁溶于氢碘酸溶液:_______________ _______ ______ 离子方程式:____________________________________8.氯化铁溶液中滴加少量硫化钠溶液:_____________ ______ 离子方程式:____________________________________9.氯化铁溶液中滴加过量硫化钠溶液:______________ ______ 离子方程式:____________________________________10.硅与氧气加热:_______________ ______11.硅与氟气:________________________12.硅单质与氢氟酸反应:_______________ ______13.硅与氢氧化钠溶液反应:________________________ __14.二氧化硅与氢氟酸反应:__________________________________15.二氧化硅与氧化钙高温反应:______________________________16.二氧化硅与氢氧化钠溶液反应:____________________________ 离子方程式:____________________________________17.二氧化硅与碳反应:____________________________________氧化剂:____________ 还原剂:____________18.硅酸钠与盐酸反应:______________________________离子方程式:____________________________________19.往硅酸钠溶液中通入少量二氧化碳:____________ ______ 离子方程式:____________________________________20.往硅酸钠溶液中通入过量二氧化碳:____________ ______ 离子方程式:____________________________________21.二氧化硅与纯碱反应:_______________________ ______22.二氧化硅与石灰石反应:_____________________ ________23.加热硅酸:_______________ ______24.向碳酸氢钙溶液中加入过量的氢氧化钠:_________ ______ ____________________________________________________离子方程式:____________________________________25.向碳酸氢钙溶液中加入少量的氢氧化钠:________ ______ ____________________________________________________离子方程式:____________________________________26.碳酸氢铵溶液中加入过量氢氧化钠溶液离子方程式:____________________________________高中化学方程式书写练习五1.水煤气的制取:_____________________________________2.用氢气还原四氯化硅:_______________________________3.碳酸氢镁溶液中加少量氢氧化钙:__________________________ 离子方程式:_________________________________4.碳酸氢镁溶液中加过量氢氧化钙:__________________________ 离子方程式:_________________________________5.实验室制氯气:______________________________________离子方程式:_________________________________氧化剂:____________ 还原剂:____________6.高锰酸钾固体加入浓盐酸:________________________________ 离子方程式:____________________________________7.钠在氯气中燃烧:____________________________________8.铜在氯气中燃烧:___________________________________9.氢气在氯气中燃烧:___________________________氧化剂:____________ 还原剂:____________10.磷与少量氯气反应:_______________________________11.硅与氯气在高温下反应:_______________________________12.氯气和水反应:______________________________离子方程式:________________________________________氧化剂:____________ 还原剂:____________13.次氯酸光照分解:__________________________________14.氯水中通入二氧化硫:_______________________________离子方程式:____________________________________氧化剂:____________ 还原剂:____________15.氯气与冷氢氧化钠溶液:________________________________离子方程式:__________________________________16.氯气与热的氢氧化钠溶液:_______________________________离子方程式:_______________________17.工业生产漂白粉:________________________________________18.向漂白粉溶液中加入稀盐酸:_______________________________ 离子方程式:________________________________19.次氯酸钙溶液中通入少量二氧化碳:________________________ 离子方程式:________________________________20.次氯酸钙溶液中通入过量二氧化碳:__________________________ 离子方程式:________________________________21.次氯酸钙溶液中通入SO2:_______________________________离子方程式:________________________________22.氯气通入碳酸氢钠溶液:_________________________________离子方程式:________________________________23.氯气通入溴化钾溶液:_______________________________离子方程式:________________________________24.氯气通入碘化钾溶液:_______________________________离子方程式:________________________________25.溴水和碘化钾溶液反应:_______________________________离子方程式:________________________________26.一氧化碳和一氧化氮反应:________________________________高中化学方程式书写练习六1.氯化钠和硝酸银溶液:_____________________________离子方程式:____________________________2.溴化钠和硝酸银溶液:___________________________离子方程式:____________________________3.碘化钠和硝酸银溶液:_________________________离子方程式:____________________________4.氟气与水反应:_________________________________5.氟气与氢气反应:_________________________________6.F2与NaOH溶液反应:_________________________________离子方程式:____________________________7.溴化银分解:______________________________________8.氯酸钾与浓盐酸:______________________________________离子方程式:____________________________________氧化剂:____________ 还原剂:____________9.溴化亚铁溶液通入足量氯气:_________________________离子方程式:____________________________10.溴化亚铁溶液通入少量氯气:_________________________离子方程式:____________________________11.等物质的量的溴化亚铁溶液与氯气:_________________________ 离子方程式:____________________________12.碘化亚铁溶液通入足量氯气:_________________________离子方程式:____________________________________13.碘化亚铁溶液通入少量氯气:_________________________离子方程式:____________________________________14.硫在空气中燃烧:__________________________________氧化剂:____________ 还原剂:____________15.硫与氢气加热:_________________________________氧化剂:____________ 还原剂:____________16.硫与铜反应:_________________________________17.二氧化硫与水:______________________________________18.二氧化硫与氧化钙:__________________________________19.少量SO2与氢氧化钠:______________________________离子方程式:_______________________________20.过量SO2与氢氧化钠:______________________________离子方程式:_____________________________________21.澄清石灰水通入少量SO2:_______________________________22.澄清石灰水通入过量SO2:_______________________________23.二氧化硫与硫化氢:_________________________氧化剂:____________ 还原剂:____________24.SO2的催化氧化:____________________________________氧化剂:____________ 还原剂:____________25.Na2SO3与氧气反应:__________________________________26.硫酸铜与氢氧化钡溶液反应:_______________________________ 离子方程式:_____________________________________高中化学方程式书写练习七1.亚硫酸钠和硫酸反应:_____________________________________2.三氧化硫和水反应:____________________________________3.三氧化硫与氧化钙:___________________________4.三氧化硫与氢氧化钙:___________________________5.铜与浓硫酸反应:________________________________________氧化剂:____________ 还原剂:____________6.碳与浓硫酸反应:________________________________________氧化剂:____________ 还原剂:____________7.硫与浓硫酸反应:__________________________________8.硫化氢与浓硫酸反应:______________________________________ 氧化剂:____________ 还原剂:____________9.硫酸铜溶液中通入硫化氢:________________________________离子方程式:________________________________10.锌与稀硫酸:__________________________________离子方程式:________________________________11.锌与浓硫酸:__________________________________12.亚硫酸溶液中加入氯水:__________________________________ 离子方程式:________________________________13.亚硫酸溶液中加入氯化铁:__________________________________ 离子方程式:________________________________14.亚硫酸溶液中加入双氧水:__________________________________ 离子方程式:________________________________15.亚硫酸钠溶液中加入溴水:__________________________________离子方程式:________________________________16.亚硫酸钠溶液中加入双氧水:________________________________ 离子方程式:________________________________17.硫溶于热的氢氧化钠溶液:_______________________________离子方程式:________________________________18.铜屑与稀硫酸和过氧化氢三者反应:_________________________ 离子方程式:________________________________19.黄铁矿(FeS2)与氧气反应:__________________________________20.用氨水吸收少量二氧化硫:__________________________________ 离子方程式:________________________________21.用氨水吸收过量二氧化硫:__________________________________ 离子方程式:________________________________22.向饱和碳酸氢钙溶液中加饱和氢氧化钙溶液:_________________ _________________________________________________离子方程式:________________________________23.等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:________________ _________________________________________________离子方程式:________________________________24.硫酸氢钠溶液与氢氧化钡反应至中性:_______________________ 离子方程式:________________________________25.硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀:_____________ _________________________________________________离子方程式:________________________________高中化学方程式书写练习八1.氮气和氧气反应:____________________________2.工业合成氨:____________________________________氧化剂:____________ 还原剂:____________3.一氧化氮与氧气反应:___________________________4.NO2溶于水:____________________________________氧化剂:____________ 还原剂:____________5.氨气和氯化氢:____________________________________6.氨的催化氧化:_______________________________________氧化剂:____________ 还原剂:____________7.氯化铵受热分解: ____________________________________8.碳酸氢铵受热分解:___________________________________9.硝酸铵和NaOH:__________________________________离子方程式:_________________________________10.实验室制氨气:_______________________________________11.浓硝酸与铜反应:_________________________________离子方程式:_________________________________12.稀硝酸与铜反应:______________________________________ 离子方程式:________________________________13.碳与浓硝酸反应:____________________________________氧化剂:____________ 还原剂:____________14.浓硝酸见光分解:_______________________________________15.NO2、O2混合气通入水中无剩余气体:______________________16.NO、O2同时通入水中无剩余气体:_________________________17.少量单质铁溶于稀硝酸中(NO): ___________________________ 离子方程式:__________________________________________ 18.过量单质铁溶于稀硝酸中(NO): ____________________________ 离子方程式:__________________________________________ 19.Fe(NO3)3溶液中加入过量HI溶液:_____________________________________________________________________离子方程式:__________________________________________ 20.Fe3O4与稀HNO3反应:___________________________________离子方程式:__________________________________________ 21.FeS放入稀硝酸溶液中:_________________________________离子方程式:__________________________________________ 22.SO2通入BaCl2和HNO3混合溶液中的反应:_________________________________________________________________离子方程式:__________________________________________ 23.将NO和NO2的混合气体通入烧碱溶液中:_________________________________________________________________24.NO2通入氢氧化钠溶液:_________________________________离子方程式:__________________________________________ 25.澄清石灰水通入少量CO2:________________________________ 离子方程式:__________________________________________ 26.澄清石灰水通入过量CO2:________________________________ 离子方程式:__________________________________________高中化学方程式书写练习一1.钠块在空气中变暗: 4Na+O2=2Na2O2.钠在空气中燃烧: 2Na+O2 Na2O23.钠与熔融四氯化钛(TiCl4)反应:4Na+TiCl4 Ti+4NaCl4.钠与水反应:_2Na+2H2O=+H2↑_离子方程式:_2Na+2H2O=2Na++2OH-+H2↑_5.钠与硫酸反应:2Na+H2SO4=Na2SO4+H2↑离子方程式:__2Na+2H+=2Na++H2↑6.钠与硫酸铜溶液:2Na+2H2O+CuSO4=Na2SO4+H2↑+Cu(OH)2↓7.氧化钠与水反应:_ Na2O+H2O=2NaOH8.氧化钠与盐酸反应:Na2O+2HCl=2NaCl+H2O离子方程式:__ Na2O+2H+=2Na++H2O9.过氧化钠与盐酸反应:2Na2O2+4HCl=4NaCl+2H2O+O2↑离子方程式:__2Na2O2+4H+=4Na++2H2O+O2↑10.过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2氧化剂:Na2O2还原剂:Na2O211.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑离子方程式:_2Na2O2+2H2O=4Na++4OH-+O2↑_12.过氧化钠与二氧化硫反应:Na2O2+SO2=Na2SO413.电解熔融氯化钠: 2NaCl(熔融)2Na+Cl2↑14.NaOH溶液中通入少量CO2:2NaOH+CO2=Na2CO3+H2O离子方程式:_2OH-+CO2=CO32-+H2O _15.NaOH溶液中通入过量CO2:NaOH+CO2=NaHCO3离子方程式:_ OH-+CO2=HCO3-_16.碳酸钠与氢氧化钙:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH离子方程式:__CO32-+Ca2+=CaCO3↓17.碳酸氢钠与盐酸:NaHCO3+HCl=NaCl+H2O+CO2↑离子方程式:___ HCO3-+H+=H2O+CO2↑_18.碳酸氢钠溶液与醋酸溶液混合: NaHCO3+CH3COOH=CH3COONa+H2O +CO2↑离子方程式:__ HCO3-+CH3COOH=CH3COO-+H2O+CO2↑19.除去碳酸钠溶液中的碳酸氢钠:NaHCO3+NaOH=Na2CO3+H2O离子方程式:____ HCO3-+OH-=H2O+CO32-_20.除去碳酸钠固体中的碳酸氢钠:2NaHCO3 Na2CO3+H2O+CO2 ↑21.除去碳酸氢钠溶液中混有的碳酸钠:Na2CO3+H2O+CO2 =2NaHCO3离子方程式:___ CO32-+H2O+CO2 =2HCO3-_22.用碳酸钠溶液吸收过量SO2:Na2CO3+H2O+2SO2=2NaHSO3+CO2离子方程式:__ CO32-+H2O+2SO2=2HSO3-+CO2_23.用碳酸钠溶液吸收少量SO2:Na2CO3+SO2 =Na2SO3+CO2离子方程式:___ CO32-+SO2 =SO32-+CO2___24.向碳酸钠溶液滴入少量稀盐酸:Na2CO3+HCl=NaHCO3+NaCl离子方程式:____ CO32-+H+=HCO3-___25.向碳酸钠溶液滴入过量稀盐酸:Na2CO3+2HCl=2NaCl+H2O+CO2↑离子方程式:____ CO32-+2H+=H2O+CO2↑_26.碳酸钙与醋酸反应:CaCO3+2CH3COOH=(CH3COO)2Ca+H2O+CO2↑离子方程式:__ CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑__高中化学方程式书写练习二1.铝与氧气的反应:4Al +3O 2 2Al 2O 32.铝与氧化铁反应(铝热反应):2Al +Fe 2O 3 高温2Fe +Al 2O 3氧化剂:Fe 2O 3 还原剂: Al3.铝和稀盐酸:_2Al +6HCl =2AlCl 3+3H 2↑_离子方程式:_2Al +6H +=2Al 3++3H 2↑_4.铝和NaOH 溶液:_2Al +2NaOH +2H 2O =2NaAlO 2+3H 2↑离子方程式:_2Al +2OH -+2H 2O =2AlO 2-+3H 2↑5.氧化铝和稀硫酸:Al 2O 3+3H 2SO 4=Al 2(SO 4)3+3H 2O _离子方程式:_ Al 2O 3+6H +=2Al 3++3H 2O6.氧化铝和NaOH 溶液:__Al 2O 3+2NaOH =2NaAlO 2+H 2O _离子方程式:__ Al 2O 3+2OH -=2AlO 2-+H 2O _7.氢氧化铝和盐酸:_Al(OH)3+3HCl =AlCl 3+3H 2O_离子方程式:Al(OH)3+3H +=Al 3++3H 2O __8.氢氧化铝和NaOH 溶液:_Al(OH)3+NaOH =NaAlO 2+2H 2O_离子方程式:__ Al(OH)3+OH -=AlO 2-+2H 2O_9.氢氧化铝受热分解:_2Al(OH)3 Al 2O 3+3H 2O _10.硫酸铝与过量氨水反应:Al 2(SO 4)3+6NH 3·H 2O =2Al(OH)3↓+3(NH 4)2SO 4离子方程式:__ Al 3++3NH 3·H 2O =Al(OH)3↓+3NH 4+__11.AlCl 3溶液中加入少量NaOH 溶液:AlCl 3+3NaOH =Al(OH)3↓+3NaCl离子方程式:_ Al 3++3OH -=Al(OH)3↓_12.AlCl 3溶液中加入过量NaOH 溶液:AlCl 3+4NaOH =NaAlO 2+3NaCl +2H 2O离子方程式:__ Al 3++4OH -=AlO 2-+2H 2O _13.偏铝酸钠溶液中加入少量HCl : NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl离子方程式:_ AlO 2-+H ++H 2O =Al(OH)3↓__14.偏铝酸钠溶液中加入过量HCl:NaAlO2+4HCl=AlCl3+NaCl+2H2O 离子方程式:__ AlO2-+4H+=Al3++2H2O __15.往偏铝酸钠溶液中通入少量CO2:2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3离子方程式:_2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-___16.往偏铝酸钠溶液中通入过量CO2:NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3离子方程式:_AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-__17.电解熔融氧化铝:2Al2O3(熔融)4Al+3O2↑18.明矾净水原因: Al3++3H 2O Al(OH)3(胶体)+3H+19.明矾溶液中加入少量氢氧化钡溶液:2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4离子方程式:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓20.明矾溶液中加入过量氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O离子方程式:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O 21.碳酸氢钠溶液与少量石灰水反应:2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O离子方程式:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O22.碳酸氢钠溶液与过量石灰水反应NaHCO3+Ca(OH)2=CaCO3↓+NaOH +H2O离子方程式:HCO3-+Ca2++OH-=CaCO3↓+H2O23.鉴别碳酸钠和碳酸氢钠溶液:Na2CO3+CaCl2=CaCO3↓+2NaCl 离子方程式:_ CO32-+Ca2+=CaCO3↓_24.电解熔融氯化镁:MgCl2 (熔融)Mg+Cl2↑25.镁与热水反应:Mg + 2H2O Mg(OH)2+ H2↑26.碳酸氢钙溶液与醋酸反应:Ca(HCO3)2+2CH3COOH=(CH3COO)2Ca+2H2O+2CO2↑离子方程式:_ HCO3-+CH3COOH=CH3COO-+H2O+CO2↑高中化学方程式书写练习三1.铁与氧气反应:_3Fe+2O2Fe3O4_2.铁与硫反应:_ Fe+S FeS_氧化剂:__ S__ 还原剂:___ Fe___3.铁在氯气中燃烧:__2Fe+3Cl2 2FeCl3___ 氧化剂:___ Cl2_______ 还原剂:___ Fe____4.铁与碘反应:__ Fe+I2 FeI2_5.铁与盐酸反应:_ Fe+2HCl=FeCl2+H2↑_离子方程式:_ Fe+2H+=Fe2++H2↑_6.铁与氯化铜溶液:__Fe+CuCl2=FeCl2+Cu_离子方程式:__ Fe+Cu2+=Fe2++Cu__7.铁和水蒸气:__3Fe+4H2O(g) 高温Fe3O4+4H2_氧化剂:_ H2O__ 还原剂:__ Fe_____8.氧化亚铁与盐酸反应:_ FeO+2HCl=FeCl2+H2O_ 离子方程式:_ FeO+2H+=Fe2++H2O_9.氧化铁与盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O 离子方程式:_ Fe2O3+6H+=2Fe3++3H2O_10.CO还原氧化铁:__ Fe2O3+3CO 高温2Fe+3CO2__11.磁铁矿与一氧化碳反应:_ Fe3O4+4CO 高温3Fe+4CO2_12.氯化铁与氢氧化钠溶液:FeCl3+3NaOH=Fe(OH)3↓+3NaCl 离子方程式:_ Fe3++3OH-=Fe(OH)3↓12.硫酸亚铁与氢氧化钠溶液:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4离子方程式:_ Fe2++2OH-=Fe(OH)2↓14.氢氧化铁加热分解:_2Fe(OH)3Fe2O3+3H2O_15.氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O=4Fe(OH)316.除去FeCl2中的FeCl3:2FeCl3+Fe=3FeCl2 _离子方程式:_2Fe3++Fe=3Fe2+氧化剂:___ FeCl3_ 还原剂:__ Fe____17.FeCl2和Cl2反应:_2FeCl2+Cl2=2FeCl3__离子方程式:_2Fe2++Cl2=2Fe3++2Cl-_18.FeCl3和Cu反应:__2FeCl3+Cu=2FeCl2+CuCl2_离子方程式:_2Fe3++Cu=2Fe2++Cu2+_氧化剂:___ FeCl3__ 还原剂:___ Cu___19.氯化铁与硫氰化钾溶液反应:_ Fe3++3SCN-=Fe(SCN)3 _20.氯化铁溶液中滴加少量碘化钾溶液:_2FeCl3+2KI=2FeCl2+2KCl2+I2___离子方程式:_2Fe3++2I–=2Fe2++I2_21.氯化铁溶液跟过量氨水反应:FeCl3+3NH3·H2O=Fe(OH)3↓+3NH4Cl__离子方程式:_ Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+_22.氯化铁溶液跟少量锌粉反应:_2FeCl3+Zn=2FeCl2+ZnCl2_离子方程式:__2Fe3++Zn=2Fe2++Zn2+__23.氯化铁溶液跟过量锌粉反应:__2FeCl3+3Zn=2Fe+3ZnCl2_离子方程式:_2Fe3++3Zn=2Fe+3Zn2+_24.镁在二氧化碳中燃烧:__2Mg+CO2 2MgO+C _氧化剂:__ CO2_ 还原剂:__ Mg__25.镁与氮气反应:_3Mg+N2 Mg3N2_氧化剂:__ N2__ 还原剂:__ Mg_____26.硫酸溶液跟氢氧化钡溶液反应: Ba(OH)2+H2SO4=BaSO4↓+2H2O 离子方程式:_ Ba2++2OH–+2H++SO42–=BaSO4↓+2H2O _高中化学方程式书写练习四1.用氯化铁与沸水反应制氢氧化铁胶体:FeCl3+3H2O Fe(OH)3(胶体)+3HCl2.硫化氢气体与氯化铁溶液反应:_2FeCl3+H2S=2FeCl2+S↓+2HCl 离子方程式:__2Fe3++H2S=2Fe2++S↓+2H+_3.硫化亚铁与盐酸反应:FeS+2HCl=FeCl2+H2S↑4.四氧化三铁溶于浓盐酸:__ Fe3O4+8HCl=2FeCl3+FeCl2+4H2O _ 离子方程式:Fe3O4+8H+=2Fe3++Fe2++4H2O5.硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:___ 2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O______离子方程式:_2Fe2++H2O2+2H+=2Fe3++2H2O6.硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:___10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O ____ 离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O7.氧化铁溶于氢碘酸溶液:___ Fe2O3+6HI=2FeI2+I2+3H2O_____离子方程式:Fe2O3+2I-+6H+=2Fe2++I2+3H2O8.氯化铁溶液中滴加少量硫化钠溶液:2FeCl3+Na2S=2FeCl2+S↓+2NaCl离子方程式:_2Fe3++S2–=S↓+2Fe2+_9.氯化铁溶液中滴加过量硫化钠溶液:2FeCl3+3Na2S=2FeS↓+S↓+6NaCl离子方程式:___2Fe3++3S2–=2FeS↓+S↓____10.硅与氧气加热:_ Si+O2SiO2_11.硅与氟气:_ Si+2F2=SiF4 __12.硅单质与氢氟酸反应:_ Si+4HF=SiF4↑+2H2↑ __13.硅与氢氧化钠溶液反应:Si+2NaOH+H2O=Na2SiO3+2H2↑14.二氧化硅与氢氟酸反应:4HF+SiO2=SiF4↑+2H2O15.二氧化硅与氧化钙高温反应:SiO 2+CaO 高温 CaSiO 3_ 16.二氧化硅与氢氧化钠溶液反应:SiO 2+2NaOH =Na 2SiO 3+H 2O _ 离子方程式: SiO 2+2OH -=SiO 32-+H 2O 17.二氧化硅与碳反应:SiO 2+2C 高温Si +2CO ↑氧化剂:___ SiO 2__ 还原剂:_ C ___18.硅酸钠与盐酸反应:Na 2SiO 3+2HCl =H 2SiO 3↓+2NaCl 离子方程式:SiO 32-+2H +=H 2SiO 3↓_19.往硅酸钠溶液中通入少量二氧化碳:Na 2SiO 3+CO 2+H 2O =H 2SiO 3↓+Na 2CO 3_离子方程式:__ SiO 32-+CO 2+H 2O =H 2SiO 3↓+CO 32- ____20.往硅酸钠溶液中通入过量二氧化碳:Na 2SiO 3+2CO 2+2H 2O =H 2SiO 3↓+2NaHCO 3_离子方程式:_ SiO 32-+2CO 2+2H 2O =H 2SiO 3↓+2HCO 3- ____21.二氧化硅与纯碱反应:_ SiO 2+Na 2CO 3高温 Na 2SiO 3+CO 2↑ 22.二氧化硅与石灰石反应:SiO 2+CaCO 3 高温 CaSiO 3+CO 2↑23.加热硅酸:_ H 2SiO 3SiO 2+H 2O24.向碳酸氢钙溶液中加入过量的氢氧化钠:___ Ca(HCO 3)2+2NaOH =CaCO 3↓+2H 2O +Na 2CO 3_________ 离子方程式:2HCO 3-+Ca 2++2OH –=CaCO 3↓+2H 2O +CO 32–25.向碳酸氢钙溶液中加入少量的氢氧化钠:________ __ Ca(HCO 3)2+NaOH =CaCO 3↓+H 2O +Na HCO 3______ 离子方程式:Ca 2++HCO 3-+OH –=CaCO 3↓+H 2O26.碳酸氢铵溶液中加入过量氢氧化钠溶液:NH 4HCO 3+2Na OH =NH 3↑+ Na 2CO 3+2H 2O离子方程式: NH 4++HCO 3-+2OH –=NH 3↑+CO 32–+2H 2O高中化学方程式书写练习五1.水煤气的制取:_ C+H2O 高温CO+H2_____________2.用氢气还原四氯化硅: 2H2+SiCl4 Si+4HCl_3.碳酸氢镁溶液中加少量氢氧化钙:_ Mg(HCO3)2+Ca(OH)2=CaCO3↓+MgCO3↓+2H2O___离子方程式:Mg2++2HCO3–+Ca2++2OH–=CaCO3↓+MgCO3↓+2H2O 4.碳酸氢镁溶液中加过量氢氧化钙:Mg(HCO3)2+2Ca(OH)2=2CaCO3↓+Mg(OH)2↓+2H2O离子方程式:Mg2++2HCO3–+2Ca2++4OH–=2CaCO3↓+Mg(OH)2↓+2H2O 5.实验室制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O_离子方程式:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O氧化剂:___ MnO2____ 还原剂:_ HCl____6.高锰酸钾固体加入浓盐酸:2KMnO4+16HCl(浓)=2KCl+ 2MnCl2+5Cl2↑+8H2O离子方程式:_ 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O7.钠在氯气中燃烧:_2Na+Cl2 2NaCl_8.铜在氯气中燃烧:__ Cu+Cl2 CuCl2__9.氢气在氯气中燃烧:_ H2+Cl2 2HCl_氧化剂:___ Cl2_____ 还原剂:___ H2____10.磷与少量氯气反应:__ 2P+3Cl2 2PCl3_______11.硅与氯气在高温下反应:_ Si+2Cl2高温SiCl4 __12.氯气和水反应:_ Cl2+H2O=HCl+HClO 离子方程式:_ Cl2+H2O=H++Cl-+HClO氧化剂:____ Cl2____ 还原剂:___ Cl2____13.次氯酸光照分解:2HClO 2HCl+O2↑_14.氯水中通入二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl离子方程式:Cl2+SO2+2H2O=4H++SO42-+2Cl-氧化剂:___ Cl2___ 还原剂:__ SO2_____15.氯气与冷氢氧化钠溶液:Cl2+2NaOH=NaCl+NaClO+H2O离子方程式:_ Cl2+2OH-=Cl-+ClO-+H2O_16.氯气与热的氢氧化钠溶液:3Cl2+6NaOH5NaCl+NaClO3+3H2O 离子方程式:_ 3Cl2+6OH-5Cl-+ClO3-+3H2O _17.工业生产漂白粉:_2Ca(OH)2 +2Cl2=Ca(ClO)2+CaCl2+2H2O18.向漂白粉溶液中加入稀盐酸:Ca(ClO)2+2HCl=CaCl2+2HClO离子方程式:___ ClO-+H+=HClO_________19.次氯酸钙溶液中通入少量二氧化碳:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO离子方程式:__ Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO__20.次氯酸钙溶液中通入过量二氧化碳:Ca(ClO)2+2CO2+2H2O=Ca(HCO3)2+2HClO离子方程式:_ClO-+CO2+H2O=HCO3-+HClO21.次氯酸钙溶液通入SO2:Ca(ClO)2+SO2+H2O=CaSO4↓+HCl+HClO 离子方程式:Ca2++2ClO-+SO2+H2O=CaSO4↓+Cl-+H++HClO22.氯气通入碳酸氢钠溶液:__ Cl2+NaHCO3=NaCl+CO2+HClO___离子方程式:Cl2+HCO3-=Cl-+CO2+HClO23.氯气通入溴化钾溶液:Cl2+2KBr=Br2+2KCl离子方程式:Cl2+2Br-=Br2+2Cl-24.氯气通入碘化钾溶液:Cl2+2KI=I2+2KCl离子方程式:Cl2+2I-=I2+2Cl-25.溴水和碘化钾溶液反应:Br2+2KI=I2+2KBr离子方程式:_ Br2+2I-=I2+2Br-26.一氧化碳和一氧化氮反应:2CO+2NO N2+2CO2高中化学方程式书写练习六1.氯化钠和硝酸银溶液:AgNO3+NaCl=AgCl↓+NaNO3离子方程式:_ Ag++Cl-=AgCl↓_2.溴化钠和硝酸银溶液:AgNO3+NaBr=AgBr↓+NaNO3离子方程式:_ Ag++Br-=AgBr↓_3.碘化钠和硝酸银溶液:_ AgNO3+NaI=AgI↓+NaNO3离子方程式:Ag++I-=AgI↓4.氟气与水反应:2F2+2H2O=4HF+O2 _5.氟气与氢气反应:__ F2+H2=2HF____6.F2与NaOH溶液反应:_2F2+4NaOH=4NaF+O2+2H2O离子方程式:2F2+4OH-=4F-+O2+2H2O7.溴化银分解:_ 2AgBr2Ag+Br2__8.氯酸钾与浓盐酸:__ KClO3+6HCl=KCl+3Cl2↑+3H2O____ 离子方程式:ClO3-+5Cl-+6H+=3Cl2↑+3H2O氧化剂:__ KClO3__ 还原剂:_ HCl__9.溴化亚铁溶液通入足量氯气:2FeBr2+3Cl2=2FeCl3+2Br2离子方程式:_2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl–_ 10.溴化亚铁溶液通入少量氯气:6FeBr2+3Cl2=2FeCl3+4FeBr3离子方程式:_2Fe2++Cl2=2Fe3++2Cl–_11.等物质的量的溴化亚铁溶液与氯气:6FeBr2+6Cl2=4FeCl3+2FeBr3+3Br2离子方程式:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl–12.碘化亚铁溶液通入足量氯气:2FeI2+3Cl2=2I2+2FeCl3离子方程式:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-13.碘化亚铁溶液通入少量氯气:FeI2+Cl2=I2+FeCl2离子方程式:2I-+Cl2=I2+2Cl-14.硫在空气中燃烧:_ S+O2SO2_氧化剂:___ O2____ 还原剂:___ S___15.硫与氢气加热:_ S+H2H2S_氧化剂:____ S__ 还原剂:____ H2____16.硫与铜反应:_2Cu+S Cu2S17.二氧化硫与水:_ SO2+H2O H2SO3__18.二氧化硫与氧化钙:SO2+CaO=CaSO3___19.少量SO2与氢氧化钠:__2NaOH+SO2=Na2SO3+H2O __离子方程式:_2OH-+SO2=SO32-+H2O__20.过量SO2与氢氧化钠:__ NaOH+SO2=NaHSO3__离子方程式:__ OH-+SO2=HSO3-21.澄清石灰水通入少量SO2:_ Ca(OH)2+SO2=CaSO3↓+H2O _22.澄清石灰水通入过量SO2:_ Ca(OH)2+2SO2=Ca(HSO3)2 _23.二氧化硫与硫化氢:_ SO2+2H2S=3S↓+2H2O _氧化剂:____ SO2____ 还原剂:__ H2S____24.SO2的催化氧化:___2SO2+O2催化剂加热2SO3_ _氧化剂:__ O2___ 还原剂:___ SO2__25.Na2SO3与氧气反应:_2Na2SO3+O2=2Na2SO4__26.硫酸铜与氢氧化钡溶液反应:Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓离子方程式:_ Ba2++2OH–+Cu2++SO42–=BaSO4↓+Cu(OH)2↓ _高中化学方程式书写练习七1.亚硫酸钠和硫酸反应:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O __2.三氧化硫和水反应:_ SO3+H2O=H2SO4____3.三氧化硫与氧化钙:_ SO3+CaO=CaSO4_4.三氧化硫与氢氧化钙:__ Ca(OH)2+SO3=CaSO4↓+H2O___5.铜与浓硫酸反应:_ Cu+2H2SO4 (浓)CuSO4 +2H2O+SO2↑氧化剂:____ H2SO4____ 还原剂:__ Cu____6.碳与浓硫酸反应:_ C+2H2SO4(浓) 2H2O+CO2↑+2SO2↑氧化剂:_____ H2SO4__ 还原剂:___ C___7.硫与浓硫酸反应:_ S+2H2SO4 (浓)2H2O+3SO2↑_8.硫化氢与浓硫酸反应: H2S+H2SO4(浓)=2H2O+SO2↑+S↓_氧化剂:___ H2SO4____ 还原剂:__ H2S____9.硫酸铜溶液中通入硫化氢:____ H2S+CuSO4=CuS↓+H2SO4________ 离子方程式:__ H2S+Cu2+=CuS↓+2H+_10.锌与稀硫酸:Zn+H2SO4=ZnSO4 +H2↑离子方程式:___ Zn+2H+=Zn2++H2↑_________11.锌与浓硫酸:Zn+2H2SO4 (浓)=ZnSO4 +2H2O+SO2↑12.亚硫酸溶液中加入氯水:_ H2SO3+Cl2+H2O=2HCl+ H2SO4离子方程式:_ H2SO3+Cl2+H2O=4H++2Cl-+SO42-13.亚硫酸溶液中加入氯化铁:H2SO3+2FeCl3+H2O=2FeCl2+2HCl+H2SO4离子方程式:_ H2SO3+2Fe3++H2O=4H++2Fe2++SO42-_14.亚硫酸溶液中加入双氧水:__ H2SO3+H2O2=H2SO4+H2O ______离子方程式:H2SO3+H2O2=2H++H2O+SO42-15.亚硫酸钠溶液中加入溴水:__ Na2SO3+H2O+Br2= Na2SO4+2HBr__离子方程式:_ SO32-+H2O+Br2=SO42-+2Br-+2H+_16.亚硫酸钠溶液中加入双氧水:_ Na2SO3+H2O2= Na2SO4+H2O __离子方程式:_ SO32-+H2O2=SO42-+H2O _17.硫溶于热的氢氧化钠溶液:_3S+6NaOH2Na2S+Na2SO3+3H2O 离子方程式:_3S+6OH-2S2-+SO32-+3H2O _18.铜屑与稀硫酸和过氧化氢三者反应:Cu+H2O2+H2SO4=CuSO4+2H2O 离子方程式:_ Cu+H2O2+2H+=Cu2++2H2O _19.黄铁矿(FeS2)与氧气反应:4FeS2+11O2高温2Fe2O3+8SO2__20.用氨水吸收少量二氧化硫: _ SO2+2NH3+H2O=(NH4)2SO3___离子方程式:SO2+2NH3+H2O=2NH4+SO321.用氨水吸收过量二氧化硫:_ SO2+NH3+H2O=NH4HSO3_离子方程式:_ SO2+NH3+H2O=NH4+HSO3_22.向饱和碳酸氢钙溶液中加饱和氢氧化钙溶液:Ca(HCO3)2+Ca(OH)2=2CaCO3↓+2H2O离子方程式:Ca2++HCO3-+OH-=CaCO3↓+H2O__23.等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:Ba(OH)2+NH4HCO3=BaCO3↓+H2O+NH3·H2O______离子方程式:Ba2++2OH–+NH4++HCO3-=BaCO3↓+H2O+NH3·H2O __ 24.硫酸氢钠溶液与氢氧化钡反应至中性:2NaHSO4+Ba(OH)2=2H2O+BaSO4↓+Na2SO4离子方程式:2H++SO42–+2OH–+Ba2+=2H2O+BaSO4↓25.硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀:NaHSO4+Ba(OH)2=H2O+BaSO4↓+NaOH离子方程式:H++SO42–+OH–+Ba2+=BaSO4↓+H2O高中化学方程式书写练习八1.氮气和氧气反应:_ N 2+O 2 2NO ___2.工业合成氨:__ N 2+3H 2 催化剂 高温高压 2NH 3__氧化剂:____ N 2____ 还原剂:__ H 2______3.一氧化氮与氧气反应:_2NO +O 2=2NO 2 __4.NO 2溶于水:__3NO 2+H 2O =2HNO 3+NO ______氧化剂:____ NO 2____ 还原剂:___ NO 2____5.氨气和氯化氢:___ HCl +NH 3=NH 4Cl___6.氨的催化氧化:__4NH 3+5O 2 4NO +6H 2O _ 氧化剂:____ O 2_____ 还原剂:___ NH 3____7.氯化铵受热分解: __ NH 4Cl NH 3↑+HCl ↑_8.碳酸氢铵受热分解:___ NH 4HCO 3 NH 3↑+H 2O ↑+CO 2↑___9.硝酸铵和NaOH :__ NH 4NO 3+NaOHNaNO 3+NH 3↑+H 2O ___ 离子方程式:__ NH 4++OH -NH 3↑+H 2O __10.实验室制氨气:_2NH 4Cl +Ca(OH)2CaCl 2+2NH 3↑+2H 2O _ 11.浓硝酸与铜反应:_4HNO 3(浓)+Cu = Cu(NO 3)2+2NO 2↑+2H 2O 离子方程式:_4H ++2NO 3-+Cu Cu 2++2NO 2↑+2H 2O _ 12.稀硝酸与铜反应:_8HNO 3(稀)+3Cu = 3Cu(NO 3)2+2NO ↑+4H 2O 离子方程式:8H ++2NO 3-+3Cu3Cu 2++2NO ↑+4H 2O 13.碳与浓硝酸反应:C +4HNO 3(浓) 2H 2O +CO 2↑+4NO 2↑ 放电。
(新教材)2020年高中化学第一册化学方程式练习(有答案)
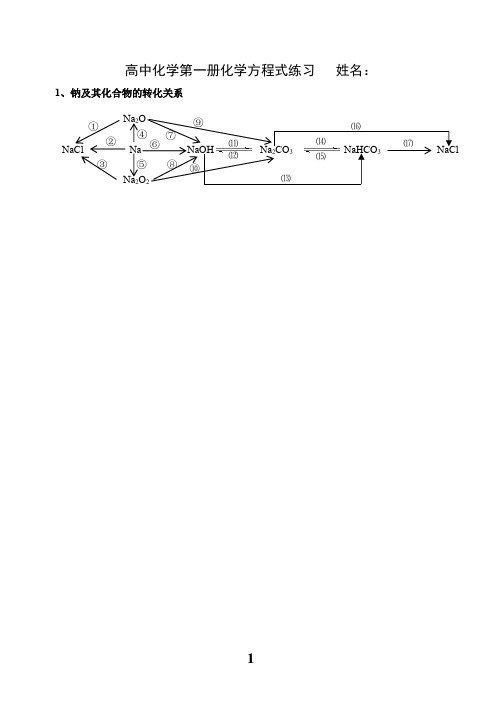
高中化学第一册化学方程式练习 姓名:1、钠及其化合物的转化关系NaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂⒃ ⒄ ④2、氯及其化合物的转化关系CuCl 2 HClO HCl Cl 2 FeCl 3NaClOCa(ClO)2 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩3、铁及其化合物的转化关系Fe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 FeCl 3 Fe(OH)3 Fe 2O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾⑿ ⒁ ⒀高中化学第一册化学方程式答案1、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O△△NaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂⒃ ⒄ ④2、氯及其化合物的转化关系①2Fe +3Cl 22FeCl 3 ②Cu +Cl 2CuCl 2③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓)MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl-Mn 2++Cl 2↑+2H 2O※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClO点燃点燃△△CuCl 2 HClO HCl Cl 2 FeCl 3 NaClOCa(ClO)2 ① ② ③④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 点燃或光照 光照光照3、铁及其化合物的转化关系①Fe 3O 4+4CO3Fe +4CO 2 ※② 3Fe +4H 2O(g)Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2 Fe 3O 4Fe +2H +=Fe 2++H 2↑ ④2Fe +3Cl 22FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2O※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3△高温点燃点燃△Fe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 FeCl 3 Fe(OH)3 Fe 2O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾⑿ ⒁ ⒀。
(word完整版)高考陌生情景中化学方程式的书写技巧与真题训练

高考陌生情景中化学方程式的书写技巧与真题训练陌生情景中的化学方程式书写,首先要根据材料中的信息写出反应物和生成物的化学式,然后再配平即可。
配平要遵循质量守恒定律(原子守恒、元素守恒、物料守恒),对于氧化还原反应还要遵循得失电子数相等即得失电子守恒规律,对于离子反应还要遵循电荷守恒规律。
【解题技巧】关键结合题目信息、流程图信息并熟记常见的氧化产物和还原产物判断生成物。
1. 熟记常见的氧化剂及对应的还原产物、还原剂及对应的氧化产物2.掌握书写信息型氧化还原反应的步骤(3步法)第1步:根据氧化还原顺序规律确定氧化性最强的为氧化剂,还原性最强的为还原剂;根据化合价规律及题给信息和已知元素化合物性质确定相应的还原产物、氧化产物;根据氧化还原反应的守恒规律确定氧化剂、还原剂、还原产物、氧化产物的相应化学计量数。
第2步:根据溶液的酸碱性,通过在反应方程式的两端添加H+或OH-的形式使方程式的两端的电荷守恒。
第3步:根据原子守恒,通过在反应方程式两端添加H2O(或其他小分子)使方程式两端的原子守恒。
3.氧化还原反应方程式的配平:步骤:①标出化合价变化了的元素的化合价。
②列变化:分别标出化合价升高数和化合价降低数③根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。
④利用元素守恒,观察配平其他物质4.“补缺”的技巧(1)可能出现的情况:H+→H2O(酸性)、OH-→H2O(碱性)、H2O→H+(中性或酸性)、H2O→OH-(中性或碱性)(2)绝不可能出现的情况:H+→OH- 或者OH-→H+题型1 氧化还原反应型的化学方程式和离子方程式的书写1、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。
纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
反应②中除掉的杂质离子是__________,发生反应的离子方程式为_________________。
高中化学离子方程式书写汇总练习题

高中化学离子方程式书写汇总练习题1、氯化钠溶液滴加硝酸银溶液,写出离子方程式:NaCl(aq) + AgNO3(aq) → AgCl(s) + NaNO3(aq)2、钠与水反应,写出化学方程式:2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)3、钠与硫酸铜溶液,写出离子方程式:CuSO4(aq) + 2Na(s) → Cu(s) + Na2SO4(aq)4、过氧化钠与水反应,写出化学方程式:2Na2O2(s) + 2H2O(l) → 4NaOH(aq) + O2(g)5、碳酸氢盐溶液与强酸溶液混合,写出化学方程式:HCO3-(aq) + H+(aq) → CO2(g) + H2O(l)6、碳酸氢盐溶液与醋酸溶液混合,写出化学方程式:HCO3-(aq) + CH3COOH(aq) → CO2(g) + H2O(l) +CH3COO-(aq)7、氢氧化钙溶液与碳酸氢镁反应,写出离子方程式:Ca(OH)2(aq) + Mg(HCO3)2(aq) → Mg(OH)2(s) +2CaCO3(s) + 2H2O(l)8、向碳酸氢钙溶液中加入过量的氢氧化钠,写出化学方程式:Ca(HCO3)2(aq) + 2NaOH(aq) → Ca(OH)2(s) +2NaHCO3(aq)9、向碳酸氢钙溶液中加入少量的氢氧化钠,写出化学方程式:Ca(HCO3)2(aq) + NaOH(aq) → CaCO3(s) + NaHCO3(aq) +H2O(l)10、澄清石灰水与少量小苏打溶液混合,写出化学方程式:Ca(OH)2(aq) + NaHCO3(aq) → CaCO3(s) + NaOH(aq) +H2O(l)11、澄清石灰水通入少量CO2,写出化学方程式:Ca(OH)2(aq) + CO2(g) → CaCO3(s) + H2O(l)12、澄清石灰水通入过量CO2,写出化学方程式:Ca(OH)2(aq) + 2CO2(g) → CaCO3(s) + H2O(l)13、碳酸氢钠溶液与少量石灰水反应,写出化学方程式:NaHCO3(aq) + Ca(OH)2(aq) → CaCO3(s) + NaOH(aq) +H2O(l)14、碳酸氢钠溶液与过量石灰水反应,写出化学方程式:2NaHCO3(aq) + Ca(OH)2(aq) → CaCO3(s) + 2NaOH(aq) + H2O(l)15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合,写出离子方程式:Ba(OH)2(aq) + 2NH4HCO3(aq) → BaCO3(s) + 2NH3(g) + 3H2O(l)16、碳酸钠溶液与盐酸反应,写出化学方程式:Na2CO3(aq) + 2HCl(aq) → 2NaCl(aq) + CO2(g) + H2O(l)17、向氢氧化钠溶液中通入少量的CO2,写出化学方程式:2NaOH(aq) + CO2(g) → Na2CO3(aq) + H2O(l)18、过量的CO2通入氢氧化钠溶液中,写出化学方程式:NaOH(aq) + CO2(g) → NaHCO3(aq)19、碳酸氢铵溶液中加入过量氢氧化钠溶液,写出化学方程式:NH4HCO3(aq) + NaOH(aq) → NaHCO3(aq) + NH3(g) +H2O(l)20、碳酸钙与盐酸反应,写出化学方程式:CaCO3(s) + 2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)21、碳酸钙与醋酸反应,写出化学方程式:CaCO3(s) + 2CH3COOH(aq) → Ca(CH3COO)2(aq) +CO2(g) + H2O(l)22、澄清石灰水与稀盐酸反应,写出化学方程式:Ca(OH)2(aq) + 2HCl(aq) → CaCl2(aq) + 2H2O(l)23、磷酸溶液与少量澄清石灰水,写出化学方程式:H3PO4(aq) + 3Ca(OH)2(aq) → Ca3(PO4)2(s) + 6H2O(l)24、磷酸溶液与过量澄清石灰水,写出化学方程式:H3PO4(aq) + 6Ca(OH)2(aq) → Ca5(PO4)3OH(s) + 6H2O(l)25、碳酸镁溶于强酸,写出化学方程式:MgCO3(s) + 2HCl(aq) → MgCl2(aq) + CO2(g) + H2O(l)26、硫酸镁溶液跟氢氧化钡溶液反应,写出离子方程式:MgSO4(aq) + Ba(OH)2(aq) → Mg(OH)2(s) + BaSO4(s)27、硫酸溶液跟氢氧化钡溶液反应,写出离子方程式:H2SO4(aq) + Ba(OH)2(aq) → BaSO4(s) + 2H2O(l)28、硫酸氢钠溶液与氢氧化钡反应至中性,写出化学方程式:2NaHSO4(aq) + Ba(OH)2(aq) → BaSO4(s) + 2H2O(l) +2NaOH(aq)29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀,写出离子方程式:2NaHSO4(aq) + Ba(OH)2(aq) → BaSO4(s) + 2H2O(l) +2NaOH(aq)30、硫酸铝溶液中加入过量氢氧化钡溶液,写出离子方程式:Al2(SO4)3(aq) + 3Ba(OH)2(aq) → 2Al(OH)3(s) + 3BaSO4(s)31、氢氧化镁与稀硫酸反应,写出化学方程式:Mg(OH)2(s) + H2SO4(aq) → MgSO4(aq) + 2H2O(l)32、铝跟氢氧化钠溶液反应,写出化学方程式:2Al(s) + 2NaOH(aq) + 6H2O(l) → 2NaAl(OH)4(aq) + 3H2(g)33、物质的量之比为1:1NaAl合金置于水中,写出化学方程式:Na(s) + Al(s) + 3H2O(l) → NaAl(OH)4(aq) + 1.5H2(g)34、氧化铝溶于强碱溶液,写出化学方程式:Al2O3(s) + 2NaOH(aq) + 3H2O(l) → 2NaAl(OH)4(aq)35、氧化铝溶于强酸溶液,写出化学方程式:Al2O3(s) + 6HCl(aq) → 2AlCl3(aq) + 3H2O(l)36、氢氧化铝与氢氧化钠溶液,写出化学方程式:Al(OH)3(s) + NaOH(aq) → NaAl(OH)4(aq)37、氢氧化铝与盐酸溶液反应,写出化学方程式:Al(OH)3(s) + 3HCl(aq) → AlC l3(aq) + 3H2O(l)38、硫酸铝溶液与碳酸氢钠溶液,写出化学方程式:Al2(SO4)3(aq) + 3NaHCO3(aq) → Al2(CO3)3(s) +3Na2SO4(aq) + 3H2O(l) + 3CO2(g)39、硫酸铝溶液与碳酸钠溶液,写出化学方程式:Al2(SO4)3(aq) + 3Na2CO3(aq) → Al2(CO3)3(s) +3Na2SO4(aq)40、氯化铝溶液中加入过量氨水,写出离子方程式:AlCl3(aq) + 3NH3(aq) + 3H2O(l) → [Al(NH3)6]Cl3(aq)41、明矾溶液加热水解生成沉淀,写出化学方程式59.当氯化铁溶液与过量氨水反应时,会形成深红色的氢氧化铁胶体。
化学式书写练习[精品文档]
![化学式书写练习[精品文档]](https://img.taocdn.com/s3/m/bc54d12110a6f524ccbf85fd.png)
化学式练习(一)(书写)一、单质:氟气氦气磷银钠氯气氖气镁钡锰碘氩气铝金氧气碳铁汞氮气硅铜铅氢气硫锌钾二、氧化物:水五氧化二磷氧化铁二氧化硫氧化镁氧化亚铁三氧化硫氧化钙四氧化三铁二氧化碳氧化锌氧化铜一氧化碳氧化铝氧化亚铜盐酸硫酸碳酸硝酸磷酸氢氧化钠氢氧化镁氢氧化铜氢氧化钾氢氧化铝氨水氢氧化钙氢氧化铁氢氧化钡氢氧化亚铁四、盐:硝酸钾氯化钾硫酸钾硝酸钠氯化钠硫酸钠硝酸钡氯化钡硫酸钡硝酸钙氯化钙硫酸钙硝酸镁氯化镁硫酸镁硝酸铝氯化铝硫酸铝硝酸锌氯化锌硫酸锌硝酸铁氯化铁硫酸铁硝酸亚铁氯化亚铁硫酸亚铁硝酸铜氯化铜硫酸铜硝酸银氯化银硫酸银硝酸铵氯化铵硫酸铵碳酸钾碳酸锌碳酸钠碳酸铁高锰酸钾碳酸钡碳酸亚铁锰酸钾碳酸钙碳酸铜亚硫酸钠碳酸镁碳酸银亚硝酸钠碳酸铝碳酸铵碳酸氢钙硫酸氢钠五、有机物甲烷乙醇一、单质:氟气F2氦气He 磷P 银Ag 钠Na 氯气Cl2氖气Ne 镁Mg 钡Ba 锰Mn 碘I2氩气Ar 铝Al 金Au氧气O2碳 C 铁Fe 汞Hg氮气N2硅Si 铜Cu 铅Pb氢气H2硫S 锌Zn 钾K水H2O 五氧化二磷P2O5氧化铁Fe2O3二氧化硫SO2氧化镁MgO 氧化亚铁FeO三氧化硫SO3氧化钙CaO 四氧化三铁Fe3O4二氧化碳CO2氧化锌ZnO 氧化铜CuO一氧化碳CO 氧化铝Al2O3氧化亚铜Cu2O 三、酸:盐酸HCl 硫酸H2SO4碳酸H2CO3硝酸HNO3磷酸H3PO4氢氧化钠NaOH 氢氧化镁Mg(OH)2氢氧化铜Cu(OH)2氢氧化钾KOH 氢氧化铝Al(OH)3氨水NH3·H2O 氢氧化钙Ca(OH)2 氢氧化铁Fe(OH)3氢氧化钡Ba(OH)2 氢氧化亚铁Fe(OH)2五、盐:硝酸钾KNO3氯化钾KCl 硫酸钾K2SO4硝酸钠NaNO3氯化钠NaCl 硫酸钠Na2SO4 硝酸钡Ba(NO3)2氯化钡BaCl2硫酸钡Ba SO4硝酸钙Ca(NO3)2氯化钙CaCl2硫酸钙Ca SO4硝酸镁Mg(NO3)2氯化镁MgCl2硫酸镁Mg SO4硝酸铝Al(NO3)3氯化铝AlCl3硫酸铝Al2(SO4)3硝酸锌Zn(NO3)2氯化锌ZnCl2硫酸锌Zn SO4硝酸铁Fe(NO3)3氯化铁FeCl3硫酸铁Fe2(SO4)3硝酸亚铁Fe(NO3)2氯化亚铁FeCl2硫酸亚铁Fe SO4硝酸铜Cu(NO3)2氯化铜CuCl2硫酸铜Cu SO4硝酸银AgNO3氯化银AgCl 硫酸银Ag2SO4硝酸铵NH4NO3氯化铵NH4Cl 硫酸铵(NH4)2SO4碳酸钾K2CO3碳酸锌ZnCO3 碱式碳酸铜Cu2(OH)2CO3碳酸钠Na2CO3碳酸铁Fe2(CO3)3高锰酸钾KMnO4碳酸钡Ba CO3碳酸亚铁Fe CO3锰酸钾K2MnO4碳酸钙Ca CO3碳酸铜Cu CO3亚硫酸钠Na2SO3碳酸镁Mg CO3碳酸银Ag2CO3亚硝酸钠NaNO2碳酸铝Al2(CO3)3碳酸铵(NH4)2CO3碳酸氢钙Ca(HCO3)2硫酸氢钠NaHSO4磷酸氢二铵(NH4)2HPO4磷酸二氢钾KH2PO4甲烷CH4甲醇CH3OH 乙醇C2H5OH 乙酸CH3COOH 尿素CO(NH2)2名称俗称化学式名称俗称化学式胆矾(蓝矾)食盐铜绿酒精金刚石醋酸石墨冰醋酸干冰纯碱熟石灰灰锰氧消石灰水银烧碱、火碱、苛性钠生石灰小苏打物质主要或有效成分名称主要或有效成分化学式物质主要或有效成分名称主要或有效成分化学式石灰水生铁、钢盐酸铁锈水煤气赤铁矿天然气、沼气磁铁矿大理石、石灰石菱铁矿化学式练习(二)俗称参考答案名称俗称化学式名称俗称化学式五水硫酸铜胆矾(蓝矾)CuSO4·5H2O 氯化钠食盐NaCl碱式碳酸铜铜绿Cu2(OH)2CO3乙醇酒精C2H5OH ——金刚石 C 乙酸醋酸CH3COOH ——石墨 C 无水乙酸冰醋酸CH3COOH 二氧化碳(固体) 干冰CO2碳酸钠纯碱Na2CO3氢氧化钙熟石灰Ca(OH)2高锰酸钾灰锰氧KMnO4消石灰汞水银Hg氢氧化钠烧碱NaOH氧化钙生石灰CaO 火碱碳酸氢钠小苏打NaHCO3苛性钠物质主要或有效成分名称主要或有效成分化学式物质主要或有效成分名称主要或有效成分化学式石灰水氢氧化钙Ca(OH)2生铁、钢铁Fe 盐酸氢氯酸HCl 铁锈氧化铁Fe2O3水煤气氢气、一氧化碳H2、CO 赤铁矿氧化铁Fe2O3天然气、沼气甲烷CH4磁铁矿四氧化三铁Fe3O4大理石、石灰石碳酸钙CaCO3菱铁矿碳酸亚铁FeCO3碘酒中的溶质是(碘)。
(完整word版)高中化学方程式书写练习(附答案)

高中化学方程式书写练习一1. 钠块在空气中变暗:____________________________________________2. 钠在空气中燃烧:_______________________________________________3. 钠与熔融四氯化钛(TiCI 4)反应:_________________________________4. 钠与水反应:_______________________________________________离子方程式:__________________________________5. 钠与硫酸反应:_________________________________离子方程式:___________________________6. 钠与硫酸铜溶液:_______________________________________________7. 氧化钠与水反应:__________________________________________ ___8. 氧化钠与盐酸反应:_________________________________离子方程式:___________________________9. 过氧化钠与盐酸反应:__________________________________________离子方程式:_________________ ________10. 过氧化钠与二氧化碳反应:_____________________________________氧化剂:__________ 还原剂:___________11. 过氧化钠与水反应:____________________________________________离子方程式:____________________________12. 过氧化钠与二氧化硫反应:_______________________________________13. 电解熔融氯化钠:_______________________________________________14. NaOH溶液中通入少量CO: _______________________离子方程式:__________________________15. NaOH溶液中通入过量CO: _______________________离子方程式:16. 碳酸钠与氢氧化钙:_________________________________高中化学方程式书写练习一离子方程式:___________________________ __________________________ 17. 碳酸氢钠与盐酸:___________________________________离子方程式:______________ ___________ __________________________ 18. 碳酸氢钠溶液与醋酸溶液混合:_________________________________离子方程式:______________ __________ _______________________ 19. 除去碳酸钠溶液中的碳酸氢钠:_________________________________离子方程式:______________________________________________________20. 除去碳酸钠固体中的碳酸氢钠:_________________________________21. 除去碳酸氢钠溶液中混有的碳酸钠:_____________________________离子方程式:______________ __________ __________________________ 22. 用碳酸钠溶液吸收过量SO: ___________________________________离子方程式:_____________________ ________________________23. 用碳酸钠溶液吸收少量SQ: ___________________________________离子方程式:___________________________ _______________________ 24. 向碳酸钠溶液滴入少量稀盐酸:____________________________________离子方程式:______________________________________________________ 25. 向碳酸钠溶液滴入过量稀盐酸:____________________________________离子方程式:______________________________________________________ 26. 碳酸钙与醋酸反应: ______________________________________________离子方程式:______________________________________________________1. 铝与氧气的反应:____________________________________2. 铝与氧化铁反应(铝热反应):_________________________________氧化剂:____________ 还原剂:______________3. 铝和稀盐酸:_____________________________________________离子方程式:____________________________________________4. 铝和NaOH溶液:___________________________________________离子方程式:____________________________________________5. 氧化铝和稀硫酸:___________________________________________离子方程式:_____________________________________6. 氧化铝和NaOH溶液:_______________________________________离子方程式:_____________________________________7. 氢氧化铝和盐酸:____________________________________离子方程式:_____________________________________8. 氢氧化铝和NaOH溶液:____________________________________离子方程式:____________________________________________9. 氢氧化铝受热分解:_____________________________________10. 硫酸铝与过量氨水反应:____________________________________离子方程式:________________________________________11. AICI 3溶液中加入少量NaOH溶液:_______________________________离子方程式:_______________________________________________12. AICI 3溶液中加入过量NaOH溶液:__________________________________离子方程式:__________________________________________高中化学方程式书写练习一13. 偏铝酸钠溶液中加入少量HCI: ____________________________________19. 明矶溶液中加入少量氢氧化钡溶液:________________________离子方程式:_________________________________________20. 明矶溶液中加入过量氢氧化钡溶液:_________________________________离子方程式:_________________________________________21. 碳酸氢钠溶液与少量石灰水反应:_______________________________离子方程式:_________________________________________22. 碳酸氢钠溶液与过量石灰水反应:_______________________________离子方程式:_________________________________________23. 鉴别碳酸钠和碳酸氢钠溶液:_______________________________________离子方程式:_________________________________________24. 电解熔融氯化镁: _______________________________________________25. 镁与热水反应: _________________________________________________26. 碳酸氢钙溶液与醋酸反应:_________________________________________离子方程式:高中化学方程式书写练习一1. 铁与氧气反应:__________________________________________2. 铁与硫反应:____________________________________氧化剂:__________________ 还原剂:____________________3. 铁在氯气中燃烧:____________________________________________氧化剂:__________________ 还原剂:____________________4. 铁与碘反应:__________________________________5. 铁与盐酸反应:__________________________________________离子方程式:_________________________________6. 铁与氯化铜溶液:____________________________________________离子方程式:_________________________________7. 铁和水蒸气:_____________________________________________氧化剂:_______________ 还原剂:________________8. 氧化亚铁与盐酸反应:___________________________________________离子方程式:_____________________________________ ____ ______9. 氧化铁与盐酸反应:_______________________________________离子方程式:__________________________________________________10. CO 还原氧化铁:_________________________________________________11. 磁铁矿与一氧化碳反应:___________________________________________12. 氯化铁与氢氧化钠溶液:____________________________________离子方程式:_____________________________________12. __________________________________________________ 硫酸亚铁与氢氧化钠溶液:______________________________________________离子方程式:_____________________________________ 14. 氢氧化铁加热分解:离子方程式:15. 氢氧化亚铁在空气中被氧化:________________________________________高中化学方程式书写练习一16. 除去FeCl2 中的FeCb:_____________________________________离子方程式:________________________________氧化剂:_______________ 还原剂:________________17. FeCl 2和Cl 2反应:_________________________________________离子方程式:______________________________________18. FeCl 3和Cu反应: _________________________________________离子方程式:___________________________________氧化剂:_______________ 还原剂:________________19. 氯化铁与硫氰化钾溶液反应:________________________________________20. 氯化铁溶液中滴加少量碘化钾溶液:__________________________________离子方程式:___________________________________21. 氯化铁溶液跟过量氨水反应:________________________________________离子方程式:___________________________________22. 氯化铁溶液跟少量锌粉反应:_________________________________________离子方程式:___________________________________23. 氯化铁溶液跟过量锌粉反应:________________________________________离子方程式:___________________________________24. 镁在二氧化碳中燃烧: ______________________________氧化剂:_______________ 还原剂:________________25. 镁与氮气反应: ________________________________氧化剂:_______________ 还原剂:________________26. 硫酸溶液跟氢氧化钡溶液反应:______________________________________离子方程式:高中化学方程式书写练习一1. 用氯化铁与沸水反应制氢氧化铁胶体:_________________________________2. 硫化氢气体与氯化铁溶液反应:_______________________________________离子方程式:___________________________________________3. 硫化亚铁与盐酸反应:____________________________________________4. 四氧化三铁溶于浓盐酸:_______________________________________离子方程式:________________________________________________5. 硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:______________________离子方程式:________________________________________________6. ____________________________________________________ 硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:_____________________________离子方程式:_____________________________________________________ 7. 氧化铁溶于氢碘酸溶液:________________________________________离子方程式:___________________________________________8. 氯化铁溶液中滴加少量硫化钠溶液:________________________________离子方程式:___________________________________________9. 氯化铁溶液中滴加过量硫化钠溶液:________________________________离子方程式:___________________________________________10. 硅与氧气加热:_______________________________11. 硅与氟气:_____________________________12. 硅单质与氢氟酸反应:________________________________13. 硅与氢氧化钠溶液反应:____________________________________14. 二氧化硅与氢氟酸反应:__________________________________________离子方程式:15. 二氧化硅与氧化钙高温反应:_______________________________________16. 二氧化硅与氢氧化钠溶液反应:_____________________________________离子方程式:___________________________________________17. 二氧化硅与碳反应:____________________________________________氧化剂:_______________ 还原剂:_______________18. 硅酸钠与盐酸反应:____________________________________离子方程式:___________________________________________19. 往硅酸钠溶液中通入少量二氧化碳:_______________________________离子方程式:___________________________________________20. 往硅酸钠溶液中通入过量二氧化碳:_______________________________离子方程式:___________________________________________21. 二氧化硅与纯碱反应:_________________________________________22. 二氧化硅与石灰石反应:____________________________ _ ________23. 加热硅酸: _____________________________ _____24. 向碳酸氢钙溶液中加入过量的氢氧化钠:___________________________离子方程式:___________________________________________25. ___________________________________________ 向碳酸氢钙溶液中加入少量的氢氧化钠:__________________________________离子方程式:___________________________________________26. ________________________________________________________ 碳离子方程式:酸氢铵溶液中加入过量氢氧化钠溶液_____________________________________ 离子方程式:高中化学方程式书写练习五1. 水煤气的制取: ____________________________________________2. 用氢气还原四氯化硅: _______________________________________3. 碳酸氢镁溶液中加少量氢氧化钙:__________________________________离子方程式:_______________________________________4. 碳酸氢镁溶液中加过量氢氧化钙:__________________________________离子方程式:_______________________________________5. 实验室制氯气: ____________________________________________离子方程式:_______________________________________氧化剂:______________ 还原剂: ______________6. 高锰酸钾固体加入浓盐酸:________________________________________离子方程式:___________________________________________7. 钠在氯气中燃烧: __________________________________________8. 铜在氯气中燃烧: __________________________________________9. 氢气在氯气中燃烧: ________________________________氧化剂:______________ 还原剂: ______________10. 磷与少量氯气反应: _____________________________________11. 硅与氯气在高温下反应: ______________________________________12. 氯气和水反应: ___________________________________离子方程式:_______________________________________________氧化剂:______________ 还原剂: ______________13. 次氯酸光照分解: _________________________________________14. 氯水中通入二氧化硫: _____________________________________离子方程式:氧化剂:______________ 还原剂: ______________15. 氯气与冷氢氧化钠溶液: ________________________________________离子方程式:_________________________________________16. 氯气与热的氢氧化钠溶液: ______________________________________离子方程式:____________________________17. 工业生产漂白粉: ________________________________________________18. 向漂白粉溶液中加入稀盐酸: _______________________________________离子方程式:______________________________________19. 次氯酸钙溶液中通入少量二氧化碳: _________________________________离子方程式:______________________________________20. 次氯酸钙溶液中通入过量二氧化碳: __________________________________离子方程式:______________________________________21. 次氯酸钙溶液中通入SO2: _______________________________离子方程式:______________________________________22. 氯气通入碳酸氢钠溶液: ________________________________________离子方程式:______________________________________23. 氯气通入溴化钾溶液: _____________________________________离子方程式:______________________________________24. 氯气通入碘化钾溶液: _____________________________________离子方程式:______________________________________25. 溴水和碘化钾溶液反应: ______________________________________离子方程式:______________________________________26. 一氧化碳和一氧化氮反应: ________________________________________高中化学方程式书写练习一1. 氯化钠和硝酸银溶液: ____________________________________离子方程式:__________________________________2. 溴化钠和硝酸银溶液: __________________________________离子方程式:__________________________________3. 碘化钠和硝酸银溶液: _______________________________离子方程式:__________________________________4. 氟气与水反应: _______________________________________5. 氟气与氢气反应: _______________________________________6. F 2与NaOH溶液反应:_____________________________________离子方程式:__________________________________7. 溴化银分解:____________________________________________8. 氯酸钾与浓盐酸:______________________________________________离子方程式:____________________________________________氧化剂:______________ 还原剂: _____________9. 溴化亚铁溶液通入足量氯气:_________________________________离子方程式:__________________________________10. 溴化亚铁溶液通入少量氯气:________________________________离子方程式:__________________________________11. 等物质的量的溴化亚铁溶液与氯气:__________________________________离子方程式:__________________________________12. 碘化亚铁溶液通入足量氯气:________________________________离子方程式:____________________________________________13. 碘化亚铁溶液通入少量氯气:________________________________离子方程式:___________________________________________14. 硫在空气中燃烧: ________________________________________氧化剂:______________ 还原剂: ______________15. 硫与氢气加热: _______________________________________氧化剂:______________ 还原剂: ______________16. 硫与铜反应: ______________________________________17. 二氧化硫与水: ____________________________________________18. 二氧化硫与氧化钙: ________________________________________19. 少量SO2 与氢氧化钠: ___________________________________离子方程式:______________________________________20. 过量SO2 与氢氧化钠: ___________________________________离子方程式:___________________________________________21. 澄清石灰水通入少量SO2: _______________________________22. 澄清石灰水通入过量SO2: _______________________________23. 二氧化硫与硫化氢: ______________________________氧化剂:______________ 还原剂: ______________24.SO2 的催化氧化:__________________________________________氧化剂:______________ 还原剂: ______________25.Na 2SO3 与氧气反应:________________________________________26. 硫酸铜与氢氧化钡溶液反应:________________________________________离子方程式:___________________________________________高中化学方程式书写练习一1. 亚硫酸钠和硫酸反应: _____________________________________________2. 三氧化硫和水反应: ___________________________________________3. 三氧化硫与氧化钙: _______________________________4. 三氧化硫与氢氧化钙: __________________________________5. 铜与浓硫酸反应: ________________________________________________氧化剂:______________ 还原剂: ______________6. 碳与浓硫酸反应: ________________________________________________氧化剂:______________ 还原剂: ______________7. 硫与浓硫酸反应: ________________________________________8. 硫化氢与浓硫酸反应: _______________________________________________氧化剂:______________ 还原剂: ______________9. 硫酸铜溶液中通入硫化氢:_________________________________________离子方程式:______________________________________10. 锌与稀硫酸: ________________________________________离子方程式:______________________________________11. 锌与浓硫酸: ________________________________________12. 亚硫酸溶液中加入氯水: _________________________________________离子方程式:______________________________________13. 亚硫酸溶液中加入氯化铁: _________________________________________离子方程式:______________________________________14. 亚硫酸溶液中加入双氧水: _________________________________________离子方程式:______________________________________15. 亚硫酸钠溶液中加入溴水: _________________________________________离子方程式:______________________________________16. 亚硫酸钠溶液中加入双氧水:________________________________________离子方程式:______________________________________17. 硫溶于热的氢氧化钠溶液:_______________________________________离子方程式:______________________________________18. 铜屑与稀硫酸和过氧化氢三者反应:__________________________________离子方程式:______________________________________19. 黄铁矿(FeS 2)与氧气反应:______________________________________20. 用氨水吸收少量二氧化硫:__________________________________________离子方程式:______________________________________21. 用氨水吸收过量二氧化硫:__________________________________________离子方程式:______________________________________22. 向饱和碳酸氢钙溶液中加饱和氢氧化钙溶液:__________________________离子方程式:______________________________________23. 等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:离子方程式:______________________________________24. 硫酸氢钠溶液与氢氧化钡反应至中性:________________________________离子方程式:______________________________________25. 硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀:______________________离子方程式:______________________________________高中化学方程式书写练习一1. 氮气和氧气反应: __________________________________2. 工业合成氨: _________________________________________氧化剂:______________ 还原剂: ______________3. 一氧化氮与氧气反应: __________________________________4. _______________________________________________ NO2 溶于水: _________________________________________________________氧化剂:______________ 还原剂: ______________5. 氨气和氯化氢: __________________________________________6. 氨的催化氧化: ______________________________________________氧化剂:______________ 还原剂: ______________7. 氯化铵受热分解: ____________________________________________8. 碳酸氢铵受热分解: __________________________________________9. 硝酸铵和NaOH:______________________________离子方程式:_______________________________________10. 实验室制氨气: _____________________________________________11. 浓硝酸与铜反应: _______________________________________离子方程式:_______________________________________12. 稀硝酸与铜反应: ______________________________________________离子方程式:_______________________________________13. 碳与浓硝酸反应: ___________________________________________氧化剂:______________ 还原剂: ______________14. 浓硝酸见光分解: ______________________________________________15. ______________________________________________________ NO2、O2 混合气通入水中无剩余气体:____________________________________ 16. ______________________________________________________ N0、02同时通入水中无剩余气体:_______________________________________17. 少量单质铁溶于稀硝酸中(NO): _____________________________高中化学方程式书写练习一离子方程式:__________________________________________________ 18. 过量单质铁溶于稀硝酸中(NO): _______________________________离子方程式:__________________________________________________ 19. Fe(NO3)3溶液中加入过量HI溶液:____________________________离子方程式:__________________________________________________ 20. Fe 304与稀HNO反应: _______________________________________离子方程式:__________________________________________________ 21. FeS放入稀硝酸溶液中:________________________________________离子方程式:__________________________________________________ 22.SO2通入BaCb和HNO昆合溶液中的反应:________________________离子方程式:__________________________________________________ 23. 将NO和NO的混合气体通入烧碱溶液中: ________________________24. NO2通入氢氧化钠溶液: ______________________________________离子方程式:__________________________________________________ 25. 澄清石灰水通入少量CQ: __________________________________离子方程式:__________________________________________________ 26. 澄清石灰水通入过量CO: __________________________________离子方程式:__________________________________________________16.碳酸钠与氢氧化钙:Na2CO+ Ca(0H)2= CaCO j + 2NaOH1. 钠块在空气中变暗:4Na + Q= 2N@02. 钠在空气中燃烧:2Na + Q 1 Na z Q3. 钠与熔融四氯化钛(TiCI 4)反应:4Na+ TiCI 4 = Ti + 4NaCI4. 钠与水反应:_2Na+ 2H2O=+ H2 f __离子方程式:_2Na+ 2H2Q= 2Na+ + 2QH + H f _5. 钠与硫酸反应:2Na+ H2SQ= NaaSQ+ H2 f离子方程式:2Na+ 2』=2Na+ + H2 f6. 钠与硫酸铜溶液:2Na+ 2H2O+ CuSd N@SQ+ H2 f + Cu(QH)2 J7. 氧化钠与水反应:_ Na2Q+ HaQ= 2NaQH8. 氧化钠与盐酸反应:NaQ>+ 2HCI = 2NaCI+ HQ离子方程式:Na2Q+ 2H+ = 2Na++ H2Q9. 过氧化钠与盐酸反应:2N@Q + 4HCI= 4NaCI+ 2HQ+ Q2f离子方程式:_2N@Q+ 4H+ = 4Na+ + 2fO+ Q f10. 过氧化钠与二氧化碳反应:2N Q Q+ 2CQ = 2N Q CQ+ Q氧化剂:NaO 还原剂:NaO11. 过氧化钠与水反应:2NaO+ 2HzQ= 4NaQ+ Q f离子方程式:_2N@Q+ 2"0= 4Na+ + 4QH + Q f _12. 过氧化钠与二氧化硫反应:N Q Q+ SQ= N Q SQ13. 电解熔融氯化钠:2NaCI(熔融)" 2Na+ C^f14. NaOH溶液中通入少量CQ: 2NaQ+ CQ= Na^CQ + H2Q离子方程式:2QH + CQ= CQ2「+ fQ _15. NaOH溶液中通入过量CQ: NaQF+ CQ= NaHCQ高中化学方程式书写练习一离子方程式:QH + CQ= HCQ16.碳酸钠与氢氧化钙:Na2CO+ Ca(0H)2= CaCO j + 2NaOH离子方程式:2_ 2+CO + Ca = CaCOj17.碳酸氢钠与盐酸:NaHCa HCl = NaCI+ H20+ CO f离子方程式:HCQ + H = H2O+ CO f18. 碳酸氢钠溶液与醋酸溶液混合:NaHCO + CHCOOH= CHCOON住H2O + CO f19.除去碳酸钠溶液中的碳酸氢钠:NaHC硏NaOH= N@CO+ HO离子方程式:HCQ + OH = H2O+ CQ2-20. 除去碳酸钠固体中的碳酸氢钠:2NaHCO - Na2CO+ H2O+ CO f21. 除去碳酸氢钠溶液中混有的碳酸钠:N&CO+ H2O+ CO = 2NaHCO离子方程式:2- -CO3 + HO+ CO = 2HCO22.用碳酸钠溶液吸收过量SO: Na t CO+ H2O+ 2SO= 2NaHS囲CQ离子方程式:2_ _CO3 + H2O+ 2SO = 2HSO + CO23.用碳酸钠溶液吸收少量SO: N Q CO+ SO = N Q SO+ CO离子方程式:2- 2-CO3 + SQ = SO3 + CO24.向碳酸钠溶液滴入少量稀盐酸:NaaCO+ HCI= NaHC硏NaCI离子方程式:CO32+ H+= HCO25.向碳酸钠溶液滴入过量稀盐酸:NazCO+ 2HCI= 2NaCI+ H2O+ CO f离子方程式:2_ + .CO3 + 2H = H2O+ CO f26.碳酸钙与醋酸反应:CaCO+ 2CHCOOI4 (CH3COO2Ca+ HO+ CO f离子方程式:CaCO3+ 2CHCOO= 2CHCO3 Ca i++ HO+ CO f高中化学方程式书写练习一1.铝与氧气的反应: 4AI + 3Q ' " 2AI 2Q高温 2.铝与氧化铁反应(铝热反应): 2AI + Fe 2Q 3 2Fe + Al 2Q 氧化剂:Fe 2O 3 还原剂: AI3.铝和稀盐酸: 2AI + 6HCI = 2AICI 3+ 3H f 离子方程式: 2AI + 6H =2AI + f 22Q 7.氢氧化铝和盐酸: AI(OH) 3+ 3HCI = AICI 3+ 3HQ离子方程式: 3AI(OH) 3 + 3H = AI + 3fO 8.氢氧化铝和 离子方程式: NaOH 溶液: AI(OH) 3 + NaOH= NaAIQ + 2H 2O AI(OH) 3 +Oh -= AIO 2- + 2H 2O 9.氢氧化铝受热分解:_2AI(OH) 3 Al 2Q + 3HO _ 10.硫酸铝与过量氨水反应:Al 2(SO 4)3 + 6NH • H 2O = 2AI(OH) 3 J + 3(NH 4)2SQ离子方程式:Al 3 + + 3NH • HbO= AI(OH) 3 J + 3NT +11.AICI 3溶液中加入少量 NaOH§液:AICI 3+ 3NaOH= AI(OH) 3 J + 3NaCI离子方程式: 3 + - . AI + 3OH = AI(OH) 3 12.AICI 3溶液中加入过量 NaOH 溶液:AICI 3+ 4NaOH= NaAIQ + 3NaCI + 2HO离子方程式: AI 3 + + 4OH = AIO 2- + 2fO13.偏铝酸钠溶液中加入少量 HCI : NaAIO 2+ HCI + fO= AI(OH) 3 J + NaCI离子方程式:AIO 2-+ H + + HkO = AI(OH) 3 J14. 偏铝酸钠溶液中加入过量HCl: NaAIO2+ 4HCI= AICI 3+ NaCI + 2H2O离子方程式:__ AIO 2 + 4』=Al3+ + 2H2O —15. 往偏铝酸钠溶液中通入少量CO: 2NaAIQ+ 3H2O+ CO= 2AI(OH) 3 J+ NaaCQ离子方程式:_2AIO2一+ 3H2O+ CO = 2AI(OH) 3 J + CO2「16. 往偏铝酸钠溶液中通入过量CO: NaAIO2+ 2H2O+ CQ= AI(OH) 3 J + NaHCO离子方程式:AIO2「+ 2H2O+ CO= AI(OH) 3 J + HC017. 电解熔融氧化铝:2Al2Q(熔融)H 4AI + 3O f _18. 明矶净水原因:AI 3+ + 3H2O AI(OH)19. 明矶溶液中加入少量氢氧化钡溶液:2KAI(SO4)2 + 3Ba(OH)2 =2AI(OH) 3 J+ 3BaSO j + K2SQ离子方程式:2AI3++ 3SO2-+ 3Ba2++ 6OH = 2AI(OH) 3J + 3BaSO j20. 明矶溶液中加入过量氢氧化钡溶液:KAI(SO4)卄2Ba(OH)2 = KAIO2 + 2BaSQ j+ 2H2O离子方程式:A|3+ + 2SO2-+ 2Ba2+ + 4OH=AIO2 + 2BaSO J + 2H2O21. 碳酸氢钠溶液与少量石灰水反应:2NaHCO+ Ca(OH)2 = CaCOj +N@CO+2HO离子方程式:2HC0 + Ca2+ + 2OH = CaCOj+ CO2「+ 2H2O22. 碳酸氢钠溶液与过量石灰水反应NaHCO+ CaQH* CaCOJ + NaOH + H2O离子方程式:HC0 + Ca + OH= CaCOj+ H2O23. 鉴别碳酸钠和碳酸氢钠溶液:Na^CO + CaCl2= CaCO j + 2NaCI离子方程式:_ CQ? + Ca?+ = CaCOJ _24. 电解熔融氯化镁:MgC b(熔融)4川Mg+ Cl2f25. 镁与热水反应:Mg + 2H2O 丄一Mg(OHk + H2f26. 碳酸氢钙溶液与醋酸反应:Ca(HCO)卄2CHCOO= (CfCOOCa+2H2O+ 2CO f离子方程式:-HCO_ + CHCOO= CHCOC+ H2O+ CO f高中化学方程式书写练习一1. 铁与氧气反应:_3Fe + 2Q 仝基Fe s O-2. 铁与硫反应: Fe + S 丄基FeS2Fe + 3CI 2 点愿 2FeCI 3 氧化剂: ―_Ch ________ 还原剂: Fe 4. 铁与碘反应: —Fe + 12 Fel 25. 铁与盐酸反应:_ Fe + 2HCI = FeCb + H 2 f _丄 2丄离子方程式: Fe + 2H = Fe + Hd6. 铁与氯化铜溶液: Fe + CuCl 2= FeCb + Cu离子方程式: Fe += Fe + Cu咼温 7. 铁和水蒸气: _3Fe + 4H0 (g)Fe 3Q + 4H_ 氧化剂: H 2O 还原剂:Fe _____ 8. 氧化亚铁与盐酸反应: FeO + 2HCI = FeCb + HO 离子方程式:_ FeO + 2H = Fe?+ +耳0_9. 氧化铁与盐酸反应: FaQ + 6HCI = 2FeCI 3 + 3H 2O 离子方程式:_ FezQ + 6H = 2Fe + 3HO咼温10. CO 还原氧化铁: _ Fe2Q + 3CO 2Fe + 3CO高温11. 磁铁矿与一氧化碳反应: __ Fe 3O 4+4CO 高 3Fe + 4CO_ 12. 氯化铁与氢氧化钠溶液: FeCb + 3NaOH= Fe(OH )3 J + 3NaCI 离子方程式: _ Fe + 3OH = Fe(OH )3 J12.硫酸亚铁与氢氧化钠溶液:FeSO + 2NaOH= Fe(OH )2 J + Na^SO2 + — 离子方程式:_ Fe + 2OH = Fe(OH )2 J 氧化S 还原剂: Fe3.铁在氯气中燃烧:高中化学方程式书写练习一14. 氢氧化铁加热分解:_2Fe(OH)^= Fe2Q+ 3HzO_15. 氢氧化亚铁在空气中被氧化:4Fe(OH)2+ Q+4Fe(OH)316. 除去FeCl2 中的FeCb:2FeCl s+ Fe= 3FeCL _离子方程式:_2Fe + Fe = 3Fe1 2氧化剂:―FeCI 3_还原剂:_ Fe_17. FeCI 2和Cl 2 反应:_2FeCl2 + Cb= 2FeCI 3_离子方程式:_2Fe2十+ Cl 2= 2Fe3* + 2C「_18. FeCl 3和Cu反应:_2FeCb+ Cu= 2FeCb+ CuCb_离子方程式:_2Fe3十+ Cu= 2Fe2*+ CiT _3NHCI_离子方程式:_ Fe3十+ 3NH・HO= Fe(OH)3〈 + 3NH*_22. 氯化铁溶液跟少量锌粉反应:2FeCb+ Zn= 2FeCI2 + ZnCI2离子方程式:_2Fe3* + Zn= 2Fe2* + Zn2+ __23. 氯化铁溶液跟过量锌粉反应:2FeCI 3+ 3Zn= 2Fe+ 3ZnCI 2离子方程式:5Fe2 ++ MnO + 8』=5Fe3+ + M K++ 4fO7. 氧化铁溶于氢碘酸溶液:___ Fe 2Q + 6HI = 2Fel 2+12+3fO _________ + 2 +离子方程式:Fe2Q+2l_ + 6H = 2Fe + I2 + 3fO8. 氯化铁溶液中滴加少量硫化钠溶液:2FeCl3+ N@S= 2FeCI2+ S J + 2NaCI离子方程式:2Fe'+ + S = S J + 2Fe?+ _9. 氯化铁溶液中滴加过量硫化钠溶液:2FeCI 3+ 3N@S= 2FeS J + S J + 6NaCI离子方程式:2Fe'+ + 3S? = 2FeS J + S J ________10. 硅与氧气加热:_ Si + O^^SiO211. 硅与氟气:Si + 2F2= SiF412. 硅单质与氢氟酸反应:_ Si + 4HF= SiF4f + 2H413. 硅与氢氧化钠溶液反应:Si + 2NaOH+ HaO= NazSiO3+ 2H d14. 二氧化硅与氢氟酸反应:4HF+ SiO2= SiF4f + 2fO高中化学方程式书写练习一 氧化剂: ―FeCI 3 还原剂: Cu19. 氯化铁与硫氰化钾溶液反应: Fe 3+ + 3SCN I = Fe(SCN )320. 氯化铁溶液中滴加少量碘化钾溶液:_2FeCb + 2KI = 2FeCb + 2KCb + I 23亠 一 2亠离子方程式: 2Fe + 21 = 2Fe + I 221. 氯化铁溶液跟过量氨水反应:FeCl 3 + 3NH • HO = Fe(OH )3 J +1. 用氯化铁与沸水反应制氢氧化铁胶体:FeCb+ 3H2O- Fe(0H)3 (胶体)+ 3HCI2. 硫化氢气体与氯化铁溶液反应:_2FeCb+ H b S= 2FeCI 2+ S J + 2HCI离子方程式:_2Fe3++ HbS= 2Fe2 ++ S J + 2H〔3. 硫化亚铁与盐酸反应:FeS+ 2HCI= FeCH HS f4. 四氧化三铁溶于浓盐酸:__ Fe 3O+ 8HCI= 2FeCl s+ FeCa+ 4H2O _I 3 + 2 +离子方程式:Fe s O l 8H = 2Fe + Fe + 4fO5. 硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:2FeSO4+ H2Q+ H2SQ= Fe2(SO4)3+ 2H02 + +3 亠离子方程式:2Fe + H2Q + 2H = 2Fe + 2HO6. 硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:___10FeSQ + 2KMnO+ 8HzSQ= 5Fe2(SO4)3 + 2MnSO+ K2SQ + 8H2O ____________________________________________________________高中化学方程式书写练习一咼温SQ 2+ 2C Si + 2COT氧化剂: Si0 2— 还原剂:__C ________18. 硅酸钠与盐酸反应: N@SiO 3 + 2HCI = H2SQ 3 J + 2NaCI 离子方程式: SQ 3 + 2H = H 2SQ 3 J _19. 往硅酸钠溶液中通入少量二氧化碳:NaSiO 3+ C0+ H0= H 2SiO 3 J + NaC03_2一 2-离子方程式:__SiO 3 + CO + H bO= H 2SQ 3J + CO - _20. 往硅酸钠溶液中通入过量二氧化碳: NazSiQ + 2CO + 2H 2O= H2SQ 3 J + 2NaHCO2 一离子方程式:_ SiO 3 + 2CO + 2fO= H 2SiO 3 J + 2HCO咼温21. 二氧化硅与纯碱反应: _ SiO 2+ NaCO 咼NQSQ 3+ CO f高温 22.二氧化硅与石灰石反应: SQ 2+ CaCOCaSiQ + CO f23. 加热硅酸:_ H z SiO^^ SQ 2+ H 2O24. 向碳酸氢钙溶液中加入过量的氢氧化钠:__ Ca(HCQ) 2+ 2NaOH = CaCOJ + 2H 2O+ Na p CO ________2 + _ 2 _离子方程式:2HCO + Ca + 2OH = CaCOj + 2H 2O + CO 25. 向碳酸氢钙溶液中加入少量的氢氧化钠: ______________ __ Ca(HCQ )2+NaO = CaCOj + H 2O+NHCO_ 咼温 15.二氧化硅与氧化钙咼温反应: SQ 2+ Ca<^^=CaSiO_16.二氧化硅与氢氧化钠溶液反应:SiO 2+ 2NaOH= Ns t SiO a + HO _ 17.二氧化硅与碳反应:离子方程式:c/十 + HCO + OH = CaCOj+ H2O26. 碳酸氢铵溶液中加入过量氢氧化钠溶液:NHHCO+ 2NjOH= NH3f + N@CO+ 2H2O离子方程式:NH4+ + HCO + 2OH = NH f+ CO2-+ 2fO1. 水煤气的制取:_ C + H2O^^ CO~ H __________________2. 用氢气还原四氯化硅:2Hk+ SiCI 4Si + 4HCI_3. 碳酸氢镁溶液中加少量氢氧化钙:_ Mg(HCO)2 + Ca(OH)2 = CaCO J + MgCOj + 2fO2丄_ 2丄_离子方程式:Mg + 2HCO + Ca + 2OH = CaCOj + MgCOj + 2HO4. 碳酸氢镁溶液中加过量氢氧化钙:Mg(HCO>2+ 2Ca(OH)2= 2CaCOj + Mg(OH》J + 2HzO2丄_ 2丄_离子方程式:Mg + 2HCO + 2Ca + 4OH = 2CaCOj+ Mg(OH)4+ 2fO5. 实验室制氯气:MnO+ 4HCI(浓)MnCl 2+ Cl 2 f + 2H2O离子方程式:MnO+ 4』+ 2CI 也=Mn2++ Cl 2 f + 2H2O氧化剂:___MnQ 还原剂:HCI6. 高锰酸钾固体加入浓盐酸:2KMnO+ 16HCI(浓)=2KCI+ 2MnCI2 +5CI2T + 8H2O离子方程式:2Mn OT+ 16』+ 10C「= 2M6++ 5Cl2f + 8fO7. 钠在氯气中燃烧:_2Na+ Cl 2亠丄2NaCI_8. 铜在氯气中燃烧:Cu + Cl 2 諛CuCI 29. 氢气在氯气中燃烧:_ H2+ CI2 2HCI_氧化剂:―CI 2 还原剂:H2高中化学方程式书写练习一10. 磷与少量氯气反应:2P + 3CI2 2PCI3 _______________一咼温11. 硅与氯气在高温下反应:_ Si + 2CI2 SiCI 4 _12. 氯气和水反应:_ CI 2+ H2O= HCI + HCIO离子方程式:Cl 2 + HO= H + Cl + HCIO氧化剂:__CI 2_ 还原剂:_ CI 2_13. 次氯酸光照分解:2HCI0 垒丄2HCI + Q f _14. 氯水中通入二氧化硫:CI2+ SQ+ 2H2O= H2SQ+ 2HCI离子方程式:CI2+ SQ+ 2H2Q= 4H+ + SQ2「+ 2CI「氧化剂:—CI 2 还原剂:SQ215. 氯气与冷氢氧化钠溶液:CI2+ 2NaQH= NaCI+ NaCIQ+ H2Q离子方程式:Cl 2 + 2QH= C「+ CIQ「+ HQ16. 氯气与热的氢氧化钠溶液:3Cb + 6NaQH“ 5NaCI + NaCIQ+ 3HQ离子方程式:3CI 2+ 6Q^^= 5C「+ CIQ3「+ 3HQ17. 工业生产漂白粉:_2Ca(QH)2 + 2CI2= Ca(CIQ) 2 + CaC“+ 2HQ18. 向漂白粉溶液中加入稀盐酸:Ca(CIQ) 2+ 2HCI= CaCb+ 2HCIQ离子方程式:—CIQ「+』=HCIQ ______________19. 次氯酸钙溶液中通入少量二氧化碳:Ca(CIQ) 2+ CQ+ fQ= CaCQ j+ 2HCIQ2+ 一离子方程式:Ca + 2CIQ + CQ + HQ= CaCQj + 2HCIQ20. 次氯酸钙溶液中通入过量二氧化碳:Ca(CIQ)2 + 2CQ + 2fQ= Ca(HCQ)2 + 2HCIQ离子方程式:CIQ 一+ CQ+ HQ= HCQ一+ HCIQ21. 次氯酸钙溶液通入SQ: Ca(CIQ) 2+ SQ+ HQ= CaSQJ + HCI + HCIQ2+ _ _ 丄离子方程式:Ca + 2CIQ_ + SQ+ HQ= CaSQ j + Cl_ + H+ HCIQ22. 氯气通入碳酸氢钠溶液:_ Cl 2 + NaHCQ= NaCI+ CQ+ HCIQ___离子方程式:Cl 2+ HCQ = Cl + CQ+ HCIQ23. 氯气通入溴化钾溶液:Cl2+ 2KBr= B“+ 2KCI离子方程式:CI2+ 2Br「= B Q+ 2CI 一24. 氯气通入碘化钾溶液:CI2+ 2KI = 12+ 2KCI离子方程式:CI2+ 21 = 12+ 2CI25. 溴水和碘化钾溶液反应:B“+ 2KI = I2+ 2KBr离子方程式:Br 2 + 21 = 12 + 2BrL圧北柚I。
高一化学化学方程式编写练习题及答案

高一化学化学方程式编写练习题及答案1. 将下列化学反应用化学方程式表示,并标明该反应属于氧化还原反应、酸碱反应、还是置换反应。
(1) 氯气与氢气反应生成盐酸。
(2) 硫酸与铜反应生成硫酸铜。
(3) 锌与硫酸反应生成氢气和硫酸锌。
(4) 氢氧化钠与盐酸反应生成氯化钠和水。
答案:(1) 2HCl + Cl2 → 2HCl属于氧化还原反应。
(2) Cu + H2SO4 → CuSO4 + H2O属于氧化还原反应。
(3) Zn + H2SO4 → ZnSO4 + H2属于氧化还原反应。
(4) 2NaOH + HCl → 2NaCl + H2O属于酸碱反应。
2. 写出下列化学方程式的化学式,并标明反应物和生成物的物态。
(1) 氢气与氧气反应生成水。
(2) 二氧化碳溶于水生成碳酸溶液。
(3) 金属钠与水反应生成氢气和氢氧化钠溶液。
(4) 氢氧化铝溶液与盐酸反应生成氯化铝溶液和水。
答案:(1) 2H2(g) + O2(g) → 2H2O(l)反应物的物态:氢气和氧气为气体。
生成物的物态:水为液体。
(2) CO2(g) + H2O(l) → H2CO3(aq)反应物的物态:二氧化碳为气体,水为液体。
生成物的物态:碳酸溶液为溶液。
(3) 2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)反应物的物态:金属钠为固体,水为液体。
生成物的物态:氢氧化钠溶液为溶液,氢气为气体。
(4) Al(OH)3(aq) + 3HCl(aq) → AlCl3(aq) + 3H2O(l)反应物的物态:氢氧化铝溶液和盐酸均为溶液。
生成物的物态:氯化铝溶液为溶液,水为液体。
3. 编写化学方程式,表示以下化学反应。
(1) 锌和二氧化碳反应生成碳酸锌。
(2) 铝和氯气反应生成三氯化铝。
(3) 氯化铝与氢气反应生成氯化氢和铝。
(4) 钙和硫酸反应生成硫酸钙和氢气。
答案:(1) Zn + CO2 → ZnCO3(2) 2Al + 3Cl2 → 2AlCl3(3) AlCl3 + 3H2 → Al + 3HCl(4) Ca + H2SO4 → CaSO4 + H2以上是高一化学化学方程式编写的练习题及答案。
高一必修二化学方程式全练习

高一必修二化学方程式全练习(知识点总结)第一章物质结构元素周期律1、Li与O2反应(点燃)____________________________________________________ P6Na与O2反应(点燃)____________________________________________________ P6Na与H2O反应:P6 K与H2O反应:P6 2、卤素单质F2、Cl2、Br2、I2与氢气反应、、P83、卤素单质间的置换反应:(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:①②P9(2)溴水与碘化钠溶液反应:P94、Mg与H2O反应:P155、Mg、Al与HCl反应:P166、Na与Cl2、反应(点燃):P217、用电子式表示氯化钠的形成过程:P22用电子式表示氯分子的形成过程:P22用电子式表示氯化氢的形成过程:P22用电子式表示下列分子:H2N2H2OCO2CH4P22第二章化学反应与能量1、Ba(OH)2·8H2O与NH4Cl的反应P33NaOH与HCl的反应:P33 2、原电池原理:典型的原电池(Zn-Cu原电池)负极(锌):(氧化反应)正极(铜):(还原反应)电子流动方向:由锌经过外电路流向铜。
总反应离子方程式:P41 3、H2O2在催化剂作用下受热分解:P484、高炉炼铁:;P50第三章有机化合物1、甲烷的主要化学性质(1)氧化反应(与O2的反应):P61 (2)取代反应(与Cl2在光照条件下的反应,生成四种不同的取代物):P62①②③④2、乙烯的主要化学性质(1)氧化反应(与O2的反应):P68(2)加成反应((与Br2的反应): P68(3)乙烯还可以和氢气、氯化氢、水等发生加成反应:P68①②③(4)聚合反应:P68(乙烯制聚乙烯) ①(氯乙烯制聚氯乙烯)②3、苯的主要化学性质: P69(1)氧化反应(与O2的反应):(2)取代反应: ________________________________________________①与Br2的反应:②苯与硝酸(用HONO2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。
高三化学方程式书写练习

高三化学方程式书写练习2017.10.181.Na与H2O反应离子方程式:2.Na2O2与CO2反应化学方程式:3.Na2O2与H2O反应化学方程式:离子方程式为:4.(1)酸性条件下,H2O2使KMnO4褪色离子方程式:(2)碱性条件下,MnO4-被还原成MnO2,离子方程式为:5.NaOH溶液中通入少量CO2离子方程式:6.NaOH溶液中通入过量CO2离子方程式:7.饱和Na2CO3溶液与CO2反应化学方程式:离子方程式为:8.向盐卤中加入NaClO将Fe2+氧化,使它变成Fe(OH)3沉淀而除去。
该反应的离子方程式是:9.用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式是:10.Na2CO3溶液逐滴加入少量HCl反应离子方程式:11.Na2CO3溶液与足量HCl反应离子方程式:12.NaHCO3溶液与NaOH溶液反应离子方程式:13.NaHCO3溶液与盐酸反应离子方程式:14.(1)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为:(2)若在强酸性溶液中,Na2S2O3会发生分解,其离子方程式为:15. ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。
写出该反应的离子方程式:16.NaHCO3溶液与足量Ca(OH)2溶液反应离子方程式:17.NaHCO3溶液与少量Ca(OH)2溶液反应离子方程式:18.Mg与CO2在高温条件下的反应化学方程式:19.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。
一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式_______________________________________________。
20.MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的化学方程式为__________________________________________________________________________21.Al与NaOH溶液反应化学方程式:,离子方程式:22.Al2O3与盐酸反应离子方程式:23.Al2O3与NaOH反应离子方程式:24.NaHSO3溶液与酸性KMnO4溶液反应离子方程式:25.用氯酸钠(NaClO3)和硫酸酸化的H2O2反应生成ClO2。
高中化学方程式总结练习和答案(直接印)

高中化学方程式总结练习化合反应金属单质+非金属单质钠在氯气中燃烧:在硫粉中研磨金属钠:镁在氯气中燃烧:镁在氮气中燃烧:铁在氯气中燃烧:在硫蒸气中加热铁:在碘蒸气中加热铁:铜在氯气中燃烧:在硫蒸气中加热铜:金属单质+氧气钠在常温下与氧气反应:钠在加热时与氧气反应:镁在空气中燃烧:铝在氧气中燃烧:铁在氧气中燃烧:在空气中加热铜:非金属单质+氧气碳在空气中不完全燃烧:碳在空气中完全燃烧:一氧化碳在空气中燃烧:氮气与氧气在高压电作用下:一氧化氮在空气中变红棕色:硅在氧气中燃烧:磷在氧气中燃烧:硫在氧气中燃烧:二氧化硫与氧气在五氧化二钒催化下反应:非金属单质+非金属单质工业合成氨反应:氢气在空气中燃烧:氢气与氟气在黑暗中爆炸:氢气在氯气中燃烧:在硫蒸气中加热氢气:在溴蒸气中加热氢气:在碘蒸气中持续加热氢气:磷在氯气中不完全燃烧:三氯化磷与氯气化合:金属氧化物+非金属氧化物氧化钠与二氧化碳:氧化钙与二氧化碳:氧化钙与二氧化硫:氧化钙与二氧化硅:金属氧化物+水氧化钠放入水中:生石灰放入水中:氧化镁放入热水:非金属氧化物+水二氧化碳使石蕊变红:五氧化二磷溶于冷水:五氧化二磷溶于热水:二氧化硫溶于水:三氧化硫溶于水:置换反应金属单质→非金属单质实验室制氢气:金属镁与醋酸:二氧化碳不能扑灭镁火的原因:镁与饱和氯化铵溶液反应:钠与水反应:钠与硫酸铜溶液反应:活泼金属→不活泼金属湿法炼铜:铝与四氧化三铁反应:活泼非金属→不活泼非金属氯气通入溴化钠溶液中:氯水滴入碘化钾淀粉溶液中:氧气通入氢硫酸溶液中:氯气通入氢硫酸溶液中:氟气通入水中:溴水使淀粉碘化钾试纸变蓝:工业制备粗硅:氢气、木炭、一氧化碳还原氧化物、氯化物一氧化碳和赤铁矿炼铁:氢气高温还原三氧化钨:木炭还原氧化铜:制备水煤气:一氧化碳与水蒸气反应:氢气与四氯化硅制取高纯硅:复分解反应(包括某些不变价的类复分解反应)金属氧化物+酸氧化铜放入稀硫酸中微热:盐酸除铁锈:氧化铝溶于稀硝酸中:四氧化三铁溶于浓盐酸中:非金属氧化物+酸氢氟酸刻蚀玻璃:金属氧化物+碱三氧化二铝溶于氢氧化钠溶液中:氧化锌溶于氢氧化钾溶液中:氧化铍溶于氢氧化钡溶液中:非金属氧化物+碱少量二氧化碳通入氢氧化钠溶液中:过量二氧化碳通入氢氧化钠溶液中:少量二氧化碳通入澄清石灰水中:过量二氧化碳通入澄清石灰水中:少量二氧化硫通入氢氧化钠溶液中:过量二氧化硫通入氢氧化钠溶液中:氢氧化钠溶液不能放在磨口玻璃塞的试剂瓶中:氢氧化钠吸收五氧化二磷白烟:氢氧化钠吸收三氧化硫:氢氧化钠吸收五氧化二氮:酸+碱向酚酞试液中滴入氢氧化钠溶液变红,加入稀盐酸后又褪色:醋酸溶液与氢氧化钠溶液反应:苯酚浊液滴入氢氧化钠溶液后变澄清:硅酸溶于氢氧化钠溶液:氢氧化铜溶于醋酸溶液:氢氧化铁溶于稀硝酸:少量硫化氢通入氢氧化钠溶液:过量硫化氢通入氢氧化钠溶液:氢氧化铝(铝酸)溶于氢氧化钠溶液:酸+盐实验室制取二氧化碳:实验室制取二氧化硫:实验室制取硫化氢:实验室制取氯化氢气体:盐酸逐滴加入碳酸钠溶液中至过量:碳酸钠溶液滴入盐酸中:碳酸氢钠溶液加入醋酸溶液中:碳酸钠溶液滴入醋酸溶液中:盐酸滴入醋酸钠溶液中:硫化氢气体通入硫化钠溶液中:二氧化碳通入碳酸钠溶液中:少量二氧化硫气体通入亚硫酸钠溶液中:少量二氧化硫通入碳酸钠溶液中:一定量的二氧化硫通入碳酸钠溶液中:过量二氧化硫通入碳酸钠溶液中:少量的二氧化硫通入碳酸氢钠溶液中:过量的二氧化硫通入碳酸氢钠溶液中:二氧化碳通入次氯酸钠溶液中:漂白粉在空气中失效:少量二氧化碳通入水玻璃中:过量二氧化碳通入水玻璃中:少量二氧化碳通入偏铝酸钠溶液中:二氧化碳通入偏铝酸钠溶液中:碱+盐实验室制氨气:制备新制氢氧化铜:氢氧化钠滴入氯化铁中出现红褐色沉淀:氢氧化钠溶液滴入硫酸亚铁溶液中出现白色沉淀,迅速变成灰绿色进而到红褐色:向硝酸银溶液中滴加稀氨水制备银氨溶液:过量氨气通入到氯化镁溶液中:氨气通入到明矾溶液中:氢氧化钠逐滴滴入到氯化铝溶液中至过量:氯化铝逐滴滴入到氢氧化钠溶液中至过量:氢氧化钙溶液与碳酸钠溶液反应:氢氧化钡溶液与硫酸钾溶液反应:氢氧化钡溶液与硫酸铵溶液反应:氢氧化钠溶液与碳酸氢钠溶液反应:氢氧化钙溶液与碳酸氢钙溶液反应:氢氧化钡溶液与少量硫酸氢钠溶液反应:氢氧化钡溶液与过量硫酸氢钠溶液反应:氢氧化钠溶液与少量碳酸氢钙溶液反应:氢氧化钠溶液与过量碳酸氢钙溶液反应:氢氧化钙溶液与少量碳酸氢钠溶液反应:氢氧化钙溶液与过量碳酸氢钠溶液反应:盐+盐氯化钙溶液与碳酸钠溶液反应:硫酸钾溶液与硝酸钡溶液反应:氯化镁溶液与硝酸银溶液反应:硫化钠溶液与硫酸铜溶液反应:硫酸铝溶液与碳酸钠溶液反应:硫酸铝溶液与碳酸氢钠溶液反应:氯化铁溶液与碳酸钾溶液反应:氯化铁溶液与碳酸氢钠溶液反应:氯化铵溶液与水玻璃反应:硝酸铝溶液与偏铝酸钠溶液反应:明矾溶液与硫化钾溶液反应:分解反应难溶碱热分解加热氢氧化铜:加热氢氧化镁:加热氢氧化铁:加热氢氧化铝:不稳定酸热分解碳酸分解:亚硫酸分解:硅酸分解:铵盐分解氯化铵分解:溴化铵分解:碳酸铵分解:碳酸氢铵分解:弱酸盐、弱酸氢盐分解煅烧石灰石:碳酸氢钠分解:碳酸氢钙分解:氧化还原反应常见的氧化剂及其还原产物:活泼的非金属单质:F2→F-;O3→O2-+O2;Cl2→Cl-;O2→O2-;Br2→Br-;I2→I-;S →S2-含高价元素的化合物或离子:S2O82—→SO42-;FeO42-→Fe3+;BiO3-→Bi3+;PbO2→Pb2+;MnO4-→MnO42-(碱性)、MnO2(弱酸性或中性)、Mn2+(强酸性);Cr2O72-→Cr3+(酸性)、CrO2-(碱性);HNO3→NO2(浓)、NO(稀)、N2O(更稀)、N2(特稀)、NH4+(极稀);H2SO4→SO2(浓)、H2(稀);Fe3+→Fe2+次卤酸根:ClO-→Cl-(其它为还原剂)、Cl2(Cl-做还原剂)氧化性强弱排序:F2>O3>S2O82—>PbO2>ClO->MnO4->Cl2>Cr2O72-、CrO42->H2O2>HNO3>O2>Br2>Fe3+>Cu2+>I2>H2SO4>S氧化性越强的氧化剂,其还原产物的还原性越弱!常见的还原剂及其氧化产物:活泼的金属单质:M→M n+含低价元素的化合物或离子:S2-→S;I-→I2;Br-→Br2;Cl-→Cl2;NH3→N2(一般);NO(催化)某些非金属单质:H2→H+;C→CO;CO2;Si→4 Si;既做氧化剂,又做还原剂的物质(元素处于中间价):氧化产物Fe3+SO2、SO32-、SO42-SO3、H2SO4O2IO3-MnO4-中间价态的物质Fe2+SSO2、SO32-、H2SO3H2O2、Na2O2I2MnO2NO还原产物Fe S2-S H2O、OH-I-Mn2+NO 表现的主要性质还原性还原性还原性氧化性氧化性氧化性氧还原性强弱排序:S2->SO2、SO32-、H2SO3>I->Fe2+>Br->Cl-还原剂的还原性越强,其氧化产物的氧化性越弱!碱里一般发生歧化反应(中间价元素既升价又降价),酸里一般发生归中反应(不同价的相同元素既升价又降价至同一中间价)。
(完整版)高中化学方程式书写练习

1.碳酸氢铵受热分解2.氯气与水反响3.将二氧化氮和氧气的混淆气体通入水中4.硅与氢氧化钠溶液反响5.硫与铜反响6.二氧化硅与氢氟酸反响7.硫酸氢钠在水中电离8.乙烯与溴化氢反响9.苯的硝化反响10.实验室制甲烷高中化学方程式书写练习(二)1.硫化氢气体与氯化铁溶液反响2.氧化铝与烧碱溶液反响3.二氧化硫与硫化氢反响4.氯气与铜反响5.硫与浓硫酸反响6.过氧化钠与水反响7.红磷与白磷的互相转变8.苯与液溴反响9.乙醇的消去反响10.乙酸甲酯的水解高中化学方程式书写练习(三)1.铝与烧碱溶液反响2.氮气与镁反响3.氨气与氯化氢反响4.氧气与臭氧的转变5.氧化钠与盐酸反响6.溴化银分解7.二氧化硅与碳反响8.实验室制乙炔9.苯的焚烧10.由甲苯制取 TNT1.实验室制氯气2.浓硝酸分解3.磷与少许氯气反响4.二氧化硅与碳酸钙反响5.氟气与水反响6.过氧化钠与二氧化碳反响7.往氯化铝溶液中滴入过度的烧碱溶液8.乙烯与水反响9.制取聚氯乙烯10.苯酚钠溶液与二氧化碳反响高中化学方程式书写练习(五)1.铁与稀硝酸反响2.硫化氢与浓硫酸反响3.二氧化氮与水反响4.镁与二氧化碳反响5.往偏铝酸钠溶液中滴入少许盐酸6.二氧化硅与氢氧化钠反响7.铜与氯化铁溶液反响8.乙烯与氢气反响9.苯酚与氢氧化钠反响10.乙醛的银镜反响高中化学方程式书写练习(六)1.将过度的二氧化碳通入偏铝酸钠溶液中2.黄铁矿与氧气反响3.硅与氢氟酸反响4.过氧化钠与盐酸反响5.一氧化氮与氧气反响6.电解饱和食盐水7.铝与氧化铁反响8.溴乙烷与氢氧化钠溶液反响9.乙醛与氢气反响10.淀粉的水解1.二氧化硫与氧气反响2.工业上制漂白粉3.将过度盐酸滴入偏铝酸钠溶液中4.氨的催化氧化5.电解熔融氯化钠6.将氯气和二氧化硫的混淆气体通入水中7.氢氧化亚铁在空气中被氧化8.乙炔与氯化氢反响9.麦芽糖的水解10.苯酚与浓溴水反响高中化学方程式书写练习(八)1.碳酸氢钠与少许氢氧化钙反响2.工业上制氨气3.明矾净水原由4.铁与氯化铁溶液反响5.氯化铝与氨水反响6.镁与热水反响7.胆矾受热分解8.实验室制乙烯9.苯与氢气反响10.乙醇与钠反响高中化学方程式书写练习(九)1.氮气与氧气反响2.往次氯酸钙溶液中通入少许二氧化碳3.铜与浓硝酸反响4.往溴化亚铁溶液中通入足量氯气5.钠与硫酸反响6.碳酸氢钠与氢氧化钠反响7.硫化氢与少许氧气反响8.制聚乙烯9.甲烷与氯气反响10.乙炔与溴水反响1.硫化氢与硫酸铜溶液反响2.氯化铝与碳酸氢钠溶液反响3.将一氧化氮和二氧化氮的混淆气体通入烧碱溶液中4.双氧水分解5.实验室制氨气6.铁与碘反响7.氯气与热的氢氧化钾溶液反响8.乙醛与新制氢氧化铜反响9.乙醇的催化氧化10.苯的磺化反响高中化学方程式书写练习(十一)1.二氧化硫与过氧化钠反响2.木炭与浓硝酸反响3.实验室制氯化氢4.磁铁矿与一氧化碳反响5.二氧化碳与硅酸钠溶液反响6.氨水与氢硫酸反响7.铁与水蒸气反响8.乙烯与溴水反响9.钠与苯酚反响10.乙醇分子间脱水高中化学方程式书写练习(十二)1.硫酸铜与氢氧化钡溶液反响2.二氧化硅与生石灰反响3.将氨气与二氧化碳的混淆气体通入食盐水中4.钾在氧气中焚烧5.水煤气的制取6.氧化银与氨水反响7.铜与浓硫酸反响8.苯酚电离9.溴乙烷的消去反响10.制取乙酸乙酯。
高一化学人教版(2019)必修第二册化学方程式练习(有答案)

S+Na——S+Fe——S+Cu——S+ Hg——S+H2——S+O2——S+ H2SO4(浓)——S+NaOH——S+ KNO3+ C——SO2+H2——H2SO3 + O2——SO2 +H2S——SO2 + NaOH ——SO2+Ca(OH) 2——SO2 + O2 ——SO2+Na2SO3+H2O——SO2+Cl2+BaCl2+ H2O——NaHCO3+SO——H2SO4(浓)+Cu——H2SO4(浓) + C——H2S+H2SO4(浓)= ——N2 + O2——NO + O2——NO2 + H2O ——NO + O2 + H2O——NO2 + O2 + H2O ——NH3 + H2O NH3·H2O——NH3 + O2——NH4Cl + Ca(OH)2——N2 + H2——NH3 + HCl——NH4Cl——NH4HCO3——Ba (OH)2·8 H2O+ NH4Cl—— HNO3C+ HNO3(浓) ——Cu+ HNO3(稀)——Cu+ HNO3(浓)——HNO3(稀)+ Fe(过量)——HNO3(稀) +Fe(不足)——Si +O2——CaO+ SiO2——C+ SiO2——Si+ NaOH+ H2O ==——SiO2+ HF ——SiO 2+ NaOH —— NaOH + CO 2 ——SiO 2 + CaCO 3 —— SiO 2 + Na 2CO 3 —— Na 2SiO 3 + HCl=—— Na 2SiO 3 + H 2O + CO 2——1. 甲烷与氯气 CH 4+Cl 2CH 3Cl+Cl 2 CH 2Cl 2+Cl 2 CHCl 3+Cl 22. 乙烯通入溴水中 CH 2=CH 2 + Br 23.乙烯和HBr 的反应 CH 2=CH 2 + HBr 4. 乙烯水化制乙醇 CH 2=CH 2 + H 2O 5. 制取聚乙烯 n CH 2=CH 2 6.乙醇与钠反应 CH 3CH 2OH + Na7. 乙醇催化氧化 CH 3CH 2OH + O 2 8.乙酸乙酯制取(用饱和碳酸钠溶液收集) CH 3COOH + CH 3CH 2OH9.蔗糖水解方程式 C 12H 22O 11 + H 2O蔗糖 葡萄糖 果糖催化剂浓硫酸 △催化剂△ Cu/Ag△10. 麦芽糖水解方程式C 12H 22O 11 + H 2O麦芽糖 葡萄糖 11. 淀粉(或纤维素)水解(C 6H 10O 5)n + nH 2OS +2Na Na 2S S +Fe FeS S +2Cu Cu 2S Hg+S=HgS(实验室Hg 泄露,可在其上撒上一些硫磺进行覆盖处理,将有毒的Hg 蒸气转化为无毒的HgS)S +H 2H 2SS +O 2=====点燃SO 2(注意:S 无论是在空气中燃烧,还是在过量、纯净的O 2中燃烧,其产物都是SO 2,而不是SO 3)S+2H 2SO 4(浓)3SO 2↑+2H 2O(归中反应)催化剂催化剂3S +6NaOH2Na 2S +Na 2SO 3+3H 2O(歧化反应)S+2KNO 3+3C=====点燃K 2S+N 2↑+3CO 2↑(制黑火药,一硫二硝三木炭反应原理) SO 2+H 2O H 2SO 3 2H 2SO 3 + O 2 = 2H 2SO 42H 2S +SO 2=3S↓+2H 2O(有黄色沉淀生成) SO 2 + 2NaOH == Na 2SO 3 + H 2O SO 2+Ca(OH) 2=CaSO 3↓+H 2O2SO 2 + O 22 SO 3SO 2+Na 2SO 3+H 2O=2NaHSO 3SO 2+Cl 2+BaCl 2+2H 2O=BaSO 4↓+4HCl 2NaHCO 3+SO 2=Na 2SO 3+2CO 2↑+H 2O 2H 2SO 4(浓)+Cu CuSO 4+2H 2O +SO 2↑ 2H 2SO 4(浓) + CCO 2↑+ 2H 2O + 2SO 2↑H 2S+H 2SO 4(浓)= S↓+ SO 2↑+2H 2ON 2 + O 2 2NO2NO + O 2== 2NO 23NO 2 + H 2O ==2HNO 3 + NO 4NO + 3O 2 + 2H 2O==4HNO 34NO 2 + O 2 + 2H 2O ==4HNO 3 NH 3 + H 2O NH 3·H 2ONH 4++OH -4NH 3 + 5O 24NO + 6H 2O2NH 4Cl + Ca(OH)2CaCl 2 + 2NH 3↑+2H 2O (氨气的实验室制法)N 2 + 3H 22NH 3 (氨气的工业制法)NH3 + HCl==NH4Cl (魔棒生烟)NH4Cl NH3↑ + HCl↑NH4HCO3NH3↑+ H2O +CO2↑Ba (OH)2·8 H2O+ 2NH4Cl == BaCl2+2NH3↑+10H2O (吸热反应) 4HNO34NO2↑+ O2↑+ 2H2OCu+4HNO3(浓)== Cu(NO3)2 +2NO2↑+2H2OC+4HNO3(浓) CO2↑+4NO2↑+2H2O3Cu+8HNO3(稀)== 3Cu(NO3)2 +2NO↑+4H2O8HNO3(稀)+3Fe(过量)== 3Fe(NO3)2+2NO↑+4H2O4HNO3(稀)+Fe(不足)== Fe(NO3)3+ NO↑+ 2H2OSi +O2 SiO2CaO+ SiO2 CaSiO32C+ SiO22CO↑ + Si (制粗硅)Si+2NaOH+ H2O == Na2SiO3+2H2↑SiO2+ 4HF == SiF4+2H2OSiO2+2NaOH ==Na2SiO3+H2O2NaOH + CO2 == Na2CO3 + H2OSiO2 + CaCO3 CaSiO3+ CO2↑SiO2 + Na2CO3 Na2SiO3+ CO2Na2SiO3 + 2HCl== 2NaCl+ H2SiO3↓Na2SiO3 + H2O + CO2== Na2CO3 + H2SiO3↓2. 甲烷与氯气 CH 4+Cl 2CH 3Cl+HClCH 3Cl+Cl 2CH 2Cl 2+HCl CH 2Cl 2+Cl 2CHCl 3+HCl CHCl 3+Cl 2CCl 4+HCl2. 乙烯通入溴水中 CH 2=CH 2 + Br 2CH 2BrCH 2Br3.乙烯和HBr 的反应 CH 2=CH 2 + HBr CH 3CH 2Br 4. 乙烯水化制乙醇 CH 2=CH 2 + H 2O CH 3CH 2OH 5. 制取聚乙烯 n CH 2=CH 2 6.乙醇与钠反应 2CH 3CH 2OH + 2Na2CH 3CH 2ONa + H 2↑7. 乙醇催化氧化 2CH 3CH 2OH + O 2 2CH 3CHO + 2H 2O 8.乙酸乙酯制取(用饱和碳酸钠溶液收集) CH 3COOH + CH 3CH 2OH CH 3COOC 2H 5 + H 2O9.蔗糖水解方程式 C 12H 22O 11 + H 2OC 6H 12O 6 + C 6H 12O 6蔗糖 葡萄糖 果糖 10. 麦芽糖水解方程式C 12H 22O 11 + H 2O2C 6H 12O 6麦芽糖 葡萄糖 11. 淀粉(或纤维素)水解 (C 6H 10O 5)n + nH 2O nC 6H 12O 6催化剂催化剂催化剂浓硫酸 △CH 2-CH 2 n催化剂△ Cu/Ag△。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 碳酸氢铵受热分解
2. 氯气与水反应
3. 将二氧化氮和氧气的混合气体通入水中
4. 硅与氢氧化钠溶液反应
5. 硫与铜反应
6. 二氧化硅与氢氟酸反应
7. 硫酸氢钠在水中电离
8. 乙烯与溴化氢反应
9. 苯的硝化反应
10. 实验室制甲烷
高中化学方程式书写练习(二)
1. 硫化氢气体与氯化铁溶液反应
2. 氧化铝与烧碱溶液反应
3. 二氧化硫与硫化氢反应
4. 氯气与铜反应
5. 硫与浓硫酸反应
6. 过氧化钠与水反应
7. 红磷与白磷的相互转化
8. 苯与液溴反应
9. 乙醇的消去反应
10. 乙酸甲酯的水解
高中化学方程式书写练习(三)
1. 铝与烧碱溶液反应
2. 氮气与镁反应
3. 氨气与氯化氢反应
4. 氧气与臭氧的转化
5. 氧化钠与盐酸反应
6. 溴化银分解
7. 二氧化硅与碳反应
8. 实验室制乙炔
9. 苯的燃烧
10. 由甲苯制取TNT
1. 实验室制氯气
2. 浓硝酸分解
3. 磷与少量氯气反应
4. 二氧化硅与碳酸钙反应
5. 氟气与水反应
6. 过氧化钠与二氧化碳反应
7. 往氯化铝溶液中滴入过量的烧碱溶液
8. 乙烯与水反应
9. 制取聚氯乙烯
10.苯酚钠溶液与二氧化碳反应
高中化学方程式书写练习(五)
1. 铁与稀硝酸反应
2. 硫化氢与浓硫酸反应
3. 二氧化氮与水反应
4. 镁与二氧化碳反应
5. 往偏铝酸钠溶液中滴入少量盐酸
6. 二氧化硅与氢氧化钠反应
7. 铜与氯化铁溶液反应
8. 乙烯与氢气反应
9. 苯酚与氢氧化钠反应
10. 乙醛的银镜反应
高中化学方程式书写练习(六)
1. 将过量的二氧化碳通入偏铝酸钠溶液中
2. 黄铁矿与氧气反应
3. 硅与氢氟酸反应
4. 过氧化钠与盐酸反应
5. 一氧化氮与氧气反应
6. 电解饱和食盐水
7. 铝与氧化铁反应
8. 溴乙烷与氢氧化钠溶液反应
9. 乙醛与氢气反应
10. 淀粉的水解
1. 二氧化硫与氧气反应
2. 工业上制漂白粉
3. 将过量盐酸滴入偏铝酸钠溶液中
4. 氨的催化氧化
5. 电解熔融氯化钠
6. 将氯气和二氧化硫的混合气体通入水中
7. 氢氧化亚铁在空气中被氧化
8. 乙炔与氯化氢反应
9. 麦芽糖的水解
10. 苯酚与浓溴水反应
高中化学方程式书写练习(八)
1. 碳酸氢钠与少量氢氧化钙反应
2. 工业上制氨气
3. 明矾净水原因
4. 铁与氯化铁溶液反应
5. 氯化铝与氨水反应
6. 镁与热水反应
7. 胆矾受热分解
8. 实验室制乙烯
9. 苯与氢气反应
10. 乙醇与钠反应
高中化学方程式书写练习(九)
1. 氮气与氧气反应
2. 往次氯酸钙溶液中通入少量二氧化碳
3. 铜与浓硝酸反应
4. 往溴化亚铁溶液中通入足量氯气
5. 钠与硫酸反应
6. 碳酸氢钠与氢氧化钠反应
7. 硫化氢与少量氧气反应
8. 制聚乙烯
9. 甲烷与氯气反应
10. 乙炔与溴水反应
1. 硫化氢与硫酸铜溶液反应
2. 氯化铝与碳酸氢钠溶液反应
3. 将一氧化氮和二氧化氮的混合气体通入烧碱溶液中
4. 双氧水分解
5. 实验室制氨气
6. 铁与碘反应
7. 氯气与热的氢氧化钾溶液反应
8. 乙醛与新制氢氧化铜反应
9. 乙醇的催化氧化
10. 苯的磺化反应
高中化学方程式书写练习(十一)
1. 二氧化硫与过氧化钠反应
2. 木炭与浓硝酸反应
3. 实验室制氯化氢
4. 磁铁矿与一氧化碳反应
5. 二氧化碳与硅酸钠溶液反应
6. 氨水与氢硫酸反应
7. 铁与水蒸气反应
8. 乙烯与溴水反应
9. 钠与苯酚反应
10. 乙醇分子间脱水
高中化学方程式书写练习(十二)
1. 硫酸铜与氢氧化钡溶液反应
2. 二氧化硅与生石灰反应
3. 将氨气与二氧化碳的混合气体通入食盐水中
4. 钾在氧气中燃烧
5. 水煤气的制取
6. 氧化银与氨水反应
7. 铜与浓硫酸反应
8. 苯酚电离
9. 溴乙烷的消去反应
10. 制取乙酸乙酯。
