2019年高考化学三轮冲刺 专题复习练习卷 化学平衡常数及转化率.doc
高三化学一轮复习精品学案:化学平衡常数及转化率的计算

第25讲化学平衡常数及转化率的计算考纲要求1.了解化学平衡常数(K)的含义。
2.能利用化学平衡常数进行相关计算。
考点一 化学平衡常数的概念及应用1.概念在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,用符号K 表示。
2.表达式对于反应m A(g)+n B(g)p C(g)+q D(g),K =c p (C )·c q (D )c m (A )·c n (B )(固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中)。
3.意义及影响因素(1)K 值越大,反应物的转化率越大,正反应进行的程度越大。
(2)K 只受温度影响,与反应物或生成物的浓度变化无关。
(3)化学平衡常数是指某一具体反应的平衡常数。
4.应用(1)判断可逆反应进行的程度。
(2)利用化学平衡常数,判断反应是否达到平衡或向何方向进行。
对于化学反应a A(g)+b B(g)c C(g)+d D(g)的任意状态,浓度商:Q =c c (C )·c d (D )c a (A )·c b (B )。
Q <K ,反应向正反应方向进行; Q =K ,反应处于平衡状态; Q >K ,反应向逆反应方向进行。
(3)利用K 可判断反应的热效应:若升高温度,K 值增大,则正反应为吸热反应;若升高温度,K 值减小,则正反应为放热反应。
(1)平衡常数表达式中,可以是物质的任一浓度()(2)催化剂能改变化学反应速率,也能改变平衡常数()(3)平衡常数发生变化,化学平衡不一定发生移动()(4)化学平衡发生移动,平衡常数不一定发生变化()(5)平衡常数和转化率都能体现可逆反应进行的程度()(6)化学平衡常数只受温度的影响,温度升高,化学平衡常数的变化取决于该反应的反应热()答案(1)×(2)×(3)×(4)√(5)√(6)√书写下列反应的平衡常数表达式。
高考化学复习化学平衡及平衡常数专题练习(含答案)

2019年高考化学复习化学平衡及平衡常数专题练习(含答案)根据勒夏特列原理,如一个已达平衡的系统被改变,该系统会随之改变来抗衡该改变,以下是2019年高考化学复习化学平衡及平衡常数专题练习,请考生练习。
2.可逆反应2SO2(g)+O2(g) ??2SO3(g)达到平衡状态时,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc 为浓度商)()A.Qc不变,K变大,O2转化率增大B.Qc不变,K变大,SO2转化率减小C.Qc变小,K不变,O2转化率减小D.Qc增大,K不变,SO2转化率增大【答案】C【解析】当可逆反应2SO2+O2??2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2,浓度商Qc变小,平衡向右移动,SO2的转化率增大,但O2的转化率降低,温度不变,K值不变。
3.(2019天水质检)工业上常用可逆反应2SO2(g)+O2(g)??2SO3(g) 0制备硫酸,下列对该反应的说法正确的是()A.增大压强,平衡向逆反应方向移动B.升高温度,平衡向正反应方向移动C.当v(SO2)∶v(O2)∶v(SO3)=2∶1∶2时,反应达到平衡状态D.当单位时间内生成2 mol SO2的同时生成2 mol SO3,说明该反应达到平衡状态【答案】D4.(2019合肥一模)已知:A(g)+2B(g)??2C(g) H=-Q kJ/mol (Q0),在恒容的密闭容器中充入1 mol A和2 mol B,在一定条件下反应。
下列有关说法正确的是()A.平衡前,随着反应的进行,容器内气体密度逐渐减小B.平衡时,该反应放出的热量为Q kJC.平衡后,再向容器中通入1 mol 氦气,A的转化率增大D.平衡后,缩小容器体积,A的浓度增大【答案】D5.(2019四川卷)在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)??2Z(g) 0,一段时间后达到平衡,反应过程中测定的数据如下表:t/min 2 4 7 9 n(Y)/mol 0.12 0.11 0.10 0.10 下列说法正确的是()A.反应前2 min的平均速率v(Z)=2.010-3molL-1min-1B.其他条件不变,降低温度,反应达到新平衡前v(逆)v(正)C.该温度下此反应的平衡常数K=1.44D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大【答案】C【解析】由表中数据可求得前2 min内生成Z为0.08 mol,故v(Z)==410-3molL-1min-1,故A错误;该反应的正反应是放热反应,降低温度平衡正向移动,反应达到新平衡前v(逆)6.(2019重庆卷)在恒容密闭容器中通入X并发生反应:2X(g)??Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是()A.该反应进行到M点放出的热量大于进行到W点放出的热量B.T2下,在0~t1时间内,v(Y)= molL-1min-1C.M点的正反应速率大于N点的逆反应速率D.M点时再加入一定量X,平衡后X的转化率减小【答案】C【解析】根据图象可知,T1T2,0,因此该反应是放热反应,故c(X)变化越大,放出热量越多,故M点放出的热量小于W点放出的热量,A项错误;T2温度下,在0~t1时间内,v(Y)=v(X)=molL-1min-1,B 项错误;因T1T2,vM正=vM逆vW逆,又因vN逆【答案】C【解析】根据各物质的化学反应速率之比等于化学计量数之比,v(N)=v(M)==1.010-3molL-1min-1,A项错误;实验②中X(g)+ Y(g)??M(g)+ N(g)c起始(molL-1)0.010.040 0c转化(molL-1) 0.008 0.008 0.008 0.008c平衡(molL-1) 0.002 0.032 0.008 0.008求得:K===1.0,B项错误;根据温度相同,则K相等,X(g)+ Y(g)?? M(g)+N(g)c起始(molL-1)0.020.03 0 0c转化(molL-1) a a a ac平衡(molL-1) 0.02-a 0.03-a a aK===1.0,求得a=0.012molL-1,则X的转化率=100%=60%,C项正确;根据上述三段式求得,在700 ℃时,K2.6,则温度升高,K减小,该反应为放热反应,若④的温度为800 ℃,此时与③为等效平衡,b=0.060,但④的温度为900 ℃,则平衡逆向移动,b0.060,则D项错误。
2019版高考化学二轮复习训练题: 高考重要填空逐空特训三 平衡转化率、平衡常数计算特训

(三)平衡转化率、平衡常数计算特训1.甲醇是一种可再生能源,工业上可用合成气制备甲醇,反应为CO(g)+2H 2(g)CH 3OH(g)。
某温度下在容积为V L 的密闭容器中进行反应,其相关数据如下图;反应开始至平衡时,用H 2表示化学反应速率为________。
该温度下CO 的平衡转化率为________。
答案0.12Vmol·L -1·min -160%解析 反应开始至平衡时需要时间为10 min ,H 2的变化物质的量为 2.0 mol -0.8 mol =1.2 mol ,则用H 2表示化学反应速率为1.2 mol V L 10 min =0.12V mol·L -1·min -1;至平衡时CO 的变化物质的量为1.0 mol -0.4 mol =0.6 mol ,该温度下CO 的平衡转化率为0.6 mol1.0 mol×100%=60%。
2.下图是当反应器中按n (N 2)∶n (H 2)=1∶3投料后,在200 ℃、400 ℃、600 ℃,反应达到平衡时,混合物中NH 3的物质的量分数随总压强的变化曲线。
列出R 点平衡常数的计算式K p =________。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。
不要求计算结果) 答案 (35×15)2(35×15)(35×35)3解析 R 点总压强为35 MPa ,NH 3的物质的量分数为20%, N 2(g)+ 3H 2(g)2NH 3(g)起始物质的量/mol 5 15 0 变化物质的量/mol n 3n 2n 平衡物质的量/mol 5-n 15-3n 2nNH3的物质的量分数为20%=2n20-2n ×100%,解得:n=53,则N2的物质的量分数为5-n20-2n×100%=15,H2的物质的量分数为1-15-15=35,R点平衡常数的计算式K p=(35×15)2(35×15)(35×35)3。
2019年高考化学一轮综合复习 第七章 第25讲 化学平衡常数及转化率的计算练习

第25讲 化学平衡常数及转化率的计算考纲要求 1.了解化学平衡常数(K )的含义。
2.能利用化学平衡常数进行相关计算。
考点一 化学平衡常数的概念及应用1.概念在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,用符号K 表示。
2.表达式对于反应m A(g)+n B(g)??p C(g)+q D(g),K =c p (C )·c q (D )c m (A )·c n (B )(固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中)。
3.意义及影响因素(1)K 值越大,反应物的转化率越大,正反应进行的程度越大。
(2)K 只受温度影响,与反应物或生成物的浓度变化无关。
(3)化学平衡常数是指某一具体反应的平衡常数。
4.应用(1)判断可逆反应进行的程度。
(2)利用化学平衡常数,判断反应是否达到平衡或向何方向进行。
对于化学反应a A(g)+b B(g)??c C(g)+d D(g)的任意状态,浓度商:Q =c c (C )·c d (D )c a (A )·c b (B )。
Q <K ,反应向正反应方向进行; Q =K ,反应处于平衡状态; Q >K ,反应向逆反应方向进行。
(3)利用K 可判断反应的热效应:若升高温度,K 值增大,则正反应为吸热反应;若升高温度,K 值减小,则正反应为放热反应。
(1)平衡常数表达式中,可以是物质的任一浓度( ) (2)催化剂能改变化学反应速率,也能改变平衡常数( ) (3)平衡常数发生变化,化学平衡不一定发生移动( ) (4)化学平衡发生移动,平衡常数不一定发生变化( ) (5)平衡常数和转化率都能体现可逆反应进行的程度( )(6)化学平衡常数只受温度的影响,温度升高,化学平衡常数的变化取决于该反应的反应热( )答案 (1)× (2)× (3)× (4)√ (5)√ (6)√书写下列反应的平衡常数表达式。
2019届高考化学人教版三轮冲刺专题强化提分练:化学反应速率、化学平衡常数及转化率的判断和计算(含解

2019届高考化学人教版三轮冲刺专题强化提分练 化学反应速率、化学平衡常数及转化率的判断与计算1、汽车尾气净化中的一个反应如下:NO(g)+CO(g)12N 2(g)+CO 2(g) ΔH =-373.4 kJ·mol -1。
在一容积为5 L 的恒容密闭容器中充入0.2molNO 和0.5molCO,5min 后该反应达到平衡,此时N 2的物质的量为0.06mol 。
下列说法正确的是( )A.达到平衡后,若只升高温度,化学平衡正向移动B.达到平衡后,再通入稀有气体,逆反应速率增大C.0~5min 内,NO 的反应速率为2.4×10-3mol·L -1·min -1D.使用催化剂,平衡常数不变 答案 D解析 A 项,正反应为放热反应,只升高温度,平衡向吸热反应方向移动,即向逆反应方向移动,错误;B 项,恒温恒容条件下,通入稀有气体,反应混合物各组分的浓度不变,正、逆反应速率都不变,错误;C 项,0~5 min 内,N 2的平均速率=0.06 mol5 L5 min=2.4×10-3 mol·L -1·min-1,速率之比等于化学计量数之比,故v (NO)=2v (N 2)=4.8×10-3mol·L -1·min -1,错误;D 项,平衡常数只受温度影响,使用催化剂,平衡常数不变,正确。
2、向恒温恒容(2L)的密闭容器中充入2molSO 2和一定量的O 2发生反应:2SO 2(g)+O 2(g)2SO 3(g) ΔH =-197.74kJ·mol -1,4min后达到平衡,这时c (SO 2)=0.2mol·L -1,且SO 2和O 2的转化率相等。
下列说法中,不正确的是( )A.2min时,c(SO2)=0.6mol·L-1B.用O2表示4min内的反应速率为0.1mol·L-1·min-1C.再向容器中充入1molSO3,达到新平衡,n(SO2)∶n(O2)=2∶1D.4min后,若升高温度,平衡向逆反应方向移动,平衡常数K减小答案 A解析设氧气的初始浓度是x mol·L-1,则2SO2(g)+O2(g)2SO3(g)初始浓度mol·L-1 1 x0变化浓度mol·L-1 0.8 0.4 0.8平衡浓度mol·L-1 0.2 x-0.4 0.8SO2和O2的转化率相等,则0.4/x=0.8,解得x=0.5。
高二化学化学平衡常数平衡转化率考试卷(含答案)【推荐下载】

高二化学化学平衡常数平衡转化率考试卷(含答案) 第2章第2节第1课时(45分钟100分)(本栏目内容,在学生用书中以活页形式分册装订!)一、选择题(本题包括10小题,每小题5分,共50分)1.下列对可逆反应的认识正确的是()A.SO2+Br2+2H2O===H2SO4+2HBr与2HBr+H2SO4(浓)===Br2+SO2↑+2H2O互为可逆反应B.既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应C.在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应D.在一定条件下SO2被氧化成SO3的反应不是可逆反应解析:分析可逆反应这个概念时一定要注意两个关键点:“同一条件”和“同时”。
答案: C2.在密闭容器中进行反应:X2(g)+3Y2(g) 2Z2(g),若X2、Y2、Z2 的初始浓度分别为0.1 molL-1、0.3 molL-1、0.2 molL-1,当反应达到平衡后,各物质的浓度有可能的是()①X2为0.2 molL-1②Y2为0.1 molL-1③Z2为0.3 molL-1④Y2为0.6 molL-1A.①②B.②③C.③④D.①④解析:对于一个可逆反应而言,不管反应进行到什幺程度,其正逆反应始终同时存在,也就是说:在可逆反应中,反应物不可能百分之百地转化为生成物,平衡时不可能出现某物质浓度为零的情况。
对于A,X2为0.2 molL-1,就意味着Z2全部转化为X2和Y2了,显然不成立,①错;同理;④错;正确的为②③。
答案: B3.反应CO(g)+H2O(g) CO2(g)+H2(g)在800 ℃达到平衡时,分别改变下列条件,K值会发生变化的是()A.将体积减小至原来的一半B.将反应温度升高至1 000 ℃C.加入催化剂D.增大水蒸气的浓度解析:对于一个特定的化学反应来讲,其平衡常数只与温度有关。
答案: B4.在相同的温度下,已知反应:①N2(g)+O2(g) 2NO(g)的平衡常数K=3.84×10-31;②2SO2(g)+O2(g) 2SO3(g)的平衡常数K=3.10×1026Lmol-1。
高考化学三轮冲刺 专题复习练习卷 化学平衡常数及转化率

化学平衡常数及转化率1.某温度时,N 2+3H 22NH 3的平衡常数K =a ,则此温度下,NH 332H 2+12N 2的平衡常数为 A .1aB .aC .12a D .1a22.某恒定温度下,在一个2 L 的密闭容器中充入A 气体、B 气体,测得其浓度为2 mol·L -1和1 mol·L -1;且发生如下反应:3A(g)+2B(g)4C(?)+2D(?)已知“?”代表C 、D 状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C ,且反应前后压强比为5∶4,则下列说法中正确的是 ①该反应的化学平衡表达式:K =4232(C)(D)(A)(B)c c c c ⋅⋅②此时B 的转化率为35%③增大该体系压强,平衡向右移动,但化学平衡常数不变 ④增加C 的量,A 、B 转化率不变 A .①② B .②③ C .①④D .③④3.温度为T ℃时,向2.0 L 恒容密闭容器中充入1.0 mol PCl 5,反应PCl 5(g)PCl 3(g)+Cl 2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表。
下列说法正确的是A .反应在前50 s 的平均速率为v (PCl 3)=0.003 2 mol·L -1·s -1B .保持其他条件不变,升高温度,平衡时c (PCl 3)=0.11 mol·L -1,则反应的ΔH <0C .相同温度下,起始时向容器中充入1.0 mol PCl 5、0.20 mol PCl 3和0.20 mol Cl 2,达到平衡前v 正>v 逆D .相同温度下,起始时向容器中充入2.0 mol PCl 5,达到平衡时,PCl 5的转化率大于20% 4.在一定温度下,将气体X 和气体Y 各0.16 mol 充入10 L 恒容密闭容器中,发生反应:X(g)+Y(g) 2Z(g)ΔH <0。
一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是A .反应前2 min 的平均速率v (Z)=2.0×10-3 mol·L -1·min -1B .其他条件不变,降低温度,反应达到新平衡前:v (逆)>v (正)C .保持其他条件不变,起始时向容器中充入0.32 mol 气体X 和0.32 mol 气体Y ,到达平衡时,n (Z)=0.24 molD.该温度下此反应的平衡常数:K=14.45.可逆反应:A(g)+2B(g)2C(g) ΔH=-Q kJ· mol-1。
(江苏专用)2019届高考化学二轮复习 压轴题热点练3 化学平衡常数、平衡转化率的计算

热点3 化学平衡常数、平衡转化率的计算1.CuCl 2溶液中的铜主要以Cu(H 2O)2+4、CuCl 2-4形式存在,将CuCl 2溶于浓盐酸中,存在下列平衡:Cu(H 2O)2+4(aq)+4Cl -(aq)CuCl 2-4(aq)+4H 2O(l) ΔH <0。
(1)该反应的平衡常数表达式为_______________________。
(2)常温下,测定平衡体系中:Cu(H 2O)2+4浓度为a mol ·L -1、Cl -浓度为b mol ·L -1、CuCl 2-4浓度为c mol ·L -1,Cl -的转化率为____________(用含a 、b 、c 的字母表示)。
答案 (1)c (CuCl 2-4)c 4(Cl -)·c [Cu (H 2O )2+4](2)4c b +4c解析 (2)已知Cu(H 2O)2+4(aq)+4Cl -(aq)CuCl 2-4(aq)+4H 2O(l)平衡体系中:Cu(H 2O)2+4浓度为a mol ·L -1、Cl -浓度为b mol·L -1、CuCl 2-4浓度为c mol ·L -1,则Cl -变化的浓度为4c mol ·L -1,Cl -起始的浓度为(b +4c ) mol·L -1,Cl -的转化率为4cb +4c。
2.T 温度时,向10 L 恒容密闭容器中充入2 mol NO 和2 mol CO 发生反应 2NO(g)+2CO(g)N 2(g)+2CO 2(g)ΔH =-746.5 kJ·mol -15 min 时达到平衡,测得0~5 min 内该反应速率v (N 2)=0.016 mol·L -1·min -1。
(1)T 温度时,该反应的平衡常数K =________。
(2)平衡时容器内压强与起始时容器内压强之比为________。
2019年高考化学考点一遍过考点40 化学平衡常数及转化率 含解析

1.化学平衡常数(1)定义在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),用K表示。
(2)表达式对于一般的可逆反应:m A(g)+n B(g)p C(g)+q D(g),K=(C)(D) (A)(B)p qm nc cc c⋅⋅。
(3)应用①判断反应进行的限度K值大,说明反应进行的程度大,反应物的转化率高。
K值小,说明反应进行的程度小,反应物的转化率低。
②判断反应是否达到平衡状态化学反应a A(g)+b B(g)c C(g)+d D(g)在任意状态时,浓度商均为Q c=(C)(D) (A)(B)c da bc cc c⋅⋅。
Q c>K时,反应向逆反应方向进行;Q c=K时,反应处于平衡状态;Q c<K时,反应向正反应方向进行。
③利用平衡常数判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
2.转化率对于一般的化学反应:a A+b B c C+d D,达到平衡时反应物A的转化率为α(A)=A AA的初始浓度-的平衡浓度的初始浓度×100%=0(A)(A)(A)c cc-×100%[c0(A)为起始时A的浓度,c(A)为平衡时A的浓度]反应物平衡转化率的变化判断判断反应物转化率的变化时,不要把平衡正向移动与反应物转化率提高等同起来,要视具体情况而定。
常见有以下几种情形:(或减小)反应反应物A和A(g)考向一化学平衡常数及影响因素典例1 在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:物质X Y Z初始浓度/(mol·L-1) 0.1 0.2 0平衡浓度/(mol·L-1) 0.05 0.05 0.1下列说法错误的是A.反应达平衡时,X的转化率为50%B.反应可表示为X+3Y2Z,其平衡常数为1 600C.增大压强使平衡向生成Z的方向移动,平衡常数增大D.改变温度可以改变此反应的平衡常数【答案】C1.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO 2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)2NO(g)+Cl 2(g)2ClNO(g) K2ΔH2<0(Ⅱ)(1)4NO 2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
高三化学平衡常数、转化率及相关计算训练

1.某可逆反应达到平衡状态后,仅改变一个外界条件,达到新平衡时产物浓度增大,下列推断合理的是()A.反应物转化率一定增大,平衡常数一定增大B.平衡一定向正反应方向移动,反应物转化率增大C.平衡一定移动,平衡常数一定不变D.上述判断都片面,不合理2.已知可逆反应3X(g)+2Y(s)⇌n C(g)ΔH。
若p1<p2,根据表中的数据判断下)p1MPa p2MPa400 ℃99.699.7500 ℃96.997.8A.B.n可能等于2、1C.200 ℃的平衡常数大于600 ℃的平衡常数D.加入高效催化剂,不改变C的平衡体积分数3.在1.0 L恒容密闭容器中加入4 mol N2O5,在一定温度下发生反应:(Ⅰ)N2O5⇌N2O3+O2,(Ⅱ)N2O3⇌N2O+O2。
达到平衡时c(O2)=4.5 mol·L-1、c(N2O3)=1.5 mol·L-1。
下列推断合理的是()A.平衡时,c(N2O5)=2 mol·L-1B.平衡时,c(N2O)=1 mol·L-1C.反应Ⅱ的平衡常数K=4.5 mol·L-1D.N2O5的平衡转化率为25%4.将一定量的X和Y加入密闭容器中,在一定条件下发生反应:2X(g)+Y(s)⇌G (g)+3E(l)压强/MPa1.0 1.52.0平衡常数温度/℃300a b10.8516c50.2d800160e fA.ΔH<0B.a>b>10.8C.ΔS<0D.800 ℃、1.0 MPa时X的转化率最大5.已知化学反应X(g)+Y(g)⇌Z(g)+G(g)ΔH的平衡常数与温度的关系如表所示。
温度/℃600700830 1 000 1 200平衡常数K 1.7 1.1 1.00.60.4在830 ℃时,向2 L密闭容器中投入a mol X、b mol Y气体,反应并达到平衡状态。
下列说法不正确的是()A.600 ℃和1 200 ℃时该反应平衡常数的表达式相同B.该可逆反应的正反应是吸热反应C .上述反应达到平衡时X 的最大转化率为50%D.上述反应达到平衡过程中密度、相对分子质量都不变 6.已知:2CH 3COCH 3(l )催化剂CH 3COCH 2C (OH )(CH 3)2(l )。
2019年高考化学一轮综合复习 第七章 化学反应速率和化学平衡 第25讲 化学平衡常数及转化率的计算练习

第25讲 化学平衡常数及转化率的计算考纲要求 1.了解化学平衡常数(K )的含义。
2.能利用化学平衡常数进行相关计算。
考点一 化学平衡常数的概念及应用1.概念在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,用符号K 表示。
2.表达式对于反应m A(g)+n B(g)??p C(g)+q D(g),K =c p (C )·c q (D )c m (A )·c n (B )(固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中)。
3.意义及影响因素(1)K 值越大,反应物的转化率越大,正反应进行的程度越大。
(2)K 只受温度影响,与反应物或生成物的浓度变化无关。
(3)化学平衡常数是指某一具体反应的平衡常数。
4.应用(1)判断可逆反应进行的程度。
(2)利用化学平衡常数,判断反应是否达到平衡或向何方向进行。
对于化学反应a A(g)+b B(g)??c C(g)+d D(g)的任意状态,浓度商:Q =c c (C )·c d (D )c a (A )·c b (B )。
Q <K ,反应向正反应方向进行; Q =K ,反应处于平衡状态; Q >K ,反应向逆反应方向进行。
(3)利用K 可判断反应的热效应:若升高温度,K 值增大,则正反应为吸热反应;若升高温度,K 值减小,则正反应为放热反应。
(1)平衡常数表达式中,可以是物质的任一浓度( ) (2)催化剂能改变化学反应速率,也能改变平衡常数( ) (3)平衡常数发生变化,化学平衡不一定发生移动( ) (4)化学平衡发生移动,平衡常数不一定发生变化( ) (5)平衡常数和转化率都能体现可逆反应进行的程度( )(6)化学平衡常数只受温度的影响,温度升高,化学平衡常数的变化取决于该反应的反应热( ) 答案 (1)× (2)× (3)× (4)√ (5)√ (6)√书写下列反应的平衡常数表达式。
高考化学一轮专题重组卷:第一部分 专题13 化学平衡常数、转化率及相关平衡图像
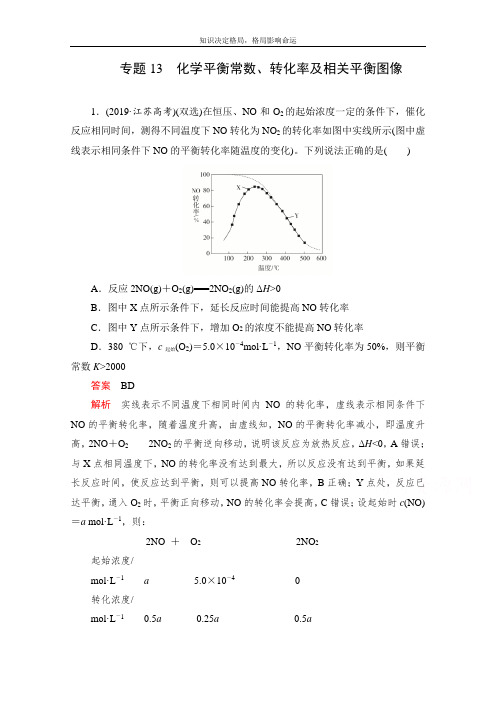
专题13化学平衡常数、转化率及相关平衡图像1.(2019·江苏高考)(双选)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。
下列说法正确的是()A.反应2NO(g)+O2(g)===2NO2(g)的ΔH>0B.图中X点所示条件下,延长反应时间能提高NO转化率C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率D.380 ℃下,c起始(O2)=5.0×10-4mol·L-1,NO平衡转化率为50%,则平衡常数K>2000答案BD解析实线表示不同温度下相同时间内NO的转化率,虚线表示相同条件下NO的平衡转化率,随着温度升高,由虚线知,NO的平衡转化率减小,即温度升高,2NO+O22NO2的平衡逆向移动,说明该反应为放热反应,ΔH<0,A错误;与X点相同温度下,NO的转化率没有达到最大,所以反应没有达到平衡,如果延长反应时间,使反应达到平衡,则可以提高NO转化率,B正确;Y点处,反应已达平衡,通入O2时,平衡正向移动,NO的转化率会提高,C错误;设起始时c(NO)=a mol·L-1,则:2NO +O22NO2起始浓度/mol·L-1a 5.0×10-40转化浓度/mol·L-10.5a0.25a0.5a平衡浓度/ mol·L -1 0.5a (5.0×10-4-0.25a ) 0.5aK =(0.5a )2(0.5a )2×(5×10-4-0.25a )=15×10-4-0.25a当0.25a =0时,K =2000,但0.25a >0,所以K >2000,D 正确。
2.(2019·河南滑县高三调研)在恒容密闭容器中充入一定量的NO ,发生反应:2NO(g)N 2(g)+O 2(g) ΔH 。
2018-2019年高三专题小练化学平衡常数及转化率
2018-2019年高三专题小练化学平衡常数及转化率1 / 62018-2019学年高三专题小练化学平衡常数 优质原创每天更新)第I 卷(选择题)一、单选题1.O 3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。
O 3可溶于水,在水中易分解,产生的 为游离氧原子,有很强的杀菌消毒能力。
常温常压下发生反应如下: 反应 :O 3O 2+[O] ΔH>0 平衡常数为 ;反应 :[O]+O 32O 2 ΔH<0平衡常数为 ; 总反应:2O 33O 2 ΔH<0平衡常数为K 。
下列叙述正确的是( ) A .降低温度,K 减小B . =C .适当升温,可提高消毒效率D .压强增大, 减小 【答案】C2.汽车尾气净化中的一个反应如下:2NO (g )+2CO (g )⇌N 2(g )+2CO 2(g )△H=-373.4k J/mol -1,若反应在恒容的密闭容器中达到平衡状态,下列有关说法正确的是( )A .其它条件不变,加入催化剂,△H 变大B .充入氦气使体系压强增大,可提高反应物的转化率C .及时除去二氧化碳,能使NO 完全转化D .若升高温度,该反应的平衡常数增大 【答案】C3.某温度下,一反应平衡常数K=.恒容时到达平衡后,升高温度,H 2浓度减小.下列说法正确的是( )A .升温,逆反应速率减小B .加压,H 2浓度减小C .增加H 2,K 减小D .该反应的正反应是吸热反应 【答案】D4.某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H 2和I 2,发生反应:H 2 (g) +I 2(g)2HI(g).反应体系中各物质浓度的有关数据如下。
下列判断正确的是A .HI 的平衡浓度:a=b>0.004B.平衡时,H2的转化率:丁>甲C.平衡时,乙中H2的转化率等于20%D.丙中条件下,该反应的平衡常数K=4【答案】A5.298 K时,各反应的平衡常数如下:①N2(g)+O2(g)2NO(g) K=1×10-30;②2H2(g)+O2(g) 2H2O(g) K=2×1081;③2CO2(g)2CO(g)+O2(g) K=4×10-92,则常温下,NO、H2O、CO2这三个化合物分解放氧的倾向最大的是( )A.①B.②C.③D.无法判断【答案】A6.某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,下列说法正确的A.该反应的化学平衡常数表达式是B.此时B的平衡转化率是40%C.增大该体系的压强,平衡向右移动,化学平衡常数增大D.增加B,平衡向右移动,B的平衡转化率增大【答案】D7.氢气用于烟气的脱氮、脱硫的反应4H2(g)+2NO(g)+ SO2(g)N2(g)+S(l)+4H2O(g) ΔH﹤0 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019年高考化学三轮冲刺 专题复习练习卷 化学平衡常数及转化率1.某温度时,N 2+3H 22NH 3的平衡常数K =a ,则此温度下,NH 332H 2+12N 2的平衡常数为 A .1aB .aC .12a D .1a22.某恒定温度下,在一个2 L 的密闭容器中充入A 气体、B 气体,测得其浓度为2 mol·L -1和1 mol·L -1;且发生如下反应:3A(g)+2B(g)4C(?)+2D(?)已知“?”代表C 、D 状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C ,且反应前后压强比为5∶4,则下列说法中正确的是 ①该反应的化学平衡表达式:K =4232(C)(D)(A)(B)c c c c ⋅⋅②此时B 的转化率为35%③增大该体系压强,平衡向右移动,但化学平衡常数不变 ④增加C 的量,A 、B 转化率不变 A .①② B .②③ C .①④D .③④3.温度为T ℃时,向2.0 L 恒容密闭容器中充入1.0 mol PCl 5,反应PCl 5(g)PCl 3(g)+Cl 2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表。
下列说法正确的是A .反应在前50 s 的平均速率为v (PCl 3)=0.003 2 mol·L -1·s -1B .保持其他条件不变,升高温度,平衡时c (PCl 3)=0.11 mol·L -1,则反应的ΔH <0C .相同温度下,起始时向容器中充入1.0 mol PCl 5、0.20 mol PCl 3和0.20 mol Cl 2,达到平衡前v 正>v 逆D .相同温度下,起始时向容器中充入2.0 mol PCl 5,达到平衡时,PCl 5的转化率大于20% 4.在一定温度下,将气体X 和气体Y 各0.16 mol 充入10 L 恒容密闭容器中,发生反应:X(g)+Y(g) 2Z(g)ΔH <0。
一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是A .反应前2 min 的平均速率v (Z)=2.0×10-3 mol·L -1·min -1B .其他条件不变,降低温度,反应达到新平衡前:v (逆)>v (正)C .保持其他条件不变,起始时向容器中充入0.32 mol 气体X 和0.32 mol 气体Y ,到达平衡时,n (Z)=0.24 molD .该温度下此反应的平衡常数:K =14.45.可逆反应:A(g)+2B(g)2C(g) ΔH=-Q kJ· mol-1。
现有甲、乙两个容积相等且不变的密闭容器,向甲容器中充入1 mol A和2 mol B,在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2 mol C,达到平衡后吸收的热量为Q2 kJ。
已知Q1=9Q2,下列叙述中正确的是A.Q1=QB.平衡时甲中C的体积分数比乙中小C.达到平衡时,甲中A的转化率为90%D.Q1+Q2>Q6.一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2+O 22SO3,其起始物质的量及SO2的平衡转化率如下表所示。
下列判断中正确的是A.甲中反应的平衡常数小于乙B.该温度下,该反应的平衡常数K为400C.SO2的平衡转化率:α1>α2=α3D.容器中SO3的物质的量浓度:丙=丁<甲7.N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)4NO2(g)+O2(g) ΔH >0。
T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:下列说法正确的是A.500 s内NO2的生成速率为2.96×10-3mol·L-1·s-1B.T1温度下该反应平衡时N2O5的转化率为29.6%C.达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)<5.00 mol·L-1D.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K28.某温度下反应2A(g)B(g)+C(g) ΔH<0的平衡常数K=4。
此温度下,在1 L的密闭容器中加入A,反应到某时刻测得A、B、C的物质的量浓度(mol·L-1)分别为0.4、0.6、0.6,下列说法正确的是A.温度升高,该反应反应速率加快,平衡常数增大B.题目所述的某时刻正、逆反应速率的大小为v(正)>v(逆)C.经10 min反应达到平衡,则该时间内反应速率v(A)为0.064 mol·L-1·min-1D.平衡时,再加入与起始等量的A,达新平衡后A的转化率增大9.向甲、乙、丙三个恒容密闭容器中充入一定量的A和B,发生反应:x A(g)+B(g)2C(g)。
各容器的反应温度、反应物起始量如表所示,反应过程中C的浓度随时间变化关系如图所示。
下列说法正确的是A.由图可知:T1<T2,且该反应为吸热反应B.T2时该反应的平衡常数K=0.8C.10 min内甲容器中反应的平均速率v(B)=0.025 mol·(L·min)−1D.T1时,若起始向甲容器中充入1.5 mol A、0.5 mol B,平衡时B的转化率为25%10.Ⅰ.工业上可用CO或CO2来生产燃料甲醇。
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正________(填“>”、“=”或“<”)v逆。
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)—反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是______________。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是______________。
Ⅱ.利用CO 和H2可以合成甲醇,反应原理为CO(g)+2H 2(g)CH 3OH(g)。
一定条件下,在容积为V L 的密闭容器中充入a mol CO 与2a mol H 2合成甲醇,平衡转化率与温度、压强的关系如下图所示。
(1)p 1________(填“>”、“<”或“=”)p 2,理由是______________________________________。
(2)该甲醇合成反应在A 点的平衡常数K =______________(用a 和V 表示)。
(3)该反应达到平衡时,反应物转化率的关系是CO________(填“>”、“<”或“=”)H 2。
(4)下列措施中能够同时满足增大反应速率和提高CO 转化率的是________(填字母)。
A .使用高效催化剂 B .降低反应温度 C .增大体系压强D .不断将CH 3OH 从反应混合物中分离出来11.近期发现,H 2S 是继NO 、CO 之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。
回答下列问题:(3)H 2S 与CO 2在高温下发生反应:H 2S(g)+CO 2(g)COS(g) +H 2O(g)。
在610 K 时,将0.10 mol CO 2与0.40 molH 2S 充入2.5 L 的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H 2S 的平衡转化率1α=_______%,反应平衡常数K =________。
②在620 K 重复试验,平衡后水的物质的量分数为0.03,H 2S 的转化率2α_____1α,该反应的∆H _____0。
(填“>”“<”或“=”)③向反应器中再分别充入下列气体,能使H 2S 转化率增大的是________(填标号) A .H 2S B .CO 2 C .COS D .N 212.随着科学技术的发展和环保要求的不断提高,CO 2的捕集利用技术成为研究的重点。
完成下列填空:(1)目前国际空间站处理CO 2的一个重要方法是将CO 2还原,所涉及的反应方程式为:CO 2(g)+4H 2(g)CH 4(g)+2H 2O(g)已知H 2的体积分数随温度升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。
(选填“增大”、“减小”或“不变”)(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:a 、b 、c 、d 与m 、n 、x 、y 之间的关系式为_________。
13.煤燃烧排放的烟气含有SO 2和NO x ,形成酸雨、污染大气,采用NaClO 2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。
回答下列问题:(2)在鼓泡反应器中通入含有SO 2和NO 的烟气,反应温度为323 K ,NaClO 2溶液浓度为5×10−3 mol·L −1。
反应一段时间后溶液中离子浓度的分析结果如下表。
①写出NaClO 2溶液脱硝过程中主要反应的离子方程式__________。
增加压强,NO 的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH 逐渐______(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。
原因是除了SO 2和NO 在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO 2溶液脱硫、脱硝的反应中,SO 2和NO 的平衡分压p e 如图所示。
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2−+223SO -224SO -+Cl −的平衡常数K 表达式为___________。
参考答案 1.【答案】A 2.【答案】D 3.【答案】C 4.【答案】C 5.【答案】C 6.【答案】B 7.【答案】D 8.【答案】B 9.【答案】B10.【答案】Ⅰ.(1)K 1·K 2 > (2)加入催化剂 将容器的体积(快速)压缩至2 LⅡ.(1)< 甲醇的合成反应是分子数减少的反应,相同温度下,增大压强CO 的转化率提高 (2)12V2a2 (3)= (4)C11.【答案】(3)①2.5 2.8×10–3 ②> > ③B12.【答案】(1)(2)2244cd xy ab mn =13.【答案】(2)①4OH −+32ClO -+4NO 43NO -+3Cl −+2H 2O 提高 ②减小 ③大于 NO 溶解度较低或脱硝反应活化能较高(3)①减小 ②2242223(Cl )(SO )(ClO )(SO )c c K c c ----⋅=⋅。
