作业题解(3章电解质溶液)
电解质溶液习题答案

第五章 电解质溶液1. 写出下列分子或离子的共轭碱:H 2O 、H 3O +、H 2CO 3、HCO - 3、NH + 4、NH + 3CH 2COO -、H 2S 、HS -。
写出下列分子或离子的共轭酸:H 2O 、NH 3、HPO 2- 4、NH - 2、[Al(H 2O)5OH]2+、CO 2- 3、NH + 3CH 2COO -。
答:(1)酸H 2O H 3O + H 2CO 3 HCO 3- NH 4+ NH 3+CH 2COO - H 2S HS -共轭碱 OH - H 2O HCO 3- CO 32- NH 3 NH 2CH 2COO - HS - S 2- (2)碱H 2ONH 3HPO 42- NH 2- [Al(H 2O) 5OH] 2+ CO 32-NH 3+CHCOO - 共轭酸 H 3O + NH 4+ H 2PO 4- NH 3 [Al(H 2O) 6] 3+ HCO 3-NH 3+CH 2COOH2. 在溶液导电性试验中,若分别用HAc 和NH 3·H 2O 作电解质溶液,灯泡亮度很差,而两溶液混合则灯泡亮度增强,其原因是什么?答:HAc 和NH 3·H 2O 为弱电解质溶液,解离程度很小;混合后反应形成NH 4Ac 为强电解质,完全解离,导电性增强。
3. 说明:(1) H 3PO 4溶液中存在着哪几种离子?请按各种离子浓度的大小排出顺序。
其中H 3O +浓度是否为 PO 3- 4浓度的3倍?(2) NaHCO 3和NaH 2PO 4均为两性物质,为什么前者的水溶液呈弱碱性而后者的水溶液呈弱酸性?答:(1) 若c (H 3PO 4)=O.10mol·L -1,则溶液中各离子浓度由大到小为:离子 H + H 2PO 4- HPO 42- OH - PO 43- 浓度/mol·L -1 2.4×10-2 2.4×10-2 6.2×10-8 4.2×10-13 5.7×10-19 其中H +浓度并不是PO 43-浓度的3倍。
普通化学第三章

Chapter 3 电解质溶液
大 学 化 学
中 国 石 油 大 学
化 学 化 工 学
第三章 电解质溶液
(Electrolyte Solution)
College Chemistry
Chapter 3 电解质溶液
大 学 化 学
【四大平衡问题】
弱电解质的解离平衡
难溶电解质的沉淀、溶解平衡 氧化还原平衡——第四章 配位平衡——第七章
College Chemistry 稀释, 会不断增大。
奥斯特瓦尔德,1888年
【注意】:①c 为弱电解质的原始浓度 ② 不断增大,但解离出的离子浓 度不一定大(c )。
数(dissociation constant)即标准平衡常数KӨ。 弱酸的解离常数:KaӨ ;弱碱的解离常数:
KbӨ。对于具体的弱酸、弱碱,一般可以把分子
College Chemistry
式标在K的右边:KӨ(HAc)、KӨ(NH3· H2O)。
Chapter 3 电解质溶液
大 学 化 学
解离常数的性质: ①弱电解质解离程度大小的标志:KӨ越大,说 明解离程度越大。一般KӨ≤10-4 —弱电解质 ②KӨ值与温度有关,但一般解离过程的热效应
Chapter 3 电解质溶液
大 学 二、解离度及其影响因素 化 1、解离度(degree of ionization) 学 已解离的分子数 解离的分子浓度
分子总数 100%= 分子总浓度
100%
(同一溶液体系,可以用浓度代替物质的量)
College Chemistry
解离度与平衡常数的关系:一元弱酸HA HA H A 初始浓度 平衡浓度 c 0 0 c c(1-) c
基础化学第三章(电解质溶液)5

Kb1 =
10-14 Ka ( HPO 2-)
4
=
10-14 Ka3
Kb2 = Ka (H Kb3 = Ka (H
10-14
PO 2 4)
10-14
3PO4)
10-14 = Ka2 10-14 = Ka1
三、酸碱平衡的移动 1、浓度对酸碱平衡的影响
酸溶液
H C
C Ka
第三章 电解质溶液 (Electrolytic solution)
• 体液(血浆、胃液、泪水、尿液)含有许多 电解质离子,如Na+、K+、Ca2+、Mg2+、Cl-、 HCO3-、CO32-、HPO42-、H2PO4-、SO42- 等,它 们维持体液渗透浓度、pH值。 • 体液中的电解质溶液是其他生理功能的必需 成分,并对神经、肌肉等组织的生理、生化 功能起着重要的作用
(二)水溶液的pH
中性溶液: [H+ ] = [OH- ]= 1.010-7 mol · L-1 酸性溶液 :[H+ ] >1.010-7 mol · L-1 > [OH- ] 碱性溶液: [H+ ] <1.010-7 mol · L-1 < [OH- ] pOH= -lg OH- pH= -lg H+ pH + pOH = -lg H+OH-= - lg 10-14 = 14.00
• 钾的代谢:
来源:食物,婴儿每天需2.0-3.0mmol/kg,成人只
需1.0-1.5mmol/kg。饥饿者进食后,由于细胞代谢
的需要,钾的需求增多。其中90%以上由尿排出,其 余大部分由粪便排出。
第一节
强电解质溶液
高考化学练习题:电解质溶液(含答案解析)

高考化学练习题:电解质溶液一.选择题(共26小题)1.(2015•安徽)25℃时,在10mL浓度均为0.1mol•L﹣1的NaOH和NH3•H2O混合溶液中滴加0.1mol•L ﹣1盐酸,下列有关溶液中粒子浓度关系正确的是()A.未加盐酸时:c(OH﹣)>c(Na+)=c(NH3•H2O)B.加入10mL盐酸时:c(NH4+)+c(H+)=c(OH﹣)C.加入盐酸至溶液pH=7时:c(Cl﹣)=c(Na+)D.加入20mL盐酸时:c(Cl﹣)=c(NH4+)+c(Na+)考点:弱电解质在水溶液中的电离平衡;真题集萃.分析:氢氧化钠为强碱,在水溶液中完全电离,一水合氨为弱碱,在水溶液中部分电离,相同体积与浓度的氢氧化钠与一水合氨其中和能力是相同的,据此分析解答即可.解答:解:A、NaOH和NH3•H2O混合溶液中,NaOH完全电离,NH3•H2O部分电离,因此c(OH ﹣)>0.1mol/L,c(Na+)=0.1mol/L,c(NH3•H2O)<0.1mol/L,故c(OH﹣)>c(Na+)>c(NH3•H2O),故A错误;B、在此混合溶液中加入10mL盐酸,存在电中性原则:c(NH4+)+c(H+)+c(Na+)=c(OH﹣)+c(Cl﹣),由于等体积等浓度混合,故c(Na+)=c(Cl﹣),即c(NH4+)+c(H+)=c(OH﹣),故B正确;C、加入盐酸至pH=7时,溶液呈中性,即c(H+)=c(OH﹣),那么c(NH4+)+c(Na+)=c(Cl﹣),即c(Cl﹣)>c(Na+),故C错误;D、加入20mL盐酸时,此时溶液恰好为氯化钠与氯化铵的混合溶液,此时溶液呈酸性,即存在c(H+)>c(OH﹣),那么c(NH4+)+c(Na+)<c(Cl﹣),故D错误,故选B.点评:本题主要考查酸碱混合的定性判断,题目难度中等,本题注意把握弱电解质的电离特点,易错点为C,注意酸碱中和滴定的实验原理.2.(2015•广东)一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是()A.升高温度,可能引起由c向b的变化B.该温度下,水的离子积常数为1.0×10﹣13C.该温度下,加入FeCl3可能引起由b向a的变化D.该温度下,稀释溶液可能引起由c向d的变化考点:水的电离;弱电解质在水溶液中的电离平衡.分析:A、由图可知abc为等温线;B、由b点计算此温度下水的离子积常数为1.0×10﹣14;C、b点到a点,氢离子浓度变大,氢氧根离子浓度减小,据此解答即可;D、稀释不会引起水的离子积的改变,据此解答即可.解答:解:A、由图可知abc三点对应的平衡常数不变,故abc为等温线,故升高温度,不能由c 到b,故A错误;B、b点c(H+)=c(OH﹣)=1.0×10﹣7,故K W=1.0×10﹣7×1.0×10﹣7=1.0×10﹣14,故B错误;C、加入FeCl3,氯化铁为强酸弱碱盐,铁离子结合水电离出的氢氧根,促进水的电离平衡右移,即氢离子浓度增大,氢氧根离子浓度减小(由b到a),符合图象变化趋势,故C正确;D、由c点到d点,水的离子积常数减小,温度不变,K不变,故不能利用稀释使其形成此变化,故D错误,故选C.点评:本题主要考查的是水的离子积常数以及水电离的影响因素,掌握水的离子积为温度的函数是解决本题的关键,难度不大.3.(2015•海南)0.1mol下列气体分别与1L0.1mol•L﹣1的NaOH溶液反应,形成的溶液pH最小的是()A.NO2B.SO2C.SO3D.CO2考点:p H的简单计算.分析:0.1mol下列气体分别与1L0.1mol•L﹣1的NaOH溶液反应,二者的物质的量相同,NO2与NaOH等物质的量反应的方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O;SO2与NaOH等物质的量反应的方程式为NaOH+SO2=NaHSO3;SO3与NaOH等物质的量反应的方程式为NaOH+SO3=NaHSO4;CO2与NaOH等物质的量反应的方程式为NaOH+CO2=NaHCO3,根据反应产物的酸碱性判断.解答:解:0.1mol下列气体分别与1L0.1mol•L﹣1的NaOH溶液反应,二者的物质的量相同,NO2与NaOH等物质的量反应的方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O,NaNO2为强碱弱酸盐,溶液显碱性;SO2与NaOH等物质的量反应的方程式为NaOH+SO2=NaHSO3,NaHSO3在溶液中即电离又水解,电离程度大于水解程度,溶液显弱酸性;SO3与NaOH等物质的量反应的方程式为NaOH+SO3=NaHSO4,NaHSO4在溶液中完全电离出氢离子,溶液显强酸性;CO2与NaOH等物质的量反应的方程式为NaOH+CO2=NaHCO3,NaHCO3在溶液中即电离又水解,水解程度大于电离程度,溶液显弱碱性;综上可知,形成的溶液pH最小的是SO3;故选:C.点评:本题考查了物质的性质,题目涉及元素化合物的性质、盐的水解、弱电解质的电离,题目难度中等,注意根据物质之间反应判断产物以及溶液的酸碱性.4.(2015•四川)常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得溶液pH<7,下列关于滤液中的离子浓度关系不正确的是()A.<1.0×10﹣7mol/LB.c(Na+)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3)C.c(H+)+c(NH4+)=c(OH﹣)+c(HCO3﹣)+2c(CO32﹣)D.c(Cl﹣)>c(NH4+)>c(HCO3﹣)>c(CO32﹣)考点:盐类水解的原理.专题:盐类的水解专题.分析:A.根据Kw=c(H+)×c(OH﹣)=1.0×10﹣14计算;B.根据物料守恒即c(Na)=c(C)分析;C.根据电荷守恒分析;D.铵根离子部分水解,则c(Cl﹣)>c(NH4+),HCO3﹣的电离程度很小.解答:解:A.Kw=c(H+)×c(OH﹣)=1.0×10﹣14,已知pH<7,即c(H+)>1.0×10﹣7mol/L,则<1.0×10﹣7mol/L,故A正确;B.溶液中存在物料守恒即c(Na)=c(C),所以c(Na+)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3),故B正确;C.溶液中存在电荷守恒:c(Na+)+c(H+)+c(NH4+)=c(OH﹣)+c(HCO3﹣)+2c(CO32﹣)+c (Cl﹣),由于析出部分NaHCO3晶体,则c(Na+)<c(Cl﹣),所以c(H+)+c(NH4+)>c(OH﹣)+c(HCO3﹣)+2c(CO32﹣),故C错误;D.铵根离子部分水解,则c(Cl﹣)>c(NH4+),由于析出部分NaHCO3晶体,则HCO3﹣浓度减小,HCO3﹣的电离程度很小,所以c(CO32﹣)最小,即c(Cl﹣)>c(NH4+)>c(HCO3﹣)>c(CO32﹣),故D正确.故选C.点评:本题考查了混合溶液中离子浓度的计算、离子浓度大小比较、电荷守恒和物料守恒的应用,题目难度中等,注意把握电荷守恒和物料守恒的应用方法.5.(2015•广东)水溶液中能大量共存的一组离子是()A.NH4+、Ba2+、Br﹣、CO32﹣B.Cl﹣、SO32﹣、Fe2+、H+C.K+、Na+、SO42﹣、MnO4﹣D.Na+、H+、NO3﹣、HCO3﹣考点:离子共存问题.专题:离子反应专题.分析:根据离子之间不能结合生成沉淀、气体、水等,不能相互促进水解等,则离子大量共存,以此来解答.解答:解:A.Ba2+、CO32﹣结合生成沉淀,不能大量共存,故A错误;B.SO32﹣、H+结合生成水和气体,不能大量共存,故B错误;C.该组离子之间不反应,可大量共存,故C正确;D.H+、HCO3﹣结合生成水和气体,不能大量共存,故D错误;故选C.点评:本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、水解反应的离子共存考查,题目难度不大.6.(2015•四川)下列有关CuSO4溶液的叙述正确的是()A.该溶液中Na+、NH4+、NO3﹣、Mg2+可以大量共存B.通入CO2气体产生蓝色沉淀C.与H2S反应的离子方程式:C u2++S2﹣=CuS↓D.与过量浓氨水反应的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+考点:离子共存问题;离子方程式的书写.分析:A.该组离子之间不反应,与硫酸铜也不反应;B.通入CO2气体,与硫酸铜溶液不反应;C.H2S在离子反应中保留化学式;D.与过量浓氨水反应,生成络离子.解答:解:A.该组离子之间不反应,与硫酸铜也不反应,则可大量共存,故A正确;B.通入CO2气体,与硫酸铜溶液不反应,不能生成蓝色沉淀,故B错误;C.H2S在离子反应中保留化学式,则与H2S反应的离子方程式为Cu2++H2S=CuS↓+2H+,故C错误;D.与过量浓氨水反应,生成络离子,则离子反应为Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O,故D 错误;故选A.点评:本题考查离子共存及离子反应,为高频考点,为2015年高考真题,把握常见离子之间的反应为解答的关键,侧重复分解反应及络合反应的离子反应考查,题目难度不大.7.(2015•上海)某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32﹣、Cl ﹣、OH﹣、NO3﹣.向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有()A.3种B.4种C.5种D.6种考点:离子共存问题.分析:溶液无色,则一定不存在有色的Fe3+;在其中加入金属铝,发生反应并放出H2,溶液可能呈酸性,也可能呈碱性,若为酸性,则不存在OH﹣、NO3﹣、CO32﹣,若呈碱性,则不存在Al3+、H+、NH4+、Fe3+,以此解答该题.解答:解:无色溶液中一定不存在有色的Fe3+;溶液中加入金属铝,发生反应并放出H2,溶液可能呈酸性,也可能呈碱性,若溶液为酸性,则不存在:OH﹣、NO3﹣、CO32﹣,阴离子只能为Cl﹣,阳离子可以为:H+、NH4+、Ba2+、Al3+,最多存在5种离子;若呈碱性,则不存在Al3+、H+、NH4+、Fe3+,阳离子只能为Ba2+,则一定不存在CO32﹣,可存在的离子为:Ba2+、Cl﹣、OH﹣、NO3﹣,则最多只有4种,根据分析可知,最多存5种离子,故选C.点评:本题考查离子共存问题,题目难度中等,涉及离子反应和种类的判断,综合侧重于学生的分析能力的考查,注意把握题目无色以及与铝反应生成氢气的特点,特别注意硝酸不能生成氢气.8.(2014•江苏)水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是()A.水是弱电解质B.可燃冰是可以燃烧的水C.氢氧两种元素只能组成水D.0℃时冰的密度比液态水的密度大考点:水的电离;不同晶体的结构微粒及微粒间作用力的区别.专题:元素及其化合物.分析:A.水能够部分电离出氢离子和氢氧根离子,存在电离平衡;B.可燃冰为甲烷和水形成的一种化合物;C.氢氧两种元素还可以组成双氧水;D.液体水变成冰,体积变大,密度变小.解答:解:A.水为极弱的电解质,能够部分电离出氢离子和氢氧根离子,故A正确;B.可燃冰为甲烷和水形成的一种特殊的化合物,并不是可燃烧的水,故B错误;C.氢氧两种元素可以组成水、双氧水,故C错误;D.冰中存在氢键,具有方向性和饱和性,其体积变大,则相同质量时冰的密度比液态水的密度小,故D错误;故选A.点评:本题考查了水的电离、水的组成结构及性质,题目难度不大,注意掌握水的电离,明确可燃冰的组成及性质,试题培养了学生灵活应用所学知识的能力.9.(2014•重庆)下列叙述正确的是()A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体B.CH3COONa溶液中滴加少量浓盐酸后c(CH3COO﹣)增大C.Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2D.25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度考点:影响盐类水解程度的主要因素;难溶电解质的溶解平衡及沉淀转化的本质.专题:电离平衡与溶液的pH专题;盐类的水解专题.分析:A、浓氨水和氯化铁之间会发生复分解反应;B、醋酸钠中加入盐酸会发生反应生成醋酸和氯化钠;C、Ca(HCO3)2溶液与过量NaOH溶液反应产物是碳酸钙和碳酸钠;D、根据沉淀溶解平衡的影响因素来回答判断.解答:解:A、浓氨水和氯化铁之间会发生复分解反应生成氢氧化铁沉淀和氯化铵,不会获得胶体,故A错误;B、醋酸钠中加入盐酸会发生反应生成醋酸和氯化钠,所以醋酸根离子浓度会减小,故B错误;C、Ca(HCO3)2溶液与过量NaOH溶液反应产物是碳酸钙和碳酸钠,并不会获得氢氧化钙,故C 错误;D、氢氧化铜存在沉淀溶解平衡Cu(OH)2⇌Cu2++2OH﹣,Cu(NO3)2溶液中铜离子会抑制沉淀溶解平衡的右移,所以Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度,故D正确.故选D.点评:本题考查学生物质的性质以及沉淀溶解平衡的影响因素等方面的知识,注意知识的归纳和整理是解题关键,难度中等.10.(2014•上海)向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中()A.c(Ca2+)、c(OH﹣)均增大B.c(Ca2+)、c(OH﹣)均保持不变C.c(Ca2+)、c(OH﹣)均减小D.c(OH﹣)增大、c(H+)减小考点:难溶电解质的溶解平衡及沉淀转化的本质.专题:物质的量浓度和溶解度专题.分析:加入CaC2,与水发生CaC2+2H2O=Ca(OH)2+HC≡CH↑,反应消耗水,结合Ca(OH)2(s)⇌Ca2+(aq)+2OH﹣(aq)的影响因素解答.解答:解:加入CaC2,与水发生CaC2+2H2O=Ca(OH)2+HC≡CH↑,反应消耗水,因原溶液为饱和溶液,则反应后一定有Ca(OH)2析出,则溶液浓度不变,故选B.点评:本题为2014年上海考题,涉及难溶电解质的溶解平衡,侧重于学生的分析能力的考查,注意把握反应的原理以及溶解平衡的特点,难度不大.11.(2014•海南)以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉).下列说法错误的是()A.阴极附近溶液呈红色B.阴极逸出气体C.阳极附近溶液呈蓝色D.溶液的pH变小考点:电解原理;真题集萃.专题:电化学专题.分析:以石墨为电极,电解KI溶液时,在阴极上是氢离子得电子发生还原反应,阳极上是碘离子失电子发生氧化反应,据此回答判断.解答:解:A、以石墨为电极,电解KI溶液时,在阴极上是氢离子得电子发生还原反应,该极区碱性增强,遇到酚酞溶液呈红色,故A正确;B、以石墨为电极,电解KI溶液时,在阴极上是氢离子得电子发生还原反应逸出气体氢气,故B正确;C、以石墨为电极,电解KI溶液时,阳极上是碘离子失电子发生氧化反应生成碘单质,遇到淀粉变蓝色,故C正确;D、以石墨为电极,电解KI溶液时,生成氢氧化钾溶液,溶液的pH变大,故D错误.故选D.点评:本题考查学生电解池的工作原理以及物质的性质知识,注意知识的归纳和整理是解题的关键,难度中等.12.(2014•四川)下列溶液中粒子的物质的量浓度关系正确的是()A.0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32﹣)>c(HCO3﹣)>c(OH﹣)B.20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO﹣)>c(Cl﹣)>c(CH3COOH)>c(H+)C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl﹣)+c(H+)>c(NH4+)+c(OH﹣)D.0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH﹣)>c (H+)+c(CH3COOH)考点:离子浓度大小的比较.专题:盐类的水解专题.分析:A.二者恰好反应生成Na2CO3,溶液中的溶质为0.05mol/L的Na2CO3,碳酸根离子两步水解都生成氢氧根离子,碳酸根离子只有第一步水解生成HCO3﹣;B.二者混合后,溶液中的溶质为等物质的量浓度的NaCl、CH3COONa、CH3COOH,混合溶液呈酸性,说明醋酸的电离程度大于醋酸根离子水解程度,但醋酸电离和醋酸根离子水解程度都较小;C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,混合溶液呈碱性,任何电解质溶液中都存在电荷守恒,结合电荷守恒判断;D.二者恰好反应生成CH3COONa,溶液呈存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.解答:解:A.二者混合后恰好反应生成Na2CO3,溶液中的溶质为0.05mol/L的Na2CO3,碳酸根离子两步水解都生成氢氧根离子,碳酸根离子只有第一步水解生成HCO3﹣,所以c(HCO3﹣)<c (OH﹣),故A错误;B.二者混合后,溶液中的溶质为等物质的量浓度的NaCl、CH3COONa、CH3COOH,混合溶液呈酸性,说明醋酸的电离程度大于醋酸根离子水解程度,但醋酸电离和醋酸根离子水解程度都较小,所以溶液中粒子浓度大小顺序是c(CH3COO﹣)>c(Cl﹣)>c(CH3COOH)>c(H+),故B正确;C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,混合溶液呈碱性即c(OH﹣)>c(H+),任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Cl﹣)+c(OH﹣)=c(H+)+c(NH4+),且c (OH﹣)>c(H+),所以c(Cl﹣)<c(NH4+),所以c(Cl﹣)+c(H+)<c(NH4+)+c(OH﹣),故C错误;D.二者混合后恰好反应生成CH3COONa,溶液呈存在电荷守恒和物料守恒,根据电荷守恒得c (CH3COO﹣)+c(OH﹣)=c(H+)+c(Na+),根据物料守恒得c(Na+)=c(CH3COO﹣)+c(CH3COOH),所以得c(OH﹣)=c(H+)+c(CH3COOH),故D错误;故选B.点评:本题考查了离子浓度大小比较,明确溶液中的溶质及溶液酸碱性再结合电荷守恒、物料守恒来分析解答,离子浓度大小比较为高考高频点,常常与盐类水解、弱电解质电离结合考查,题目难度中等.13.(2014•天津)下列有关电解质溶液中粒子浓度关系正确的是()A.pH=1的NaHSO4溶液:c(H+)=c(SO42﹣)+c(OH﹣)B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl﹣)=c(I﹣)C.CO2的水溶液:c(H+)>c(HCO3﹣)=2c(CO32﹣)D.含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4﹣)+c(C2O42﹣)+c (H2C2O4)]考点:离子浓度大小的比较;弱电解质在水溶液中的电离平衡;盐类水解的应用.专题:电离平衡与溶液的pH专题;盐类的水解专题.分析:A、NaHSO4溶液中存在氢离子守恒分析判断;B、AgCl和AgI固体的悬浊液中氯化银溶解度大于碘化银;C、二氧化碳的水溶液中碳酸分步电离,第二步电离微弱;D、依据溶液中元素物料守恒计算分析.解答:解:A、NaHSO4溶液中存在质子守恒分析,硫酸氢钠电离出钠离子、氢离子、硫酸根离子,NaHSO4 =Na++H++SO42﹣,H2O⇌H++OH﹣,溶液中质子守恒,c(H+)=c(SO42﹣)+c(OH﹣),故A正确;B、AgCl和AgI固体的悬浊液中氯化银溶解度大于碘化银,c(Ag+)>c(Cl﹣)>c(I﹣),故B错误;C、二氧化碳的水溶液中碳酸分步电离,第二步电离微弱,H2CO3⇌H++HCO3﹣,HCO3﹣⇌H++CO32﹣,c(H+)>c(HCO3﹣)>2c(CO32﹣),故C错误;D、依据溶液中元素物料守恒计算,含等物质的量NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4﹣)+C(C2O42﹣)+c(H2C2O4)],故D错误;故选A.点评:本题考查了电解质溶液中电离平衡分析,沉淀溶解平衡的理解应用,电解质溶液中物料守恒,质子守恒的分析判断,掌握基础是关键,题目难度中等.14.(2014•广东)常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是()A.HA为强酸B.该混合液pH=7C.图中X表示HA,Y表示OH﹣,Z表示H+D.该混合溶液中:c(A﹣)+c(Y)=c(Na+)考点:酸碱混合时的定性判断及有关ph的计算.专题:电离平衡与溶液的pH专题.分析:一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A﹣浓度小于0.1mol/L,说明在溶液中存在A﹣+H2O⇌HA+OH﹣,NaA水解,HA为弱酸,NaA 溶液呈碱性,则c(OH﹣)>c(H+),一般来说,盐类的水解程度较低,则有c(A﹣)>c(OH﹣),所以有:c(Na+)=0.1mol/L>c(A﹣)>c(OH﹣)>c(HA)>c(H+),即X表示OH﹣,Y表示HA,Z表示H+,溶液中存在物料守恒为:c(Na+)=c(A﹣)+c(HA).A.HA为弱酸;B.该混合液pH>7;C.X表示OH﹣,Y表示HA,Z表示H+;D.Y表示HA,溶液中存在物料守恒得到c(A﹣)+c(Y)=c(Na+).解答:解:一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A﹣浓度小于0.1mol/L,说明在溶液中存在A﹣+H2O⇌HA+OH﹣,NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH﹣)>c(H+),一般来说,盐类的水解程度较低,则有c(A﹣)>c(OH ﹣),所以有:c(Na+)=0.1mol/L>c(A﹣)>c(OH﹣)>c(HA)>c(H+),即X表示OH﹣,Y 表示HA,Z表示H+,溶液中存在物料守恒得到:c(Na+)=c(A﹣)+c(HA).A.一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,二者恰好反应:HA+NaOH=NaA+H2O,所得溶液为NaA溶液,溶液中中A﹣浓度小于0.1mol/L,说明在溶液中存在A﹣+H2O⇌HA+OH﹣,NaA水解,HA为弱酸,故A错误;B.c(Na+)>c(A﹣),说明NaA水解,A﹣+H2O⇌HA+OH﹣,该混合液pH>7,故B错误;C.HA是弱电解质,则有c(A﹣)>c(OH﹣),c(OH﹣)除了水解产生的还有水电离的,因此c (OH﹣)>c(HA),所以有:c(Na+)=0.1mol/L>c(A﹣)>c(OH﹣)>c(HA)>c(H+),即X表示OH﹣,Y表示HA,Z表示H+,故C错误;D.溶液中存在物料守恒c(Na+)=c(A﹣)+c(HA),Y表示HA,得到c(A﹣)+c(Y)=c(Na+),故D正确;故选D.点评:本题考查了酸碱混合溶液定性判断,根据酸的强弱结合物料守恒、电荷守恒分析解答,考查离子浓度大小比较、溶液PH值、盐类水解等,判断一元酸HA是弱酸为解题关键,题目难度中等.15.(2014•山东)已知某温度下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.1mol•L ﹣1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中()A.水的电离程度始终增大B.先增大再减小C.c(CH3COOH)与c(CH3COO﹣)之和始终保持不变D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO﹣)考点:酸碱混合时的定性判断及有关ph的计算.专题:电离平衡与溶液的pH专题.分析:A.开始时,溶液的酸性逐渐减弱,水的电离程度逐渐增大,当氨水过量后,溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小;B.根据一水合氨的电离平衡常数可知,该比值与氢氧根离子成反比,电解氨水的过程中,溶液中氢氧根离子浓度逐渐增大;C.根据物料守恒,醋酸和醋酸根离子的物质的量之和不变,但是溶液体积增大,二者的浓度之和逐渐减小;D.CH3COOH和NH3•H2O的电离常数相等,氨水与醋酸的浓度、体积相等时,溶液显示中性,根据电荷守恒可知c(NH4+)=c(CH3COO﹣).解答:解:A.酸溶液、碱溶液抑制了水的电离,溶液显示中性前,随着氨水的加入,溶液中氢离子浓度逐渐减小,水的电离程度逐渐增大;当氨水过量后,随着溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小,所以滴加过程中,水的电离程度先增大后减小,故A错误;B.当向CH3COOH溶液中滴加相同浓度的氨水,开始时溶液为CH3COOH和CH3COONH4的混合物,由CH3COONH4的水解常数K h=,随着氨水的加入,c(H+)逐渐减小,Kh不变,则变小,当加氨水至溶液显碱性时,氨水的电离常数K b=,c(OH﹣)与氢离子浓度成反比,随着氨水的滴入,氢氧根离子浓度逐渐增大,电离常数K不变,所以逐渐减小,即始终减小,故B错误;C.n(CH3COOH)与n(CH3COO﹣)之和为0.001mol,始终保持不变,由于溶液体积逐渐增大,所以c(CH3COOH)与c(CH3COO﹣)之和逐渐减小,故C错误;D.当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH﹣),根据电荷守恒可知:c(NH4+)=c(CH3COO﹣),故D正确;故选D.点评:本题考查了酸碱混合时溶液定性判断及溶液酸碱性与溶液pH的关系,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确根据电荷守恒、物料守恒、盐的水解比较溶液中离子浓度大小的方法.16.(2014•广东)水溶液中能大量共存的一组离子是()A.Na+、Ca2+、Cl﹣、SO42﹣B.Fe2+、H+、SO32﹣、ClO﹣C.Mg2+、NH4+、Cl﹣、SO42﹣D.K+、Fe3+、NO3﹣、SCN﹣考点:离子共存问题.专题:离子反应专题.分析:离子之间不生成气体、沉淀、弱电解质、络合物、不发生氧化还原反应、不发生双水解的就能共存,据此分析解答.解答:解:A.Ca2+、SO42﹣生成微溶物硫酸钙,所以不能大量共存,故A错误;B.酸性条件下,ClO﹣具有强氧化性,能将Fe2+、SO32﹣氧化为Fe3+、SO42﹣,所以不能共存,故B 错误;C.这几种离子之间不发生反应,所以能共存,故C正确;D.Fe3+、SCN﹣生成络合物Fe(SCN)3,所以这两种离子不能共存,故D错误;故选C.点评:本题考查了离子共存,明确离子共存条件是解本题关键,知道物质的性质即可解答,注意:硫酸钙是微溶物,少量时能在水溶液中共存,但不能大量存在,为易错点.17.(2014•安徽)下列有关Fe2(SO4)3溶液的叙述正确的是()A.该溶液中,K+、Fe2+、C6H5OH、Br﹣可以大量共存B.和KI溶液反应的离子方程式:Fe3++2I﹣═Fe2++I2C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42﹣+Ba2++3OH﹣═Fe(OH)3↓+BaSO4↓D.1L O.1mol•L﹣1该溶液和足量的Zn充分反应,生成11.2g Fe考点:离子共存问题;离子方程式的书写.专题:离子反应专题.分析:A.铁离子能够与苯酚发生显色反应;B.根据电荷守恒判断,该离子方程式两边电荷不守恒;C.该离子方程式不满足硫酸铁、氢氧化钡的化学组成关系;D.根据n=cV计算出硫酸铁及铁离子的物质的量,再根据质量守恒及m=nM计算出铁的质量.解答:解:A.Fe2(SO4)3溶液中的Fe3+与C6H5OH发生显色反应,在溶液中不能大量共存,故A错误;B.铁离子能够与碘离子发生氧化还原反应,反应的离子方程式为:2Fe3++2I﹣═2Fe2++I2,题目方程式未配平,故B错误;C.Fe2(SO4)3溶液和Ba(OH)2溶液反应的生成氢氧化铁沉淀和硫酸钡沉淀,铁离子和硫酸根离子的物质的量的比为2:3,正确的离子方程式为:2Fe3++3SO42﹣+3Ba2++6OH﹣═2Fe(OH)3↓+3BaSO4↓,故C错误;D.1L O.1mol•L﹣1该溶液中含有溶质硫酸铁0.1mol,0.1mol硫酸铁中含有0.2mol铁离子,与足量锌反应可以生成0.2mol铁,生成铁的质量为11.2g,故D正确;故选D.点评:本题考查了离子方程式的书写、离子共存的判断,题目难度中等,注意掌握离子反应发生条件,明确常见的离子之间不能共存的情况及离子方程式的书写原则.18.(2013•重庆)下列说法正确的是()A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质B.25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<V NaOHC.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成D.AgCl沉淀易转化为AgI沉淀且K(AgX)=c(Ag+)•c(X﹣),故K(AgI)<K(AgCl)考点:电解质与非电解质;难溶电解质的溶解平衡及沉淀转化的本质;酸碱混合时的定性判断及有关ph的计算;镁、铝的重要化合物.专题:电离平衡与溶液的pH专题;几种重要的金属及其化合物.分析:A.KClO3和三氧化硫的水溶液都能导电,KClO3是电解质,但三氧化硫是非电解质;B.CH3COOH不完全电离,根据电荷守恒可知,c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣),等体积等浓度混合时显碱性,则中性时应使醋酸过量;C.NaHCO3溶液与NaAlO2溶液,反应中碳酸氢钠提供氢离子与偏铝酸根反应生成Al(OH)3;D.AgCl沉淀易转化为AgI沉淀,说明溶解度S(AgCl)>S(AgI),所以K(AgCl)>K (AgI);解答:解:A.电解质是熔融态或水溶液状态下能导电的化合物,是自身电离出自由移动的离子.氯酸钾溶于水自身电离出钾离子和氯酸根离子,能导电是电解质;SO3溶于水后和水反应生成硫酸,硫酸电离出阴阳离子而使其溶液导电,电离出阴阳离子的物质是硫酸而不是三氧化硫,所以SO3是非电解质,故A错误;B.醋酸与NaOH溶液反应:CH3COOH+NaOH=CH3COONa+H2O,根据电荷守恒c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣),若等体积等浓度混合时显碱性,则25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7显中性时应使醋酸过量,即V醋酸>V NaOH,故B错误;C.氢氧化铝为两性氢氧化物,由于酸性:HCO3﹣>Al(OH)3,根据强酸制备弱酸,NaHCO3溶液与NaAlO2溶液,反应中碳酸氢钠提供氢离子与偏铝酸根反应生成生成Al(OH)3,AlO2﹣+HCO3﹣+H2O=Al(OH)3↓+CO32﹣有沉淀生成,无气体生成,故C错误;D.向AgCl沉淀中滴入稀KI溶液,会出现白色沉淀AgCl转变为黄色沉淀AgI,说明AgCl沉淀易转化为AgI沉淀,沉淀易转化为更难溶沉淀,越难溶物质其饱和溶液中电离出相应离子浓度越小,故K(AgI)<K(AgCl),故D正确;故选D.点评:本题考查了电解质、酸碱中和、氢氧化铝、难溶电解质的溶解平衡及沉淀转化等知识,掌握它们的相关本质是解答的关键,题目难度中等.19.(2013•天津)下列有关电解质溶液的说法正确的是()A.在蒸馏水中滴加浓H2SO4,K w不变B.CaCO3难溶于稀硫酸,也难溶于醋酸。
高中化学选择性必修第一册第3章第三节第3课时电解质溶液中微粒间的关系

第3课时电解质溶液中微粒间的关系一、溶液中的守恒关系1.电荷守恒电解质溶液中阳离子所带的电荷总数与阴离子所带的电荷总数相等。
即电荷守恒,溶液呈电中性。
(1)解题方法①分析溶液中所有的阴、阳离子。
②阴、阳离子浓度乘以自身所带的电荷数建立等式。
(2)举例如:Na2CO3溶液中①Na+、H+、CO2-3、HCO-3、OH-。
②1×c(Na+)+1×c(H+)=2×c(CO2-3)+1×c(HCO-3)+1×c(OH-)。
化简得:c(Na+)+c(H+)=2c(CO2-3)+c(HCO-3)+c(OH-)。
2.元素质量守恒在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化,就该离子所含的某种元素来说,其质量在反应前后是守恒的,即元素质量守恒。
(1)解题方法①分析溶质中的特定元素的原子或原子团间的定量关系(特定元素除H、O元素外)。
②找出特征元素在水溶液中的所有存在形式。
(2)举例如:Na2CO3溶液中①n(Na+)n(CO2-3)=21,即n(Na+)=2c(CO2-3),CO2-3在水中部分会水解成HCO-3、H2CO3,共三种含碳元素的存在形式。
②c(Na+)=2[c(CO2-3)+c(HCO-3)+c(H2CO3)]。
3.质子守恒方法一:可以由电荷守恒与元素质量守恒推导出来。
如Na2CO3中将电荷守恒和元素质量守恒中的金属阳离子消去得c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3)。
方法二:质子守恒是依据水的电离平衡:H2O H++OH-,水电离产生的H+和OH-的物质的量总是相等的,无论在溶液中由水电离出的H+和OH-以什么形式存在。
如:Na2CO3溶液中即c(OH-)=2c(H2CO3)+c(HCO-3)+c(H3O+)或c(OH-)=2c(H2CO3)+c(HCO-3)+c(H+)。
二、溶液中离子浓度比较的四种类型1.不同溶液中同一离子浓度比较要考虑溶液中其他离子对该离子的影响,如:在相同浓度的下列溶液中①NH4Cl,②CH3COONH4,③NH4HSO4,④(NH4)2SO4,⑤(NH4)2CO3,c(NH+4)由大到小的顺序:④>⑤>③>①>②。
《基础化学A》作业-解答-第3章

第3 章电解质溶液自测题专业及班级学号姓名计分批改作业者班级批改作业者姓名(一)是非题:(共20分,每题2分。
用“√”、“х”代表对、错填入括号中)(√)1、强电解质溶液中离子的有效浓度总比理论浓度小。
(×)2、将HCl 溶液和HAc 溶液混合,溶液中H+全部由HCl 提供,与HAc 的浓度、KΘ值无关。
(√)3、近似计算中,0.1 mol·L-1NH4Ac 溶液与 0.5 mol·L-1NH4Ac 溶液的 pH 值基本相等。
(×)4、MgCO3 的溶度积常数K sp=2.38×10-6,这意味着所有含有固体MgCO3 的溶液中[Mg2+]=[CO32-],且[Mg2+]=[CO32-]=2.38×10-6。
(×)5、多元弱酸溶液中,其酸根的浓度近似等于其最后一级离解常数。
(√)6、将 0.10 mol•L-1 的 NH4CN 溶液加水稍加稀释,其溶液的 pH 值基本保持不变。
(√)7、难溶电解质沉淀溶解平衡属于多相平衡。
(√)8、离子强度仅与溶液中各离子的浓度及电荷数有关,与离子种类无关。
(×)9、同离子效应的同时也有盐效应,但一般将同离子效应忽略不计。
(×)10、解离度大的碱溶液中,[OH-]离子浓度也大。
(二)填空题:(共15分,每空1分。
将答案填入对应的下划线上)1、NH4+的共轭碱是NH3 ;[Fe(OH)(H2O)5]2+的共轭酸是[Fe(H2O)6]3+ 。
2、[Fe2+]= 0.1 mol·L-1 溶液中,溶液的 pH 值为7.61 时,Fe(OH)2 才开始沉淀(Ksp(Fe(OH)2)=1.64×10-14)。
3、当 HAc 分别溶解在液氨、液态氟化氢、水等溶剂中时,以在液氨中的酸常数最大。
4、298K 时,0.01 mol·L-1 某一元弱酸水溶液的 pH 值为 4,则K a 为1.0 ×10-6 ,解离度 a为1% 。
基础化学习题及详细答案

基础化学习题及详细答案电解质溶液首页难题解析学生自测题学生自测答案章后习题解答难题解析[TOP]例3-1(1)NaOH和H3PO4溶液等体积混合,测得溶液pH值为4.66,溶液的渗透浓度为200mmol·L-1,求混合前NaOH和H3PO4溶液的浓度各为多少?(2)若此NaOH和H3PO4溶液以2:1的体积混合,溶液pH和渗透浓度各为多少?(已知H3PO4:pKa1=2.16;pKa2=7.21;pKa3=12.32)分析(1)NaOH和H3PO4溶液等体积混合,由pH=4.66知混合后只有NaH2PO4,那么NaOH和H3PO4浓度相等,再由混合溶液渗透浓度求得NaOH和H3PO4溶液的浓度。
(2)NaOH和H3PO4以2:1体积混合,可计算出溶液pH和渗透浓度。
解(1)因NaOH和H3PO4溶液等体积混合后pH=4.66=(pKa1+pKa2)/2,可判断混合溶液只含有NaH2PO4,因此混合前NaOH和H3PO4浓度相等,又混合溶液的渗透浓度为200mmol·L-1,即2某c(NaH2PO4)=200mmol·L-1c(NaH2PO4)=0.10mol·L-1根据c(NaH2PO4)推出混合前c(NaOH)=0.20mol·L-1,c(H3PO4)=0.20mol·L-1(2)NaOH和H3PO4溶液以2:1的体积混合发生的反应为:2NaOH(aq)+H3PO4(aq)Na2HPO4(aq)+2H2O(aq)由于混合前c(NaOH)=0.20mol·L-1,c(H3PO4)=0.20mol·L-1,混合后溶液只含有Na2HPO4,浓度为c(Na2HPO4)=(2/3)某0.20mol·L-1因此溶液的渗透浓度为3某(2/3)某0.20某1000mmol·L-1=400mmol·L-1由于混合溶液只含有Na2HPO4两性物质,pH=(pKa2+pKa3)/2=(7.21+12.32)/2=9.76例3-2在0.100mol·L-1HA溶液的解离度为1.32%,(1)计算HA的解离常数。
高考化学(热点+题型全突破)专题7模块4热点题型三电解质溶液的导电性和导电能力(含解析)

专题7 模块4 热点题型三电解质溶液的导电性和导电能力一、化学中物质导电情况:(1)自由移动的电子(金属、石墨)(2)自由移动的离子(电解质溶液、熔融态离子化合物等)二、电解质溶液的导电性和导电能力(1)电解质不一定导电(如NaCl晶体、无水醋酸),导电物质不一定是电解质(如石墨),非电解质不导电,但不导电的物质不一定是非电解质.(2) 电解质溶液导电能力是由溶液中自由移动的离子浓度决定的,离子浓度大,导电能力强;离子浓度小,导电能力弱。
离子浓度大小受电解质的强弱和溶液浓度大小的决定。
(3)强电解质溶液导电性不一定比弱电解质强(浓度可不同);饱和强电解质溶液导电性不一定比弱电解质强;(4)电解质的导电条件是水溶液或高温熔融液(熔液)。
共价化合物只能在溶液中导电,离子化合物在熔液和溶液均可导电(区别离子与共价化合物)。
典例一、【考点定位】本题主要考查弱电解质的电离平衡,酸碱混合溶液的PH判断,溶液的导电性和沉淀溶解平衡的应用。
【2015重庆卷】下列叙述正确的是( )A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7C.25℃时,0。
1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱D.0。
1 mol AgCl和0。
1mol AgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-)【答案】C典例二、【考点定位】考查电解质溶液导电能力,水的电离程度,离子浓度大小比较。
【重庆市第一中学2017届高三下学期第一次月考理科综合】常温下,向10mL0。
1mol·L—1的HR溶液中逐渐滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是()A. a~b点导电能力增强,说明HR为弱酸B. b点溶液pH=7,此时酸碱恰好中和C. b、c两点水的电离程度:b<cD. c点溶液存在c(NH4+)〉c(R-)、c(OH-)>c(H+)【答案】C典例三、【考点定位】考查限制条件下的离子共存问题、水电离的影响因素,水的离子积的计算,元素及其化合物的性等知识。
2014届高二化学反应原理第三章 电解质溶液知识梳理

高二化学第三章水溶液中的离子平衡第一节一、强弱电解质1、电解质:在或状态下能够导电的叫做电解质。
2、电解质分类强电解质强酸强碱按照程度盐弱酸弱电解质弱碱水3、思考:1)、Cu、食盐水是电解质吗?为什么?2)、电解质一定能导电吗?3)、电解质溶液中各微粒的存在形式?强电解质溶液中:离子分子弱电解质溶液中:离子分子4)、强电解质的导电性一定强于弱电解质吗?电解质溶液的导电性强弱与什么因素有关?5)有下列物质:①CH3COONa ②Ba(OH)2 ③CaCO3 ④SO2 ⑤Cl2⑥H2O ⑦C2H5OH ⑧NH4Cl ⑨C6H5OH其中(填序号)属于强电解质的是_____________,属于弱电解质的是________________ 二、弱电解质的电离平衡影响电离平衡的外界因素①温度,促进电离。
②浓度,加水稀释电离。
按要求完成下列表格的内容:写出电离方程式,并判断外界条件对平衡移动的影响。
练习题:1、下列物质中,属于强电解质的是()A、CO2B、盐酸C、BaSO4D、NaOH溶液2.下列物质中,能够导电而且是电解质的是()A.熔融的氢氧化钠B.稀盐酸C.硝酸钾晶体 D. 融化的铁3、下列叙述中正确的是()A、氯化钠溶液能导电,所以氯化钠溶液是电解质;B、固体氯化钠不导电,所以氯化钠不是电解质;C、氯化氢溶液能导电,所以氯化氢是电解质;D、氯气(Cl2)溶于水能导电,所以氯气是电解质,3、电解质溶于水后电离出的阴、阳离子是能够导电的,而且溶液的导电能力与溶液中离子所带的电荷的浓度有关,下列溶液的导电能力最强的是( ) A、0.2 mol/L NaCl溶液B、0.15 mol/L MgCl2溶液C、0.2 mol/L BaCl2溶液D、0.25 mol/L HCl溶液4、在做溶液导电性的实验装置中盛一定量的CuSO4溶液,此时通电,灯泡发光,再不断的加入某种物质,会发现灯泡逐渐变暗,直至熄灭,持续加入该物质灯泡会再次逐渐变亮,据此分析加入的物质是( ) A、Zn粒B、BaCl2溶液C、KOH溶液D、Ba(OH)2溶液5.常温下,关于等体积、等浓度的盐酸和醋酸说法正确的是()A.溶液中的氢离子浓度相等B.溶液中微粒的种类一样多C.导电能力盐酸大于醋酸,中和等量的氢氧化钠时消耗的物质的量一样多D.分别加入完全相同的足量镁条,与盐酸反应的起始速率快,与醋酸反应最终产生的氢气多高二化学第三章水溶液中的离子平衡第二节一、水的电离平衡1、定义,纯水中,氢离子与氢氧根离子的乘积为K W = c(H+) . c(OH-)25℃时,K W = c(H+) . c(OH-) =实验测定,该温度下,稀溶液中都有这样的关系,即K W = c(H+) . c(OH-) =2、如果温度高于25℃时,水的电离程度,K W值。
基础化学第三版习题解答

基础化学(第3版)思考题和练习题解析第一章 绪 论1. 为什么说化学和医学的关系密切,医学专业学生必须学好化学?答:(略)2. “1 mol 硫酸的质量是98.0g ”,对吗?答:错误!未指明基本单元,正确说法是1 mol H 2SO 4的质量是98.0g 或1 mol[(1/2) (H 2SO 4)]的质量是49.0g 。
3. 0.4 mol H 2SO 4溶解于水,配成500 m L 溶液,其浓度表示正确的是A. c (H 2SO 4) = 0.8 mol·L -1B. c [21(H 2SO 4)] = 0.8 mol·L -1 C. c [21 (H 2SO 4) ]= 0.4 mol·L -1 D. 硫酸的浓度为0.8 mol·L -1 答;正确的是A 。
根据定义,1L 溶液中含有0.8 mol H 2SO 4,c (H 2SO 4) = 0.8 mol·L -1。
4. 下列说法正确的是A. “1 mol O ”可以说成“1 mol 原子O ”B. 1摩尔碳C 原子等于12gC. 1 L 溶液中含有H 2SO 4 98 g ,该溶液的摩尔浓度是1 mol·L -1D. 基本单元不仅可以是构成物质的任何自然存在的粒子或粒子的组合,也可以是想象的或根据需要假设的种种粒子或其分割与组合答:正确的是D 。
A 应说成“1 mol 氧原子”;B 应为“1摩尔碳C 原子的质量等于12g ”; C 不应该使用“摩尔浓度”,此术语已被废除。
5. 求0.100kg (21Ca 2+)的物质的量。
解:M (21Ca 2+) =(40.08 / 2)= 20.04 (g · mol -1), n (21Ca 2+) = [ m / M (21Ca 2+) ] = (0.100×103 )/20.04 = 4.99 (mol) 6. 每100m L 血浆含K + 为20mg ,计算K +的物质的量浓度,单位用mmol·L -1表示。
电解质溶液习题及答案 (2)
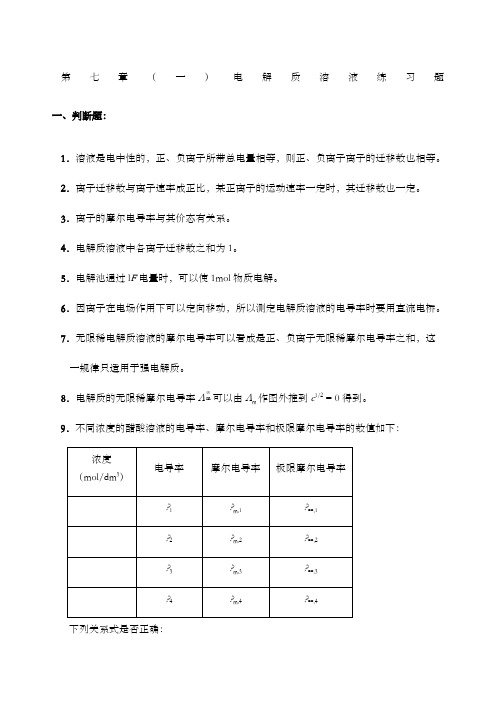
第七章(一)电解质溶液练习题一、判断题:1.溶液是电中性的,正、负离子所带总电量相等,则正、负离子离子的迁移数也相等。
2.离子迁移数与离子速率成正比,某正离子的运动速率一定时,其迁移数也一定。
3.离子的摩尔电导率与其价态有关系。
4.电解质溶液中各离子迁移数之和为1。
5.电解池通过l F电量时,可以使1mol物质电解。
6.因离子在电场作用下可以定向移动,所以测定电解质溶液的电导率时要用直流电桥。
7.无限稀电解质溶液的摩尔电导率可以看成是正、负离子无限稀摩尔电导率之和,这一规律只适用于强电解质。
8.电解质的无限稀摩尔电导率Λ m可以由Λm作图外推到c1/2 = 0得到。
9.不同浓度的醋酸溶液的电导率、摩尔电导率和极限摩尔电导率的数值如下:下列关系式是否正确:(1) ?∞,1<?∞,2<?∞,3<?∞,4(2)κ1=κ2=κ3=κ4(3) ?∞,1=?∞,2=?∞,3=?∞,4(4)?m,1=?m,2=?m,3=?m,410.德拜—休克尔公式适用于强电解质。
11.对于BaCl2溶液,以下等式成立:(1) a = γb/b0;(2) a = a+·a - ;(3) γ± = γ+·γ - 2;(4) b = b+·b-;(5) b±3 = b+·b-2;(6) b± = 4b3。
12.若a(CaF2) = ,则a(Ca2+) = ,a(F-) = 1。
二、单选题:1.下列溶液中哪个溶液的摩尔电导最大:(A) KCl水溶液;(B) HCl水溶液;(C) KOH水溶液;(D) KCl水溶液。
2.对于混合电解质溶液,下列表征导电性的量中哪个不具有加和性:(A) 电导;(B) 电导率;(C) 摩尔电导率;(D) 极限摩尔电导。
3.在一定温度和较小的浓度情况下,增大强电解质溶液的浓度,则溶液的电导率κ与摩尔电导Λm变化为:(A) κ增大,Λm增大;(B) κ增大,Λm减少;(C) κ减少,Λm增大;(D) κ减少,Λm减少。
电解液考试试题及答案

电解液考试试题及答案一、选择题1. 电解液是指在电解过程中能够导电的溶液。
以下哪种溶解度(Ksp)最大的化合物不属于电解液?A. NaClB. KClC. H2SO4D. AgCl答案:D2. 电解质的导电性与以下哪个因素没有直接关系?A. 电解质浓度B. 电解质种类C. 温度D. 溶剂种类答案:D3. 在电解质溶液中,电流的通量最大的区域是:A. 阳极B. 阴极C. 电解液的中间区域D. 与电解液无直接接触的区域答案:A4. 以下哪个物质不属于强电解质?A. HClB. H2OC. KOHD. HNO3答案:B5. 电解的实质是:A. 氧化反应B. 还原反应C. 酸碱中和反应D. 电子传导答案:D二、填空题1. 电解质在电解过程中会分解成(1)和(2)。
答案:(1)阳离子;(2)阴离子2. 电解液导电性随着溶液浓度的(1)而(2)。
答案:(1)增加;(2)增大3. 电解质溶液中的电荷载流子是(1)和(2)。
答案:(1)阳离子;(2)阴离子4. 当电流通过电解液时,阴极上发生(1)反应,阳极上发生(2)反应。
答案:(1)还原;(2)氧化5. 电解质溶液导电性与电流强度之间呈(1)关系。
答案:(1)直线正比三、问答题1. 简述电解质和强电解质的区别。
答:电解质是指在电解过程中能够导电的溶液,可以分为强电解质和弱电解质。
强电解质在水中完全离解成离子,导电性强,如盐酸、硫酸等。
而弱电解质只有部分分子离解成离子,导电性较弱,如乙酸、碳酸等。
因此,强电解质的离子浓度较高,电导率大。
2. 什么因素会影响电解质溶液的导电性?答:以下因素会影响电解质溶液的导电性:(1)电解质的浓度:电解质浓度越高,溶液中离子浓度也越高,导电性越强。
(2)温度:通常情况下,溶液的温度越高,离子的运动速率越快,导电性越强。
(3)溶剂种类:不同的溶剂对电解质的溶解度不同,溶解度越高,电解质的导电性越强。
3. 请解释电解的实质是什么?答:电解的实质是电子传导。
第三章 电解质溶液 练习题

第三章电解质溶液一、是非题[1] 弱酸的标准解离常数愈大,其解离度一定也愈大。
()[2] 如果将NaOH及NH3·H2O溶液均稀释一倍,则两溶液中c(OH- )均减小到原来的二分之一。
.()[3] 因为难溶盐类在水中的溶解度很小,所以它们都是弱电解质。
()[4]根据酸碱质子理论,对于反应HCN + H 2O H3O+ + CN-来说,H2O和CN-都是碱。
()[5] 计算H2S饱和溶液的c(H+ )时,可只按K(H2S)计算。
因此,当H2S溶液中加入Na2S 时,将不改变H2S溶液中的c (H+ )。
()二、选择题[1] pH = 2.00的溶液与pH = 5.00的溶液,c (H+ )之比为()。
(A) 10;(B) 1000;(C) 2;(D) 0.5。
[2] pH = 1.00的HCl溶液和pOH = 13.00的HCl溶液等体积混合后,溶液的pH值为.()。
(A) 1.00;(B) 13.00;(C) 7.00;(D) 6.00。
[3] 通常,在HAc (aq)平衡组成计算中,常取K(HAc) = 1.75 ×10-5,是因为()。
(A) K与温度无关;(B) 实验都是在25℃条件下进行的;(C) 温度为25℃,溶液浓度为1.0 mol·L-1时,K(HAc) = 1.75 ×10-5;(D) K随温度变化不明显。
[4] 某一弱碱强酸盐MA,其标准水解常数K=1.0 ×10-9,则相应弱碱的标准解离常数K 为.()。
(A) 1.0 ×10-23;(B) 1.0 ×10-5;(C) 1.0 ×10-9;(D) 1.0 ×10-14。
[5] 已知:K(HCN) = 6.2 ×10-10,则NaCN的标准水解常数为()。
(A) 1.6 ×10-6;(B) 6.2 ×10-10;(C) 6.2 ×10-24;(D) 1.6 ×10-5。
基础化学第三章 电解质溶液

i的理论值应=2, i 的实验值=1.87 i的实验值< i的理论值
理论推导得
=
i-1 n-1
n: 解离出的离子数
Tf=iKfbB i=1.87 n=2
表观解离度=0.87
强电解质溶液理论
凝固点法测定电解质的校正因子
电解质 cB(mol·L-1) 度
NaCl 0.10
理论i 值
2
实验i 值 表观解离
I=d=ef=
1 2
∑i bi Zi2
bi~i离子质量摩尔浓度 Zi~i离子的电荷数
I =1/2(b1Z12 + b2Z22 + b3Z32 +‥‥) =1/2∑ibiZi2
I单位:mol·kg-1, 近似计算时可用ci代替bi
例:某溶液中有0.1mol·L-1NaCl和0.1mol·L-1 HAc, 求溶液的离子强度 I
X射线实验和强电解质溶液理论认为: 强电解质完全解离
二、强电解质溶液理论
离子相互作用理论
(1) 强电解质在水溶液中100%解离
. . (2) 离子间静电吸引和排斥,形成离子氛
Na+ Cl-
Na+ Cl-
溶液极稀时,每一NaCl分子可产生两个质点
i=2
Na+ 溶液极浓时,i → 1
Cl-
Na+ Cl-
解: 溶液中离子 [Na+]=[Cl-]= 0.1mol·L-1 [H+]和[Ac-]可忽略不计
I=1/2{[Na+] ×12 + [Cl-] ×(-1)2} =1/2[0.1×12 +0.1×(-1)2] =0.1
例:某溶液中有0.1mol·L-1NaCl和0.1mol·L-1 NaAc , 求溶液的离子强度 I
电解质溶液习题解答

第八章电解质溶液习题解答(总7页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--第八章 习题解答1、在300K 和100kPa 压力下,用惰性电极电解水以制备氢气。
设所用直流电的强度为5A ,电流效率为100%。
来电解稀H 2SO 4溶液,如欲获得1m 3氢气,须通电多少时间如欲获得1m 3氧气,须通电多少时间已知在该温度下水的饱合蒸气压为3565Pa 。
解 电解时放出气体的压力为 p=()Pa=96435Pa 1m 3气体的物质的量为311(96435)(1)/()38.6637(8.314)(300)Pa m n pV RT mol J K mol K --⨯===⋅⋅⨯ 氢气在阴极放出,电极反应为 2H ++2e -→H 2(g)根据法拉第定律,It=ξzF=(Δn B /νB )·zF , t=(Δn B /νB I)·zF 放氢时,12=H ν,z=2,11(38.6637)2(96500)1492418.821(5)mol t C mol s C s --=⨯⨯⋅=⨯⋅。
氧气在阳极放出,电极反应为 2H 2O-4e -→O 2(g)+4H + 放氧时,12=O ν,z=4,11(38.6637)4(96500)2984837.641(5)mol t C mol s C s --=⨯⨯⋅=⨯⋅。
2、用电解NaCl 水溶液的方法制备NaOH ,在通电一段时间后,得到了浓度为·dm -3的NaOH 溶液,在与之串联的铜库仑计中析出了的Cu(s)。
试计算该电解池的电流效率。
解 析出Cu(s)的反应为Cu 2++2e -→Cu电解NaCl 水溶液制备NaOH 的反应为 阴极上的反应 2H 2O+2e -→2OH -+H 2(g) 阳极上的反应 2Cl --2e -→Cl 2(g)电解总反应为 2H 2O+2NaCl →Cl 2(g)+H 2(g)+ 2NaOH即铜库仑计中若析出1molCu(s),则理论上在电解池中可得到2 mol 的NaOH 。
电解质溶液-学生解析

3608电解时,主要承担电量迁移任务的离子与首先在电极上发生反应的离子间有什么关系?()(A)没有任何关系(B)有某种关系(C)有无关系视相对电迁移率的大小而定3667 (D)两者总是一致的3610已知Cu的相对原子量为64,用0.5法拉第电量可从CuSO4溶液中沉淀出多少Cu()(A) 16 g (B) 32 g(C) 64 g (D) 127 g3611H2S2O8可由电解法制取,阳极反应为:2H2SO4 →H2S2O8 + 2H+ + 2e-,阳极副反应为O2的析出。
阴极析氢效率为100%,已知电解产生H2,O2的气体体积分别为9.0 L和2.24 L(标准态下),则生成H2S2O8的物质的量为:()(A) 0.1 mol (B) 0.2 mol(C) 0.3 mol (D) 0.4 mol3612法拉第电解定律限用于:()(A) 液态电解质(B) 无机液态或固态电解质(C) 所有液态或固态电解质(D) 所有液态、固态导电物质3613将铅酸蓄电池在10.0 A电流下充电1.5 h,则PbSO4分解的质量为()(A) 84.8 g (B) 169.6 g(C) 339.2 g (D) 无法确定(已知M r(PbSO4) = 303)3614按物质导电方式的不同而提出的第二类导体,下述对它特点的描述,哪一点是不正确的?()(A)其电阻随温度的升高而增大(B)其电阻随温度的升高而减小(C)其导电的原因是离子的存在(D)当电流通过时在电极上有化学反应发生3615描述电极上通过的电量与已发生电极反应的物质的量之间的关系的是:()(A) 欧姆定律(B)离子独立运动定律(C)法拉第定律(D)能斯特定律3617当一定的直流电通过一含有金属离子的电解质溶液时,在阴极上析出金属的量正比于:()(A) 阴极的表面积(B) 电解质溶液的浓度(C) 通过的电量(D) 电解质溶液的温度3618电解熔融NaCl时,用10 A的电流通电5 min,能产生多少金属钠?()(A) 0.715 g (B) 2.545 g(C) 23 g (D) 2.08 g3620在CuSO4溶液中用铂电极以0.1 A的电流通电10 min,在阴极上沉积的铜的质量是:()(A)19.9 mg(B) 29.0 mg(C) 39.8 mg (D) 60.0 mg3621在NiI2的水溶液中,通过24 125 C的电量后,沉积出金属镍(M r=58.7)的质量最接近于:()(A) 7.3 g (B) 14.6 g(C) 29.2 g (D) 58.7 g3622电解硫酸铜溶液时,析出128 g铜(M r =64),需要通入多少电量?()(A) 96 500 C (B) 48 250 C(C) 386 000 C (D) 24 125 C36231 mol电子电量与下列哪一个值相同?()(A) 1安培·秒(B) 1库仑(C) 1法拉第(D) 1居里3624使2000 A的电流通过一个铜电解器,在1 h 内,能得到铜的质量是:()(A) 10 g (B) 100 g(C) 500 g (D) 2 700 g3625用0.1 A的电流,从200 ml 浓度为0.1 mol·dm-3的AgNO3溶液中分离Ag,从溶液中分离出一半银所需时间为:()(A) 10 min (B) 16 min(C) 100 min (D) 160 min3651离子电迁移率的单位可以表示成( )(A) m·s-1(B) m·s-1·V-1(C) m2·s-1·V-1(D) s-13653水溶液中氢和氢氧根离子的电淌度特别大,究其原因,下述分析哪个对?()(A) 发生电子传导(B) 发生质子传导(C) 离子荷质比大(D) 离子水化半径小3654在一定温度和浓度的水溶液中,带相同电荷数的Li+、Na+、K+、Rb+、…,它们的离子半径依次增大,但其离子摩尔电导率恰也依次增大,这是由于:()(A) 离子淌度依次减小(B) 离子的水化作用依次减弱(C) 离子的迁移数依次减小(D) 电场强度的作用依次减弱3666电解质溶液中离子迁移数(t i) 与离子淌度(U i) 成正比。
基础化学试题库[试题库_答案解析]
![基础化学试题库[试题库_答案解析]](https://img.taocdn.com/s3/m/850fd628f61fb7360a4c65a0.png)
第二章稀溶液依数性练习题一、是非题(共10题)1. 溶液的沸点是指溶液沸腾温度不变时的温度。
()2. 溶液与纯溶剂相比沸点升高、凝固点降低是由于溶剂摩尔分数减小引起的。
()3. 等物质的量硝酸钾和碳酸钾分别加入等量的水中,该两溶液的蒸气压下降值相等。
()4. 凡是浓度相等的溶液都是等渗溶液。
()5. 溶液的蒸气压下降和沸点升高仅适用于难挥发的非电解质溶质,而凝固点降低及渗透压则不受此限制。
()6. 电解质浓溶液也有依数性变化规律,但不符合拉乌尔定律的定量关系。
()7. 一定量的电解质加入纯水中,此溶液的沸点一定高于100 C,但无法定律计算。
()8. 任何两种溶液用半透膜隔开,都有渗透现象发生。
()9. 分散质粒子大小在合适的范围内,高度分散在液体介质中就能形成稳定的溶胶。
()10. AICI3、MgCl2、KCI三种电解质对负溶胶的聚沉值依次减小。
()二、选择题(共11题)1. 以下论述正确的是( )(A)饱和溶液一定是浓溶液(B)甲醇是易挥发性液体,溶于水后水溶液凝固点不能降低(C)强电解质溶液的活度系数皆小于1(D)质量摩尔浓度数值不受温度变化2. 已知乙醇和苯的密度分别为0.800 g c m-3和0.900 g •m-3若将86.3cm3乙醇和901 cm3苯互溶,则此溶液中乙醇的质量摩尔浓度为---------------------------------------------------- ( )(A) 1.52 mol dm-3(B) 1.67 mol dm-3(C) 1.71 mol kg-1(D) 1.85 mol kg-13. 2.5 g某聚合物溶于100 cm3水中,20C时的渗透压为100 Pa,则该聚合物的相对分子质量是--------------- ( )(A) 6.1 X102(B) 4.1 X104(C) 6.1 X105(D) 2.2 X1064 1.0 mol dm-3蔗糖的水溶液、1.0mol dm-3乙醇的水溶液和1.0 mol dm-3乙醇的苯溶液,这三种溶液具有相同的性质是---------------------------------------------- ( ) (相对原子质量:Na 23, Cl 35.5)6. 同温同浓度的下列水溶液中,使溶液沸点升高最多的溶质是 ------------------------- ( )(A) CuS04 (B) K 2SO 4 (C) Ab(SO 4)3(D) KAl(SO 4)21.00 C ,必须向200 g 水中加入 CaC 2的物质的2=1.86K kg mol -1) -------------------------------------------------------------------------(A) 1.08 mol (B) 0.108 mol (C) 0.0540 mol (D) 0.0358 mol8.某难挥发非电解质稀溶液的沸点为100.400 C ,则其凝固点为5.(A)渗透压 (B)凝固点(C)沸点1.17 % 的 (D)以上三种性质都不相同NaCI 溶液产生的渗透压接近于(A) 1.17 % 葡萄糖溶液 (B) 1.17 % 蔗糖溶液 (C) 0.20 mol •m -3葡萄糖溶液(D) 0.40 mol dm -3 蔗糖溶液7.要使溶液的凝固点降低(水的K b= 0.512 K k g mol-1, K f= 1.86 K k g mol-1)(A) -0.110 C (B) -0.400 C (C) -0.746 C溶液的蒸气压(B) 一定升高(C) 不变(D) 需根据实际情况做出判断若溶质是挥发性很大的化合物就不一定降低10. 60 C时,180 g水中溶有180 g葡萄糖,已知60 C时水的蒸气压为19.9 kPa, C6H12O6的相对分子质量为180,则此水溶液的蒸气压应为----------------------------------------------- ( )(A) 1.81 kPa (B) 9.95 kPa (C) 15.9 kPa (D) 18.1 kPa11.若氨水的质量摩尔浓度为mmol kg-1,则其中NH3的摩尔分数为-------( )(A)-m(B)m1000/18 [(1000-17 m)/18]+ m m(C) (D) 不确定(1000/18) + m (D) -1.45 C9.与纯溶剂相比(A) 一定降低三、填空题(共8题)1. (2 分)体温为37C时,血液的渗透压为775 kPa,此时与血液具有相同渗透压的葡萄糖(相对分子质量为180)静脉注射液的浓度应为_____________________________ g •m-3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
c (OH-) < 1.38×10-6 mol· -3(NH ) dm c
3
缓冲体系: c(OH-) = Kb c(NH +) 4 1.38×10-6 = 1.76×10-5 ×[1/2(1.0×10-2)/ c(NH4+) ]
6 13 103 c( HAc) 0.078mol dm 3 1
c( HAc) pH pKa l g c( Ac ) 4.75 l g 5.72 0.078 0.735
• (2) HCl+Ac-=HAc+Cl• c(Ac-)=0.735-0.10=0.635 mol· -3 dm • c(HAc)=0.078+0.10=0.178 mol· -3 dm
21 (1)
Ag2CrO4(s) = 2Ag+ + CrO42-…………..(a) AgCl (s) = Ag+ + Cl-…………………….(b) (a) - 2 ×(b)得 Ag2CrO4(s) + 2Cl- = 2AgCl(s) + CrO42K Ө = K Өa / (K
Ө )2 b
= Ksp(Ag2CrO4) / [Ksp(AgCl)]2
• • • • • •
1.计算下列各溶液的H+、OH-离子浓度和pH值。 (1) 0.0010 mol· -3H2SO4溶液。 dm (2)0.010mol· -3NaOH溶液。 dm (3)0.050mol· -3HAc溶液。 dm (4)0.50mol· -3NH3· 2O溶液。 dm H 解: (1) HSO4- ⇌ H+ + SO42平衡浓度 / mol· -3 dm 0.0010-x 0.0010+x x
•10.取100g NaAc· 2O,加入13cm-3的6mol· -3HAc,再用水稀释至 3H dm 1dm-3,此缓冲溶液的pH值为多少?若向此溶液中通入0.10molHCl气 体(忽略体积变化),求溶液pH值变化了多少。 •解: (1) 100 c( Ac ) 0.735mol dm 3 136.02 1
pH = 14-pKb + lg (cb/cs) = 14 - 4.75 +lg(0.05/0.50) = 8.25 即c(OH-)= 1.78×10-6 Ksp(Mn(OH)2) = 1.9×10-13 Q = c(Mn2+) c2(OH-) = (0.001 )× [1014 - 8.25]2 = 3.16 ×10-15< Ksp(Mn(OH)2) = 1.9×10-13
•
2Ag+ + SO42平衡浓度/ mol· -3 dm s s ∴Ksp(Ag2SO4 )=c2(Ag+ )· c(SO42-)=(2s)2s=4s3= 1.4×10-5 ∴s= 1.52×10-2 mol· -3 dm ∴ Ag2SO4 在水中的溶解度比AgCl大。
Ag2SO4 ⇌
21 根据多重平衡的原理计算下列各反应的平衡常数(KӨ) (1)Ag2CrO4(s) + 2Cl- = 2AgCl(s) + CrO42(2) Mg(OH)2(s) + 2NH4+ = Mg2+ + 2NH3· 2O H (3)ZnS (s) + Cu2+ = CuS (s) + Zn2+ (4) NH4+ + Ac- + H2O = HAc + NH3· 2O H
•
pH pKa l g
c ( HAc) c ( Ac )
0.178 4.75 l g 0.635 5.30
• pH=5.30-5.72=-0.42 • 即pH值降低了0.42。
11、在10毫升的0.0015mol· -3的MnSO4溶液中,加入5毫升 dm 0.15mol· -3的氨水和0.495克硫酸铵晶体(不考虑体积效应),通 dm 过计算说明有无Mn(OH)2沉淀生成?
= (9 ×10-12) / (1.56 × 10-10)2
= 3.7 ×108
21 (2)
Mg(OH)2(s) = Mg2+ + 2OH-……………(a)
NH3· 2O = NH4+ + OH-………………..(b) H (a) – 2 × (b)得:
Mg(OH)2(s) + 2NH4+ = Mg2+ + 2NH3· 2O H KӨ = K Өa / (K Өb )2 = Ksp[Mg(OH)2) / [Kb(NH3· 2O)]2 H
= (1.8×10-11)/(1.77×10-5)2
= 5.7×10-2
21(3) ZnS (s) = Zn2+ + S2-…………………..(a) CuS(s) = Cu2+ + S2-…………………..(b) (a)-(b)
ZnS (s) + Cu2+ = CuS (s) + Zn2+
KӨ = K Өa / K Өb = Ksp(ZnS) / Ksp(CuS) = (1.2×10-23)/(8.5×10-45) = 1.4×1021
Ka
12(2)、解: 平衡浓度/mol· -3 dm
NH3· 2O + HCl = NH4Cl + H2O H
(0.1×20)/30
c(NH3· 2O)= 0.1×(20-20)/(20+20) = 0 mol· -3 H dm
c(NH4+) = 0.1×20/(20+20) = 0.05 mol· -3 dm 此体系是NH4Cl的水解体系,由于NH4Cl是强酸弱碱盐,所 以溶液现酸性, pH < 7
Hale Waihona Puke c(NH4+) = 0.0644 mol· -3 dm
M(NH4Cl) = 53.49 m(NH4Cl) = 0.0644×200×10-3×53.49 = 0.69 (克)
• 16.已知室温下AgCl,Ag2SO4的溶度积,试通过计算比较两者在水中 溶解度的大小。 • 解:Ksp(AgCl)=1.56×10-10,Ksp(Ag2SO4)=1.4×10-5 • AgCl ⇌ Ag+ + Cl• 平衡浓度/ mol· -3 dm s s • ∴Ksp(AgCl)=c(Ag+ )· -)=s2= 1.56×10-10 c(Cl • ∴s= 1.25×10-5 mol· -3 dm • • • • •
pH = lg0.02 =1 .7
• • • • • • • • • • • • • • • •
15.根据PbI2的溶度积,计算(298K时) (1) PbI2在纯水中的溶解度(mol· -3)。 dm (2) PbI2在0.010 mol· -3KI溶液中的溶解度。 dm (3) PbI2在0.010mol· -3Pb(NO3)2溶液中的溶解度。 dm 解: (1)Ksp(PbI2)=1.39×10-8 PbI2 ⇌ Pb2+ + 2I平衡浓度/ mol· -3 dm s 2s ∴Ksp(PbI2)=c(Pb2+)·2(I-) c =s · 2=4s3= 1.39×10-8 (2s) ∴s= 1.51×10-3 mol· -3 dm (2) PbI2 ⇌ Pb2+ + 2I平衡浓度/ mol· -3 dm s 2s+0.010 ∴Ksp(PbI2)=c(Pb2+)·2(I-) c =s · (2s+0.010)2= 1.39×10-8 , ∵s 很小,∴ 2s+0.010≈ 0.010 ∴s= 1.39×10-4 mol· -3 dm
解: c(Mn2+) = 0.0015 ×10/15=0.001 mol· -3 dm
c(NH3) = 0.15×5/(10+5) = 0.05 mol· -3 dm M [(NH4)2SO4)] = 132.1
c (NH4+)=2 (0.495/132.1) / (15×10-3) = 0.50mol· -3 dm
c( H ) K h c pH 5.27
KW c 5.31 10 6 m ol L1 Kb
12 (3 )、解: 平衡浓度/mol· -3 dm
NH3· 2O + HCl = NH4Cl + H2O H
(0.1×10)/50
c(HCl)= 0.1×10/(30+20) = 0.02 mol· -3 dm 此体系是HCl体系,由于HCl是强酸,所以溶液现酸性,
17
在100cm-3 0.20 mol· -3MnCl2溶液中,加入等体积 dm
的含有NH4Cl的1.0×10-2mol· -3氨水,问其中含多少克 dm NH4Cl,与MnCl2溶液混合时才不致于产生Mn(OH)2沉淀?
17 解: Ksp[Mn(OH)2]=1.9×10-13 c(Mn2+) = 0.10 mol· -3 dm Mn(OH)2 (s) = Mn2+(aq) + 2OH-(aq)
12(1)、解: 平衡浓度/mol· -3 dm
NH3· 2O + HCl = NH4Cl + H2O H [0.1×(20-10)]/30
(0.1×10)/30
c(NH3· 2O)= 0.1×(20-10)/(20+10) = 0.033mol· -3 H dm
c(NH4+) = 0.1×10/(20+10) = 0.033 mol· -3 dm 此体系是缓冲体系 pH = 14- pKb +lg [c(NH3· 2O)/ c(NH4+)] = 14- 4.75 + lg(0.033/0.033) H = 9.25
