如何使用quantityone计算条带灰度值
qualityone教程使用简介

凝胶定量软件Quantity One使用简介1、内容简介凝胶电泳是每个做分子生物学的同学天天都要打交道的基本技术。
电泳之后的信息处理与电泳本身同样重要。
目前有大量软件可以用于分析电泳结果,比较有名的比如BandScan、BandLeader、Sigma Gel等等。
今天要向大家介绍的是来自Bio-Rad的1D凝胶定量软件Quantity One(Bio-Rad还有一个做2D凝胶分析的软件PDQuest)。
这个软件的最新版本可以在Bio-Rad的主页免费下载。
目前的最新版本是4.52版2、Quantity One的定量方法Quantity One的分析功能顾名思义主要用来进行凝胶或者培养皿的荧光定量分析。
它的分析功能或者说分析方式主要有4种:泳道/条带轨迹定量法;等高线直接定量法;菌落计数;分子量测定这三种方法中使用最为方便也是最为广泛的应该是等高线定量法(Volumn Contour)。
它通过半自动描绘电泳条带的等高线边缘来得到等高线区域内部面积,再将该面积乘以区域内平均光密度值得到条带内部总的信号量。
当然这种分析方法的弊病显而易见:无法同等得排除不同泳道的背景亮度;等高线的绘制处于“半自动”状态,即需要人为判断作为等高线标准的电泳条带的边缘;最致命的是在几个电泳条带距离十分接近的时候几乎无法绘制单一条带的轮廓(常出现连续的几个条带等高线相连而无法分离出单独条带的轮廓)。
三种方法中个人感觉最为科学和严谨的应该是泳道/条带轨迹定量法(Trace Tracking)。
这种方法使用起来步骤较为繁琐,必须通过泳道识别---电泳条带识别两个连续的步骤才能进行定量。
然而这种方式的最大优点在于它可以完全抛弃人为主观因素进行全自动定量。
他的定量方式为:首先根据不同电泳条带的光密度值绘制光密度曲线,然后计算光密度曲线下面积作为电泳条带的定量根据。
大家可能会问他能不能排除泳道背景?答案是肯定的,它能够最大程度的排除不同泳道之间的背景差异,让各个泳道上的不同电泳条带在一条几乎相同的起跑线上进行对比。
QuantityOne 说明

这三种方法中使用最为方便也是最为广泛的应该是等高线定量法(Volumn Contour)。
它通过半自动描绘电泳条带的等高线边缘来得到等高线区域内部面积,再将该面积乘以区域内平均光密度值得到条带内部总的信号量。
当然这种分析方法的弊病显而易见:无法同等得排除不同泳道的背景亮度;等高线的绘制处于“半自动”状态,即需要人为判断作为等高线标准的电泳条带的边缘;最致命的是在几个电泳条带距离十分接近的时候几乎无法绘制单一条带的轮廓(常出现连续的几个条带等高线相连而无法分离出单独条带的轮廓)。
三种方法中个人感觉最为科学和严谨的应该是泳道/条带轨迹定量法(Trace Tracking)。
这种方法使用起来步骤较为繁琐,必须通过泳道识别---电泳条带识别两个连续的步骤才能进行定量。
然而这种方式的最大优点在于它可以完全抛弃人为主观因素进行全自动定量。
他的定量方式为:首先根据不同电泳条带的光密度值绘制光密度曲线,然后计算光密度曲线下面积作为电泳条带的定量根据。
大家可能会问他能不能排除泳道背景?答案是肯定的,它能够最大程度的排除不同泳道之间的背景差异,让各个泳道上的不同电泳条带在一条几乎相同的起跑线上进行对比。
这个背景排除功能是等高线法无法做到的(等高线法也有基本的背景排除办法,但是和泳道/条带轨迹定量法的背景排除不是一个等级的。
等高线法只能排除同一泳道上的背景,而不能均等的排除不同泳道的背景)。
另外泳道/条带轨迹定量法还可以结合Gauss Model Bands对紧密相连的电泳条带进行分析,而这种条带也是等高线法无法分析的。
我们此次重点学习这个方法。
第三个分析功能是菌落计数(Colony Counting)。
这个功能其实很实用,可以分析蓝白筛选的结果。
但是很奇怪我的电脑居然无法运行这个功能,因此无法向大家介绍了。
另外Quantity One还可以通过回归曲线测定分子量下面让我们了解一下Quantity One常用的基本菜单操作。
利用Quantity One软件分析DGGE条带

Click here to change the sensitivity value to get more bands
Click the ’match’ button to match all the bands to the model band automately
Click here to enter a appropriate tolence value to identify the minimum distances between bands
Optimize Image
Open a file to acquire an image
Before you can use Quantity One to analyze a biological image, you need to capture the image and save it as an image file. This may be done with one of the several BioRad imaging instruments supported by this software
Click here to detect the bands automately
Click here to add the bands which could not be detected by the software Click here to adjust the site of the bands
How to analysis the DGGE band What is the information we can get from it?
Reported by JW Li
Steps Involved in Quantity One
Quantity One说明

功能强大的操作、分析软件“Quantity One”简介“Quantity One”是Bio-Rad公司图像系列产品的操作和分析软件。
主要用来定量和分析荧光、化学发光、放射性同位素、化学染色物标记的各种单向电泳、杂交点和条带、TCL 板、酶标板、培养皿的克隆斑等。
“Quantity One”能在Windows 98、Windows 95、Windows NT 4.0、Macintosh 9500(或更高)环境下运行。
窗口设计有下拉式菜单、图像工具栏、菜单操作提示栏等,界面设计十分友好、非常简单易学。
“Quantity One”的图像文件以Tiff文本格式输出,可以方便的进入其它的图像处理软件进行更深一步的图像处理和编辑。
同时,分析数据可以直接转入到Micro Excel,以报告形式排版、打印。
每套“Quantity One”软件都有相对应的进入密码(Unique Password)和软件狗(Hardware Protection keys),并附有详尽的软件操作说明书。
1.“Quantity One”的运行程序打开操作界面输入操作指令,进行图像采集图像初步优化图像处理各种功能分析文字注解和打印格式2.“Quantity One”的主要功能和优势2.1“Quantity One”的图像采集功能步骤一:自动选择仪器的配置根据您的标记信号类型,“Quantity One”能自动选择激光波长和滤波片,使整个光路调整到适当的工作状态。
步骤二:选择扫描范围GelDoc2000提供的最大扫描面积为25cm×26cm,您可以根据样品放置的位置和大小,任意选择所需的扫描范围。
步骤三:扫描、采集图像GelDoc2000的扫描、采集图像和计算机成像同步进行,您可以随时从屏幕上观察到扫描的结果。
2.2“Quantity One”的分析功能及优势1.“Quantity One”的图像优化处理工具栏“Quantity One”的图像处理功能主要移植于Photoshop “Quantity One”可以进行背景噪音过滤,梯度背景扣除,背景灰度调节,图像的放大和缩小,图像旋转,图像修饰等图像优化和处理工作。
凝胶定量软件QuantityOne使用简介1内容简介凝胶电泳是每个做

凝胶定量软件Quantity One使用简介1 内容简介凝胶电泳是每个做分子生物学的同学天天都要打交道的基本技术。
电泳之后的信息处理与电泳本身同样重要。
目前有大量软件可以用于分析电泳结果,比较有名的比如BandScan、BandLeader、Sigma Gel等等。
今天要向大家介绍的是来自Bio-Rad的1D凝胶定量软件Quantity One(Bio-Rad还有一个做2D凝胶分析的软件PDQuest)。
这个软件的最新版本可以在Bio-Rad的主页免费下载。
2 Quantity One的定量方法Quantity One的分析功能顾名思义主要用来进行凝胶或者培养皿的荧光定量分析。
它的分析功能或者说分析方式主要有4种:泳道/条带轨迹定量法;等高线直接定量法;菌落计数;分子量测定--------------------------------------------------------------------------------这三种方法中使用最为方便也是最为广泛的应该是等高线定量法(Volumn Contour)。
它通过半自动描绘电泳条带的等高线边缘来得到等高线区域内部面积,再将该面积乘以区域内平均光密度值得到条带内部总的信号量。
当然这种分析方法的弊病显而易见:无法同等得排除不同泳道的背景亮度;等高线的绘制处于“半自动”状态,即需要人为判断作为等高线标准的电泳条带的边缘;最致命的是在几个电泳条带距离十分接近的时候几乎无法绘制单一条带的轮廓(常出现连续的几个条带等高线相连而无法分离出单独条带的轮廓)。
三种方法中个人感觉最为科学和严谨的应该是泳道/条带轨迹定量法(Trace Tracking)。
这种方法使用起来步骤较为繁琐,必须通过泳道识别---电泳条带识别两个连续的步骤才能进行定量。
然而这种方式的最大优点在于它可以完全抛弃人为主观因素进行全自动定量。
他的定量方式为:首先根据不同电泳条带的光密度值绘制光密度曲线,然后计算光密度曲线下面积作为电泳条带的定量根据。
Quantity one 软件分析使用方法简介

Quantity one 软件分析使用方法简介一、条带分子量分析方法打开软件,在volumes quick guide一栏中选择open,打开你所需要分析的图片。
图片格式为tiff。
Transform转化,调节图象的对比度黑白到合适程度。
确定泳道(lane),并对泳道进行各种调整(实际实验中泳道往往不是垂直的而出现各种变形)。
按下图所示在软件的工具栏中有一Lane Tool图标,包含有更多泳道编辑工具(Frame Lane中输入泳道个数即可做到自动添加泳道,手动调整大小即可)。
确定泳道和条带的操作也可以手动进行,即点击Lane 菜单,选择Sigle Lane中的Creat Lane,将鼠标移至打开的图片中,这时鼠标后面会有一个绿色的加号,选择一个marker泳道和需要计算分子量的泳道,每个泳道重上至下的创建。
这种方法是单个泳道一个一个的创建,创建时注意在每个泳道条带的正中间开始创建,减少跑电泳时条带的不整齐对结果计算的影响,并且创建的泳道线(红线)一定要垂直。
完成泳道添加步骤后,确定分析条带。
该步骤可以自动也可以手动。
手动添加步骤为:点击Band菜单,选则Create Band,这时是要创建每个泳道中条带的位置。
再将鼠标移动至图片位置,同样鼠标后面呈现绿色加号形式,用鼠标依次点击marker的条带位置。
最后点击你所测定的目的条带。
泳道中创建Band时也要在条带的中间位置创建,以免跑电泳时加量过多使跑出来的条带过宽,进而影响测定结果。
自动添加步骤为:选择Detect Band,检测泳道内的条带,打开出现如下窗口。
通过调节sensitivity灵敏度可调节检测出的条带数,调节Lane Width使代表表带的红色横线与条带宽度差不多宽。
中间一行人工编辑按钮可以用来增加/减少条带、调节条带的上、下边界等。
打开工具栏中Band Tool条带编辑工具包可看到更多编辑工具。
条带确定后点击Match菜单,选择Standards,选择New Standard,编辑好所创建的marker的名称,并依次输入你所跑的marker的分子量(KDa栏)和所对应的名字(Name 栏),点Achive保存。
quantity_one_软件使用说明
quantity one 软件使用说明
quantity one软件,对于熟悉分子生物学实验技术凝胶成像操作的各位大侠一定都不陌生,可是这个软件功能非常全面,对于每一个功能不知大家是不是一样的熟悉,我目前正在使用它的一项功能,稍稍了解了一点,希望能讲给大家,不到之处,还请各位指点!
我想向大家介绍band analysis功能:
1. 首先打开*.lsc或*.tif等格式的图像文件
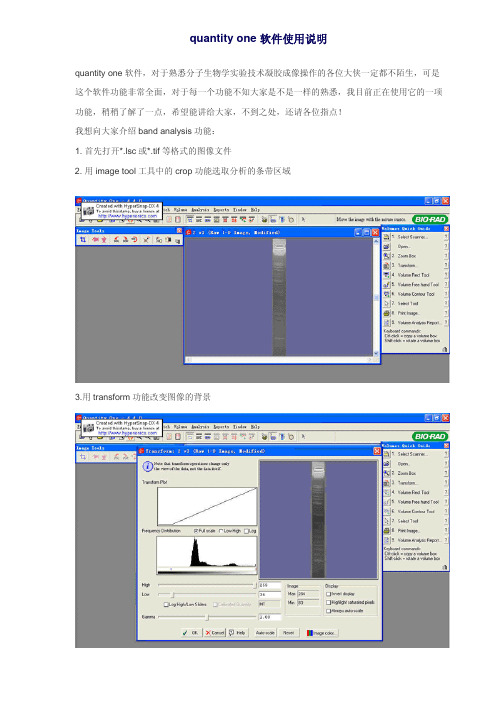
2. 用image tool工具中的crop功能选取分析的条带区域
3.用transform功能改变图像的背景
4. 选frame lanes功能,确定分析区域,一条带对应于选择的数字为1
5. 用stretch lanes及add/adjust anchors进行区域的调整,点击每个框架四周的4个小圆圈待光标有变化时,即可拖动调节区域的范围
6. 用lane background substraction功能进行本底剪影
7. 用detect band 功能进行条带的标记,可以通过调节敏感度来使标记的条带认为受到控制,利于对一些结果准确和客观的判读,band 工具栏中有编辑,去除及调整band的工具进行band 的修改
8. 用standards功能,选择合适的standards
9. band attributes 功能了解band 信息描述
10. all lanes report给出关于每一条band的分析结果,可以保存为*. txt文件,常选的指标有峰值,域值,相对量等,条带分析即可完成。
凝胶成像及Quantity-One中文操作说明

凝胶成像及Quantity-One中文操作说明第一章简介凝胶电泳是每个做分子生物学的研究者天天都要打交道的基本技术。
电泳之后的信息处理与电泳本身同样重要。
目前有大量软件可以用于分析电泳结果,要向大家介绍的是Bio-Rad公司的1D凝胶分析软件Quantity One(Bio-Rad还有一个做2D凝胶分析的软件PDQuest)。
Quantity One软件是常用1D凝胶分析软件中功能最强大,自动化程度最高的软件。
这个软件的最新版本可以在Bio-Rad的网()免费下载,以供试用或用户升级之用。
Quantity One软件的主要功能包括定量分析(Volumes Quick Guide),电泳条带分析(Band Analysis),差显分析(Differential Display Analysis),克隆计数(Colony Counting Analysis)等,此外,还可以直接控制Bio-Rad公司的各类图像仪和ExQuest自动切胶仪,使您的凝胶分析工作变得极为轻松。
Quantity One软件拥有与windows操作系统下绝大多数应用软件相同的友好界面。
插入密码狗,打开Quantity One软件,可以看到最上缘蓝色横条幅是标题栏,往下依次是菜单栏和工具栏。
File 图像打开、保存、引入、打印等操作Match分子量估算、条带匹配分析Edit 图像普通编辑操作Volumn定量分析View 图像缩放、三维视图、看光密度值等操作Analysis浓度估算、克隆计数等分析每个菜单的主要功能如下:往下一行是工具栏,上面每个按钮的功能见下表:Quantity One 软件Help àQuick Guide 快捷指南提示如何实现一个功能,如定量分析(Volumes Quick Guide),电泳条带分析(Band Analysis),差显分析(Differential Display Analysis),克隆计数(Colony Counting Analysis)等。
凝胶定量软件QuantityOne使用

凝胶定量软件Quantity One使用简介1 内容简介凝胶电泳是每个做分子生物学的同学天天都要打交道的基本技术。
电泳之后的信息处理与电泳本身同样重要。
目前有大量软件可以用于分析电泳结果,比较有名的比如BandScan、BandLeader、Sigma Gel等等。
今天要向大家介绍的是来自Bio-Rad的1D凝胶定量软件Quantity One(Bio-Rad还有一个做2D凝胶分析的软件PDQuest)。
这个软件的最新版本可以在Bio-Rad的主页免费下载。
目前的最新版本是4.52版2 Quantity One的定量方法Quantity One的分析功能顾名思义主要用来进行凝胶或者培养皿的荧光定量分析。
它的分析功能或者说分析方式主要有4种:泳道/条带轨迹定量法;等高线直接定量法;菌落计数;分子量测定这三种方法中使用最为方便也是最为广泛的应该是等高线定量法(V olumn Contour)。
它通过半自动描绘电泳条带的等高线边缘来得到等高线区域内部面积,再将该面积乘以区域内平均光密度值得到条带内部总的信号量。
当然这种分析方法的弊病显而易见:无法同等得排除不同泳道的背景亮度;等高线的绘制处于“半自动”状态,即需要人为判断作为等高线标准的电泳条带的边缘;最致命的是在几个电泳条带距离十分接近的时候几乎无法绘制单一条带的轮廓(常出现连续的几个条带等高线相连而无法分离出单独条带的轮廓)。
三种方法中个人感觉最为科学和严谨的应该是泳道/条带轨迹定量法(Trace Tracking)。
这种方法使用起来步骤较为繁琐,必须通过泳道识别---电泳条带识别两个连续的步骤才能进行定量。
然而这种方式的最大优点在于它可以完全抛弃人为主观因素进行全自动定量。
他的定量方式为:首先根据不同电泳条带的光密度值绘制光密度曲线,然后计算光密度曲线下面积作为电泳条带的定量根据。
大家可能会问他能不能排除泳道背景?答案是肯定的,它能够最大程度的排除不同泳道之间的背景差异,让各个泳道上的不同电泳条带在一条几乎相同的起跑线上进行对比。
quantity one的使用说明

GEL EQ凝胶成像使用指南1. 打开主机电源与计算机电源.2. 点击凝胶成像软件,进入QUANTITY ONE操作界面.3. 在FILE菜单中,选择GEL EQ菜单,进入图像采集界面4. 点击LIVE/FOCUS菜单,采集图像.(根据被扫胶的要求, 在凝胶成像主机面板上选择UV/WHITE紫外光/白光).(如需使用透射白光,则把白光台电源打开,把白光台放在底板上,把胶放在白光台上.)5. 调节光圈大小,点击IRIS下OPEN/CLOSE;调节聚焦,点击FOCUSE下NEAR/FAR按钮;调节远近即大小,点击ZOOM下相应按钮,直到满意为止.6. 爆光时间一般选择自动AUTO EXPOSE即可.7. 若图像上有高亮红点,说明爆光过度,则须缩小光圈.8. 图像调好后,点击SAVE键保存.若需保存为其他格式,则在FILE菜单下选择导出,保存为JPEG/TIFF格式文件.9. 关于分析处理见Quantity One应用讲义Quantity One应用讲义本讲义介绍Quantity One的两个重要分析功能:定量分析和分子量确定。
Quick Quantity One软件Help Guide快捷指南提示如何实现一个功能,如定量分析(Volumes Quick Guide),电泳条带分析(Band Analysis),差显分析(Differential Display Analysis),克隆计数(Colony Counting Analysis)等。
快捷指南下有1,2,3…步骤,根据提示完成。
一.定量分析功能快捷指南Volumes Quick Guide,此功能能对任意所选区域进行定量分析,此分析可以报告2个结果:相对浓度和绝对浓度(如有浓度标准样品)1.选择成像系统或打开已保存的文件(软件可以控制Bio-Rad所有的成像系统如GelDoc,ChemiDoc,VersaDoc,GS-800,FX,如不是Bio-Rad成像系统所摄取的图象,将图象保存为Tiff文件格式,软件也可进行分析处理)2. Zoom Box,缩放,对图象进行放大观察3. Transform转化,调节图象的对比度黑白4. Volume Rect Tool 矩形区域选择,如U15. Volume Free hand Tool自由画笔选择区域,可以勾勒出无规则形状,如U26. Volumn Contour Tool等高线勾勒区域,自动连接浓度浓度相同的点,如U3上面3种方法选择需要定量的区域。
利用Quantity One软件分析DGGE条带

Optimize Image
Open a file to acquire an image
Before you can use Quantity One to analyze a biological image, you need to capture the image and save it as an image file. This may be done with one of the several BioRad imaging instruments supported by this software
Click here to detect the bands automately
Click here to add the bands which could not be detected by the software Click here to adjust the site of the bands
Click here
Click here to crop the image
Click the ‘Lane’ button to choosdd/adjust anchors’ button to adjust the lanes
Click here to change the sensitivity value to get more bands
Click the ’match’ button to match all the bands to the model band automately
Click here to enter a appropriate tolence value to identify the minimum distances between bands
凝胶成像及Quantity-One中文操作说明

第一章简介凝胶电泳是每个做分子生物学的研究者天天都要打交道的基本技术。
电泳之后的信息处理与电泳本身同样重要。
目前有大量软件可以用于分析电泳结果,要向大家介绍的是Bio-Rad公司的1D凝胶分析软件Quantity One〔Bio-Rad还有一个做2D凝胶分析的软件PDQuest〕。
Quantity One软件是常用1D凝胶分析软件中功能最强大,自动化程度最高的软件。
这个软件的最新版本可以在Bio-Rad的网〔〕免费下载,以供试用或用户升级之用。
Quantity One软件的主要功能包括定量分析(Volumes Quick Guide),电泳条带分析(Band Analysis),差显分析(Differential Display Analysis),克隆计数(Colony Counting Analysis)等,此外,还可以直接控制Bio-Rad公司的各类图像仪和ExQuest自动切胶仪,使您的凝胶分析工作变得极为轻松。
Quantity One软件拥有与windows操作系统下绝大多数应用软件相同的友好界面。
插入密码狗,打开Quantity One软件,可以看到最上缘蓝色横条幅是标题栏,往下依次是菜单栏和工具栏。
File 图像打开、保存、引入、打印等操作Match分子量估算、条带匹配分析Edit 图像普通编辑操作Volumn定量分析View 图像缩放、三维视图、看光密度值等操作Analysis浓度估算、克隆计数等分析每个菜单的主要功能如下:往下一行是工具栏,上面每个按钮的功能见下表:Quantity One 软件Help àQuick Guide 快捷指南提示如何实现一个功能,如定量分析(Volumes Quick Guide),电泳条带分析(Band Analysis),差显分析(Differential Display Analysis),克隆计数(Colony Counting Analysis)等。
Quantity One 中文教学光盘说明

Quantity One 中文教学光盘说明1、教程开始了,Quantity One一级主菜单栏、主工具栏。
主工具栏包括:标准文件操作命令、主浏览工具、以及打开自己工具栏和快捷指南的图标。
如果将鼠标指向任意图标会出现一个附助式命令相应的在主工具栏中会显示该命令的简短介绍。
Quantity One次级菜单栏包括数组相关的命令,例如图象工具栏包括:修剪工具、图象旋转工具、过滤指南、数据反转命令等。
击工具栏中右下角按扭可改变它的水平和和垂直的分布方式,对新用户而言可采用扩展窗口形式查看命令。
扩展窗口在每一图标边显示该命令的名称,并有一个问号图标可打开相应的在线帮助,工具栏可在窗口中任意移动,在同一时刻可打开多个窗口。
要关闭某一窗口再击一下此按扭即可。
下面开始讲解如何使用Quantity One 。
2、图象显示在主工具栏中选择Open按扭打开一个对话框,选择目录,双击目录下的文件名,打开此图象文件,在窗口内可将的此图象的位置及尺寸进行调整。
主工具栏中的缩放按扭能将所选择的区域放大,选择此按扭在图象上拖动鼠标选择所要放大的区域,释放鼠标所选择区域将充满整个图象窗口。
Quantity One 中有许多类似缩放操作的命令,它们必须要用鼠标来完成,先选择该命令,然后在图象内单击或拖动鼠标来完成。
在实际操作中,这些操作可能会改变鼠标的形状。
在主菜单的状态栏中会显示当前所进行的命令。
当击此命令显示可将鼠标恢复原状。
抓取工具可调整图象在窗口中的位置。
击一下此按扭,然后将图象抓取到新的位置,你也可用键盘的上下左右方向键对图象位置进行调整。
全屏显示按扭,可将图象恢复到全窗口显示状态,下面我们来看看如何优化图象显示。
3、优化图象显示,选择主工具栏中的转换按扭,打开转换窗口,在此窗口中可进行一系列的图象优化操作,转换窗口中有一缩小的图象预览及多种调节亮度和对比度的按扭,须注意的是这些转换只是改变图象的外观,并不能改变图象的质量和数据。
如何使用quantityone计算条带灰度值

在其他网站上看到的,很实用转来分享样品制备:变性条件——SDS LB直接裂解:用常温或者高温预热过(预热更有利于阻止蛋白水解或者磷酸酶去磷酸化,但容易遗忘,LB久煮某些性质会改变)的1*SDSLB(或者略高1.5*)直接加到细胞或者组织上并煮样。
通常6孔板细胞80%以上密度,需200ul,其他按平板面积比类推。
通常条件下,SDSLB都是过量的(因此不一定要严格参考SDS LB稀释比);如果SDSLB不够,样品核酸、蛋白浓度过高时,煮样后会发现tip吸不上来,非常粘、一砣一砣的,很容易堵住tip。
这时候常规做法有两种,1.再煮5min。
常规煮样时间3-5min,样品过浓时就煮10min;2.如果10min煮样后,仍然吸不起来,才适当增加SDSLB,继续煮;也可以对样品进行超声。
煮样时间若过长,蛋白会凝固,此时以失去继续WB的意义,请丢弃(判断标准:出现明显的蛋白沉淀和水分层)此方法的缺点,SDS LB煮过的样品如果用来做IP,需要特殊方法,因此,这种制备方法制备的样品有使用局限。
非变性裂解法(不讨论诸如核抽提、亚细胞器分离等等了,其实类似)裂解细胞请尽量冰上操作,减缓酶解作用。
俺前boss nature文章上的裂解液配方是:20mM Tris/HCl, pH7.6, 100mM NaCl, 20mM KCl,1.5mM MgCl2, 0.5% NP-40 and protease inhibitors (20μg/ml leupeptin,10μg/ml pepstatin A and 10 μg/mlaprotinin)(此裂解液可用于抽提核蛋白),其中蛋白酶抑制剂很复杂也很贵,其实用0.5mMPMSF替代这三种就好了;如果还要做磷酸化蛋白,加1mM Na3VO4(现加现用),10 mM NaF, 1 mM Na3VO4, 50 mMbeta-GP。
此方法的优点:NaCl浓度略低于生理状态,保证裂解细胞的方式较为温和,便于随后的IP 等试验。
凝胶成像及quantityone中文操作说明

第一章简介凝胶电泳是每个做分子生物学的研究者天天都要打交道的基本技术。
电泳之后的信息处理与电泳本身同样重要。
目前有大量软件可以用于分析电泳结果,要向大家介绍的是Bio-Rad公司的1D凝胶分析软件Quantity One ( Bio-Rad还有一个做2D凝胶分析的软件PDQuest)。
Quantity One软件是常用1D凝胶分析软件中功能最强大,自动化程度最高的软件。
这个软件的最新版本可以在Bio-Rad的网()免费下载,以供试用或用户升级之用。
Quantity One软件的主要功能包括定量分析(Volumes Quick Guide),电泳条带分析(Band Analysis),差显分析(Differential Display Analysis),克隆计数(Colony Counting Analysis)等,此外,还可以直接控制Bio-Rad 公司的各类图像仪和ExQuest自动切胶仪,使您的凝胶分析工作变得极为轻松。
Quantity One软件拥有与windows操作系统下绝大多数应用软件相同的友好界面。
插入密码狗,打开Quantity One软件,可以看到最上缘蓝色横条幅是标题栏,往下依次是菜单栏和工具栏Match 分子量估算、条带匹配分析File 图像打开、保存、引入、打印等操作Edit 图像普通编辑操作Volumn定量分析View 图像缩放、三维视图、看光密度值Analysis浓度估算、克隆计数等分析等操作Image 图像旋转、翻转、裁切等操作Reports分析结果输出Lane 泳道分析Window窗口分析拖曳门局部放大存文字工具 定量工具」定量分析快捷指南, 条带分析快捷指南IBan愆条带分析并居中屮巴 Help帮助虎捷菜单巴件注册等往下一行是工具栏,上面每个按钮的功能见下表: Acquire 要功能如下: mes Quick Guide), 每个菜单的主4快捶指南门uantity One 软件Help d Quick Guide 快捷指南提示如何实现一个功能,如定量分析 (Voli 泳条带分析(Band Analysis),差显分析^DiffterentiOl display Analysis),克隆计数(Colony Counting Analysis)等。
凝胶成像系统软件操作指南2

Quantity One 应用讲义本讲义介绍Quantity One 的两个重要分析功能:定量分析和分子量确定。
Quantity One 软件Help Quick Guide 快捷指南提示如何实现一个功能,如定量分析(V olumes Quick Guide),电泳条带分析(Band Analysis),差显分析(Differential Display Analysis),克隆计数(Colony Counting Analysis)等。
快捷指南下有1,2,3…步骤,根据提示完成。
二.条带分析功能Band Analysis介绍用此功能对泳道内的所有条带进行分子量确定,相对浓度分析1,2,3同上4,5,6确定泳道lane,并可对泳道进行各种调整(实际实验中泳道往往不是垂直的而出现各种变形。
在软件的工具栏中有一Lane Tool 图标,包含有更多泳道编辑工具。
7.Lane Background 去除泳道背景,建议不做Lane Tool泳道编辑工具包 Band Tool条带编辑工具包8.Detect Band ,检测泳道内的条带,打开出现如下窗口,一般可通过调节sensitivity 灵敏度来调节检测出的条带,或通过人工编辑来增加/减少条带。
打开工具栏中Band Tool 条带编辑工具包可看到更多编辑工具(如上图)10. Standard 输入分子量标准,软件自带有许多Bio-Rad 的分子量标准,如你用的是自己的标准,进入New Standard 建立新的分子量标准,软件可以选择标准单位是MW (蛋白质)还是BP (核酸)等(左下图)。
在Protein-Standard 对话框中输入分子量数值,完成后单击赋值图标(右下图),回到图象文件上单击标准样品的泳道,软件自动将所输的分子量数值和泳道内的条带一一对应。
10. Band Attribute 条带属性,在完成第9步以后,软件已自动计算出了其他未知条带的分子量,打开band attribute 选择要报告的参数,这里我们选择Molecular Weight ,图象上可以看到所有条带的分子量(红颜色标记),标准分子量为蓝色标记。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
如何使用quantityone计算条带灰度值在其他网站上看到的,很实用转来分享样品制备:变性条件——SDS LB直接裂解:用常温或者高温预热过(预热更有利于阻止蛋白水解或者磷酸酶去磷酸化,但容易遗忘,LB久煮某些性质会改变)的1*SDSLB(或者略高1.5*)直接加到细胞或者组织上并煮样。
通常6孔板细胞80%以上密度,需200ul,其他按平板面积比类推。
通常条件下,SDSLB都是过量的(因此不一定要严格参考SDS LB稀释比);如果SDSLB不够,样品核酸、蛋白浓度过高时,煮样后会发现tip吸不上来,非常粘、一砣一砣的,很容易堵住tip。
这时候常规做法有两种,1.再煮5min。
常规煮样时间3-5min,样品过浓时就煮10min;2.如果10min煮样后,仍然吸不起来,才适当增加SDSLB,继续煮;也可以对样品进行超声。
煮样时间若过长,蛋白会凝固,此时以失去继续WB的意义,请丢弃(判断标准:出现明显的蛋白沉淀和水分层) 此方法的缺点,SDS LB煮过的样品如果用来做IP,需要特殊方法,因此,这种制备方法制备的样品有使用局限。
非变性裂解法(不讨论诸如核抽提、亚细胞器分离等等了,其实类似)裂解细胞请尽量冰上操作,减缓酶解作用。
俺前boss nature文章上的裂解液配方是:20mM Tris/HCl, pH7.6, 100mM NaCl, 20mM KCl,1.5mM MgCl2, 0.5% NP-40 and protease inhibitors (20μg/ml leupeptin,10μg/ml pepstatin A and 10 μg/mlaprotinin)(此裂解液可用于抽提核蛋白),其中蛋白酶抑制剂很复杂也很贵,其实用0.5mMPMSF替代这三种就好了;如果还要做磷酸化蛋白,加1mM Na3VO4(现加现用),10 mM NaF, 1 mM Na3VO4, 50 mMbeta-GP。
此方法的优点:NaCl浓度略低于生理状态,保证裂解细胞的方式较为温和,便于随后的IP等试验。
其他Na盐浓度的细胞裂解液也很常见,诸如0.15M(生理盐浓度)、0.3M、0.6M(高盐系列,裂解细胞时染色体会析出,细胞碎片和沉淀非常粘稠)及0.8-1.2M;0.3M及以下适合IP试验,0.6M及以上适合纯化蛋白,尤其相互作用较强的复合体,要得到纯化的一些复合体的组成蛋白一般采用极端的高盐裂解细胞。
用于核蛋白的裂解的原因是0.5% NP-40,用于破坏核膜结构;可用到1%,但此时染色体会析出,沉淀粘稠。
组织块裂解:组织块较大用匀浆的方法最合适,现在有不少转头很小的匀浆器。
当组织超微量的时候,比如50mg新鲜癌组织,我采用的方法是1. 低温(剪)搅碎,成肉糜状。
2. 锡箔纸包裹好,放入少量液氮,快速敲击(控制力量,尽量避免弄破锡箔纸),进一步破碎;反复多次。
3. 用上述细胞裂解液回收。
分泌型蛋白富集:用无血清培养基培养细胞,收集上清液用于WB检测;如果含量过低,需要用TCA沉淀富集。
理论上,从普通培养基中收集分泌蛋白,此时对细胞生长条件的影响最小,是最佳的实验条件;但是这存在隐忧。
因为含血清的培养基中含有非常丰富的BSA(牛血清白蛋白)之类的蛋白质,除非你进一步分离纯化,否则直接用这种样品去WB会有非常大的麻烦,尤其当你的蛋白在60-46kDa之间的时候;用“任何”抗体去检测这一区间的蛋白,会有一片非常强的信号。
因为此区间蛋白(主要是BSA)浓度过于富集,会非特异性粘附“任意”抗体,从而最终被识别。
同理,采用SDS LB裂解细胞制备样品前,通常要用PBS洗涤,其目的之一是去除培养基中的BSA。
采用无血清培养基收集细胞上清除了改变细胞的生理状态外(可能激活未知信号途径,诸如AKT等),还会出现的问题是:1. 即使采用了无血清收集上清,仍然有大量杂蛋白,但相对好很多。
2. 选用了上清,由于蛋白浓度太稀,通常要采用TCA沉淀富集,再重新溶解。
a. TCA沉淀对半定量操作要求非常高,因为很容易沉淀不充分或者离心操作丢失,尤其在离心过程,离心管的摆放非常讲究,要180度翻转离心两次。
b。
重新溶解时,由于蛋白需要在一定的盐离子条件下才能重新溶解,你要摸索充分溶解的条件,相对麻烦。
实际上,如果你不是非常强调蛋白的分泌有什么生理功能,一般不建议检测上清,尤其半间的差异。
定量的WB实验检测不同样品这里面有实验操作细节的麻烦——经验之谈,我曾经参与的cancer cell文章所研究的蛋白就是分泌型蛋白,但90%的数据是celllysis;偶尔用到上清,也只是作为富集纯化该蛋白的原料,为进一步分析做准备。
样品制备完,应立即低温保存(-20度短期(几天);-80度长期;例外,IP用样品应直接进行IP,避免冻融破坏蛋白质间弱的相互作用)。
SDSLB煮沸过的样品冻融会存在另一个问题,SDS沉淀;SDS 4度就会沉淀,何况-80度。
上样前应加热充分溶解,否则从加样口向下拖带(SDSLB不够,样品未充分溶解也会出现类似拖尾;上样过大也会)。
在样品制备过程中,另一个需要注意的问题是,从样品制备的起始阶段就要注意定量问题;WB本身系统误差有20%,太细微的差别经常忽略不计。
细胞样品可以先计数再接种,短时间内即使细胞生长有差异也不会对WB结果影响太多。
组织样品,从肿瘤组织的大小(称重)开始,裂解液的体积都是精确定量的,操作过程也尽量避免蛋白损失。
有人会说可以电泳前蛋白定量,我将下一节讨论蛋白定量的不科学性,以及裂解液成分对定量的干扰。
蛋白电泳:电泳胶的制备、配方、缓冲液配方,请参考分子克隆。
经验之谈,8%胶最底边约36KDa,10%最底边约25KDa,12%最底部约12KDa。
8%胶可以跑300KDa-36KDa之间的任意蛋白,转膜效率对WB结果的的影响都问题不大。
12%,180KDa左右,转膜效率对WB结果的影响都问题不大(300KDa蛋白如何,没有尝试过)。
电泳一般采用恒流,45mA-55mA(应根据电泳仪器适当调整,要注意仪器最高限压;此条件适合gibco modelV16型,胶宽20cm)。
采用恒流的优点,保证最快速度完成电泳(电压会逐渐增大),省时且减少扩散;但是由于电泳速度过快时会发热而溶胶,所以你必须想办法散热。
散热不好,条带出现波浪状。
注意事项:1(聚丙烯酰胺的30%母液会降解,要4度避光保存。
2(APS会失效,10%APS一般保质期才一个月左右。
-20度分装长期保存。
3(注意Tris buff的PH值,以及平时所用的水的PH值。
PH值改变会使带型非常怪异,所有蛋白和溴酚蓝压成一条细线(即便在分离胶中),如果溴酚蓝前有红色染料,那么此染料彗星式拖尾从溴酚蓝一直延伸到胶底部(溴酚蓝此时涌动极缓慢,位于胶中上部) 4(上下层式电泳装置若漏液,哪边漏液,电泳条带往哪边倾斜。
内外式电泳装置漏液,则液体会过热。
SDS-PAGE胶可能局部自溶,条带扭曲、变形。
装置处于短路状态,5(配胶用玻璃板和边条应及时洗净。
玻板未洗净的坏处很多。
尽管玻璃看似平滑,但是一些细微的凹陷处会凝结肉眼无法分辨的胶颗粒(摸上去疙疙瘩瘩),其坏处是,在该部位极易导致不均匀的胶块,样品经过该处或电泳散热不好,条带变形。
如果是RNA的超薄胶,胶板的颗粒会导致局部巨大气泡,非常难于清除;蛋白胶也会导致一些小气泡的产生。
玻板没洗净的另一个坏处是,由中学物理知识可知,玻璃表面越光滑粘附越牢,未洗净的玻板会削弱和胶体间的粘附力,拔梳子或边条时会产生微小的错动,胶体下部出现大量气泡(夹在玻板和胶之间,这个关系不大);严重的错动会使上样时,样品从胶和玻璃之间的间隙漏光,或者甚至胶和玻板分开。
为避免拔梳子时的错动,可在电泳缓冲液中拔梳子(比水更好,有SDS润滑)。
判断玻板是否洗干净,用手摸一下有没有疙疙瘩瘩的;最好用洗洁精之类,洗衣粉、肥皂都不好用。
6(上样时,不要把tip深入胶孔过深(或者采用细的尖端拉长的专用上样枪头),可能会错开胶和玻板,样品会泄露。
7(未加样的孔应添加高浓度SDS LB平衡,否则最外侧条带会拉宽变形。
通常20ul样品(含5ul 4*SDS LB),可用8-8.5ul4*SDSLB平衡。
同理,点marker的lane也要加入同样体积的LB。
LB若在室温放置太久和新鲜的在比重上会有差异,在新旧LB靠近的地方,条带会拉宽或挤压变形。
因此,同一块胶上,煮样及填空白所用LB应一致。
LB应-20度保存。
8(增加上样量不一定会提高荧光信号强度。
增加上样量的后果通常只能是让你的内参粘连,所有的蛋白条带都扭曲变形。
因为增加上样量最多只能提高几倍,而WB灵敏度是以10的几次幂量级的,所有目的蛋白信号的唯一方案就是IP富集(可特异提高目的蛋白浓度数百数千倍,并去除其它杂蛋白干扰)。
增加上样量的另一个坏处是,本来高表达的蛋白,诸如内参,在同样WB条件下,可能出现荧光灼烧式粹灭(一晃而灭)或者条带中空。
仍以6孔板80%以上汇合度为例,细胞裂解液和SDSLB通常都是投入200(最少ul80ul,这样面积的培养板如果裂解液投入太少,回收时的损失就太大,上样就很难做到一致),而这种浓度条件下制备的样品,电泳时上样量要控制在5-6ul,最少2.5ul,最多10ul,10ul时内参基本已经开始粘连成一条线,带型出现波浪纹;当然并非不可以多上样,再多对WB结果影响不大(没有的仍然没有),且条带都很丑。
9.不同样品上样时,可考虑将样品体积调成一致或类似。
如果一组IP样品和一组细胞裂解液样品,前者通常洗脱体积为15ul,刚好+5ul 4*SDSLB达到常规20ul上样体积;后者第8点提到只上5ul,同样+5ul SDS LB(比重同,不会互相挤压),最好补加10ulDDW使总体积一致。
通常这样不同条件获得的样品,中间最好用“空白”泳道隔开(空白仅指无蛋白,仍应加入8-8.5ul 4*SDSLB),这样才能确保每条带都很美观。
10. SDSPAGE胶配好暂时不用时,需用电泳缓冲液灌满空间(拔去梳子和底边边条后的间隙),用保鲜膜包裹防止液体蒸发,短期室温或稍长期4度保存。
个人习惯为,灌好分离胶用饱和的正丁醇灌满上层,保鲜膜包裹,次日再灌堆积胶。
两种方案都可以。
所以如果预计次日工作量较大,可以提前灌好SDS PAGE。
样品是否一定需要定量再上样,——不是的,这是浪费时间的一个操作。
我们首先来讨论一下蛋白定量的科学性。
蛋白定量首先需要一个参照系(标准蛋白),参照蛋白通常选择BSA,也就是说你所谓的定量是对应于BSA的浓度的一个参照值。
这里面存在一个问题,即忽略了蛋白折叠和空间构象对光吸收、折射的影响;不同的蛋白折叠和构象还会影响颜料分子的嵌入。
因此你其实默认将所有的蛋白等同于BSA在溶液中的折叠状态、光吸收情况下,然后做出的一个相,这就存在一个“系统误差”——还不算上测量误差等等,就已经很不准确了。
