Pramiracetam_CI-879_CAS号68497-62-1说明书_AbMole中国
Roche MagNA Lyser 产品说明书

Ordering Information Cat. No. Product ***********MagNA Lyser Instrument (230 Volt)***********MagNA Lyser Instrument (110 Volt)(Instruments supplied with rotor and rotor cooling block)***********MagNA Lyser Green Beads (100 tubes)Related Products Cat. No. Product***********MagNA Pure LC DNA Isolation Kit II (Tissue)***********MagNA Pure LC mRNA Isolation Kit II (Tissue)03 330 591 001MagNA Pure LC RNA Isolation Kit III (Tissue)***********MagNA Pure LC DNA Isolation Kit III (Bacteria, Fungi)***********MagNA Pure LC RNA Isolation Tissue Lysis Buffer – Refill (70 ml)System DescriptionHomogenize up to 16 samples in just a few seconds.Save valuable lab space with a small benchtop instrument.Reduce hands-on time by replacing the mortar and pestle and other manual methods.Integrate your workflow with the automated nucleic acid isolation of the MagNA Pure LC Instrument.Perform consistent and reproducible sample disruption.Process many different sample types.Prevent nucleic acid degradation with the benchtop cooling unit.Ease your setup with a removable rotor and prefilled disposable vials.Automate with an easy-to-use instrumentVersatile, efficient, and rapid pre-preparationFigure 71. Add your sample and lysis buffer to the MagNA Lyser Green Beads.2. Homogenize with the MagNA Lyser Instrument.3. Centrifuge to pellet the debris.4. Proceeed with the supernatant to prepare nucleic acids or proteins.For detailed information,visit or contact your local representative.Trademarks:MagNA Pure, MagNA Lyser, LightCycler, and the MagNA Pure Logo are trademarks of a member of the Roche Group.The technology used for the LightCycler System is licensed from Idaho Technology Inc., Salt Lake City, UT, USA.Fully automated sample preparationon the PCR Workflow SystemRoche Diagnostics GmbH Roche Applied Science Nonnenwald 282372 Penzberg Germany0000Roche Applied Science Part of Roche DiagnosticsMagNA Lyser InstrumentStart the Ball Rollingwith Automated Tissue HomogenizationᕤᕣᕢᕡFigure 6Components of the system.The MagNA Lyser InstrumentAutomated tissue homogenizationProcessing conditionsRefer to the following tables for guidelines on setting up your homogenizationSample material(10 mg)*Time settings(seconds)Cooling(between the runs)Speed Average yield(µg)***Average purity(OD 280/260 nm)***Spleen 2 x 25 906,00030–40 1.9Liver 25-6,00016–18 1.8Lung 2 x 25906,00025 1.8Kidney25-6,000201.8Maize leaves **20-5,00010n.d.Maize polenta **20-5,0008n.d.Tortilla chips **20-5,0001n.d.*Aliqout containing 10 mg sample material (here mouse and food samples) was taken for the DNA purificationusing the MagNA Pure LC DNA Isolation Kit II (Tissue), (see pack insert)**Centrifugation after the homogenization for 5 minutes at 2,200 x g*** Yield and purity strongly depend on the condition of the sample material n.d.not determinedData kindly provided by Dr. Peterhänsel, RWTH Aachen, GermanyFigure 1Gel electrophoresis from genomic DNA isolated from tissue homogenized with the MagNA LyserInstrument, using the MagNA Pure LC DNA Kit II (Tissue).Marker: DNA Marker III*Aliquot containing 10 mg sample material (here mouse and human research samples) was taken to purify RNAeither with the MagNA Pure LC RNA Isolation Kit III (Tissue) or the MagNA Pure LC mRNA Isolation Kit II (Tissue) homogenized with the MagNA Lyser Instrument.** Yield and purity strongly depend on the condition of the sample material. The yield for mRNA was not determined.Sample material(10 mg)*Time settings(cycles/seconds)Cooling(between/afterthe runs in seconds)SpeedAverage yield (mg)(total RNA)**Average purity(OD 280/260 nm)**RNA/mRNARarely expressed targets in small numbers of target cells,as seen in experiments about minimalresidual diseases,are difficult to detect.Increasing the cell number can improve sensitivity and lead to accurate results.Without the MagNA Lyser pre-processing,the MagNA Pure mRNA HS Kit can efficiently obtain mRNA from a maximum of 1 x 107white blood cells (WBCs),as shown in research studies with human samples.However,using greater cell numbers results in a saturation effect with quantitative assays (Figure 3).Homogenization of the lysate with the MagNA Lyser Instrument prior to the purification eliminatesthe amplification saturation at 1 x 107cells and allows the use of up to 2.5 x 107WBCs (Figure 4 and 5),enhancing the analytical sensitivity of the assay.Eliminate sensitivity barriers with increased sample inputFigure 3mRNA was purified from different amounts of human white blood cells with the MagNA Pure mRNA HS Kit. G6PDH was amplified using the LightCycler t(9;22) Quantification Kit (see text beside).Figure 4mRNA was purified from different amounts of human white blood cells with the MagNA Pure mRNA HS Kit. The lysates from 2.5 x 107cells and 5 x 107cells were homogenized with the MagNA Lyser Instrument (2x50 seconds with 90 seconds cooling in between) prior to the mRNA purification. G6PDH was amplified using the LightCycler t(9;22) Quantification Kit (see text beside).Figure 5Scalability from 1 x 106cells to 2.5 x 107cells is represented in the graph and the table of the relationship between crossing points and cell numbers. The limitation of cell input is indicated by no change in crossing point with increased cell number (see text beside).Cell number 5 x 1072.5 x 1071 x 1075 x 1061 x 106Log (cell number)7.77.47.06.76.0Crossing point 20.320.321.822.424.4crossingpointLog(cell number)252423222120195.86.36.87.37.8Figure 2Gel electrophoresis from total RNA isolated from tissue homogenized with the MagNA Lyser Instrument, using the MagNA Pure LC RNA Kit III (Tissue).Ma r k e rS p l e e nL i v e rL u n gK i d n e yM a r k e rMa i z e l e a v e sMa i z e l e a v e sS p l e e nL i v e r11 kb5 kb5 kb28 S rRNA 18 S rRNASpleen 2 x 50 90 6,500–7,000 30–40 1.9Liver 50 - 6,500–7,000 13–17 2.0Thymoid tissue60906,500n.d.n.d.Heart 60 90 6,500 n.d. n.d.Abdominal fat 60 90 6,500 n.d. n.d.Aorta 60 90 6,500 n.d. n.d. Other samples1+n x 50 90 6,500–7,000- -1 x 105 x 101 x 10- 5 x 101 x 105 x 105 x 10- 5 x 102.5 x 10 5 x 10。
产品说明(阿米迪)

• 妥洛特罗贴剂(阿米迪®)治疗6-8天后,患儿症状体征评 分显著下降
* * *P<0.05 *
仅供内部培训学习使用
阿米迪®显著改善喘息性或毛细支气管炎 患儿的生活质量
一项在299例喘息性或毛细支气管炎患儿中进行的为期8天的研究显示:
口服或静脉给药困难的患者也可使用。
无肝脏首过效应,不增加肝脏负担。 适用年龄范围广(半岁以上儿童患者至高龄患者)。
毛细支气管炎
仅供内部培训学习使用
研究设计
• 多中心、随机、开放标签、阳性药物平行对照研究 • 共入299例6个月~5岁喘息性支气管炎或毛细支气管炎患儿:
治疗组: n=140
皮肤 (角质层)
给药中
给药结束
日本药学会(2001年)发表资料
药物结晶储存系统
• 溶解的妥洛特罗分子与均匀分散的妥洛特罗结晶共存于膏
体中,妥洛特罗结晶具有作为药物贮藏槽的功能。
• 伴随着皮肤吸收,减少的妥洛特罗分子从妥洛特罗结晶中 逐步得到补充,可保持膏体及接触皮肤表面的妥洛特罗浓 度长时间稳定,从而使持续的药物释放成为可能。
使血药浓度达峰时间(Tmax)与“晨降” 的发作时间带相吻合
抑制血药峰浓度(Cmax)过度上升从而 减轻全身性副作用
1日只需给药1次,提高患者依从性
浜松CPT研究所中岛光好(浜松医科大学名誉教授)资料(改编)
6
阿米迪®贴剂的构成示意图
有效控制药物持续释放
:妥洛特罗晶体 :妥洛特罗分子
支持体 给药开始 膏体
经皮吸收型长效支气管扩张剂
妥洛特罗贴剂(阿米迪® )
今晚一贴 明朝呼吸舒畅 平喘止咳 “剂”高一筹
卡非佐米药物说明书

卡非佐米药物说明书目录1、基本信息>2、研发状态>3、全球同靶点竞争格局>4、中国注册申报>5、临床试验信息>6、全球上市批准>7、医药专利信息>8、市场信息>导出日期:2022-02-16药物名称carfilzomib中文名称卡非佐米研发代码ONO-7057、PR-171其余名称carfilzomib (intravenous/Captisol-enabled, cancer), Onyx/Ligand、PR 171、ONO 7057、ONO-7057、Kyprolis、PR-171、carfilzomib、PR171、ONO7057、epoxomicin derivative (anticancer), Proteolix、proteasome inhibitors (hematological malignancies), Proteolix创新类型创新药全球最高研发状态已上市(首次上市:多发性骨髓瘤-美国-2012)工艺技术Biological therapeutic(生物药)Formulation powder(粉末制剂)Freeze drying(冻干制剂)Infusion(输注)Intravenous formulation(静脉注射剂)Oral formulation(口服制剂)Peptide(肽)剂型注射剂给药途径注射、内服特殊审批Accelerated Approval(加速批准)Fast Track(快速通道)Orphan Drug(孤儿药)专利号WO-2005105827EphMRA分类号原研企业Yale University(耶鲁大学)是否国内原研企业否参与研发的企业Amgen Inc(安进)BeiGene Co Ltd(百济神州有限公司)Dr Reddy's Laboratories Ltd(瑞迪博士实验室)Ono Pharmaceutical Co Ltd(小野制药)靶点Proteasome inhibitor(PSM)全称:Proteasome inhibitor(PSM)简称:PSM中文:蛋白酶体抑制剂别名:详情:Ubiquitin inhibitor(UB)全称:Ubiquitin inhibitor(UB)简称:UB中文:泛素化抑制剂别名:详情:适应症Acute lymphoblastic leukemia(急性淋巴细胞白血病)Multiple myeloma(多发性骨髓瘤)Neuroendocrine tumor(神经内分泌肿瘤)治疗领域Hematologic(血液系统)Cancer(肿瘤)ATC分类L01XX45(抗肿瘤药和免疫机能调节药>抗肿瘤药>其它抗肿瘤药物>其它抗肿瘤药>卡非佐米)分子式C40H57N5O7分子量719.91化学名称L-Phenylalaninamide,(α S)-α -[(4-morpholinylacetyl)amino]benzenebutanoyl-L-leucyl-N-[(1S)-3- methyl-1-[[(2R)-2-methyloxiranyl]carbonyl ]butyl]-CAS登记号868540-17-4化学结构研发状态上市时间轴日期国家/地区适应症2012-07-20美国多发性骨髓瘤2015-11-19欧盟多发性骨髓瘤2016-07-04日本多发性骨髓瘤2021-07-09中国多发性骨髓瘤适应症地区最高研发阶段多发性骨髓瘤中国已上市实体瘤全球临床二期巨球蛋白血症全球临床二期套细胞淋巴瘤全球临床二期小细胞肺癌全球临床二期肾细胞癌全球临床二期激素抵抗性前列腺癌全球临床二期神经内分泌肿瘤全球临床二期血液肿瘤全球临床一期慢性淋巴细胞白血病全球临床一期外周T细胞淋巴瘤全球临床一期皮肤T淋巴细胞瘤全球临床一期急性淋巴细胞白血病全球临床一期癌症全球药物发现非霍奇金淋巴瘤全球药物发现适应症国家/地区研发公司研发现状研发进度中国BeiGene Co Ltd(百济神州有限公司)已上市(2021-07-09)药物发现临床前临床一期临床二期临床三期申请上市(2020-01-02)已上市(2021-07-09)摩洛哥Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)沙特阿拉伯Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)新西兰Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期(2013-10-01)申请上市已上市(2019-12-10)Onyx Pharmaceuticals Inc(安进)临床三期(2012-07-03)药物发现临床前临床一期临床二期临床三期(2012-07-03)————智利Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)秘鲁Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)白俄罗斯Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)阿尔及利亚Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)菲律宾Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)最高研发状态积极研发详情厄瓜多尔Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)马来西亚Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)波兰Amgen Inc(安进)已上市(2019-02-18)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-02-18)荷兰Amgen Inc(安进)已上市(2019-01-07)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-01-07)丹麦Amgen Inc(安进)已上市(2018-12-03)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-12-03)芬兰Amgen Inc(安进)已上市(2018-11-21)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-11-21)爱尔兰Amgen Inc(安进)已上市(2018-11-05)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-11-05)挪威Amgen Inc(安进)已上市(2018-10-29)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-10-29)捷克共和国Amgen Inc(安进)已上市(2018-10-23)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-10-23)德国Amgen Inc(安进)已上市(2018-09-01)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-09-01)比利时Amgen Inc(安进)已上市(2018-08-13)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-08-13)奥地利Amgen Inc(安进)已上市(2018-03-01)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-03-01)埃及Amgen Inc(安进)已上市(2017-10-23)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-10-23)新加坡Amgen Inc(安进)已上市(2017-10-23)药物发现临床前临床一期临床二期临床三期(2013-10-01)申请上市已上市(2017-10-23)Onyx Pharmaceuticals Inc(安进)临床三期(2013-03-31)药物发现临床前临床一期临床二期临床三期(2013-03-31)————约旦Amgen Inc(安进)已上市(2017-10-23)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-10-23)希腊Amgen Inc(安进)已上市(2017-10-02)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-10-02)巴林Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)中国香港Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)澳大利亚Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)黎巴嫩Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)卡塔尔Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)中国澳门Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)土耳其Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)多发性骨髓瘤印度Dr Reddy's Laboratories Ltd(瑞迪博士实验室)已上市(2017-08-30)药物发现(2015-08-06)临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)阿拉伯联合酋长国Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)阿曼Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)中国台湾Amgen Inc(安进)已上市(2017-04-13)药物发现临床前临床一期临床二期临床三期(2013-10-01)申请上市已上市(2017-04-13)Onyx Pharmaceuticals Inc(安进)临床三期(2013-03-31)药物发现临床前临床一期临床二期临床三期(2013-03-31)————日本Ono PharmaceuticalCo Ltd(小野制药)已上市(2016-07-04)药物发现临床前临床一期临床二期(2011-08-02)临床三期(2014-05-13)申请上市(2015-08-26)已上市(2016-07-04)巴西Amgen Inc(安进)已上市(2016-06-10)药物发现临床前临床一期临床二期临床三期(2013-10-01)申请上市已上市(2016-06-10)Onyx Pharmaceuticals Inc(安进)临床三期(2012-07-03)药物发现临床前临床一期临床二期临床三期(2012-07-03)————俄罗斯Amgen Inc(安进)已上市(2016-06-03)药物发现临床前临床一期临床二期临床三期申请上市已上市(2016-06-03)瑞士Amgen Inc(安进)已上市(2016-06-03)药物发现临床前临床一期临床二期临床三期申请上市已上市(2016-06-03)英国Amgen Inc(安进)已上市(2016-02-12)药物发现(2014-12-11)临床前临床一期临床二期临床三期申请上市已上市(2016-02-12)加拿大Amgen Inc(安进)已上市(2016-01-21)药物发现临床前临床一期临床二期临床三期申请上市已上市(2016-01-21)Onyx Pharmaceuticals Inc(安进)临床三期(2010-07-21)药物发现临床前临床一期临床二期临床三期(2010-07-21)————韩国Amgen Inc(安进)已上市(2015-11-24)药物发现临床前临床一期临床二期临床三期申请上市已上市(2015-11-24)Onyx Pharmaceuticals Inc(安进)临床三期(2012-07-03)药物发现临床前临床一期临床二期临床三期(2012-07-03)————欧盟Amgen Inc(安进)已上市(2015-11-19)药物发现临床前临床一期临床二期临床三期申请上市(2015-01-27)已上市(2015-11-19)哥伦比亚Amgen Inc(安进)已上市(2015-11-19)药物发现临床前临床一期临床二期临床三期申请上市已上市(2015-11-19)科威特Amgen Inc(安进)已上市(2015-09-18)药物发现临床前临床一期临床二期临床三期申请上市已上市(2015-09-18)泰国Amgen Inc(安进)已上市(2015-07-24)药物发现临床前临床一期临床二期临床三期申请上市已上市(2015-07-24)Onyx Pharmaceuticals Inc(安进)临床三期(2012-07-03)药物发现临床前临床一期临床二期临床三期(2012-07-03)————阿根廷Amgen Inc(安进)已上市(2015-01-27)药物发现临床前临床一期临床二期临床三期申请上市已上市(2015-01-27)以色列Amgen Inc(安进)已上市(2015-01-27)药物发现临床前临床一期临床二期临床三期申请上市已上市(2015-01-27)Onyx Pharmaceuticals Inc(安进)临床三期(2010-07-21)药物发现临床前临床一期临床二期临床三期(2010-07-21)————Amgen Inc(安进)已上市(2015-01-27)药物发现临床前临床一期临床二期临床三期申请上市已上市(2015-01-27)Onyx Pharmaceutic als Inc(安进)临床三期(2013-03-31)药物发现临床前临床一期临床二期临床三期(2013-03-31)————美国Amgen Inc(安进)已上市(2013-10-01)药物发现临床前临床一期临床二期临床三期申请上市已上市(2013-10-01)Onyx Pharmaceuticals Inc(安进)已上市(2012-07-20)药物发现临床前临床一期临床二期临床三期(2010-07-21)申请上市(2011-01-31)已上市(2012-07-20)东欧洲Onyx Pharmaceuticals Inc(安进)临床三期(2013-03-31)药物发现临床前临床一期临床二期临床三期(2013-03-31)————欧洲Onyx Pharmaceuticals Inc(安进)临床三期(2010-07-21)药物发现临床前临床一期临床二期临床三期(2010-07-21)————北美Onyx Pharmaceuticals Inc(安进)临床二期(2009-11-17)药物发现临床前临床一期临床二期(2009-11-17)——————Proteolix Inc(安进)临床二期(2007-08-16)药物发现临床前临床一期临床二期(2007-08-16)——————神经内分泌肿瘤美国Amgen Inc(安进)临床二期(2015-06-04)药物发现临床前临床一期临床二期(2015-06-04)——————激素抵抗性前列腺癌美国Ono PharmaceuticalCo Ltd(小野制药)药物发现(2014-01-20)药物发现(2014-01-20)————————————肾细胞癌美国Onyx Pharmaceuticals Inc(安进)临床二期(2013-10-24)药物发现临床前临床一期临床二期(2013-10-24)——————巨球蛋白血症美国Onyx Pharmaceuticals Inc(安进)临床二期(2011-11-10)药物发现临床前临床一期临床二期(2011-11-10)——————小细胞肺癌美国Onyx Pharmaceuticals Inc(安进)临床二期(2013-09-30)药物发现临床前临床一期临床二期(2013-09-30)——————实体瘤美国Onyx Pharmaceuticals Inc(安进)临床二期(2009-11-17)药物发现临床前临床一期临床二期(2009-11-17)——————Proteolix Inc(安进)临床二期(2007-09-24)药物发现临床前临床一期临床二期(2007-09-24)——————套细胞淋巴瘤美国Onyx Pharmaceuticals Inc(安进)药物发现(2011-12-12)药物发现(2011-12-12)————————————急性淋巴细胞白血病澳大利亚Amgen Inc(安进)临床一期(2014-12-03)药物发现临床前临床一期(2014-12-03)————————美国Amgen Inc(安进)临床一期(2014-12-03)药物发现临床前临床一期(2014-12-03)————————以色列Amgen Inc(安进)临床一期(2014-12-03)药物发现临床前临床一期(2014-12-03)————————欧洲Amgen Inc(安进)临床一期(2014-12-03)药物发现临床前临床一期(2014-12-03)————————加拿大Amgen Inc(安进)临床一期(2014-12-03)药物发现临床前临床一期(2014-12-03)————————外周T细胞淋巴瘤美国Onyx Pharmaceuticals Inc(安进)临床一期(2011-06-28)药物发现临床前临床一期(2011-06-28)————————慢性淋巴细胞白血病美国Onyx Pharmaceuticals Inc(安进)临床一期(2010-10-26)药物发现临床前临床一期(2010-10-26)————————皮肤T淋巴细胞瘤美国Onyx Pharmaceuticals Inc(安进)临床一期(2013-01-30)药物发现临床前临床一期(2013-01-30)————————Onyx Pharmaceuticals Inc(安进)临床一期(2009-11-17)药物发现临床前临床一期(2009-11-17)————————Proteolix Inc (安进)临床一期(2005-12-12)药物发现临床前临床一期(2005-12-12)————————癌症日本Ono PharmaceuticalCo Ltd(小野制药)药物发现(2010-09-08)药物发现(2010-09-08)————————————适应症国家/地区研发公司研发现状研发进度多发性骨髓瘤中国Amgen Inc(安进)申请上市(2019-12-02)药物发现临床前临床一期临床二期临床三期(2014-07-08)申请上市(2019-12-02)——激素抵抗性前列腺癌美国Amgen Inc(安进)临床二期(2014-06-05)药物发现临床前临床一期临床二期(2014-06-05)——————小细胞肺癌美国Amgen Inc(安进)临床二期(2013-10-01)药物发现临床前临床一期临床二期(2013-10-01)——————巨球蛋白血症美国Amgen Inc(安进)临床二期(2013-10-01)药物发现临床前临床一期临床二期(2013-10-01)——————实体瘤美国Amgen Inc(安进)临床二期(2013-10-01)药物发现临床前临床一期临床二期(2013-10-01)——————肾细胞癌美国Amgen Inc(安进)临床二期(2013-10-01)药物发现临床前临床一期临床二期(2013-10-01)——————套细胞淋巴瘤美国Amgen Inc(安进)临床二期(2013-04-30)药物发现临床前临床一期临床二期(2013-04-30)——————慢性淋巴细胞白血病美国Amgen Inc(安进)临床一期(2013-10-01)药物发现临床前临床一期(2013-10-01)————————皮肤T淋巴细胞瘤美国Amgen Inc(安进)临床一期(2013-10-01)药物发现临床前临床一期(2013-10-01)————————外周T细胞淋巴瘤美国Amgen Inc(安进)临床一期(2013-10-01)药物发现临床前临床一期(2013-10-01)————————非霍奇金淋巴瘤美国Amgen Inc(安进)药物发现(2013-11-11)药物发现(2013-11-11)————————————血液肿瘤美国Yale University(耶鲁大学)药物发现(2003-03-31)药物发现(2003-03-31)————————————非积极研发详情全球同靶点竞争格局(数据来源:药融云全球药物研发数据库)靶点药物发现临床前临床临床一期临床二期临床三期提交上市申请已上市PSM 1110036103UB5211药品名称药品名称靶点全球最高研发阶段carfilzomib 耶鲁大学PSM 、UB已上市bortezomib 武田26S proteasome complex 、PSM 已上市ixazomib citrate 武田PSM 已上市marizomib 加州大学圣迭戈分校PSM 临床三期CX13-608宁波圣健生物医药科技有限公司PSM临床二期zetomipzomib 安进Proteasome beta-8 subunit 、PSM 临床二期AP-101, AL-S Pharma Neurimmune Holding AG PSM 、CUZNSOD 临床二期VLX-1570Vivolux AB PSM 、UCHL5、USP14临床二期disulfiram + copper gluconate 犹他大学PSM临床二期inobrodibCellCentric LtdAR 、CREBBP 、Ep300、UB临床二期受理号药品名称生产企业承办日期JYHB2101557注射用卡非佐米Onyx Pharmaceuticals, Inc.、Amgen Technology (Ireland) Unlimited Company (ADL)2021-11-25中国注册申报 (数据来源:药融云中国药品审评数据库)企业分析受理号药品名称生产企业承办日期CYHS2101694注射用卡非佐米江苏豪森药业股份有限公司2021-09-07CYHS2101693注射用卡非佐米江苏豪森药业股份有限公司2021-09-07CYHS2101695注射用卡非佐米江苏豪森药业股份有限公司2021-09-07CYHL2100010注射用卡非佐米扬子江药业集团有限公司2021-01-27CYHL2100009注射用卡非佐米扬子江药业集团有限公司2021-01-27JXHB2000044注射用卡非佐米百济神州(北京)生物科技有限公司2020-11-02CYHS2000355注射用卡非佐米江苏豪森药业股份有限公司2020-06-03CYHS2000354注射用卡非佐米江苏豪森药业股份有限公司2020-06-03JYHB2000692注射用卡非佐米百济神州(北京)生物科技有限公司2020-06-02受理号药品名称生产企业承办日期CYHS2200094注射用硼替佐米江苏诚康药业有限公司2022-01-17JYHZ2100744注射用硼替佐米Janssen-Cilag International N.V.、BSP Pharmaceuticals S.p.A.、西安杨森制药有限公司2021-12-23JYHZ2100743注射用硼替佐米Janssen-Cilag International N.V.、BSP Pharmaceuticals S.p.A.、西安杨森制药有限公司2021-12-23JYHB2101557注射用卡非佐米Onyx Pharmaceuticals, Inc.、Amgen Technology (Ireland) Unlimited Company (ADL)2021-11-25CYHS2102042注射用硼替佐米仁合熙德隆药业有限公司2021-11-17JYHB2101417注射用硼替佐米Janssen-Cilag International N.V.、西安杨森制药有限公司、BSP Pharmaceuticals S.p.A 、Janssen pharmaceutica N.V.2021-09-16JYHB2101416注射用硼替佐米Janssen-Cilag International N.V.、西安杨森制药有限公司、BSP Pharmaceuticals S.p.A 、Janssen pharmaceutica N.V.2021-09-16CYHS2101694注射用卡非佐米江苏豪森药业股份有限公司2021-09-07CYHS2101693注射用卡非佐米江苏豪森药业股份有限公司2021-09-07CYHS2101695注射用卡非佐米江苏豪森药业股份有限公司2021-09-07同靶点药品分析临床试验信息 (数据来源:药融云全球临床试验数据库、药融云中国临床试验数据库)全球临床试验-试验阶段分析试验登记号药品名称试验阶段登记日期NCT0230 3821carfilzomibVariable regimens including 6-mercaptopurine, carfilzomib , cyclophosphamide, cytarabine , daunorubicin, dexamethasone, hydrocortisone , methotrexate , mitoxantrone , pegaspargase , vincristine1期临床2014-12-01NCT0199 1301carfilzomibciclosporin, Novartis plus methotrexate1期临床2013-11-25NCT0130 2392carfilzomib3期临床2011-02-24 carfilzomib (Arm I)NCT0194 9545carfilzomib (Arm II)carfilzomib (Arm III)carfilzomib (Arm IV)1期临床2013-09-24 carfilzomibNCT0400 4338carfilzomib——2019-07-02 EchocardiogramNCT0482 7563EndoPAT deviceblood Testscarfilzomib——2021-04-01 home blood pressure cuffNCT0326 9552carfilzomibcarfilzomib plus rituximab2期临床2017-08-31NCT0249 1359carfilzomib2期临床2015-07-08NCT0244 2648carfilzomibplasmapheresis1期临床2015-05-13NCT0231 8784carfilzomib2期临床2014-12-17INCB052793gemcitabinenab-paclitaxeldexamethasoneNCT0226 5510Carfilzomibbortezomiblenalidomide1期临床2014-10-16 azacitidinepomalidomideINCB050465INCB039110NCT0225 7476carfilzomibdexamethasone1期临床2014-10-06NCT0217 8579bortezomibcarfilzomib——2014-07-01NCT0204 2950carfilzomib2期临床2014-01-23NCT0202 0941carfilzomibcarfilzomib plus dexamethasone2期临床2013-12-25适应症4期临床3期临床2期临床1期临床0期临床临床阶段不明合计多发性骨髓瘤2918659561101221780急性淋巴细胞白血病2136150153040486神经内分泌肿瘤6161145929295登记号试验题目药品名称适应症试验状态试验分期申办单位主要临床机构首次公示日期CTR2 0212410注射用卡非佐米在复发性或难治性多发性骨髓瘤患者中随机、开放、两序列、四周期交叉生物等效性及延长用药疗效分析预试验注射用卡非佐米骨髓瘤进行中BE 试验扬子江药业集团有限公司首都医科大学附属北京朝阳医院2021-11-26CTR2 0190717一项在复发性多发性骨髓瘤患者中比较卡非佐米联合地塞米松与硼替佐米联合地塞米松的随机、开放标签的3期研究注射用卡非佐米多发性骨髓瘤进行中III 期Amgen Europe B.V.、Amgen Technology (Ireland) Unlimited Com pany (ADL)、安进生物技术咨询(上海)有限公司中国医学科学院血液病医院(中国医学科学院血液学研究所)2019-11-28CTR2 0160857一项卡非佐米联合地塞米松用于中国复发难治性多发性骨髓瘤受试者的开放标签的单臂3期研究注射用卡非佐米复发难治性多发性骨髓瘤进行中III 期Onyx Pharmaceuticals, Inc.、DS M Pharmaceuticals, Inc.(DPI)、杭州泰格医药科技股份有限公司首都医科大学附属北京朝阳医院2016-12-07CTR2 0140135一项对比CMP 疗法与VMP 疗法用于初诊的不符合移植条件的多发性骨髓瘤患者的随机、开放、Ⅲ期临床研究注射用卡非佐米初诊的不符合移植条件的多发性骨髓瘤进行中III 期Onyx Pharmaceuticals, Inc.、DS M Pharmaceuticals,Inc.(DPI)、杭州泰格医药科技股份有限公司中国医学科学院血液学研究所血液病医院2014-05-19药品名称公司名称申请号国家/地区批准日期CARFILZOMIB BRECKENRIDGE ANDA 209330美国2021-06-11CARFILZOMIBBRECKENRIDGEANDA 209330美国2021-06-11中国临床试验-试验分期分析全球上市批准 (数据来源:药融云全球上市药品筛选系统数据库)药品名称公司名称申请号国家/地区批准日期CARFILZOMIB EUGIA PHARMA ANDA 210823美国2020-03-31 CARFILZOMIB APOTEX ANDA 211185美国2020-03-20 CARFILZOMIB APOTEX ANDA 209425美国2020-03-16 CARFILZOMIB DR REDDYS ANDA 209422美国2019-09-09 CARFILZOMIB QILU PHARM CO LTD ANDA 209528美国2019-01-18KYPROLIS ONYX THERAP NDA 202714美国2012-07-20KYPROLIS ONYX THERAP NDA 202714美国2012-07-20KYPROLIS ONYX THERAP NDA 202714美国2012-07-20专利公开号专利题目专利权人专利类型专利首次公开日期WO2021257941A1Methods of measuring carfilzomib Amgen Inc诊断、分析和测定2021-12-23WO20212 31814A1Compositions and methods for the treatment and prevention of vascular malformationsColumbia University药物发现和筛选、基因筛查和组合、新用途2021-11-18WO2021222783A1Anti-TM4SFl antibody drug conjugates and methods of using same Angiex Inc配方2021-11-04WO20212 22524A1Methods of treating multiple myeloma with a triplet therapy of carfilzomib, dexamethasone, and an antibody that specifically recognizes cd38.Janssen Biotech Inc、OnyxPharmaceuticals Inc联合用药2021-11-04WO2021209947A1Stable ready to dilute formulations of carfilzomib Kashiv BioSciences LLC配方2021-10-21WO2021142359A1Stable cyclodextrin free carfilzomib formulation Amgen Inc配方2021-07-15WO2021142360A1Stable cyclodextrin free carfilzomib formulation Amgen Inc给药装置、配方2021-07-15WO20211 13754A1Use of isatuximab for the treatment of relapsed and/or refractory multiple myelomaSanofi SA、Sanofi-AventisUS LLC配方、新用途2021-06-10医药专利信息(数据来源:药融云全球医药专利数据库、药融云中国医药专利数据库)全球医药专利-专利类型分析全球医药专利-专利公开所属地分析专利公开号专利题目专利权人专利类型专利首次公开日期WO20211 10121A1HDAC6 selective inhibitor and combination therapy thereof CStone Pharmaceuticals 联合用药、配方、新用途2021-06-10WO20211 01842A1Alkylated cyclodextrin compositions and processes for preparing and using the s ameCyDex Pharmaceuticals In c配方2021-05-27公开号标题当前第一申请(专利权)人公开日专利类型CN111646958B 一种卡非佐米的制备方法常州恒邦药业有限公司——授权发明CN111646958A 一种卡非佐米的制备方法常州恒邦药业有限公司——发明申请CN111153964A 一种卡非佐米晶型及其制备方法及其用途安礼特(上海)医药科技有限公司——发明申请CN110882221A 一种注射用卡非佐米冻干制剂的生产工艺健进制药有限公司——发明申请CN110639002A 卡非佐米在制备用于治疗骨肉瘤药物中的应用西安交通大学——发明申请CN110613835A 卡非佐米在制备治疗缺血性脑损伤药物中的应用浙江大学——发明申请CN110759967A 一种卡非佐米的制备方法雅本化学股份有限公司——发明申请HK40004216A 一種用於純化卡非佐米中間體的方法FRESENIUS KABI ONCOLOGY LTD.——发明申请HK1262091A 聚乙二醇化卡非佐米化合物AMGEN INC.——发明申请CN109406685A一种分离卡非佐米和其异构体的高效液相色谱方法南京盖斯夫医药科技有限公司——发明申请中国医药专利-专利类型分析市场信息单位:万元企业该条件暂无相关数据单位:万企业该条件暂无相关数据。
美瑞尼(盐酸美他环素胶囊)

美瑞尼(盐酸美他环素胶囊)【药品名称】商品名称:美瑞尼通用名称:盐酸美他环素胶囊英文名称:Metacycline Hydrochloride Capsules【成份】成分为盐酸美他环素,其化学名为[4S-(4α,4aα,5α,5aα,12aα)]-6-亚甲基-4-(二甲氨基)-3,5,10,12,12a-五羟基-1,11-二氧代-2-并四苯甲酰胺盐酸盐。
其结构式为:分子式:C22H22N2O8·HCl分子量:478.89【适应症】1.本品作为首选或选用药物可用于下列疾病:(1)立克次体病,包括流行性斑疹伤寒、地方性斑疹伤寒、洛矶山热、恙虫病和Q热。
(2)支原体属感染。
(3)衣原体属感...【用法用量】成人口服每12小时300mg,8岁以上小儿口服每12小时按体重5mg/kg。
【不良反应】1.消化系统:胃肠道症状如恶心、呕吐、上腹不适、腹胀、腹泻,偶有胰腺炎等。
偶有食管炎和食管溃疡的报道,多发生于服药后立即上床的患者。
2.肝毒性:通常为脂肪肝变性,妊娠期妇女、原有肾功能损害的患者易发生,亦可发生于并无上述情况的患者。
本品所致胰腺炎也可与肝毒性同时发生,患者并不伴有原发性肝病。
3.变态反应:多为斑丘疹和红斑,此外可见荨麻疹、血管神经性水肿、过敏性紫癜、心包炎以及系统性红斑狼疮皮损加重,表皮剥脱性皮炎并不常见。
偶有过敏性休克和哮喘发生。
某些用本品的患者日晒时可能有光敏现象。
所以,建议患者不要直接暴露于阳光或紫外线下,一旦皮肤有红斑应立即停药。
4.血液系统:偶可引起溶血性贫血、血小板减少、中性粒细胞减少和嗜酸粒细胞减少。
5.中枢神经系统:偶可致良性颅内压增高,可表现为头痛、呕吐、视神经乳头水肿等。
6.肾毒性:原有显著肾功能损害的患者可能发生氮质血症、高磷酸血症和酸中毒。
7.二重感染:长期应用本品可诱发耐药金葡菌、革兰阴性杆菌和真菌等引起的二重感染,严重者可致败血症。
产品介绍:硫酸安普霉素等相关信息

[产品规格]
每mg原料药不少于550安普霉素单位。
[包装规格]
10个十亿/纸板桶;一个十亿/铝罐。
[执行标准]
中国兽药典
[抗菌谱]
硫酸安普霉素对畜禽革兰氏阴性菌和大部分革兰氏阳性菌有较强的抗菌活性,特别是对耐庆大霉素、卡那霉素、丁胺卡那霉素等抗生素的细菌仍有较强的抗菌作用,而且不易产生耐药性。
附录1:允许用于食品动物,但不需要制定残留限量的药物中的唯一抗生素。
返回产品目录
杭州凯胜生物技术有限公司版权所有
头孢噻呋钠 头孢噻呋盐酸盐 盐酸氨丙啉头孢替呋钠L-色氨酸 磷霉素钙
[吸收与代谢]
口服:不易吸收,仅有11%通过肠道吸收进入机体,89%以原药的形式在肠道起作用。
肌肉注射:消失半衰期为6小时,98%以上的药物在96小时内以原药的形式通过肾脏排出。
[休药期]猪21天Fra bibliotek鸡7天[贮藏]
避光,在干燥处保存
[安全]
硫酸安普霉素是农业部2002年235号公告《动物性食品最高残留限量》
产品介绍:硫酸安普霉素
硫酸安普霉素(APRAMYCIN SULFATE)
[化学名称]
硫酸安普霉素(APRAMYCIN SULFATE)
[化学结构式]
[分子式]
C21H41N5011· 5/2H2SO4
[分子量]
784.8
[性状]
淡黄色粉末,易溶于水,不溶于甲醇、氯仿等有机溶剂,其水溶液活性稳定。
[产品简介]
自-罗氏proGRP产品说明书

【产品名称】通用名称:胃泌素释放肽前体检测试剂盒(电化学发光法)英文名称:ProGRP【包装规格】100测试/盒【预期用途】主要用途用于体外定量检测人血浆和血清中的胃泌素释放肽前体(ProGRP)。
该分析结合其他临床方法可辅助用于肺癌的鉴别诊断和小细胞肺癌患者的管理。
结果必须根据标准临床诊疗指南结合其他方法进行解释。
Elecsys和cobas e免疫分析仪的工作原理是电化学发光免疫分析“ECLIA”。
临床应用胃泌素释放肽(GRP)是一种重要的调节分子,和人体许多生理功能、病理状态有关。
它是一种胃肠激素,是哺乳动物同源的两栖动物蛙皮素,最初从猪胃粘膜中分离,广泛分布于哺乳动物的神经系统、胃肠道和呼吸道。
1随着信号肽解离,它的148个氨基酸的前蛋白原进一步分解生成27个氨基酸的胃泌素释放肽和68个氨基酸的胃泌素释放肽前体(ProGRP)。
由于胃泌素释放肽的半衰期很短,只有2分钟,不可能在血中检测到。
因此研发出一种检测胃泌素释放肽前体(31-98)的测定法,一个羧基端区域,常见于三种类型的人胃泌素释放肽前体剪接变体。
现已证明血清胃泌素释放肽前体(31-98)可作为小细胞肺癌(SCLC)病人的可靠标志物。
2,3,4,5Elecsys胃泌素释放肽前体检测血浆和血清中的胃泌素释放肽前体(31-98)。
胃泌素释放肽前体和神经特异性烯醇化酶(NSE)是与神经内分泌源组织和肿瘤有关的两种分子。
胃泌素释放肽前体水平升高见于多种神经内分泌源肿瘤,包括小细胞肺癌、类癌、具有神经内分泌功能的未分化大细胞肺癌、甲状腺髓样癌6、其他神经内分泌恶性肿瘤6以及具有神经内分泌功能的不依赖雄激素的前列腺癌亚组。
7良性疾病中的胃泌素释放肽前体:文献报道胃泌素释放肽前体血清浓度在2-50pg/mL时为正常。
8但是,在一项对包括肝脏疾病在内的良性疾病(肾功能不全除外)病人的研究中,有2.5%的病人胃泌素释放肽前体血清水平>50pg/mL。
阿司咪唑

合成方法
合成方法
化合物(I)和碘甲烷在乙醇中回流8h,环合得到化合物(Ⅱ)。再水解脱去酯基,得到化合物(Ⅲ)。用对甲氧 基苯乙基溴进行N-烷基化,得化合物(Ⅳ)。再用对氟苄基溴烷基化,得阿司咪唑。
1. 1-[(4-氟苯基)甲基]-苯并咪唑-2-(3H)-酮的制备
在反应瓶中加入2-羟基苯并咪唑5.0g(37.3mmol)和NaH 1.6g(53mmol)(NaH含量大约为80%,浸入矿物油中) 的DMF 100ml的悬浮液.加毕.在60ºC.(最好有N2保护)搅拌反应1h.再加入4-氟苄基氯(FBC)5.4g(37mmol),加热 ( 6 0 ºC ) 搅 拌 反 应 5 . 5 h . 冷 却 至 室 温 后 加 入 冰 水 7 0 0 m l , 用 二 氯 甲 烷 ( 5 0 0 m l × 2 ) 提 取 . 有 机 层 用 食 盐 水 洗 . 无 水 N a 2 S O 4 干燥.过滤.滤液减压浓缩.剩余物用石油醚析晶.得1-[(4-氟苯基)甲基]-苯并咪唑-2-(3H)-酮固体8.0g,为无色 结 晶 m p 1 7 8 ~ 1 7 9 ºC , 收 率 8 8 % .
治疗措施
阿司咪唑中毒的治疗要点为: 1.大量摄入者予洗胃,后灌服活性炭和导泻。 2.对心肌抑制和Q-T间期延长者予5%碳酸氢钠250ml静注可能有效。 3.对症、支持治疗。
专家点评
专家点评
阿司咪阿司咪唑自1983年上市以来,在许多国家得到了广泛应用。国外研究显示阿司咪唑治疗荨麻疹的总有 效率为74%。国内的一项多中心双盲安慰剂对照试验表明阿司咪唑对急性荨麻疹的总有效率为82.9%,对慢性荨麻 疹的总有效率为86.0%,均显著高于安慰剂,主要不良反应为嗜睡、倦怠、口干等,连续用药3个月的患者中,半 数有食欲及体重增加。阿司咪唑的心脏毒性虽然发生率较低,但由于后果严重,已限制了它的应用。阿司咪唑为 强效和长效的H1受体拮抗剂,无中枢镇静和抗毒蕈碱样作用。代谢产物去甲阿司咪唑仍有抗胆胺作用。长期服用 可增进食欲和增加体重,服用过量可引起心脏Q-T间期延长和室性心律失常。适用于各种原因引起过敏性疾病。
美普清(丙卡特罗)片 25ug20盒

【药物名称】中文通用名称:盐酸丙卡特罗英文通用名称:Procaterol Hydrochloride其他名称:丙卡特罗、川迪、曼普特、美喘清、美普清、普鲁卡地鲁、普鲁喹醇、希思宁、盐酸丙卡特鲁、盐酸普鲁卡地鲁、异丙喹喘宁、Aerosol Proeaterol Hydrochloride、Masacin、Meptin、Mesacin、Onsukil、Procadil、Procaterol。
【临床应用】[SFDA说明书适应症]用于防治支气管哮喘、哮喘性支气管炎、伴有支气管反应性增高的急性支气管炎和慢性阻塞性肺疾病所致的喘息症状。
【药理】1.药效学本药为β2-肾上腺素受体激动药,对支气管的β2受体具有高度选择性,其支气管扩张作用强而持久。
本药还具有较强的抗过敏作用,不但抑制速发型的气道阻力增加,还抑制迟发型的气道反应性增高。
豚鼠肺切片试验显示,本药对用白蛋白诱发组胺释放的抑制作用比异丙肾上腺素强10倍,比硫酸沙丁胺醇强100倍。
人体试验表明,本药能抑制哮喘患者以乙酰胆碱喷雾剂诱发的支气管收缩反应,并有轻微增加支气管纤毛运动的作用。
2.药动学本药口服后迅速吸收,5分钟内开始起效,作用可持续6-8小时。
1-2小时后在血浆、组织及主要器官中能达到最高浓度,在肝、肾及主要代谢器官的浓度最高,其中在支气管及靶器官的浓度也较高,但在中枢及末梢神经系统的浓度较低。
本药主要在肝脏及小肠中代谢为葡萄糖醛酸化合物,衰减模式呈双相性,半衰期α相为3小时,β相为8.4小时,随尿液及粪便排出体外。
【注意事项】1.禁忌症对本药及肾上腺素受体激动药过敏者。
2.慎用(1)甲状腺功能亢进者。
(2)高血压患者。
(3)冠心病等心脏病患者。
(4)糖尿病患者。
3.药物对儿童的影响儿童用药的安全性尚不明确,应慎用。
4.药物对妊娠的影响孕妇用药的安全性尚不明确,应慎用。
5.药物对哺乳的影响哺乳期妇女用药的安全性尚不明确,应慎用。
【不良反应】1.心血管系统可见高血压,偶见心悸、心律失常、心率加快、面色潮红及心电图改变。
雷帕霉素说明书
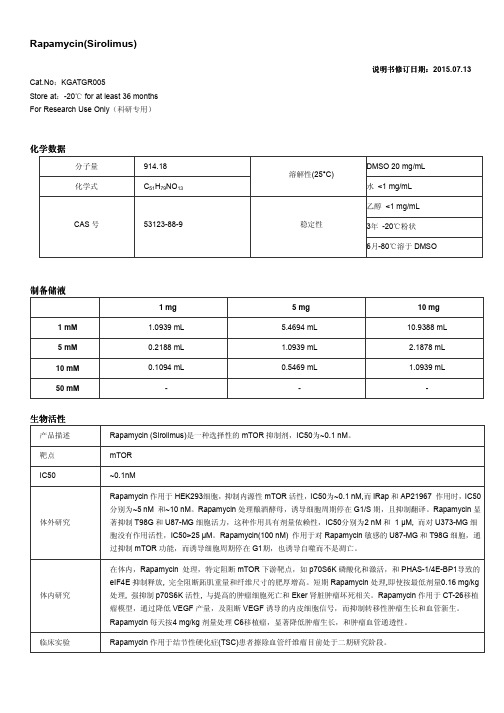
Rapamycin(Sirolimus)说明书修订日期说明书修订日期::2015.07.13Cat.No :KGATGR005Store at :-20 for at least 36 months ℃ For Research Use Only (科研专用)化学数据分子量 914.18DMSO 20 mg/mL化学式C 51H 79NO 13溶解性(25°C)水 <1 mg/mL 乙醇 <1 mg/mL3年 -20℃粉状 CAS 号53123-88-9稳定性6月-80℃溶于DMSO制备储液1 mg 5 mg 10 mg 1 mM 1.0939 mL 5.4694 mL 10.9388 mL 5 mM 0.2188 mL 1.0939 mL 2.1878 mL 10 mM 0.1094 mL0.5469 mL1.0939 mL50 mM---生物活性产品描述 Rapamycin (Sirolimus)是一种选择性的mTOR 抑制剂,IC50为~0.1 nM 。
靶点 mTOR IC50~0.1nM体外研究Rapamycin 作用于HEK293细胞,抑制内源性mTOR 活性,IC50为~0.1 nM,而iRap 和AP21967 作用时,IC50分别为~5 nM 和~10 nM 。
Rapamycin 处理酿酒酵母,诱导细胞周期停在G1/S 期,且抑制翻译。
Rapamycin 显著抑制T98G 和U87-MG 细胞活力,这种作用具有剂量依赖性,IC50分别为2 nM 和 1 µM, 而对U373-MG 细胞没有作用活性,IC50>25 µM 。
Rapamycin(100 nM) 作用于对Rapamycin 敏感的U87-MG 和T98G 细胞,通过抑制mTOR 功能,而诱导细胞周期停在G1期,也诱导自噬而不是凋亡。
体内研究在体内,Rapamycin 处理,特定阻断mTOR 下游靶点,如p70S6K 磷酸化和激活,和PHAS-1/4E-BP1导致的eIF4E 抑制释放, 完全阻断跖肌重量和纤维尺寸的肥厚增高。
美珀株单抗说明书

美珀株单抗说明书
美珀株单抗(Mepolizumab)是一种用于治疗特发性嗜酸性粒细胞性
鼻炎、嗜酸性粒细胞性支气管炎和嗜酸性粒细胞增多症(EGPA)的生物制剂。
它属于IgG1k(kappa)类单克隆抗体,是靶向IL-5受体α亚单位
的抗体。
美珀株单抗在人体内通过结合IL-5受体α亚单位来阻断IL-5的信
号通路。
IL-5是一种调节嗜酸性粒细胞增殖和活化的细胞因子,而嗜酸
性粒细胞是引起特发性嗜酸性粒细胞性鼻炎、嗜酸性粒细胞性支气管炎和
嗜酸性粒细胞增多症症状的主要细胞类型。
治疗前需要对患者进行过敏史评估和嗜酸性粒细胞水平的检测,以确
定是否符合使用该药物的适应症。
此外,患者还需要定期进行嗜酸性粒细
胞计数的监测和相关疗效的评估。
美珀株单抗的主要不良反应包括头痛、注射部位反应(如红肿、疼痛、瘙痒等)、口咽部炎症、气道感染等,一般都是轻度或中度的不良事件。
少数患者可能出现过敏反应,如荨麻疹、血管神经性水肿、喉头水肿等严
重不良事件,需要立即停药并采取适当处理措施。
美珀株单抗是一种新型的靶向嗜酸性粒细胞的生物制剂,对特发性嗜
酸性粒细胞性鼻炎、嗜酸性粒细胞性支气管炎和嗜酸性粒细胞增多症的治
疗具有重要意义。
然而,由于该药物的局限性和患者个体差异,使用前还
需权衡利弊,确保在适当的病例中合理使用,以取得最佳的疗效。
阿瑞匹坦胶囊说明书

核准日期:2013年7月16日修改日期:阿瑞匹坦胶囊说明书请仔细阅读说明书并在医师指导下使用[药品名称]通用名称:阿瑞匹坦胶囊商品名称:意美(EMEND)英文名称:Aprepitant Capsules汉语拼音:Aruipitan Jiaonang[成份]本品主要成份为阿瑞匹坦化学名称:5-[[(2R,3S)-2-[(1R)-1-[3,5-二(三氟甲基) 苯基]乙氧基]-3-(4-氟苯基)-4-吗啉基]甲基]-1,2-二氢-3H-1,2,4-三唑-3-酮化学结构式:分子式:CH21F7N4O323分子量:534.43[性状]本品为硬胶囊,内容物为类白色小丸。
80mg:白色不透明硬胶囊,印有‘461’和‘80mg’的字样。
125mg:不透明硬胶囊,白色囊身和粉色囊帽,印有‘462’和‘125mg’的字样。
[适应症] 阿瑞匹坦胶囊与其它止吐药物联合给药,适用于预防高度致吐性抗肿瘤化疗的初次和重复治疗过程中出现的急性和迟发性恶心和呕吐。
(参见“用法用量”)[规格] (1)80mg;(2)125mg[用法用量]本品的剂型为口服胶囊。
在阿瑞匹坦胶囊与一种糖皮质激素和一种5-HT3拮抗剂联合治疗方案中,本品给药3天。
在开始治疗前需仔细阅读5-HT3拮抗剂的说明书。
本品的推荐剂量是在化疗前1小时口服125mg(第1天),在第2和第3天早晨每天一次口服80mg。
在一项在中国开展的临床研究中,使用了以下治疗方案预防高度致吐性抗肿瘤化疗导致的恶心和呕吐:*在第1天化疗前1小时以及第2天和第3天早晨口服阿瑞匹坦。
**在第1天化疗前30分钟以及第2-4天的早晨服用地塞米松,服用剂量根据药物相互作用确定。
†在第1天化疗前30分钟使用格拉司琼。
一般信息关于本品与糖皮质激素联合应用时的其它信息参见“药物相互作用”。
联合使用的止吐剂可参见其说明书。
本品可以与食物同时服用,也可以不与食物同时服用。
不同年龄、性别、种族及身体质量指数(BMI)的患者不需要调整药物的剂量。
产品说明书-特耐-2010年11月05日修订

Version No: 20101105
第 6 页,共 15 页
如果患者具有发生心血管事件的高危因素(如:高血压、高血脂、糖尿病、吸烟),采 用本品治疗前应认真权衡利益风险。
有高血压和/或心力衰竭(如液体潴留和水肿)病史的患者应慎用。
代谢和营养异常 常见:低钾血症。
精神异常 常见:焦虑、失眠。
神经系统异常 常见:感觉减退。 少见:脑血管疾病。
心脏异常 少见:心动过缓。
血管异常 常见:高血压、低血压。 少见:高血压加重。
Version No: 20101105
பைடு நூலகம்
第 4 页,共 15 页
呼吸、胸及胸腔纵隔异常 常见:呼吸功能不全、咽炎。
胃肠道异常 常见:干槽症、消化不良、胃肠气胀。 少见:胃及十二指肠溃疡。
皮肤及附属器官异常 常见:瘙痒。 少见:瘀斑。
肌肉骨骼及结缔组织异常 常见:背痛。
肾及泌尿系统异常 常见:少尿。
全身及注射部位 常见:外周水肿。
常规检查 常见:肌酐升高。 少见:SGOT 升高、SGPT 升高、血液尿素氮升高。
以下罕见严重不良事件与使用非甾体抗炎药有关,并且不能排除帕瑞昔布钠发生这些不 良反应的可能:支气管痉挛和肝炎。
[不良反应] 根据国外文献报道,在不同发生率类别中,不良事件按其严重程度降序排列。
在临床对照试验中,接受帕瑞昔布治疗的患者中有 1962 名为术后疼痛患者。
在 12 项安慰剂对照临床研究中(包括口腔科、妇科、骨科或冠状动脉搭桥术(CABG) 术后止痛,以及口腔科与骨科的术前用药), 1543 名接受帕瑞昔布 20mg 或 40mg,单 剂量或多剂量(最大剂量为 80mg/天)治疗的患者曾报告出现以下不良事件,其发生率 高于安慰剂组。在这些临床研究中,由于不良事件而退出研究的受试者比率为:帕瑞昔 布组 5.0%;安慰剂组 4.3%。
阿帕他胺片安森珂

核准日期:2019年09月05日修订日期:2020年08月12日2020年10月30日2021年05月28日阿帕他胺片说明书请仔细阅读说明书并在医师指导下使用【药物名称】通用名称:阿帕他胺片商品名称:安森珂® ERLEADA®英文名称:Apalutamide Tablets汉语拼音:Apata’an Pian【成分】本品活性成分为阿帕他胺化学名:4-[7-(6-氰基-5-三氟甲基吡啶-3-基)-8-氧-6-硫代-5,7-二氮杂螺[3.4]辛-5-基]-2-氟-N-甲基苯甲酰胺化学结构式:分子式:C21H15F4N5O2S分子量:477.43辅料为:片芯:胶态二氧化硅、交联羧甲纤维素钠、醋酸羟丙基甲纤维素琥珀酸酯(HPMC-AS)、硬脂酸镁、微晶纤维素、硅化微晶纤维素薄膜包衣:氧化铁黑(E172)、氧化铁黄(E172)、聚乙二醇、聚乙烯醇(部分水解)、滑石粉、二氧化钛【性状】本品为浅黄绿色至灰绿色椭圆形薄膜衣片,一侧凹刻有“AR 60”字样,除去包衣后显白色至类白色或微黄色。
【适应症】⚫转移性内分泌治疗敏感性前列腺癌(mHSPC)成年患者⚫有高危转移风险的非转移性去势抵抗性前列腺癌(NM-CRPC)成年患者【规格】60 mg【用法用量】推荐剂量本品的推荐剂量是240 mg(4片60 mg/片的片剂),每日一次,口服给药。
需整片吞下。
可以单独服用或与食物同服。
患者还应同时接受雄激素剥夺治疗,即同时接受促性腺激素释放激素类似物(GnRHa)治疗或已接受过双侧睾丸切除术。
如果错过了1次用药,应尽快在当天补服药物,次日仍按正常计划服药。
请勿额外服用本品以弥补漏服剂量。
剂量调整如果患者出现≥3级毒性或无法耐受的不良反应,应暂停给药,直至症状改善至≤1级或原有级别,如果有必要,再恢复相同剂量或减量(180 mg或120 mg)。
其他给药方法对于吞咽整片药物困难的患者,可将推荐剂量的阿帕他胺片与苹果酱混合后服用。
马来酸罗托沙敏-安全技术说明书MSDS

第一部分化学品及企业标识化学品中文名:马来酸罗托沙敏化学品英文名:Carbinoxamine hydrogen maleateCAS No.:3505-38-2分子式:C20H23ClN2O5产品推荐及限制用途:工业及科研用途。
第二部分危险性概述紧急情况概述吞咽会中毒。
造成皮肤刺激。
造成严重眼刺激。
可引起呼吸道刺激。
GHS危险性类别急性经口毒性类别 3皮肤腐蚀 / 刺激类别 2严重眼损伤 / 眼刺激类别 2特异性靶器官毒性一次接触类别 3标签要素:象形图:警示词:警告危险性说明:H301 吞咽会中毒H315 造成皮肤刺激H319 造成严重眼刺激H335 可引起呼吸道刺激●预防措施:—— P264 作业后彻底清洗。
—— P270 使用本产品时不要进食、饮水或吸烟。
—— P280 戴防护手套/穿防护服/戴防护眼罩/戴防护面具。
—— P261 避免吸入粉尘/烟/气体/烟雾/蒸气/喷雾。
—— P271 只能在室外或通风良好处使用。
●事故响应:—— P301+P310 如误吞咽:立即呼叫解毒中心/医生—— P330 漱口。
—— P302+P352 如皮肤沾染:用水充分清洗。
—— P332+P313 如发生皮肤刺激:求医/就诊。
—— P362+P364 脱掉沾染的衣服,清洗后方可重新使用—— P305+P351+P338 如进入眼睛:用水小心冲洗几分钟。
如戴隐形眼镜并可方便地取出,取出隐形眼镜。
继续冲洗。
—— P337+P313 如仍觉眼刺激:求医/就诊。
—— P304+P340 如误吸入:将人转移到空气新鲜处,保持呼吸舒适体位。
—— P312 如感觉不适,呼叫解毒中心/医生●安全储存:—— P403+P233 存放在通风良好的地方。
保持容器密闭。
—— P405 存放处须加锁。
●废弃处置:—— P501 按当地法规处置内装物/容器。
物理和化学危险:无资料。
健康危害:吞咽会中毒。
造成皮肤刺激。
造成严重眼刺激。
Pramiracetam_68497-62-1_DataSheet_MedChemExpress

P d t D t Sh t Product Name:Pramiracetam CAS No.:68497-62-1Cat. No.:HY-17455Product Data SheetMWt:269.38Formula:C14H27N3O2Purity :>98%Solubility:DMSO 54 mg/mL; Water <1mg/mL;Ethanol <1mg/mL Mechanisms:Biological Activity:Pramiracetam is a nootropic drug derived from piracetam, and is more potent. PramiracetamPathways:Others; Target:Others mg/mL; Ethanol <1 mg/mLreportedly improved cognitive deficits associated with traumatic brain injuries.IC50 Value:Target: in vitro: Pramiracetam sulfate did not exhibit any affinity in vitro for dopaminergic , GABAergic,serotoninergic, adrenergic, muscarinic, adenosine (IC50 > 10 uM), and benzodiazepine receptors(IC50 > 1 uM) binding sites [1].in vivo: In a double-blind, randomized design, two groups of six subjects each received alternating placebo and single 400, 800, 1,200, and 1,600 mg oral doses of pramiracetam after an overnight fast Mean (+/SD)peak plasma concentrations of the fo r dose gro ps (271+/054540+/References:[1]. Warner Lambert, et al. Some Neurochemical Properties of Pramiracetam (CI-879), A NewCognition-Enhancing Agent.[2]Chang T et al Pharmacokinetics of oral pramiracetam in normal volunteers J Clin Pharmacol fast. Mean (+/- SD) peak plasma concentrations of the four dose groups (2.71 +/- 0.54, 5.40 +/-1.34, 6.13 +/- 0.71, 8.98 +/- 0.71 micrograms/mL) were attained between two to three hours following drug administration [2]. Two doses of pramiracetam (7.5 mg/kg and...[2]. Chang T, et al. Pharmacokinetics of oral pramiracetam in normal volunteers. J Clin Pharmacol.1985 May-Jun;25(4):291-5.Caution: Not fully tested. For research purposes onlyMedchemexpress LLC18W i l k i n s o n W a y , P r i n c e t o n , N J 08540,U S AE m a i l : i n f o @m e d c h e m e x p r e s s .c o m W e b : w w w .m e d c h e m e x p r e s s .c o m。
盐酸氯米帕明片

盐酸氯米帕明片药品名称:【通用名称】盐酸氯米帕明片[药典]【商品名称】安拿芬尼® Anafranil【英文名称】 Clomipramine Hydrochloride Tablets [药典]【汉语拼音】 Yan Suan Lv Mi Pa Ming Pian成份:活性成份:盐酸氯米帕明化学名称:N,N-二甲基-10,11-二氢-3-氯-5H-二苯并[b,f]氮杂卓-5-丙胺盐酸盐化学结构式:分子式:C19H23ClN2·HCl分子量:351.32所属类别:化药及生物制品>> 抗精神失常药>> 抗抑郁药>> 三环类性状:本品为浅黄色圆形双凸面糖衣片,除去糖衣后,显黄白色。
适应症:各种病因和症状表现的抑郁状态:-内源性、反应性、神经症性、器质性、隐匿性及更年期性抑郁。
-与精神分裂症和人格障碍伴随的抑郁。
-由于早老、衰老、慢性疼痛状态、慢性躯体疾病引起的抑郁综合征。
-反应性、神经症性及精神病性的抑郁性心境障碍,包括其相应的躯体表现,也见于儿童患者。
强迫综合征(强迫症)其它适应症:恐怖症和惊恐发作,伴有发作性睡病的猝倒症,慢性疼痛状态、夜间遗尿(5岁以上,应首先排除可能的器质性病因)。
规格:25mg用法用量:在开始使用安拿芬尼进行治疗之前,应首先治疗可能存在的低钾血症(参见注意事项)应根据不同的个体及患者的情况确定给药剂量和给药方式。
原则上应尽可能用最小剂量达到最佳疗效,且慎重地增加剂量,特别是在治疗老年及青春期患者时,因其对安拿芬尼的反应比中间年龄的患者更强。
为了预防可能出现的QT间期延长和5-羟色胺中毒,建议依照推荐的剂量使用安拿芬尼,当同时服用可能导致QT间期延长的药物或其它5-羟色胺激活药物时,应慎重增加安拿芬尼的剂量。
在使用本品治疗期间,应严密地监视患者的疗效及药物耐受性。
抑郁症、强迫症和恐怖症:治疗初期:每次一片,每日2-3次。
以后的剂量视患者对药物的耐受性逐渐增加,如在治疗第一周每隔二、三天增加25毫克,直到每日4-6片。
Epicentre RNase I 产品说明书

ManualRNase IFor Research Use Only. Not for use in diagnostic procedures.Contents1. Introduction (3)2. Product designations and kit components (3)3. Product specifications (3)4. Protocol for removing RNA from DNA preparations (4)5. References (4)6. Further support (4)1. IntroductionRNase I preferentially degrades single-stranded RNA to individual nucleoside 3′ monophosphates by cleaving every phosphodiester bond.1 By comparison, other ribonucleases cleave only after specific residues (e.g., RNase A cleaves 3′ to pyrimidine residues). Thus, RNase I is useful for removing RNA from DNA preparations,2 detecting mismatches in RNA:RNA and RNA:DNA hybrids 2,3 and analysing and quantifying RNA in ribonuclease protection assays (RPA).4,5 The enzyme is completely inactivated by heating at 70 °C for 20 minutes in the presence of 5 mM dithiothreitol (DTT), eliminating the requirement to remove the enzyme prior to many subsequent procedures. 2. Product designations and kit components3. Product specificationsStorage: Store only at -20 °C in a freezer without a defrost cycle.Storage buffer: RNase I is supplied in a 50% glycerol solution containing 50 mM Tris-HCl (pH 7.5), 0.1 M NaCl and 0.1 mM EDTA.RNase I Dilution Buffer: A 50% glycerol solution containing 50 mM Tris-HCl (pH 7.5), 0.1 M NaCl and 0.1 mM EDTA.10X TNE Buffer: 100 mM Tris-HCl (pH 7.5), 1 M NaCl and 10 mM EDTA.Unit definition: One unit degrades 100 ng of E. coli ribosomal RNA per second into acid-soluble nucleotides at 37 °C.Quality control: RNase I is function-tested in a reaction containing 10 mM Tris-HCl (pH 7.5), 100 mM NaCl, 1 mM EDTA and 60 μg of E. coli ribosomal RNA with varying amounts of enzyme.6Contaminating activity assays: RNase I is free of detectable exo- and endodeoxyribonucleaseactivities as judged by incubation of 1 μg of various DNA substrates with 4 x 106 U of enzyme at 37 °C for 16 hours.ProductKit sizeReagent descriptionCatalog numberPart numberVolume4. Protocol for removing RNA from DNA preparationsRNase I can be used in place of RNase A for removing RNA from DNA preparations. In contrast to RNase A, RNase I effectively degrades contaminating RNA to mono- and dinucleotides that will not interfere with visualisation of small DNA molecules. After RNA removal, the enzyme can be inactivated by heating at 70 °C for 20 minutes in the presence of 5 mM DTT.Protocol1. Isolate DNA from 1-2 mL of overnight bacterial culture using a standard alkaline lysis procedure.52. After ethanol precipitation, suspend the DNA in 1X TNE buffer (page 3) at a concentrationappropriate for subsequent applications (see Notes below).3. Dilute RNase I enzyme 10-fold with RNase I Dilution Buffer and add 1.5-2 U to the DNApreparation.4. Incubate at 37 °C for 30 minutes to degrade contaminating RNA.5. Add DTT to a final concentration of 5-10 mM.6. Incubate at 70 °C for 20 minutes to inactivate the enzyme.NotesReaction buffer: Incubation with RNase I can be performed simultaneously with the digestion of plasmid DNA by restriction endonucleases. RNase I maintains ≥90% activity in buffers containing between 100 mM to 200 mM salt (either NaCl or KOAc). The activity of the enzyme is also relatively constant over a pH range of 7.0-8.8. Therefore, if the restriction endonuclease buffer is within these parameters, RNase I digestion can be performed in the restriction endonuclease buffer.Enzyme dilution: Diluted enzyme may be stored for up to two months at -20 °C in a freezer without a defrost cycle.5. References1. Shen, V. and Schlessinger, D. (1982) The Enzymes XV (Part B), 501.2. Winter, E. et al., (1985) Proc. Natl. Acad. Sci. USA82, 7575.3. Myers, R.M. et al., (1985) Science230, 1242.4. Sambrook, J. et al., (1989) in: Molecular Cloning: A Laboratory Manual (2nd ed.), Cold SpringHarbor Laboratory Press, New York.5. Saccomanno, C.F. et al., (1992) BioTechniques13, 847.6. Corbishley, T.P. et al., (1984) Meth. Enzymatic Anal. 4, 134.6. Further supportIf you require any further support, please do not hesitate to contact our Technical Support Team:************************Integrated tools. Accelerated science.All trademarks and registered trademarks mentioned herein are the property of their respective owners. All other trademarks and registered trademarks are the property of LGC and its subsidiaries. Specifications, terms and pricing are subject to change. Not all products are available in all countries. Please consult your local sales representative for details. No part of this publication may be reproduced or transmitted in any form or by any means, electronic or mechanical, including photocopying, recording or any retrieval system, without the written permission of the copyright holder. © LGC Limited, 2021. All rights reserved. GEN/889/EK/0121@LGCBiosearch。
α-蒎烯安全技术说明书MSDS

第一部分化学品及企业标识化学品中文名:α-蒎烯化学品英文名:α-pinene化学品别名:α-松油萜CASNo.:80-56-8ECNo.:201-291-9分子式:C10H16第二部分危险性概述紧急情况概述液体。
易燃,其蒸气与空气混合,能形成爆炸性混合物。
如果被吞食,可能会造成严重肺部损伤。
对皮肤有刺激性。
跟皮肤接触可能会引起敏化作用。
对水生物有剧毒,使用适当的容器,以预防污染环境。
对水生环境可能会引起长期有害作用。
使用适当的容器,以预防污染环境。
GHS危险性类别根据GB30000-2013化学品分类和标签规范系列标准(参阅第十六部分),该产品分类如下:易燃液体,类别3;吸入危险,类别1;皮肤腐蚀/刺激,类别2;皮肤敏化作用,类别1;危害水生环境-急性毒性,类别1;危害水生环境-慢性毒性,类别1。
标签要素象形图警示词:危险危险信息:易燃液体和蒸气,吞咽并进入呼吸道可能致命,造成皮肤刺激,可能导致皮肤过敏反应,对水生生物毒性极大,对水生生物毒性极大并具有长期持续影响。
预防措施:远离热源、热表面、火花、明火以及其它点火源。
禁止吸烟。
保持容器密闭。
容器和接收设备接地和等势联接。
使用不产生火花的工具。
采取措施,防止静电放电。
避免吸入粉尘/烟/气体/烟雾/蒸气/喷雾。
作业后彻底清洗。
受沾染的工作服不得带出工作场地。
避免释放到环境中。
戴防护手套/穿防护服/戴防护眼罩/戴防护面具。
事故响应:不得诱导呕吐。
清洗后方可重新使用。
收集溢出物。
如误吞咽:立即呼叫中毒急救中心/医生。
如发生皮肤刺激或皮疹:求医/就诊。
脱去被污染的衣服,清洗后方可重新使用。
如皮肤(或头发)沾染:立即去除/脱掉所有沾染的衣服。
用水清洗皮肤或淋浴。
安全储存:存放处须加锁。
存放在通风良好的地方。
保持低温。
废弃处置:按照地方/区域/国家/国际规章处置内装物/容器。
物理化学危险:易燃液体,其蒸气与空气混合,能形成爆炸性混合物。
健康危害:在正常生产处理过程中,吞咽本品并进入呼吸道可能致命。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子量269.38
溶解性(25°C)
DMSO 54 mg/mL
分子式C H N O Water < 1 mg/mL
CAS号68497-62-1Ethanol < 1 mg/mL
储存条件3年 -20°C 粉末状
生物活性
Pramiracetam 是由Piracetam衍生的一种更有效的促智药。
不同实验动物依据体表面积的等效剂量转换表(数据来源于FDA指南)
小鼠大鼠兔豚鼠仓鼠狗
重量 (kg)0.020.15 1.80.40.0810
体表面积 (m)0.0070.0250.150.050.020.5
K系数36128520
动物 A (mg/kg) = 动物 B (mg/kg) ×
动物 B的K系数
动物 A的K系数
例如,依据体表面积折算法,将白藜芦醇用于小鼠的剂量22.4 mg/kg 换算成大鼠的剂量,需要将22.4 mg/kg 乘以小鼠的K系数(3),再除以大鼠的K系数(6),得到白藜芦醇用于大鼠的等效剂量为11.2 mg/kg。
参考文献
The action of pramiracetam on consequences of hypobaric hypoxia is only moderate.
Maresová D, et al. Physiol Res. 1996;45(3):245-8. PMID: 9200217.
Pramiracetam 目录号M5892
化学数据
142732
2
m
m
m
m m。
