2.2化学能与电能
人教版化学必修二2.2-化学能与电能-配套讲课课件

C.CH3OH(g)+H2O(l) -6e- ===CO2(g)+6H+(aq) D.O2(g)+2H2O(l)+4e-===4OH-(aq)
【答案】 C 【点拨】 甲醇燃料电池是甲醇在负极发生氧化反应,氧气在 正极发生还原反应,故B、D错误;A项不是电极反应式。
特点:高能电池,电压高,质量轻, 贮存时间长等。
用途:电脑、手表、心脏起搏器等。
(3)燃料电池
氢氧燃料电池(碱性介质):
负极:
2H2+4OH— -4e— =4H2O (氧化反应)
正极:
氢氧燃料电池结构
O2+H2O+4e—=4OH—(还原反应) 总反应:2H2+O2=2H2O
练习 科学家近年来研制出一种新型细菌燃料电池,利 用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的 燃料电池发电,电池负极反应为( )
阳离子向正极移动 阴离子向负极移动
练习2:请在图上标出电子的流动方向和电流方向,
并判断正负极,写出电极反应式和总反应式.
I e-
e- I
Ag
Fe
Zn
Cu
H2SO4 (aq)
CuSO4 (aq)
负极( Fe ): Fe-2e - = Fe 2+ . 负极( Zn): Zn-2e - = Zn2+ .
人教版高一化学必修二第二章第二节化学能和电能
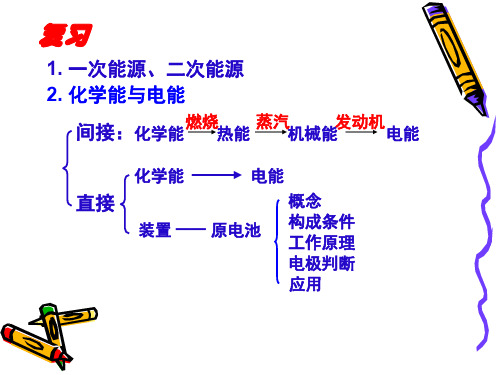
间接:化学能燃烧热能蒸汽机械能发动机电能
装置
直接:
原电池
工 作
概
构 成
原念条
理
件
原电池知识要点
人教版高中化学必修二课件-2.2化学能与电能

思考:火力发电有什么缺点?
1.煤炭是非可再生资源,会造成能源危机
2.煤炭燃烧会产生污染性气体 3.经多次转换,能量损耗大,燃料的利用率低
直接?
原电池:把化学能转变为电能的装置。
探究:原电池由几部分组成,它的构成条件是什么?
第一组: 原电池 的两级
第二组: 原电池 的溶液
第三组: 原电池 的电路
G
G Cu
G Cu
不偏转
NaCl溶 液
偏转
偏转
电极材料均插入 电解中质。溶液
第三组: 原电池 的电路
实验探究1
G
G Cu
电流计 指针是 否偏转
构成原 电池的 条件三:
不偏转
两极相连形成
偏转
闭。合电路
一、原电池
1、构成原电池的条件(两极一液一连线) ★电极:有两种活泼性不同的金属(或一 种是能导电的非金属单质)作电极 ★溶液:电极材料均插入电解质溶液中 ★导线:两极相连形成闭合电路
3.现有如下两个反应:
(A)NaOH+HCl===NaCl+H2O
(B)Cu+2Ag+===Cu2+
(1)根据两反应本质,判断能否设计成原电池_________。 (2)如果不能,说明其原因_______________。 (3)如果可以,则写出正、负极材料、 其电极反应式、反应类型(“氧化反应”或“还原反应”): 负极:________,__________________,________。 正极:________,_____________________,________。
【当堂过关】 1.下列装置能形成原电池的是( )
A.①②③⑦ C.①②③④
B.①②⑤⑥ D.①②③⑥⑦
2.2 化学能与电能 (共40张PPT)

总反应: Zn + Cu2+ = Zn 2+ + Cu
电极反应方程式的书写方法
负极:较活泼金属(a)
电极反应:a-ne-=an+ (氧化反应)
正极:较不活泼金属或非金属(b)
电极反应: Cm+ + me- = C(还原反应)
化学能 间接:
燃烧
蒸汽 发动机 机械能 电能 热能
直接:
装置
原电池 概 念 构 成 条 件
NO3-
K+ NO3-
e e e e e
Cu2+
Cu2+
Cu2+ Cu2+ Cu2+ Cu2+
Cu2+ Cu2+
2+ Cu2+ e e Cu e e Cu2+ e e Cu2+ Cu2+ e Cu2+ e e e Cu2+ Cu2+ ee Cu2+ e
Cu2+ Cu2+
Zn
Zn
H2SO4 A
H2SO4
C
H2SO4
A
4.如何书写电极反应方程式
负极(锌片): Zn -2e - = Zn 2+ 正极(石墨): 2H++2e - = H2 ↑ 总反应: Zn + 2H+ = Zn 2+ + H2 ↑ 负极(锌片): Zn -2e - = Zn 2+ 正极(铜片): Cu2+ + 2e - = Cu
一 . 一次能源和二次能源
一次能源: 从自然界中直接取得的能源.如:煤,石 油,天然气等. 二次能源: 经一次能源加工转移得到的能源.
2.2化学能与电能

(3)原电池的设计
基本要求:(必须明确负极、正极和电解 质溶液)
请将氧化还原反应: Fe + Cu = Cu + Fe
2+ 2+
设计成一个原电池(画出其示意 图,并写出正负极的反应式)。
1、电解液:
。
2、电极材料:
1、电解液: 硫酸铜、氯化铜、硝 酸铜等可溶性铜盐溶液 2、电极材料: 负极:铁, 正极:铜 、石墨或比 铁不活泼的其他金属 正极 ,负极 Fe - 2e - = Fe 2+ Cu2+ +2e - = Cu 。
原电池反应的本质是氧化还原反应。
探究活动: 构成原电池应有怎样的条件
探究实验2
1
构成原电池的条件
2
3
(可以)
(可以)
(不可以)
形成条件一: 通常用活泼性不同的两种材料作电极
负极:较活泼的金属 正极:较不活泼的金属或非金属(如石墨等)
第一组实验
4
5
盐酸
(可以)
(不可以)
形成条件二:两极之间填充电解质溶液;
3、电极反应式 : 负极: 正极: . .
思考题
请根据反应2Fe3++Fe=3Fe2+
设计原电池,你有哪些可行方案? Fe-Cu Fe-C Fe-Ag FeCl3 Fe(NO3)3 Fe(SO4)3
(6)原电池原理的应用 ①加快反应速率:
例如,实验室制H2时,由于锌太纯,反应一 般较慢,可加入少量CuSO4以加快反应速率。
不可再生能源:石油、煤、天然气等。
2001年我国发电总量构成图
火力81.2%
水电17.6%
其他1.2%
一、化学能转化为电能
人教版高中化学必修二2-2化学能与电能精品PPT课件
应用: 汽车上使用的电瓶等
②镍镉充电电池: 负极: Cd 正极: NiO(OH) 电解质: KOH 优缺点:具有残留性记忆,可重复使用500次以上,体积小;
但如不回收,会产生严重污染
应用:广泛用于收录机、无线对讲机、电子闪光灯、
电动剃须刀等
③锂离子电池:
是新一代可充电的绿色电池,现已成为笔记本电脑、 移动电话、数码相机、摄像机等低功耗电器的主流 电源
一个短暂快乐的周末小假期,给予我的时光让我充分认识到: 我不会再装模作样地拥有很多朋友,而是要回到了真实独立的自我之中,以真正的我开始了独自的生活。 虽然有时我也会因为寂寞而难以忍受空虚的折磨,但我宁愿以这样的方式来维护自己的自尊,也不愿以耻辱为代价去换取那种表面的朋友。
正所谓,真正的生命不是你活了多少日子,而是你记住了多少日子。
(3)碱性锌锰电池: 负极(Zn):Zn-2e-+2OH- =Zn(OH)2 正极(C) 电解质:KOH 优点: 使用寿命长,不易泄漏
(4)应用:卡式录音机、闪光灯、电动玩具、袖珍电视机等
2.充电电池 放电之后能充电
(1)二次电池: 内部的氧化还原反应可逆向进行 电池可以恢复到放电前的状态 能够重复使用至一定的周期
抵达民宿时,太阳已落下了帷幕,温馨点点的灯光在落寞的黑夜中显得无比温暖。
热情周到的女主人迎接我的到来,放下随身物品后,我在小镇上随意寻觅了些小食,就来到了后院安静坐下。
头顶上是浩瀚的星空 眼前是闪烁的灯火
心中却是平和幽静的情感
远离了呼啸而过的地铁呼啸声;远离了川流不息的车流声; 等到了一个此时此刻,用我的五官感受到了一个真正美好寂静的夜晚,属于自己的夜晚。
内电路
3.原电池正负极的判断方法 [设计P40]
2.1 2.2化学能与热能、化学能与电能

化学能与热能、化学能与电能一、一周内容概述本周学习了化学能与电能的转化、太阳能、生物质能和氢能的利用,重点介绍了: 原电池的化学原理、电极反应式的书写、电解原理、能量变化的综合利用等。
二、重难点知识剖析(一)原电池的化学原理1、原电池的本质是将化学能转化为电能原电池的正、负极变化的规律为:负极——电子流出的一极,通常是活泼性较强的金属,电极被氧化,电极上发生氧化反应。
如: Zn-2e-=Zn2+正极——电子流入的一极,通常是活泼性较弱的金属或非金属导体,电极上发生还原反应。
如: 2H++2e -=H2↑原电池中电子从负极流出,流入正极,与电流方向相反。
2、形成原电池的条件两种不同的金属(或一种为能导电的非金属)以导线相连(或直接接触),插入电解质溶液里,形成闭合回路。
(二)原电池中的反应书写原电池有关反应式时,要遵循原子守恒和电荷守恒原理,弱电解质写成化学式,在正极上的电级反应应按阳离子放电顺序(氧化性强的阳离子先还原)写出反应式,现以 Cu— Zn 原电池(右图)为例说明原电池中的反应。
1、电极反应分别在负极和正极进行的氧化和还原反应叫做电极反应。
负极 (-) Zn,Zn-2e-=Zn2+(氧化反应)正极 (+) Cu,2H++2e-=H2↑(还原反应)2、电池反应电极反应的总反应叫做总电池反应式或电池反应式,书写时,将两个电级反应式相加,消去电子,即得原电池的电池反应式。
电池反应式:Zn+2H+=Zn2++H2↑如果把电池中的稀 H2SO4换为醋酸溶液,电池反应式为:Zn+2CH3COOH=(CH3COO)2Zn+H2↑(三)原电池的基本类型1、负极参与反应的原电池这是最基本最早的原电池,例 Cu—Zn 原电池(伏打电池)。
锌锰电池(干电池):锌皮是负极,中间碳棒是正极,石墨周围填充 ZnCl2、NH4Cl 和淀粉糊作电解液,填有 MnO2吸收正极放出的 H2,电池反应式:负极(Zn)Zn-2e-=Zn2+正极(C)2NH4++2e-=2NH3↑+H2↑H2+MnO2=Mn2O3+H2O正极产生的 NH3被 ZnCl2吸收: Zn2++4NH3=[Zn(NH3)4]2+电池反应式:2Zn+4NH4Cl+2MnO2=[Zn(NH3)4]Cl2+ZnCl2+Mn2O3+H2O2、两极都参加反应的原电池可充电池都是两极都参加反应的原电池。
化学必修二2.2 化学能与电能 课件

Cu
有什么现象?
写出有关反应的离子
方程式,用双线桥表示
电子的转移情况。
失2e-
Zn + 2H +=== Zn2+ + H2↑
稀硫酸
得2e-
将Zn片、Cu片上 端连接插入稀硫酸中, 有什么现象?为什么? e ?
猜想:Zn片上的电 子通过上端转移给了Cu 片,Cu片将电子传递给 了H+,如何检验?
稀硫酸
让我们一起来倾听电流的声音
第二章化学反应与能量
第二节 化学能与电能
阅读教材P39 资料卡片
直接从自然界取得的能源称为 一次能源
一次能源经加工、转换得到的能源称为
二次能源
水能
风能
石油
电能
原煤
天然气
蒸汽
一、化学能转化为电能
2001年我国发电总量构成图
火电81.2%
水电17.6%
其他1.2%
火电站的工作原理
化学能
热能
机械能 电能
煤炭
燃烧设备
蒸汽机
发电机
排出温室效应气体(CO2)和废气(SO2),能导致 酸雨;产生废渣、废液;能量转化效率低。
思考:面对这些不足,你能否设计一种装置:
能减少中间环节:
? 直接
化学能
电能
能发生化学反应; 能进行电子转移,形成电流;
------氧化还原反应
将一Zn片、Cu片 分别插入稀硫酸中, Zn
Zn
ee-
Cu
e-
稀硫酸
e-
H+
SO42-
H+ SO42-
H+
H+
Zn
Cu
ee-
2.2化学能与电能
第一课时
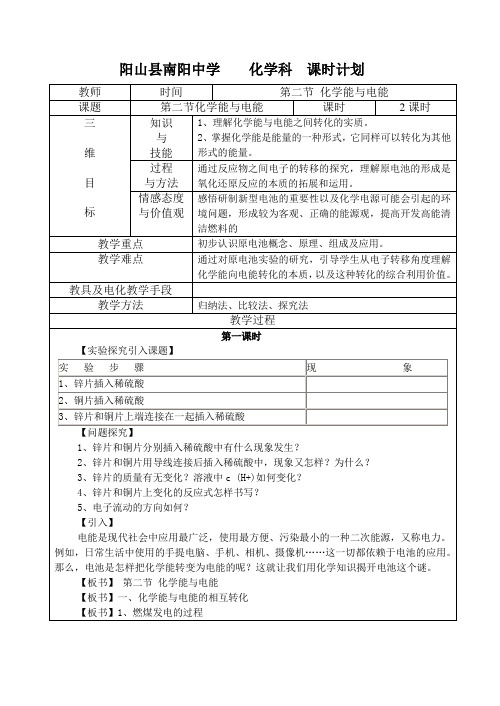
【实验探究引入课题】
实验步骤
现象
1、锌片插入稀硫酸
2、铜片插入稀硫酸
3、锌片和铜片上端连接在一起插入稀硫酸
【问题探究】
1、锌片和铜片分别插入稀硫酸中有什么现象发生?
2、锌片和铜片用导线连接后插入稀硫酸中,现象又怎样?为什么?
3、锌片的质量有无变化?溶液中c (H+)如何变化?
4、锌片和铜片上变化的反应式怎样书写?
【学生探究活动】根据铜锌原电池,填写下表:
电极
电极材料
电极反应
反应类型
得失电子的粒子
电子流动方向
负极
正极
总反应:________________________________________________________
【学生探究练习】动画模拟
引出组成原电池需要的条件
【板书】(3)组成原电池的条件
锌片:Zn - 2e-= Zn2+(氧化反应)
铜片:2H++ 2e-= H2↑(还原反应)
总反应:Zn+2H+= Zn2++ H2↑
【板书】(1)原电池的定义──将化学能转变为电能的装置叫做原电池。
【板书】(2)原电池的电极
负极:发生氧化反应,电子流出(流向正极)的一极。
正极:发生还原反应,电子流入(来自负极)的一极。
5、电子流动的方向如何?
【引入】
电能是现代社会中应用最广泛,使用最方便、污染最小的一种二次能源,又称电力。例如,日常生活中使用的手提电脑、手机、相机、摄像机……这一切都依赖于电池的应用。那么,电池是怎样把化学能转变为电能的呢?这就让我们用化学知识揭开电池这个谜。
【板书】第二节化学能与电能
高中化学必修二课件-2.2化学能与电能11-人教版

Zn
Cu
将一Zn片、Cu
片平行插入稀硫酸
中,有什么现象?
写出有关反应的离
子方程式。
稀硫酸
实验2-4
Zn
Cu 现象
(1)锌片不断溶解 (2)铜片上有气泡产生 (3)电流表指针有偏转
稀硫酸
一、原电池
(1)定义:将化学能直接转变成电能的
装置,称为原电池(电源) 负极 : 电子流出(或电流流进)的一极
阴离子→负极
e-→ e-
↓
e↑ -
_
⊕
这样整个电路构成了闭合回路,带 电粒子的定向移动产生电流
回忆思考:通过以上实验想想原 电池是由哪几部分组成的,构成 原电池的条件又有哪些?
组成:两电极、导线、电解质溶液以及容器
怎样才能构成一个原电池呢?
实验探究:形成原电池的条件
(可以) (不可以)
(可以)
(可以)
病 例 回顾
病例分析
思 ??? 考 你能为她开一个药方吗? :
诊疗方案:拔掉一颗, 换成和另一颗牙相同材 料的假牙!
学案 学以致用5
练习.把a、b、c、d四块金属片浸入稀硫酸中,
用导线两两相连组成原电池。若a、b相连时,a
为负极;c、d相连时,电流由d到c;a、c相连
时,c极上产生大量气泡,b、d相连时,电子由
(不可以
形成条件四:必须具备一)个自发进 行的氧一化还原反应
第四组实验
(3)原电池组成条件
① 两种活泼性不同的金属作电极 (或其中一种为能导电 的非金属,如“碳棒”
) 其中较活泼金属为负极。
较不活泼金属(或非 金 属)为正极 ② 电解质溶液 ③ 形成闭合回路 ④ 能自发地发生氧化还原反应
化学必修二2.2 化学能与电能 课件

Zn
Zn 2+
H+
SO24 -
H+
H2
Cu
一、原电池
1.定义:将化学能直接转变成电能的装置, 称为原电池
2.正负极: 正极: 电子流进(或电流流出)的一极 负极: 电子流出(或电流流进)的一极
3.工作原理:
(铜片在这里起传导电子的作用)
Zn ee-
Zn2+
Cu
锌片:Zn-2e-=Zn2+
(氧化反应)
正极
得电子 还原反应
原电池
过自己喜欢的生活,成为自己喜欢的样子,其实很简单,就是把无数个“今天”过好,这就意味着不辜负不蹉跎时光,以饱满的热情迎接每一件 事,让生命的每一天都有滋有味。 把气愤的心境转化为柔和,把柔和的心境转化为爱,如此,这个世间将更加完美。 君子不以言举人,不以人废言。——《论语·卫灵公》 如果你能够平平安安的渡过一天,那就是一种福气了。多少人在今天已经见不到明天的太阳,多少人在今天已经成了残废,多少人在今天已经 失去了自由,多少人在今天已经家破人亡。 你只管活你自己的,不必去介意别人的扭曲与是非。 上天生下我们,是要把我们当作火炬,不是照亮自己,而是普照世界。——莎士比亚 理想的书籍是智慧的铜匙。 随缘不是得过且过因循苟且,而是尽人事听天命。 立志欲坚不欲锐,成功在久不在速。——张孝祥 往者不可谏,来者犹可追。——《论语·微子》 在经过岁月的磨砺之后,每个人都可能拥有一对闪闪发光的翅膀,在自己的岁月里化茧成蝶。 不敢生气的是懦夫,不去生气的才是智者。
铜片:2H++2e-=H2↑
(还原反应)
总反应:
H+
Zn+2H+=Zn2++H2↑
2.2.2化学能与电能

铅蓄电池:
Pb+PbO2+2H2SO4
放电 充电
2PbSO4+2H2O
银锌电池:Zn+Ag2O+H2O=2Ag+Zn(OH)2
氢氧燃料电池:2H2+O2=2H2O
(负极在电解质溶液中能够输出电子。)
3)两极相连形成闭合回路。
由铝、铁、铜、银和稀硫酸,可以组成产物 明显电流的原电池的总数为 ( C ) A.3种 B.4种 C.5种 D.6种
原电池中电解质溶液的作用是
①参与反应
②导电
1.下列说法中正确的是 ( )
A.原电池是把电能转为化学能的装置
B.原电池中的阳离子向正极移动 C.原电池两级均发生氧化还原反应 D.原电池中电子流出的一极是正极,发生氧 化反应
右下图中,烧杯中盛有水,铁圈 和银圈直接相连接,在接头处用 一根绝绝缘线吊住使之平衡,小 心地向烧杯中央滴入CuSO4溶液, 一段时间后,可观察到的现象 是 ; 银圈表面镀上一层铜, 银圈下降,铁圈上升 发生的电极反应为: 铁圈:负极,电极反应式:Fe–2e-= Fe2+ ;
银圈:正极,电极反应式:Cu2+ + 2e-= Cu。
1780年,伽伐尼(Galvani,L.) 青蛙抽搐实验。
原电池的雏形
理论解释 :生物电观点!
伏打对生物电观点的质疑
(Volta,A.1745-1827)
1800年建立伏打电堆模型。
伏打电池是 实用电池的开端。
水果电池
土豆
西红柿
萝卜
二、发展中的化学电源
1)化学电池有三大类型: 一次性电池 、 二次电池 、 燃料电池 . 2)特点: ①一次电池:不可充电, 如干电池(又称为锌锰电池,是最早使用的化学电池) ②二次电池:可循环利用, 放电过程是将 化学能转化为 电 能; 充电过程是将 电 能转化为 化学能。 ③燃料电池:可不断充入氧化剂、还原剂连续使用, 最理想的燃料是 H2 。 (1)产物为水,无污染 (2)与其它能源比,反应相同质量,放出能量多 (3)来源广
人教版高中化学必修二课件-2.2 化学能与电能25

总结
1.定义:能把化学能转变为电能的装置,叫做 原电池。
2.原理:将氧化还原反应中的电子转移到外电 路中形成电流。
3.形成条件:
(1)两极相连形成闭合电路; (2)有两种活动性不同的金属(或非金属单质)作电极; (3)电极材料均插入电解质溶液中; (4)存在一个自发的氧化还原反应。
• 难忘的一天 • 今天,太阳照着大地,就像闪闪发光的金子一样,到处都是暖洋洋的,我的心里
原电池
化学2 第二章第二节 化学能与电能
原电池
由来
1800年意大利物理学家伏打在前人的研究基础 上建立伏打电池,使得人们开始走向动电时代。
概念
原理
形成 条件
实际 运用
原电池
由来概念原理形 条件 实际 运用原电池
由来 一、定义:能把化学能转变为 电能的装置,叫做原电池。
概念
原理
形成 条件 实际 运用
• 我来到学校的时候已经是7时35分了。进入校门的时候,有一位老师摸了摸我的 头,微笑着说:“跳跳,你真厉害,考了个全班第一!”我腼腆的笑了笑。
• “老师,同学们,早上好!”一个声音从广播里传出来,“现作文在公布全级期 末考试成绩排名前二十名同学的名单……”顿时,大家都安静了下来,心里既紧 张又充满了期待。“第四名,202,王跳跳。第五名……”这时全班同学都尖叫了 起来,纷纷看着我,眼里充满了羡慕。我也开心得差点就跳起来了。
也是暖洋洋的。
• 我早早就起了床,不是因为天气热,也不是因为我想出去玩,而是我们得回学校 了。
• 我来到学校的时候已经是7时35分了。进入校门的时候,有一位老师摸了摸我的 头,微笑着说:“跳跳,你真厉害,考了个全班第一!”我腼腆的笑了笑。
• “老师,同学们,早上好!”一个声音从广播里传出来,“现作文在公布全级期 末考试成绩排名前二十名同学的名单……”顿时,大家都安静了下来,心里既紧 张又充满了期待。“第四名,202,王跳跳。第五名……”这时全班同学都尖叫了 起来,纷纷看着我,眼里充满了羡慕。我也开心得差点就跳起来了。
2.2第1课时:化学能与电能 课件-高中化学必修二

四.原电池——化学能直接转化为电能 1.定义:将化学能转变为电能的装置 按照课本40页实验2-4组装原电池
锌电极 固体溶现象铜电极 冒气泡2.电极判断、电极反应书写
负极:失电子、氧化反应
Zn-2e-=Zn2+
正极:得电子、还原反应
2H++2e-=H2↑
简称:负氧正还
写出总离子反应方程式
3.工作原理
3.观察生活中发电站:电能如何产生? 水利发电 火力发电
风力发电 地热发电
核能发电 人力发电
近年来我国发电总量构成图 观看:课本40页图2-8,火电站工作原理图
火力发电:化学能间接转化为电能
(1)过程:
化学能―燃―烧→热能―蒸―汽→机械能―发―电→机 电能
(2)缺点:
转换环节多、效率低、能源浪费多、环境 污染严重。 思考:采用啥装置可以直接将化学能转化为电能?
铜半电池
锌半电池电极反应: 铜半电池电极反应: 硫酸根的运动方向:
拓展3:盐桥
盐桥的作用: 离子的迁移方向:
练习:下图所示装置能够组成原电池的是
EFH
拓展应用:判断电极、并写出电极反应
总结归纳:原电池正负极的判断
练习: 课本44-43页:1-2题
1.电子运动方向 电子不下“水”
2.离子运动方向 离子不上“岸”
3.电流运动方向
4.电解质溶液变化
原电池工作原理体验
4.原电池构成条件归纳 1.自发的氧化还原反应
2.活性不同的两电极 3.电解质溶液 4.闭合回路
拓展1:判断电极、写电极反应、分析原理
拓展2:半电池
ZnSO4
锌半电池
CuSO4
人教版必修二第2章第2节第1课时
化学能与电能
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节化学能与电能第1课时化学能转化为电能一、能源的分类1.一次能源:直接从自然界取得的能源。
2.二次能源:一次能源经过加工、转换得到的能源。
二、化学能转化为电能1.化学能通过燃烧转化为电能——火电(1)能量转化过程:化学能――→燃烧热能――→蒸汽机械能――→发电机电能(2)能量转化的关键步骤:燃烧(氧化还原反应)是化学能转化为电能的关键。
2.原电池(1)实验探究实验装置实验现象铜片:有气泡逸出锌片:溶解电流表:指针发生偏转结论有电流产生,装置中化学能转化为电能(2)(3)工作原理:锌失去电子,作负极,发生的反应为氧化反应,电子通过导线流向铜片,溶液中的H+在Cu片上得电子生成H2,铜片作正极,发生的反应为还原反应。
(4)反应本质:原电池反应的本质是氧化还原反应。
(5)原电池的构成条件①具有活动性不同的两个电极;②能自发进行的氧化还原反应;③电极间形成闭合回路;④电解质溶液。
(6)原电池的正、负极判断负极正极电极材料活泼性较强的金属活泼性较弱的金属或能导电的非金属电子流动方向电子流出极电子流入极电解质溶液中离子定向移动方向阴离子移向的极阳离子移向的极发生的反应氧化反应还原反应反应现象电极溶解电极增重或有气泡放出知识点一一次能源与二次能源1.能源可分为一次能源和二次能源,自然界以现成形式提供的能源称为一次能源,需依靠其他能源的能量间接制取的能源称为二次能源。
据此判断下列叙述正确的是() A.天然气是二次能源B.石油是二次能源C.电能是一次能源D.水力是一次能源2.下列叙述不正确的是()A.根据一次能源和二次能源的划分标准,氢气为二次能源B.电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源C.火力发电是将燃料中的化学能直接转化为电能的过程D.在火力发电时,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化知识点二原电池的构成3.下列装置能构成原电池的是()4.某原电池工作时总的反应为Zn+Cu2+===Zn2++Cu,该原电池的组成可能是() A.Zn为正极,Cu为负极,CuCl2溶液作电解质溶液B.Cu为正极,Zn为负极,稀H2SO4作电解质溶液C .Cu 为正极,Zn 为负极,CuSO 4溶液作电解质溶液D .Fe 为正极,Zn 为负极,ZnSO 4溶液作电解质溶液 知识点三 原电池的工作原理5.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( ) A .2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑ B .2H 2+O 2=====点燃2H 2OC .Mg 3N 2+6H 2O===3Mg(OH)2+2NH 3↑D .CH 4+2O 2―→CO 2+2H 2O6.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )①两烧杯中铜片表面均无气泡产生 ②甲中铜片是正极,乙中铜片是负极 ③两烧杯中溶液的c (H +)均减小 ④产生气泡的速率甲比乙慢⑤甲中SO 2-4向Zn 片移动,H +向Cu 片移动 ⑥乙中电流从Cu 片流向Zn 片 ⑦甲乙两烧杯中Cu 片的质量均不变 A .①②③B .③⑤⑦C .④⑤⑥D .②③④⑤⑦知识点四 原电池原理的应用7.一学生欲通过实验判断X 、Y 、Z 、W 四块金属的活泼性,做了如下实验并得结论: 当X 、Y 组成原电池时,Y 为负极;当Z 、W 组成原电池时,W 为正极;W 能从含Y 离子的盐溶液中置换出单质Y ,据此可知它们的活泼性顺序是( ) A .Z >W >X >Y B .X >Y >Z >W C .X >Y >W >ZD .Z >W >Y >X8.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌作为负极,则该金属可 能为( ) A .铝B .铜C .锡D .硅练基础落实1.对于原电池的电极名称叙述有错误的是( ) A .发生氧化反应的为负极B.正极为电子流入的一极C.比较不活泼的金属为负极D.电流的方向由正极到负极2.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是() A.Zn+Ag2O+H2O===Zn(OH)2+2AgB.Pb+PbO2+2H2SO4===2PbSO4+2H2OC.Zn+CuSO4===Cu+ZnSO4D.C+CO2=====高温2CO3.茫茫黑夜中,航标灯为航海员指明了方向。
航标灯的电源必须长效、稳定。
我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。
在这种电池中()①铝合金是正极②铝合金是负极③海水是电解液④铝合金电极发生还原反应A.②③B.②④C.①②D.①④4.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是()5.如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是()A.a为负极,是铁片,烧杯中的溶液为硫酸B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液C.a为正极,是碳棒,烧杯中的溶液为硫酸D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液练方法技巧——原电池正、负极及电极反应的判断6.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是()A.Cd(OH)2B.Ni(OH)2C.Cd D.NiO(OH)充电放电7.据报道,美国正在研究用锌电池取代目前广泛使用的铅蓄电池,锌电池具有容量大、污染少等优点,其电池反应为2Zn+O2===2ZnO,其原料为锌粉、电解液和空气。
则下列叙述正确的是()A.锌为正极,空气进入负极B.负极反应为Zn-2e-===Zn2+C.正极发生氧化反应D.电解液是酸溶液题号 1 2 3 4 5 6 7 答案8.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如下图所示。
(1)写出甲池中正极的电极反应式:正极:____________________________________________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:负极:________________________________________________________________。
总反应的离子方程式:______________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论?()A.利用原电池反应判断金属活动顺序时应注意选择合适的介质B.镁的金属性不一定比铝的金属性强C.该实验说明金属活动顺序表已过时,已没有实用价值D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析(5)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种做法________(可靠或不可靠)。
如不可靠,请你提出另一个判断原电池正负极的可行实验方案_________________________________________________________________________________________________________________________________________________________________________________________________________(如可靠,此空可不填)。
第2课时发展中的化学电源一、原电池工作原理的应用1.加快氧化还原反应速率如实验室用Zn和稀H2SO4(或稀HCl)反应制H2,常用粗锌,它产生H2的速率快。
原因是粗锌中的杂质和锌、稀H2SO4形成原电池,加快了反应,使产生H2的速率加快。
2.比较金属的活动性强弱原电池中,一般活动性强的金属为负极,活动性弱的金属为正极。
例如有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生,由原电池原理可知,金属活动性A>B。
3.设计原电池已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂(电解质溶液中的阳离子)在正极上被还原。
例如,利用Cu+2AgNO3===Cu(NO3)2+2Ag的氧化还原反应可设计成如图所示的原电池,该原电池的电极反应式为:负极(Cu):Cu-2e-===Cu2+(氧化反应)正极(C):2Ag++2e-===2Ag (还原反应)4.化学电源人们利用原电池原理,将化学能直接转化为电能,制作了多种电池。
如干电池、蓄电池、充电电池、高能燃料电池等,以满足不同的需要。
在现代生活、生产和科学技术的发展中,电池发挥着重要的作用,大至宇宙火箭、人造卫星、飞机、轮船,小至电脑、电话、电子手表、心脏起搏器等,都离不开各种各样的电池。
二、发展中的化学电源1.干电池普通锌锰干电池电池组成:锌作负极;位于中央的顶盖带有铜帽的石墨棒作正极;电解质是NH4Cl糊。
负极反应为Zn-2e-===Zn2+。
2.充电电池充电电池是一种二次电池。
充电放电可循环进行,至一定周期后终止。
最早也是使用最广泛的是铅蓄电池,负极是Pb,正极是PbO2,电解质是稀硫酸。
封闭式体积小的充电电池——镍镉电池,负极是Cd,正极是NiO(OH),电解质是KOH。
另外还有锂离子电池等。
3.燃料电池燃料电池是一种高效、环境友好的发电装置。
如氢氧燃料电池,在负极上发生氧化反应的是H2,在正极上发生还原反应的是O2,产物是H2O。
燃料电池与干电池的主要区别在于反应物不是储存在电池内部,而是用外加的设备提供燃料和氧化剂等,使反应连续进行。
电池反应:2H2+O2===2H2O(1)电解质溶液为稀硫酸:负极:2H2-4e-===4H+,正极:O2+4e-+4H+===2H2O。
(2)电解质溶液为KOH溶液:负极:2H2-4e-+4OH-===4H2O正极:O2+4e-+2H2O===4OH。
知识点一化学电源电极的判断及电极反应方程式的书写1.如下图,锌锰干电池在放电时总反应方程式可表示为Zn+2MnO2+2NH+4===Zn2++Mn2O3(s)+2NH3↑+H2O。
在此电池放电时,正极(碳棒)上发生反应的物质是()A.Zn B.碳C.MnO2和NH+4D.Zn2+和NH32.人造地球卫星用到一种高能电池——银锌蓄电池,其电池电极反应为Zn+2OH--2e -===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。
