2012年 安徽省高考化学试卷
【精品试卷】高考化学复习安徽高考化学试题解析(复习必备)

高中化学学习材料(灿若寒星**整理制作)2012年安徽高考化学试题解析7. B 【解析】本题以新的储氢方法为背景,综合考查化学反应与能量、化学键、氧化还原反应等知识,同时考查考生对接受、吸收、整合化学信息的能力。
化学反应过程中一定伴随着能量的变化,A项错误;NaHCO3、HCOONa均为离子化合物,含有离子键,在HCO-3、中均含有共价键,B项正确;储氢过程中NaHCO3被还原,C项错误;D项没有说HCOO-明气体所处的状态,错误。
8. A 【解析】本题考查离子的共存问题,同时考查考生应用知识解决实际问题的能力。
C项中Fe+与Cl2不能大量共存,D项中Ag+与NH3·H2O不能大量共存,可排除;A项通入2CO2后不反应,仍能大量共存,正确;B项,因SiO2-3+CO2+H2O===H2SiO3↓+CO 2-3,故通入CO2后SiO2-3不能大量存在。
9. D 【解析】本题主要考查外界条件对化学平衡的影响,同时考查考生应用基础知识解决简单化学问题的能力。
因反应前后气体分子数不等,平衡前容器内压强逐渐变小,A项错误;硫为固体,减少其量不影响化学反应速率,B项错误;升温,平衡左移,SO2的转化率降低,C项错误;只有温度的改变,才能影响反应的平衡常数,故D项正确。
10.C 【解析】本题主要考查常见实验中仪器的选择,同时考查考生对简单实验的设计能力。
A项,在分液漏斗中加入混合物,然后加水振荡,分液即可得到乙酸乙酯和乙醇的水溶液,而要从乙醇水溶液中再分离出乙醇,需进行蒸馏操作,需用到蒸馏烧瓶、冷凝管等玻璃仪器;B项,还需用到酸式滴定管等玻璃仪器;C项用试管、胶头滴管即可实现实验目的;D项,制备、收集NH3用到的玻璃仪器有大试管、酒精灯、导管、集气瓶。
故C项正确。
11.D 【解析】本题考查原电池及电解池工作原理,旨在考查考生对知识的综合应用能力。
断开K2,闭合K1时,装置为电解池,两极均有气泡产生,则反应为2Cl-+2H2O 通电H2↑+2OH-+Cl2↑,石墨为阳极,铜为阴极,因此石墨电极处产生Cl2,在铜电极处产生H2,附近产生OH-,溶液变红,故A、B两项均错误;断开K1、闭合K2时,为原电池反应,铜电极反应为H2-2e-+2OH-===2H2O,为负极,而石墨电极反应为Cl2+2e-===2Cl-,为正极,故C项错误,D项正确。
安徽2012年高考化学试题赏析

安徽2012年高考化学试题赏析安徽高考化学试题题目设计很好,亮点突出,特别是知识的结合方面,结合面比较广但又不偏离教材,有利于考察学生的知识整合能力。
最突出的亮点在设置开放性试题,对教学中重视学生开放性思维能力和知识运用能力的起导向作用。
7、科学家最近研究出一种环保、安全的储氢方法,其原理可表示为: NaHCO 3+H 2 HCOONa+H 2O 下列有关说法正确的是( )A .储氢、释氢过程均无能量变化B .NaHCO 3、HCOONa 均含有离子键和共价键C .储氢过程中,NaHCO 3被氧化D .释氢过程中,每消耗0.1molH 2O 放出2.24L 的H 2分析与赏析:此题命题的背景新颖,属于新背景旧知识的题型。
但新旧之间联系好,是一个难得的好题,考察了化学反应与能量、化学键、氧化还原反应和化学计算的内容。
在考察考生的信息分析和处理能力方面有比较好的作用。
A 项,因为是化学反应,一定伴有能量改变,所以A 说法错误;B 项,NaHCO 3、HCOONa 均为含有共价键的离子化合物,所以B 项正确;C 项NaHCO 3的C 从+4价变成HCOONa 的C 的+3价,是被还原,所以C 项错误。
D 项,从物质的量关系是正确的,但没有指明标准状况,所以2.24L 氢气不一定是0.1mol,所以D 项错。
本题中容易错选D 。
本题C 项,NaHCO 3表现氧化性,也是新知识。
选择B 。
本题如果改为C 项正确,这个题目就更好。
改动如下: A .储氢、释氢过程均无能量变化B .NaHCO 3、HCOONa 均含有离子键和非极性键C .储氢过程中,NaHCO 3表现氧化性D .释氢过程中,每消耗0.1molH 2O 放出2.24L 的H 28.下列离子或分子在溶液中能大量共存,通入CO 2后仍能大量共存的一组是 A .K +、Na +、Cl —、NO 3— B .K +、Na +、Br —、SiO 32—C .H +、Fe 2+、SO 42—、Cl 2D .K +、Ag +、NH 3·H 2O 、NO 3—分析与赏析:考察离子共存问题。
2012年高考真题——理综化学部分(新课标卷)含解析

2012年普通高等学校招生统一考试理科综合能力测试试题可能用到的相对原子质量:H l C l2 N 14 O 16 Mg 24 S 32 C1 35 5 Fe 56 Cu 64 Zn 65 Br 80一、选择题:本大题共13小题.每小题6分。
在每小题给出的四个选顼中,只有一项是符合题目要求的。
7.下列叙述中正确的是A.液溴易挥发,在存放液溴的试剂瓶中应加水封B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+答案:A解析:此题为基础题,B答案在考前多个试题里面都出现过,因为除了氯气外,其它的如臭氧都可以将其氧化得到碘单质。
C答案应该是碘单质,D答案不能排除硫酸根的干扰。
8.下列说法中正确的是A.医用酒精的浓度通常为95%B.单质硅是将太阳能转变为电能的常用材料C.淀粉、纤维素和油脂都属于天然高分子化合物D.合成纤维和光导纤维都是新型无机非金属材料答案:B答案解析:此题为基础题。
A答案应该为75%,C中油脂不为高分子化合物,这个选项也在考前多个试题里出现D答案光导纤维为二氧化硅,合成纤维为有机材料,这个选项多个试题也出现,从前面两个题看来,还是没什么创新,或者考前已经被很多老师抓住题了。
9.用N A表示阿伏加德罗常数的值。
下列叙述中不正确的是A.分子总数为N A的NO2和CO2混合气体中含有的氧原子数为2N AB.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 N AC.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6 N AD.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 N A答案:D解析:此题为基础题,尤其C选项平时学生练习过多次,估计每位参加高考的学生至少做个3-4次。
D选项因为是常温常压下,气体的体积与状态有关系。
2012年高考化学试卷(新课标)(解析)

2012年全国统一高考化学试卷(新课标)参考答案与试题解析一、选择题(每小题6分.在每小题给出的四个选项中,只有一项是符合题目要求的)1.(6分)下列叙述中正确的是()A.液溴易挥发,在存放液溴的试剂瓶中应加水封B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2C.某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I﹣D.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+【考点】PS:物质的检验和鉴别的基本方法选择及应用;PT:物质的检验和鉴别的实验方案设计.【专题】542:化学实验基本操作.【分析】A.实验室保存液溴常用水封的方法;B.能使润湿的淀粉KI试纸变成蓝色的物质具有氧化性;C.CC14层显紫色,证明原溶液中存在I2;D.溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,可能为AgCl或BaSO4.【解答】解:A.液溴易挥发,密度比水大,实验室常用水封的方法保存,故A 正确;B.能使润湿的淀粉KI试纸变成蓝色的物质具有氧化性,可能为NO2、O3、Cl2等物质,但不一定为Cl2,故B错误;C.CC14层显紫色,证明原溶液中存在I2,I﹣无色,故C错误;D.溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,可能为AgCl或BaSO4,不一定含有Ag+,故D错误。
故选:A。
【点评】本题考查物质的保存、检验等知识,题目难度不大,解答该类题目注意把握相关化学基本实验操作.2.(6分)下列说法正确的是()A.医用酒精的浓度通常是95%B.单质硅是将太阳能转化为电能的常用材料C.淀粉、纤维素和油脂都属于天然高分子化合物D.合成纤维和光导纤维都是新型无机非金属材料【考点】FH:硅和二氧化硅;IO:生活中的有机化合物;L1:有机高分子化合物的结构和性质.【专题】55:化学计算.【分析】A、医用酒精的浓度通常是75%,此浓度杀菌消毒作用强;B、单质硅可以制太阳能电池板,是将太阳能转化为电能;C、油脂不是高分子化合物;D、合成纤维是有机非金属材料,光导纤维是新型无机非金属材料;【解答】解:A、医用酒精的浓度通常是75%,此浓度杀菌消毒作用强;故A错误;B、单质硅可以制太阳能电池板,是将太阳能转化为电能;故B正确;C、淀粉、纤维素都属于天然高分子化合物,油脂不是高分子化合物;故C错误;D、合成纤维是有机非金属材料,光导纤维是新型无机非金属材料;故D错误;故选:B。
2012年全国统一高考化学试卷新课标含解析版

2012年全国统一高考化学试卷(新课标)一、选择题(每小题6分.在每小题给出的四个选项中,只有一项是符合题目要求的)1.(6分)下列叙述中正确的是( )A.液溴易挥发,在存放液溴的试剂瓶中应加水封B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2C.某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I﹣D.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+2.(6分)下列说法正确的是( )A.医用酒精的浓度通常是95%B.单质硅是将太阳能转化为电能的常用材料C.淀粉、纤维素和油脂都属于天然高分子化合物D.合成纤维和光导纤维都是新型无机非金属材料3.(6分)用N A表示阿伏加德罗常数的值,下列叙述中不正确的是( )A.分子总数为N A的NO2和CO2混合气体中含有的氧原子数为2N AB.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2N AC.常温常压下,92g 的NO2和N2O4混合气体含有的原子数为6N AD.常温常压下,22.4 L 氯气与足量的镁粉充分反应,转移的电子数为2N A 4.(6分)分子式为C5H12O且可与金属钠反应放出氢气的有机物有(不考虑立体异构)( )A.5种B.6种C.7种D.8种5.(6分)已知温度T时水的离子积常数为K W,该温度下,将浓度为a mol•L﹣1的一元酸HA与b mol•L﹣1一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )A.a=bB.混合溶液的pH=7C.混合溶液中,c(H+)=mol•L﹣1D.混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)6.(6分)分析下表中各项的排布规律,按此规律排布第26项应为( )12345678910C2H4C2H6C2H6O C2H6O2C3H6C3H8C3H8O C3H8O2C4H8C4H10A.C7H16B.C7H14O2C.C8H18D.C8H18O7.(6分)短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子.根据以上叙述,下列说法中正确的是( )A.上述四种元素的原子半径大小为W<X<Y<ZB.W、X、Y、Z原子的核外最外层电子数的总和为20C.W与Y可形成既含极性共价键又含非极性共价键的化合物D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点二、必考题(本题包括26~28三大题,共43分.每个试题考生都必须作答)8.(14分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物.(1)要确定铁的某氯化物FeCl x的化学式,可用离子交换和滴定的方法.实验中称取0.54g FeCl x样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH﹣的阴离子交换柱,使Cl﹣和OH﹣发生交换.交换完成后,流出溶液的OH﹣用0.40mol•L﹣1的盐酸滴定,滴至终点时消耗盐酸25.0mL.计算该样品中氯的物质的量,并求出FeCl x中的x值: (列出计算过程)(2)现有一含有FeCl2和FeCl3的混合物的样品,采用上述方法测得n(Fe)﹕n (Cl)=1﹕2.1,则该样品中FeCl3的物质的量分数为 .在实验室中,FeCl2可用铁粉和 反应制备,FeCl3可用铁粉和 反应制备;(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为 .(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3和KClO在强碱性条件下反应可生成K2FeO4,其反应的离子方程式为 .与MnO2﹣Zn电池类似,K2FeO4﹣Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 .该电池总反应的离子方程式为 .9.(15分)光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用CO与Cl2在活性炭催化下合成。
安徽省化学高考试题 2008-2012
2008年普通高等学校夏季招生考试理科综合能力测试(安徽卷)一、选择题 ( 本大题共 2 题, 共计 12 分)1、(6分)已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是A.c(OH-)>c(HA)>c(HB)>c(H+)B. c(OH-)>c(A-)>c(B-)>c(H+)C. c(OH-)>c(B-)>c(A-)>c(H+)D. c(OH-)>c(HB)>c(HA)>c(H+)2、(6分)已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g),△H=-1025KJ/mol,该反应是一个可逆反应。
若反应物起始物质的量相同,下列关于该反应的示意图不正确的是二、非选择题 ( 本大题共 1 题, 共计 13 分)1、(13分) 取化学式为MZ的黄色粉末状化合物进行如下实验。
将MZ和足量碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水。
按图连接仪器。
实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成。
同时,b瓶的溶液中出现白色浑浊。
待反应完全后,停止加热,仍继续通氮气,直至反应管冷却。
此时,管中的熔融物凝固成银白色金属。
根据以上叙述回答问题:(1)元素Z是:(2)停止加热前是否需要先断开a和b的连接处?为什么?;(3)反应管a中发生的所有反应的化学方程式是;(4)本实验的尾气是否需处理?如需处理,请回答如何处理:如不需处理,请说明理由。
三、选择题 ( 本大题共 2 题, 共计 12 分)1、(6分) 下列各组物质不属于同分异构体的是A.2,2-二甲基丙醇和2-甲基丁醇B.邻氯甲苯和对氯甲苯C.2-甲基丁烷和戊烷D.甲基丙烯酸和甲酸丙酯2、(6分)在溶液中加入中量Na2O2后仍能大量共存的离子组是A.、Ba2+、Cl-、B.K+、、Cl-、C.Ca2+、Mg2+、、D.Na+、Cl-、、四、非选择题 ( 本大题共 1 题, 共计 16 分)1、(16分) 实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。
2012年安徽省高考化学试卷

2012年安徽省高考化学试卷一、选择题1.(3分)(2012•安徽)科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:储氢释氢NaHCO3+H2HCOONa+H2O下列有关说法正确的是()A.储氢、释氢过程均无能量变化B.NaHCO3、HCOONa均含有离子键和共价键C.储氢过程中,NaHCO3被氧化D.释氢过程中,每消耗0.1molH2O放出2.24L的H22.(3分)(2012•安徽)下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是()A.K+、Ca2+、Cl﹣、NO3﹣ B.K+、Na+、Br﹣、SiO32﹣C.H+、Fe2+、SO42﹣、Cl2D.K+、Ag+、NH3•H2O、NO3﹣3.(3分)(2012•安徽)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l)△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是()A.平衡前,随着反应的进行,容器内压强始终不变B.平衡时,其他条件不变,分离出硫,正反应速率加快C.平衡时,其他条件不变,升高温度可提高SO2的转化率D.其他条件不变,使用不同催化剂,该反应平衡常数不变4.(3分)(2012•安徽)仅用下表提供的玻璃容器(非玻璃容器任选)就能实现相应实验目5.(3分)(2012•安徽)某兴趣小组设计如下微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是()A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl﹣Cl2↑+H2↑B.断开K2,闭合K1时,石墨电极附近溶液变红C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e﹣=2Cl﹣D.断开K1,闭合K2时,石墨电极作正极6.(3分)(2012•安徽)氢氟酸是一种弱酸,可用来刻蚀玻璃.已知25℃时:①HF(aq)+OH﹣(aq)═F﹣(aq)+H2O(l)△H=﹣67.7kJ•mol﹣1②H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1在20mL 0.1mol•L﹣1氢氟酸中加入V mL 0.1mol•L﹣1 NaOH溶液.下列有关说法正确的是()A.氢氟酸的电离方程式及热效应可表示为:HF(aq)⇌F﹣(aq)+H+(aq)△H=+10.4 kJ•mol ﹣1B.当V=20时,溶液中:c(OH﹣)=c(HF)+c(H+)C.当V=20时,溶液中:c(F﹣)<c(Na+)=0.1 mol•L﹣1D.当V>0时,溶液中一定存在:c(Na+)>c(F﹣)>c(OH﹣)>c(H+)7.(3分)(2012•安徽)已知室温下,Al(OH)3的K sp或溶解度远大于Fe(OH)3.向浓度均为0.1mol•L﹣1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液.下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是()A.B.C.D.二、非选择题8.(16分)(2012•安徽)X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息位于元素周期表第周期第族,其基态原子最外层有个电子.(2)X的电负性比Y的(填“大”或“小”);X和Y的气态氢化物中,较稳定的是(写化学式)(3)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目:.(4)在X原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称:.氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:.9.(14分)(2012•安徽)PbS是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经下列路线合成:(1)A→B的反应类型是;B的结构简式是.(2)C中含有的官能团名称是;D的名称(系统命名)是.(3)半方酸是马来酸酐的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含﹣O﹣O﹣键.半方酸的结构简式是.(4)由D和B合成PBS的化学方程式是.(5)下列关于A的说法正确的是.a.能使酸性KMnO4溶液或溴的CCl4溶液褪色b.能与Na2CO3反应,但不与HBr反应c.能与新制Cu(OH)2反应d.1molA完全燃烧消耗5molO2.10.(15分)(2012•安徽)亚硫酸盐是一种常见食品添加剂.为检验某食品中亚硫酸盐含量(通常1kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程:(1)气体A的主要成分是,为防止煮沸时发生暴沸,必须先向烧瓶中加入;通入N2的目的是.(2)写出甲方案第①步反应的离子方程式:.(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是.(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果(填“偏高”、“偏低”或“无影响”)(5)若取样品wg,按乙方案测得消耗0.01000mol•L﹣1I2溶液VmL,则1kg样品中含SO2的质量是g(用含w、V的代数式表示).11.(14分)(2012•安徽)工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32﹣(aq)⇌PbCO3(s)+SO42﹣(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.(1)上述反应的平衡常数表达式:K=.(2)室温时,向两份相同的样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在溶液中PbSO4转化率较大,理由是.(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3•Pb(OH)2],它和PbCO3受热都易分解生成PbO.该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,请你完成假设二和假设三:假设一:全部为PbCO3;假设二:;假设三:.(4)为验证假设一是否成立,课题组进行如下研究.由图中信息得出结论:假设一不成立.你是否同意该同学的结论,并简述理由:.2012年安徽省高考化学试卷参考答案与试题解析一、选择题1.(3分)(2012•安徽)科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:储氢释氢NaHCO3+H2HCOONa+H2O下列有关说法正确的是()A.储氢、释氢过程均无能量变化B.NaHCO3、HCOONa均含有离子键和共价键C.储氢过程中,NaHCO3被氧化222.(3分)(2012•安徽)下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是()A.K+、Ca2+、Cl﹣、NO3﹣ B.K+、Na+、Br﹣、SiO32﹣+2+2﹣++﹣3.(3分)(2012•安徽)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l)△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是()A.平衡前,随着反应的进行,容器内压强始终不变B.平衡时,其他条件不变,分离出硫,正反应速率加快C.平衡时,其他条件不变,升高温度可提高SO2的转化率4.(3分)(2012•安徽)仅用下表提供的玻璃容器(非玻璃容器任选)就能实现相应实验目5.(3分)(2012•安徽)某兴趣小组设计如下微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是()A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl﹣Cl2↑+H2↑B.断开K2,闭合K1时,石墨电极附近溶液变红C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e﹣=2Cl﹣Cl6.(3分)(2012•安徽)氢氟酸是一种弱酸,可用来刻蚀玻璃.已知25℃时:①HF(aq)+OH﹣(aq)═F﹣(aq)+H2O(l)△H=﹣67.7kJ•mol﹣1②H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1在20mL 0.1mol•L﹣1氢氟酸中加入V mL 0.1mol•L﹣1 NaOH溶液.下列有关说法正确的是()A.氢氟酸的电离方程式及热效应可表示为:HF(aq)⇌F﹣(aq)+H+(aq)△H=+10.4 kJ•mol ﹣1B.当V=20时,溶液中:c(OH﹣)=c(HF)+c(H+)C.当V=20时,溶液中:c(F﹣)<c(Na+)=0.1 mol•L﹣1+﹣﹣+7.(3分)(2012•安徽)已知室温下,Al(OH)3的K sp或溶解度远大于Fe(OH)3.向浓度均为0.1mol•L﹣1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液.下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是()A.B.C.D.二、非选择题8.(16分)(2012•安徽)X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息位于元素周期表第四周期第VIII族,其基态原子最外层有2个电子.(2)X的电负性比Y的小(填“大”或“小”);X和Y的气态氢化物中,较稳定的是H2O (写化学式)(3)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目:.(4)在X原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称:丙烷.氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:CH3COOH+HCO3﹣=CH3COO﹣+H2O+CO2↑.9.(14分)(2012•安徽)PbS是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经下列路线合成:(1)A→B的反应类型是加成反应;B的结构简式是HOOCCH2CH2COOH.(2)C中含有的官能团名称是碳碳三键、羟基;D的名称(系统命名)是1,4﹣丁二醇.(3)半方酸是马来酸酐的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含﹣O﹣O﹣键.半方酸的结构简式是.(4)由D和B合成PBS的化学方程式是nHOOCCH2CH2COOH+nHOCH2CH2CH2CH2OH png_iVBORw0KGgoAAAANSUhEUgAAANwAAAAOCAYAAABErHKlAAAAAXNSR0IArs4c6QAAAARnQU1BAACxjwv8YQUAAAAJcEhZcwAADsMAAA7DAcdvq GQAAAi+SURBVGhDrVpLcttGECV9gFSyzDJZZhdXsoxkSaTXqfIRvIhEKrfIwmUCukKSA5ifC0TS2ruIlHyYkEi/7umZnsE MAH1eCQWgp2f6Px9Qo9l01IxGclXrbQNY2qxaMQ2w9NH0wlG7cWh2zWQ05j6TeeWogoO7r+pZM9Zx6VpttSV AZL/y7fP5 3LUQiN3qhvbLGbVvV542Gp2RJsS4s7Qg63AIMrfryrdPZlf8Dt/U86mnXyyWzLuYT/gd+kf20XA6JuxjnvGY/Yl3a+Nw++ka0 5Xx/XZ95ftPL2uv86o+93TVj+WRLkwvxJF1hizisTpbP/fliweZ89T4rHduDAvLA/3pHXLXV3NHf9WcXeZtPTR7pjOcm7v9L/ ySx9Ke5jEj0rucayPwwhnqPEU1m3ja3gnzzqSxOCAY2OpGsIkLHJqH5nR0ygqkbQDkjCbn9OQccb9m46v1v/Le3MeyCRw87h Mc0Wqf/sbPh7s1Jc5EHOAAnc5I9ztPC0FYXiFBya690LT41BcoujSp4IuUpmD7TFJrAmhQ++zfH7Yt+7zvnf7yPpV3+lOdF6s7 bl9Xs1aSgCebOA TRKUxoMn5IRPhXxwYQ12p+2soh4GXiI8Cb2sa6gOCSWseHrnlbP7q3GP35F2O3qYt+29+TLi1bdmzLzo3f U3AilB3uElwBJ6PfrP7kKILYRSJwkijhQc6CcfGM4uS5JBXZ8WoG1PMZj2l5LbRdAhKSEzfodDo2NAdNjlbi0BgaUPhlXq/5 mUFDQAdtjyYVlwxqn7YgA VjGUPsxM/O4CJoEDr4/r5ZeZ1sALMjo3FdwGNvr3aczoZUvxCT5svX8ipeKjz5xzmnx+i67ZjYT WyCvZetm0bx17REG+D+F+u1w+M9RCHvXP7WFAN2mhuYL7mPiLMxY9UbW84tJPEMB4N3UtIQXFGMQk85WVglF0T C31YAjIgdnMH/b3S5OcLO/w4HmTl11LeDM1GEpkFipPNgR06Qo2D43WWDEqBgJw+3fMJkLg59oJXZ9h+iMrVZfwSmszg I382tSEaBTvYonJaz8URE6vEh8tIl54Rf3noL4oL/YJXqjq7VV ATpvQXv8nwLFm/MbP7mCsyszdig2/33BQUB6qQPRrrO6VUE SRrYGwIcPH5qjoyO+jo+P+frl+HXzzfir5ueTE34/eiMXeOOEc4EFaFmHfBh8XgqYU6RUkF5PFyR7veIz5VmzPTiZjlmTF/Ro BjPgLQiPI+dJvVSHtn/KE5IWjSBvf8k+9b3qnNt+KZjX6Dp2ZzObhMrPvFHBCex4ab5glcA9V3AvEh8F8aItVwiK1Fa9citcHJ+ 8/wHNZVw//fBd8/W33zcnx28knynX379/z3zQj33B/rX5kRTcnFaw2Fl7v0UA2Glm66iVHSvcNF/uH5qbm5vour75q3k9+rH5+/r a0f7h+8PDQ6u/x+6TNzgNWLRK0GOkm2lS7LGvNgbDNizzmHXueazg6LBaJIE2qGbtM9yyumjRoOe6/p3si7fiFo+135qufYP OoZGfEt5QXGLb3Sae9UsxDQg+gU5pcdl8sXh+fAxccfYVXGQrseZWOGCI/4Hb21u+kLd//nHRvP511txehxz//PmzaM/6pbH QM5zQOs9wsqXcFxVDv0t7nslABfIMHPSQZ1q67QcEhcoDlZ8zM+6qrtiIUvu6knZxwkm8zFOL37LgD4Hlv/wZDvSKzkvAY 7aUxQQhOm/JcEDvs7+6LPoeMofojPF8wjlRSEL9khdhu4l09hMc6QwZKAfOl6U5MxI+zs6aatX+pPjs+HiIT9XuFPVCbPG2+ h3KPio49Pf2kew+/yv0uVS83L5FoYbigu8k/6fNPVOSM5yF/eqETlNaJiXAAt4OJdWcgwh0fMwaZkqAt2hvTUIhACQLssEuC SWf0xUweu7epT3MouiDds/PAS3POj6hHNjZCf98Gj76cMElMzb6qD4aYAQVgWH7TMGw7GlIwGH2uyRTeShCo2O3zjJhpl/ posRhH1EiTkQPq5NPGqMzF5zPDQH6pDkEPDc+KdS3vkjoBtn6DlvT7ePdSs5d6As+3HWy6fd/AHyBvqfzhaMkGGDLk36H4 981MrOuhSayF+h0UFW8SvRgfz/BPZ1xNGiqUzrDFNs1kfhyOkS0UbNcLl3fE+8USeDAo/pwcBxN/YItptI0iHVd8x3+Ql/Low HxhU63PvuB2VR+Syr5Xn5vC+cGHWO1uPD91C9qH5/laCzVF/ZpDlhbbRLl8gUf1ZjmJmWFynn37l0hPrJ1k6svPkEHbIctj+p hf3M8my2YGzroGTP47Ytf/fv8n07IKLg0/xhpruFnpcQWjMsrXCdieQbxSpUCPzDKJQXX2o/nkLD09kj5SUYgZfRzjdaJdmsak kX6ps5+LHRsxpChEp6nSu/ql9pk33UFeKpcC3xpRFJr/FsfdXK+daQ4PotMfMrojxntQDafQlwsElJupFzB5WXm66NQcF3F1F1 oHk4HXX0wy0DR/Ne/fILre8ug9LXXySUEWw7bpZ8pY5Tt7ZO6WrkEAWMnc7f9JfCw6iPznEPpq6sF68tDtG32Y5dFZJvQT 1fQx8PoQatFPj4BWfnu7kHjtM+u/f63u6hWwbl7FkljVHDSVk6wZ4MF5I0LcPKTZvDn+gRal979NklxlPli2R187o4t2TL9N5w U2eay/WV06SNtPZrwCpJN6L6OPUCiLjcyLobKD1fWX+EnrydBxsfq5Ld49twWIfW/+k917Ne1C1JwPPjzBnoWWlF4ri6hf3ei ChCI7u3K4/Sx5xz9kNCpxwvZn5XRb350XvN+GNBvCOwHpxhi49D4XNTy438nHqFzJLfVr+z/Ifp2cRTPcDh9BbQV6BdrEfc v9c3SmTisPyPT2MWvB3tcdqsgfcqOfzRowLYeA+wCMduQ1y1ljd6z4yg6bO3tR9miW1bHa7dguPRDRG6oruFL8Ylg/gvGYsg 22qJLD8C2twtvQCybpvkfJc2t8h8xWccAAAAASUVORK5CYILoj4HkvJjnvZE=+(2n﹣1)H2O.(5)下列关于A的说法正确的是a、c.a.能使酸性KMnO4溶液或溴的CCl4溶液褪色b.能与Na2CO3反应,但不与HBr反应c.能与新制Cu(OH)2反应d.1molA完全燃烧消耗5molO2.+png_iVBORw0KGgoAAAANSUhEUgAAANwAAAAOCAYAAABErHKlAAAAAXNSR0IArs4c6QAAAARnQU1BAACxjwv8YQ10.(15分)(2012•安徽)亚硫酸盐是一种常见食品添加剂.为检验某食品中亚硫酸盐含量(通常1kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程:(1)气体A的主要成分是SO2、N2,为防止煮沸时发生暴沸,必须先向烧瓶中加入碎瓷片;通入N2的目的是将生成的SO2全部赶出(防止SO2在水溶液中被O2氧化).(2)写出甲方案第①步反应的离子方程式:SO2+H2O2=SO4+2H.(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是在碱式滴定管中加入1﹣2mL标准NaOH溶液,将滴定管横过来并转动,让NaOH溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2﹣3次.(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果无影响(填“偏高”、“偏低”或“无影响”)(5)若取样品wg,按乙方案测得消耗0.01000mol•L﹣1I2溶液VmL,则1kg样品中含SO2的质量是g(用含w、V的代数式表示).的质量为=故答案为:.11.(14分)(2012•安徽)工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32﹣(aq)⇌PbCO3(s)+SO42﹣(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.(1)上述反应的平衡常数表达式:K=.(2)室温时,向两份相同的样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在Na2CO3溶液中PbSO4转化率较大,理由是相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32﹣)较大.(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3•Pb(OH)2],它和PbCO3受热都易分解生成PbO.该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,请你完成假设二和假设三:假设一:全部为PbCO3;假设二:全部为2PbCO3•Pb(OH)2;假设三:PbCO3与2PbCO3•Pb(OH)2的混合物.(4)为验证假设一是否成立,课题组进行如下研究.②定量研究:取26.7mg的干燥样品,加热,测的固体质量随温度的变化关系如图.某同学由图中信息得出结论:假设一不成立.你是否同意该同学的结论,并简述理由:同意,若全部为PbCO3,26.7g完全分解后,其固体质量为22.3g.K=故答案为:=。
2012高考化学试题全集
2012国标2012国标07 2012国标08 2012国标09 2012国标10 2012国标11 2012国标12 2012国标13 2012国标26 2012国标27 2012国标28 2012国标36 2012国标37 2012国标38 2012北京2012北京06 2012北京07 2012北京08 2012北京09 2012北京10 2012北京11 2012北京12 2012北京25 2012北京26 2012北京27 2012北京28 2012山东2012山东07 2012山东08 2012山东09 2012山东10 2012山东11 2012山东12 2012山东132012山东282012山东292012山东302012山东312012山东322012山东332012浙江2012浙江072012浙江082012浙江092012浙江102012浙江112012浙江122012浙江132012浙江262012浙江272012浙江282012浙江292012福建2012福建062012福建072012福建082012福建092012福建102012福建112012福建122012福建232012福建242012福建252012福建312012福建322012安徽2012安徽072012安徽082012安徽092012安徽102012安徽112012安徽122012安徽132012安徽252012安徽262012安徽272012安徽282012天津2012天津012012天津022012天津032012天津042012天津052012天津062012天津072012天津082012天津092012天津102012重庆2012重庆062012重庆072012重庆082012重庆092012重庆102012重庆112012重庆122012重庆132012重庆262012重庆272012重庆282012重庆292012四川2012四川062012四川072012四川082012四川092012四川102012四川112012四川122012四川132012四川262012四川272012四川282012四川292012广东2012广东072012广东082012广东092012广东102012广东112012广东122012广东222012广东232012广东302012广东312012广东322012广东332012海南2012海南012012海南022012海南032012海南042012海南052012海南062012海南072012海南082012海南092012海南102012海南112012海南122012海南132012海南142012海南152012海南162012海南172012海南182012海南192012海南202012江苏2012江苏012012江苏022012江苏032012江苏042012江苏052012江苏062012江苏072012江苏082012江苏092012江苏102012江苏112012江苏122012江苏132012江苏142012江苏152012江苏162012江苏172012江苏182012江苏192012江苏202012江苏21【鸣谢整理人员:2012国标(3中赵云)2012北京(6中邱诗文)2012山东(17中崔昕)2012浙江(17中崔昕)2012福建(6中邱诗文)2012安徽(6中邱诗文)2012天津(6中邱诗文)2012重庆(17中崔昕)2012四川(17中崔昕)2012广东(17中崔昕)2012海南(3中赵云)2012江苏(3中赵云)】2012国标2012国标07下列叙述中正确的是A.液溴易挥发,在存放液溴的试剂瓶中应加水封B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+答案:A2012国标08下列说法中正确的是A.医用酒精的浓度通常为95%B.单质硅是将太阳能转化为电能的常用材料C.淀粉、纤维素和油脂都属于天然高分子化合物D.合成纤维和光导纤维都是新型无机非金属材料答案:B2012国标09用N A表示阿伏加德罗常数的值。
2012高考试题—理综化学生物部分(安徽卷)解析版.pdf

第13章 热和能 比热容 海 边 沙 漠 一、比热容: 首先让我们来想一下,在我们生活中烧水的时候,水吸收的热量与水的质量、水温升高的多少有什么关系? 结论:水的质量越大,温度升高的度数越多,吸收的热量越多。
一、比热容: 比较不同物质的吸热能力: 结论:质量相同的不同物质,升高相同的温度,吸收的热量不相等。
一、比热容: 比热容:单位质量的某种物质,温度升高1℃所吸收的热量。
比热容用符号: c 表示,单位:焦/每千克摄氏度,符号:J/(kg ·℃)。
一、比热容: 几种物质的比热容:c/[J·(kg·℃) ] -
1 0.13 ×10 铅 0.9
2 ×10 砂石 0.14 ×10 水银 1.8 ×10 蓖麻油 0.39 ×10 铜 2.1 ×10 冰 0.46 ×10 铁、铜
2.1 ×10 煤油 0.84 ×10 干泥土 2.4 ×10 酒精 0.88 ×10 铝 4.2×10 水 3 3 3 3 3 3 3 3 3 3 3 3 二、热量的计算: 1、例题讲解: 二、热量的计算: 2、习题讲解: 散热器:。
2010-2012年安徽省高考理综化学试题
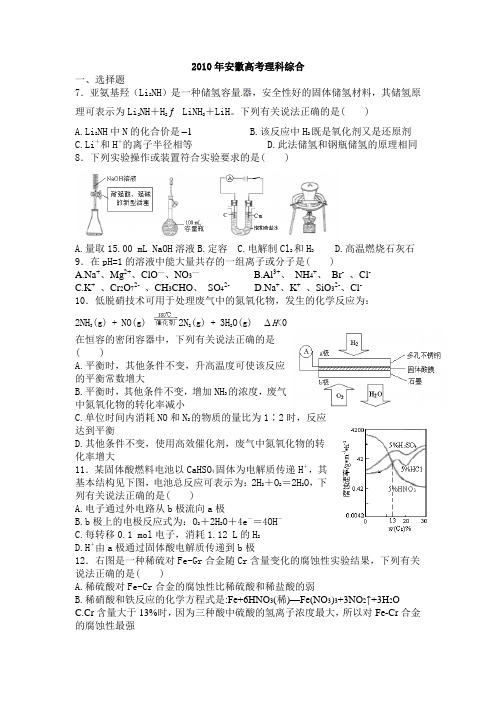
2010年安徽高考理科综合一、选择题7.亚氨基羟(Li 2NH )是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li 2NH +H 2 LiNH 2+LiH 。
下列有关说法正确的是( )A.Li 2NH 中N 的化合价是1-B.该反应中H 2既是氧化剂又是还原剂C.Li +和H +的离子半径相等D.此法储氢和钢瓶储氢的原理相同8.下列实验操作或装置符合实验要求的是( )A.量取15.00 mL NaOH 溶液B.定容C.电解制Cl 2和H 2D.高温燃烧石灰石9.在pH=1的溶液中能大量共存的一组离子或分子是( )A.Na +、Mg 2+、ClO —、NO 3—B.Al 3+、 NH 4+、 Br - 、Cl -C.K + 、Cr 2O 72- 、CH 3CHO 、 SO 42-D.Na +、K + 、SiO 32-、Cl -10.低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH 3(g) + NO(g) 2N 2(g) + 3H 2O(g) ∆H <0在恒容的密闭容器中,下列有关说法正确的是( )A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大B.平衡时,其他条件不变,增加NH 3的浓度,废气中氮氧化物的转化率减小C.单位时间内消耗NO 和N 2的物质的量比为1∶2时,反应达到平衡D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大11.某固体酸燃料电池以CaHSO 4固体为电解质传递H +,其基本结构见下图,电池总反应可表示为:2H 2+O 2=2H 2O ,下列有关说法正确的是( )A.电子通过外电路从b 极流向a 极B.b 极上的电极反应式为:O 2+2H 2O +4e -=4OH -C.每转移0.1 mol 电子,消耗1.12 L 的H 2D.H +由a 极通过固体酸电解质传递到b 极12.右图是一种稀硫对Fe-Gr 合金随Cr 含量变化的腐蚀性实验结果,下列有关说法正确的是( )A.稀硫酸对Fe-Cr 合金的腐蚀性比稀硫酸和稀盐酸的弱B.稀硝酸和铁反应的化学方程式是:Fe+6HNO 3(稀)—Fe(NO 3)3+3NO 2↑+3H 2OC.Cr 含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr 合金的腐蚀性最强D.随着Cr含量增加,稀硫酸对Fe-Cr合金的腐蚀性减弱13.将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计) ( )①Na2O1 ②Na2O ③Na2CO3④NaClA.①>②>③>④B.①>②>④>③C.①=②>③>④D.①=②>③=④二、非选择题25.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:元素相关信息X X的基态原子核外3个能级上有电子,且每个能级上的电子数相等Y 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积Z Z和Y同周期,Z的电负性大于YW W的一种核素的质量数为63,中子数为34(1)Y位于元素周期表第_________周期表_________族,Y和Z的最高价氧化物对应的水化物的酸性较强的是___________________________(写化学式)。
2012年安徽高考理综化学试题

2012年高考理综化学试题解析6.(2012·福建高考·T6)下列说法不正确...的是( )A.易燃试剂与强氧化性试剂分开放置并远离火源B.用湿润的红色石蕊试纸检验氨气C.在50mL量筒中配置0.1000mol·L-1碳酸钠溶液D.金属着火时,用细沙覆盖灭火【解析】强氧化剂都具有较强的得电子能力,遇易燃物品、有机物、还原剂等会发生剧烈化学反应引起燃烧爆炸,故A正确;氨气是碱性气体,使湿润的红色石蕊试纸变蓝,故B正确;量筒是用来量取一定体积溶液的仪器,不能用于配制溶液,配制一定物质的量浓度的溶液要在容量瓶中进行,故C错误;金属钠遇到水或二氧化碳都会发生反应生成O2,所以金属钠着火时,要用细沙覆盖灭火,故D正确。
【答案】C7.(2012·福建高考·T7)下列关于有机物的叙述正确的是A.乙醇不能发生取代反应B.C4H10有三种同分异构体C.氨基酸、淀粉均属于高分子化合物D.乙烯和甲烷可用溴的四氯化碳溶液鉴别【解析】乙醇和乙酸发生酯化反应,酯化反应也属于取代反应,故A错;C4H10只存在两种同分异构体:正丁烷和异丁烷,故B错;氨基酸不属于高分子化合物,故C错;乙烯可以使溴的四氯化碳褪色,而甲烷不能,故D正确。
【答案】D8.(2012·福建高考·T8)短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中T所处的周期序数与族序数相等。
下列判断不正确...的是ArrayA.最简单气态氢化物的热稳定性:R>QB.最高价氧化物对应水化物的酸性:Q<WC.原子半径:T>Q>RD.含T的盐溶液一定显酸性【解析】由这四种元素是短周期元素,且“T所处的周期序数与族序数相等”,可知T是铝元素,则Q是硅、R是氮、W 是硫:。
非金属性N>Si,故最简单气态氢化物的热稳定性R>Q,A正确;非金属性Si<S,故最高价氧化物对应的水化物的酸性Q <W,故B正确;根据同周期和同主族原子半径的递变规律,原子半径T>Q>R,C项正确;偏铝酸钠的水溶液因水解而显碱性,故D错。
2012年安徽高考理综化学选择题详解

B.NaHCO3、HCOONa 均是离子化合物,含离子键; HCO3−、HCOO− 含共价键
C.H2是还原剂 D.温压条件不明 考点:化学反应与能量、化学键、氧化还原反应等
下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是
A. K+、Ca2+、Cl− 、NO3− C. H+、Fe2+、SO42− 、Cl2 B. K+、 Na+、 Br−、SiO32− D. K+、Ag+、NH3· H2O、NO3−
D.当V>0时,溶液中一定存在:c(Na+)>c(F−)>c(OH−)> c(H+)
D.离子浓度取决于V的大小
氢氟酸是一种弱酸,可以用来刻蚀玻璃。已知25℃时: ①HF(aq)+ OH− (aq)= F−(aq)+ H2O(l) ②H+(aq)+OH− (aq)=H2O(l) △H=−67.7kJ ·mol-1 △H=−57.3kJ ·mol-1
在20mL,0.1mol ·L−1氢氟酸中加入VmL,0.1mol ·L−1NaOH溶液。 下列有关说法正确的是
A.氢氟酸的电离方程式及热效应可表示为: △H=+10.4 kJ ·mol-1 HF(aq) F- (aq)+H+ (aq)
B.当V=20时,溶液中:c(OH−)=c(HF)+c(H+) C.当V=20时,溶液中:c(F−)<c(Na+)=0.1mol ·L−1
在20mL,0.1mol ·L−1氢氟酸中加入VmL,0.1mol ·L−1NaOH溶液。 下列有关说法正确的是
A.氢氟酸的电离方程式及热效应可表示为: △H=+10.4 kJ ·mol-1 HF(aq) F- (aq)+H+ (aq)
安徽2012年高考化学试题无偏题怪题 难度适中

安徽2012年高考化学试题无偏题怪题难度适
中
2012年安徽高考化学卷在试卷结构、题型、题量、知识分布等方面保持稳定,无偏题、怪题,试题难度适中。
安徽2012年高考化学试题在情境的创设上多选材于“与化学有关的科技新发现、化学知识在生活中的新应用、贴近学生学习经验的新成果”等。
试题以中学化学核心知识为载体,“坚持能力立意,倡导化学学科积极、正面的教育价值。
”。
如第27题取材于“常见食品添加剂亚硫酸盐在食品中残留量检测”这一既贴近考生认知水平,又具有现实意义的问题创设情境,在引导学生关注食品安全同时,向考生展示运用化学知识解决生活中的实际问题的真实过程。
此外,“设问巧”是今年化学命题的又一显著特点。
第 1 页共 1 页。
安徽省高考化学信息交流(一)试题

安徽省2012届高三高考信息交流(一)理科综合化学能力测试本试卷分第I卷(选择题)和第II卷(非选择题)两部分。
满分300分。
考试时间150分钟。
第I卷选择题(共120分)本卷共20小题,每小题6分,共120分。
在每题给出的四个选项中,只有一项是符合题目要求的。
以下数据可供解题时参考:相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24 S—327.A、B两容器容积固定且相同,相同温度下,分别向处于真空的两容器内充气。
A充入1molO2和1molNO;B中充入2moLH2S气体,下列说法正确的是()A.最终两容器中的气体压强相同B.最终两容器中的气体密度相同C.A中反应时有2N A个电子转移D.最终A中气体物质的量为1.5mol 8.某恒容器中充入1molA和2molB发生反应:A(g)+2B(g) 2C(g)△H<0;下列图像能准确表达其含义的是()9.pH=2的醋酸溶液1L,说法正确的是()A.加入足量的Zn粒,产生标况下112mLH2B.加入NaOH固体后醋酸电离平衡右移,pH减小C.与一定量盐酸混合后pH=1,此时c(CH3COO-)+c(Cl-)+c(OH-)=0.1mol/LD.加入冰醋酸,电离程度增大,p减小10.有下列一整套电化学装置,关于该装置说法正确的是()A.甲池中Mg极为阳极,电极反应式为:Mg-2r-====Mg2+B.甲池中:当Mg减少2.4g时,石墨(C)极上产生标况下2.24L气体C.乙池中将化学能转化为电能D.乙池左侧石墨电极附近变蓝,右侧石墨电极附近变红11.下列事实与其对应的方程式解释均正确的是()A.SO2使酸性KMnO4溶液褪色:5SO2+2MnO4-+2H2O====5SO2-4+2Mn2++4H+B.1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:N2(g)+3H2(g) 3NH3(g)△H=-73kJ/molC.将AlCl3溶液与Na2S混合产生沉淀:2Al3++3S2-===Al2S3↓D.0.05mol/LNaH2PO4溶液pH<1的原因:NaH2PO4=Na++2H++PO3-412.下列实验操作或装置符合实验要求的是()13.某学生将H2O2(具有很弱的弱酸性)滴入含有酚酞氢氧化钠溶液中,观察到溶液的红色消失。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2012年安徽省高考化学试卷
一、选择题
1.(3分)(2012•安徽)科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:
储氢释氢NaHCO3+H2HCOONa+H2O下列有关说法正确的是()
A.储氢、释氢过程均无能量变化
B.NaHCO3、HCOONa均含有离子键和共价键
C.储氢过程中,NaHCO3被氧化
D.释氢过程中,每消耗0.1molH2O放出2.24L的H2
2.(3分)(2012•安徽)下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是()
A.K+、Ca2+、Cl﹣、NO3﹣ B.K+、Na+、Br﹣、SiO32﹣
C.H+、Fe2+、SO42﹣、Cl2D.K+、Ag+、NH3•H2O、NO3﹣
3.(3分)(2012•安徽)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l)△H<0若反应在恒容的密闭容器中进行,下列有关说
法正确的是()
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应平衡常数不变
4.(3分)(2012•安徽)仅用下表提供的玻璃容器(非玻璃容器任选)就能实现相应实验目
5.(3分)(2012•安徽)某兴趣小组设计如下微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是()
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl﹣Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e﹣=2Cl﹣
D.断开K1,闭合K2时,石墨电极作正极
6.(3分)(2012•安徽)氢氟酸是一种弱酸,可用来刻蚀玻璃.已知25℃时:
①HF(aq)+OH﹣(aq)═F﹣(aq)+H2O(l)△H=﹣67.7kJ•mol﹣1
②H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1
在20mL 0.1mol•L﹣1氢氟酸中加入V mL 0.1mol•L﹣1 NaOH溶液.下列有关说法正确的是()
A.氢氟酸的电离方程式及热效应可表示为:HF(aq)⇌F﹣(aq)+H+(aq)△H=+10.4 kJ•mol ﹣1
B.当V=20时,溶液中:c(OH﹣)=c(HF)+c(H+)
C.当V=20时,溶液中:c(F﹣)<c(Na+)=0.1 mol•L﹣1
D.当V>0时,溶液中一定存在:c(Na+)>c(F﹣)>c(OH﹣)>c(H+)
7.(3分)(2012•安徽)已知室温下,Al(OH)3的K sp或溶解度远大于Fe(OH)3.向浓度均为0.1mol•L﹣1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液.下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是()
A.B.
C.D.
二、非选择题
8.(16分)(2012•安徽)X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息
位于元素周期表第周期第族,其基态原子最外层有
个电子.
(2)X的电负性比Y的(填“大”或“小”);X和Y的气态氢化物中,较稳定的是(写化学式)
(3)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目:.(4)在X原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称:.氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:
.
9.(14分)(2012•安徽)PbS是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经下列路线合成:
(1)A→B的反应类型是;B的结构简式是.
(2)C中含有的官能团名称是;D的名称(系统命名)是.(3)半方酸是马来酸酐的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含﹣O﹣O﹣键.半方酸的结构简式是.
(4)由D和B合成PBS的化学方程式是.
(5)下列关于A的说法正确的是.
a.能使酸性KMnO4溶液或溴的CCl4溶液褪色b.能与Na2CO3反应,但不与HBr反应c.能与新制Cu(OH)2反应d.1molA完全燃烧消耗5molO2.
10.(15分)(2012•安徽)亚硫酸盐是一种常见食品添加剂.为检验某食品中亚硫酸盐含量(通常1kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程:
(1)气体A的主要成分是,为防止煮沸时发生暴沸,必须先向烧瓶中加
入;通入N2的目的是.
(2)写出甲方案第①步反应的离子方程式:.
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是.(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果(填“偏高”、“偏低”或“无影响”)
(5)若取样品wg,按乙方案测得消耗0.01000mol•L﹣1I2溶液VmL,则1kg样品中含SO2的质量是g(用含w、V的代数式表示).
11.(14分)(2012•安徽)工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32﹣(aq)⇌PbCO3(s)+SO42﹣(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(1)上述反应的平衡常数表达式:K=.
(2)室温时,向两份相同的样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在溶液中PbSO4转化率较大,理由是.(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3•Pb(OH)2],它和PbCO3受热都易分解生成PbO.该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,请你完成假设二和假设三:
假设一:全部为PbCO3;假设二:;
假设三:.
(4)为验证假设一是否成立,课题组进行如下研究.
由图中信息得出结论:假设一不成立.你是否同意该同学的结论,并简述理由:.。
