基础化学第八版第七章
基础化学第7章缓冲溶液

由此得出:
缓冲溶液具有抗酸性、抗碱性和抗稀释性.。
【例题2】 在0.10mol·L-1NaH2PO4溶液300ml中 加 入0.10 mol·L-1NaOH溶液200ml 和400ml , 求混合溶液的pH值。 解:(1)在NaH2PO4溶液中加入200ml0.10 mol·L-1NaOH溶液后有如下反应, 过量
pH 4.75 lg 0.055 4.75 0.56 5.31 0.015
即缓冲溶液的pH值由原来的5.15升至5.31
(3)加入100ml水后,溶液的pH值:
[HAc] = 0.020 1000 0.018 (mol·L-1) 1100
[NaAc]= 0.0501000 0.045 (mol·L-1) 1100
缓冲比在 1 ~ 10 具有有效缓冲作用
10
1
pH = pKa ±1
pKa + 1~ pKa -1
常用缓冲系的缓冲范围
缓冲系
HCl-KCl
H2C8H4O4- NaOH KHC8H4O4- NaOH
HAc-NaAc
KH2PO4- NaHPO4 H3BO3- NaOH
NaHCO3- Na2CO3
pKa 缓冲范围 1.0~2.2
7.0
指示剂
溴麝香草酚蓝
颜色 绿 绿
绿
加酸 黄 黄
绿
加碱 蓝 蓝
绿
黄 6.0~~绿~~~7.6 蓝
2.定义:
把能够抵抗外来少量强酸、强碱或 稍加稀释而保持pH值基本不变的溶液称 为缓冲溶液。
把溶液能够抵抗外来少量强酸、强 碱或稀释而保持pH值基本不变的作用称 为缓冲作用。
基础生物化学试题(第七章-氨基酸代谢)选择题(含答案)

《基础生物化学》试题第七章氨基酸代谢单选题1.生物体内氨基酸脱氨基的主要方式为:[1分]A氧化脱氨基B转氨基C联合脱氨基D直接脱氨基参考答案:C2.成人体内氨的最主要代谢去路为:[1分]A合成非必需氨基酸B合成必需氨基酸C合成NH4+随尿排出D合成尿素参考答案:D3.转氨酶的辅酶组分含有:[1分]A泛酸B吡哆醛(或吡哆胺)C尼克酸D核黄素参考答案:B4.GPT(ALT)活性最高的组织是:[1分]A心肌B脑C骨骼肌D肝参考答案:D5.嘌呤核苷酸循环脱氨基作用主要在哪些组织中进行?[1分]A肝B肾C脑D肌肉参考答案:D6.嘌呤核苷酸循环中由IMP生成AMP时,氨基来自:[1分]A天冬氨酸的α-氨基B氨基甲酰磷酸C谷氨酸的α-氨基D谷氨酰胺的酰胺基参考答案:A7.在尿素合成过程中,下列哪步反应需要ATP?[1分]A鸟氨酸+氨基甲酰磷酸→瓜氨酸+磷酸B瓜氨酸+天冬氨酸→精氨酸代琥珀酸C 精氨酸代琥珀酸→精氨酸+延胡素酸D精氨酸→鸟氨酸+尿素参考答案:B8.鸟氨酸循环的限速酶是:[1分]A氨基甲酰磷酸合成酶IB鸟氨酸氨基甲酰转移酶C精氨酸代琥珀酸合成酶D精氨酸代琥珀酸裂解酶参考答案:C9.氨中毒的根本原因是:[1分]A肠道吸收氨过量B氨基酸在体内分解代谢增强C肾功能衰竭排出障碍D肝功能损伤,不能合成尿素参考答案:D10.体内转运一碳单位的载体是:[1分]A叶酸B维生素B12C硫胺素D四氢叶酸参考答案:D11.下列哪一种化合物不能由酪氨酸合成?[1分]A甲状腺素B肾上腺素C多巴胺D苯丙氨酸参考答案:D12.下列哪一种氨基酸是生酮兼生糖氨基酸?[1分]A丙氨酸B苯丙氨酸C丝氨酸D羟脯氨酸参考答案:B13.鸟氨酸循环中,合成尿素的第二分子氨来源于:[1分] A游离氨B谷氨酰胺C天冬酰胺D天冬氨酸参考答案:D14.下列中心哪一种物质是体内氨的储存及运输形式?[1分] A谷氨酸B酪氨酸C谷氨酰胺D谷胱甘肽参考答案:C15.转氨酶的辅酶为:[1分]ANAD+BNADP+CFADD磷酸吡哆醛参考答案:D16.氨的主要代谢去路是:[1分]A合成尿素B合成谷氨酰胺C合成丙氨酸D合成核苷酸参考答案:A17.合成尿素的器官是:[1分]A肝脏B肾脏C肌肉D心脏参考答案:A18.有关鸟氨酸循环,下列说法哪一个是错误的:[1分]A循环作用部位是肝脏线粒体B氨基甲酰磷酸合成所需的酶存在于肝脏线粒体C 尿素由精氨酸水解而得D每合成一摩尔尿素需消耗四摩尔ATP参考答案:A19.肾脏中产生的氨主要由下列反应产生:[1分]A胺的氧化B氨基酸嘌呤核苷酸循环脱氨C尿素分解D谷氨酰胺水解参考答案:D20.参与尿素循环的氨基酸是:[1分]A蛋氨酸B鸟氨酸C脯氨酸D丝氨酸参考答案:B21.一碳单位的载体是:[1分]A二氢叶酸B四氢叶酸C生物素D焦磷酸硫胺素参考答案:B22.甲基的直接供体是:[1分]A蛋氨酸BS-腺苷蛋氨酸C半胱氨酸D牛磺素参考答案:B23.在鸟氨酸循环中,尿素由下列哪种物质水解而得:[1分]A鸟氨酸B半胱氨酸C精氨酸D瓜氨酸参考答案:C24.血氨的主要来源:[1分]A氨基酸脱氨基作用B氨基酸在肠道细菌作用下分解产生C尿素在肠道细菌脲酶水解产生D肾小管谷氨酰胺的水解参考答案:A25.体内转运氨的形式有:[1分]A丙氨酸B谷氨酰胺C谷氨酸D谷氨酰胺和丙氨酸参考答案:B26.鸟氨酸循环的主要生理意义是:[1分]A把有毒的氨转变为无毒的尿素B合成非必需氨基酸C产生精氨酸的主要途径D 产生鸟氨酸的主要途径参考答案:A27.尿素循环与三羧酸循环是通过哪些中间产物的代谢联结起来:[1分]A天冬氨酸B草酰乙酸C天冬氨酸与延胡索酸D瓜氨酸参考答案:C28.尿素循环中,能自由通过线粒体膜的物质是:[1分]A氨基甲酰磷酸B鸟氨酸和瓜氨酸C精氨酸和延胡索酸D精氨酸代琥珀酸参考答案:B29.联合氧化脱氨基作用所需的酶有:[1分]A转氨酶和D-氨基酸氧化酶B转氨酶和L-谷氨酸脱氢酶C转氨酶和腺苷酸脱氨酶D腺苷酸脱氨酶和L-谷氨酸脱氢酶参考答案:B30.一碳单位由下列哪项提供:[1分]A色氨酸B甘氨酸C组氨酸D以上都是参考答案:D31.谷草转氨酶含量最高的器官是:[1分]A肝B心C肌肉D肾参考答案:B32.谷丙转氨酶活性最低的组织是:[1分]A肝B心C肌肉D血清参考答案:D33.不能脱下游离氨的氨基酸脱氨基方式是:[1分]A氧化脱氨基B转氨基C联合脱氨基D嘌呤核苷酸循环参考答案:B34.在氨基酸联合脱氨基作用中,作递氨体的物质是[1分]A丙酮B乙酰辅酶AC草酸Dα-酮戊二酸参考答案:D35.脱氨基后能产生草酰乙酸的氨基酸是[1分]A谷氨酸B琥珀酸C天冬酰胺D天冬氨酸参考答案:D36.经氧化脱氨基作用生成α-酮戊二酸的是[1分]A天冬氨酸B苏氨酸C亮氨酸D谷氨酸参考答案:D37.引起肝昏迷的主要原因是[1分]A肠道胺类物质增多B血氨增高使脑中谷氨酸下降C血中酪氨酸增多D血氨增高使肝合成尿素增多参考答案:B38.氨在肝细胞主要合成的物质是[1分]A氨基酸B尿素C谷氨酰氨D嘌呤碱参考答案:B39.下列循环可合成尿素的是()[1分]A鸟氨酸循环B丙氨酸-葡萄糖循环C三羧酸循环Dβ-氧化循环参考答案:A40.生物体内氨基酸脱氨基的主要方式,也是体内合成非必需氨基酸的主要方式为()[1分]A氧化脱氨基B还原脱氨基C转氨基D联合脱氨基参考答案:C41.治疗巨幼红细胞贫血症,最有效的药物组合是()[1分]A叶酸和VB12B叶酸和VB6C叶酸和VCDVB12和VA参考答案:A42.生酮氨基酸降解后的产物,()。
基础化学介绍

《基础化学》课程简介
《基础化学》课是生物医药学部生物、食品、中药三个专业的基础课,理论总学时为70学时。
以专业需求为导向设定教学内容,注重理论的应用,以应用为线索确定教学案例以提高学生的学习兴趣,同时让学生对化学课有一个全面的认知。
该课程的基本内容包括:绪论(4学时)
1.什么是化学
2化学在人类生活中的应用
第一章化学基本概念与基本计算(4学时)
第二章生命中的重要元素及其化合物(6学时)
第三章溶液(6学时)
第四章酸碱溶液pH值的计算和测定(8学时)
第五章重要有机化合物(10学时)
1.有机化合物的概念
2.烃类化合物
3.烃的衍生物
第六章生命中重要的有机化合物(18)
1.糖
2.蛋白质
3.核酸
第七章中药化合物(中药中常见的化合物主要是杂环化合物)。
《基础化学》课后习题参考答案(无机部分)
⑵
-2
⑶
-4
⑺ 1.1×10
1
⑻ 5.0×10-15
+
5.0×10
6.3×10
1.8×10
-5
1.1×10
-11
6.3×10
-8
1.0
[OH ] 2.0×10-13 1.6×10-11 5.5×10-10 8.7×10-4 1.6×10-7 1.0×10-14 8.9×10-16 2.0 3、 [OH-]=1.3×10-3 mol·L-1 α=1.3% 4、HOAc:[H+]=1.9×10-3mol·L-1 α=0.94% HCN:[H+]=9.9× -6 -1 + 10 mol·L α=0.0050% c 相同,Ka 越大,[H ]与 α 越大 5、⑴0.1mol·L-1HCl>HF>H2S>HCN>1.0× 10-5mol·L-1HCl ⑵ HF 最大,HCN 最小 ⑶0.1mol·L-1HCl 6、HOCN:[H+]=3.5×10-3 mol·L-1 HCN: + -6 -1 -5 -1 3 [H ]=7.0×10 mol·L HOCN>HCN 7、1.3×10 mol·L 8、⑴2.0×10 ⑵7.65 9、445mL 10、⑴9.03 ⑵4.97 ⑶7.00 ⑷9.28
2
1 ⑷m = 0 2
5、 n ≥ 3 、 l = 0,1 、 l = 0 、 m = 0 、 m s = ±
2
1 2
2s
n 2 2
m 0 0
ms +1/2 -1/2
2p3
※
2 2 2
1 1 1
0 +1 -1
+1/2 +1/2 +1/2
基础化学第七章课件

2011-5-25
酸和碱互为共轭,并组成共轭酸碱对,彼此之间差一 个H+,所以酸碱共轭统一在同一体系中的H+的传递。 质子理论中的酸碱不局限于分子,也可以是离子。 质子酸可以是:分子(HCl)、正离子(NH4+)、负离子 (HCO3-) 质子碱可以是:分子(NH3)、负离子(Ac-)、正离子 [Fe(H2O)5OH]2+ 有些酸碱物质在不同共轭酸碱对中既可以作酸,又可作 碱,称为两性物质。(HCO3-H2O)
电子教案
扬州工业职业技术学院应用化学系 朱权
1.掌握酸碱的定义、酸碱的强度及其影响因素、酸碱反 .掌握酸碱的定义、酸碱的强度及其影响因素、 应的实质; 应的实质; 2.掌握酸碱平衡中总浓度、平衡浓度及物料平衡的概念 .掌握酸碱平衡中总浓度、 ; 3.掌握 的含义,熟悉 与氢离子浓度的相互换算; 的含义, 与氢离子浓度的相互换算; .掌握pH的含义 熟悉pH与氢离子浓度的相互换算 4.了解溶液pH的近似测定; .了解溶液 的近似测定; 的近似测定 5.能利用化学平衡移动原理分析水、弱酸、弱碱的电离 .能利用化学平衡移动原理分析水、弱酸、 平衡; 平衡; 6.掌握多元弱酸电离的机理; .掌握多元弱酸电离的机理; 7.掌握同离子效应、盐效应等影响电离平衡移动的因素 .掌握同离子效应、 ; 8.熟练掌握有关离子浓度的计算; .熟练掌握有关离子浓度的计算; 9.说明同离子效应和缓冲溶液的特点,并掌握溶液 .说明同离子效应和缓冲溶液的特点,并掌握溶液pH 的计算了解缓冲容量和缓冲范围, 的计算了解缓冲容量和缓冲范围,会根据需要选择配制缓 上一内容 下一内容 回主目录 返回 冲溶液。 冲溶液。 2011-5-25
第三章酸碱平衡 第一节 酸碱理论基础
基础化学重点内容
① 标态下电池电动势的计算
② 非标态下电极电位和原电池电动势的求算:能斯特方程
③
(正确写出氧化还原半反应或总反应、配平、写出该反应对应
的正确能斯特公式)
2021/3/7
CHENLI
11
第九章 原子结构和元素周期律
氢原子的波函数:四个量子数(即原子核外轨道数量与类型) 原子轨道的角度分布和径向分布:电子云图象 多电子原子的原子结构 ① 屏蔽效应、有效核电荷的计算 ②原子电子组态三规则 ③电子组态的写法(第四周期前元素的原子与离子) 4. 元素周期表 ①周期表的划分:周期、族、元素分区、过渡元素和稀土元素 ②变化规律:有效核电荷、原子半径、电离能、电子亲和势、电负性
2.30 (1 3缓 1 冲 ) ( 1 + 比 1/缓 1 冲 ) c总 比
4. 配制缓冲溶液的原则和方法。 5. 血液中的主要缓冲系及在稳定血液pH过程中的作用。
2021/3/7
CHENLI
6
第十二章 滴定分析
1.滴定分析中的基本概念
标准溶液、试样、化学计量点、滴定终点、指示剂、滴定误差 2.滴定分析的计算 3.酸碱指示剂的变色原理、变色点和变色范围 4.酸碱滴定中指示剂的选择原则;(滴定突跃,突跃范围的影响
化型物质、还原型物质、参比电极、指示电极
2. 原电池与电极电位
① 原电池组成式、电池半反应式、常用电极类型
② 电极电位概念、标准氢电极、标准电极电位
3. 电池电动势
① 电动势E与△G的关系
② E与反应平衡常数的关系
③ 利用E判断反应是否自发进行 RTlnKo- =- nFEo =Gom
4. 电极电位的计算
《基础化学》重点内容
2021/3/7
CHENLI
基础化学第七章 化学动力学基础

时,t T1/ 2
1 1 kA t cA cA,0
1 c A, 0 / 2
k AT1/ 2
1 c A, 0
T1/ 2
1 kA cA,0
3、二级反应的特征
1 1 kA t cA cA,0
(1)速率系数的SI单位为 m3 mol1 s 1 常用单位为 L · -1 · -1 mol s (2) 1/cA 对t做图得到一条直线,直线的 斜率为kA,截距为1/cA,0 。 (3)反应的半衰期与速率系数和反应物的起
第七章 化学动力学基础
化学教研室
王斌
第一节
化学反应速率的表示方法
化学反应速率:在一定条件下,反应 物转变为生成物的速率。
A→B
一、以反应物或产物浓度随时间的变化率 定义的反应速率
dc A 1 dnA A = V dt dt
1 dnB dcB B = V dt dt
单位:(mol · -1·-1) L s
二、质量作用定律
(一)质量作用定律
质量作用定律: 在一定温度下,元反应 的反应速率与各反应物浓度幂之积成正比。
例如:元反应 2NO2 → 2NO + O2
υ= kc2(NO2 )
NO2 + CO → NO + CO2
υ= kc (NO2 )c(CO)
υ= kp (NO2 )p(CO)
对于任何一个元反应:
(二)有效碰撞
1、定义:能够发生化学反应的碰撞称为有效碰撞。 2、发生有效碰撞必须具备两个条件:
(1)参加反应物分子或离子必须具有足够的能 量。
(2)碰撞时要有合适的方向。
← 有效碰撞
无效碰撞 →
(三)活化分子和活化能 1、活化分子
南方医科大学药学院基础化学第七章化学动力学8-01
26
aA+ dD gG +hH
反应速率可写作:
vA
dnA Vdt
dcA dt
vG
dnG Vdt
dcG dt
它们之间有如下的关系:
vA vD vG vH v ad g h
vD
dnD Vdt
dcD dt
vH
dnH Vdt
dcH dt
3
二、反应速率的表示方法二
反应速率可用单位时间、单位体积内反应进度的
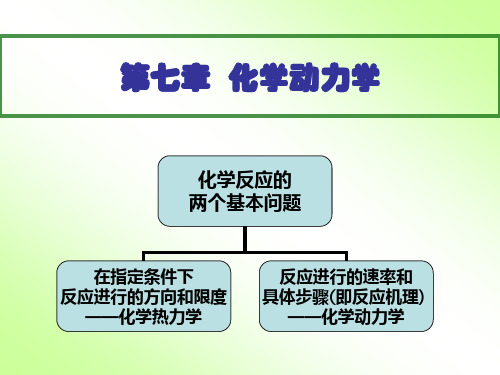
第七章 化学动力学
化学反应的 两个基本问题
在指定条件下 反应进行的方向和限度
——化学热力学
反应进行的速率和 具体步骤(即反应机理)
——化学动力学
第一节 反应速率的表示方法
一、以产物或反应物浓度随时间的变化定义反应速率 二、以反应进度随时间的变化定义反应速率 三、化学反应的平均速率与瞬时速率
一、反应速率的表示方法一
反应的总级数: n=+++……
17
四、 简单级数反应的速率方程
1、一级反应 2、 二级反应 3、 零级反应
一. 一级反应
反应速率只与物质浓度的一次方成正比的反应称为一级反
应(first order reaction) 。对一级反应
A
G
t = 0 cA,0
0
t = t cA=cA,0-x cG
微分速率方程为:
解:(1)∵氯乙烷的分解为一级反应,则
lg c0 kt
c 2.303
kt
2.5 103 24 60
lg c lg c0 2.303 lg 0.200
有机化学基础目录

第五节 烯烃的来源和制法
环烷烃
第六节 环烷烃 分类、命名和异构现象
第七节 环烷烃的性质
第八节 环张力
第九节 环烷烃的构象
习题
第五章 炔烃和二烯烃
炔烃
第一节 炔烃的结构、异构现象和命名
第二节 炔烃的物理性质
第三节 炔烃的质
第六节 共轭二烯经的反应
第七节 丁二烯的结构和共轭效应
第八节 1,2-加成和1,4-加成 速度和平衡
第六章 芳香烃和苯
第七章 卤代烃
第八章 醇、酚、醚
第九章 醛、酮、醌
第十章 羧酸及其衍生物
第十一章 含氮化合物
第十二章 测定有机化合物结构的物理方法
第十三章 周环反应
第十四章 杂环化合物
第十五章 碳水化合物
第十六章 氨基酸、蛋白质和核酸
第一章 绪论
第一节 有机化学和有机化合物
第二节 有机化合物的结构
第三节 化学键
第四节 有机化合物的分类
第二章 烷烃
第一节 烷烃的同系列、同分异构和命名
第二节 烷烃的构象
第三节 烷烃的物理性质
第四节 烷烃的反应
第五节 烷烃的来源和制备
第三章 立体化学
第一节 平面偏振光与物质的旋光性
第二节 对映异构现象与分子结构的关系
第三节 含一个手性碳原子的化合物、对映体和外消旋体
第四节 构型的表达式和命名
第五节 含两个以上手性碳原子的化合物
第六节 环状化合物的立体异构
第七节 其他手性分了
第八节 外消旋体的拆公和外消旋化
第九节 不对称合成
第四章 烯烃和环烷烃
烯烃
第一节 烯烃的结构和异构现象
第二节 烯烃的命名
全套人教版高中化学教材目录

全套人教版高中化学教材目录第一册:化学基础- 第一章:化学与生活- 第二章:物质的组成与结构- 第三章:化学反应与能量变化- 第四章:电解质溶液的电离与电解- 第五章:氧化还原反应- 第六章:金属及其化合物- 第七章:非金属元素及其化合物- 第八章:碳与碳化合物- 第九章:化学反应速率与化学平衡- 第十章:物质的酸碱性- 第十一章:盐与金属的腐蚀与防护第二册:化学反应与能量- 第一章:化学反应热- 第二章:化学反应速率- 第三章:化学平衡- 第四章:酸碱中的化学反应- 第五章:氧化还原反应- 第六章:电化学第三册:物质的结构与性质- 第一章:物质的结构- 第二章:材料中的能量转化- 第三章:离子在溶液中的行为- 第四章:金属及其化合物- 第五章:非金属元素及其化合物- 第六章:碳与碳化合物- 第七章:高分子材料- 第八章:化学分析与检验第四册:化学变化与化学计量- 第一章:化学反应的基本概念- 第二章:化学方程式与化学计量- 第三章:气体反应与化学计量- 第四章:电解质溶液的化学计量- 第五章:化学反应中的能量变化- 第六章:化学反应速率与化学平衡- 第七章:物质的酸碱性- 第八章:化学分析与检验第五册:物质的变化与运动- 第一章:物质的内部结构- 第二章:物质的变化- 第三章:物体的运动和力- 第四章:物质的状态和状态变化- 第五章:物质的传递和转化第六册:化学的前沿与应用- 第一章:化学的发展与应用- 第二章:化学与能源- 第三章:化学与材料- 第四章:化学与环境- 第五章:化学与健康- 第六章:化学与生活- 第七章:化学与安全以上是全套人教版高中化学教材的目录,共分为六册,涵盖了化学的基础知识、反应与能量、物质的结构与性质、化学变化与化学计量、物质的变化与运动,以及化学的前沿与应用等内容。
这些教材以简洁的语言和直观的示意图展示了化学的重要概念和原理,旨在帮助学生建立起对化学的基本认识和理解。
基础生物化学试题(第七章-氨基酸代谢)选择题(含答案)

《基础生物化学》试题第七章氨基酸代谢单选题1.生物体内氨基酸脱氨基的主要方式为:[1分]A氧化脱氨基B转氨基C联合脱氨基D直接脱氨基参考答案:C2.成人体内氨的最主要代谢去路为:[1分]A合成非必需氨基酸B合成必需氨基酸C合成NH4+随尿排出D合成尿素参考答案:D3.转氨酶的辅酶组分含有:[1分]A泛酸B吡哆醛(或吡哆胺)C尼克酸D核黄素参考答案:B4.GPT(ALT)活性最高的组织是:[1分]A心肌B脑C骨骼肌D肝参考答案:D5.嘌呤核苷酸循环脱氨基作用主要在哪些组织中进行?[1分]A肝B肾C脑D肌肉参考答案:D6.嘌呤核苷酸循环中由IMP生成AMP时,氨基来自:[1分]A天冬氨酸的α-氨基B氨基甲酰磷酸C谷氨酸的α-氨基D谷氨酰胺的酰胺基参考答案:A7.在尿素合成过程中,下列哪步反应需要ATP?[1分]A鸟氨酸+氨基甲酰磷酸→瓜氨酸+磷酸B瓜氨酸+天冬氨酸→精氨酸代琥珀酸C 精氨酸代琥珀酸→精氨酸+延胡素酸D精氨酸→鸟氨酸+尿素参考答案:B8.鸟氨酸循环的限速酶是:[1分]A氨基甲酰磷酸合成酶IB鸟氨酸氨基甲酰转移酶C精氨酸代琥珀酸合成酶D精氨酸代琥珀酸裂解酶参考答案:C9.氨中毒的根本原因是:[1分]A肠道吸收氨过量B氨基酸在体内分解代谢增强C肾功能衰竭排出障碍D肝功能损伤,不能合成尿素参考答案:D10.体内转运一碳单位的载体是:[1分]A叶酸B维生素B12C硫胺素D四氢叶酸参考答案:D11.下列哪一种化合物不能由酪氨酸合成?[1分]A甲状腺素B肾上腺素C多巴胺D苯丙氨酸参考答案:D12.下列哪一种氨基酸是生酮兼生糖氨基酸?[1分]A丙氨酸B苯丙氨酸C丝氨酸D羟脯氨酸参考答案:B13.鸟氨酸循环中,合成尿素的第二分子氨来源于:[1分]A游离氨B谷氨酰胺C天冬酰胺D天冬氨酸参考答案:D14.下列中心哪一种物质是体内氨的储存及运输形式?[1分]A谷氨酸B酪氨酸C谷氨酰胺D谷胱甘肽参考答案:C15.转氨酶的辅酶为:[1分]ANAD+BNADP+CFADD磷酸吡哆醛参考答案:D16.氨的主要代谢去路是:[1分]A合成尿素B合成谷氨酰胺C合成丙氨酸D合成核苷酸参考答案:A17.合成尿素的器官是:[1分]A肝脏B肾脏C肌肉D心脏参考答案:A18.有关鸟氨酸循环,下列说法哪一个是错误的:[1分]A循环作用部位是肝脏线粒体B氨基甲酰磷酸合成所需的酶存在于肝脏线粒体C 尿素由精氨酸水解而得D每合成一摩尔尿素需消耗四摩尔ATP参考答案:A19.肾脏中产生的氨主要由下列反应产生:[1分]A胺的氧化B氨基酸嘌呤核苷酸循环脱氨C尿素分解D谷氨酰胺水解参考答案:D20.参与尿素循环的氨基酸是:[1分]A蛋氨酸B鸟氨酸C脯氨酸D丝氨酸参考答案:B21.一碳单位的载体是:[1分]A二氢叶酸B四氢叶酸C生物素D焦磷酸硫胺素参考答案:B22.甲基的直接供体是:[1分]A蛋氨酸BS-腺苷蛋氨酸C半胱氨酸D牛磺素参考答案:B23.在鸟氨酸循环中,尿素由下列哪种物质水解而得:[1分]A鸟氨酸B半胱氨酸C精氨酸D瓜氨酸参考答案:C24.血氨的主要来源:[1分]A氨基酸脱氨基作用B氨基酸在肠道细菌作用下分解产生C尿素在肠道细菌脲酶水解产生D肾小管谷氨酰胺的水解参考答案:A25.体内转运氨的形式有:[1分]A丙氨酸B谷氨酰胺C谷氨酸D谷氨酰胺和丙氨酸参考答案:B26.鸟氨酸循环的主要生理意义是:[1分]A把有毒的氨转变为无毒的尿素B合成非必需氨基酸C产生精氨酸的主要途径D 产生鸟氨酸的主要途径参考答案:A27.尿素循环与三羧酸循环是通过哪些中间产物的代谢联结起来:[1分]A天冬氨酸B草酰乙酸C天冬氨酸与延胡索酸D瓜氨酸参考答案:C28.尿素循环中,能自由通过线粒体膜的物质是:[1分]A氨基甲酰磷酸B鸟氨酸和瓜氨酸C精氨酸和延胡索酸D精氨酸代琥珀酸参考答案:B29.联合氧化脱氨基作用所需的酶有:[1分]A转氨酶和D-氨基酸氧化酶B转氨酶和L-谷氨酸脱氢酶C转氨酶和腺苷酸脱氨酶D腺苷酸脱氨酶和L-谷氨酸脱氢酶参考答案:B30.一碳单位由下列哪项提供:[1分]A色氨酸B甘氨酸C组氨酸D以上都是参考答案:D31.谷草转氨酶含量最高的器官是:[1分]A肝B心C肌肉D肾参考答案:B32.谷丙转氨酶活性最低的组织是:[1分]A肝B心C肌肉D血清参考答案:D33.不能脱下游离氨的氨基酸脱氨基方式是:[1分]A氧化脱氨基B转氨基C联合脱氨基D嘌呤核苷酸循环参考答案:B34.在氨基酸联合脱氨基作用中,作递氨体的物质是[1分]A丙酮B乙酰辅酶AC草酸Dα-酮戊二酸参考答案:D35.脱氨基后能产生草酰乙酸的氨基酸是[1分]A谷氨酸B琥珀酸C天冬酰胺D天冬氨酸参考答案:D36.经氧化脱氨基作用生成α-酮戊二酸的是[1分]A天冬氨酸B苏氨酸C亮氨酸D谷氨酸参考答案:D37.引起肝昏迷的主要原因是[1分]A肠道胺类物质增多B血氨增高使脑中谷氨酸下降C血中酪氨酸增多D血氨增高使肝合成尿素增多参考答案:B38.氨在肝细胞主要合成的物质是[1分]A氨基酸B尿素C谷氨酰氨D嘌呤碱参考答案:B39.下列循环可合成尿素的是()[1分]A鸟氨酸循环B丙氨酸-葡萄糖循环C三羧酸循环Dβ-氧化循环参考答案:A40.生物体内氨基酸脱氨基的主要方式,也是体内合成非必需氨基酸的主要方式为()[1分]A氧化脱氨基B还原脱氨基C转氨基D联合脱氨基参考答案:C41.治疗巨幼红细胞贫血症,最有效的药物组合是()[1分]A叶酸和VB12B叶酸和VB6C叶酸和VCDVB12和VA参考答案:A42.生酮氨基酸降解后的产物,()。
大学基础化学课件--工科-07化学反应速率与化学平衡

7.2.2 过渡态理论(活化配合物理论)
化学反应不是通过反应物分子间的 简单碰撞就能完成,而是在碰撞后 要经过一个由反应物分子以一定的 构型而存在的中间过渡状态(活化配合物)
O3(g) NO(g) NO 2 (g) O2 (g)
NO+O3
O ON O O
NO2+O2
E 活化络合物
Ea逆
以气体分子运动论为基础 主要用于气相双分子反应
O3(g) NO(g) NO 2 (g) O2 (g)
有效碰撞:能发生反应的碰撞 临界能(或阈能):分子发生有效碰撞
必须具备的能量 活化分子:能发生有效碰撞的分子
或:具有等于或大于临界能的分子
活化能(Ea):活化分子的平均能量E *与反
(activated energy) 应物分子的平均能量E 之差
Ea E * E
注:大多数反应的活化能在60~250kJ·mol-1之间
E 活化分子
Ea,逆
Ea正
E生成物
E 活化分子
Ea正 Ea逆
E反应物
E反应物
E生成物
(1) r Hm E(生成物) E(反应物) Ea正 Ea逆 (2) 可逆反应中,吸热反应的活化
能总是大于放热反应的活化能
ÊÔ Ñé ±à ºÅ
1 2 3 4 5
cH2 /(mol L1) 0.0060 0.0060 0.0060 0.0030 0.0015
cNO/(mol L-1)
0.0010 0.0020 0.0040 0.0040 0.0040
/(mol L1 s1) 7.9 107
单位:mol·L-1 a、c分别称为反应对反应物A和C的级数
2023人教版新教材化学八年级下册目录

2023人教版新教材化学八年级下册目录第一章:化学基础知识1.1 元素和化合物1.2 化学式和化学方程式1.3 元素周期表和元素周期1.4 元素的性质和用途第二章:物质的组成与分类2.1 物质的组成和性质2.2 三态物质的分类和转化2.3 溶液的制备和性质2.4 分离混合物的方法和原理第三章:酸、碱和盐3.1 酸的定义和性质3.2 碱的定义和性质3.3 酸碱反应和盐的形成3.4 盐类的命名与应用第四章:化学反应与能量转化4.1 化学反应的基本概念4.2 化学反应中的能量变化4.3 燃烧反应与氧化还原反应4.4 化学能的转化和利用第五章:金属与非金属5.1 金属与非金属的基本性质5.2 金属的提取与应用5.3 非金属的性质和用途5.4 金属与非金属的比较与分析第六章:酸碱中和与盐类制备6.1 酸碱中和反应的原理和条件6.2 酸碱滴定和指示剂的应用6.3 不同酸碱的中和计算和实验6.4 盐类的制备和性质测定第七章:电活性和电化学7.1 金属的电活性与电化学原理7.2 电解和电解质溶液7.3 电化学电池的构成和工作原理7.4 电化学电池的应用和维护第八章:碳与碳化合物8.1 碳的构成和性质8.2 碳的同素异形体和同位素8.3 碳的衍生物和碳化合物8.4 有机化合物的命名和分类第九章:宇宙中的化学元素9.1 星际物质中的元素与化合物9.2 恒星的能量来源和生成新元素9.3 地外生命和化学元素的探索9.4 化学元素在宇宙中的作用和意义以上是2023年人教版新教材化学八年级下册的目录。
本册主要涵盖了化学基础知识、物质的组成与分类、酸、碱和盐、化学反应与能量转化、金属与非金属、酸碱中和与盐类制备、电活性和电化学、碳与碳化合物以及宇宙中的化学元素等内容。
通过学习这些知识,能够更好地了解化学的基本概念和原理,并掌握化学在日常生活和科学研究中的应用。
基础化学中课本单词总结

基础化学中课本单词总结第一章绪论matter 实物field 场snbstance 物质SI 国际单位制significant figure 有效数字scientific notation 科学计数法dispersed medium 分散系dispersed phase 分散相dispersed medium 分散介质homogeneous dispersed system 均相分散系heterogeneous dispersed system 非均相分散系phase 相amount of substance 物质的量mole 摩尔Avogadro constant 基本单元mass 质量Avogadro constant 阿伏伽德罗常数molar mass 质量amount-of-subtance concentration (物质的量)浓度mass concentration 质量浓度mole fraction 摩尔分数molality 质量摩尔浓度solution 溶液element 元素compound 化合物cation 阳离子anion 阴离子negative ion 阴离子molecule 分子atom 原子electronic 电子property 性质inorganic 无机的componential 成份exact number 有效数字aqueous solution 水溶液instrument 仪器composition 组成mixture 混合物entity 实体第二章稀薄溶液的依数性colligative properties of dilute solution 稀薄溶液的依数性evaporation 蒸发condensation 凝结(saturated) vapor pressure (饱和)蒸气压Sublimation 升华Vapor pressure lowering 蒸气压下降Boiling pint depression 沸点升高diffuse 扩散semi-permeable membrance 半透膜osmosis 渗透作用osmosis pressure 渗透压力osmolarity 渗透浓度isotonic solution 等渗溶液hypertonic solution 高渗溶液hypotonic solution 低渗溶液solute 溶质solvent 溶剂nonvolatile 难挥发的hemoglobin 血红蛋白conductivity 导电性fluid 流体第三章电解质溶液Electrolyte 电解质degree of dissociation 解离度ion interaction theory 离子相互作用理论ion atmosphere 离子氛activity 活度activity coefficient 活度因子ionic strength 离子强度acid-base equilibria 酸碱平衡acid dissociation constant 酸解离常数base dissociation constant 碱解离常数dilution law 稀释定律common-ion effect 同离子效应salt effect 盐效应Bronsted-lowry theory 酸碱质子理论half reaction of acid-base 酸碱半反应conjugate acid 共轭酸conjugate base 共轭碱amphoteric substance 两性物质proton-transfer reactions质子传递反应proton self-transfer reaction 质子自递反应ion-product constant for water水的离子积polyprotic acids 多元酸1polyacid bases多元碱electron theory of acid and base酸碱的电子理论solubility equilibrium 溶解平衡(precipitation equilibrium 沉淀平衡)solubility product costant 溶度积常数solubility 溶解度ion product 离子积fractional precipitate 分级沉淀polar 极性soluble 可溶的equilibrium constant 平衡常数proton 质子dissociate 解离equilibrium shift 平衡移动mass or material balance 物料守恒charge balance 电子守恒proton balance 质子守恒precise 准确的side-reaction 副反应第四章缓冲溶液Buffer solution 缓冲溶液Buffer action 缓冲作用Buffer system 缓冲系(buffer pair 缓冲对)Buffer-component ratio 缓冲比Buffer capacity 缓冲容量Buffer effective range 有效缓冲范围Plasma 血浆Ctotal 总浓度Dilution 稀释PBS 磷酸根的缓冲系(指磷酸二氢根和磷酸一氢根)第五章胶体colloid 胶体sol 溶胶macromolecular solution 高分子溶液associated colloid 缔合胶体degree of dispersion 分散度specific surface area 比表面surface energy 表面能Brownian movement 布朗运动diffusion 扩散sedimentation 沉降sedimentation equilibrium 沉降平衡electrophoresis 电泳electroosmosis 电渗diffused electric double layer 扩散双电层coagulation 聚沉polyelectrolyte 聚电解质isoelectric point 等电点salting out 盐析Donnan equilibrium 膜平衡(Donnan 平衡)surface active substance 表面活性物质surface tension 表面张力hydrophilic 亲水性hydrophobic 疏水性micelle 胶束critical micelle concentration CMC 临界胶束浓度emulsion 乳状胶emulsifying agent 乳化剂dispersion phase 分散相dispersion medium 分散介质radium 半径diameter 直径particle 粒子filtered 过滤scatter light 散色光(丁达尔效应)suspensions 悬浊液settle out 沉淀dialysis 透析optical 光学的第六章化学反应热及反应的方向的限度thermodynamics 热力学system 系统surrounding 环境opening system 开放系统closed system 封闭系统isolated system 隔离系统state 状态state function 状态函数extensive property 广度性质intensive property 强度性质process 过程isothermal process 等温过程isobar process 等压过程isovolumic process 等容过程adiabatic process 绝热过程cyclic process 循环过程heat 热2work 功volume work 体积功reversible process 可逆过程irreversible process 不可逆过程thermodynamic number 热力学能(internal energy内能)the first low of thermodynamic 热力学第一定律enthalpy 焓stoichiometric number 化学计量数reactant 反应物product 产物extent of reaction 反应进度thermochemical equation 热化学方程式reaction 反应standard state 标准态aqueous solution 水溶液graphite 石墨diamond 金刚石standard molar enthalpy of formation 标准摩尔生成焓standard molar enthalpy of combustion 标准摩尔燃烧热spontaneous process 自发过程entropy 熵the third law of thermodynamics 热力学的三定律conventional entropy 规定熵standard molar entropy 标准摩尔熵principle of entropy increase 熵增加原理Gibbs free energy Gibbs 自由能standard molar Gibbs free energy of formation 标准摩尔生成Gibbs自由能standard equilibrium constant 标准平衡常数experimental equilibrium constant 实验平衡常数species 物种multiple equilibrium 多重平衡coupling reaction 耦合反应shift of chemical equilibrium 化学平衡移动第七章化学反应速率chemical kinetics 化学动力学rate of chemical reaction 化学反应速率average rate 平均速率instantaneous rate 瞬时速率reaction mechanism 反应机制elementary reaction 元反应complex reaction 复杂反应ratedetermining step 速率控制步骤molecularity of reaction 反应分子数law of mass action 质量作用定律rate law(rate equation) 速率方程rate constant 速率常数reaction order 反应级数first-order reaction 一级反应half-life 半衰期pseudo-first-order reaction 准一级反应second-order reaction 二级反应zero-order reaction 零级反应collision theory 碰撞理论effective collision 有效反应elastic collision 弹性形状activated molecule 活化分子activated energy 活化能transition state theory 过渡态理论activated complex 活化络合物energy barrier 能垒catalyst 催化剂catalysis 催化效应homogeneous catalysis 均相催化heterogeneous catalysis 多相催化active site 活性点enzyme 酶substrate 底物第八章氧化还原反应与电极电位oxidation-reduction reaction 氧化反应oxidation number 氧化值(氧化值)apparent charge number 表观荷电数oxidation reaction 氧化反应notation of cell 电池组成式reduction reaction 还原反应reduction agent 还原剂oxidizing agent 氧化剂redox half-reaction 氧化还原半反应oxidized species 氧化性物质reduced species 还原性物质redox electric couple 氧化还原电对salt bridge 盐桥primary cell 原电池half-cell 半电池electrode 电极anode 负极cathode 阳极cell reaction 电池反应3electrode potential 电极电位standard hydrogen electrode,SHE标准氢电池electromotive force,emf电动势standard electrode potential 标准电极电位Faraday constant、法拉第常数Nernst equation Nernst方程reference electrode 参比电极indicator electrode 指导电极calomel electrode 甘汞电极saturated calomel electrode SEC饱和甘汞电极glass electrode 玻璃电极combination electrode 复合电极operational definition of pH pH操作定义第九章原子机构和元素周期律nuclear model 有核模型Planck constant 普朗克常数line spectrum 线状光谱stationary state 定态energy level 能级ground state 基态excited state 激发态transition 跃态principal quantum number 主量子数particle-wave duality 波粒二象性de Broglie relation de Broglie关系式probability wave 概率波uncertainty principle 测不准原理Schrödinger’s equation Schrödinger’s方程wave function 波函数probability density 概率密度electron cloud 电子云atomic orbital 原子轨道quantum number 量子数principal quantum number 主量子数(符号n)shell 电子层orbital angular momentum quantum number 轨道角动量量子数(符号l)subshell或sublevel 亚电子层magnetic quantum number 磁量子数(符号m) equivalent orbit 简并轨道(等价轨道)spin angular momentum quantum number 自旋角动量量子数(符号s)radial wave function 径向波函数angular wave function 角度波函数lobe 波瓣nodal plane 节面radial distribution function 径向波函数screening effect 屏蔽作用screening constant 屏蔽常数effective nuclear charge 有效核常数electronic configuration 电子组态Pauli exclusion principle Pauli不相容原理Building-up principle或Aufbau principle构造原理Hund’s rule Hund规则atomic core 原子芯valence electron 价电子valence electron 电子层(价层)period 周期group 族block 区transition element 过渡元素inner transition element 内过渡元素rare earth element 稀土元素atomic radius 原子半径covalent radius 共价半径van der waals radius van der waals半径metallic radius 金属半径ionic radius 离子半径electronegativity 电负性macroelement 常量元素microelement or trace clement 微量或痕量元素poisonous or harmful element 有毒或有害元素第十章共价键与分子间力Chemical bond 化学键Intermolecular force 分子间作用力Valence bond theory 简称VB 价键理论Molecular orbit theory 简称MO分子轨道理论ground state 基态repellent state 排斥态normal covalent bond 正常共价键coordinate covalent bond 配位共价键(coordinate bond 配位键)lone pair electron 孤对电子bond parameter 键参数dissociation energy 解离能bond length 键长bond angle 键角nonpolar covalent bond 非极性共价键4polar covalent bond 极性共价键hybrid orbital theory 杂化轨道理论hybridization 杂化hybrid orbital 杂化轨道equivalent hybridization 等性杂化nonequivalent hybridization 不等性杂化valence shell pair repulsion theory 简称VSEPR 价层电子对互斥理论linear combination of atomic orbitals LOCAO 原子轨道波函数的线性组合bonding molecular orbital 成键分子轨道antibonding molecular orbital 反键分子轨道nonbonding orbital 非键轨道bond order 键级localized bond 定域键delocalized bond 离域键free radical 自由基或游离基active oxygen free radical 活性氧自由基triplet oxygen 三线态氧singlet oxygen 单线态氧disproportion 歧化nonpolar molecule 非极性分子polar molecule 极性分子electric dipole moment 电偶极矩permanent dipole 永久偶极orientation force 取向力induction force 诱导力dispersion force 色散力hydrogen bond 氢键sort out by泡芙小民,如有错误,欢迎指正5。
第7章金属有机配合物

结构新奇, 结构新奇 化学键本质独特 化学反应性多种多样 丰富了化学的知识宝库 推动无机化学、有机化学、 推动无机化学、有机化学、结构化学的发展 应用得到广泛而深入的开拓, 应用得到广泛而深入的开拓, 尤其是在催化不对称 合成方面 有人预言,手性金属茂有可能在 世纪的塑料工业 有人预言 手性金属茂有可能在21世纪的塑料工业 手性金属茂有可能在 中,引发一场革命 引发一场革命
金属茂的催化聚合
20世纪 年代 世纪50年代 成功地用TiCl4+Al(Me)3催化 世纪 年代Ziegler-Natta成功地用 成功地用 开创了现代塑料工业。 聚合乙烯 , 开创了现代塑料工业。人们称之为 ZieglerNatta 催化剂。20世纪 年代 , 有人用金属茂 主要是弯 催化剂。 世纪 世纪80 有人用金属茂( 没成功。 曲夹心型 )代替 TiCl4,没成功。后来将助催化剂改用 代替 MAO {MAO=(MeAlO)n}式 (11), 成功了。用这种催化剂生 成功了。 式 产聚烯已在美国、德国、日本实现工业化。 产聚烯已在美国、德国、日本实现工业化。 • Al(Me)3+H2O (MeAlO) n (11) )
开环金属茂的构象比闭环金属茂要丰富 钒的开环茂是交错型的 , 熔点在-20℃以下) 铁的是覆盖型的 ,(熔点在 ℃以下 熔点在 铬的介于它们之间。 铬的介于它们之间。 周期表由左到右 , 开环金属茂的构象异构体由交 错型渐变为覆盖型。 错型渐变为覆盖型。
对于像2,4- 二甲基茂二烯基这样对称的开环茂 ,它 对于像 它 们的过渡金属夹心化合物,有旋转对映异构体, 们的过渡金属夹心化合物,有旋转对映异构体, 或叫构象对映异构体。 或叫构象对映异构体。 例如 (2,4-C7H11)2Fe,在构象角为 ,在构象角为59.7°时,应有 ° 两种构象异构体互为对映:9,10 。这两种异构体可 两种构象异构体互为对映 通过旋转相互转化,但需克服旋转势垒 28kJ/mol。 通过旋转相互转化 但需克服旋转势垒 。
《基础化学》第7章 醇、酚、醚---课程思政

命名实例
OH
OH
OH OH
邻苯二酚
α-萘酚
OH OH
间苯二酚
β-萘酚
HO
OH
对苯二酚
《基础化学》
第七章 醇酚醚
命名实例
OH
O2N
NO2
NO2
2, 4,6-三硝基苯酚
OH SO3H
邻羟基苯磺酸
《基础化学》
第七章 醇酚醚
7.2.3 酚的化学性质:
(一).结构与反应性
仲醇氧化生成酮,酮不易被继续氧化 .
H3C CH OH
[O] CH3
CH3 C CH3 O
《基础化学》
第七章 醇酚醚
K2Cr2O7 + H2SO4
O
RCH2OH
RCHO
RCOOH
CH3CH2OH + Cr2O72橙红
CH3CHO + Cr3+ 绿色
K2Cr2O7 CH3COOH
此反应可用于检查醇的含量,例如,检查司机是否
OH
CH3-CH-CH-CH2-CH-CH3
CH3
Cl
CH3-CH-CH2-CH=CH2
OH
2-甲基 -5- 氯 -3- 己醇 4 - 戊烯 -2- 醇
《基础化学》
第七章 醇酚醚
•
多元醇常用俗名.结构复杂的醇应选择包含多
个羟基在内的最长的数目.
(CH3)2CH OH
2 _ 甲基 _ 4 _异丙基_ 4 _ 己烯_ 3 _ 醇
CHCH=CH2
OH
1_ 苯基_ 2 _ 丙烯_ 1 _ 醇
CH 2CH 3
OH
2 _ 乙基_ 1 _ 环己醇
《基础化学》
基础化学-第七章沉淀溶解平衡

对于m:n型沉淀(MmAn) MmAn (s) mM(aq) + nA(aq)
对于Mg(OH)2: Mg(OH)2 (s) Mg2+(aq)+2OH-(aq)
总反应 CaSO4(s) + CO32-(aq) CaCO3(s) + SO42-(aq)
转化反应的平衡常数:
根据CaSO4的Ksp,在饱和的CaSO4溶液中
需要多大的[CO32-]才能生成CaCO3沉淀呢?
即只要[CO32-]>9.310-7mol· L-1 ,转化作用即可进行,这个条件是很容易满足的。
MA(s) MA(aq) M+(aq) + A-(aq)
(1) (2)
(1)——溶解平衡 (2)——解离平衡
溶解平衡:
Kθ=aMA(aq)= MA× [MA]
设 MA=1
则: [MA](aq)= Kθ =s0 固有溶解度
沉淀转化反应平衡常数不大,转化不会彻底。但在反应中,[CO32-]随反应的进行而逐渐降低,[SO42-]则不断增大,最后当[SO42-]/[CO32-]=1/46时,反应趋于平衡,转化反应不能继续进行。
但是,如转化停止后,倒掉上层清液,再加入新鲜的Na2CO3溶液,转化反应重复发生。如此反复处理,就能将BaSO4全部转化为BaCO3。
BaSO4(s) Ba2+(aq) + SO42-(aq) Ba2+(aq) + CO32-(aq) BaCO3(s)
总反应为 BaSO4(s) + CO32-(aq) BaCO3(s) + SO42-(aq)
基础化学教案

基础化学教案第一章物质结构元素周期律第二章物质的量第三章重要的非金属元素及其化合物第四章化学反应速率和化学平衡第五章电解质溶液第六章重要的金属元素及其化合物第七章烃第八章烃的衍生物第九章糖类和蛋白质第十章有机高分子材料第一章原子结构与元素周期律第一节原子结构一、教学目标(一) 知识与技能目标1.引导学生认识原子核的结构,懂得质量数和 A Z X的含义,掌握构成原子的微粒间的关系;知道元素、核素、同位素的涵义;掌握核电荷数、质子数、中子数、质量数之间的相互关系。
2.引导学生了解原子核外电子的排布规律,使他们能画出1~18号元素的原子结构示意图;了解原子的最外层电子排布与元素的原子得、失电子能力和化合价的关系。
(二)过程与方法目标通过对构成原子的微粒间的关系和氢元素核素等问题的探讨,培养学生分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。
(三)情感态度与价值观目标1.通过构成物质的基本微粒的质量、电性的认识,了解微观世界的物质性,从而进一步认识物质世界的微观本质;通过原子中存在电性不同的两种微粒的关系,认识原子是矛盾的对立统一体。
2.通过人类探索原子结构的历史的介绍,使学生了解假说、模型等科学研究方法和科学研究的历程,培养他们的科学态度和科学精神,体验科学研究的艰辛与喜悦。
3.通过“化学与技术----放射性同位素与医疗”,引导学生关注化学知识在提高人类生活质量中所起的作用。
4.通过“未来的能源----核聚变能”,引导他们关注与化学有关的热点问题,形成可持续发展的思想。
二、教学重点、难点(一)知识上重点、难点:构成原子的微粒间的关系和核外电子排布规律。
(二)方法上重点、难点:培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。
了解假说、模型等科学研究方法和科学研究的历程。
三、教学方法问题推进法、讨论法。
四、课时设计2课时五、教学过程第1课时【提问】化学变化中的最小微粒是什么?【学生回答】原子是化学变化中的最小微粒。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四节 温度对化学反应速率的影响
从Arrhenius方程式可得出下列三条推论: ① 对同一反应,活化能Ea是常数,e-Ea/RT随T升高而增 大。表明温度升高,k变大,反应加快。 ② 当温度一定时,对不同反应若反应的A值相近,Ea 愈大则k愈小。即活化能愈大,反应愈慢。 ③ 对不同的反应,温度对反应速率影响的程度不同。 当温度变化相同时,对Ea较大的反应,k的变化也 较大。表明改变相同的温度,对具有较大活化能反 应的速率影响较大。
例7-3:某化学反应的动力学数据如下: 2A + B → C
T c(A) c(B) v
1) 250C 2) 250C
1.0 2.0
1.0 1.0
0.1 0.4
3) 250C
4) 350C
1.0
1.0
4.0
1.0
1.6
0.4
求:1)反应的级数 2)反应的活化能Ea 3)450C时的速率常数k
第五节 催化剂与酶
基础化学
1
第七章 化学反应速率
Rate of Chemical Reaction
内容提要
1. 化学反应速率及表示方法 ① 化学反应速率 ② 化学反应的平均速率和瞬时速率 2. 浓度对化学反应速率的影响 ① 化学反应速率方程 ② 具有简单级数反应的特点 3. 化学反应速率理论简介 ① 碰撞理论与活化能 ② 过度状态理论简介
第二节 浓度对化学反应速率的影响
3. 反应级数(reaction order)
反应: aA+bB→dD+eE v = k cα(A) cβ(B) α—A的反应级数 β—B的反应级数 总的反应级数 = α + β
第二节 浓度对化学反应速率的影响
二、 具有简单级数的反应及其特点
(一) 一级反应(first-order reaction) 1. 一级反应 当反应时间由0→t,反应物浓度则由c0→c
及
E a / RT
E a ,催化 / RT
第五节 催化剂与酶
均相催化—中间产物学说: A+B AB,活化能E 有催化剂C参与时反应改变途径 并按以下两步进行: (1) A+C AC, 生成中间产物AC,活化能E1 (2) AC+BAB+C,活化能E2 正、逆向反应同时被催化, 在正向反应活化能降低的同时, 逆向反应活化能也降低同样多。
反应热与Ea的关系:
r Hm = Ea - Ea’
r Hm<0 (放热反应)
r Hm>0 (吸热反应) • 过渡状态理论将动力学 与热力学联系起来。
第四节 温度对化学反应速率的影响
一、温度与速率常数的关系
或
k Ae
Ea / RT
– – – –
Ea ln k B RT — Arrhenius方程式 k —反应速率常数 A —指前因子,与反应物碰撞频率、碰撞时分 子取向的可能性(分子复杂程度)有关 Ea —反应的活化能
c(H 2 O 2 ) dc(H 2 O 2 ) t 0 t dt
对同一化学反应,用不同物质表 示的反应速率不同,但反应进度相同。
第二节 浓度对化学反应速率的影响
一、化学反应的速率方程 1. 速率方程(rate equation) • 对一般化学反应:aA + bB → dD + eE 表示反应物浓度与反应速率之间定量关系的 数学式称为反应的速率方程式。
(a)弹性碰撞
H
O O C O C O H H (b) O H H H C O
(b)有效碰撞
H
第三节 化学反应速率理论简介
2. 活化分子与活化能
• 活化分子(activated molecule) 具有较大动能并能够发生有效碰撞的反应物分子。 • 活化能(Ea, activation energy) 活化分子具有的最低能量与反应物分子的平均能量 之差。 活化能单位:kJmol-1
反应级数 基本方程式
一级反应 ln(c0/ c)= k t
二级反应 1 1 kt c c0
零级反应 c0- c = k t
直线关系 斜率
半衰期(t1/2) k的量纲 [浓度]1-n[时间]1
lnc对t -k
0.693/ k [时间]-1
1/c对t k
1/ k c0
c对t -k
c0/2 k
[浓度]-1[时间]-1 [浓度] [时间]-1
第三节 化学反应速率理论简介
活化能特点:
①Ea为正值。
②不同的反应其Ea不同;同一反应不同途径的Ea不同。
③Ea与反应物本性及途径有关,与c、T 无关。 ④其它条件一定时, Ea 越大 , 反应速率越快。 (Ea是反应进行的能量障碍—能垒)
第三节 化学反应速率理论简介
二、过渡态理论(transition theory) 1. 活化络合物(activated complex) 具有足够能量的反应物分子相互碰撞,形成 一个高能量的过渡状态—活化络合物,此络合物 极不稳定,既可恢复成反应物,又可转化为产物。
内容提要
4. 温度对化学反应速率的影响 ① 温度与速率常数的关系 ② 温度影响化学反应速率的原因 5. 催化剂与酶 ① 催化剂及催化作用 ② 催化作用理论简介 ③ 生物催化剂-酶 6. 化学反应机制简介 ① 元反应、简单反应与复合反应 ② 元反应的速率方程 ③ 复合反应的速率方程
教学基本要求
1. 掌握化学反应速率、元反应、速率方程、速率
c
t dc c0 ( dt ) 0 k dt - (lnc –lnc0) = k t c0 k t c0 kt c c0 e ln k t lg c 2.303 c
• k 的单位:(时间)-1 • 以lnc ~ t作图得一直线,斜率为-k
第二节 浓度对化学反应速率的影响
请观看“trasition”动画
第三节 化学反应速率理论简介
2. 活化能与反应热 • 活化能是活化络合物具 有的能量与反应物分子 的平均能量之差。 • 无论吸热还是放热,反 应物分子必须越过能垒 (即一般分子变成活化 分子,或者形成活化络 合物所需的的能量)反 应才能进行。
第三节 化学反应速率理论简介
v = k c(N2O5)。设某温度时k = l.68×10-2s-1,如在一个
5.00L的容器中放入2.50molN2O5,问在该温度下反应进 行1.00min时,N2O5的剩余量及O2的生成量各为多少?
第二节 浓度对化学反应速率的影响
例7-2
某药物的初始含量为5.0g· L-1,在室温下放置
20个月之后,含量降为4.2 g· L-1。若此药物分解30
dc( N 2 ) 1 dc(H 2 ) 1 dc( NH3 ) v dt 3 dt 2 dt
第一节 化学反应速率的表示方法
二、化学反应的平均速率和瞬时速率
1.平均速率
H2O2(aq)
v
I-
1 H2O(l) + 2 O2(g)
2.瞬时速率
v lim
c( H 2 O 2 ) t
2. 半衰期 (t1/2, half-life) • 定义:反应物反应掉一半所需要的时间。 对一级反应
k t1/ 2 ln
t1 2
cO cO 2
ln 2
0.693 k
•
特点: 一级反应的t1/2 与起始浓度c0无关。
第二节 浓度对化学反应速率的影响
例7-1
反应2N2O5 (g) → 4NO2(g) + O2(g)服从速率方程式
第四节 温度对化学反应速率的影响
二、温度影响反应速率的原因 设k1为反应在T1时的速率常数,k2为T2时的速率 常数,T2>T1。 由Arrhenius方程
Ea ln k B RT
k2 Ea T2 T1 ln ( ) k1 R T1T2 因Ea>0,ln(k2/k1)>0,故k2>k1,即升高温度总是加 快化学反应速率。
第五节 催化剂与酶
二、催化作用理论简介 • 催化剂能够加快反应速率的根本原因在它参与反应 改变了反应途径,降低反应的活化能。 对反应 A+B AB 活化能为Ea;有催化剂时为Ea,催化; 且Ea,催化< Ea。
有 所以
k Ae k催化 Ae k催化 ( Ea ,催化 Ea ) / RT e 1, 即 k催化 k k
有效碰撞理论(collision theory)要点:
• 只有有效碰撞才能使反应物转化为产物。
• 发生有效碰撞的两个条件:
(1)反应物分子需有足够的能量;
(2)碰撞时要有合适的方向; CO(g)+H2O(g) 例 CO2(g)+H2(g)
第三节 化学反应速率理论简介
O O C O C H H O H (a) O H Fra bibliotek O C得
第四节 温度对化学反应速率的影响
主要原因:
①分子的平均动能增加。 ②活化分子的分数增加。 • 温度升高反应速率加快的 主要原因是反应物活化分 子的分数增加。设某反应 的Ea=100 kJmol-1,温度由 298K升至308K,反应速率 增加3.7倍,而平均动能仅 增加3%。
第四节 温度对化学反应速率的影响
v = k cα(A) cβ(B)
例如
NO2(g)+CO(g) NO(g)+CO2(g)
v = k c(NO2) c(CO)
第二节 浓度对化学反应速率的影响
2. 速率常数(rate constant)
• •
• •
对一般反应反应 aA + bB → dD + eE 速率方程为 v = k cα(A) cβ(B) k称为速率常数。与反应物浓度无关,与反应物本 质及温度有关。 k的物理意义:k在数值上等于各反应物浓度均为 1mol· L-1时的反应速率,故又称为比速率。 相同条件下,k愈大,表示反应的速率愈大。 k的量纲则根据速率方程式中浓度项上幂次的不同 而不同。
