高中化学 每日一题 常见漂白剂的分类及漂白原理 新人教版
漂白剂的种类和漂白原理

漂白剂的种类及其漂白原理***化学化工学院化学教育专业06级指导教师:杨延民教授摘要 : 物质的漂白脱色是化工生产中经常遇到的问题。
根据化工产品呈色的原因不同,对不同物质采取不同的漂白方法。
我们通常使用活性炭等物理吸附剂漂白因含有色素而显色的物质。
而对因含有生色团而显色的物质漂白,一般都是使用漂白剂与其发生化学反应,我们称它为化学漂白。
根据发生化学反应机理的不同,将化学漂白剂分为氧化型漂白剂和还原型漂白剂。
本文将对一些常见的漂白剂种类及其漂白的原理进行阐述。
关键词:漂白剂;原理;氧化;还原;二氧化硫;臭氧;氯气The Type of Bleach and the Principle of BlechingWu XuemeiCollege of Chmistry and Chemical Engineering Grade2006 Instructor:Yang YanminAbstract:Many chemical products has color that we do not want, bleaching material is frequently encountered in chemical production problems. Chemical coloration for many reasons, the coloration of different products for different reasons .We use different bleach method according to the different color material. We use charcoal to bleach substances which contains the color pigments by physical adsorption. bleching stances mainly by physical adsorption and chemical reaction, bleaching agents are chemical bleach. In this paper, some common bleaching agents and the principle of bleaching are expounded.Key words : bleaching ;principle ;oxidation ;reduction;sulfu r;dioxide;ozone;chlorine引言很多物质都带有我们不希望见到的颜色,我们要使物质失去这种颜色,这就是我们通常所说的漂白。
常见漂白剂的分类及漂白原理-试题君之每日一题君2017-2018学年高一化学人教版(上学期期末复习) 1
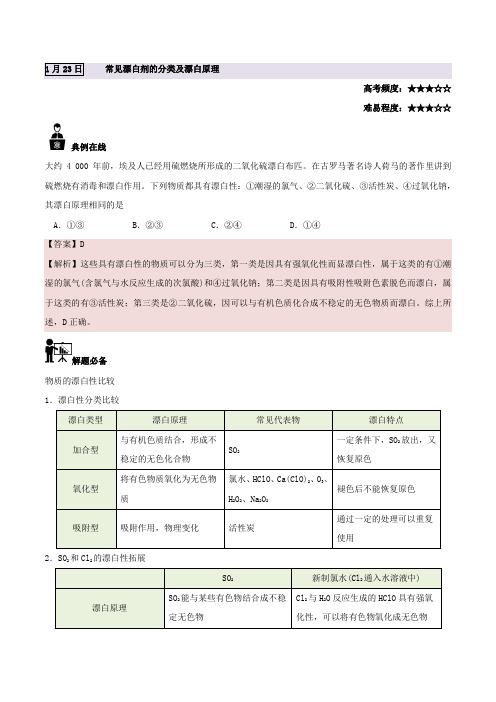
1月23日常见漂白剂的分类及漂白原理高考频度:★★★☆☆ 难易程度:★★★☆☆典例在线大约4 000年前,埃及人已经用硫燃烧所形成的二氧化硫漂白布匹。
在古罗马著名诗人荷马的著作里讲到硫燃烧有消毒和漂白作用。
下列物质都具有漂白性:①潮湿的氯气、②二氧化硫、③活性炭、④过氧化钠,其漂白原理相同的是A .①③B .②③C .②④D .①④【答案】D【解析】这些具有漂白性的物质可以分为三类,第一类是因具有强氧化性而显漂白性,属于这类的有①潮湿的氯气(含氯气与水反应生成的次氯酸)和④过氧化钠;第二类是因具有吸附性吸附色素脱色而漂白,属于这类的有③活性炭;第三类是②二氧化硫,因可以与有机色质化合成不稳定的无色物质而漂白。
综上所述,D 正确。
解题必备物质的漂白性比较 1.漂白性分类比较漂白类型 漂白原理常见代表物漂白特点加合型与有机色质结合,形成不稳定的无色化合物 SO 2一定条件下,SO 2放出,又恢复原色氧化型将有色物质氧化为无色物质氯水、HClO 、Ca(ClO)2、O 3、H 2O 2、Na 2O 2褪色后不能恢复原色吸附型吸附作用,物理变化活性炭通过一定的处理可以重复使用2.SO 2和Cl 2的漂白性拓展SO 2新制氯水(Cl 2通入水溶液中) 漂白原理SO 2能与某些有色物结合成不稳定无色物Cl 2与H 2O 反应生成的HClO 具有强氧化性,可以将有色物氧化成无色物漂白效果不稳定,加热能复原稳定漂白范围某些有机色质绝大多数有机色质与有机色质作用实例品红2SO−−−→通褪色−−→△红色,紫色石蕊2SO−−−→通红色品红2l−−−→通C褪色−−→△不显红色,紫色石蕊2l−−−→通C先变红,随即褪色混合作用SO2+Cl2+2H2O===H2SO4+2HCl,漂白作用大大减弱易错易混若将等物质的量的Cl2和SO2气体相混合,在溶液中会发生反应:SO2+Cl2+2H2O===H2SO4+2HCl,从而失去漂白能力。
人教课标版高中化学必修1热点突破:常见的漂白性物质

热点突破: 常见的漂白性物质
➢ 1.热点透析 ➢ 2.典例剖析 ➢ 3.变式训练
常见的漂白性物质
热点透析
用于漂白 的物质
实际参 与漂白 的物质
漂白原理
变化 类别
漂白特点
能漂白的 物质
活性炭
活性炭
吸吸附附型漂漂白白
物理 物理漂白 一般用于 变化 不可逆 溶液漂白
氯气 次氯酸盐 次氯酸
次氯酸
利用次氯酸的 强氧化性
强氧化性漂白
化学 变化
氧化还原 可以漂白 漂白,不 所有有机 可逆 色质
过化钠 过氧化氢
过氧 化氢
过氧化氢的强 氧化性
化学 变化
氧化还原 可以漂白 漂白,不 所有有机 可逆 色质
二氧化硫
二氧 化硫
二氧化硫与有 色 成化物不合质稳型化定漂合的白生无 色物质
化学 变化
非氧化还 原漂白, 可逆
解析 A 项中 SO2 表现还原性。B 项中 SO2 表现酸性氧化 物的性质。D 项中 SO2 表现还原性。
变式训练
【变式】下列现象描述正确的是( C )。 A.向品红溶液中通入二氧化硫,红色褪去;加热该无
色溶液,无颜色变化
B.向饱和硫化氢溶液中通入二氧化硫,溶液变浑浊;
继续通入二氧化硫,浊液变澄清
具有选择 性,如品 红、棉、 麻、草等
典例剖析
【典例】能证明SO2具有漂白性的是( C )
A.酸性KMnO4溶液中通入SO2气体后紫红色消失
B.滴有酚酞的NaOH溶液中通入SO2气体后红色消失
C.品红溶液中通入SO2气体后红色消失
D.溴水中通入SO2气体后橙色消失
解析显/隐
要将SO2的还原性、酸性氧化物的通性与漂白性区分开; SO2的漂白具有选择性,仅能将品红、棉,麻、草漂白。
漂白剂

2.下列褪色现象是SO2的漂白性吗?试写出他们的离子方程式。
(1)SO2使橙色溴水褪色:(2)SO2使紫色KMnO4酸性溶液褪色:(3)SO2使红色酚酞褪色:3.氯水和SO2分别使紫色石蕊产生什么现象:4.SO2和Cl2混合后能否增强漂白效果?原因【实验探究】某同学用如图所示装置探究SO2的性质及其有关实验。
(1)实验室用亚硫酸钠固体和一定浓度的硫酸反应制备SO2气体,写出该反应的化学方程式:(2)分别将SO2气体通入下列C溶液中,请回答下列问题:①少量SO2通入紫色石蕊试液,现象是,继续通入过量SO2气体,现象是。
②SO2通入紫红色KMnO4溶液,现象是,其反应的离子方程式为。
③SO2慢慢地通入澄清石灰水中,现象是。
④若C取双氧水,则通入SO2后,请大胆判断所得溶液是什么(填溶质的化学式),若该同学制备的SO2气体中混有CO2气体,产生杂质的的原因可能是亚硫酸钠固体中混有。
要证明气体中既有SO2又有CO2,应该选用的试剂依次为。
各种漂白剂与漂白原理2.下列褪色现象是SO2的漂白性吗?(1)SO2使橙色溴水褪色(2)SO2使紫色KMnO4酸性溶液褪色(3)SO2使红色酚酞褪色解析:以上褪色现象都不是SO2的漂白性所致。
(1)、(2)褪色的原因是SO2的还原性。
分别发生氧化还原反应SO2+Br2+2H2O= H2SO4+2HBr;5 SO2+2KMnO4+2H2O=K2SO4+2 MnSO4+ 2H2SO4(3)褪色的原因是SO2溶于H2O后生成了H2SO3,H2SO3是酸可以使红色酚酞变为无色。
3.氯水和SO2分别使紫色石蕊产生什么现象?解析:氯水中的HClO先使紫色石蕊变红,而后因为它有强氧化性使红色褪去。
SO2溶于H2O后生成了H2SO3,H2SO3是酸可以使紫色石蕊变为红色。
而H2SO3不具有强氧化性,所以红色不会褪去。
4.SO2和Cl2混合后能否增强漂白效果?解析:不能。
因为SO2和Cl2混合后会发生氧化还原反应:SO2+ Cl2+2 H2O= H2SO4+2HCl【实验探究2】解析:(2)①SO2通入水中生成H2SO3,H2SO3H++HSO3—,HSO3—H++SO32—,溶液呈酸性,遇到石蕊显红色。
高中化学第四章非金属及其化合物重难点常见漂白性物质及漂白原理人教版

重难点6 常见漂白性物质及漂白原理1、漂白剂的类型及漂白原理类型原理特点举例氧化型漂白剂本身是氧化剂,利用其氧化性氧化有色物质,使之失去原有的颜色加热时不能恢复原有的颜色NaClO、Ca(ClO)2、HClO、H2O2、O3等化合型漂白剂与有色物质结合生成新的无色物质,使之失去原来的颜色加热时能恢复原来的颜色二氧化硫等吸附型有些固体物质疏松、多孔,具有较大的比表面积,可以吸附无色物质使之失去原来的颜色部分吸附剂可以重复使用活性炭、胶体等2、SO2和Cl2漂白比较(1)(2)特别提醒(1)二氧化硫的三种“褪色”:①二氧化硫能使品红褪色表现漂白性;②使溴水、氯水及酸性高锰酸钾溶液褪色体现还原性;③使滴有酚酞的氢氧化钠溶液褪色说明其水溶液呈酸性。
(2)SO2不能漂白紫色石蕊溶液、含酚酞的NaOH溶液,而氯水能漂白。
(3)检验SO2气体的方法是将气体通入品红溶液,溶液褪色后加热又恢复到红色。
★★★【重难点考向一】二氧化硫的漂白性【例1】能证明SO2具有漂白性的是( )A.酸性KMnO4溶液中通入SO2气体后,紫色消失B.显红色的酚酞通入SO2后,红色消失C.品红溶液中通入SO2后,红色消失D.溴水中通入SO2后,橙色消失【答案】C【重难点考向二】氯气与SO2漂白原理的区分【例2】下列说法正确的是( )A.SO2能使品红溶液、溴水和酸性KMnO4溶液褪色,是因为SO2具有漂白性B.SO2、Cl2都可用于漂白物质,将等物质的量的两种气体同时作用于潮湿的有色物质时,可增强漂白效果C.活性炭使有色物质褪色是利用了碳单质的还原性D.SO2使品红溶液褪色后,将褪色后的溶液加热,溶液重新变为红色【答案】D【解析】SO2能使品红溶液褪色,表现SO2的漂白性,SO2能使溴水和酸性KMnO4溶液褪色表现SO2的还原性,A项不正确;当SO2、Cl2等物质的量同时作用于潮湿的有色物质时,发生以下反应:Cl2+SO2+2H2O=2HCl+H2SO4,失去漂白作用,B项不正确;活性炭使有机物褪色利用了碳的吸附性,C项不正确;SO2与品红结合成不稳定的无色物质,加热后又分解成原来的品红,故D项正确。
2020-2021学年新教材化学人教版必修第二册微专题强化训练1 常见漂白剂的归类分析

微专题强化训练1常见漂白剂的归类分析1.下列物质不能用于漂白的物质是()A.84消毒液B.氯水C.双氧水D.洁厕净D[洁厕净中主要含盐酸,可以除去水垢等。
]2.(双选)下列物质利用氧化性漂白的是()A.氯水B.活性炭C.SO2D.双氧水AD[活性炭是利用吸附作用,SO2是利用与有色物质化合成无色物质。
] 3.下列物质均使品红溶液褪色,但加热又恢复红色的是()A.Cl2B.O3C.H2O2D.SO2[答案] D4.下列说法正确的是()A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊溶液褪色B.能使品红溶液褪色的不一定是SO2C.SO2、漂白粉、活性炭都能使红墨水褪色,其原理相同D.将SO2和Cl2等物质的量混合后,通入装有湿润的有色布条的集气瓶中,漂白效果更好B[SO2能使溴水、酸性KMnO4溶液褪色是因为SO2具有还原性,能使品红溶液褪色才体现其漂白性,SO2不能使石蕊溶液褪色,A项错误;能使品红溶液褪色的物质很多,不仅仅是SO2,B项正确;SO2与红墨水中的有色物质结合生成不稳定的无色物质而漂白,漂白粉能将红墨水中的有色物质氧化而漂白,活性炭能吸附红墨水中的有色物质而漂白,三者的漂白原理不相同,C项错误;SO2和Cl2等物质的量混合后与H2O发生反应SO2+Cl2+2H2O===H2SO4+2HCl,从而失去漂白能力,D项错误。
]5.如图是研究二氧化硫性质的微型实验装置。
现用70% H2SO4溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。
下列说法错误的是()A.紫色石蕊溶液变红,然后逐渐褪色B.品红溶液褪色C.溴水的橙黄色褪去D.含酚酞的NaOH溶液的红色变浅或褪色A[SO2与水反应生成的H2SO3显酸性,能使紫色石蕊溶液变红但不褪色,A 错误。
SO2有漂白性,能使品红溶液褪色,B正确。
SO2有还原性,与溴水发生反应Br2+SO2+2H2O===H2SO4+2HBr,使溴水褪色,C正确。
2019-2020学年高中化学 每日一题 氯水的成分及性质分析 漂白剂 新人教版

2019-2020学年高中化学每日一题氯水的成分及性质分析漂白剂新人教版高考频度:★★★☆☆难易程度:★★★☆☆典例在线小王同学在一次实验中发现:把新制氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时溶液的红色突然消失。
请回答下列问题:(1)将氯气通入水中的化学方程式为________________;氯水中具有强氧化性的分子有________、________。
(2)探究“溶液的红色突然消失”的原因:①猜想:a.是氯水中的盐酸中和了NaOH,使酚酞由红色变成无色;b.是_____________________________________________。
②设计实验:往已褪色的溶液中连续滴加NaOH溶液至过量,若现象为________,则证明“猜想a”正确;若现象为________,则“猜想b”正确。
【答案】(1)Cl2+H2O===HCl+HClO Cl2HClO(2)①b.氯水中的HClO的强氧化性(或漂白性)将酚酞氧化而褪色②红色重新出现红色不再出现解题必备一、氯水性质的多重性1.氯水中的反应Cl2+H2O===H++Cl−+HClO,2HClO 光照2H++2Cl−+O2↑,所以,保存氯水要密闭、放在冷暗处、棕色瓶中。
但氯水不宜长期存放,最好是现用现配,因为不见光也会缓慢分解。
2.氯水的成分新制氯水分子有Cl2、HClO、H2O三种,溶质分子中以Cl2为主;离子有H+、Cl−、ClO−、OH−(少量)四种。
长期放置的氯水,由于HClO分解,Cl2全部反应,氯水最终变为稀盐酸。
3.氯水的性质(1)表现Cl2的性质氯水中含有Cl2,所以氯水呈黄绿色,由于Cl2具有强氧化性,当向氯水中加入强还原性物质,便可与Cl2发生氧化还原反应。
如:氯水能使润湿的淀粉KI试纸变蓝(用于对Cl2收集的验满),能与Na2SO3、FeBr2等发生氧化还原反应:Na2SO3+Cl2+H2O===Na2SO4+2HCl,2FeBr2+3Cl2(足量)===2FeCl3+2Br2。
漂白液和漂白粉的原理

漂白液和漂白粉的原理
漂白液和漂白粉都是常用的漂白剂,它们主要通过氧化和还原反应来实现漂白作用。
漂白液一般指的是含有氯比的漂白剂,常见的成分是次氯酸钠(NaClO)。
在漂白液中,次氯酸钠会分解为次氯酸离子(ClO-)和钠离子(Na+),次氯酸离子是一种强氧化剂,它能够与有色物质中的染料或杂质发生氧化反应,使其变为无色物质或较浅颜色的物质,从而达到漂白的效果。
漂白粉一般指的是含有活性氧的氧化剂,常见的成分是过氧化氢(H2O2)。
漂白粉在水中溶解时会分解成活性氧分子,活性氧分子具有较强的氧化性能,能够与有色物质中的染料或杂质发生氧化反应,使其变为无色物质或较浅颜色的物质,从而实现漂白作用。
在漂白过程中,漂白剂中的活性氧或次氯酸离子会与有色物质中的染料或杂质发生氧化反应。
氧化反应是一种电子转移反应,漂白剂通过接受有色物质中的电子,从而使其还原,自身发生还原。
在反应过程中,有色物质中的电子被转移到漂白剂中,同样的,漂白剂中的氧化剂也会失去电子,发生还原。
通过这样的反应机制,漂白剂能够将有色物质中的染料或杂质转化为无色或较浅色的物质,实现漂白效果。
需要注意的是,漂白剂的使用需要谨慎,因为其具有较强的氧化性能,使用不当
可能会导致材料损坏或人身伤害。
在使用漂白剂时应按照说明进行稀释或配合其他化学剂使用,以确保安全和有效地进行漂白作用。
高考化学漂白知识点总结

高考化学漂白知识点总结一、漂白的定义漂白是指通过化学方法去除物质中的颜色、污渍或杂质的过程。
漂白可以分为氧化漂白和还原漂白两种方式。
氧化漂白是指通过氧化反应使染色质氧化而脱色,还原漂白则是指通过还原反应使染色质还原而脱色。
二、漂白剂的种类1. 氯漂白剂:大气中的氯气和水生成的次氯酸溶液,次氯酸钠和次氯酸钙。
2. 臭氧漂白剂:臭氧气体。
3. 过氧化氢漂白剂:过氧化氢溶液。
4. 硫代硫酸盐漂白剂:亚硫酸氢钠和硫代硫酸钠。
三、漂白原理1. 氯漂白剂原理:次氯酸可以氧化分子中的双键,氧化染料使其脱除色。
同时也可以分解有机物,氧化染色物使其脱除色。
2. 臭氧漂白剂原理:臭氧能将染料中的双键氧化,或通过和分子中某些固定位置的双键分子发生加成反应而发生分子的裂解,使其变得无色。
3. 过氧化氢漂白剂原理:过氧化氢本身在水溶液中是不稳定的,它可以分解为活性自由基,自由基氧化染料使其脱除色。
4. 硫代硫酸盐漂白剂原理:亚硫酸氢根离子和双氧-亚硫酸根离子能与染料中的双键发生加成反应,活化染料分子,或起到还原作用,使其脱色。
四、漂白剂的应用1. 漂白衣物:在日常生活中,漂白剂常用于漂白衣物,以去除衣物上的污渍或变黄的部分。
2. 消毒食品:漂白可以杀菌消毒,使食品更加安全可靠。
3. 清洁环境:漂白剂也可以用于清洁户外场所,去除一些难以清洁的环境污染。
五、高考化学漂白的考点和解题技巧1. 理解漂白的原理和机制,掌握漂白剂的种类及其化学反应过程,例如次氯酸的生成和分解反应,次氯酸和染料中双键的氧化反应等。
2. 掌握漂白剂的应用场景和具体操作步骤,如何使用次氯酸或过氧化氢来漂白衣物、清洁环境等。
3. 掌握漂白相关的化学方程式,如次氯酸钠和氯气的反应方程,过氧化氢水溶液分解的反应方程等。
4. 注意漂白剂的化学性质和用途之间的关系,考查漂白剂是否可以氧化某种物质或还原某种物质的反应类型。
总之,在高考化学中,漂白是一个重要的考试内容,学生需要理解漂白的原理和机制,掌握漂白剂的种类和化学反应过程,掌握漂白剂的应用场景和具体操作步骤,掌握漂白相关的化学方程式,注意漂白剂的化学性质和用途之间的关系等,才能更好地应对考试中的相关题目。
漂白水漂白原理

漂白水漂白原理
漂白水是一种强氧化剂,主要成分是含氧化氯的次氯酸(ClO)。
它可以去除物质表面的颜色,使之变得更加白净。
漂白的原理是使用次氯酸来氧化染料分子,从而使其丧失颜色。
当漂白水与染料接触时,次氯酸会释放氧气。
氧气分子很容易与染料分子发生反应,使其分解成无色物质。
此过程中,染料分子中存在的双键或芳香环结构可以被氧气破坏,从而消除颜色。
此外,次氯酸还可以与有机物中的醛、酮等官能团发生氧化反应,从而降低其颜色。
因此,漂白水可以被用来去除多种有机染料、污渍和污垢。
需要注意的是,漂白水是一种强氧化剂,使用时需要小心操作。
过量使用漂白水可能会导致物品表面发黄或变脆。
此外,漂白水还会与一些物质如氨、酸等产生反应,产生有毒气体。
所以在使用漂白水时,要按照使用说明进行正确的操作和配比,以避免意外发生。
高中化学漂白性物质归纳!
高中化学漂白性物质归纳!
今天小编要给大家分享的是:漂白性物质的种类,以及值得思考的几个问题。
常用的漂白剂有活性炭、氯水、
Na2O2、O3、H2O2、SO2、HClO、NaClO、Ca(ClO)2(漂白粉的有效成分)等,但是它们的漂白原理很容易混淆,这里就总结一下,供同学们参考。
1、下列褪色现象是SO2的漂白性吗?
(1)SO2使橙色溴水褪色
(2)SO2使紫色KMnO4酸性溶液褪色
(3)SO2使红色酚酞褪色
解析:以上褪色现象都不是SO2的漂白性所致。
(1)、(2)褪色的原因是SO2的还原性。
分别发生氧化还原反应
SO2+Br2+2H2O= H2SO4+2HBr
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+ 2H2SO4
(3)褪色的原因是SO2溶于H2O后生成了H2SO3,H2SO3是酸可以使红色酚酞变为无色。
2、氯水和SO2分别使紫色石蕊产生什么现象?
解析:氯水中的HClO先使紫色石蕊变红,而后因为它有强氧化性使红色褪去。
SO2溶于H2O后生成了H2SO3,H2SO3是酸可以使紫色石蕊变为红色。
而H2SO3不具有强氧化性,所以红色不会褪去。
3、SO2和Cl2混合后能否增强漂白效果?
解析:不能。
因为SO2和Cl2混合后会发生氧化还原反应SO2+ Cl2+2H2O= H2SO4+2HCl
生成物H2SO4和HCl都没有漂白作用,所以漂白效果会减弱。
当n(SO2): n(Cl2)=1:1时,完全失去漂白作用。
2020学年高中化学 每日一题 常见漂白剂的分类及漂白原理 新人教版

常见漂白剂的分类及漂白原理高考频度:★★★★☆难易程度:★★★☆☆典例在线下列由于物质的漂白性而导致溶液褪色的是①将过氧化钠投入水中,然后加入几滴酚酞溶液,溶液先变红后褪色②将活性炭放入红墨水中,溶液褪色③向品红溶液中滴加氯水,红色褪去④向酸性高锰酸钾溶液中通入二氧化硫气体,溶液紫色褪去A.①③ B.①②③ C.①②③④ D.②④【答案】B【解析】①将过氧化钠投入水中反应生成氢氧化钠和氧气,然后加入几滴酚酞溶液,溶液先变红后褪色是生成的过氧化氢具有漂白性,正确;②将活性炭放入红墨水中,活性炭具有吸附性,溶液褪色,正确;③向品红溶液中滴加氯水,次氯酸具有漂白性,溶液的红色褪去,正确;④向酸性高锰酸钾溶液中通入二氧化硫气体,二氧化硫具有还原性,溶液紫色褪去,错误;故选B。
解题必备物质的漂白性比较1.漂白性分类比较漂白类型漂白原理常见代表物漂白特点加合型与有机色质结合,形成不稳定的无色化合物SO2一定条件下,SO2放出,又恢复原色氧化型将有色物质氧化为无色物质氯水、HClO、Ca(ClO)2、O3、H2O2、Na2O2褪色后不能恢复原色吸附型吸附作用,物理变化活性炭通过一定的处理可以重复使用2.SO2和Cl2的漂白性拓展SO2新制氯水(Cl2通入水溶液中)漂白原理SO2能与某些有色物结合成不稳定无色物Cl2与H2O反应生成的HClO具有强氧化性,可以将有色物氧化成无色物漂白效果不稳定,加热能复原稳定漂白范围某些有机色质绝大多数有机色质与有机色质作用实例品红2SO−−−→通褪色−−→△红色,紫色石蕊2SO−−−→通红色品红2l−−−→通C褪色−−→△不显红色,紫色石蕊2l−−−→通C先变红,随即褪色混合作用SO2+Cl2+2H2O===H2SO4+2HCl,漂白作用大大减弱易错易混若将等物质的量的Cl2和SO2气体相混合,在溶液中会发生反应:SO2+Cl2+2H2O===H2SO4+2HCl,从而失去漂白能力。
常见漂白剂及其应用

化合性漂白与有机色素结合成无色的物质新物质分解后颜色会复原
常见漂白剂 漂白原理及பைடு நூலகம்途
HClO HClO有强氧化性,常用于自来水消毒。 Ca(ClO)2 Ca(ClO)2与CO2、水生成HClO而呈漂白性,常用于衣服、织物的漂白 Na2O2 Na2O2有强氧化性,常用于织物、丝稠、麦秆等漂白 O3 O3有极强的漂白性,常用于消毒。 H2O2 H2O2有强氧化性,3%的双氧水常用于医疗消毒。 SO2 化合性漂白,与有机色素结合成无色的物质,新物质分解后颜色会复原。 木炭或活性碳 物理吸附性漂白,可以做脱色剂,除臭剂,去味剂,防毒面具的滤毒罐等。
高三化学每日一读一练有漂白作用的物质与其常见考查类型归纳和专项训练

有漂白作用的物质与其常见考查类型归纳和专项训练一、具有漂白作用的物质与漂白原理漂白原理氧化作用化合作用吸附作用变化类型化学变化化学变化物理变化过程是否可逆不可逆可逆可逆常见物质举例Cl2、O3、Na2O2、NaClO、浓HNO3SO2、H2SO3活性炭二、有关漂白性物质常见的考查类型:1、判断物质的漂白原理是否相同[例1]下列四种有色溶液与SO2气体作用均能褪色,其实质相同的是()①酸性高锰酸钾溶液;②品红溶液③溴水;④滴有酚酞的氢氧化钠溶液;A.①③ B.②③ C. ①④ D.②④解析:SO2使酸性高锰酸钾溶液、溴水褪色发生的是氧化还原反应,即酸性高锰酸钾溶液、溴水把SO2氧化为SO42-;SO2使品红溶液褪色是SO2与品红化合成无色物质而褪色;SO2使滴有酚酞的氢氧化钠溶液褪色是SO2与氢氧化钠发生中和反应使溶液酸化而褪色。
故答案为A.2、利用物质的漂白作用检验(或鉴别)物质[例2]下列物质不能用于鉴别SO2和CO2气体的是( )A、品红溶液B、酸性KMnO4溶液C、石蕊试液D、酸化的Ba(NO3)2溶液解析:要用一种溶液鉴别两种气体,只要分别把两种气体通入这种溶液中产生不同的现象,就可将其鉴别开。
SO2能与品红化合成无色物质而褪色,而CO2不能;SO2能把酸性KMnO4溶液还原而褪色,而CO2不能;SO2能与酸化的Ba(NO3)2溶液反应生成BaSO4白色沉淀而CO2通入其中无明显变化;SO2和CO2气体分别通入石蕊试液中,都能使其变红。
故知答案为C.3、考查生活中或化学中与漂白物质有关的物质成分或有效成分[例3]“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用。
它的有效成分是下列物质中的一种,这种物质是()。
A.NaClO B.NaOH C.KMnO4 D.Na2O2解析:这是一道生活常识考查题。
不过即使不知道这个常识,据题目所给信息和已学化学知识也可解答此题。
由题目中“该消毒液无色,有漂白作用”的提示,可排除有色的KMnO4 和无漂白作用的NaOH,而Na2O2在溶液中不可能存在,由此可知答案为A。
2020-2021学年化学人教版第二册教案:第5章第1节微专题1 常见漂白剂的归类分析含解析
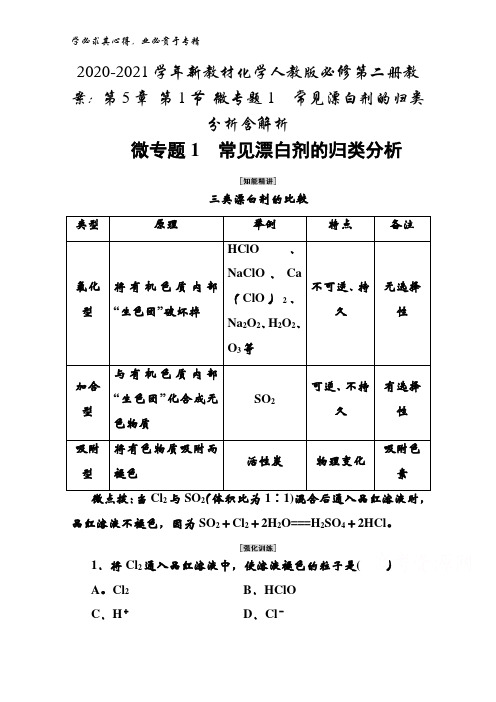
2020-2021学年新教材化学人教版必修第二册教案:第5章第1节微专题1常见漂白剂的归类分析含解析微专题1常见漂白剂的归类分析三类漂白剂的比较类型原理举例特点备注氧化型将有机色质内部“生色团”破坏掉HClO、NaClO、Ca(ClO)2、Na2O2、H2O2、O3等不可逆、持久无选择性加合型与有机色质内部“生色团”化合成无色物质SO2可逆、不持久有选择性吸附型将有色物质吸附而褪色活性炭物理变化吸附色素22品红溶液不褪色,因为SO2+Cl2+2H2O===H2SO4+2HCl。
1.将Cl2通入品红溶液中,使溶液褪色的粒子是()A。
Cl2B.HClOC.H+D.Cl-[答案]B2.为了提高氯水的漂白性,可以向氯水中加入或通入的物质是()A.SO2B.CaCO3C.FeCl2D.Na2SB[A项,SO2与Cl2、H2O反应生成HCl和H2SO4,减弱漂白性;C、D项,Fe2+、S2-与Cl2均反应,减弱漂白性。
]3.下列说法正确的是()A。
向BaCl2溶液中通入SO2气体,溶液仍澄清,滴入3%过氧化氢溶液后有白色沉淀产生B.可以用澄清石灰水来鉴别SO2与CO2C.向紫色石蕊溶液中通入SO2气体,溶液先变红后褪色D。
SO2使溴水褪色,体现了SO2的漂白性A[HCl的酸性强于H2SO3,因此向BaCl2溶液中通入SO2,溶液仍澄清,SO2具有还原性,H2O2具有强氧化性,滴入过氧化氢溶液后,发生反应H2O2+SO2===H2SO4,BaCl2+H2SO4===2HCl +BaSO4↓,溶液中有白色沉淀产生,故A正确.SO2和CO2都能使澄清石灰水变浑浊,因此用澄清石灰水无法鉴别SO2和CO2,故B错误。
向紫色石蕊溶液中通入SO2,SO2与H2O反应生成H2SO3,会使溶液变红,但不会褪色,故C错误。
SO2使溴水褪色,发生反应SO2+Br2+2H2O===H2SO4+2HBr,体现了SO2的还原性,故D错误。
漂白剂科普知识

漂白剂科普知识漂白剂是一种常见的清洁产品,常用于漂白衣物、清洁卫生间等场合。
它能够有效去除污渍和杀灭细菌,使物品恢复洁白。
下面我们来了解一下漂白剂的科普知识。
一、漂白剂的成分和分类漂白剂的主要成分是含氯化合物,如次氯酸钠(NaClO)、次氯酸钙(Ca(ClO)2)等。
它们可分为氯漂白剂和非氯漂白剂两大类。
1.氯漂白剂:氯漂白剂是最常见的漂白剂,常用于洗衣和清洁卫生间。
它的主要成分是次氯酸钠,具有强氧化性和杀菌作用。
氯漂白剂可以氧化染料颜料,使其变为无色物质,从而起到漂白的效果。
2.非氯漂白剂:非氯漂白剂是一种相对环保的漂白剂,不含氯成分。
常见的非氯漂白剂有过氧化氢(H2O2)和过氧化苯甲酰(C6H5COOOH)等。
与氯漂白剂相比,非氯漂白剂的漂白效果可能较弱,但对环境的影响较小。
二、漂白剂的使用注意事项1.正确使用:在使用漂白剂时,首先要阅读产品说明书,按照指示正确使用。
不同的漂白剂有不同的适用场景和用量,要根据实际情况进行选择和使用。
2.避免混用:漂白剂与其他清洁剂或洗衣剂混用可能产生有害的化学反应,产生有毒气体。
因此,在使用漂白剂前,要确保清洁区域没有其他清洁剂的残留,并且不要与其他清洁剂混合使用。
3.保持通风:漂白剂具有刺激性气味,使用时要保持通风良好的环境,以减少对人体的刺激。
4.避免接触皮肤和眼睛:漂白剂具有腐蚀性,使用时要避免直接接触皮肤和眼睛。
如不慎接触,应立即用清水冲洗,并咨询专业医生。
5.避免长时间浸泡:漂白剂对某些物品有腐蚀作用,长时间浸泡可能导致物品损坏。
因此,在使用漂白剂时,要根据产品说明书的建议,控制浸泡时间。
三、漂白剂的环境影响漂白剂的使用会产生少量有机氯物质,如三氯甲烷等,这些物质对环境具有一定的影响。
因此,在使用漂白剂时,要注意合理用量,避免过度使用,减少对环境的负面影响。
为了减少对环境的影响,可以选择使用非氯漂白剂,如过氧化氢等。
非氯漂白剂在分解后只产生水和氧气,对环境无污染。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见漂白剂的分类及漂白原理
高考频度:★★★★☆ 难易程度:★★★☆☆
典例在线
下列由于物质的漂白性而导致溶液褪色的是
①将过氧化钠投入水中,然后加入几滴酚酞溶液,溶液先变红后褪色 ②将活性炭放入红墨水中,溶液褪色 ③向品红溶液中滴加氯水,红色褪去
④向酸性高锰酸钾溶液中通入二氧化硫气体,溶液紫色褪去
A .①③
B .①②③
C .①②③④
D .②④ 【答案】B
【解析】①将过氧化钠投入水中反应生成氢氧化钠和氧气,然后加入几滴酚酞溶液,溶液先变红后褪色是生成的过氧化氢具有漂白性,正确;②将活性炭放入红墨水中,活性炭具有吸附性,溶液褪色,正确;③向品红溶液中滴加氯水,次氯酸具有漂白性,溶液的红色褪去,正确;④向酸性高锰酸钾溶液中通入二氧化硫气体,二氧化硫具有还原性,溶液紫色褪去,错误;故选B 。
解题必备
物质的漂白性比较 1.漂白性分类比较
2.SO 2和Cl 2的漂白性拓展
易错易混
若将等物质的量的Cl2和SO2气体相混合,在溶液中会发生反应:SO2+Cl2+2H2O===H2SO4+2HCl,从而失去漂白能力。
因此将Cl2和SO2混合使用,不仅不能提升漂白效果,反而会降低甚至失去漂白能力。
学霸推荐
1.下列物质能使品红溶液褪色,且褪色原理基本相同的是
①活性炭②新制氯水③二氧化硫④臭氧⑤过氧化钠⑥双氧水
A.①②④ B.②③⑤ C.②④⑤⑥ D.③④⑥2.下列物质都具有漂白作用,其中漂白原理没有利用物质化学性质的是
A.过氧化钠 B.二氧化硫 C.双氧水 D.活性炭3.下列说法正确的是
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊试液褪色
B.能使品红溶液褪色的不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
D.等物质的量的SO2和Cl2相遇在溶液中具有漂白能力
4.A、B是两种常温下有刺激性气味的气体。
将A通入品红溶液中,品红溶液变为无色;将B通入品红溶液中,品红溶液也变为无色。
将A通入紫色石蕊溶液中,溶液变为红色;
将B通入紫色石蕊溶液中,溶液先变红后褪色。
将A和B按1∶1的体积比充分混合,通入品红溶液中,品红溶液不褪色,通入紫色石蕊溶液中,溶液只变红不褪色。
试回答下列问题:
(1)写出A、B的化学式:A________;B________。
(2)写出A与NaOH溶液反应的化学方程式:______________________或__________________________。
(3)写出B与NaOH溶液反应的离子方程式:___________________________________。
(4)加热通入A后变为无色的品红溶液,现象是________________________;加热通入B
后变为无色的品红溶液,现象是______________________________。
参考答案
1.【答案】C
【解析】新制氯水、臭氧、过氧化钠和双氧水都是利用其强氧化性,使品红褪色。
2.【答案】D
【解析】A.过氧化钠因为强氧化性而具有漂白作用,经它们漂白的物质,不能恢复原来的颜色,发生化学变化,A错误;B.SO2的漂白是由于它跟某些有色物质化合生成了不稳定的无色物质,这些物质受热容易分解而恢复原来的颜色,发生了化合反应,B错误;C.双氧水因为强氧化性而具有漂白作用,经它们漂白的物质,不能恢复原来的颜色,发生化学变化,C错误;D.活性炭具有吸附性而具有漂白作用,是物理变化过程,不涉及化学变化,D正确,答案选D。
3.【答案】B
4.【答案】(1)SO2 Cl2
(2)2NaOH+SO2===Na2SO3+H2O NaOH+SO2===NaHSO3
(3)2OH−+Cl2===Cl−+ClO−+H2O
(4)溶液变为红色无明显变化
【解析】具有漂白作用,能使品红溶液褪色的气体有Cl2、SO2、O3等。
A气体不能使紫色石蕊溶液褪色,
但能使紫色石蕊溶液变红色,所以A为SO2:H2O+SO2H2SO3;B气体使紫色石蕊溶液先变红后褪色,为Cl2:H2O+Cl2===HCl+HClO,HCl使紫色石蕊溶液变红,HClO能使紫色石蕊溶液变为无色。
如果将Cl2与SO2等体积混合,通入溶液中,则发生下列反应:Cl2+SO2+2H2O===H2SO4+2HCl,生成的盐酸和硫酸都没有漂白作用,它们只能使紫色石蕊溶液变红。
