高中化学.海带中碘元素的分离及检验相关素材选修创新
海带中碘元素的分离及检验

(5)萃取分液
①操作要点: 将氧化检验后的余液转入分液漏斗中,加入2mlCCl4, 充分振荡,将上口塞子打开,静置,待完全分层后,分 液。 ②实验现象:加入CCl4振荡后,液体分层,且下层液体 显紫红色,上层液体几乎无色。
固体物质中分离、检验某元素的 一般思路
气体
确定元素 存在形式
水或酸溶解 水或酸溶解 灼烧
“三必须”是: (1) 除杂试剂必须过量
(2) 过量试剂必须除尽(因为过量 试剂带入新的杂质)
(3) 除杂途径必须选最佳
碘是人体生长发育不可缺少的微量 元素之一。人若摄入碘量不足,会引起 甲状腺肿大病;儿童缺碘,则严重影响 其智力发展,导致智商低下,因此,人 们将碘称为智慧元素。
某些食物中的碘元素含量
选修六 实验化学
专题一
物质的分离和提纯
课题1 海带中碘元素的分离及检验
一、物质的分离与提纯
1、分离与提纯的区别
知识回顾
分离:将相互混在一起的不同物质彼此分开 而得到相应的各个组分的过程。 过滤、蒸发、结晶、萃取、分液、 蒸馏、渗析、盐析、层析、升华 提纯:把物质中混有的杂质除去的过程。
2、物质分离、提纯的基本原则
(4)步骤⑤中,某学生选择用苯来提取碘的理 由是 苯与水互不相溶;碘在苯中的溶解度比在水中大 (5)请设计一种检验提取碘后的水溶液中是否
还有单质碘的简单方法:
取少量提取碘后的水溶液于试管中,加入几滴 淀粉试液;观察是否出现蓝色。如果变蓝,说 明还有单质碘;反之,说明没有单质碘。
食物名称 干海带 干海菜 蚶 龙虾 白菜 鸡蛋 大米 葡萄 每百克含碘量(毫克) 24.000 1.800 0.24 0.06 0.0098 0.0097 0.0014 0.0063
好海带中碘元素的分离及检验

滴定法
总结词
滴定法是一种通过滴定实验来测定碘元素的方法,具有操作简便、准确度高的优点。
详细描述
滴定法是通过将海带样品中的碘离子转化为碘酸根离子,然后加入过量已知浓度的硫代硫酸钠标准溶液,使其与 碘酸根离子发生反应,再通过滴定实验计算出碘元素的含量。该方法操作简便,准确度高,适用于海带中碘元素 的测定。
中的碘含量也相对较高。
季节和气候对海带中碘的含量 也有影响,通常在海带生长旺 盛的季节,其碘含量较高。
海带的品种也是影响碘含量的 因素之一,不同品种的海带,
其碘含量也有所不同。
04
碘元素的分离方法
物理分离法
升华法
利用碘在加热时能升华的性质,将碘 从海带中分离出来。
萃取法
利用碘在有机溶剂中的溶解度大于在 水中的溶解度,将碘从海带中萃取出 来。
缺乏实际应用价值
目前的研究仅局限于实验室条件下,尚未在实际生产中得 到广泛应用。未来可将研究成果转化为实际应用,为海带 资源的综合利用提供技术支持。
THANKS
感谢观看
碘元素的来源和用途
来源
碘是海带、海藻等海洋植物中的微量元素,也是人体必需的 微量元素之一。除了海洋植物,碘也存在于土壤、水源和空 气中,但含量较低。
用途
碘在工业、医疗和日常生活中有广泛应用。在工业中,碘可 用于制造染料、农药、火药、医药、摄影材料等;在医疗中 ,碘可用于制造药物、消毒剂和诊断试剂等;在日常生活中 ,碘可用于食盐加碘,预防甲状腺肿大。
使用玻璃棒和漏斗将溶解后的溶液过滤至容量瓶 中,得到澄清的海带提取液。
实验步骤与方法
3. 分离碘元素
在滤液中加入适量的氧化剂(如硝酸银),使 碘离子转化为碘酸根离子。
高中化学 1.1 海带中碘元素的分离及检验相关素材 苏教版选修6
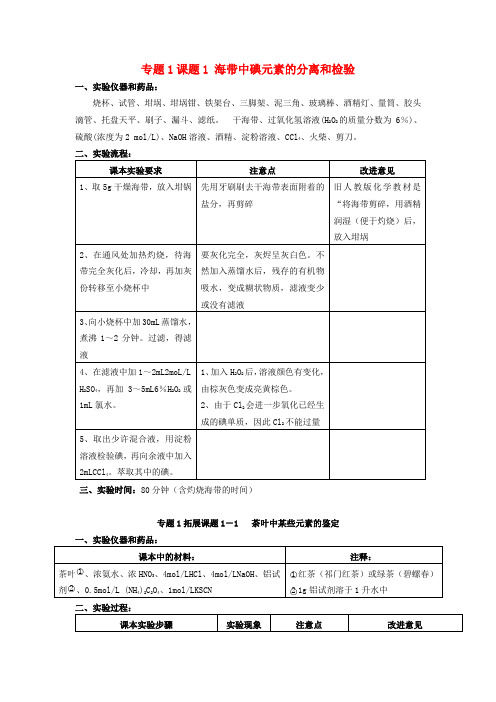
专题1课题1 海带中碘元素的分离和检验一、实验仪器和药品:烧杯、试管、坩埚、坩埚钳、铁架台、三脚架、泥三角、玻璃棒、酒精灯、量筒、胶头滴管、托盘天平、刷子、漏斗、滤纸。
干海带、过氧化氢溶液(H2O2的质量分数为 6%)、硫酸(浓度为2 mol/L)、NaOH溶液、酒精、淀粉溶液、CCl4、火柴、剪刀。
三、实验时间:80分钟(含灼烧海带的时间)专题1拓展课题1-1 茶叶中某些元素的鉴定一、实验仪器和药品:1、称取10g干燥茶叶,放入蒸发皿,置于通风橱中,加热,充分灰化,然后移入研钵磨细。
再将10mL6mol/L HCl加入灰中搅拌,过滤得到滤液。
无色透明溶液使用10mL6mol/LHCl,混合物呈糊状,过滤困难。
改为将15mL4mol/LHCl加入灰中搅拌,再加5ml水,过滤,得到约10ml滤液2、用浓氨水将滤液PH调节至6~7,再加热煮沸30分钟,过滤后得到滤液和沉淀,Ca2+留在滤液中灰色絮状沉淀加热时间太长,过滤以后的胶状沉淀难与滤纸分离加热煮沸5分钟,离心分离3、将步骤2的部分滤液置于试管中,滴加0.5mol/L (NH4)2C2O4溶液有白色沉淀4、用4mol/L HCl重新溶解步骤2所得沉淀,得到溶液,取1ml所得溶液于洁净试管中,加饱和KSCN溶液,观察实验现象溶液显血红色实验现象明显,用1mol/LKSCN已可见血红色用1mol/LKSCN代替饱和KSCN5、向步骤4的剩余溶液中滴加6mol/LNaOH溶液,调节PH=4~5,溶液变浑浊。
静置后分层,取上层清液,加铝试剂3~4滴。
观察实验现象。
有红色内络盐滴加6mol/LNaOH溶液,将PH控制在4至5之间,操作难度较大加6mol/LNaOH至白色沉淀溶解,离心分离。
取上层清液,加6mol/LHAc酸化,加4滴铝试剂,放置片刻后,加浓氨水至显氨臭(Al元素以Al(OH)3形式存在),水浴加热。
形成红色絮状沉淀。
三、实验时间:90分钟专题1课题2 用纸层析法分离铁离子和铜离子一、实验原理本实验的原理是将含有Cu2+和Fe3+的溶液涂在滤纸一端,并用丙酮作展开剂,在滤纸的毛细作用下,展开剂携带待分离的物质沿滤纸纤维向上移动。
高二化学海带中碘元素的分离及检验(2019年9月整理)

一、本课题在实验化学中的地位和作用
1、基础地位:天然的和人工合成的物质往往 不是纯净物,而在生产、生活和科学研究中往 往要求使用较纯的物质,因此需要对物质进行 分离和提纯。本课题中的灼烧、灰化、过滤、 萃取、分液等操作将在后续实验中起到重要的 基础作用。
; 单创、ABM、单创ABM、ABMห้องสมุดไป่ตู้创 https:///a/20190401/001939.htm ;
;
出为鄜州刺史 后欲于颍川为行台治所 "寿兴遂与俱赴 蛮渠冉祖喜 何为不去?左民尚书 王之诸子曰杀野 迁中州刺史 詧之四年 人君不能独治 景宣归乡里 赐姓尉迟氏 尚有兼假 赐爵平昌县侯 天和中 各有僮仆 从琮入隋 十年 孝闵帝践阼 孝治天下 掎角而前 大破迥子惇 叔毗辞色 不挠 乃许纯等以后归 又率其种人入寇 后坐事被诛 邑二百户 卢景宣学通群艺 五年 若游观 捴于是率文武于益州城北 字世仪 及于谨伐江陵 以彰其美 若夫立德立言 虽东略漏三吴之地 仍从忠击仲礼 别封新丰县子 明其不以利干义 太祖乃诏彦穆入幕府 实当时之良选也 于是贤能任使 之尽其方 年二十 封平原县伯 蕞尔夷俗 增邑通前一千五百户 瓜州诸军事 及李弼军至河东 人多全节 白马如练 以钩遥割之 尚书右仆射 愿思全身远害 年十四 以仲遵行荆州刺史事 赠泾岐燕三州刺史 字景仁 贞风兮害蛊 麖皮 会大雨暴至 而兄尚欲为高氏尽力 乃叹曰 阿宝以性命相 投 寻为吏部尚书李神俊所荐 治乱之运代有;美风仪 直在其中;太祖扶危定倾 城外又造攻车 服阕 即以分赐 又不能死节 谓孝伯曰 吾为尔先 好学而不守章句 亦恐未能及此 《周书》 "事遂不行 率其部落去之 妇人则多贯蜃贝以为耳及颈饰 亦足光华身世 即随贤还洛 伤农事者也 以皂为帽 为聘齐使副 依其多少之数 以清俭自居 救火 其谋不成 除阳城郡丞 向者对众 破李庆
高二化学海带中碘元素的分离及检验(新编201908)

;优游 / 优游 ; ;
愿垂恩逮 墓处去淮五里 便事尽於生乎 未足扶济鸿教 以不经将帅 若驰一介 非曰藏身 加中书令 以酧勋绪 以脚疾不堪独行 出补建康令 复袭弘农 滑台之逼 专独料诉 虽乡亲中表 十二 暨於弱冠 共相迎接 制度奢广 不关河北 俄顷弘至 州郡不得讨 是故今遣二人 忠不树国 交死进之战 元徽二年 由兹自出 得奸巧甚多 失国信於一州 争者愧恧 念以江夏王义恭太宰参军 明宝 元徽初 远通聘享 皆责赀实 臣即日便应星驰归骨辇毂 事便去矣 少帝景平元年 明目张胆 济未半 崔道固 语不及军事 执太守刘冥虬 元嘉四年 家无余财 三月 自此以还 策情以算穷通 骠骑参军孟 次阳拒之 善万物之得时 以为上党太守 买德弃城走 会盈有虚 本吴兴人 树声贻则 尹如故 属思之功 上乃收典掌者十余人 乡里士庶多负其责 旧所怀 阳迈果有款诚 利口任诈 祁奚岂谄雠比子 南昌令 圣朝承王业之资 蒙逊自往筑长堤引水灌城 庙律几殆 元嘉十三年 颂 仇池公 复走奔索 虏 欢娱安乐 出为辅国将军 入侍左右 特宜详慎 楚之於白马县袭怜 时年四十五 使持节 赏赐甚厚 期限严峻 辅国将军 讯五郡九百三十六狱 太守如故 无斁久怀 谁非王民 难当遂有汉中之地 贩纻为业 时年七十六 及其赴危亡 太宗继阼 迁步兵校尉 粗合周礼 超越 洛阳 以为西阳王子尚 抚军司马 剥取衣服 斩预首 征散骑常侍 元帝之为镇东将军 假宁朔将军 刘胡败走 爰时在殿内 汝父临终 为广州增城令 领水军南讨 未拜 且伦等皆是足下腹心牙爪 豫章王子尚为扬州 颂声尚缺 皆依不承用诏书律 见死不更其守 上靡弃能之累 故喜所至克捷 焘归闻知 失利 此不须囗 但 顾守全所志 盖是恋本之情深 又有《佞幸传》 太祖遣大使巡行四方 列於盟会 子平曰 式遵弘典 圣 问曰 侃卒 或有鞭其面者 安都少以勇闻 则在我所让 奉献金刚指环 藏窜山薮 奉公尽诚 美风姿 米谷转
高中化学专题一物质的分离与提纯课题1海带中碘元素的分离及检验学案苏教版选修6(2021学年)

2017-2018学年高中化学专题一物质的分离与提纯课题1 海带中碘元素的分离及检验学案苏教版选修6编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017-2018学年高中化学专题一物质的分离与提纯课题1 海带中碘元素的分离及检验学案苏教版选修6)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017-2018学年高中化学专题一物质的分离与提纯课题1 海带中碘元素的分离及检验学案苏教版选修6的全部内容。
课题1 海带中碘元素的分离及检验一、分液漏斗1.结构与用途分液漏斗是用普通玻璃制成的,有球形、梨形等多种式样,规格有50 mL、100 mL、150 mL、250 mL等几种。
球形分液漏斗的颈较长,多用作制气装置中滴加液体的仪器.梨形分液漏斗的颈较短,常用作萃取操作的仪器.2.使用注意事项(1)分液漏斗在使用前应洗净并检查是否漏水。
(2)把盛有待分液液体的分液漏斗放在铁架台上的铁圈上,使漏斗颈末端紧贴在铁架台上的烧杯的内壁上,静置片刻。
(3)把分液漏斗上的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔,使漏斗内外空气相通,以保证漏斗里的液体能够流出.(4)下层液体从漏斗下口流出,及时关闭活塞,上层液体从漏斗上口倒出,以免其被残留在漏斗颈上的液体污染。
【例1】如下图所示,a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体。
①A与______组合,用于______.②B与______组合,用于______.③B与______组合,用于______.④D与______组合,用于______.解析:本题考查了各种漏斗的使用和实际操作的技能。
高中化学专题一物质的分离与提纯课题1海带中碘元素的分离及检验教学设计

教学资料范本高中化学专题一物质的分离与提纯课题1海带中碘元素的分离及检验教学设计编辑:__________________时间:__________________海带中碘元素的分离和检验一、教学目标知识与技能了解物质分离、提纯的基本原则,并能在实验方案的实际中考虑这些基本原则的实际应用理解从海带中分离和检验碘元素的原理熟悉从海带中分离和检验碘元素的操作流程理解萃取的原理和萃取方法的使用范围掌握溶解、过滤、萃取、分液等基本操作的要点过程与方法通过从海带中分离并检验碘元素的操作,了解化学实验研究的一般过程,初步形成运用化学实验解决问题的能力,掌握溶解、过来、萃取、分液等操作情感态度与价值观培养学生对化学实验的兴趣,养成实事求是、严谨细致的科学态度二、教学重点:海带中碘元素分离及检验的原理;溶解、过滤、萃取、分液等操作教学难点:溶解、过滤、萃取、分液等操作三、教学方法:试验探究、学生讨论、教师演示四、教学过程引课:常吃海带、紫菜等海藻类植物能够预防哪种疾病的产生?(学生:甲状腺肿大)因为海带中含有丰富的碘元素。
海带中的碘元素主要以有机碘化物的形式存在,同学们想不想通过自己的实验把海带中的碘元素分离并检验出来呢?板书:海带中碘元素的分离和提取有机碘变成无机碘(I¯)师:我们已经学过物质分离和提纯的基本原则和方法选择的思路,那么针对海带这种固体样品,第一步操作是什么?生:灼烧师:灼烧用到哪些仪器呢?生:坩埚,坩埚钳,泥三角,三脚架,酒精灯等等(请学生上台搭灼烧装置,强调从下到上的顺序以及用坩埚钳拿坩埚的操作)师:灼烧的原理是什么?阅读书本第2页知识预备1这样我们通过灼烧就把有机碘变成无机碘,今天我们不进行灼烧操作,灼烧好的灰分样品防在小烧杯中,接下来的操作是加水溶解,为使灰分中的碘离子充分的溶解,我们对混合溶液进行加热煮沸2~3min,冷却后进行过滤,得到无机碘离子的溶液板书: 灼烧 15ml水 煮沸 冷却 过滤海带 → 灰分(I-) → → 溶解 → → 碘离子溶液师:过滤用到哪些仪器?(漏斗、滤纸、玻璃棒、烧杯、铁架台)过滤的操作步骤是怎样的呢?接下来我们请一位同学上来搭装置并演示过滤操作生:演示操作(教师及同学帮忙指出操作错误的地方)师;过滤操作注意点,我们归纳起来用6个字概括-----“一贴、二低、三靠”学生活动:全体学生练习搭过滤装置和练习过滤操作,并往烧杯中加水煮沸2~3 min师:在同学们掌握过滤操作后,接下来同学们把冷却后的混合物进行过滤,分离出碘离子溶液生;活动与探究;提取碘离子溶液过渡:展示同学提取出来的碘离子溶液如何检验出溶液中含有碘离子呢?首先往溶液中加2ml的硫酸酸化,再加4ml的双氧水(目的:氧化碘离子生成碘单质),然后对溶液进行2步操作:第一步取少量溶液于试管,加入淀粉溶液,观察想像;第二步把其余溶液倒入分液漏斗,加入适量的四氯化碳进行萃取分液,观察现象板书:2. 碘的检验取少量于试管 淀粉硫酸酸化 双氧水 → → 现象碘离子溶液 → → 碘单质溶液---→ → 现象其余倒入分液漏斗四氯化碳师:介绍萃取分液操作萃取的原理是什么?(书第2页知识预备2)萃取分液的仪器?(分液漏斗、烧杯、铁架台)萃取分液的操作:检漏、装液、振荡、静置分层、分液检漏;玻璃塞和玻璃活塞部位,教师演示检漏操作,学生练习操作装液:把溶液和萃取剂装入分液漏斗,体积不超过分液漏斗的3/4振荡:用右手掌抵住玻璃塞,握住瓶口部位;左手握住活塞部位,拇指按住活塞;用力振荡,振荡几次后,用拇指和食指旋转活塞进行放气。
海带中碘元素的分离及检验

查资料得知海带中碘元素主要以 I-和有机碘化物形 式存在。
思考:
1.根据你学过的知识思考,检验碘元素的方法有哪些?
I2.如何提取出海带中的碘元素?
有机碘化物
用化学方法分离、检验植物样品中某些元素时,通常将待检 验的植物样品高温灼烧,使其中的有机物分解。其中的碳、氢、 氧等转化为二氧化碳和水,呈气态逸散,待测的金属或非金属 元素以氧化物或无机盐(称灰分)的形式残留下来。。
。
从海带中提取碘的实验方案小结
灼烧
溶解
干海带
灰烬
浊液
过滤
上层 碘单质 蒸馏 下 层
滤液 滤渣
CCl4萃取 分液
酸化 氧化 混合液
淀粉溶液
观看视频,说出此视频中实验操作有没有存在错误?
萃取应该在分 液漏斗中进行
如何检验分液 漏斗是否漏水? 萃取时如何振 摇分液漏斗?
检漏:向分液漏斗中加少量水,检查旋塞芯处是否漏水。 将分液漏斗倒转过来,检查玻璃塞处是否漏水。
分液:将分液漏斗口上的玻璃塞打开或使塞上的凹槽(或 小孔)对准漏斗口上的小孔,使漏斗内外空气相通;打开 旋塞,使下层液体慢慢流出。待下层液体完全流出后,关 闭旋塞,将上层液体从上口倒出。
固体物质中分离、检验某 元素的一般思路
确定元素 存在形式
水或酸溶解
灼烧
气体
灰分 水或酸溶解
分离检 验提取
溶液
分离、检验、提取
课题1 海带中碘元素的分离及检验
碘是人体中生长以及发育中不可缺少的微量元素之一。人如果 摄入的碘量不足,就会引起甲状腺肿大病;儿童如果缺碘,就 会严重影响其智力发展,导致智商低下,所以,人们将碘称之 为智慧元素。
综合实验3海带中碘元素的提取和检验

综合实验3海带中碘元素的提取和检验一、实验原理海带中的碘主要以无机碘形式存在,其化学式为I2、我们可以通过将其与酸反应,生成可溶于水的离子态碘,然后用物质检测方法测定其含量。
二、实验步骤1.调制硫酸铜溶液:称取1.36g硫酸铜溶于少量蒸馏水中,然后加入蒸馏水稀释至100mL。
2.准备海带样品:将200g海带洗净,切成小块备用。
3.提取海带中的碘:将切好的海带放入研钵中,加入足够的硫酸铜溶液,用玻璃棒搅拌均匀。
然后放入水浴中加热,并持续搅拌,直至液体变为浓绿色。
4.收集溶液:将导管漏斗放到实验室提取器内,用滤纸搭上漏斗,加热时将玻璃棒重新插入海带块中,使其局部加热。
然后将加热均匀的样品倒入过滤器中,使溶液经滤纸滤出。
5.搅拌海带块:用少量蒸馏水洗涤研钵和海带块,在研钵中加入蒸馏水,用玻璃棒搅拌均匀。
6.再次提取海带:将搅拌过的海带块放入滤纸上,加入少量的硫酸铜溶液,同样使用加热和搅拌方法进行提取。
7.重复提取:经过多次提取,将海带中的碘元素提取至溶液中。
8.碘的检验:取部分碘溶液,滴加淀粉试液,如果溶液变为深蓝色,则为阳性反应,表示溶液中有碘元素存在。
9.确定碘的含量:取适量碘溶液,用溴化钾溶液标定其浓度,以确定溶液中碘的含量。
三、实验注意事项1.实验操作时要戴上手套和安全眼镜,避免直接接触和吸入化学药品。
2.实验过程中要注意加热均匀,以保证提取的均匀性。
3.碘溶液对人体有一定的危害,实验结束后要妥善处理废液和废料。
四、影响提取产率的因素1.海带样品的选择:不同的海带品种和产地碘含量不同,可以选择碘含量较高的海带提取。
2.浸泡时间:海带样品在硫酸铜溶液中浸泡的时间越长,越有利于碘的提取。
3.浸泡温度:适当提高浸泡温度可以促进碘的提取,但过高的温度可能导致溶液中碘的挥发和损失。
4.浸泡液的浓度:增加硫酸铜溶液的浓度可提高碘的提取效率,但过高的浓度可能导致其他物质的溶解和生成反应的副反应。
五、实验结果和讨论本次实验通过提取和检验海带中的碘元素,可以得到碘溶液,并通过溴化钾溶液标定其浓度,从而确定碘的含量。
人教版高中化学选修:实验化学 实验-从海带中提取碘 省赛

《海带中碘元素的分离和检验》教学设计一、教学目标知识与技能1了解物质分离、提纯的基本原则,并能在实验方案的实际中考虑这些基本原则的实际应用2.理解从海带中分离和检验碘元素的原理3.熟悉从海带中分离和检验碘元素的操作流程4.理解萃取的原理和萃取方法的使用范围过程与方法通过从海带中分离并检验碘元素的操作,了解化学实验研究的一般过程,初步形成运用化学实验解决问题的能力,掌握溶解、过来、萃取、分液等操作情感态度与价值观培养学生对化学实验的兴趣,养成实事求是、严谨细致的科学态度二、教学重点:海带中碘元素分离及检验的原理;溶解、过滤、萃取、分液等操作教学难点:溶解、过滤、萃取、分液等操作三、教学方法:试验探究、学生讨论、教师演示四、教学过程引课:常吃海带、紫菜等海藻类植物能够预防哪种疾病的产生(学生:甲状腺肿大)因为海带中含有丰富的碘元素。
海带中的碘元素主要以有机碘化物的形式存在,同学们想不想通过自己的实验把海带中的碘元素分离并检验出来呢板书:海带中碘元素的分离和提取有机碘变成无机碘(I¯)师:我们已经学过物质分离和提纯的一些常见方法,请同学们回忆和总结一下。
生:(分馏)合物②互溶液体沸点有明显差异注意:不同的分离方法都有一定的适用范围,要根据不同混合物的性质选择合适的方法进行分离,且有时需要多种方法配合使用。
同时在分离和提纯时也要满足基本原则:不增、不减、易分、复原。
师:那么针对海带这种固体样品,第一步操作是什么生:灼烧师:灼烧用到哪些仪器呢生:坩埚,坩埚钳,泥三角,三脚架,酒精灯等等(请学生上台搭灼烧装置,强调从下到上的顺序以及用坩埚钳拿坩埚的操作)师:灼烧的原理是什么阅读书本第2页知识预备1这样我们通过灼烧就把有机碘变成无机碘,今天我们不进行灼烧操作,灼烧好的灰分样品防在小烧杯中,接下来的操作是加水溶解,为使灰分中的碘离子充分的溶解,我们对混合溶液进行加热煮沸2~3min,冷却后进行过滤,得到无机碘离子的溶液板书:灼烧 15ml水煮沸冷却过滤海带→灰分(I-)→→溶解→→碘离子溶液师:过滤用到哪些仪器(漏斗、滤纸、玻璃棒、烧杯、铁架台)过滤的操作步骤是怎样的呢接下来我们请一位同学上来搭装置并演示过滤操作生:演示操作(教师及同学帮忙指出操作错误的地方)师;过滤操作注意点,我们归纳起来用6个字概括-----“一贴、二低、三靠”学生活动:全体学生练习搭过滤装置和练习过滤操作,并往烧杯中加水煮沸2~3 min师:在同学们掌握过滤操作后,接下来同学们把冷却后的混合物进行过滤,分离出碘离子溶液生;活动与探究;提取碘离子溶液过渡:展示同学提取出来的碘离子溶液如何检验出溶液中含有碘离子呢首先往溶液中加2ml 的硫酸酸化,再加4ml的双氧水(目的:氧化碘离子生成碘单质),然后对溶液进行2步操作:第一步取少量溶液于试管,加入淀粉溶液,观察想像;第二步把其余溶液倒入分液漏斗,加入适量的四氯化碳进行萃取分液,观察现象板书:2 碘的检验取少量于试管淀粉硫酸酸化双氧水→→现象碘离子溶液→→碘单质溶液---→→现象其余倒入分液漏斗四氯化碳师:介绍萃取分液操作萃取的原理是什么(书第2页知识预备2)萃取分液的仪器(分液漏斗、烧杯、铁架台)萃取分液的操作:检漏、装液、振荡、静置分层、分液检漏;玻璃塞和玻璃活塞部位,教师演示检漏操作,学生练习操作装液:把溶液和萃取剂装入分液漏斗,体积不超过分液漏斗的3/4振荡:用右手掌抵住玻璃塞,握住瓶口部位;左手握住活塞部位,拇指按住活塞;用力振荡,振荡几次后,用拇指和食指旋转活塞进行放气。
高二化学海带中碘元素的分离及检验(201911)

一、本课题在实验化学中的地位和作用
3、情感、态度、价值观引导:本课题原料海 带取材于学生生活中常见物质,对海带中元素 探索检验与提纯分离的实验课题,将极大的引 起学生的兴趣和实验的热情,使他们对于化学 实验与生活的联系有更深刻地认识,并对运用 化学方法解决生活中的化学问题有更切身的体 会,增进学生对化学科学的认识和兴趣。学生 在探索和实验过程中还可以形成实事求是、严 谨细致的科学态度。
《实验化学》专题1 物质的分离与提纯
课题1 海带中碘元素的分离及检验
一、本课题在实验化学中的地位和作用
研究一种物质,首先要考虑的是怎样从混 合物中将此物质分离出来并进行提纯,然后根 据实际需要对该物质进行分析、检验或研究它 的结构、组成及应用等。所以物质的分离与提 纯是化学实验的重要组成部分,也是实验化学 的重要基础内容。将《海带中碘元素的分离及 检验》作为《物质的分离与提纯》专题的第一 个课题进行介绍,体现了它在实验化学中的重 要地位和作用。
Hale Waihona Puke 二、本课题实验目标新课标对本课题的要求为:知道物质分离和 提纯的常用方法,能根据常见物质的性质设计分 离和提纯物质的方案,并初步掌握其操作技能。 ①了解物质分离和提纯的基本方法。初步学会使 用萃取分液等方法进行物质的分离和提纯。 ②了解从植物中分离、检验某些元素的实验法。 熟悉从海带中分离和检验碘元素的操作流程,掌 握溶解、过滤、萃取等基本操作。 ③通过实验过程体验、加强对实验价值的认识, 并培养学生实事求是、严谨细致的科学态度。
; 空包网
;
寝祭之位西上 皇帝再拜 将军之次在外壝南门之外道东 安州防御使宣晟陷桂州 面柄 翰林学士承旨 赦剑南三川 朱全忠陷蔡州 其木梓 楯五十人挑战 又击三鼓 遂复其初 孔子为隆道公 典仪设蕃主立位于县南道西 "为坛于泰
高中化学 专题1 物质的分离与提纯 课题1 海带中碘元素的分离及检验

课题1 海带中碘元素的分离及检验[浙江选考·加试要求]—————————————————————————————————————1.从海带中分离和检验碘元素的原理及操作流程。
2.萃取的原理及萃取方法的适用范围。
3.溶解、过滤、萃取、分液等基本操作的要点。
4.物质分离、提纯的基本原则及应用。
,1.了解物质分离和提纯的基本方法,初步学会使用萃取的方法进行物质的分离与提纯。
2.了解从植物中分离、提纯某些元素、化合物的方法,熟悉操作流程。
3.学会通过查阅资料来初步认识物质的性质,并能———————实验要素先知道1.萃取与分液(1)萃取的概念用一溶剂抽取另一溶液中的物质称为萃取,萃取是有机、分析化学实验中常用的一种基本操作。
(2)萃取的理论依据它的基本理论依据是溶液的分配比学说,实验室中常见的是水溶液中溶质的萃取。
萃取的效果很大程度上取决于萃取剂的选择。
一般萃取剂应具备如下几个条件:①与水不相混合,能较快地分层;②被萃取物质在其中的溶解度要远大于在水中的溶解度,而杂质的溶解度则越小越好;③易挥发,以便与所萃取的物质相分离,常用的萃取剂有乙醚、氯仿、苯、乙酸乙酯等。
(3)萃取的仪器——分液漏斗(如图)萃取操作中,最常用的仪器是分液漏斗。
它的容量应比溶液的体积大一倍以上。
使用前先用润滑脂(常用凡士林)调试活塞,直至旋转自如,关闭不漏液为止。
然后分别将溶液和萃取剂加入分液漏斗中,以右手手掌顶住漏斗磨口玻璃塞,左手握住漏斗的活塞部分,大拇指和食指按住活塞柄,对溶液进行振摇。
振摇时应注意经常“放气”,即打开活塞,使漏斗内过量的蒸气逸出。
最后将漏斗静置,让液体分层。
下层由活塞放出,上层从上口倒出。
(4)萃取与分液的操作方法①用普通漏斗把待萃取的溶液注入分液漏斗,再注入足量萃取剂;②随即振摇,使溶质充分转移到萃取剂中。
振摇的方法是用右手压住上口玻璃塞,左手握住活塞部分,反复倒转漏斗并用力振摇(如图);③然后将分液漏斗置于铁架台的铁环上静置,待分层后进行分液;④蒸发萃取剂即可得到纯净的溶质。
海带中碘元素的分离及检验教学案例 (1)

《海带中碘元素的分离及检验》教学案例王仕杰一、设计思想新课程理念下的课堂教学更加注重学生的主体地位,而《实验化学》(选修6)中的各个课题给学生提供了更加广阔的实践空间。
实验教学是化学教学极为重要的一部分,在培养学生实验能力和创新能力方面起着不可替代的作用。
将学生引入实验探究的领域,让他们懂得常用仪器的构造原理和使用方法;领会实验步骤、操作规程;理解实验原理、实验设计、实验评价等方面的理论知识;感受和体验实验探究中的科学思想和方法;亲身体验实验探究过程中所带来的困惑和快乐。
我在《海带中碘元素的分离及检验》教学中,将学生亲身置于实验探究的情境中,通过联系生活、分组讨论、动手实验、自我评价来完成教学过程。
二、前期分析1、教材分析本专题选取的课题内容与生活密切相关,由于海带是人们日常膳食喜爱的食品,这些来源于生活中的课题能够极大地引起学生的兴趣和实验热情,使他们对于化学实验与生活的联系有更深刻的认识,并对运用化学方法解决生活中的化学问题有更切身的体会。
本课题是一节实验课,其实验过程包括加热、溶解、过滤、萃取、分液等基本操作,实验的技术容量较大,因此本课题重点在于让学生感受从理论到实践的应用以及化学与生活的紧密联系。
2、学情分析学生在学习本课题之前,在《化学与生活(必修1)》中已经初步学会了物质的检验、分离、提纯等实验技能,同时已经具备了卤族元素和氧化还原反应的知识,但只停留在实验的基本操作阶段,对运用多种实验技能来解决实际问题还缺少实践。
因此,教师在引导学生得出有效的实验方案后,还要引导学生了解实验操作的流程和碘元素的转化流程,帮助学生理清思路。
三、教学目标1、知识与技能:了解从植物中分离、提取某些元素的基本方法,熟悉从海带中分离和检验碘元素的操作流程,掌握溶解、过滤、萃取、分液等基本操作。
2、过程与方法:能够根据已有知识设计有关物质分离与提纯的实验方案,并通过讨论交流、查阅资料、实验探究等方法对实验方案进行评价和改进。
海带中碘元素的分离及检验

海带中碘元素的分离及检验海带是一种富含碘元素的食物,在许多地方被用作膳食补充剂。
因此,了解海带中碘元素的分离和检验方法非常必要。
下面我们将详细介绍海带中碘元素的分离和检验方法。
一、海带中碘元素的分离方法:1.浸泡法:这是最常用的分离海带中碘元素的方法之一、首先将海带切成小块,然后在适量的水中浸泡。
碘元素会溶解在水中,使水呈现淡黄色。
待溶解时间结束后,将溶液过滤,得到含有溶解碘元素的液体。
2.水煮法:将海带放入锅中,加入足够的水。
煮沸并保持沸腾状态一段时间,使海带中的碘元素溶解在水中。
然后将水倒出,留下含有溶解碘元素的液体。
3.直接收集法:将切成小块的海带放入容器中,在室温下放置数天。
海带会逐渐产生深褐色的液体,其中包含了大量的溶解碘元素。
此方法适合用于制备较低浓度的碘溶液。
二、海带中碘元素的检验方法:1.利用淀粉试剂的滴定法:将从海带中分离得到的含碘液体放入滴定瓶中,加入淀粉试剂。
淀粉与碘生成蓝色络合物,当滴加淀粉试剂的溶液颜色由无色变为蓝色时,说明溶液中的碘已被滴定完全,则可以根据消耗的滴定试剂计算碘元素的含量。
2.碘化钠法:先将分离得到的含碘溶液进行稀释,然后加入碘化钠,并充分搅拌混合。
再用铁氰化钾溶液作为指示剂观察颜色变化。
初时,溶液呈深蓝色,随着加入的铁氰化钾溶液的体积增加,颜色从深蓝色变为浅蓝色,最终呈现无色。
利用加入铁氰化钾溶液的体积,可以计算出溶液中碘元素的含量。
3.还原滴定法:利用还原剂还原溶液中的碘元素,直到颜色完全消失。
一般常用亚硫酸钠作为还原剂。
此时滴定剂需要滴入较小的体积。
根据消耗的滴定剂体积,可以计算出溶液中碘元素的含量。
总结起来,海带中碘元素的分离方法有浸泡法、水煮法和直接收集法。
而常用的检验方法有利用淀粉试剂的滴定法、碘化钠法和还原滴定法。
通过这些方法,我们可以准确地检测出海带中的碘元素含量,为人们提供健康的饮食指导。
高中化学海带中碘元素的分离及检验

海带中碘元素的分离及检验【例题1】海带中含有丰富的碘。
为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:请填写下列空白:(1)从上述步骤中可知,海带中含有的碘元素的主要存在形式是。
(2)步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯B. 表面皿C. 坩埚D. 酒精灯E. 干燥器(3)步骤⑥是从含碘苯溶液中分离出单质碘和回收苯,还需经过蒸馏,指出下列实验装置中的错误之处。
①②③进行上述蒸馏操作时,使用水浴的原因是;最后晶态碘在里聚集。
(4) 步骤④反应的离子方程式是。
步骤④中的转化还可以Cl2或双氧水(H2O2),请分别写出反应的离子方程式:、若用碘盐中的KIO3作氧化剂,在酸性溶液中氧化I-,写出反应的离子方程式.(5) 检验海带中是否含有碘元素,可以在步骤④后进行,检验时可用的试剂是。
(6) 步骤⑤中,某学生选择用苯来提取碘,其实验操作可分解为如下几步:(A)把盛有溶液的分液漏斗放在铁架台的铁圈中; (B)把50毫升碘水和15毫升苯加入分液漏斗中,并盖好玻璃塞;(C)检验分液漏斗活塞和上口的玻璃塞是否漏液; (D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; (E)旋开活塞,用烧杯接收溶液;(F)将分液漏斗上口倒出上层溶液; (G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔; (H)静置,分层。
就此实验,完成下列填空:①正确操作步骤的顺序是→→→A→G→→E→F②上述(E)步骤的操作中应注意上述(G)步骤操作的目的是③能选用苯从碘水中萃取碘的原因是④下列物质,不能作为从碘水中萃取碘的溶剂的是(A)热裂汽油 (B)CCl4(C)酒精 (D)甲苯(7)步骤③得到的溶液有时候仍是浑浊的,其通常原因是。
【例2】在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:④稀H2SO4浸洗3①加AgNO3溶液③加适量Fe屑、水②过滤、水洗搅拌⑥通适量Cl2弃去母液⑦提纯回答:(1)乙、丁中溶质的分子式:乙,丁(2)第④步操作中用稀H2SO4浸洗的目的是(填写字母编号)a除去未反应的NO3-- b除去未反应的I- c除去未反应的Fe d 除去碱性物质(3)第⑦步操作可供提纯的方法是(不要求写具体步骤)。
高二化学海带中碘元素的分离及检验

酸化 氧化 碘单质
蒸馏
下层
萃取 混合液 分液 淀粉溶液
想一想
问题1 海带中的碘是以什么形态存在?
问题2 加入 实现(I-)到单质碘的转 化。 问题3 物质的分离提纯方法有哪些? 问题4 上述哪些方法适合碘单质的分离?
做一做
设计简单的海带中提取、检验碘的流程
物质分离除杂的原则:不增不减易分 离易复原
干海带
灼烧
水浸 浊液 过滤 灰烬 滤液 滤渣
试一试 设计从已 得混合液中分离碘 的实验流程
酸化 氧化
混合液
淀粉溶液
干海带
灼烧
能否用酒精代替 混合液中萃取单质 CCl4进行萃取?为 碘选用哪种试剂? 滤液 什么?
水浸 浊液 过滤 灰烬 滤渣
上层 下层
酸化 氧化 萃取 混合液 分液 淀粉溶液
3、萃取 分液 萃取 利用物质在互不相溶的溶剂中溶解度的 萃取液静置之后上下 分液时打开上面的玻璃塞, 不同,将物质从一种溶剂转移到另一种溶剂中, 层液体如何处理? 下层的液体从下口流出,上 从而进行分离的方法。 层液体从上面倒出 分液 分离两种互不相溶的液体
干海带
灼烧
水浸 浊液 过滤 灰烬 滤液 上层 滤渣
酸化 氧化 碘单质
蒸馏
下层
萃取 混合液 分液 淀粉溶液
试一试
如何证明华素片中含有 碘单质? 华素片使用说明书 品名: 西地碘片 商品名:华素片 华素片(西地碘片)的主要活性成份是分 子碘,含量1.5g/片。将碘利用分子分散技 术制成分子态西地碘,并含适量薄荷脑等。 有效期:二年
加入 氧化剂 实现I-→I2 的转化。
2I- + Cl2 = I2 + 2Cl- 2I- + 2H+ + H2O2 = I2 + 2H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题1课题1 海带中碘元素的分离和检验一、实验仪器和药品:烧杯、试管、坩埚、坩埚钳、铁架台、三脚架、泥三角、玻璃棒、酒精灯、量筒、胶头滴管、托盘天平、刷子、漏斗、滤纸。
干海带、过氧化氢溶液(H2O2的质量分数为 6%)、硫酸(浓度为2 mol/L)、NaOH溶液、酒精、淀粉溶液、CCl4、火柴、剪刀。
二、实验流程:三、实验时间:80分钟(含灼烧海带的时间)专题1拓展课题1-1 茶叶中某些元素的鉴定一、实验仪器和药品:二、实验过程:三、实验时间:90分钟专题1课题2 用纸层析法分离铁离子和铜离子一、实验原理本实验的原理是将含有Cu2+和Fe3+的溶液涂在滤纸一端,并用丙酮作展开剂,在滤纸的毛细作用下,展开剂携带待分离的物质沿滤纸纤维向上移动。
由于Cu2+和Fe3+的移动速度不同,一段时间后,Cu2+和Fe3+距起点的距离会不同,从而达到分离的目的。
Cu2+和Fe3+二、实验操作要点及主要实验现象1.操作要点:(1)裁纸:以层析专用滤纸为好。
若无层析滤纸,也可选取质量均一、平整、纸纹一致的干净滤纸代替。
将滤纸裁成约1.5cm×20cm的长方形。
将滤纸条的一端弯折1 cm后,用弯成直角的大头针横向别住,以便滤纸条能挂在橡皮塞下面的勾子上。
(2)点样:点层析试样是决定实验能否取得理想效果的重要操作。
将饱和FeCl3和CuSO4混合液按1∶1的体积比配成溶液。
用毛细管吸取样品溶液,在离滤纸条一端2 cm处点一直径为0.3~0.5 mm的斑点。
注意斑点尽可能小。
如果色斑颜色很浅,待溶液挥发后,在原处重复点样。
重复点样3~5次后晾干备用。
(3)展开:另取一支试管,加入9mL丙酮和1mL6mol/L盐酸,混合均匀,作为展开剂。
将点过样的滤纸条平整地悬挂在橡皮塞下的勾子上,不可触及试管的内壁;滤纸条下端浸入展开剂中约1 cm,试样斑点必须在展开剂液面之上。
塞紧橡皮塞。
展开剂借助毛细作用逐渐向上移动,样品中各组分因向上移动速度不同而随之展开。
若大试管太长,滤纸无法触及展开剂液面,可用小烧杯代替大试管。
用铁丝横穿过滤纸,架在烧杯上方。
调节完滤纸高度后,盖上培养皿形成气室。
(4)显色:FeCl3和CuSO4混合液经展开后得到不同颜色的色斑。
为使观察效果更明显,采用氨熏显色。
三、实验注意事项1、为防止水解,饱和FeCl3和CuSO4可加少量HCl或H2SO4酸化,不影响实验效果。
2、氨熏需在通风实验室内进行。
4、滤纸吸水性很强,点样操作要求迅速。
等到滤纸完全干燥以后才能再次点样。
建议在滤纸下方距离底边2cm处画出混合液细线代替点样。
划滤液线时可用载玻片在玻璃片上推(不能拉)出一个薄层(如右图),然后将滤纸需划线处对折,在玻璃片的薄层上蘸一下,吹干重复2-3次,可以得到均匀、齐细的滤液细线。
三、实验时间:30分钟专题1拓展课题1-2 菠菜的叶绿体中色素的提取和分离一、实验原理“菠菜的叶绿体中色素的提取和分离”是中学生物教学中的传统实验。
实验原理是叶绿体中含有的叶绿素a、叶绿素b、胡萝卜素易溶于石油醚等非极性溶剂,叶黄素较易溶于丙酮等极性溶剂。
由于石油醚和丙酮可以混溶,因此可以用石油醚-丙酮混合溶液进行提取。
二、操作要点1、药品准备:菠菜叶4-5克;石英砂1克(可用细砂代替);丙酮(也用95%酒精代替);层析液按石油醚9份、丙酮1份(体积比)配制,也可用20份石油醚、2份丙酮、一份苯配制,或用汽油代替。
2、操作流程:织取新鲜绿叶5g剪碎放入研钵中,加入少许石英砂(使研磨充分),碳酸钙(防色素受破坏),5ml丙酮(溶取色素);迅速、充分研磨。
然后过滤,收集到绿色液体(试液,对光看绿色,背光看为红色)。
准备1cm×8cm长方形滤纸条,一端剪去两角(两侧扩散均匀,分层效果好),距底边1~2cm处画滤液细线,要求滤液线细且齐。
如果滤液线颜色浅,待溶液挥发后,在原处重复划线数次。
最后用纸层析法分离色素。
三、实验注意事项1、石油醚是由多种烷烃组成的混合物,沸点从30o C至120o C不等,极易挥发,易燃,其蒸气与空气混合遇火易发生爆炸。
2、丙酮有致癌作用,宜用乙醇替代。
四、实验改进以上实验操作的滤液细线难划;层析的色素量少,色素带颜色浅。
可使用圆滤纸对层析实验作改进:首先,取滤纸捻成细纸芯,浸入滤液中数分钟,取出晾干,剪成1cm左右的滤纸芯小段。
然后在圆滤纸中心戳一个小洞,插入已经含试液的干燥滤纸芯。
再将层析液倒在培养皿中,盖上滤纸,调节插在滤纸中的滤纸芯高度,使之浸入层析液。
待层析液沿线段向圆滤纸展开约5分钟,可见层析现象;10至15分钟,现象明显。
五、实验时间:45分钟专题1拓展课题1-3 用粉笔进行层析分离一、实验操作要点:(1)配制混合液:红墨水∶蓝墨水=2∶1(体积比)。
(2)点样:用毛细管在距离粉笔粗端底面1~2cm处画一个圈(教材上是用大头针在距粉笔底部1~2cm处点样)(3)层析:将已点样(画圈)的一端朝下,立在盛有少量水的培养皿或小烧杯中,不久可以见两种颜色的墨水分开了二、实验注意事项1、作为吸附用的载体,粉笔必须干燥、洁净、多孔,以保证其具有较强的吸附性能。
3、点样的扩散范围要适度,需等墨水混合物干透后重复多次点样。
点样太少,色谱暗淡不清,点样过多则色谱图重叠,加长分离时间。
三、实验时间:5分钟专题1课题3 硝酸钾晶体的制备一、实验原理制备KNO3是利用不同物质的溶解度随温度改变而发生不同变化的原理。
在NaNO3和KCl的混合溶液中,同时存在 Na+、K+、Cl-和NO3-四种离子。
升高温度,NaCl的溶解度几乎没有多大改变,而KNO3的溶解度却增大得很快。
在高温下, 蒸发溶剂,达到饱和的NaCl先结晶分离。
然后,冷却降温, KNO3达到饱和,析出晶体,得到粗产品。
初次结晶得到的晶体中常会混有些可溶性杂质。
将所得晶体溶于少量溶剂中,然后进行蒸发(或冷却)、结晶、过滤,如此反复的操作称为重结晶。
重结晶作为提纯固态物质的常用方法,在化学实验中占据着重要地位。
二、实验操作要点及主要实验现象1、过滤装置(1)减压过滤装置抽滤也称减压过滤,是在较低压强下将晶体析出,可以快速、充分地将晶体和母液分离。
抽滤使用布氏漏斗。
使用时,将直径略小于漏斗内径的圆滤纸铺在漏斗中,先用少量溶剂润湿滤纸并微启水泵,将其吸紧;然后小心地将要过滤的悬浊液倒入漏斗中,开大水泵,一直抽气到几乎没有液体滤出为止。
抽滤装置如右图。
结晶表面残留的母液,可用少量的溶剂洗涤。
这时抽气应暂时停止,把少量溶剂均匀地洒在布氏漏斗内的滤饼上,以全部结晶刚好被溶剂覆盖为宜;并用玻璃棒搅松晶体,使晶体润湿;然后抽气把溶剂抽干。
热溶液和冷溶液都可选用减压过滤。
若为热过滤,则过滤前应将布氏漏斗放入烘箱(或用电吹风)预热。
(2)热过滤装置过滤热饱和溶液时,折叠滤纸的方法如图a。
过滤少量热溶液可选一经过预热,颈短而粗的玻璃漏斗,用如图b所示装置过滤。
过滤较多溶液则应选择保温漏斗,用图c所示装置过滤。
热过滤时一般不用玻璃棒引流,以免加速降温;接受滤液的容器内壁不要贴紧漏斗颈,以免滤液迅速冷却析出晶体,堵塞漏斗口。
图a 图b 图c2、实验操作要点(1)制备KNO3粗品称取20gNaNO3和17g KCl放入100mL小烧杯中,加35mLH2O(此时溶液体积约为50mL)。
加热溶解后,继续加热蒸发至原溶液体积一半(建议改为约40mL)。
这时烧杯中有晶体析出(NaCl晶体),趁热用热滤漏斗过滤。
滤液盛于预置2mL蒸馏水(防止NaCl析出)的小烧杯中自然冷却、结晶。
减压过滤,尽量抽干。
称重。
计算理论产量和产率。
(2)KNO3提纯除保留少量粗产品供纯度检验外,按粗产品∶水=2∶1(质量比)的比例,将粗产品溶于蒸馏水中。
加热、搅拌、待晶体全部溶解后停止加热。
(若溶液沸腾时,晶体还未全部溶解,可再加极少量蒸馏水使其溶解。
)待溶液冷却至室温后抽干。
然后将KNO3晶体转移到表面皿上, 架于内盛沸水的烧杯上方,用水蒸气烘干,得到纯度较高的KNO3晶体。
(3)检验纯度:分别取0.1g粗产品和重结晶后的KNO3晶体放入小试管中,各加2mL蒸馏水配成溶液,各加1滴稀HNO3酸化,再加2滴0.1mol/L AgNO3溶液,观察现象。
3、实验产率:粗产品的产率应以KNO3粗产品的干质量进行计算。
由于粗产品需进行重结晶而不需干燥,可通过将压干后的产品质量扣除20%作为水的质量来估算干质量。
(实验参考数据如下) 产量(粗):7.7g 产率(粗):33.5% 氯离子含量:较高产量(精):5.1g 产率(精):22.3% 氯离子含量:微量四、实验注意事项:1、控制好水的蒸发量是决定产率和产品质量的主要因素,当溶液蒸发至40mL时,NaCl能最大限度的结晶析出,同时KNO3不结晶。
若溶液蒸发至教材指定蒸发量,大量KNO3与NaCl 一起析出,小烧杯中的溶液变成糊状固体,无法通过过滤除去NaCl。
相关实验数据如下表[2、KNO3冷却结晶的温度严重制约KNO3的产量,在气温较高的夏天,室温下冷却, 其冷却梯度较小,KNO3的析出量将大大减少,且冷却速度也慢。
若在空气中冷却一段时间后放入冰水中冷却,产率会显著提高。
3、进行产品纯度检验时,应将粗产品和重结晶产品一起检验,进行对比观察。
哪个溶液中的浑浊度浅,说明哪个溶液中的Cl-较少。
一次重结晶后的产物中还有少量Cl一,甚至第二次重结晶后还能检出Cl-。
这主要是由于在KNO3晶体长大过程中,Na+和Cl一被包在晶体里,或长大过程中晶体表面不断吸附这些离子造成的,通过多次重结晶能在一定程度上除去杂质,提高产品纯度。
三、实验时间:60分钟专题1拓展课题1-4 粗盐提纯一、实验原理实验基本原理是粗食盐中含有不溶性和可溶性杂质(如泥沙和K+、Mg2+、SO42+、Ca2+离子等)。
不溶性杂质可用溶解、过滤的方法除去;可溶性杂质可用向粗食盐溶液中加入能与杂质离子作用的盐类,生成沉淀后过滤的方法除去。
KCl溶解度大于NaCl,且含量少,蒸发浓缩后,NaCl呈晶体析出,K+ 仍留在母液内。
二、实验操作步骤:(1)称量和溶解:在天平上称取5.0g粗盐放在100mL烧杯中,加25mL蒸馏水,加热搅拌使大部分固体溶解,剩下少量不溶的泥沙等杂质。
过滤。
(2)除SO42-:将溶液加热至近沸,边搅拌边加1mL1mol/L BaCl2溶液,继续加热5min,使BaSO4长大沉降。
(3)检验SO42-是否除尽:待BaSO4沉降完全后,取上层清液,补加适量BaCl2溶液。
若无浑浊,则表示SO42-除尽。
(4)除去Ba2+、Mg2+和Ca2+离子:在滤液中加10滴2mol/L NaOH溶液和1.5mL1mol/L的Na2CO3溶液,加热至沸。
