微环境诱导肝细胞癌多药耐药的形成及机制
肝癌多药耐药机制研究现状

【 关键词 】 肝脏 ; 肿瘤
【 中图分类号】 R753 . 3
【 文献标识码】 c
【 文章编号】 10- 6 (08 0- 9 - 06 7120 )50 20 4 3 4
介导 的药物转运 , P 可通过促进药 物与谷胱 甘肽 的结合 MR 1
肝癌是常见 的恶 性肿 瘤之 一 , 在消 化道肿 瘤 中 占第三
1 3 肺 耐 药相 关蛋 白 (u gr iat s ca dpo i,R ) . 1n e s n as i e rt n L P st o t e
高表达 , 能将抗肿瘤 药物泵 出细胞外 , 造成 细胞 内药物浓 度 降低 , 降低 细胞 毒作 用 , 导 细胞 耐药 J 诱 。另外 , —p还 Pg 具有抑制肿 瘤 细胞 凋 亡 的功 能 , 究 表 明 Pg 研 —P能 够抑 制
一
国内 学者 熊 茂 明 等 利 用荧 光 定 量 R .C TP R对肝 癌
H p 2 A M m rm N e G / D dl R A表 达 进 行 了 相 关 研 究 , 癌 组 织 肝 m rmR A表 达 阳性 率 明 显 高 于 及 正 常 肝 组 织 。研 究 还 发 dl N
位, 高发 于我 国东南沿海地 区。化疗是肝癌综合性治疗 的重
要方法之一 , 但肝癌细胞对多种化疗药物产生 的交叉耐药 现 象严重 影 响 临床 化疗 的效 果 。多 药耐 药 ( ut rgr i- m ldu e s i st ac , R) ne MD 的发生机制 及其逆转 一直 是 国内外学者 研究 的
一
物 的外排而致多药耐药 。A a 等证 明 N 乙酰半胱氨酸 可 kn4 .
以增加 人 类 胚 肾 细胞 ( K 9 )及 其 转 染 全 长 MR 1的 HE 2 3 P 2 3 P细 胞 , 者对 MR 9 MR 两 P介 导 的长 春新 碱 的耐 药性 , 而
2024常见化疗药物肝细胞癌耐药的耐药机制及干预策略要点(全文)

202常见化疗药物肝细胞癌耐药的耐药机制及干预策略要点(全文)肝细胞癌(HCC)是全球范围内死亡率高、发病率不断上升的常见恶性肿瘤之一。
目前,化疗是中晚期HCC的重要综合治疗方法。
尽管化疗初期能取得良好的治疗效果,但HCC的高度表型和分子异质性使其对常规化疗或靶向治疗产生耐药,甚至导致多药耐药(MDR),这是临床化疗的主要障碍之一。
本文综述了HCC耐药的机制和干预策略,为克服肝癌的MDR提供有希望的治疗策略。
引起HCC耐药的常见抗癌药物目前肝癌的药物治疗主要有化疗、靶向治疗和免疫治疗,临床常用的化疗药物有5-佩尿瞪唗(5-FU)、顺铅、阿霉素(ADM),常用的分子靶向药物有索拉非尼、仑伐替尼、瑞戈非尼、替凡替尼、卡博替尼等。
HCC的免疫治疗是一种比较新的治疗手段,主要包括针对程序性细胞死亡蛋白l (PD-1)、PD-1配体(PD-Ll)和受体细胞毒性T淋巴细抗原4(CTLA-4)的免疫检查点抑制剂/单克隆抗体,包括纳武单抗、MED14736、帕博利珠单抗、替西木单抗、伊匹木单抗等药物。
然而,HCC治疗过程中,对上述药物产生耐多药性可能导致治疗失败。
HCC的耐多药机制l.AB C转运蛋白ABC转运蛋白是一种ATP依赖性跨膜蛋白,在HCC患者的MDR中具有重要作用。
A BC转运蛋白在肿瘤细胞中过表达,作为药物外排泵,通过降低抗癌药物的细胞内浓度来诱导MDR。
A BC转运蛋白具有典型的四结构域结构,包括保守的胞质核昔酸结合结构域(NBD)和高度异质性的跨膜结构域(TMD)。
NBD主要负责ATP的水解,而TMD负责底物的识别和转运。
由千TMD的高度异质性,A BC转运蛋白家族成员众多,能识别多种不同的底物,最终导致肿瘤的MDR。
2.细胞凋亡抗癌治疗的最终目的是诱导癌细胞凋亡。
细胞周期检查点和凋亡信号失调是MOR的主要原因。
既往有研究发现了多种与肝癌MOR密切相关的凋亡信号分子,包括p53和Bcl-2蛋白家族。
基于以AMPK为靶点的药物抗肝癌和抗乳腺癌多药耐药作用及其机制探讨

基于以AMPK为靶点的药物抗肝癌和抗乳腺癌多药耐药作用及其机制探讨近年来,肿瘤已经成为危害我国人民身体健康的首要疾病。
目前,临床传统的肿瘤治疗方式是手术配合放化疗,虽然可以起到抗肿瘤的作用,但毒副作用强大,因此如何寻找新的、靶向性强的抗肿瘤药物是我们亟待解决的问题。
同时,长期化疗又会引起肿瘤耐药的产生,显示了化疗的局限性,因此抗肿瘤耐药也是需要解决的问题之一。
另外,肿瘤的能量代谢异常已经成为肿瘤的十大新特征之一,有文献报道肿瘤的能量代谢异常对肿瘤的发生发展甚至耐药均起到重要的作用,因此我们提出从能量代谢的角度入手,寻找新靶向的抗肿瘤药物,从而解决耐药的问题。
AMPK作为与能量代谢相关的激酶,被称为能量代谢的感受器。
研究表明AMPK 可以纠正肿瘤的能量代谢异常,调节AMPK可以从能量代谢角度起到抗肿瘤和逆转肿瘤多药耐药的作用。
因此我们以AMPK为靶点,从能量代谢角度入手,期望实现抗肿瘤和抗耐药的目的。
CTAB是纳米材料的重要合成原料之一。
我们的研究结果表明CTAB可以选择性的杀伤肝癌细胞系,起到抗肝癌作用,同时CTAB具有一定的靶向性。
CTAB可以通过激活AMPK进而激活下游的p53,从而激活线粒体内源性凋亡通路,引起肝癌细胞的凋亡。
黄连素是一种传统的中药,近年来它的抗肿瘤活性引起人们的广泛关注。
我们的研究结果表明黄连素对乳腺癌耐药细胞系MCF-7/MDR具有小剂量增敏和大剂量直接促凋亡的作用。
而小剂量的黄连素的增敏作用是通过激活AMPK-HIF-1α-P-gp信号通路实现的,大剂量的促凋亡作用是通过激活AMPK-p53信号通路实现的。
缺氧作为肿瘤微环境的主要特征之一,对肿瘤耐药的产生具有重要的作用。
我们构建由缺氧诱导的耐药乳腺癌细胞系MCF-7/hypoxia,发现黄连素依然具有小剂量增敏和大剂量促凋亡的作用。
小剂量的黄连素通过抑制AMPK进而抑制下游的HIF-1α-P-gp信号通路实现增敏作用,而大剂量黄连素的促凋亡作用则是通过抑制AMPK-HIF-1α信号通路,进而激活p53而实现的。
miRNA_与肝细胞癌的关系研究进展

miRNA与肝细胞癌的关系研究进展潘丽英1,2,韦丽军1,2,黄赞松1,2,钟国强1,2,林岩1,21 右江民族医学院附属医院消化内科广西肝胆疾病临床医学研究中心,广西百色533000;2 右江民族医学院研究生学院摘要:目前,肝细胞癌(HCC)发生、发展的确切机制仍未完全阐明,越来越多的研究表明,微小RNA(miRNA)与HCC的发生、发展关系密切。
miRNA是一类非编码内源性微小RNA,通过与靶基因mRNA3'非翻译区碱基配对结合调控靶基因的转录,从而调节细胞的生长、分化、发育和凋亡。
异常表达的miRNA可作为致癌基因或抑癌基因参与包括HCC在内的多种病理过程。
miRNA通过结合靶mRNA的3'端降解靶基因或抑制其表达发挥生物学作用,参与调控HCC的增殖、凋亡、侵袭、转移、代谢重编程和自噬等恶性进程,并通过多种机制调控HCC的耐药性,其不仅是HCC诊断及疗效预测的生物标志物,也是潜在的治疗靶点。
关键词:肝细胞癌;微小RNA;增殖凋亡;代谢编程;侵袭转移;自噬;肿瘤标志物doi:10.3969/j.issn.1002-266X.2023.31.021中图分类号:R735.7 文献标志码:A 文章编号:1002-266X(2023)31-0083-05肝细胞癌(HCC)是原发性肝癌最常见的病理类型,由于其发病隐匿、恶性程度高、易转移、治疗难度大,目前仍是我国癌症相关死亡的第二大原因[1]。
目前,国内外认为HCC发生、发展是遗传、环境双重因素交互作用的结果,但其确切致病机制仍未完全阐明。
因此,对HCC发病机制和治疗的研究一直是研究的难点和热点。
微小RNA(miRNA)是一类由18~22个核苷酸组成的非编码内源性性小RNA,是近年来医学科学研究领域研究的热点。
miRNA生理学机制复杂,可通过促进靶miRNA的降解或抑制其翻译过程而参与细胞生长、增殖、分化以及凋亡等过程[2]。
近年来,对miRNA在HCC形成过程中的分子机制研究发现,miRNA可作为致癌基因或抑癌基因调控HCC细胞的分化、增殖、凋亡、侵袭转移、代谢重编程和自噬。
三氧化二砷诱导多药耐药肝癌细胞凋亡的实验研究

3ot继续培养 4h弃上清液 , 7 c , 加入二 甲基亚砜
2 1 HeG2A M 细 胞与 HeG2 胞药 物敏 感性 . p / D p 细 H p 2A M 细胞 对 A M、D P M eG / D D c D 、 MC均 有 明显 的抗 药性 , a23 对 s 抗药 性不 明显 , 见 表 1 0 详 。
m / l 化丙 锭 (r ii d eP) 色 3 i, gm 碘 po d m i i ,I染 p u od 0rn 流 a 式 细胞 仪计 数 l4 细胞 , 定波 长 为 48n 分 析 O个 测 8 m,
采 用 M " 检 测 H p 2A M 细 胞 、 eG TI法 eG / D H p 2细
不同 D A含量细胞的分布 , N 低于 G 期 (u—1 的 1 sb ) G
细胞 为 凋亡 细 胞 , 验 重复 3 。其 占细胞 总数 的 实 次 比例 为凋亡 细胞 比例 。
14 统计 学 方法 .
单细胞悬液 ( 15m ) 分别 接种到 9 孑 板 (0 5 0 1, X / 6 L 20 /L 即 1 5 孑 , l 个细胞) XO 。培养 2 后参 照抗癌药 4h 物血浆高峰浓度加入不同浓度 的上述药物( 5 设 个
H p 2A M组及 H p 2 , eG / D eG 组 常规条件下培养 2 , 4h
当细胞贴 壁 生长 后 , 别 加 入不 问浓 度 的 A23每 分 s , 0 孑 0 , 物终浓 度 为 04m / , . gL 每一 浓 Ll 药 . gL 08m / , 度 均设平 行 孔 , 作 用 2、87 小 时 后应 用 流 式 分别 44 、2 细 胞仪 检细 胞凋 亡 。
13 A z 3诱 导 HeG2A M 及 其 亲 本 株 HeG2 . sO p /D p
肝细胞癌靶免治疗药物原发性和继发性耐药后治疗选择

肝细胞癌靶免治疗药物原发性和继发性耐药后治疗选择近年来,针对中晚期肝细胞癌(HCC)的靶向联合免疫治疗取得了显著进展,然而,治疗的有效率仅约为30%,中位无进展生存期为6~9个月,且约20%的病人在初始免疫治疗时即出现耐药现象。
对这些耐药病人后续治疗的选择成为了亟待解决的临床问题。
靶免联合治疗的失败主要表现为原发性耐药和继发性耐药两种情况。
原发性耐药通常与肿瘤免疫原性的降低有关,包括新抗原的低表达、抗原呈递的改变及免疫共抑制信号的表达。
继发性耐药则可能与肿瘤在免疫治疗后向低免疫原性表型的克隆进化有关。
针对这两种耐药机制的治疗策略目前尚未形成标准的临床方案。
HCC的进展模式可以分为肝内进展、肝外进展、肝内新病灶和肝外新病灶,不同进展模式的预后存在显著差异。
肝内进展和肝外新病灶的病人相对有较好的进展后生存期,而新发的血管侵犯则预示着较差的预后。
未来的临床研究和实践需要在免疫微环境的重编程、病因学差异及多学科诊疗的框架下进行更为精准和个体化的治疗布局,特别是针对耐药HCC病人的后续治疗,可联合局部治疗如肝动脉化疗栓塞(TACE)或肝动脉灌注化疗(HAIC)等,以提高病人的生存期。
靶免联合治疗在HCC全病程中的作用正在逐步得到确认,但仍需进一步探索以建立标准的后续治疗策略。
全球范围内,肝细胞癌的发病率和死亡率居高不下,尤其在中国,HCC的发病和死亡病例占全球比例显著。
随着诊断和治疗手段的不断发展,HCC的治疗方式逐渐从单一的外科治疗拓展到包括靶向治疗和免疫治疗在内的综合治疗模式。
近年来,靶向联合免疫治疗在中晚期HCC治疗中取得了重要进展,已成为临床实践中的优先选择。
目前,以靶免治疗为主的全病程管理体系正在逐步建立,多个优化组合方案和方案前移的临床研究正在积极开展。
然而,由于治疗效果的异质性和耐药现象的频发,临床研究和实践仍面临诸多挑战。
本文探讨当前中晚期HCC的靶向联合免疫治疗现状、治疗进展模式、耐药机制及其应对策略,为未来的临床研究和实践提供参考。
多药耐药与肝细胞保护的研究进展

cassette)转运蛋白超家族中的P.糖蛋白(P-gp)及多药耐药相关蛋白(MRP)1,2,3,6。本文通过对相
关研究进展的分析,从多个方面阐述了多药耐药与细胞保护,尤其是肝细胞保护的关系,从而为疾病的预防和治 疗提供新的思路。 【中图分类号l
R322.4+7
【文献标识码l
A
【文章编号1
proteins(MRP)1,2,3,6
resisLeabharlann anceareexpressed mostly
liver.This review mainly discuss the relationship between the muhidrug
a
and cytoprotection by analyzing related fields,especially in the liver,consequently provide
2.2肝细胞保护及相关因子 由于肝脏的重要生理功能,对肝细胞保护的研 究受到人们的关注。许多相关的研究发现各种因子
万方数据
2009年第15卷第3期
黄慧雅等
多药耐药与肝细胞保护的研究进展 3多药耐药与细胞保护的关系
・335・
通过不同的机制对肝细胞起到保护作用,主要有: 前列腺素:PG的肝细胞保护作用效果明确,研 究得较多。肝是合成、释放和降解PG的重要器官之 一,而PG对肝的保护作用有普遍性,既无种系差 异,保护效果也与损伤因子的理化性质无关。关于 PG保护肝细胞的机制有许多观点,如通过间质细胞 或肝细胞膜的PG受体发挥作用、PG对膜的稳定作 用、改善线粒体呼吸功能、调节细胞代谢等,但目 前还不能用单一的理论完全说明其细胞保护作用的 全过程。 肝刺激因子:肝刺激因子(hepatic stimulator substance,HSS)存在于胎肝,是一种源于肝又有保 肝作用的物质,是典型的肝自身保护模式。其保肝 机制主要为:保护肝细胞膜的流动性和肝的组织结 构;抗自由基对膜脂质过氧化;减少肝的自由基清 除剂消耗以加强肝的抗氧化能力;保护线粒体琥珀 酸脱氢酶活性;刺激四氯化碳染毒肝合成DNA,促 进染毒肝再生;保持肝细胞内游离Ca2+稳态等。 消炎痛:实验结果证明药物消炎痛具有非特异性 的广谱的防止肝损伤作用,在正常肝和已受损肝都 有十分明显的保护作用,其机制并非由消炎痛直接 的药物作用所引起的,而是需要通过机体自身的反 应过程,通过增强机体的抗损伤能力而产生保护 的。线粒体结构与功能的相对完整性、线粒体和微 粒体的Ca2+调节作用和膜的结构与功能的变化可能是 消炎痛的肝保护作用的基础。 脑一肠肽:上皮生长因子、神经降压素、降钙素 基因相关肽、生长抑素、胰岛素一胰高血糖素都被报 道对肝细胞具有直接或间接的保护作用,每种因子 的保护机制也是多样的。 此外,维生素D,、一氧化氮(NO)、白细胞介 素一1 B、合成胆汁酸、几种中草药(黄芪皂苷、阿 魏酸钠、黄褐毛忍冬皂甙、北五味子粗多糖、紫堇 灵、乙酰紫堇灵及原鸦片碱)以及铜、硒等微量元 素对肝细胞都有不同程度的保护作用”“,并不时有 文献报道新的肝细胞保护因子被发现。一方面,正 常生理水平的因子能够起到一定的保护作用,即直 接细胞保护;另一方面,有害刺激还能通过防御代 偿机制诱导肝细胞增强抗损伤的能力,如消炎痛的 作用,以及四氯化碳中毒时肝脏的内源性抗损伤物 质金属硫蛋白的含量增加,这些是适应性细胞保护 的表现。肝细胞保护的机制是多样的,虽然进行了 大量研究,但人们所了解的还远远不够。尤其是关 于多药耐药与肝细胞保护之间的关系,目前还缺乏 较深的认识。
肝癌治疗中的药物耐药机制及对策

论文题目:肝癌治疗中的药物耐药机制及对策肝癌是全球范围内发病率高、治疗难度大的恶性肿瘤之一。
尽管近年来新型治疗药物的引入,如靶向药物和免疫治疗药物,取得了一定的临床效果,但药物耐药性问题仍然是制约治疗效果的重要因素。
本文将深入探讨肝癌治疗中药物耐药的机制及相应的对策。
1. 药物耐药机制的分类1.靶向治疗药物的耐药机制:o抑制通路的继发激活:例如,通过细胞信号转导通路的其他途径绕过受抑制的靶点。
o基因突变:如在使用BRAF抑制剂时出现的BRAF基因突变。
o药物代谢通路的改变:包括药物转运体的过度表达或代谢酶的活化,导致药物降解或排出增加。
1.化疗药物的耐药机制:o多药耐药性(MDR)机制:通过增加药物外排通路,如P-糖蛋白的过度表达,降低细胞对药物的敏感性。
o DNA修复通路的增强:肝癌细胞增强了DNA损伤的修复能力,降低了化疗药物的致死效果。
2. 靶向不同耐药机制的治疗对策1.组合治疗策略:o双靶点抑制:使用两种或多种靶向药物同时抑制多个关键通路,延缓耐药性的发展。
o联合使用化疗药物:将靶向药物与化疗药物联合使用,通过不同的机制增加肿瘤细胞的死亡率。
1.个体化治疗:o分子标志物导向治疗:通过检测患者的分子特征,选择对某些特定药物敏感的亚群体进行治疗,避免无效治疗和耐药的发生。
3. 免疫治疗药物的耐药机制及对策1.PD-1/PD-L1抑制剂的耐药机制:o PD-L1表达变化:肿瘤细胞PD-L1表达的增加可能导致抗PD-1/PD-L1治疗的耐药性。
o免疫逃逸通路的激活:通过其他免疫逃逸通路如TIM-3、LAG-3等来绕过PD-1/PD-L1的抑制作用。
1.免疫治疗的增强策略:o联合其他免疫检查点抑制剂:如联合抑制PD-1/PD-L1和CTLA-4抑制剂,增强T细胞的免疫活性。
o改善肿瘤微环境:通过减少免疫抑制性细胞的存在,如MDSCs和Treg细胞,增强免疫治疗的效果。
4. 实验室和临床研究进展1.耐药性机制的分子生物学研究:o单细胞分析技术:揭示单个肿瘤细胞中不同信号通路的活性状态,有助于理解耐药机制的复杂性。
肝细胞癌对仑伐替尼耐药机制的研究进展

仑伐替尼(lenvatinib )是一种口服多激酶抑制剂,靶向血管内皮生长因子受体(vascular endothelial growth factor receptor ,VEGFR )1~3、成纤维细胞生长因子受体(fibroblast growth factor receptor ,FGFR )1~4、血小板衍生生长因子受体α(platelet-derived growth factor receptor α,PDGFR α)、原癌基因KIT 和RET [1]。
仑伐替尼已经在多种实体瘤中显示出抗肿瘤活性,并在甲状腺癌、肝细胞癌(hepatocellular carcinoma ,HCC )、卵巢癌和肾细胞癌中作为单药或联合使用[2-4]。
此外,仑伐替尼在非小细胞肺癌、腺样囊性癌和子宫内膜癌中也表现出强大的抗肿瘤活性[5-8]。
原发性肝癌是全球第六大最常诊断的癌症类型和第三大癌症死亡原因,其中HCC 占75%~85%[9]。
HCC 早期症状隐匿但进展迅速,因此大多数HCC 患者在疾病中晚期阶段才被诊断出来,仅20%的患者能够进行手术切除,其余无法手术的HCC 患者5年总生存率不足18%[10]。
一直以来肝癌的靶向药物以索拉非尼为主,但其对肝癌患者生存预后的改善有限。
直至2018年,REFLECT 研究显示:在不可切除HCC 患者中,仑伐替尼组总生存期非劣效于索拉非尼组,至此仑伐替尼成为了第二个用于不可切除HCC 的一线药物,打破了分子靶向药物治疗HCC 的困境[11-12]。
由于HCC 的高度异质性及仑伐替尼的原发性或适应性耐药,仑伐替尼单药治疗HCC 的效果不佳,多数晚期HCC 患者无法从仑伐替尼的治疗中获益,总体治疗有效率仅24.1%[6]。
因此,探索仑伐替尼的耐药机制和寻找有效的联合治疗靶点对提高仑伐替尼治疗HCC 的效果具有重大意义。
目前已有大量仑伐替尼用于多种癌症治疗的耐药机制研究,本文将对仑伐替尼在HCC 中潜在的耐药机制进行综述。
肝癌多药耐药的研究进展

【 关键词 】 肝癌 ; 多药耐药 ; 基因治疗 ; 逆转 【 中图分类号 l R7 57 3 . 【 文献标识码 l C 【 文章编号 l 10 -7 1 20 )30 3 -3 0 64 6 (0 7 0 -240 的药物如顺 铂 、 卡铂 、 烷化剂等到胞浆 , 改变细胞 内的药 物分 布, 使药物远离作用靶点 , 过核靶 点屏蔽机制产生耐药 J 通 。 Zu h 等 发 现缺 氧 、 低糖 和 H V感 染 均 可 诱 导 肝 癌 细 胞 B H p 2中耐药相关基 因 m r 、 R 、 P eG dl L P MR 1的高表 达 , 缺氧 在
12 多 药 耐 药 相 关 蛋 白( P . MR )
与 G H结合 , 5种称 为膜结合 微粒体 。5种 类 型中 , S ・ S 第 G T
订约 占总数的 9 % 且与 恶性 肿瘤 关系最 密切 , 0 可催 化亲 电
化合物如烷化剂等抗癌药 物与 G H结合 , S 使其水溶性 增加 , 更易排 出, 也可使亚硝基 脲类药物脱 亚硝基 , 除阿霉 素 和 清
13 肺 耐 药蛋 白( l . Li p)
期 、 :M期表达 , G/ 有丝分裂后下降。因其主要对 核蛋 白体 基
因转 录的空 间构型组成及调整起重要作用 , 所以也是化疗药 物 的重要靶点 。T p 是喜树碱 和蒽环类药 物靶点 ,o oI ooI Tp 1
是鬼 臼素类药物靶 点 。肿瘤 细胞 Tp oo酶减少 或活 性降低 , 药物靶点和 D A不易形成复合物 , N 对药物敏感性 下降 , 即发
维普资志 2 0 07年 6月第 1 5卷第 3期
Jun lfHp tb i ySre ,o, N . ,u .0 7 ora eaoi r u r Vl1 o3 Jn 20 o l a gy 5,
肿瘤的多药耐药及其逆转剂研究进展

综述肿瘤的多药耐药及其逆转剂研究进展安徽省肿瘤医院桂留中化疗仍是恶性肿瘤的重要治疗手段之一,然而肿瘤细胞的耐药常使化疗最终失败。
根据肿瘤细胞的耐药特点,耐药可分为原药耐药(Primary drug resistance,PDR)和多药耐药(Multidrug resistance ,MDR)。
PDR只对诱导药物产生耐药而对其他药物不产生交叉耐药性,如抗代谢药类;MDR 则是指肿瘤细胞对一种抗肿瘤药产生抗药性的同时,对其他结构和作用机制不同的抗肿瘤药产生交叉耐药性。
MDR的表现十分复杂,既可有原发性(天然性)耐药,也可有诱导性(获得性)耐药;还有典型性和非典型性耐药之分。
由于MDR给化疗带来了困难,近年人们对其产生的机制以及试图寻找逆转剂做了大量的工作。
本文简介MDR产生的机制并着重介绍近年逆转剂的研究进展。
1.MDR产生的机制1.1膜糖蛋白介导的机制1.1.1 P-gp与MDR 1976年Ling等首先在抗秋水仙碱的中国仓鼠卵巢细胞株上发现了一种能调节细胞膜通透性的糖蛋白(P-glycoprotein,P-gp),因其相对分子量为170kd,又称P-170。
[1]。
P-gp主要分布在有分泌功能的上皮细胞的细胞膜中,在人类正常组织中有不同程度的表达,其中肾上腺、肺脏、胃肠、胰腺等组织中表达较高,而在骨髓中表达较低。
P-gp属于ATP结合盒家族的转运因子,其生理功能为在ATP供能下将细胞内的毒性产物泵出细胞,对组织细胞起保护作用。
P-gp由mdr1基因编码产生。
人类mdr1基因位于7号染色体长臂2区一带一亚带(7q21.1)。
1986年,Gros将编码P-gp的mdr1cDNA直接转染敏感细胞后,转染细胞表现出完全的MDR表型,从而提供了P-gp能够导致多药耐药的有力证据。
现已证明,许多肿瘤原发性或获得性耐药均与P-gp过量表达有关。
P-gp随mdr1基因扩增而增加。
P-gp有多个药物结合位点,因而具有多种药物泵出功能,不过其底物多为天然性抗癌药如长春碱类、蒽环类、紫杉醇类和鬼臼毒素类等。
厦门大学:微囊泡PKM2通过诱导巨噬细胞分化和重塑肿瘤微环境促进肝癌进展
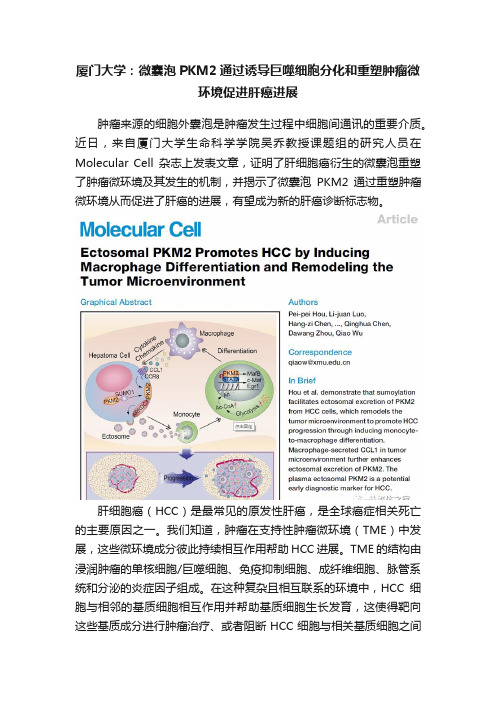
厦门大学:微囊泡PKM2通过诱导巨噬细胞分化和重塑肿瘤微环境促进肝癌进展肿瘤来源的细胞外囊泡是肿瘤发生过程中细胞间通讯的重要介质。
近日,来自厦门大学生命科学学院吴乔教授课题组的研究人员在Molecular Cell杂志上发表文章,证明了肝细胞癌衍生的微囊泡重塑了肿瘤微环境及其发生的机制,并揭示了微囊泡PKM2通过重塑肿瘤微环境从而促进了肝癌的进展,有望成为新的肝癌诊断标志物。
肝细胞癌(HCC)是最常见的原发性肝癌,是全球癌症相关死亡的主要原因之一。
我们知道,肿瘤在支持性肿瘤微环境(TME)中发展,这些微环境成分彼此持续相互作用帮助HCC进展。
TME的结构由浸润肿瘤的单核细胞/巨噬细胞、免疫抑制细胞、成纤维细胞、脉管系统和分泌的炎症因子组成。
在这种复杂且相互联系的环境中,HCC细胞与相邻的基质细胞相互作用并帮助基质细胞生长发育,这使得靶向这些基质成分进行肿瘤治疗、或者阻断HCC细胞与相关基质细胞之间的相互联系可以成为HCC的治疗策略。
肿瘤浸润巨噬细胞是HCC肿瘤微环境中最丰富的基质细胞类型之一,不仅通过诱导细胞外基质重塑、血管生成、肿瘤转移和治疗耐药从而抑制抗肿瘤免疫,而且还分泌各种炎症介质促进肿瘤细胞的进展。
这些巨噬细胞主要来自循环里的单核细胞前体,被来自肿瘤细胞的调节因子的刺激而分化成为成熟的巨噬细胞。
据报道包括MafB、c-Maf、Egr-1、Klf4和PU.1在内的转录因子可以介导和限制巨噬细胞的分化过程,但是,对这个过程的详细机制仍然知之甚少。
最近报道,肿瘤来源的细胞外囊泡(EVs),特别是外泌体,对于肿瘤发展过程中的细胞间通讯至关重要。
例如,含有miR-1247-3p的HCC细胞来源的外泌体可被成纤维细胞吸收,并将普通成纤维细胞转化为肿瘤相关的成纤维细胞,从而进一步促进肝癌的肺转移。
微囊泡(ectosomes)比外泌体要大得多(外泌体的直径为40-150 nm,而微囊泡的直径为150-1,000 nm),是直接从质膜脱落的EV的一种亚型。
肝癌的化疗耐药机制研究

肝癌的化疗耐药机制研究近年来,肝癌在全球范围内呈现出日益增加的趋势,成为世界上最常见和最致命的恶性肿瘤之一。
化疗作为肝癌的一线治疗方法,尽管取得了一定的疗效,但耐药现象严重制约了其临床应用。
因此,深入研究肝癌的化疗耐药机制对于寻找新的治疗策略具有重要意义。
一、细胞毒性效应的减弱化疗药物常常通过对肝癌细胞的毒性作用来达到治疗的效果,但长期使用化疗药物会导致肿瘤细胞对药物的适应性和抵抗性逐渐增强。
这主要与细胞内的解毒系统、DNA修复机制、细胞凋亡等相关基因异常表达和功能失调有关。
1. 解毒系统异常肝脏是身体的解毒器官,它通过排泄和代谢来清除体内的有毒物质。
然而,肝癌细胞中某些基因的突变可能会导致解毒系统异常,进而使肿瘤细胞对化疗药物的毒性效应减弱。
例如,肝癌细胞中谷胱甘肽S-转移酶(GSTP1)的表达增加,使得肿瘤细胞能够更高效地清除化疗药物,从而减少了药物对肿瘤细胞的杀伤能力。
2. DNA修复机制异常DNA损伤是化疗药物杀伤肿瘤细胞的主要机制之一。
然而,一些肝癌细胞可能通过过度表达或突变DNA修复相关基因来修复药物对DNA的损伤,从而减弱药物的细胞毒性作用。
例如,肝癌细胞中DNA修复基因PARP (聚合酶封闭剂)、MGMT (甲基化酶)等的异常表达可以增加肿瘤对化疗药物的耐药性。
二、细胞信号传导通路的异常激活细胞信号传导通路的异常激活在肝癌的耐药机制中起到重要作用。
肝癌细胞在长期暴露于化疗药物的环境下,可以通过改变部分信号通路来适应药物的毒性作用,进而降低其对药物的敏感性。
1. PI3K/AKT/mTOR通路PI3K/AKT/mTOR通路是肝癌发生发展过程中重要的信号传导通路之一。
研究发现,在经历了化疗的肝癌细胞中,PI3K/AKT/mTOR通路往往呈异常激活状态,这种异常激活可能与肝癌细胞的耐药性密切相关。
因此,针对PI3K/AKT/mTOR通路进行的联合治疗可能是克服化疗耐药的有效策略之一。
2. Wnt/β-catenin通路Wnt/β-catenin 通路在肝癌细胞的生长、增殖和转移过程中发挥着关键作用。
肝癌多药耐药机制的研究进展

西南军医2013年1月第15卷第1期Journal of Military Surgeon in Southwest China,V ol.15,No.1,Jan.,2013原发性肝癌是我国常见的消化系统恶性肿瘤,治疗手段是以手术为主的综合性治疗,化疗是重要治疗方法之一。
但多药耐药(multiple drug resistance,MDR )的存在使肝癌的化疗效果受到严重影响。
因此,肝癌多药耐药的机制一直是国内外学者研究的重点,本文就新近肝癌MDR 相关机制的研究进展做如下综述。
1介导药物外排机制1.1P-糖蛋白(P-glycoprotein ,P-gp )P-gp 是位于细胞膜的转运蛋白,人MDR 的P-gp 相对分子量为170kd,故名P-170。
研究证明,P-gp 的表达增强与MDR 的形成有关。
一般认为,P-gp 具有“药泵功能”,它能够与药物结合使药物转移到细胞外,导致细胞内的药物浓度降低,达不到有效治疗浓度,由此而获得耐药性[1-3]。
Huesker 等[4]通过研究证明肝癌化疗耐药与P-gp 的过量表达有重要的关系。
1.2多药耐药相关蛋白(MRP )MRP 属于跨膜转运蛋白之一。
MRP 介导的MDR 机制主要通过外排方式降低胞内抗肿瘤药物的浓度及使药物远离作用靶点而导致药物在细胞内的重新分布。
目前研究认为药物首先与谷胱甘肽(GSH )结合,然后由依赖ATP 能量的MRP 将其转运出细胞,由此可见MRP 是在GSH 共同参与下起外泵作用导致耐药性的产生。
王百林等[5]研究发现在术前未化疗的原发性肝癌组织、肝癌癌旁组织及肝硬化中均有不同程度的MRP 基因表达,而原发性肝癌组织MRP 基因表达较其他两种组织明显增高,表明肝癌的MDR 与MRP 有关。
1.3乳腺癌耐药蛋白(BCRP )乳腺癌耐药蛋白是在乳腺癌耐药细胞株中发现的一种新的MDR 相关蛋白。
Allikmets 等[6]和Miyake 等分别从人胎盘组织和耐米托蒽醌的人结肠癌细胞S1-M1-80中克隆得到BCRP 基因,因而BCRP 又称为胎盘特异性ATP 结合盒转运分子(placenta-specific ATP-binding cassette transporter ,ABCP )和耐米托蒽醌转运分子(mitoxan-trone resis-tance transporter ,MXR )。
缺氧与肝癌多药耐药的研究进展

是指肿瘤细胞接触一种抗癌药物后,不仅对该药产生耐药性, 对其他结构和作用机制不同的多种抗肿瘤药物也可产生交叉 耐药性。肝癌是临床常见的对化疗不敏感的恶性肿瘤,研究已 证实多药耐药是肝癌化疗无效或渐失效的主要原因。肝癌多 药耐药产生存在多种机制,近年来,已有大量文献对肝癌细胞 缺氧与肝癌MDR的发生机制、临床意义等方面展开了深入研 究,本文就缺氧与肝癌多药耐药作一综述。
1肝癌多药耐药产生机制
肝癌的MDR产生机制复杂,主要有以下几个方面:(1) P170糖蛋白(P—SP)P—gP由7号染色体上的多药耐药基因 1(Mulfidrug
Resistance
Genel,MDRl)编码的糖蛋白,它是一种
相对分子量为170KD、具有能量依赖性“药泵”功能的跨膜糖蛋 白,属于ABC转运蛋白超家族成员,其能将细胞内带阳性电荷 的亲脂类化疗药物逆浓度泵至细胞外,使细胞内化疗药物达不 到有效作用浓度而产生耐药性…。(2)多药耐药相关蛋白( MRP) 1992年,从人小细胞肺癌耐药细胞株H69AR中克隆
万方数据
酉直至匿!!!Q笙§旦
筮!呈鲞笠≥翅』!!里堂堂丛业!型§!翌塑i!塾!!b!墅!曼堕!!:!丛12:塑!:!:丛型,垫!Q
。537・
2肝癌细胞缺氧及其分子反应
局部微环境缺氧在许多实体瘤中是常见现象。肿瘤组织 中的氧状况取决于氧的供给、弥散及氧耗。缺氧主要是由于肿 瘤生长迅速,氧的消耗及弥散距离增加;而肿瘤血管往往异常 增生、管壁萎陷、血流淤滞、血供不足,因而使得肿瘤区域氧的 供求失衡而相对缺氧。距毛细血管同样远近的肿瘤组织较正 常组织中氧浓度低10—100倍,当肿瘤球体直径达到2009~ 3009m时其中心氧分压即下降到很低(缺氧)。而且肿瘤内部 的缺氧程度是不均一的,通常地,以肿瘤的中央为轴心,缺氧的 程度向外渐次减弱,亦即越靠近肿瘤中心缺氧时间越长、缺氧 越为严重”J。 肝癌细胞组织内缺氧尤为显著,肝细胞癌通常是由慢性肝 损伤、肝硬化发展而来。肝脏的慢性损伤导致肝细胞性状的改 变继而引起肝组织硬化,并破坏肝内正常的血供系统。肝血供 系统的破坏进一步导致肝供血不足、肝组织内缺氧。而且,随 着肿瘤细胞的高度增殖、数量增多、肿瘤体积增大,也引起肝癌 组织内更严重的缺氧。机体为对抗这种缺氧的微环境,会发生 了一系列适应性改变,肿瘤细胞的基因组/蛋白组发生变异,肝 癌表现出某些新的生物学性状一J。 肝癌细胞在缺氧情况下,发生一系列生化改变适应缺氧, 包括无氧糖酵解的增强,保护性应激蛋白的表达提高等。后者 包括一些细胞因子和生长因子,如促红细胞生成素(erythrop— oietin,EPO)、VEGF、糖酵解酶等;转录调控因子的改变有A 一1、和缺氧诱导因子(hypoxia—inducible 等‘Io】。
癌症药物耐药机制

癌症药物耐药机制癌症是一种严重威胁人类健康的疾病,而药物治疗是一种常见的治疗手段。
然而,长期以来,科学家们发现,一些癌症患者在接受药物治疗后会出现耐药现象,使得治疗效果大打折扣。
这一现象被称为“癌症药物耐药”。
癌症药物耐药机制是指这种现象发生的原因和方式。
本文将探讨癌症药物耐药的机制,以便进一步加深对癌症治疗的理解。
一、基因突变引发耐药基因突变是癌症药物耐药的主要原因之一。
在癌细胞分裂和生长过程中,其遗传物质DNA可能会发生突变,导致细胞基因组的改变。
这些基因突变可能会导致癌症细胞中的药物靶点发生改变,进而使得药物无法正常作用。
例如,一些细胞基因的突变可能会导致其转录和翻译过程出现错误,从而影响药物与其结合的效率。
此外,还有一些突变可能会导致细胞信号传导通路发生改变,进而使得癌细胞对药物的反应降低。
二、多药耐药转运蛋白多药耐药转运蛋白是另一个重要的癌症药物耐药机制。
这些蛋白质存在于细胞膜上,具有将药物从细胞内输送到细胞外的功能。
当人体接受药物治疗时,这些转运蛋白可以将药物从癌细胞内排出,从而减少药物在癌细胞内的有效浓度。
此外,还有一些转运蛋白可以通过增加药物从细胞内摄取到细胞外的速度,进一步降低药物的疗效。
因此,这些多药耐药转运蛋白可以降低药物在癌细胞内的有效浓度,增加了耐药的风险。
三、肿瘤微环境的改变肿瘤微环境的改变也与癌症药物耐药密切相关。
肿瘤微环境是指肿瘤细胞周围的组织和细胞之间的相互作用。
在癌症治疗过程中,肿瘤微环境的改变可能会导致药物在肿瘤组织中的分布和代谢发生变化。
例如,肿瘤的血管系统可能会发生改变,导致药物不能有效进入肿瘤组织;肿瘤间质细胞的数量和类型也可能会影响药物的作用效果。
此外,肿瘤细胞周围的免疫环境也可能会影响药物的疗效。
因此,肿瘤微环境的改变是癌症药物耐药的重要因素之一。
四、干细胞和癌细胞的关系干细胞和癌细胞之间的关系是癌症药物耐药的一个研究热点。
干细胞具有自我更新和分化为多种细胞类型的能力,而癌细胞则是一种具有不受控制增生和扩散能力的细胞。
细胞凋亡与癌细胞耐药性研究

细胞凋亡与癌细胞耐药性研究细胞凋亡是一个重要的细胞死亡机制,它在维持组织稳态、预防癌症发展和抵抗病原体感染等方面起着关键作用。
然而,癌细胞对细胞凋亡的逃逸是导致癌症发展和治疗失败的重要原因之一。
近年来,研究人员致力于探索细胞凋亡与癌细胞耐药性之间的关系,并寻求新的治疗策略以克服耐药性问题。
一、细胞凋亡的机制细胞凋亡,又称程序性细胞死亡,是一种高度调控的自杀程序。
在正常情况下,细胞凋亡通过激活信号通路或遗传调控来实现。
这些调控因子包括凋亡相关蛋白(如Bax、Bcl-2等)、半胱氨酸蛋白酶(如caspase家族成员)以及DNA损伤传感器等。
细胞凋亡过程中,细胞核出现DNA断裂和染色质凝集的特征,细胞膜发生变化并最终破裂。
二、癌细胞耐药性的机制癌细胞耐药性指的是癌症患者在接受化疗或放疗时,癌细胞对抗治疗药物的能力增强,导致治疗效果降低或失效。
癌细胞耐药性可以通过多种途径获得,包括多药耐药转运蛋白的表达增加、细胞凋亡通路的改变、DNA修复能力的提高以及肿瘤微环境的影响等。
这些因素共同作用,使癌细胞克服治疗的压力,生存下来并继续扩增。
三、细胞凋亡与癌细胞耐药性之间的关系细胞凋亡的抑制和癌细胞耐药性之间存在紧密联系。
研究发现,细胞凋亡途径的异常激活或变异可以导致肿瘤细胞对化疗药物的耐药性增加。
例如,Bcl-2家族蛋白的过度表达会抑制细胞凋亡的发生,从而使癌细胞对化疗药物产生耐药性。
此外,一些细胞凋亡途径的调控因子在癌细胞中发生突变,也会使癌细胞对治疗产生抗性。
四、克服癌细胞耐药性的策略针对癌细胞耐药性的挑战,研究人员提出了多种新的治疗策略。
1. 多靶点联合治疗:通过联合使用多种药物或靶向剂,同时作用于细胞凋亡途径的不同环节,以增加治疗的有效性。
2. 调亡原基因治疗:通过基因编辑技术或基因传递技术,修复或激活细胞凋亡途径中的异常基因,恢复细胞对治疗的敏感性。
3. 免疫疗法:利用免疫系统识别和攻击癌细胞,增强机体对癌细胞的抗肿瘤免疫反应。
肿瘤微环境的免疫因子与肿瘤耐药

肿瘤微环境的免疫因子与肿瘤耐药【摘要】肿瘤微环境对肿瘤的发生发展至关重要,针对肿瘤的治疗,不仅包括癌细胞本身,还涉及相当数量的良性细胞群和非细胞组分,如胞外基质、生长因子、细胞因子、趋化因子及脉管系统等。
恶性肿瘤处在特殊的微环境中,其耐药特性不仅由肿瘤细胞本身改变所导致,并且是肿瘤相关微环境中多种细胞互相影响的结果。
肿瘤细胞和肿瘤微环境的相互作用介导着耐药性的产生。
现阶段普遍认为肿瘤细胞遗传物质的改变是肿瘤发展和耐药的原因。
现在,肿瘤微环境逐渐被发现是肿瘤发生不可或缺的一部分,在肿瘤生长、侵袭、转移和耐药中扮演着关键的角色。
本文就肿瘤微环境的组成、功能机制和肿瘤耐药之间的关系作一综述【关键词】肿瘤微环境;耐药;免疫因子【中图分类号】R73【文献标识码】A【文章编号】2096-0867(2016)09-004-02肿瘤是威胁人类健康的主要疾病,但是肿瘤的治疗状况却一直不尽人意,其中影响肿瘤治疗效果的最大因素之一就是肿瘤耐药性。
以前对肿瘤耐药机制的研究局限于肿瘤细胞本身,由此发展的治疗方法所取得的成效并不理想。
随着研究的不断深入,人们逐渐认识到肿瘤微环境在肿瘤耐药性的产生中也扮演着关键的角色。
肿瘤微环境是肿瘤细胞产生和生活的特殊环境,其中不但包含肿瘤细胞,还包括细胞外基质、各种非肿瘤细胞、微血管和浸润其中的生物因子等等。
肿瘤细胞和肿瘤微环境构成了一个不可分割的整体,两者的相互作用促进了耐药性的产生。
因此,针对肿瘤微环境的研究能为提高肿瘤的治疗效果提供一种新的思路和方法。
1.肿瘤耐药性研究的回顾癌细胞在遭受细胞毒素损伤之后能通过多种抵抗机制得以存活。
其中经典的机制包括减少药物的摄取;增加药物的外流;改变药物的作用靶点和新陈代谢;增强DNA损伤后修复;改变细胞周期关卡介质以及凋亡通路的下游介质等。
然而,这些机制难以解释一些现象的发生。
肿瘤细胞获得耐药性主要通过两种方式:一是肿瘤细胞内在基因改变的结果,即内在耐药性,包括药物排出泵的上调、解毒酶的激活或凋亡缺失;二是外在因素如细胞因子和生长因子的改变促进了肿瘤药物抵抗,即外在耐药性。
