乙醇气相脱水制乙烯动力学实验(宁波工程)
实验3乙醇气相脱水制乙烯宏观反应速率的测定

实验三简易内循环无梯度反应(乙醇气相脱水制乙烯宏观反应速率的测定)一、实验目的1.巩固所学有关反应动力学方面的知识。
2.掌握测取宏观反应动力学数据的手段和方法。
3.学会实验数据的处理方法,并能根据动力学方程求出相关的动力学参数值。
4.了解内循环式无梯度反应器的特点及其使用方法。
二、实验原理反学动力学描述了化学反应速率与各种因素如浓度、温度、压力、催化剂等之间的定量关系。
动力学在反应过程开发和反应器设计过程中起着重要的作用。
它也是反应工程学科的重要组成部分。
气固相催化反应是一个多步骤的反应,它包括以下七个步骤:1.反应物分子由气流主体向催化剂的外表面扩散(外扩散);2.反应物分子由催化剂外表面向催化剂微孔内表面扩散(内扩散);3.反应物分子在催化剂微孔内表面上被吸附(表面吸附);4.吸附的反应物分子在催化剂的表面上发生化学反应,转化成产物分子(表面反应);5.产物分子从催化剂的内表面上脱附下来(表面脱附);6.脱附下来的产物分子从微孔内表面向催化剂外表面扩散(内扩散);7.产物分子从催化剂的外表面向气流主体扩散。
这七个步骤可分为物理过程和化学过程。
其中步骤1、2、6、7为物理扩散过程,步骤3、4、5为化学过程。
在化学过程中,步骤3、步骤5分别为化学吸附和化学脱附过程,步骤4为表面化学反应过程。
整个反应的总速率取决于这7个步骤中阻力最大的一步,该步骤称为反应的速率控制步骤。
如果步骤1或7为控制步骤,称反应为外扩散控制反应;如果步骤2或6为控制步骤,称反应为内扩散控制反应;如果步骤3、4或5的任何一步为控制步骤,称反应过程为反应控制或动力学控制。
在考虑以上所有步骤的影响的反应速率为为宏观反应速率,在消除了传递过程(包括热量传递和质量传递)的影响的理想情况下,测得的化学反应的反应速率为相应反应的本征反应速率。
在实际反应过程中,由于固体催化剂一般都具有很大的内表面,反应物质通过扩散达到催化剂内部的不同深度进行反应,因而导致常常具有浓度梯度和温度梯度,而这个浓度梯度和温度梯度对催化反应影响一般很大,因此需要了解催化剂颗粒内表面的浓度和温度梯度,即内扩散对总反应速率的影响。
乙醇气相脱水制乙烯实验报告(一)

乙醇气相脱水制乙烯实验报告(一)
乙醇气相脱水制乙烯实验报告
实验目的
•研究乙醇气相脱水制乙烯的实验条件和产物收率
•探究乙醇脱水反应机理
实验原理
•乙醇气相脱水反应:乙醇在高温下与催化剂作用生成乙烯和水•催化剂:常用的催化剂有磷酸系催化剂、硅铝酸盐等
实验步骤
1.准备实验装置:包括加热器、冷凝器、反应容器等
2.将乙醇与催化剂按一定比例加入反应容器中
3.将装置密封,加热至特定温度,并控制温度保持稳定
4.收集冷凝水,记录产物乙烯的收率
5.进行实验单点和多点对比实验,研究不同条件下的乙醇脱水反应
情况
实验结果
•控制温度为300°C、催化剂为磷酸系催化剂的实验,乙醇脱水产物乙烯收率为70%
•提高温度至400°C,乙醇脱水产物乙烯收率上升至80%
结论
•乙醇气相脱水制乙烯是一种有效的方法,可以通过调节温度和催化剂种类来控制乙烯的产率
•高温对乙醇脱水反应有促进作用,但过高温度可能导致副反应的发生和产物选择性的降低
实验改进
•进一步研究不同催化剂在乙醇脱水反应中的催化活性和选择性•调查不同温度下乙醇脱水反应的反应动力学特性
以上是本次乙醇气相脱水制乙烯实验的相关报告。
通过实验的不断改进和深入研究,有望在工业生产中应用该方法来制备乙烯。
乙醇气相脱水制乙烯实验报告

乙醇气相脱水制乙烯实验报告1. 引言本实验旨在通过乙醇气相脱水制备乙烯,并探究不同反应条件对乙烯产率的影响。
乙烯是一种重要的工业原料,广泛应用于塑料、橡胶、化肥等领域。
本实验通过控制反应温度、气体流速和催化剂用量,寻找最佳的制备乙烯的条件。
2. 实验步骤2.1 原料准备准备乙醇、催化剂和载气。
乙醇要保持高纯度,以确保反应的可靠性和重复性。
催化剂一般选择酸性固体催化剂,如磷钨酸盐等。
载气可以选择氮气,用于控制反应系统的气氛。
2.2 反应装置搭建搭建乙醇气相脱水反应装置,并将所需的催化剂放置在反应器中。
反应器需要具备对温度和流速的精确控制能力,以确保反应的可控性。
2.3 反应条件设定根据实验要求,设定不同的反应条件,包括反应温度、气体流速和催化剂用量。
通过改变这些条件,可以比较它们对乙烯产率的影响。
2.4 实验操作将乙醇注入反应器中,加热至设定的反应温度。
在反应过程中,控制气体流速,并定期取样分析乙烯产率。
根据乙烯的生成速率和反应时间,计算乙烯的产率。
3. 实验结果与分析3.1 不同反应温度下的产率比较在固定流速和催化剂用量的条件下,分别设定不同的反应温度,并测定乙烯的产率。
结果显示,随着反应温度的升高,乙烯的产率逐渐增加,但在一定温度范围内,随着温度的继续升高,乙烯的产率开始下降。
这可能是因为催化剂在高温下活性减弱,导致反应速率降低。
3.2 不同气体流速下的产率比较在固定温度和催化剂用量的条件下,分别设定不同的气体流速,并测定乙烯的产率。
结果显示,随着气体流速的增加,乙烯的产率逐渐增加,并达到一个稳定的值。
这可能是因为较高的流速有利于乙醇与催化剂的接触,促使反应更充分地进行。
3.3 不同催化剂用量下的产率比较在固定温度和气体流速的条件下,分别设定不同的催化剂用量,并测定乙烯的产率。
结果显示,随着催化剂用量的增加,乙烯的产率呈现先增加后减少的趋势。
这是因为催化剂的增加可以提高反应速率,但过多的催化剂可能会导致反应中产生的副产物增加,从而降低乙烯的产率。
乙醇气相脱水制乙烯动力学(内循环无梯度)
3.300
气 81.57 1.465 16.46 0.08825 0.408
液
16.24
83.5
0.6000
318.5
气 89.78 2.065
液
48.81
7.098
0.1551 51.09
0.984 0.9600
气 90.18 2.298 7.109 0.3243
1.440
液
56.59
43.02
1.570
水,乙醇,乙醚的摩尔数分别为 0.0134,0.0151,0.0041 质量计算;乙烯质量=原子量×摩尔数=32×0.0087=0.2795 水和乙醇,乙醚的质量分别为 0.2407,0.6975,0.3030 合计为:0.0087+0.2407+0.6975+0.303=1.5206 与乙醇进料量基本平衡。
六、讨论 1、本次实验用来巩固所学的有关动力学的知识,由实验证明该反应器是本
征反应。 2、本次实验在操作过程中,另取了 4 个点,得一直线。 3、由实验结果可以看出,升高反应温度,乙醇气相脱水制乙烯反应有利于
生成乙烯,不利于生成乙醚。最佳反应温度在 350℃左右。
95.98
46.45 0.03515
69.50 24.59 2.155 3.766
96.62
66.36 0.01675
59.08 38.42 0.7433 1.763
98.67
64.13 0.03238
54.62 43.76 0.4146 1.198
99.24
60.84 0.04605
CA
0.0002080 0.0001580 0.0001230 0.0004320 0.0002540 0.0002310 0.001462 0.0005890 0.0005340 0.0004270 0.0001470 0.00008210
乙醇气固相催化制备乙烯实验报告

化工专业实验报告实验六乙醇气固催化脱水制乙烯姓名:XXX学号:XXXXXX班级:同组人:一实验目的1、掌握乙醇脱水实验的反应过程、实验流程和操作。
2、掌握乙醇气相脱水操作条件对产物收率的影响,学会获取稳定的工艺条件的方法。
3、了解固定床反应器的构造、原理和使用方法,学习反应器的正常操作和安装。
4、学习气相色谱在线分析的方法和定性、定量分析,学习如何手动进样分析液体成分。
了解气相色谱的原理和构造,掌握色谱的正常使用和分析条件选择。
5、学习微量泵的使用方法,学会使用湿式流量计测量流体流量。
二、实验原理乙醇脱水属于平行反应,即可进行分子内脱水生成乙烯,又可进行分子间脱水生成乙醚。
一般而言,较低的温度有利于生成乙醚,因此该复合反应条件改变,脱水机理也有不同。
采用浓硫酸、氧化铝和分子筛催化剂可以有下列反应过程产生:浓硫酸:2C2H5-OH C2H5OC2H5+H2O(140℃)C2H5OH C2H4+H2O(170℃)氧化铝:C2H5OH C2H4+H2O(360℃)分子筛:C2H5OH C2H4+H2O(300℃)随着温度升高,反应可得到足够多的乙烯转化,而乙醚的生成量较少。
乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心,乙烯产品占石化产品的70%以上,在国民经济中占有重要的地位。
世界上已将乙烯产品作为衡量一个国家石油化工生产水平的重要标志之一。
主要用于制聚乙烯、聚氯乙烯、醋酸、高级醇等,还可用来催熟水果。
三、实验装置及流程图6-1 固定床反应装置实物图 VAVV 57151683TCITITCI-控温热电偶;TI-测温热电偶;PI-压力计; K-调节阀;V-截止阀;VA-调节阀;VB-安全阀;1-气体钢瓶;2-钢瓶减压阀;3-稳压阀;4-干燥器;5-过滤器;6-质量流量控制器;7,7'-取样器;8-预热炉;9-预热器;10-反应炉;11-固定床反应器;12-汽液分离器;13-冷凝器; 14-尾液收集器;15-转子流量计;16-湿式流量计; 17-加料罐;18-液体泵;PI9104TCI TCITCI6137'141812111217KPIVV57151683TCITI TCI-控温热电偶;TI-测温热电偶;PI-压力计; K-调节阀;V-截止阀;VA-调节阀;VB-安全阀;1-气体钢瓶;2-钢瓶减压阀;3-稳压阀;4-干燥器;5-过滤器;6-质量流量控制器;7,7'-取样器;8-预热炉;9-预热器;10-反应炉;11-固定床反应器;12-汽液分离器;13-冷凝器; 14-尾液收集器;15-转子流量计;16-湿式流量计; 17-加料罐;18-液体泵;PI9104TCI TCITCI6137'14181111217K PI图6-2 乙醇气固催化制备乙烯实验流程图本实验选用固定床反应器,凡是流体通过不动的固体物料所形成的床层而进行反应的装置都称作固定床反应器。
乙醇气相脱水制乙烯动力学实验

化工专业实验报告实验名称:乙醇气相脱水制乙烯动力学实验学院:化学工程学院专业:化学工程与工艺班级:化工、班姓名:、学号、同组者姓名:指导教师:杨春风日期:2012年3月8日一、实验目的1.巩固所学的有关动力学方面的知识。
2.掌握获得反应动力学数据的方法和手段。
3.学会动力学数据的处理方法,根据动力学方程求出相应的参数值。
4.熟悉内循环式无梯度反应器的特点以及其它有关设备的使用方法,提高自己的实验技能。
二、实验原理乙醇属于平行反应。
既可以进行分子内脱水生成乙烯,又可以进行分子间脱水生成乙醚。
一般而言,较高的温度有利于生成乙烯,而较低的温度有利于生成乙醚。
因此,对于乙醇脱水这样一个复合反应,随着反应条件的变化,脱水过程的机理也会有所不同。
借鉴前人在这方面做的工作,将乙醇在分子筛催化剂作用下的脱水过程描述成:2C2H5OH→C2H5OC2H5+H2OC 2H5OH→C2H4+H2O三、实验装置及流程实验装置:无梯度反应器试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,重3.0克。
内循环无梯度反应色谱实验装置流程示意图四、实验步骤开始实验之前,需熟悉流程中所有设备、仪器、仪表的性能及使用方法。
然后才可按实验步骤进行实验。
1.打开H2钢瓶使柱前压达到0.5kg/cm2确认色谱检测中截气通过后启动色谱,柱温110℃,气化室130℃,检测室温达到120℃,待温度稳定后,打开热导池—微电流放大器开关,桥电流至100mA。
2.在色谱仪升温的同时,开启阀恒温箱加热器升温至110℃,开启保温加热器升温至150℃。
3.打开反应器温度控制器开关,升温,同时向反应器冷却水夹套通冷却水。
4.打开微量泵,以小流量向气化器内通原料乙醇。
5.用阀箱内旋转六通阀取样分析尾气组成,记录色谱处理的浓度值。
6.在260-360℃之间选两个温度,改变三次进料速度,测定各种条件下的数据。
五、原始实验数据(附页)六、实验数据记录及处理乙醇密度:0.79g/ml 进料速度:0.3ml/min 乙醇进料质量:3.0g计算说明:乙醇的转化率=反应掉的乙醇摩尔数/原料中乙醇的摩尔数乙烯的收率=生成乙烯的摩尔数/原料中乙醇的摩尔数乙醇的进料速度=乙醇液的体积流量×0.79(乙醇的密度)/46(乙醇的分子量)乙烯的生成速度=(乙醇进料速度×乙烯的收率)/[催化剂用量(g)] mol/(g·h)反应器内乙醇的浓度:C A=P A/(R·T)式中P A为乙醇的分压;反应的总压为0.1Mpa。
乙醇脱水反应动力学参数测定实验讲义

三、实验装置及流程
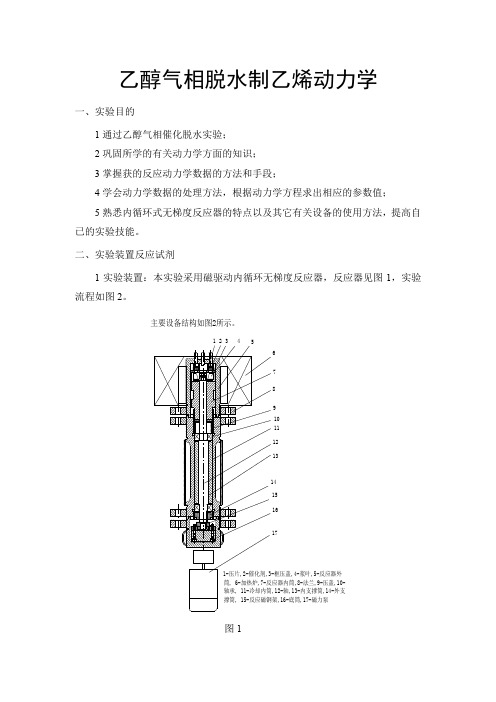
采用磁驱动内循环无梯度反应器,实验流程如图 1,反应器见图 2。
TT—热电偶,PI—压力计,1—钢瓶,2—稳压阀,3—调节阀,4—转子流量计,5—预热器,6— 预热炉,7—反应器,8—反应炉,9—冷凝器,10—尾液收集器,11—六通阀,12—马达 图 1 内循环无梯度乙醇脱水实验装置
2、数据处理
表 2 数据处理表 实 验 号 1 反应 温度 /℃ 245 乙醇进 料量 /(ml/mi n) 2 4 6 2 270 2 4 6 3 312 2 4 6 产物摩尔数组成 乙烯 0.064 0.025 0.056 0.515 0.549 0.504 0.544 0.523 0.454 水 0.321 0.281 0.221 0.195 0.152 0.229 0.309 0.333 0.305 乙醇 0.602 0.667 0.712 0.265 0.258 0.235 0.145 0.144 0.240 乙醚 0.013 0.027 6 0.011 0.025 0.041 0.032 0.003 0 0.006 乙醇转 化率 0.1301 0.1073 0.099 0.6807 0.7098 0.7073 0.7910 0.7841 0.6601 乙烯 收率 0.092 5 0.033 5 0.070 9 0.620 5 0.617 5 0.627 6 0.782 7 0.784 1 0.643 1 V/(mol · min1 -1 g ) 0.0010 0.0008 0.0024 0.0071 0.0141 0.0646 0.0090 0.0179 0.0221 C/(L/m ol) 0.0141 6 0.0156 9 0.0167 5 0.0059 5 0.0057 9 0.0052 7 0.0030 2 0.0030 0 0.0050 0 2.9801 1.1933 K/( L1 · min1 -1 g ) 0.0706 2
乙醇脱水乙烯实验报告

一、实验目的1. 了解乙醇脱水制乙烯的反应原理及实验操作流程。
2. 掌握乙醇脱水制乙烯的实验条件对产物的影响。
3. 通过实验,观察并分析乙醇脱水制乙烯的反应过程及产物。
二、实验原理乙醇在催化剂的作用下,通过脱水反应生成乙烯。
该反应属于平行反应,既可以进行分子内脱水生成乙烯,又可以进行分子间脱水生成乙醚。
实验中,通过调节反应温度、催化剂种类和浓度等条件,可以控制反应方向,提高乙烯的产率。
三、实验材料与仪器1. 实验材料:乙醇、浓硫酸、沸石分子筛、NaOH、水、无水乙醇、乙醚等。
2. 实验仪器:恒温水浴锅、反应釜、冷凝管、集气瓶、量筒、滴定管、移液管、酒精灯、蒸馏装置等。
四、实验步骤1. 准备工作(1)将乙醇、浓硫酸、沸石分子筛等实验材料称量、配制。
(2)检查反应釜、冷凝管、集气瓶等实验仪器的完好性。
2. 实验操作(1)将一定量的乙醇加入反应釜中,加入适量的沸石分子筛作为催化剂。
(2)开启恒温水浴锅,将反应釜放入其中,调节温度至反应所需温度。
(3)反应一定时间后,停止加热,待反应釜冷却至室温。
(4)将反应液转移到蒸馏装置中,进行蒸馏操作,收集乙烯气体。
(5)对收集到的乙烯气体进行定量分析,测定乙烯的产率。
3. 实验结果分析(1)通过观察反应液的颜色变化、气体收集量等,分析反应过程。
(2)对收集到的乙烯气体进行定量分析,计算乙烯的产率。
(3)分析不同实验条件对乙烯产率的影响。
五、实验结果与讨论1. 反应过程观察实验过程中,反应液颜色逐渐变浅,说明乙醇逐渐被转化为乙烯。
随着反应时间的延长,气体收集量逐渐增加,说明乙烯的产率逐渐提高。
2. 乙烯产率测定通过定量分析,得到实验条件下乙烯的产率为80%。
3. 实验条件对乙烯产率的影响(1)温度:实验发现,在反应温度为150℃时,乙烯产率最高。
(2)催化剂:采用沸石分子筛作为催化剂,比浓硫酸具有更高的催化活性,且对环境友好。
(3)反应时间:实验结果表明,反应时间对乙烯产率有一定影响,但超过一定时间后,乙烯产率趋于稳定。
乙醇气相脱水制乙烯动力学实验

乙醇气相脱水制乙烯动力学实验乙醇气相脱水制乙烯动力学实验是一个研究乙醇脱水反应动力学的实验,该实验旨在探究反应条件对反应速率的影响,从而了解反应机理和动力学规律。
以下是实验的详细步骤和数据分析。
一、实验步骤1.准备实验装置:本实验采用气相反应装置,包括反应器、加热器、温度控制器、压力控制器、冷凝器、收集瓶等。
2.准备试剂:本实验采用95%乙醇作为原料,催化剂为酸性催化剂(如硫酸或磷酸)。
3.装填催化剂:将酸性催化剂装填到反应器中,确保催化剂表面平整。
4.添加原料:将95%乙醇加入到反应器中,确保液面在催化剂表面以上。
5.启动实验:开启加热器,将反应器加热到预设的反应温度,同时开启压力控制器,保持反应压力在预设值。
6.收集数据:在实验过程中,通过冷凝器收集反应产物,并记录不同时间下的产物产量。
7.实验结束:实验结束后,关闭加热器和压力控制器,取出产物进行分析。
二、数据分析1.产物分析:通过气质联用仪(GC-MS)对产物进行分析,确定产物种类及其含量。
2.动力学参数测定:根据实验数据,采用适当的动力学模型进行拟合,求得反应速率常数、活化能等动力学参数。
3.反应机理研究:结合产物分析和动力学参数测定结果,推断反应机理。
三、实验结果与讨论1.产物分析结果:实验结果表明,乙醇气相脱水制乙烯的主要产物为乙烯和水,其中乙烯的产量随反应时间的延长而增加。
2.动力学参数测定结果:通过拟合实验数据,得到反应速率常数为k=0.05min-1,活化能为Ea=300kJ/mol。
这些参数可以用于描述乙醇气相脱水制乙烯的动力学行为。
3.反应机理研究结果:结合产物分析和动力学参数测定结果,可以推断乙醇气相脱水制乙烯的反应机理为:乙醇在酸性催化剂的作用下脱去一分子水生成乙烯和水蒸气,整个反应过程包括扩散、吸附、反应和脱附等步骤。
其中,扩散和吸附是限制反应速率的步骤,而反应和脱附则相对较快。
四、结论本实验研究了乙醇气相脱水制乙烯的动力学行为,得到了反应速率常数和活化能等动力学参数,并确定了反应机理。
乙醇脱水制乙烯
/g
重/g
样品质量/g
实验内容 实验目的 仪器药品 实验原理 实验步骤
数据处理
资料仅供参考,不当之处,请联系改正。
乙醇脱水制乙烯
4、样品色谱分析数据记录表 (1)进料速率为0.5mL.min-1时的样品色谱分析数据
分析次数 I
II
峰号 项目
1
2
3
1
2
3
保留时间 /min
峰面积 /uv.s
峰面积百 分比/%
实验内容 实验目的 仪器药品 实验原理 实验步骤
数据处理
资料仅供参考,不当之处,请联系改正。
乙醇脱水制乙烯
4、在一个恒定的乙醇进料速率的条件下反应30分钟 ,然后放出吸收瓶中的液体准确称重,并及时对此 液体进行色谱分析。
5、将乙醇的加料速率设定为1.0mL/min,重复步骤3 、4的操作;
6、将乙醇的加料速率设定为1.5mL/min,重复步骤3 、4的操作;
7、在实验的间隙中配制合适浓度的水、无水乙醇、 无水乙醚的标准溶液,并对标准溶液进行色谱分析 ,以确定水、无水乙醇、无水乙醚的相对校正因子 ,为后续的反应残液的定量分析作准备。
实验内容 实验目的 仪器药品 实验原理 实验步骤
数据处理
资料仅供参考,不当之处,请联系改正。
乙醇脱水制乙烯
实验数据记录及处理
资料仅供参考,不当之处,请联系改正。
乙醇脱水制乙烯
5、反应速率方程曲骤
数据处理
❖ 反应机理为:
主反应: C 2H 5O H C 2H 4+ H 2O
副反应: 2 C 2 H 5 O H C 2 H 5 O H 5 C 2 + H 2 O
实验内容 实验目的 仪器药品 实验原理 实验步骤
乙醇气相脱水制乙烯实验报告

乙醇气相脱水制乙烯实验报告
乙醇气相脱水制乙烯实验报告
1. 引言
•介绍乙醇气相脱水制乙烯实验的背景和目的。
2. 实验方法
•列出实验所使用的仪器、试剂和设备。
•详细描述实验步骤,包括试验条件、操作流程等。
3. 实验结果
•描述实验过程中观察到的现象和数据。
•用表格或图表记录实验数据和实验结果。
•对实验结果进行分析和讨论。
4. 实验讨论
•分析实验结果并讨论实验所得结论的可靠性。
•探讨实验中可能存在的误差和改进方法。
•就实验方法和结果提出进一步的研究方向。
5. 结论
•总结实验的目的、方法和结果。
•对实验所得结论进行概括和归纳。
6. 参考文献
•列出实验报告中引用的相关文献。
以上是对实验报告的基本结构的一个大纲,可以根据实际情况进行具体的编写。
实验报告要清晰、准确地反映出实验的过程和结果,同时要有逻辑性和可读性。
乙醇气固催化脱水制乙烯实验报告

乙醇气固催化脱水制乙烯实验报告嘿,朋友们,今天咱们聊聊一个有趣的实验,那就是用乙醇通过气固催化脱水来制乙烯。
听上去是不是有点高大上?别急,咱们慢慢来,保证你听得明明白白,轻松愉快。
乙烯,这可是一个大名鼎鼎的化学小子,塑料、合成纤维,甚至是咱们日常生活中的一些小玩意儿,都少不了它的身影。
说到乙醇,那更是咱们熟悉的酒精,啤酒、红酒,聚会的时候来一杯,真是没得说。
但今天的主角可不是喝的,而是它在实验室里的另一种风采。
我们得知道,这个实验的目的是什么。
就是把乙醇分解,变成乙烯,这样一来,乙烯就能在化工原料里大显身手。
说到催化剂,它就像是这场实验的导演,帮我们加速反应,让一切变得更高效。
用的催化剂是什么呢?嘿,通常是一些氧化铝之类的家伙。
它们的存在简直是如虎添翼,让反应顺利进行。
想象一下,没有催化剂,就像是一场没有组织的聚会,大家都不知道该干啥。
咱们得准备实验的材料,首先就是乙醇。
咱们这可是纯度很高的那种,不能打折扣。
然后呢,还有催化剂,这里咱们选的就是那些不起眼但却极其重要的氧化铝颗粒。
它们在反应过程中可忙了,表面大大增加了反应的机会。
还得准备一些设备,像是反应器、冷凝器等等。
其实这些设备就像是厨房里的工具,没有它们,咱们的实验可就成了无米之炊。
开始实验了!把乙醇放进去,慢慢加热。
温度得控制好,不能太高,免得把乙醇烧了个精光。
大家想象一下,那种热腾腾的气体逐渐冒出来的样子,仿佛在给实验加油打气。
慢慢地,乙醇开始转变,像是变魔术一样,冒出来的乙烯气体让人忍不住想欢呼。
实验室里弥漫着淡淡的气味,这就是乙烯的气息。
咱们可是要把这些气体收集起来,做进一步的分析和利用。
反应结束后,别急着收工,咱们得仔细分析一下产物。
取样一试,哇,真是让人开心,乙烯的产量不错,效率也很高。
要是能把这些乙烯用到实际生产中,那简直是两全其美,既能省钱又能环保。
这种实验就像做菜,掌握好火候,选对材料,最后才会呈现出美味的佳肴。
实验过程中难免有些小插曲。
实验一 乙醇气相脱水制乙烯
密度 1 M2w 0.789 M3w 0.7134 M4w 5.008691 2.510561 6.883202
M1乙烯 M2水 M3乙醇 M4乙醚
乙醇进料量ml/hr 乙醇进料量mol 0.048743 乙醇转化率 5.041179 乙烯收率 2.512983 6.884638
627110.4651 16.33100169 0.846121912 0.002984704
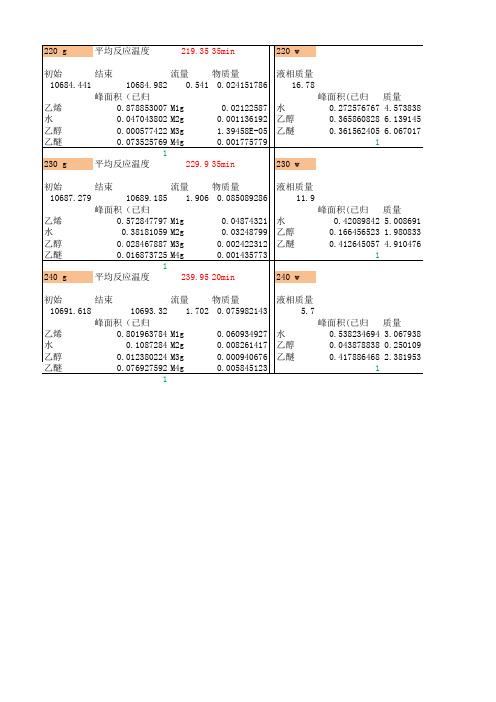
220 g 平均反应温度 219.35 初始 结束 流量 10684.441 10684.982 0.541 峰面积(已归一) 乙烯 0.878853007 M1g 水 0.047043802 M2g 乙醇 0.000577422 M3g 乙醚 0.073525769 M4g 1 230 g 平均反应温度 229.9 初始 结束 流量 10687.279 10689.185 1.906 峰面积(已归一) 乙烯 0.572847797 M1g 水 0.38181059 M2g 乙醇 0.028467887 M3g 乙醚 0.016873725 M4g 1 240 g 平均反应温度 239.95 初始 结束 流量 10691.618 10693.32 1.702 峰面积(已归一) 乙烯 0.801963784 M1g 水 0.1087284 M2g 乙醇 0.012380224 M3g 乙醚 0.076927592 M4g 1
35min 220 w 物质量 液相质量 0.024151786 16.78 0.02122587 水 0.001136192 乙醇 1.39458E-05 乙醚 0.001775779 35min 230 w 物质量 液相质量 0.085089286 11.9 0.04874321 水 0.03248799 乙醇 0.002422312 乙醚 0.001435773 20min 240 w 物质量 液相质量 0.075982143 5.7 0.060934927 水 0.008261417 乙醇 0.000940676 乙醚 0.005845123 峰面积(已归一)质量 0.538234694 3.067938 0.043878838 0.250109 0.417886468 2.381953 1 峰面积(已归一)质量 0.42089842 5.008691 0.166456523 1.980833 0.412645057 4.910476 1 峰面积(已归一)质量 0.272576767 4.573838 0.365860828 6.139145 0.361562405 6.067017 1
实验4 乙醇气相脱水制乙烯

实验四小型微型反应器联合装置(乙醇气相脱水制乙烯)一、实验目的1了解乙醇气相脱水制备乙烯的过程,学会设计实验流程和操作.2 掌握乙醇气相脱水操作条件对产物收率的影响,学会获取稳定的工艺条件的方法。
3 熟悉固定床反应器的特点以及其它相关设备的使用方法,提高实验技能。
4 巩固复习色谱分析方法二、试验装置和试剂1、装置:采用管式炉加热固定床反应器。
实验流程图见2,反应器见32、试剂:无水乙醇(分析纯)分子筛催化剂:60目-80目3、仪器:柱塞式液体加料泵氮气缸瓶注射器色谱仪反应装置V-截止阀; V-三通阀; K-调节阀; P I- 压力计; T CI- 控温热电偶; T I-测温热电偶;1、1'-稳压阀;2、2'-干燥器;3、3'-转子流量计;4、4'-预热器;5、5'-预热炉;6-固定床反应器; 7-固定床反应炉; 8-微反反应器; 9-微反反应炉; 10-微反冷凝器;11-固定床冷凝器; 12-固定床汽液分离器;13-湿式流量计;14-皂膜流量计;15-加料泵;16-原料瓶; 17-取样器;18-注射器图2、微反色谱与小型固定床联合装置三、实验方法及操作步骤1、组装流程,检查各接口,试漏(空气或氮气)2、检查电路是否连接妥当。
上述准备工作完成后,开始升温,预热器温度控制在120。
待反应器温度达到165后,启动乙醇加料泵。
3、在200-300之间选取不同温度,考察温度对反应物转化率和产品收率的影响。
4、反应结束后停止加乙醇原料。
继续通冷却水维持30分钟,以消除催化剂上的焦状物,使之再生。
5、实验结束关闭水和电源。
乙醇脱水制乙烯实验

实验六 乙醇气固相脱水制乙烯动力学实验一、实验目的1、熟悉内循环式无梯度反应器的特点以及其它有关设备的使用方法。
2、通过乙醇气固相催化脱水实验,巩固所学的有关动力学方面的知识。
3、掌握内循环式无梯度(全混流)反应器的设计方程。
4、掌握利用内循环式无梯度反应器获得反应动力学数据的方法和手段,巩固动力学数据的处理方法,并可根据动力学方程求出相应的参数值。
二、实验原理本实验采用磁驱动内循环无梯度反应器,催化剂颗粒置于不锈钢筐内,不锈钢筐置于反应器内腔,反应器整体置于恒温电炉中。
由于搅拌轮的推动作用,使气流强制循环,可使反应器内的反应混合物达到理想混合,即无浓度梯度和温度梯度,物料的流动方式近于全混流。
根据全混流反应器的设计方程可知,反应物的反应速率满足式(1)。
0mol-'=,()g hA A A F X r W ⋅ (1) 其中,F A 0——进料的摩尔流率,mol/h ;X A ——反应物A 的转化率; W ——催化剂质量,g ;-r A `——反应物A 的消耗速率,mol/(g ·h)。
由此可计算出反应物的反应速率。
通过调整进料速率,可以得到不同的反应物转化率(或反应器出口浓度),从而可得出反应速率常数k 与反应级数n 。
本实验的对象为乙醇脱水反应,该反应为平行反应,乙醇进行分子内脱水成乙烯,同时可能分子间脱水生成乙醚,参见式(2)和式(3)。
25252522C H OH C H OC H +H O → (2)25242C H OH C H +H O → (3)一般而言,较高的温度有利于生成乙烯,而较低的温度则有利于生成乙醚。
在给定温度压力条件下,在所述内循环无梯度反应器内,以60~80目分子筛为催化剂,在一定的乙醇进料速率下,进行乙醇脱水气固相反应。
利用六通阀对产物进行采样分析,得到各组分的色谱分析面积百分比。
利用表1所提供的校正因子按式(4)计算得出各组分的质量分数或摩尔分数。
乙醇气固相催化制备乙烯实验报告

化工专业实验报告实验六乙醇气固催化脱水制乙烯姓名:XXX学号:XXXXXX班级:同组人:一实验目的1、掌握乙醇脱水实验的反应过程、实验流程和操作。
2、掌握乙醇气相脱水操作条件对产物收率的影响,学会获取稳定的工艺条件的方法。
3、了解固定床反应器的构造、原理和使用方法,学习反应器的正常操作和安装。
4、学习气相色谱在线分析的方法和定性、定量分析,学习如何手动进样分析液体成分。
了解气相色谱的原理和构造,掌握色谱的正常使用和分析条件选择。
5、学习微量泵的使用方法,学会使用湿式流量计测量流体流量。
二、实验原理乙醇脱水属于平行反应,即可进行分子内脱水生成乙烯,又可进行分子间脱水生成乙醚。
一般而言,较低的温度有利于生成乙醚,因此该复合反应条件改变,脱水机理也有不同。
采用浓硫酸、氧化铝和分子筛催化剂可以有下列反应过程产生:浓硫酸:2C2H5-OH C2H5OC2H5+H2O(140℃)C2H5OH C2H4+H2O(170℃)氧化铝:C2H5OH C2H4+H2O(360℃)分子筛:C2H5OH C2H4+H2O(300℃)随着温度升高,反应可得到足够多的乙烯转化,而乙醚的生成量较少。
乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心,乙烯产品占石化产品的70%以上,在国民经济中占有重要的地位。
世界上已将乙烯产品作为衡量一个国家石油化工生产水平的重要标志之一。
主要用于制聚乙烯、聚氯乙烯、醋酸、高级醇等,还可用来催熟水果。
三、实验装置及流程图6-1 固定床反应装置实物图 VAVV 57151683TCITITCI-控温热电偶;TI-测温热电偶;PI-压力计; K-调节阀;V-截止阀;VA-调节阀;VB-安全阀;1-气体钢瓶;2-钢瓶减压阀;3-稳压阀;4-干燥器;5-过滤器;6-质量流量控制器;7,7'-取样器;8-预热炉;9-预热器;10-反应炉;11-固定床反应器;12-汽液分离器;13-冷凝器; 14-尾液收集器;15-转子流量计;16-湿式流量计; 17-加料罐;18-液体泵;PI9104TCI TCITCI6137'141812111217KPIVV57151683TCITI TCI-控温热电偶;TI-测温热电偶;PI-压力计; K-调节阀;V-截止阀;VA-调节阀;VB-安全阀;1-气体钢瓶;2-钢瓶减压阀;3-稳压阀;4-干燥器;5-过滤器;6-质量流量控制器;7,7'-取样器;8-预热炉;9-预热器;10-反应炉;11-固定床反应器;12-汽液分离器;13-冷凝器; 14-尾液收集器;15-转子流量计;16-湿式流量计; 17-加料罐;18-液体泵;PI9104TCI TCITCI6137'14181111217K PI图6-2 乙醇气固催化制备乙烯实验流程图本实验选用固定床反应器,凡是流体通过不动的固体物料所形成的床层而进行反应的装置都称作固定床反应器。
乙醇制备乙烯实验报告

一、实验目的1. 理解乙醇制备乙烯的反应原理和过程。
2. 掌握乙醇制备乙烯的实验操作技能。
3. 学习并验证乙烯的物理和化学性质。
二、实验原理乙醇在浓硫酸的催化作用下,加热至170℃时,会发生消去反应生成乙烯和水。
反应方程式如下:C2H5OH → CH2=CH2↑ + H2O三、实验仪器与药品1. 仪器:蒸馏烧瓶、酒精灯、石棉网、温度计、冷凝管、锥形瓶、洗气瓶、导管、集气瓶、酒精、浓硫酸、氢氧化钠溶液、溴水、酸性高锰酸钾溶液。
2. 药品:乙醇、浓硫酸、氢氧化钠溶液、溴水、酸性高锰酸钾溶液。
四、实验步骤1. 准备工作(1)检查仪器是否完好,确保实验安全。
(2)配制乙醇溶液:将4ml乙醇与12ml浓硫酸混合,边加边摇。
(3)准备洗气瓶:将氢氧化钠溶液加入洗气瓶中。
2. 乙醇制备乙烯(1)在125ml蒸馏烧瓶中加入4ml乙醇,12ml浓硫酸。
(2)放入约1g P2O5及少量碎瓷片。
(3)塞上温度计,连接好装置。
(4)强热反应物,使温度迅速上升至160-170℃,调节火焰,保持此范围温度和乙烯气流均匀产生。
(5)收集乙烯气体:将乙烯气体通过导管导入集气瓶中。
3. 乙烯性质试验(1)与卤素反应a. 将收集到的乙烯气体通入含有0.5ml 1%Br2/CCl4的试管中,观察现象。
b. 观察溴水褪色。
(2)氧化a. 将收集到的乙烯气体通入含有0.5ml 0.1%KmnO4和0.5ml 10%H2SO4的试管中,观察现象。
b. 观察酸性高锰酸钾褪色。
(3)可燃性a. 采用安全点火法,点燃乙烯气体。
b. 观察乙烯燃烧产生黑烟。
4. 实验结束(1)关闭酒精灯,熄灭火焰。
(2)整理实验仪器,回收药品。
五、结果与讨论1. 实验结果(1)乙醇在浓硫酸的催化作用下,加热至170℃时,成功制备了乙烯。
(2)乙烯与卤素反应,溴水褪色;与酸性高锰酸钾反应,褪色。
(3)乙烯具有可燃性,燃烧产生黑烟。
2. 讨论与分析(1)实验过程中,注意控制反应温度在160-170℃范围内,以确保乙烯的生成。
乙醇气相脱水制乙烯动力学实验(宁波工程)

化工专业实验报告实验名称:乙醇气相脱水制乙烯动力学实验学院:化学工程学院专业:化学工程与工艺班级:姓名:学号同组者姓名:指导教师:日期:一、实验目的1、巩固所学的有关动力学方面的知识;2、掌握获得的反应动力学数据的方法和手段;3、学会动力学数据的处理方法,根据动力学方程求出相应的参数值;4、熟悉内循环式无梯度反应器的特点以及其他有关设备的特点以及其它有关设备的使用方法,提高自己的实验技能。
二、实验原理乙醇脱水属于平等反应。
既可以进行分子内脱水成乙烯,又可以分子间脱水生成乙醚。
一般而言,较高的温度有利于生成乙烯,而较低的温度则有利于生成乙醚。
较高温度:O H H OC H C OH H C 25252522+→较低温度:O H H C OH H C 24252+→三、实验装置、流程及试剂1.实验装置装置由三部分组成:第一部分是有微量进料泵,氢气钢瓶,汽化器和取样六通阀组成的系统; 第二部分是反应系统,它是由一台内循环式无梯度反应器,温度控制器和显示仪表组成;第三部分是取样和分析系统,包括六通阀,产品收集器和在线气相色谱信。
2.实验流程如下图所示:3.试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,60~80目,重3.0克。
内循环无梯度反应色谱实验装置流程示意图K3-进气旁路调节阀;K2-阀箱产物流量调节;K3-气液分离后尾气调节;J-进液排放三通阀;1-气体钢瓶;2-稳压阀;3-转子流量计;4-过滤器;5-质量流量计;6-缓冲器;7-压力传感器;8-预热器;9-预热炉;10-反应器;11-反应炉;12-马达;13-恒温箱;14-气液分离器;15-调压阀;16-皂膜流量计;17-加料泵12内循环无梯度反应色谱实验装置流程示意图四、实验步骤1、打开H 2钢瓶使柱前压达到0.5kg/cm 2确认色谱检测中截气通过后启动色谱,柱温110℃,汽化室130℃,检测室温达到120℃,待温度稳定后,打开导热池——微电流放大器开关,桥电流至100mA ;2、在色谱仪升温的同时,开启阀恒温箱加热器升温至110℃,开启保温加热器升温至160℃;3、打开反应器温度控制开关,升温,同时向反应器冷却水夹套通冷却水。
乙醇脱水制乙烯

实验内容 实验目的 仪器药品 实验原理 实验步骤
数据处理
资料仅供参考,不当之处,请联系改正。
乙醇脱水制乙烯
4、在一个恒定的乙醇进料速率的条件下反应30分钟 ,然后放出吸收瓶中的液体准确称重,并及时对此 液体进行色谱分析。
5、将乙醇的加料速率设定为1.0mL/min,重复步骤3 、4的操作;
6、将乙醇的加料速率设定为1.5mL/min,重复步骤3 、4的操作;
/mL.min-1 /mim
率/%
/%
性/%
0.5
1.0
1.5
实验内容 实验目的 仪器药品 实验原理 实验步骤
数据处理
资料仅供参考,不当之处,请联系改正。
乙醇脱水制乙烯
4、反应速率方程相关数据表
进料速率 /mL.min-1
y/%
0.5
1.0
1.5
实验内容 实验目的 仪器药品 实验原理 实验步骤
数据处理
资料仅供参考,不当之处,请联系改正。
乙醇脱水制乙烯 实验内容
一、实验目的 二、实验仪器和药品 三、实验原理 四、实验步骤 五、实验数据记录及处理
实验内容 实验目的 仪器药品 实验原理 实验步骤
数据处理
资料仅供参考,不当之处,请联系改正。
乙醇脱水制乙烯
实验目的
❖ 掌握乙醇脱水实验的反应过程和反应机理、特点,了解针对 不同目的产物的反应条件对正、副反应的影响规律和生成的 过程。
预热温度 加热温度
/℃
/℃
反应温度/℃
实验内容 实验目的 仪器药品 实验原理 实验步骤
数据处理
资料仅供参考,不当之处,请联系改正。
乙醇脱水制乙烯
3、样品收集及称量数据表
样品
乙醇脱水制备乙烯综合性实验设计

第29卷第3期2014年6月 大学化学UNIVERSITY CHEMISTRY Vol.29No.3Jun.2014 乙醇脱水制备乙烯综合性实验设计*马新起 郭泉辉 杨显(河南大学化学化工学院精细化学与工程研究所 河南开封475004) 摘要 从实验设计的思路㊁实验目的㊁实验设备㊁实验操作流程㊁实验思考题㊁实验数据记录和实验结果的处理等方面介绍乙醇脱水制备乙烯综合性实验的设计与实现过程㊂ 关键词 高等教育 综合性实验 实验设计 随着高等教育改革的进一步深化,各高等院校更加注重对大学生创新意识㊁创新精神和创新能力的培养,对于理工科院校来说,进一步强化学生的工程实践能力是很重要的[1⁃3]㊂学生通过系统的实验训练,可以初步了解和掌握所学理论知识的运用,培养实践能力㊁分析问题能力和创新能力[4⁃6]㊂学生在学过乙烯的相关内容后,对以石油路线制备乙烯的过程有了一定的了解;同时也了解了利用可再生的生物质为原料制备生物乙醇㊁再以生物乙醇制备乙烯的路线[7⁃9]㊂ 本文从实验设计的思路㊁实验目的㊁实验主要设备㊁实验操作流程㊁实验思考题㊁实验数据记录方法和实验结果的处理方法等方面,介绍我们利用本校现有实验装置开设的一个乙醇脱水制备乙烯综合性实验的设计与实现过程㊂希望借此为理工科院校实验教学改革提供一些参考㊂本文介绍的实验可作为化学化工类本科生的必修或选修实验㊂1 实验设计的思路 笔者在本科生的专业课教学中主要是主讲及辅导化工工艺学和化工实验等课程㊂为了使学生熟悉后石油时代替代能源开发和利用的方法及其重要性,掌握利用生物乙醇制备乙烯的原理㊁工艺过程及自控系统㊁产物分析检测的方法,培养学生的实践能力和创新能力[10⁃11],笔者根据对石油路线制乙烯的工艺过程的了解,利用现有实验装置作为平台,开设了乙醇脱水制备乙烯的综合性实验㊂ 乙醇催化脱水制备乙烯综合性实验综合运用了先修课程中学过的有机化学㊁化工原理㊁化学反应工程㊁化工仪表与自动化㊁仪器分析㊁化工工艺学等内容㊂先修课程所学内容在综合实验中的应用见表1㊂表1摇先修课程所学内容在综合实验中的应用先修课程先修课对应内容实验使用内容有机化学烯烃的制备乙烯的制备方法化工工艺学烃类裂解制乙烯乙醇制乙烯㊁数据处理化工原理流体输送物料的输送与计量化学反应工程反应器的型式固定床反应器化工原理传热设备冷凝冷却器的选择化工仪表与自动化仪表㊁自动化控制在线控制系统仪器分析气相色谱反应产物的分析检测*基金资助:河南大学第十二批校级教学改革研究资助项目(No.20120046)85大学化学第29卷 2 实验目的 根据本校教学大纲要求,化学化工实验的目的是提高学生的动手能力和分析㊁解决问题的能力,掌握实验的设计和组织方法,学会使用自控仪表和用微机采集数据㊁进行数据处理,并能运用实验技术进行化工新产品的开发和独立进行科学研究㊂ 乙醇脱水制备乙烯实验的具体实验目的如下: (1)了解固定床反应器㊁柱塞泵㊁气相色谱仪的结构,熟悉其工作原理与操作方法㊂ (2)掌握乙醇脱水制备乙烯反应的基本原理和工艺流程㊂ (3)熟悉乙醇脱水制备乙烯的在线控制原理和反应产物分析检测方法㊂ (4)掌握实验结果的数据处理方法㊂3 实验原理和主要实验设备 乙醇催化脱水制备乙烯是一个在催化剂作用下的气⁃液或气⁃固非均相反应㊂工业上常用活性氧化铝㊁分子筛等做催化剂[12]㊂本实验选用改性ZSM⁃5分子筛催化剂,催化剂的活性温度范围为250~ 300℃㊂ 乙醇脱水的主要化学反应如下:OH C2H4+H2O C2H5→OH C2H5OC2H5+H2O 2C2H5→ 实验所用的主要试剂为无水乙醇(分析纯)㊂ 实验所用的主要设备有:J⁃W柱塞计量泵(杭州之江石化装备有限公司);固定床反应器及乙醇预热器(天津市天大北洋化工实验设备有限公司);气液分离器(自制);GC7700气相色谱仪(上海天美科学仪器有限公司);JJ300型电子天平(常熟市双杰测试仪器厂)㊂4 实验操作流程 乙醇脱水制备乙烯的实验流程见图1㊂图1摇乙醇脱水制备乙烯实验流程示意图 在线设定预热器㊁固定床各段加热温度,原料乙醇由柱塞式计量泵进样,经过预热器气化后,进入固定床反应器中(催化剂装填量约25mL),反应产生的气体从反应器下部进入冷凝器,冷凝后的气液混合物进入气液分离器;分别取气相产物和液相产物,利用气相色谱仪分析检测;液相产物用电子天平进行称量,在分析检测后倒入密闭的废液收集桶;气相产物尾气经湿式气体流量计计量后用管线引至室外放空㊂5 实验数据记录与实验结果的处理方法 气相产物经气相色谱仪分析检测可能有的产物为:乙烯㊁乙醇㊁水㊁乙醚;液相产物经气相色谱仪分析检测可能有的产物为:乙醇㊁水㊁乙醚㊂ 实验数据记录包括:室温㊁大气压,反应温度㊁反应时间㊁进料量㊁出料量等㊂ 实验可以根据原始数据,进行数据处理,并根据学生所学过的相关课程中的公式[13]计算出转化率㊁选择性和收率㊂实验结果处理时采用以下公式进行计算: 转化率=参加反应的原料量通入反应器的原料量×100% 选择性=转化为目的产物的原料量参加反应的原料量×100% 收率=转化为目的产物的原料量通入反应器的原料量×100%=转化率×选择性6 实验思考题 为了提高综合性实验的实验效果,在实验设计过程中准备了一定数量的思考题供学生在预习实验㊁复习实验及实验过程中思考㊂本实验主要设定的思考题如下: (1)根据学过的相关课程,制备乙烯的方法有哪些? (2)影响乙醇催化脱水制备乙烯的因素有哪些? (3)利用气相色谱分析检测气㊁液相样品时应注意哪些问题? (4)本实验中的固定床反应器能否用流化床反应器替代?请说明理由㊂7 结语 本文介绍的乙醇脱水制备乙烯综合性实验已在本校2008~2010级化学化工专业的学生实验中试用㊂结果表明,学生通过做本实验,拓宽了自己的知识面,加深了对有机化学㊁化工工艺学等课程的理解,提高了分析问题和解决问题的能力,取得了较好的实验效果㊂本实验可作为化学化工类本科生的必修或选修实验开设㊂ 下一步拟开设成设计型研究型实验,让学生自己设计进料量㊁温度等,以进一步培养学生的实践能力和创新能力㊂参 考 文 献[1] 陈国金.实验室研究与探索,2010,29(3):95[2] 赖绍聪,华洪,王震亮,等.中国大学教学,2007(8):12[3] 马新起.实验技术与管理,2001,18(4):57[4] 郭瑞丽,张建树,代斌.高教论坛,2010(3):41[5] 吕淑平,马忠丽,王科俊.实验技术与管理,2010,27(8):123[6] 胡涛,孟长功,王春艳,等.大学化学,2011,26(4):59[7] 杨波,周海.化工技术与开发,2009,38(12):27[8] 张林香,王俊文,刘世斌,等.实验室科学,2007(2):51[9] 朱瑞芬,张亚静,金谊.宁波工程学院学报,2009,21(3):133[10] 徐寿昌.有机化学.第2版.北京:高等教育出版社,1993[11] 马新起,乔聪震,吉欣,等.化工高等教育,2007(5):82[12] 胡应杰,薛蒙伟.南京晓庄学院学报,2009(6):48[13] 吴指南.基本有机化工工艺学.修订版.北京:化学工业出版社,199995 第3期马新起等:乙醇脱水制备乙烯综合性实验设计。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化工专业实验报告
实验名称:乙醇气相脱水制乙烯动力学实验
学院:化学工程学院
专业:化学工程与工艺
班级:
姓名:学号
同组者姓名:
指导教师:
日期:
一、实验目的
1、巩固所学的有关动力学方面的知识;
2、掌握获得的反应动力学数据的方法和手段;
3、学会动力学数据的处理方法,根据动力学方程求出相应的参数值;
4、熟悉内循环式无梯度反应器的特点以及其他有关设备的特点以及其它有关设备的使用方法,提高自己的实验技能。
二、实验原理
乙醇脱水属于平等反应。
既可以进行分子内脱水成乙烯,又可以分子间脱水生成乙醚。
一般而言,较高的温度有利于生成乙烯,而较低的温度则有利于生成乙醚。
较高温度:O H H OC H C OH H C 25252522+→
较低温度:O H H C OH H C 24252+→
三、实验装置、流程及试剂
1.实验装置
装置由三部分组成:
第一部分是有微量进料泵,氢气钢瓶,汽化器和取样六通阀组成的系统; 第二部分是反应系统,它是由一台内循环式无梯度反应器,温度控制器和显示仪表组成;
第三部分是取样和分析系统,包括六通阀,产品收集器和在线气相色谱信。
2.实验流程如下图所示:
3.试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,60~80目,重3.0克。
内循环无梯度反应色谱实验装置流程示意图K3-进气旁路调节阀;K2-阀箱产物流量调节;K3-气液分离后尾气调节;J-进液排放三通阀;
1-气体钢瓶;2-稳压阀;3-转子流量计;4-过滤器;5-质量流量计;6-缓冲器;
7-压力传感器;8-预热器;9-预热炉;10-反应器;11-反应炉;12-马达;
13-恒温箱;14-气液分离器;15-调压阀;16-皂膜流量计;17-加料泵12
内循环无梯度反应色谱实验装置流程示意图
四、实验步骤
1、打开H 2钢瓶使柱前压达到0.5kg/cm 2
确认色谱检测中截气通过后启动色谱,柱温110℃,汽化室130℃,检测室温达到120℃,待温度稳定后,打开导热池——微电流放大器开关,桥电流至100mA ;
2、在色谱仪升温的同时,开启阀恒温箱加热器升温至110℃,开启保温加热器升温至160℃;
3、打开反应器温度控制开关,升温,同时向反应器冷却水夹套通冷却水。
4、打开微量泵,以小流量向气化器内通原料乙醇;
5、用阀箱内旋转六通阀取样分析尾气组成,记录色谱处理的浓度值;
6、在200~380℃之间选择四个温度,改变三次进料速度,测定各种条件下的数据。
五、数据处理
乙醇每5min 内进料质量:1.5×0.79=1.185g 乙醇密度:ρ=0.79g /mL n 总(乙醇)=1.185/46=0.0258mol
分子筛催化剂用量:0.4g
10 乙醇的转化率为3.7×410-/0.0258=0.01434
乙烯收率=5.357×10-4/0.0258=0.0208
乙醇的进料速度=0.3×0.79/46=5.15×310-mol/min=0.309mol/h
乙烯的生成速率=0.309×0.0208=6.4272×310-mol/(g.h)
反应器内乙醇的浓度:A A P C RT
= 式中A P 为乙醇的分压;反应的总压为0.1MPa 。
对于第一组A P =(0.02543/0.0258) ×0.1=0.09857 (Mpa )
所以A A P C RT
=
=(0.09857×610)/(8.314×463.75)=25.57mol/m 3=0.02557mol/L 生成乙烯的反应步骤的速率常数k 可以通过下式求出:
A K C γ
==6.4272×310-/0.02557=0.2514L/(g.h)
同理可得另两组温度下的数据。
由阿伦尼乌斯方程0E
RT k k e -=,将lnK 对1/T 作图得:
由01ln ln E k k R T =-+,即y=kx+b 型函数。
从图可得到0ln k 和E R
-,计算可得: E R
-=-5.8547 所以E=48.68kJ/mol 0ln k =11.31258 所以k o =8.1845×410 L/(g.h)
六、实验结果分析及讨论
实验中所得的数据随机性较大,因为反应速度与反应温度密切相关,温度不同,反应速率就不同,同时反应过程也不会稳定,给测量造成误差,所以整个实
验的结果是否准确与温度控制密不可分。
另外环境温度高低对于加热时间长短也有影响。
对于上表中所得到的实验结果存在有一定的误差,并且在做实验当中有几组数据偏大,其原因可能是:1、乙醇不纯,不是真正的无水乙醇。
2、微量泵仪器本身和天平都存在有系统误差。
3、秒表计时有时也会给结果带来误差。
如果实验中每次温差调大的话,实验结果可能会准确些,但又很耗时。
总之影响实验的因素很多,要想保证实验的准确度,务必保证反应温度的恒定,进料乙醇体积,秒表计时的测量准确性,还要有较高的实验技能。
建议:希望学校多提供一些仪器设备,并且使设备更完善一些,这样我们才能更好的进行操作,对于结果能更详细的测定。
七、思考题
1、用无梯度反应器测定化学反应动力学的优、缺点是什么?
答:反应器进口浓度物料循环,使累计的转化率较高,进料浓度和出口浓度,有较大的差值,因此对组成分析没有过苛要求和出口浓度十分接近,反应器内不存在浓度梯度和温度梯度。
2、要想证明测定的是本征动力学数据,还需要补充哪些实验内容?
答:还需要补充热量传递,质量传递,动量传递等内容,加上前面的反应,即三传一反是化学动力学的本证特性。
